1
INDICE
RIASSUNTO ... 2
DIABETE MELLITO TIPO 1 ... 5
Introduzione ... 5
Epidemiologia ... 7
Eziopatogenesi ... 9
TERAPIA DEL DIABETE TIPO 1 ... 17
Terapia Insulinica ... 17
Terapia infusionale continua sottocutanea di insulina e sensori... 23
Terapie Farmacologiche aggiuntive non insuliniche ... 29
Farmaci insulino-sensibilizzanti ... 29
Modulatori dell’assorbimento gastrointestinale ... 31
Pramlintide (analogo della Amilina) ... 32
TERAPIA INCRETINICA ... 33
Effetti pancreatici del Glucagone-like Peptide-1 (GLP-1)………... 37
Effetti extra-pancreatici del Glucagone-like Peptide-1 (GLP-1)…………40
Effetti delle Incretine nel diabete tipo 1... 45
GLP-1 mimetici o analoghi del GLP-1 nel diabete di tipo 1……….45
Terapia con inibitori del DPP-4 nel diabete tipo 1……… 47
SCOPO DELLO STUDIO ... 51
PAZIENTI E METODI ... 52 ELABORAZIONE STATISTICA ... 54 RISULTATI ... 55 DISCUSSIONE ... 59 BIBLIOGRAFIA ... 64 RINGRAZIAMENTI………..77
2
RIASSUNTO
L’avvento degli analoghi del glucagone-like peptide 1 (GLP1) non solo ha fornito un nuovo modo per controllare l’iperglicemia nel diabete tipo 2, ma ha permesso di comprendere meglio la sua azione e ha migliorato le conoscenze sui meccanismi patogenetici dell’iperglicemia post-prandiale. Nei pazienti con diabete tipo 2, ad esempio, è stato dimostrato che, nel periodo post-prandiale si registra un aumento delle concentrazioni di glucagone che contribuisce all’iperglicemia. L’iperglucagonemia è correlabile, probabilmente, all’inadeguata secrezione insulinica post-prandiale o come possibile effetto glucotossico dell’iperglicemia sulla funzione α-cellulare. È possibile ipotizzare che un simile disturbo fisiopatologico sia presente anche nel diabete tipo 1, dove il deficit insulinico è ancora più grave.
In considerazione di questo, e nell’ottica di valutare, nel diabete tipo 1, ulteriori strategie terapeutiche, in aggiunta all’insulina, abbiamo ipotizzato che l'uso della Liraglutide, un analogo del GLP-1, potesse aiutare a controllare meglio la glicemia e le sue oscillazioni.
Abbiamo, pertanto, valutato in uno studio in cieco controllato condotto su 8 pazienti caucasici, di cui 5 maschi, affetti da diabete mellito tipo 1, C-peptide negativi, il possibile effetto della Liraglutide sull’andamento glicemico giornaliero e le sue ricadute sul dosaggio insulinico oltre che la sua tollerabilità. Tutti i soggetti erano in terapia insulinica continua sottocutanea con microinfusore (CSII) da oltre 12 mesi. Il valore medio di HbA1c al momento dell’entrata nello studio risultava 8.0±1.1% ed il loro fabbisogno insulinico era 0.6±0.1 UI/kg. Ai pazienti arruolati sono state consegnate 6 siringhe da insulina da 0.5 ml, numerate da 1 a 6: 3 siringhe contenevano 0.1 ml di soluzione fisiologica, e le altre 3 siringhe contenevano 0.1 ml di Liraglutide
3
(corrispondente a 0.6 mg di principio attivo). Sono stati quindi invitati a somministrarsi al mattino, alle ore 8.00, in aggiunta alla terapia insulinica, il contenuto delle siringhe, seguendo l’ordine numerico. In questo modo ad ognuno di loro è stata somministrata, in singolo cieco, terapia sottocutanea con 0.1 ml di soluzione fisiologica, per 3 giorni, e 0.1 ml di Liraglutide per altri 3 giorni. I pazienti sono stati invitati a consumare una quantità costante di carboidrati per tutta la durata dello studio, ad astenersi dall’esecuzione di esercizio fisico intenso e, durante i sei giorni di osservazione, per registrare le escursioni glicemiche giornaliere, è stato applicato Continuous Glucose Monitoring in modalità Real-Time.
I nostri risultati mostrano che, durante i 3 giorni di trattamento con Liraglutide, seppur ad un dosaggio ridotto, la glicemia media giornaliera risulta significativamente inferiore rispetto ai 3 giorni di trattamento con Placebo. Si assiste, inoltre, ad una significativa riduzione della variabilità glicemica sia quando viene valutata come Deviazione Standard della glicemia sia quando viene utilizzato il Coefficiente di Variazione.
Contemporaneamente si assiste a una significativa riduzione delle glicemie al di sopra dei 140 mg/dl nei giorni di trattamento con Liraglutide rispetto a quelli in cui i pazienti ricevevano trattamento con Placebo.
Relativamente alle ipoglicemie (valori inferiori a 70 mg/dl) si assiste, durante trattamento con Liraglutide, ad una lieve riduzione dell’area sotto la curva per glicemie inferiori a 70 mg/dl, anche se la differenza tra i due periodi di trattamento non risulta significativa. Analizzando, infine, il fabbisogno insulinico giornaliero dei nostri 8 pazienti, è stata registrata una significativa riduzione delle unità di insulina nei 3 giorni di trattamento con Liraglutide rispetto al Placebo.
4
Relativamente ai meccanismi che stanno alla base dei cambiamenti nell’omeostasi glicemica indotte dalla Liraglutide, nel diabete tipo 1, è possibile ipotizzare che, un ruolo importante venga svolto dalla Liraglutide con la soppressione dell’iperglucagonemia post-prandiale.
Un ulteriore meccanismo potrebbe giocarlo il rallentato svuotamento gastrico, indotto dalla Liraglutide, che potrebbe determinare una riduzione dell’escursione glicemica post-prandiale. Un ultimo meccanismo, seppur ipotetico, potrebbe essere la capacità del GLP-1, e dei suoi analoghi, di “risvegliare”, in alcuni casi, l’attività quiescente delle β-cellule residue.
Naturalmente queste iniziali osservazioni non sono da considerarsi definitive e non consentono, al momento, un’applicazione indiscriminata di questo schema di trattamento a tutti i soggetti con diabete tipo 1. Per poter confermare il potenziale effetto positivo del trattamento combinato di insulina e agonisti del recettore del GLP-1 nel diabete tipo 1, occorrono studi con numerosità più ampia, di maggiore durata, randomizzati e a doppio cieco.
5
DIABETE MELLITO TIPO 1
Introduzione
Il diabete mellito tipo 1 è una patologia multifattoriale e poligenica caratterizzata dalla distruzione specifica e selettiva delle ß-cellule pancreatiche su base autoimmune con conseguente deficit assoluto di Insulina.
La storia della terapia insulinica inizia nel 1922 con la prima iniezione di 15 ml di estratto pancreatico di cane, eseguita da Banting e Best alla giovane L. Thompson, affetta da una malattia fino ad allora mortale, il Diabete mellito (1). Anche se si trattava di una preparazione insulinica impura, ha salvato la vita della bambina che ha subito ripreso il peso corporeo precedentemente perso.
Da allora non è trascorso molto tempo affinchè l’insulina generasse ulteriori aspettative e si potessero stabilire degli obiettivi terapeutici.
Già nel 1935, il dottor Elliot Joslin, fondatore della diabetologia moderna, sosteneva che “l’obiettivo di una adeguata terapia del diabete dovrebbe includere un serio sforzo per raggiungere livelli glicemici simili al soggetto non diabetico”. In effetti, negli anni successivi, al fine di raggiungere questo obiettivo, molti sforzi sono stati eseguiti dai pazienti, dai loro medici e dalle aziende farmaceutiche. Tuttavia, ci sono voluti altri 50 anni, prima che la sperimentazione confermasse che il trattamento insulinico intensivo, il solo capace di assicurare un controllo glicemico quasi normale, è in grado di prevenire e/o rallentare la comparsa e/o l’evoluzione delle complicanze d’organo legate al diabete.
6
Nello studio clinico Diabetes Control and Complication Trials (DCCT) il raggiungimento e mantenimento dell’emoglobina glicosilata A1c (HbA1c) a 7,0% nel gruppo di pazienti sottoposti a terapia insulinica intensiva, rispetto ai pazienti trattati con terapia insulinica convenzionale e con compenso metabolico peggiore (HbA1c 9.0%), si associava ad un significativa riduzione del rischio di nuova comparsa o di progressione della microangiopatia. Analizzando singolarmente le varie forme di microangiopatia si registrava per la retinopatia, nefropatia e neuropatia, rispettivamente, una riduzione del rischio del 76%, 50% e 60%, per i nuovi casi, e del 54%, 50% e 60% per la progressione delle stesse (2).
Durante tutti questi anni, cercando di mimare la fisiologica secrezione di insulina da parte del pancreas umano, sono stati ottenuti dei grandi progressi nel trattamento del diabete tipo 1, basati sulla scoperta di nuove insuline, nuovi schemi terapeutici, l’avvento dell’automonitoraggio glicemico domiciliare, l’utilizzo di terapie non-insuliniche, ecc. Tutto ciò ha permesso di ridurre le oscillazioni glicemiche giornaliere, migliorando l’omeostasi glucidica e la qualità della vita dei soggetti affetti da diabete mellito tipo 1.
7
Epidemiologia
In passato il diabete mellito tipo 1 era considerata una patologia tipica dell'infanzia o comunque di una età inferiore a 20 anni, con un esordio improvviso caratterizzato da una delle complicanze acute più temibili: la chetoacidosi. Dati più recenti suggeriscono che solo circa il 50-60% dei pazienti con diabete di tipo 1 ha un’età inferiore ai 16-18 anni alla diagnosi e che tale malattia si verifica, pur se con bassa incidenza, anche in età adulta. Inoltre, studi sulla storia naturale del diabete tipo 1 nei parenti di primo grado con positività per gli anticorpi contro l’insula pancreatica, indicano che vi è spesso un lungo periodo di tempo che precede l'insorgenza clinica della malattia, in cui l’omeostasi glicemica è normale o solo lievemente alterata (3,4). Infine, la chetoacidosi diabetica non è presente sistematicamente all'esordio della malattia, in età pediatrica, ad esempio, viene segnalata nel 15-67%, mentre negli adulti in circa il 25% degli esordi di malattia (5,6).
La Tabella 1 riassume la presentazione del diabete di tipo 1 a seconda dell'età (7,8).
Tabella 1: Presentazione del T1D a seconda dell’età
Bambini Adulti Commenti
Durata dei sintomi (settimane)
3-4 7-8 Grande Variabilità Sintomi classici* 95% 96% Raramente asintomatica DKA alla diagnosi (%) 15-67% ~25%
Dipendente dall’età: 0-4 anni 5-9 anni 10-14 anni 15-21 anni 40-50 % 15-25 % 17-28 % 12-15 %
La frequenza di DKA alla diagnosi è correlata inversamente con l’incidenza nelle diverse aree geografiche
* Poliuria, nicturia, enuresi, polidipsia, polifagia, perdita di peso, letargia, astenia, dolore addominale.
8
L'epidemiologia del diabete di tipo 1, in molti paesi, è stata valutata soprattutto nei bambini di età inferiore a 18 anni. Dai vari registri (Diamond, Eurodiab, ecc) risulta, innanzitutto, che l'incidenza di malattia è aumentata di circa 2-5% (3-4% per Eurodiab) per anno, con una notevole variabilità, nel corso degli anni, caratterizzata da periodi ad alta incidenza alternati a periodi a bassa incidenza (9-12).
Esiste, inoltre, una grande variabilità geografica, con paesi come la Cina, che ha la più bassa percentuale d’incidenza (circa 0,57 casi ogni 100 000 abitanti per anno in giovani non oltre i 18 anni di età) il Regno Unito con percentuali maggiori di circa 30 volte (18-20 casi per 100 000 abitanti all'anno) e luoghi come Finlandia e Sardegna dove l’incidenza è quasi 100 volte superiore (circa 48-49 casi per 100 000 abitanti all'anno) (13-20).
Vi è anche una riduzione significativa dell'età di comparsa del diabete, in particolare nei bambini di età inferiore ai 5 anni. Indicativi sono i dati sulla popolazione svedese e belga (21,22). In Svezia dal 1983 al 1998, mentre, nella popolazione di età inferiore ai 34 anni, l’incidenza complessiva non è aumentata, l'età media alla diagnosi si è progressivamente ridotta (21). Risultati simili sono emersi in Belgio, dal 1989 al 2000, nei pazienti di età inferiore ai 40 anni (22). Questa tendenza alla comparsa precoce della malattia potrebbe essere riconducibile ad una maggiore esposizione a fattori ambientali scatenanti e/o all’incremento ponderale della popolazione generale (23,24). A conforto di ciò sta il dato che la popolazione migrante, in breve tempo, acquisisce un rischio di malattia uguale alla popolazione autoctona (25). Ciò è ulteriormente supportata dai dati che l'incidenza crescente della malattia in età infantile è sempre meno associata al contributo degli aplotipi HLA ad alto rischio per diabete (10).
9
Eziopatogenesi
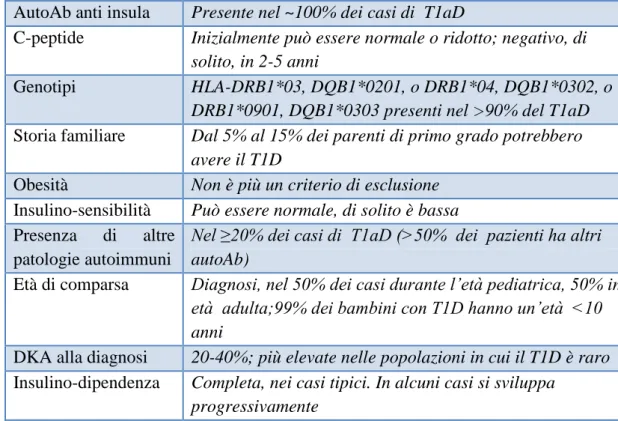
Il Diabete tipo 1 è una condizione in cui la distruzione delle -cellule pancreatiche porta a carenza assoluta di insulina (3,26-28). Le caratteristiche cliniche e laboratoristiche correntemente utilizzate per distinguere il Diabete tipo 1 sono riassunte nella Tabella 2 (29).
Tabella 2. Caratteristiche cliniche e laboratoristiche del Diabete tipo 1
AutoAb anti insula Presente nel ~100% dei casi di T1aD
C-peptide Inizialmente può essere normale o ridotto; negativo, di solito, in 2-5 anni
Genotipi HLA-DRB1*03, DQB1*0201, o DRB1*04, DQB1*0302, o DRB1*0901, DQB1*0303 presenti nel >90% del T1aD
Storia familiare Dal 5% al 15% dei parenti di primo grado potrebbero avere il T1D
Obesità Non è più un criterio di esclusione
Insulino-sensibilità Può essere normale, di solito è bassa
Presenza di altre patologie autoimmuni
Nel ≥20% dei casi di T1aD (>50% dei pazienti ha altri autoAb)
Età di comparsa Diagnosi, nel 50% dei casi durante l’età pediatrica, 50% in
età adulta;99% dei bambini con T1D hanno un’età <10 anni
DKA alla diagnosi 20-40%; più elevate nelle popolazioni in cui il T1D è raro
Insulino-dipendenza Completa, nei casi tipici. In alcuni casi si sviluppa progressivamente
Sono identificate due forme: il tipo 1A, causato dall’attacco autoimmune cellulo-mediato delle -cellule (3,27-28), ed il tipo 1B, molto meno frequente, la cui causa è sconosciuta, che si verifica soprattutto in soggetti di origine asiatica o africana, con diversi gradi di carenza insulinica ed episodi sporadici di chetoacidosi (30). Negli anni 1980 Eisenbarth (31) propose il modello attuale per lo sviluppo della forma immunitaria di diabete mellito tipo 1 e, anche se le nostre conoscenze da allora hanno compiuto notevoli progressi, gli aspetti fondamentali di questo modello restano pertinenti (3,27-28). Questo
10
modello ipotizza che tutti i soggetti nascono con un certo grado di suscettibilità, più o meno marcata, a sviluppare diabete mellito tipo 1. La suscettibilità è in gran parte ereditata, e risiede prevalentemente nei genotipi HLA DR e DQ e, in misura minore, in una serie di altri loci genetici definiti geni sensibili IDDM (diabete mellito insulino-dipendente) (Tabella 3).
Tabella 3. Loci importanti ai fini della suscettibilità per Diabete tipo 1
Cromosomi Geni/markers Candidati
IDDM1 6p21-31 Regione HLA DR/DQ
Importante ruolo nella presentazione dei peptidi alle Cellule T
IDDM2 11p15-5 Insulin-VNTR Protezione associata al messaggio timico dell’insulina
IDDM12 2q33 CTLA-4, CD28 Relativo all’attivazione delle Cellule T, Autoimmunità tiroidea
Per molti di quelli non in lista (IDDM 3-11, 13-17), il gene responsabile non è stato ancora identificato oppure la funzione del gene responsabile è ancora incerta in relazione al T1D.
Il locus HLA si ritiene che conferisca circa il 50% della suscettibilità genetica, circa il 15% è dovuto ad altri due geni insulina-VNTR (IDDM2) e CTLA-4 (IDDM12) ed infine contributi minori sono forniti da altri geni IDDM (3,27-28,32). Sono stati identificati, inoltre, sia alcuni geni associati ad alto rischio di malattia (ad esempio, DR3/4, DQA1 * 0301-DQB1* 0302 e DQA1 * 0501-DQB1 * 0201) sia gli aplotipi HLA con effetto protettivo (DQA1 * 0102-DQB1* 0602, che conferiscono resistenza al diabete e le molecole DR come DRB1 * 1401, associate con protezione dal diabete) (27). Questi geni di suscettibilità sono ritenuti importanti regolatori della risposta immunitaria. Altri geni associati sia con sindromi rare tra cui il diabete (ad esempio, AIRE e Foxp3) che con altre patologie autoimmuni (ad esempio, PTPN22)
11
potrebbero anche fornire importanti informazioni sulla patogenesi immune del diabete mellito tipo 1.
Il passo successivo richiede l'esposizione ad uno o più fattori ambientali che alterano la funzione immunitaria, avviando la distruzione delle beta-cellule. I fattori scatenanti includono tossine ambientali (ad esempio, nitrosamine) (33), o alimenti (ad esempio, precoce esposizione alle proteine del latte vaccino, cereali, o glutine) (34-38) e virus (ad esempio, gli enterovirus, Coxsackie). Una stretta relazione è stata identificata anche con la rosolia congenita (39,40). Un gruppo di ricercatori europei , nel 2003, (41) hanno identificato la presenza di un virus Coxsackie B4 nelle cellule beta di un sottogruppo di donatori d’organo, affetti da diabete tipo 1. Le isole pancreatiche di quel sottogruppo di soggetti con infezione virale beta-cellulare, presentavano segni d’infiammazione (insulite) caratterizzata dalla presenza di cellule ‘natural killer’ (NK), ma senza la tipica infiltrazione da parte dei linfociti T autoreattivi. Quando poi con lo stesso virus si è provato ad infettare le cellule beta-pancreatiche sane, queste presentavano a loro volta un difetto secretivo e segni di sofferenza cellulare, ma non venivano distrutte; ciò indicava che l’infezione virale, comunque, era in grado di interferire con il normale funzionamento delle cellule beta (e quindi con la secrezione insulinica) (41).
Relativamente ad un possibile effetto scatenante da parte delle vaccinazioni pediatriche, i risultati di uno studio effettuato nel 2004 non hanno confermato l’esistenza di una relazione causale tra la vaccinazione ed il diabete mellito tipo 1 (42,43).
L'attivazione anomala del sistema immunitario, mediata dalle cellule-T, negli individui suscettibili, porta ad una risposta infiammatoria all'interno delle isole pancreatiche (insulite) nonché ad una risposta umorale con produzione di anticorpi contro gli antigeni beta-cellulare. I
12
primi anticorpi ad essere stati descritti sono gli anticorpi anti-insula, ma successivamente sono stati sostituiti, nella diagnosi di malattia, da autoanticorpi più specifici come quelli diretti verso l'insulina (IAA), l’acido glutammico decarbossilasi (GADA/GAA) e la proteina tirosina
fosfatasi IA2 (IA-2AA), tutti facilmente rilevati
radioimmunologicamente (3). Recentemente, lo zinco-trasportatore 8 (ZnT8) (Slc30A8) è stato identificato come nuovo autoantigene. Sono stati, infatti, rilevati anticorpi anti ZnT8 nel 60-80% dei nuovi casi di diabete di tipo 1 rispetto a <2% dei controlli e <3% dei diabetici tipo 2 e nel 30% dei pazienti con altre patologie autoimmuni associate al diabete tipo 1. Anticorpi anti-ZnT8 (ZnT8A) sono stati trovati nel 26% dei soggetti con diabete tipo 1 precedentemente classificati come autoanticorpi negativi sulla base degli attuali marcatori [glutammato decarbossilasi (GADA), proteina tirosina fosfatasi IA2 (IA2A), anticorpi anti-insulina (IAA), e insule autoanticorpi citoplasmatici (ICA)]. Soggetti seguiti dalla nascita fino alla comparsa di diabete tipo 1 hanno mostrato ZnT8A già all’età di 2 anni con livelli via via crescenti e persistono anche dopo la comparsa di malattia. Nella fase di prediabete, gli ZnT8A generalmente compaiono più tardi rispetto a GADA e IAA, anche se ciò non è la regola (44). La presenza di uno o più tipi degli anticorpi suddetti può precedere la manifestazione clinica del diabete tipo 1 di anni o, addirittura, decenni. La presenza e la persistenza di positività anticorpale aumenta la probabilità di progressione verso la malattia clinica (4,45-46). Non c'è dubbio che ognuno di questi anticorpi ha un ruolo attivo nella patogenesi di questa malattia.
Con la graduale distruzione delle beta-cellule pancreatiche si determina la progressiva perdita della riserva secretoria di insulina. Inizialmente si registra la perdita della prima fase secretoria insulinica, valutata durante test di tolleranza al glucosio endovenoso (IVGTT)
13
successivamente, quando la secrezione di insulina scende sotto un valore critico, si assiste alla comparsa clinica del diabete. La distruzione beta-cellulare, infine, anche se non in tutti i pazienti, porta ad uno stato di deficit assoluto di insulina (3, 31). Il periodo di luna di miele, o periodo di remissione della malattia, avviene subito dopo la diagnosi clinica con l'inizio della terapia insulinica, quando, diminuita l’insulino-resistenza legata alla glucotossicità iniziale, una parte della secrezione endogena di insulina residua viene ripristinata, grazie alle beta-cellule non ancora distrutte (47,48). In generale, in base all’età d’insorgenza del diabete è possibile affermare che, quando il diabete insorge in giovane età, si assiste ad una più rapida distruzione delle beta-cellule, rispetto agli adulti. Inoltre nei giovani pazienti, meno frequentemente, registriamo lunghi periodi di remissione (47). Gli individui adulti, inoltre, hanno più probabilità di rispondere, subito dopo la diagnosi, ad interventi finalizzati sul sistema immunitario volti a preservare la secrezione residua di insulina.
A conferma della patogenesi autoimmunitaria del diabete tipo 1 c’è la predisposizione, di questi individui, a sviluppare altre patologie autoimmuni; tra queste la Tiroidite di Hashimoto, la malattia di Graves, il morbo di Addison, la Celiachia, la Miastenia Gravis, e la Vitiligine sono le più frequenti (49-52). Sebbene la conoscenza ha contribuito alla comprensione della patogenesi del diabete tipo 1, non esiste una teoria unificante circa la causa di tale patologia. Tra le teorie più accreditate, ci sono quella dell’igiene e l’ipotesi dell’acceleratore (53,54).
L'ipotesi dell'igiene deriva dalle osservazioni che i disturbi atopici, come l'asma, sono più frequenti nei paesi più ricchi e la loro incidenza aumenta con la crescita della modernizzazione. Tali disturbi sono meno frequenti nei bambini di famiglie numerose o tra i bambini che frequentano l’asilo nido rispetto ai bambini di famiglie meno numerose o
14
che non frequentano l’asilo nido (53,55,56). Esistono della analogie tra questi risultati e alcuni studi sul diabete tipo 1 (57). Questi risultati suggeriscono che i bambini, in queste situazioni, sono meno esposti, nei primi anni della loro vita, ad infezioni o altre problematiche immunitarie che agiscono come fattori protettivi verso i fattori ambientali. Gale (53) ha proposto che l'effetto protettivo è mediato dai linfociti T regolatori. Anche se plausibile, questa ipotesi sulla genesi del diabete tipo 1 è, al momento, priva di sostegno scientifico credibile.
Nell'ipotesi dell’acceleratore, Wilkin (54) ipotizza che il diabete tipo 1 e tipo 2 siano due aspetti di un’unica malattia, piuttosto che due entità distinte. Egli sostiene che i due tipi di diabete si distinguono solo per la percentuale di beta-cellule perdute, e per gli acceleratori specifici per la comparsa della malattia. Wilkin chiama in causa tre acceleratori:
Il primo è un elevato tasso di apoptosi beta-cellulare, di tipo costituzionale, che è un passo essenziale ma insufficiente per lo sviluppo di diabete.
Il secondo è l'insulino-resistenza, come conseguenza dell’incremento ponderale e dell’inattività fisica. Quest’ultima rappresenterebbe il legame tra i due tipi di diabete. L'insulino-resistenza, costringendo la massa beta-cellulare, già a rischio per l'apoptosi, ad uno sforzo lavorativo, potrebbe accelerare la morte programmata, contribuendo all’espressione clinica del diabete.
Il terzo acceleratore è presente solo in quegli individui predisposti geneticamente per l’autoimmunità cellulare. Le beta-cellule metabolicamente più attive, in individui insulino-resistenti, geneticamente predisposti all’elevato tasso di apoptosi, sono a maggior rischio di deterioramento funzionale della beta-cellula, espressione tipica del diabete tipo 1. In assenza di quest’ultimo acceleratore immunitario, l’apoptosi è più lenta e la progressione è verso il diabete tipo 2.
15
I sostenitori della ipotesi dell’acceleratore dicono che l'aumento dell'obesità infantile parallelamente alla crescita, nell'infanzia, di entrambi i tipi di diabete, e la diminuzione dell'età di insorgenza del diabete tipo 1 nei bambini con peso elevato conferiscono ulteriore sostegno alla loro tesi (58). Sempre più persone, infatti, con diabete tipo 1 presentano un quadro di insulino-resistenza e problemi ponderali.
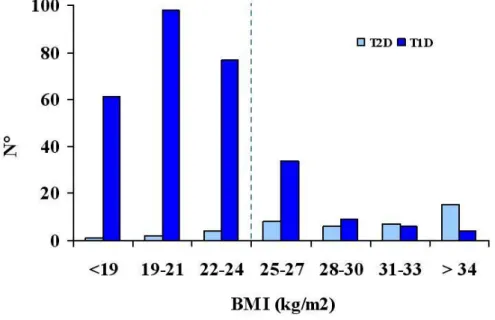
Viene segnalato come il 40-50% dei pazienti con diabete tipo 1, negli Stati Uniti, in concomitanza con il diabete presentano un quadro di sindrome metabolica (59). Nel DCCT/EDIC study, inoltre, dopo 12 anni di follow-up, il 30% dei pazienti con diabete tipo 1 presentavano una condizione di obesità (60). Una simile percentuale (30%) di bambini con diabete tipo 1 risultano in sovrappeso o francamente obesi (61). Questo ci porta ad affermare che l’obesità è compatibile con la diagnosi di diabete tipo 1. Infatti, in USA circa la metà dei pazienti con BMI >27 kg/m2, con una diagnosi di diabete prima dei 20 anni ha il Diabete tipo 1 (Figura 1) (29).
16
Figura 1: Distribuzione del BMI alla diagnosi di diabete, età 10-19 anni.
Gli oppositori della tesi dell’”Acceleratore”, invece, sostengono che esistono prove sufficienti a sostegno del modello Eisenbarth (Figura 2) senza dover coinvolgere altri acceleratori (62).
Figura 2: Vari stadi nello sviluppo del Diabete tipo 1(modificata da Eisenbarth GS. N Engl J Med 1986: 314; 1360.)
17
TERAPIA DEL DIABETE TIPO 1
Terapia Insulinica
Il gold standard per la terapia del Diabete mellito tipo 1 è la terapia insulinica.
Nel Maggio del 1921, un gruppo di ricercatori canadesi guidati da Banting Frederick, in appena otto mesi isolarono un estratto pancreatico dal cane, ne dimostrarono le proprietà ipoglicemizzanti negli animali da laboratorio, isolarono una sostanza con caratteristiche simili dal pancreas bovino, ed infine confermarono i suoi effetti di riduzione della glicemia nell’uomo. Il nome dell’estratto non poteva essere che Insulina. Leonard Thompson e James Havens Jr furono i due adolescenti che agli inizi del 1922 si avvantaggiarono della prima insulina, con risultati certamente eccellenti per allora. Thompson morì di polmonite 13 anni dopo, mentre Havens riuscì a sposarsi, avere bambini e diventare un artista quotato prima di morire per cancro all’età di 59 anni(63).
La commercializzazione dell’insulina iniziò subito negli Stati Uniti e Canada.
La prima insulina regolare aveva una durata di 6-8 ore; era confezionata e commercializzata a pH acido, necessario per solubilizzare le altre proteine presenti nell’estratto e proteggere l’insulina dalla degradazione operata dagli enzimi pancreatici presenti come contaminanti nella preparazione. Nonostante i limiti delle prime preparazioni commerciali (troppo diluite, impure, poco riproducibili nell’attività biologica) la durata della vita dei diabetici aumentò di molto, cosi come la qualità della vita, almeno nei primi anni di malattia (64).
18
Nel giro di una decade divenne chiaro che l’insulina non curava il diabete, perchè complicanze come cecità, insufficienza renale, gangrena ed infarto del miocardio erano comunque presenti, sebbene con minore velocità di progressione. Qualche mente illuminata, come Elliot Joslin, già allora predicava che la normalizzazione della glicemia era indispensabile per eliminare le complicanze del diabete, ma le prove sarebbero apparse molti anni dopo (2).
Il problema della durata d’azione, mostratosi precocemente, fu affrontato aggiungendo additivi per ritardare l’assorbimento dell’insulina. Agli inizi degli anni Trenta fu prodotta la protamino-zinco, con una durata d’azione più lunga (in teoria 36 ore) ma gravata da frequenti reazioni cutanee e incostanza di assorbimento. Negli anni quaranta il danese H.C. Hagedorn sviluppò l’isofane, insulina-protamina a pH neutro, che divenne ben presto il punto di riferimento delle insuline con durata intermedia (12-14 ore) (NPH). Qualche anno dopo, negli anni Cinquanta, venne fuori la serie delle insuline lente che utilizzava differenti concentrazioni di zinco per ottenere insuline con diversa durata d’azione (64).
La biologia molecolare, negli anni Ottanta, ha permesso di ottenere le prime insuline, umane nella sequenza e nella conformazione spaziale, utilizzando diversi sistemi basati sulla tecnologia del DNA ricombinante attraverso l’inserimento del gene della proinsulina umana in ceppi non patogeni di E.Coli o Saccharomyces Cerevisiae. Ciò ha permesso di abbandonare le insuline animali con una riduzione delle reazioni immuno-mediate (65).
Le insuline tradizionali si sono dimostrate ragionevolmente efficaci quando utilizzate negli schemi di terapia insulinica intensificata con iniezioni multiple. Purtroppo le insuline regolari, per quanto pronte, agiscono in modo troppo lento per riprodurre le caratteristiche
19
farmacologiche dell’insulina rilasciata ai pasti da un pancreas normale. Inoltre, il consiglio di anticipare la dose di insulina prandiale di 20-30 minuti, nel tentativo di ridurre il “gap” tra picco glicemico ed effetto insulinico massimale, tende ad essere trascurato, con la maggior parte dei pazienti che si inietta l’insulina 5-10 minuti prima del pasto. Sull’altro fronte, l’ipoglicemia può diventare un problema a distanza di 3-4 ore del pasto. Ancora più problemi offrono le insuline lente ed ultralente con la mancata copertura delle 24 ore e con indesiderati ed imprevedibili picchi di attività, vista l’estrema variabilità d’azione, che ostacolano la desiderata insulinizzazione basale. A causa di queste limitazioni la ricerca si è orientata verso lo studio di molecole di insulina che riproducessero al meglio le caratteristiche basali e prandiali necessarie per mimare la fisiologia (65).
L’occasione si è presentata quando divenne chiaro che, mutazioni specifiche di particolari amminoacidi della molecola, potevano produrre insulina con attività biologica simile a quella umana di partenza, ma con differente velocità di assorbimento sottocutaneo. La prima insulina modificata, designata con il nome di analogo a breve durata, che si rese disponibile sul mercato è stata l’insulina lispro commercializzata nel 1996 negli Stati Uniti. Negli anni successivi, altri analoghi sia a breve durata (Insulina Aspart e Glulisina) che a lunga durata d’azione (Insulina Glargine e Detemir), sono stati commercializzati (66).
Gli analoghi a breve durata d’azione sono assorbiti molto più rapidamente in quanto presenti sotto forma di monomeri o dimeri nel sito di iniezione e hanno un picco d’azione di circa 1 ora e durata d’azione di circa 4 ore. Queste caratteristiche di assorbimento spiegano la rapidità di inizio e la breve durata d’azione, più efficaci nel controllo della iperglicemia post-prandiale e più raramente causa di ipoglicemia post-prandiale. L’effetto ipoglicemizzante ottimale degli analoghi a
20
breve durata si raggiunge quando la somministrazione viene effettuata nei 15 minuti precedenti il pasto, anche se il procrastinare l’iniezione subito dopo il pasto non altera eccessivamente il loro effetto (66). Inoltre dimostrano meno variabilità giornaliera nelle caratteristiche farmacologiche, il che si traduce in una maggiore prevedibilità dell’effetto biologico. Sebbene gli analoghi a breve durata d’azione sembrino presentare vantaggi rispetto all’insulina regolare in termini di convenienza e farmacocinetica, non sempre gli studi clinici hanno mostrato un miglioramento dei livelli di HbA1c. Una probabile ragione è da ricercare nella breve durata d’azione dell’analogo che non riesce a frenare un’iperglicemia post-prandiale tardiva aggravata dal fatto che manca, ad oggi, nella terapia insulinica multiiniettiva, una insulina ad azione lenta, che possa creare una insulinizzazione basale ottimale. L’ostacolo può essere aggirato aumentando l’insulina basale per compensare la più breve durata d’azione dell’analogo; gli studi clinici, infatti, hanno dimostrato che l’aggiunta di piccole dosi di insulina NPH all’analogo prima del pasto produce un miglior controllo glicemico in termini di riduzione di HbA1c e causa meno eventi ipoglicemici.
L’analogo a lunga durata d’azione, insulina Glargine e insulina Detemir, presentano una durata d’azione rispettivamente tra le 20-24 ore, la prima, e 12 ore circa la seconda senza evidente picco insulinico (66). Gli studi che hanno confrontato gli effetti di una singola dose di insulina Glargine rispetto alla somministrazione serale o bi-giornaliera di insulina NPH hanno fatto rilevare un controllo glicemico uguale se non migliore nei pazienti trattati con l’analogo in associazione con un minor rischio di ipoglicemia notturna (67).
Oggi abbiamo a disposizione diversi tipi di insuline a rapida e lunga durata d’azione (Figura 3) questo però non ha portato ad un eccellente compenso glicometabolico di tutti i pazienti affetti da diabete
21
mellito tipo 1 in quando ognuno di loro è un entità diversa con diversi fabbisogni insulinici giornalieri, sensibilità insulinica ed insulino-resistenza, attività lavorativa e non e comorbilità associate.
Figura 3. Farmacocinetica delle insuline attualmente in commercio
Prendendo in considerazione le necessità personali appena descritte ma anche i brillanti risultati del DCCT (2), in primis, ed altri studi che hanno dimostrato l’importanza del controllo glicemico nel prevenire o rallentare le complicanze micro- e macrovascolari croniche del diabete negli ultimi anni è stata innescata una onda fruttuosa di ricerche volte allo sviluppo di terapie innovative, in particolare sulla terapia insulinica, in modo da poter personalizzare la terapia e adeguarla alle necessità cliniche dei singoli pazienti.
Sono in via di sperimentazione, infatti, altri analogi, alcuni ad azione ancora più rapida, rispetto a lispro, aspart e glulisina, (linjeta®) ed altri con durata d’azione ancora più lenta rispetto a detemir e glargine (Degludec®, LY2605541®). Tutto ciò per creare un’insulinizzazione sempre più simile a quella endogena (68).
22
Relativamente alla Degludec, caratterizzata da una durata d’azione prolungata, maggiore di 24 ore, ed una ridotta variabilità sono stati recentemente pubblicati dati di confronto tra Degludec ed insulina Glargine sia nel diabete tipo 1 che tipo 2. Entrambe le insuline determinano un controllo glicemico ed un numero di ipoglicemie simili. Sembra, comunque, che la Degludec, rispetto alla Glargine, si accompagna ad una riduzione del 25% del numero di ipoglicemie notturne (68).
D’altra parte c’è anche il tentativo di migliorare l’assorbimento sottocutaneo delle insuline rapide attualmente in commercio. A tale riguardo viene sperimentata l’aggiunta alla preparazione insulinica di Ialuronidasi umana da DNA ricombinante (rHuPH20 Hyaluronidase), utilizzata per interagire con l’acido ialuronico presente nei tessuti interstiziali del sottocute. La Ialuronidasi, in questo modo, rompe la barriera che rallenta il flusso dei liquidi nel tessuto sottocutaneo, permettendo all’insulina di raggiungere i capillari più velocemente. L’assorbimento, così, è molto più rapido, il picco di concentrazione più alto e la durata d’azione più corta. Tutte queste caratteristiche farmacocinetiche si potrebbero tradurre in un miglior controllo delle escursioni glicemiche post-prandiali ed una riduzione delle ipoglicemie post-prandiali (69).
Dando uno sguardo al futuro prossimo della terapia insulinica, noon possiamo non fare un cenno all’insulina intelligente o smart-insulin, un’insulina che promette di funzionare di più con glicemie elevate e meno in caso di ipoglicemie. La smart-insulin è costituita da un polimero glicosilato coniugato con insulina (IPC), biocompatibile e biodegradabile, che si lega ad una molecola ingegnerizzata legante il glucosio (GBM). In presenza di elevate concentrazioni di glucosio, il polimero IPC, con l’insulina, viene staccato da GBM determinando il
23
calo glicemico. In caso di ipoglicemia il legame tra IPC e GBM di venta serrato, impedendo la liberazione di insulina (70) (Figura 4).
Figura 4. Tecnologia Smart-insulin con attività glucosio-dipendente
Terapia infusionale continua sottocutanea di insulina e sensori
Anche se negli ultimi 90 anni, come è stato sopramenzionato, la terapia insulinica ha subito diversi cambiamenti in senso migliorativo puntando sull’ottimizzazione della terapia del diabete mellito tipo 1, tuttora esistono le stesse problematiche gestionali del passato. In particolare, vista l’estrema variabilità della richiesta insulinica nelle 24 ore e a seconda dell’età (Figura 5) (71), esiste la difficoltà a rappresentare il fabbisogno insulinico basale con un’insulina che, nelle migliori condizioni, può assicurare una insulinizzazione piatta per tutte le 24 ore.
24
Figura 5. Fabbisogno insulinico giornaliero in soggetti con diabete tipo 1.
Un aiuto concreto per la risoluzione di questi problemi può arrivare dalla somministrazione sottocutanea continua dell’insulina attraverso micro pompe programmabili chiamati microinfusori. Questa modalità di terapia insulinica, introdotta più di 30 anni fa (il primo microinfusore, messo in commercio nel 1976 da Pickup e Keen) (72,73 74), è quella che, più della terapia multiiniettiva con penne da insulina, riesce a mimare al meglio la fisiologica secrezione pancreatica di insulina dei soggetti sani.
Il microinfusore è una pompa portatile di insulina, che utilizzando l’analogo rapido di insulina, la infonde attraverso una fine cannula sottocutanea in teflon secondo due modalità: in modo continuo nelle 24 ore, per l’insulinizzazione basale (notturna ed interprandiale) e sotto forma di boli pre-pasto, decisi dal paziente stesso (insulinizzazione prandiale).
La terapia insulinica con microinfusore, rispetto alla terapia multi-inniettiva, migliora il controllo glicemico nei pazienti con Diabete mellito tipo 1 perchè riduce la variabilità glicemica (75,76,77). Questo effetto forse è dovuto alla minima deposizione sottocutanea dell’insulina
25
durante la terapia con microinfusore ed il basso coefficiente di variabilità dell’assorbimento durante l’infusione basale continua. La riduzione delle oscillazioni glicemiche giornaliere porta ad un miglioramento del compenso metabolico e quindi alla riduzione della HbA1c senza rischio di incremento di ipoglicemie (75).
Diverse meta-analisi di studi randomizzati che hanno valutato il controllo glicemico mettendo a confronto la terapia insulinica multi-iniettiva e quella continua sottocutanea con microinfusore, hanno dimostrato che l’HbA1c media è significativamente più bassa con la terapia con microinfusore (con una differenza media da 0.3 a 0.6% tra i vari studi). Questa riduzione della glicata è accompagnata, inoltre, da una riduzione della dose insulinica giornaliera del 10-20% (78-81).
Un altro dato importante è la riduzione significativa della frequenza delle ipoglicemie severe nei pazienti che effettuano terapia con microinfusore rispetto a quelli in terapia insulinica multi-iniettiva (80).
Alcuni lavori hanno valutato, infine, le ripercussioni della terapia con microinfusore sulla qualità delle vita dei pazienti. Una review della Cochrane conclude che i pazienti preferiscono la terapia insulinica con microinfusore rispetto a quella multi-iniettiva, sia per quando riguarda la soddisfazione terapeutica, ma anche per la qualità della vita e la percezione della salute generale e mentale di questi pazienti (81).
Questo tipo di trattamento viene prescritto in pazienti ben selezionati che, nonostante una buona gestione della terapia insulinica multiniettiva, presenta alcuni problemi nel controllo della loro malattia (come per esempio scarso controllo glicemico, frequenti ipoglicemie severe e/o ipoglicemie unawareness, fenomeno alba, bisogno di flessibilità per esigenze lavorative e non, paura degli aghi e
26
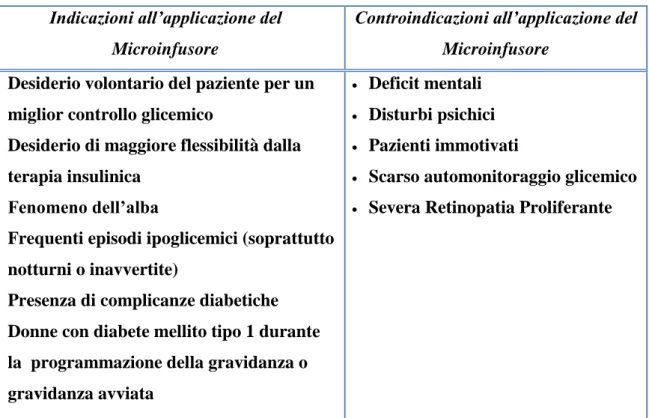
preparazione per il concepimento nelle pazienti affette da diabete mellito tipo 1) (Tabella 4).
Tabella 4. Indicazioni e controindicazioni all’uso del Microinfusore Indicazioni all’applicazione del
Microinfusore
Controindicazioni all’applicazione del Microinfusore
Desiderio volontario del paziente per un miglior controllo glicemico
Desiderio di maggiore flessibilità dalla terapia insulinica
Fenomeno dell’alba
Frequenti episodi ipoglicemici (soprattutto notturni o inavvertite)
Presenza di complicanze diabetiche
Donne con diabete mellito tipo 1 durante la programmazione della gravidanza o gravidanza avviata
Deficit mentali
Disturbi psichici
Pazienti immotivati
Scarso automonitoraggio glicemico
Severa Retinopatia Proliferante
Per avere successo in questa forma di terapia è, comunque molto importante che i pazienti siano molto motivati, eseguano accurato autocontrollo glicemico mediante glucostik, seguano un programma di pianificazione alimentare, siano seguiti da un team medico-infermieristico-dietistico specializzato, e che siano ben educati alla gestione delle apparecchiature e alla risoluzioni di eventuali problemi intercorrenti come, per esempio, risoluzione di una ipoglicemia, correzione di una iperglicemia, gestione della terapia nel caso di malattie concomitanti, nel caso di esercizio fisico o nel caso di guasto dell’apparecchiatura (82).
Ma anche se la tecnologia ha fatto passi da gigante, circa il 20% dei pazienti in terapia con microinfusore continua ad avere episodi di
27
iper- o ipoglicemia ed una estrema variabilità glicemica (83). Questi paziente potrebbero trarre beneficio utilizzando il monitoraggio continuo delle glicemie (84). Ciò è possibile grazie a dei sensori sottocutanei, da cambiare ogni 5-7 giorni, che misurano la concentrazione di glucosio nel liquido interstiziale. I dati registrati si trasmettono in modo wireless ad un display portatile oppure, nel caso di alcuni modelli di microinfusori, direttamente sul loro monitor, dando informazioni sui valori della glicemia attuale, anche se esiste, tra lo scomparto interstiziale e quello ematico un ritardo fisiologico di adeguamento, chiamato lag-time, di 15-20 min (85). Queste due tecnologie, microinfusori e sensori, se utilizzate insieme forniscono un sistema integrato valido ed efficace per la migliore gestione del diabete mellito tipo 1. E’ stato dimostrato un miglioramento dell’HbA1c di 0,8 % nell’arco di 1 anno rispetto alla terapia multiiniettiva con una riduzione delle glicemie elevate ma senza aumentare le ipoglicemie (86). In una categoria selezionata di pazienti che sono quelli con ipoglicemie severe asintomatiche, l’utilizzo del sistema microinfusore + sensore per più dell’80% del tempo, in una piccola esperienza del nostro centro, ha determinato una riduzione delle ipoglicemie, ed in particolare delle ipoglicemie unawareness con riacquisizione del corteo sintomatologico tipico delle ipoglicemie nei pazienti che hanno utilizzato il sistema integrato dopo almeno 1 anno di terapia (87).
Inoltre tutti i pazienti devono essere capaci di praticare il conteggio dei carboidrati. Un ulteriore aiuto viene dato dagli ultimi modelli di microinfusori e dai sistemi integrati che avendo un calcolatore di boli nel loro software (88) hanno la possibilità, inserendo la quota di carboidrati da ingerire, la glicemia al momento del pasto, i target glicemici, la sensibilità insulinica e prendendo anche in considerazione la quota di insulina attiva (insulina “on board”) di suggerire al paziente
28
la dose di insulina da somministrarsi al pasto o per correggere un’eventuale iperglicemie inaspettata (89).
Per il momento comunque, si tratta di apparecchi che necessitano dell’interazione del paziente per qualsiasi variazione e gestione delle terapia; attualmente, però, sono in corso diversi studi nei quali si cerca di trovare l’algoritmo giusto e di migliorare la efficacia e la vita media dei sensori glicemici in modo da poter chiudere l’ansa (microinfusore, sensore glicemico, software) ed avere nel prossimo futuro una gestione in automatico della glicemia che escluda, quindi, l’intervento del paziente (90).
29
Terapie Farmacologiche aggiuntive non insuliniche
Diversi sono gli agenti farmacologici che in aggiunta alla terapia insulinica possono migliorare la gestione terapeutica del Diabete mellito tipo 1.
Farmaci insulino-sensibilizzanti
Negli ultimi anni si sta osservando un aumento del numero di pazienti affetti da diabete mellito tipo 1 con problemi di sovrappeso o francamente obesi che presentano, quindi, anche un certo grado di insulino-resistenza. In questi pazienti un valido aiuto farmacologico potrebbe essere dato dall’aggiunta, alla terapia insulinica, di farmaci insulino-sensibilizzanti. Tra questi il più importante è la metformina.
Pochi anni fa, ad esempio, è stata eseguita una revisione dei dati clinici prendendo in considerazione 197 studi in cui sono stati valutati gli effetti della metformina, in soggetti con diabete mellito tipo 1, sul controllo glicemico (HbA1c), sul peso corporeo, sulla dose insulinica giornaliera e sugli eventuali effetti avversi (91). Anche se gli autori hanno trovato una estrema eterogeneità tra i vari studi, per quando riguarda la dose di metformina somministrata, l’età dei soggetti partecipanti agli studi ed i tempi di trattamento e di follow-up, in linea generale emerge che la terapia con metformina è in grado di determinare una riduzione della dose insulinica giornaliera, dell’HbA1c, del peso corporeo e del colesterolo totale. Veniva inoltre dimostrato che la terapia con metformina era ben tollerata dai pazienti ma viene segnalato un lieve aumento delle ipoglicemie. Purtroppo non ci sono dati per quando riguarda gli effetti della metformina sulle malattie cardiovascolari o altri tipo di patologie in questa categoria di soggetti.
30
Per quando riguarda la terapia con i Tiazolinedioni gli studi eseguiti nel diabete tipo 1 sono prevalentemente condotti con il Rosiglitazone. In un recente studio, randomizzato in doppio-cieco, placebo-controllato crossover di rosiglitazone vs placebo (durata di 24 settimane ciascuno, con un periodo di 4 settimane di washout), rosiglitazone ha determinato una diminuzione della dose di insulina (5,8% di riduzione vs 9,4%, incremento P = 0.02), ma nessun cambiamento significativo nel livello di HbA1c (-0,3 vs -0,1, P = 0,57) (92). Alla luce di questi dati la “Food and Drug Administration” negli Stati Uniti (FDA USA) ha preteso che venisse menzionato esplicitamente, nel foglietto illustrativo del rosiglitazone, che questo farmaco non deve essere usato nel trattamento del diabete tipo 1 (93). Diversi studi eseguiti in passato, invece, hanno dimostrato gli effetti benefici dei tiazolinedioni sulla funzione beta cellulare in soggetti affetti da LADA (94). Inoltre un altro studio in doppio cieco randomizzato, eseguito per valutare la sicurezza e l'efficacia di rosiglitazone nel trattamento di soggetti con diabete di tipo 1 in sovrappeso (50 adulti), ai quali veniva somministrato, per un periodo di 8 mesi, insulina e placebo (n = 25) o insulina e rosiglitazone al dosaggio di 4 mg due volte al giorno (n = 25). Il gruppo insulina e rosiglitazone, rispetto a quello con placebo, ha mostrato un miglioramento del controllo glicemico e della pressione arteriosa senza effetti sul fabbisogno insulinico, e il massimo effetto del rosiglitazone si otteneva nei soggetti insulino-resistenti. Tale farmaco, però, è stato recentemente tolto dal commercio, per l’elevato
31
Modulatori dell’assorbimento gastrointestinale
L’acarbose è un inibitore reversibile della alfa-glucosidasi intestinale. La sua efficacia e sicurezza nel trattamento del diabete mellito tipo 1 è stata valutata in diversi studi clinici randomizzati controllati. E’ stato dimostrato che, l’uso di acarbose in associazione alla terapia insulinica, riduce i livelli della glicemia post-prandiale, nei paziente affetti da diabete mellito tipo 1 non ben controllati con la sola terapia insulinica. Inoltre è stato dimostrato che l’acarbose riduce il fabbisogno insulinico nei paziente affetti da diabete mellito tipo 1.
Tuttavia non è stato dimostrato nessun effetto significativo per sui livelli di HbA1c (95-103). Per esempio, in uno studio multicentrico, in doppio cieco, randomizzato, controllato con placebo, 6 settimane di run-in, 121 pazienti sono stati randomizzati ad acarbose o placebo associati ad un’alimentazione a contenuto diverso di fibre. Alla fine delle 24 settimane di trattamento, l'analisi ha dimostrato che l'acarbose, rispetto al placebo, ha ridotto livelli di glucosio plasmatico 2 ore dopo il pasto (12,23 ± 0,83 vs 14,93 ± 0,87 mmol / l, P <0.02) anche se non sono emersi effetti significativi sui livelli di HbA1c e sul numero di ipoglicemie. Relativamente agli eventuali effetti collaterali, i dati raccolti da studi clinici mostrano che l’acarbose ha, generalmente, un buon profilo di sicurezza (95-103). Ad esempio, in uno degli studi clinici, l'incidenza di eventi avversi sono stati 75%, nel gruppo acarbose, e 39%, in quello con placebo; inoltre gli eventi avversi sono risultati lievi e limitati al tratto gastrointestinale (98). In un altro studio clinico, gli eventi avversi più frequenti riportati sono stati: flatulenza (43%), diarrea (27%) e dolore addominale (11%) (99).
32
Pramlintide (analogo della Amilina)
L’Amilina è un ormone co-prodotto dalle cellule beta pancreatiche insieme all’insulina. Essendo queste cellule completamente distrutte nel diabete mellito tipo 1 anche la secrezione dell’amilina, come succede per l’insulina, è assente. Da pochi anni, pertanto, in USA (non ancora in Europa), è in commercio un analogo dell’amilina (pramlintide) già utilizzata in diversi trials.
Nel 2010, Lee et al. hanno condotto una revisione sistematica della letteratura volta a valutare la sicurezza e l'efficacia della pramlintide nel trattamento del diabete tipo 1 (104). Tre studi randomizzati hanno confrontato pramlintide verso placebo. In uno studio in cui la pramlintide è stata utilizzata in aggiunta alla terapia insulinica intensiva, non sono emerse, rispetto al placebo, differenze significative nella riduzione dei livelli di HbA1c (105). Gli altri due studi, invece, hanno mostrato un miglioramento significativo dei livelli di HbA1c con pramlintide rispetto al placebo sia a 26 che a 52 settimane, di 0,2% e 0,3%, rispettivamente (106,107).
Gli eventi avversi più comunemente riportati sono stati: nausea da lieve a moderata, vomito, anoressia oppure riduzione dell’appetito. Inoltre, durante trattamento con pramlintide, rispetto al placebo, sono emerse, molto più frequentemente, episodi di ipoglicemia severa, più spesso durante le prime 4 settimane di trattamento (105-107). Successivamente, quando veniva adeguato il dosaggio della pramlintide, il numero di ipoglicemie era uguale nei due gruppi.
In uno di questi studi, utilizzando un questionario elaborato appositamente, è stato valutato il grado di soddisfazione al trattamento che è risultato significativamente maggiore per il trattamento con pramlintide rispetto al placebo in 12 dei 14 pazienti (108).
33
TERAPIA INCRETINICA
Il termine “incretine” è stato coniato nel primo ventennio del secolo scorso per identificare i potenziali fattori con cui l’intestino partecipa alla regolazione della secrezione insulinica. Nel 1960 fu possibile dosare l’insulina nel plasma e dimostrare che il tratto intestinale riveste un ruolo importante nel controllo della secrezione endocrina pancreatica. Gli studi clinici mostrarono, infatti, che, confrontando un carico endovenoso e orale di glucosio, caratterizzati dallo stesso profilo glicemico, la risposta secretoria insulinica era maggiore se il glucosio era somministrato per via orale (Figura 6) (109). Tale fenomeno fu definito effetto incretinico e fu stabilito che il 50-70% della quantità totale di insulina secreta in risposta all’ingestione di glucosio dipende direttamente da tale fenomeno.
Figura 6: Effetto incretinico in soggetti con normale tolleranza al glucosio.
34
Le incretine sono ormoni secreti dal tratto gastrointestinale nella circolazione sistemica per stimolare la secrezione insulinica glucosio-dipendente in risposta all’ingestione di nutrienti. Il primo ormone incretinico fu isolato dall’intestino tenue del maiale e definito “Gastric Inhibitory Polipeptide” (GIP) per la sua proprietà di inibire la secrezione acida gastrica. Successivamente fu scoperto che il GIP è in grado di stimolare la secrezione insulinica sia nel modello animale che nell’uomo e per tale motivo fu nuovamente definito “Glucose-dipendent Insulinotropic Polipeptide” mantenendo l’acronimo GIP (110). In studi successivi emerse che una volta neutralizzata l’attività endogena del GIP si assisteva all’attenuazione piuttosto che all’abolizione dell’effetto incretinico (111). La spiegazione fu trovata con la scoperta di un altro ormone incretinico, il Glucagon-like Peptide-1 (GLP-1), contibuendo così ad ampliare le nostre conoscenze relative alla fisiologia del sistema incretinico e della fisiopatologia del diabete. Il GLP-1 potenzia la secrezione insulinica glucosio-dipendente ed è responsabile della maggior parte dell’effetto incretinico in risposta all’ingestione di nutrienti. Recentemente, sono stati identificati altri agenti con attività incretino-simile: ormoni, nutrienti, acidi biliari e alcuni lipidi sono secreti dopo ingestione di nutrienti, attivano specifici recettori sulla β-cellula e stimolano, spesso solo debolmente, la secrezione insulinica glucosio-dipendente.
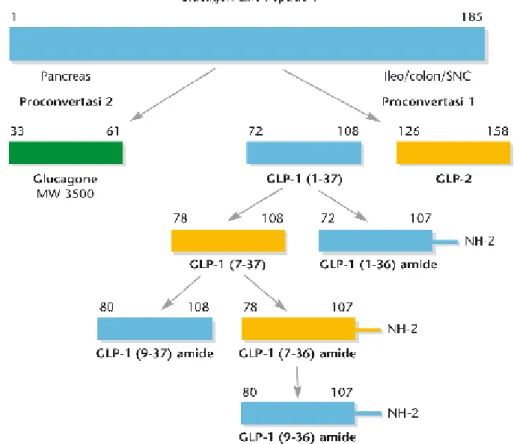
Il gene del GIP è espresso principalmente nelle cellule entero-cromaffini, definite anche cellule K, della porzione prossimale dell’intesrtino tenue. Il gene del pro-glucagone è invece espresso in cellule entero-cromaffini, dette anche cellule L, presenti nell’intestino tenue e nel colon, in cui l’attività di una pro-convertasi è responsabile della produzione di GLP-1(112). Il GIP è un polipeptide di 42 aminoacidi e peso molecolare pari a 49kDa, mentre il GLP-1 è prodotto
35
sotto forma di peptide inattivo composto da trentasette aminoacidi con un peptide C-terminale contenente glicina e peso molecolare pari a 32kDa. La forma attiva di GLP-1 deriva del clivaggio post-traslazionale di sei aminoacidi dalla porzione N-terminale in posizione 1-37, la forma tronca risultante (GLP-1 7-37) e quella amidica a livello della glicina nella porzione N-terminale (GLP-1 7-36 amide), rappresentano le forme principali di GLP-1 circolante. Entrambe le forme attive presentano attività insulinotropica (Figura 7) (112).
Figura 7: Processi di clivaggio del proglucagone e sintesi di GLP-1
I recettori del GIP sono espressi in molte tipologie cellulari, sopratutto a livello della β-cellula e dell’α-cellula pancreatica, stomaco, tessuto adiposo e Sistema Nervoso Centrale (SNC). I recettori del GLP-1, oltre ad essere espressi in α- e β-cellula pancreatica, sono ampliamente
36
espressi nelle cellule parietali dello stomaco, piloro, e analogamente al GIP, a livello dell’SNC (112).
La secrezione delle incretine ha un andamento circandiano e le concentrazioni aumentano rapidamente, in circa 15 minuti, con l’ingestione di un pasto e raggiungono approssimativamente 200 pmol/L per il GIP e circa 50 pmol/L per il GLP-1. Normalmente queste concentrazioni si mantengono per 30-40 minuti per poi ritornare ai valori basali in 2-3 ore (113). Inoltre, GIP e GLP-1 sono caratterizzati da una breve emivita (3-5 minuti) a causa delle rapida inattivazione da parte di proteasi, soprattutto DiPeptidil-Peptidasi-4 (DPP-4) e altre endopeptidasi (114). L’enzima DPP-4 è un enzima ubiquitario, appartenente alla famiglia della serina-proteasi, espresso sulla superficie cellulare ma presente anche nel sangue circolante e, oltre a GIP e GLP-1, riconosce numerosi substrati. L’inattivazione delle incretine da parte di DPP-4 è mediata dal clivaggio di due aminoacidi N-terminali che portano alla formazione della forma inattiva di GIP (3-42) e GLP-1 (9-36 amide), inoltre, entrambe le forme agiscono da antagonisti sui rispettivi recettori. Affinchè il GIP e soprattuto il GLP-1 stimolino la secrezione insulinica, è necessaria l’ingestione di carboidrati perchè, a differenza di quanto accade con proteine e acidi grassi, solo in questo caso si ha un aumento delle concentrazioni circolanti di glucosio necessarie per la risposta β-cellulare. Nel caso dell’ingestione di proteine e acidi grassi si ha secrezione di GLP-1 e GIP ma non di insulina.
La capacità delle cellule L di rispondere al glucosio è dovuta all’espressione e all’attivazione di specifici recettori definiti “Test Receptors” (T1R2 e T1R3). Questi recettori sono associati a una proteina G, detta gustoducina, si attivano in presenza di glucosio nel lume intestinale e modulano la secrezione di GLP-1. Il Sodium-dependent Glucose coTrasporter isoform 1 (SGLT1), trasportatore presente nelle
37
cellule intestinali e deputato al trasporto di glucosio dal lume intestinale al lume vascolare, interviene nei processi assorbitivi intestinali e la sua attivazione è controllata dal recettore T1R3-gustoducina (115,116). Anche altre sostanze, come per esempio gli acidi grassi, stimolano sia la secrezione insulinica che di GLP-1, mediante un meccanismo specificamente enterale dopo somministrazione per via orale (117,118). Il metabolismo intestinale e post-assorbitivo degli acidi grassi rappresenta uno dei più importanti fattori, direttamente ed indirettamente, di regolazione della secrezione di incretine nell’uomo. La secrezione di GLP-1 è influenzata anche dagli acidi biliari che agiscono sulle cellule L mediante il recettore T1R5. L’attivazione di questi recettori comporta la stimolazione della secrezione di GLP-1 cAMP-dipendente ed il miglioramento della tolleranza glicemica nel modello animale di diabete mellito tipo 2 (119,120). In fine altre molecole come alcuni aminoacidi, ormoni e citochine, in particolare la glutammica (121,122), l’insulina (123) e la IL6 (124) rispettivamente, sono fattori efficaci nel potenziare la secrezione di GLP-1 nelle cellule enteroendocrine.
Effetti pancreatici del Glucagone-like Peptide-1 (GLP-1)
Il GLP-1 si distingue per le modulazione della funzione e massa β-cellulare. Durante il digiuno le concentrazioni plasmatiche di GLP-1 attivo sono ai limiti della dosabilità. Acutamente il GLP-1 stimola la secrezione insulinica glucosio dipendente, seguita dal potenziamento della trascrizione del gene dell’insulina e della biosintesi ormonale (125). Questi effetti risultano mediati dall’attivazione dell’adenilato-ciclasi e dall’aumento dei livelli intracellulari di cAMP. Sebbene l’esatto meccanismo molecolare con cui il GLP-1 agisce sulla β-cellula sia
38
ancora sconosciuto, la modalità con cui stimola la secrezione insulinica dipende dalla combinazione di effetti a più livelli (126) che coinvolgono il cAMP, il trasportatore di glucosio (127), i canali del potassio (128,129) e del calcio (130), così come le protein-chinasi cAMP-dipendenti e l’esocitosi dei granuli secretori contenenti insulina (131,132) (Figura 8).
Figura 8: Regolazione della secrezione insulinica glucosio-dipendente
La più importante proprietà fisiologica del GLP-1 in combinazione agli effetti del GIP è quella di promuovere la secrezione insulinica e regolare l’omeostasi del glucosio senza provocare ipoglicemie (133-134).
Tra i vari effetti del GLP-1 ci sono anche quelli trofici e protettivi sulla β-cellula. Il GLP-1 è in grado di stimolare la proliferazione e la neogenesi di β-cellule dalle cellule duttali sia nell’animale che nell’uomo (135). L’effetto stimolatorio di GLP-1 sulla β-cellula si associa
39
all’effetto anti-apoptotico che è possibile osservare anche in colture di isole umane sottoposte a glico-, lipo- e glucolipotossicità. Entrambi, l’effetto proliferativo ed anti-apoptotico, sono mediati dall’attivazione della protein-chinasi B (PKB) (136). Il GLP-1 modula il funzionamento anche del reticolo endoplasmatico della β-cellula, sottoposto a cosiddetto stress durante iperglicemia cronica. La compromissione del reticolo endoplasmatico è parte attiva nei processi molecolari che conducono alla disfunzione β-cellulare e all’apoptosi, il GLP-1 riduce i marcatori di stress del reticolo endoplasmatico (137) migliorando anche la sopravvivenza della β-cellula. Nell’uomo sebbene le proprietà trofiche ed anti-apoptotiche di GLP-1 in vivo siano ancora tutte da dimostrare, gli effetti in vitro fanno ben sperare che l’azione farmacologia sul sistema incretinico mediante gli analoghi o l’inibizione dell’enzima DPP-4 possa preservare la massa funzionale β-cellulare nel diabete.
Oltre gli effetti sulla β-cellula, il GLP-1 è in grado di sopprimere la secrezione di glucagone da parte delle α-cellule. Molto probabilmente l’effetto inibitorio è indirettamente causato dalla stimolazione della secrezione di insulina e somatostatina con conseguente regolazione paracrina della secrezione del glucagone. La modulazione del rapporto insulina/glucagone è responsabile, almeno in parte, della riduzione dell’insulino-resistenza sia nel fegato che nei tessuti periferici (138). D’altra parte un effetto diretto di GLP-1 non può essere completamente escluso dal momento che le cellule α-pancreatiche esprimono il recettore per il GLP-1 (131). Inoltre, poiché la soppressione della secrezione di glucagone è glucosio-dipendente, la risposta contro-regolatoria necessaria per la prevenzione dell’ipoglicemia non risulta compromessa (134). Inoltre il recettore del GLP-1 è espresso anche sulle cellule δ-pancreatiche e l’attivazione di esso comporta il rilascio di somatostatina (139).
40
La partecipazione di tutte le componenti endocrine dell’isola pancreatica in risposta al GLP-1 suggerisce che il bilanciamento dell’omeostasi glicemica è il risultato di una complessa interazione tra tutti gli ormoni capaci di modificare direttamente o indirettamente la glicemia.
Effetti extra-pancreatici del Glucagone-like Peptide-1 (GLP-1)
Il GLP-1 esercita effetti inibitori sulla secrezione e sulla motilità gastrica, in particolare rallenta lo svuotamento gastrico (130). La somministrazione di GLP-1 a dosi fisiologiche in soggetti normo-tolleranti riduce lo svuotamento gastrico in modo dose-dipendente e riduce l’assorbimento di glucosio che rappresenta uno dei principali fattori coinvolti nella riduzione della glicemia post-prandiale (130). Questi effetti suggeriscono che il GLP-1 partecipa al cosidetto “ileal brake”, fenomeno con cui i nutrienti presenti nella parte distale dell’intestino tenue riducono la secrezione e la motilità delle porzioni prossimali. I meccanismi alla base degli effetti di GLP-1 sulla motilità e sulla secrezione intestinale sono mediati dal sistema nervoso centrale e periferico, soprattutto mediante l’attivazione del nervo vago. Il ruolo fisiologico di GLP-1 è, quindi, quello di regolare la capacità assorbitiva del glucosio, a livello intestinale, e la quantità di chimo, modulando la motilità e la secrezione intestinale di enzimi digestivi. In condizioni fisiologiche l’azione gastrointestinale di GLP-1 riveste probabilmente un ruolo più importante rispetto all’azione insulinotropica (130).
In aggiunta il GLP-1 riduce l’introito calorico e aumenta il senso di sazietà mediante l’azione diretta sul sistema nervoso centrale e periferico. In soggetti normo-tolleranti la somministrazione endovenosa di GLP-1 a dosi sovra-fisiologiche aumenta il senso di sazietà e riduce
41
l’introito calorico (140). Il meccanismo con cui il GLP-1 modula il senso di sazietà non è ancora completamente chiaro ma probabilmente esercita un ruolo nell’attivazione delle fibre afferenti vagali che a loro volta interagiscono direttamente con il SNC. Questa ipotesi è supportata dall’evenienza secondo cui i neuroni contenenti GLP-1 nel nucleo del tratto solitario hanno connessioni neuro-trasmettitoriali con le regioni talamiche ed ipotalamiche coinvolte nella regolazione dell’introito di alimenti. Un’altra possibilità riguarda l’azione centrale del GLP-1 su specifici recettori espressi da aree cerebrali come l’area postrema e l’organo subfornicale che tipicamente non presentano barriera emato-encefalica e sono, a volte, in diretta connessione con le aree cerebrali coinvolte nel controllo dell’omeostasi dei nutrienti. Infine, il rallentamento dello svuotamento gastrico partecipa alla genesi della sensazione di sazietà partecipando indirettamente alla regolazione dell’introito calorico.
Per quando riguardo gli effetti del GLP-1 sul metabolismo epatico,
in vitro, l’esposizione degli epatociti al GLP-1 si associa o inibizione
della glicogenolisi glucagone-dipendente senza agire in competizione con il glucagone sullo stesso recettore (141). Sebbene nell’uomo gli epatociti non esprimono il recettore di GLP-1, l’esposizione agli analoghi del GLP-1 si associa ad attivazione di una serie di cascate molecolari che si traducono in aumento delle trascrizione di una serie di fattori e proteine associati alla proliferazione e all’espressione del gene dell’insulina (142).
I recettori del GLP-1 sono ampiamente espressi nel cuore e nei vasi, in particolare nelle cellule muscolari lisce, cardiomiociti, endocardio e cellule endoteliali muscolari e cardiache (143,144). L’attivazione del recettore del GLP-1 è in grado di esercitare un’ampia gamma di effetti sul sistema cardiovascolare modulando frequenza