Indice
Introduzione
pag. 3Parte I
Riattivazione e riacutizzazione dell’infezione da HBV nel paziente
immunocompromesso: rilevanza clinica del problema e gestione del
paziente.
Epidemiologia dell’infezione da HBV pag. 8 HBV: struttura virale e ciclo replicativo pag. 13
Patogenesi dell’infezione da HBV pag. 18
Storia naturale dell’infezione da HBV pag. 21 Fisiopatologia delle riacutizzazioni e riattivazioni dell’infezione
da HBV pag. 27
Linee guida per la profilassi e terapia dell’infezione da HBV
nel paziente immunocompromesso pag. 39
Parte II
Riattivazione dell’epatite B occulta nel paziente oncoematologico
sottoposto a chemioterapia: casi clinici.
Caso clinico I pag. 49
Caso clinico II pag. 51
Caso clinico III pag. 55
Caso clinico IV pag. 57
Caso clinico VI pag. 61
Caso clinico VII pag. 63
Conclusioni
pag. 66Bibliografia pag. 71
Introduzione
Il virus dell’epatite B (HBV), anche dopo l’introduzione di un vaccino efficace nel prevenire l’infezione, continua a rappresentare su scala mondiale un problema di sanità pubblica rilevante.
Nei paesi poveri del mondo dove l’infezione risulta spesso endemica (con prevalenza di infezione cronica > 8% nella popolazione generale) le politiche di prevenzione dell’infezione, in particolare i programmi vaccinali a tutti i nuovi nati ed il ricorso alla profilassi passiva ed attiva nei neonati da madri HBsAg positive, risultano spesso deficitarie.
In queste realtà l’infezione da HBV, frequentemente trasmessa per via verticale, continua a rappresentare una delle principali cause di morte a causa delle ben note complicanze dell’infezione cronica (cirrosi ed epatocarcinoma).
Nei paesi sviluppati dove sono state adottate efficaci politiche vaccinali l’incidenza di nuove infezioni si è nettamente ridotta in particolare tra i giovani mentre permane il problema delle persone che hanno già acquisito l’infezione da HBV nel corso della loro esistenza.
Tra coloro che risultano portatori di HBsAg un 20-40% potrà sviluppare cirrosi ed epatocarcinoma sebbene la maggior parte dei pazienti con infezione cronica HBV-correlata non svilupperà mai particolari complicanze legate all’infezione. In questo contesto si inserisce l’opportunità di modificare la storia naturale dell’infezione offerta dalle terapie antivirali sia a base di interferone che di analoghi nucleos(t)idici vecchi e nuovi.
Una problematica emersa con forza negli ultimi anni riguarda poi la possibilità che varie condizioni di immunocompromissione fungano da fattore predisponente per riacutizzazioni di infezioni croniche in atto (attive od inattive) o per riattivazioni di infezioni occulte presenti allo stato latente.
In effetti è ormai definitivamente chiarito che il concetto di “guarigione” nel caso dell’infezione da HBV, come per molti altri microrganismi persistenti, è un
concetto relativo all’efficienza dei meccanismi di difesa nei confronti dell’infezione messi in atto del sistema immunitario dell’ospite.
Sebbene nelle infezioni acute la guarigione clinica, biochimica e sierologica siano molto frequenti così come risultano possibili anche nel corso delle infezioni croniche, la completa “clearance” del virus dall’organismo a livello molecolare probabilmente non viene mai raggiunta.
È in effetti dimostrata la persistenza del genoma virale in forma episomale (cccDNA) all’interno degli epatociti probabilmente per tutta la vita dell’individuo infettato.
Come avviene per altre infezioni latenti la mancata espressione dell’agente infettivo, ed in questo caso la sua permanenza a livello del nucleo degli epatociti in forma episomale fortemente repressa, viene raggiunta mediante un’efficace sorveglianza condotta dal sistema immunitario ed in particolare dalla sua branca cellulo-mediata.
L’equilibrio che si viene a creare tra persistenza dell’agente infettivo in forma repressa e controllo dell’infezione da parte di un’efficiente risposta immunitaria acquisita è tuttavia soggetto a possibili alterazioni.
In particolare il sempre più frequente ricorso a potenti terapie immunosoppressive che rappresentano strumenti terapeutici fondamentali in ambito onco-ematologico, trapiantologico, reumatologico ed in altri settori della medicina, si sta rivelando un fattore importante nella riduzione delle capacità di controllo del sistema immunitario nei confronti di numerose infezioni latenti con conseguenti possibili riattivazioni (spesso ad evoluzione grave dato il quadro di generale compromissione dell’ospite).
L’infezione da HBV da questo punto di vista non fa eccezione e già negli anni ’70, poco dopo la sua scoperta, venivano segnalate sporadiche riattivazioni dell’infezione in pazienti farmacologicamente immunocompromessi il cui profilo sierologico originale indicava soltanto contatto pregresso e risolto con il virus.
Negli ultimi anni in parte per il sempre più frequente ricorso a terapie immunosoppressive in vari ambiti della medicina ed in parte per la crescente attenzione verso il problema, con maggior comprensione degli intimi meccanismi fisiopatologici che stanno alla base dell’infezione da HBV ed alla sua persistenza nell’organismo ospite, vi è stata una continua espansione di evidenze ed esperienze in ambito di riacutizzazioni di infezioni croniche (attive o inattive) e di riattivazioni di infezioni occulte da HBV nel paziente immunocompromesso.
Se da un lato la recente introduzione in vari ambiti della terapia medica di farmaci biologici a forte azione immunosoppressiva (in particolare rituximab, alemtuzumab ed in misura minore altri anticorpi monoclonali come infliximab) ha ulteriormente amplificato il problema della riattivazione dell’epatite da HBV nell’ospite immunocompromesso, dall’altro la disponibilità di farmaci, in particolare gli analoghi nucleos(t)idici, spesso efficaci nel prevenire riacutizzazioni e riattivazioni dell’infezione, ha posto le basi per una razionale gestione clinica del paziente immunocompromesso o candidato a terapia immunosoppressiva con infezione cronica da HBV o “markers” di infezione occulta.
Sono in effetti oggi disponibili numerose raccomandazioni e linee guida sempre più omogenee che consentono di gestire correttamente il paziente immunocompromesso portatore attivo, inattivo od occulto di infezione da HBV mediante misure di follow-up, profilassi o terapia.
Sebbene il rischio di riattivazione dell’infezione da HBV nel singolo caso di trattamento immunosoppressivo, nella singola patologia e nel singolo paziente sia di difficile valutazione, l’attuazione su larga scala delle linee guida per la profilassi e la terapia dell’infezione da HBV nel paziente immunocompromesso e lo screening di tutti i pazienti immunocompromessi o candidati a trattamento immunosoppressivo per infezione conclamata od occulta da HBV, contribuiranno certamente a ridurre la mortalità e i danni legati alla
riattivazione/riacutizzazione dell’infezione da HBV in pazienti spesso già profondamente provati sia fisicamente che psicologicamente dalla patologia di base.
Parte I
Riattivazione e riacutizzazione dell’infezione da HBV nel paziente
immunocompromesso: rilevanza clinica del problema e gestione
del paziente.
Epidemiologia dell’infezione da HBV
L’infezione da virus dell’epatite B (HBV) è una delle più diffuse patologie infettive. Circa 2 milioni di persone nel mondo sono state infettate in una fase della loro vita da HBV.
Si stima che vi siano circa 350 milioni di portatori di HBsAg su scala mondiale, la maggior parte dei quali vive in Asia ed Africa sub-Sahariana dove le complicazioni associate all’epatopatia cronica ed il tumore del fegato sono tra i più importanti problemi di salute.
Globalmente da 600 mila ad 1 milione di persone muoiono annualmente per complicazioni correlate all’infezione da HBV (1)(2).
Su scala planetaria si distinguono tre aree a differente prevalenza di infezione determinate in base a studi di prevalenza di marcatori sierici di infezione cronica:
-Bassa prevalenza (<2%): Australia e Nuova Zelanda, Nord America, Europa Occidentale.
-Media prevalenza (2-8%): Centro e Sud America, Medio Oriente, Asia Centrale, Giappone, alcuni paesi dell’area mediterranea.
-Alta prevalenza (≥8%): Sud-Est Asiatico, Cina, Africa subsahariana (fig.1) L’Italia viene attualmente classificata tra le aree a bassa prevalenza essendo presenti nella popolazione generale circa 900.000 portatori cronici di HBsAg (1.5% circa della popolazione totale).
Vi è inoltre una quota non facilmente stimabile, ma dell’ordine di alcuni milioni di soggetti, con “markers” di pregressa infezione da HBV (positività almeno dell’anticorpo anti-HBc) (3).
In generale tanto più alta risulta la prevalenza di infezione cronica in una determinata area quanto più precocemente nella vita viene acquisita l’infezione.
Tanto più precocemente nella vita l’infezione viene acquisita quanto maggiore risulta la possibilità della sua evoluzione cronica (90% per le infezioni perinatali, 5% negli adulti).
Fig.1 Prevalenza nella popolazione mondiale dell’HBsAg (fonte CDC 2007)
In seguito all’introduzione della vaccinazione nei paesi più sviluppati ed in particolare in quelli che hanno reso la vaccinazione obbligatoria, l’incidenza delle nuove infezioni si è nettamente ridotta.
In Italia la vaccinazione obbligatoria per l’epatite B è stata introdotta nel 1991, prima di questa data erano segnalati circa 3.500 nuovi casi di epatite B all’anno ed il tasso medio di prevalenza dei portatori cronici di HBsAg nella popolazione italiana era del 2%, con punte del 6% in alcune regioni e in alcune aree metropolitane.
Dopo l’introduzione della vaccinazione obbligatoria l’incidenza della malattia si è notevolmente ridotta, con una diminuzione del 62% dal 1987 al 2002.
La riduzione è stata particolarmente marcata nei bambini fino a 14 anni, dove si è passati da 356 casi nel 1987 a 29 casi nel 2002 con una riduzione del 91% (fig.2).
Fig. 2 Casi di epatite acuta B in Italia 1987-2002 (fonte: Centro Nazionale Epidemiologia ISS)
Nonostante che in seguito all’attuazione di programmi di vaccinazione l’incidenza di infezione da HBV sia in riduzione nella maggior parte dei paesi, le complicazioni correlate all’infezione da HBV e le morti conseguenti continuano a presentare una continua crescita.
Questo può essere dovuto ad un ritardo dell’impatto della vaccinazione sulle complicanze dell’infezione ed a un miglioramento della diagnostica sia nel riconoscimento delle infezioni da HBV che delle relative complicazioni.
Si distinguono due principali modalità di trasmissione dell’infezione da HBV: orizzontale e verticale.
Appartengono alla prima modalità la via sessuale e la via percutanea (in particolare tossicodipendenti per via endovenosa e personale sanitario), più rara risulta la trasmissione attraverso trasfusioni e trapianti di organo.
Appartiene alla seconda modalità la via perinatale (acquisizione dell’infezione “in utero”, durante il parto o nel periodo post-natale).
Nei paesi a bassa prevalenza le modalità principali di acquisizione dell’infezione risultano essere i rapporti sessuali non protetti e l’utilizzo di stupefacenti per via endovenosa con scambio di siringhe, nei paesi ad elevata prevalenza la principale modalità di acquisizione dell’infezione risulta essere la trasmissione materno-infantile seguita dalla via sessuale (4).
Per ciò che riguarda la via verticale di trasmissione un neonato presenta in generale dal 10% al 90% di probabilità di infettarsi alla nascita se la madre presenta un’infezione cronica da HBV (5). La probabilità di trasmissione dell’infezione da madre a figlio risulta molto alta (~90%) in particolare se la madre presenta positività per HBsAg ed HBeAg risultando in attiva replicazione virale (nei paesi ad elevata prevalenza si stima che circa il 20-40% delle madri HBsAg positive siano anche HBeAg positive).
La trasmissione dell’infezione avviene in particolare durante l’espletamento del parto mentre la trasmissione “in utero” risulta infrequente (meno del 2% di tutte le infezioni trasmesse dalla madre al figlio).
Non ci sono inoltre chiare evidenze che il virus dell’epatite B possa essere trasmesso con l’allattamento al seno.
L’elevata efficacia della somministrazione di immunoglobuline specifiche (HBIG) e della vaccinazione alla nascita nel prevenire l’infezione del neonato (95% circa di efficacia) conferma il fatto che la grande maggioranza delle infezioni avviene al momento del parto piuttosto che nel periodo prenatale. Sebbene sia dimostrato che tanto maggiore risulta essere la viremia nella madre quanto più elevata sia la probabilità di infezione del nascituro, non è chiaro se il trattamento della madre con analoghi nucleos(t)idici conferisca un’ulteriore protezione rispetto all’immunizzazione attiva-passiva del neonato.
Non esistendo a tale proposito chiare linee guida è possibile prendere in considerazione il trattamento con analoghi nucleos(t)idici della gestante in casi
di viremia particolarmente elevata, ed in questo caso il farmaco più appropriato sembra essere lamivudina.
L’utilizzo di telbivudina può essere considerato un’alternativa mentre l’utilizzo di adefovir, entecavir e tenofovir viene sconsigliato in gravidanza.
Non vi sono ad oggi evidenze che il parto cesareo riduca il rischio di trasmissione dell’infezione da HBV al neonato rispetto al parto naturale, a differenza di ciò che avviene con l’infezione da HIV (6).
HBV: struttura virale e ciclo replicativo
Il virus dell’epatite B (HBV) appartiene alla famiglia Hepadnaviridae che include numerose specie virali degli uccelli e dei mammiferi con organizzazione genomica, organo-tropismo e strategie replicative simili.
Il virione è una particella di 42 nm di diametro rivestita da un pericapside di natura glicolipoproteica contenente l’HBsAg (4)(6)(7).
Il capside a simmetria isometrica di 27 nm contiene il genoma, una DNA-polimerasi virale (che presenta attività di trascrittasi inversa) ed una protein-chinasi.
Oltre alla classica particella di Dane di 42 nm di diametro nel siero dei pazienti infetti si ritrovano anche particelle sferiche di 22 nm e strutture tubulari entrambe non infettanti costituite prevalentemente da HBsAg (da eccesso di produzione).
Il genoma di HBV è una molecola di DNA circolare parzialmente bicatenario (di 3.200 paia di basi) costituito da un filamento lungo L di senso negativo e da un filamento corto S incompleto di senso positivo di lunghezza variabile.
Il filamento S è incompleto per il 10-50% a seconda delle particelle virali.
Il filamento L non è continuo ma presenta un’incisione a livello del 5’ del filamento S dove presenta una struttura a forcina possibile sito d’origine della replicazione.
Qui il 5’ del filamento L lega una proteina che può partecipare all’innesco della sintesi del DNA virale.
Il filamento L contiene l’intera potenzialità codificante ed è costituito da 4 ORF (Open Reading Frames) che nella loro sequenza risultano parzialmente sovrapposte: gene S (con le regioni pre-S1 e pre-S2), gene P, gene C (con la regione pre-C), gene X.(fig.3) (8).
L’HBsAg classico presente sulla superficie del virione è l’espressione del gene S e viene definito proteina S o “small”.
Nel caso vengano tradotte anche la regione pre-S1 e pre-S2 si ottengono varianti proteiche di maggiori dimensioni la cui proporzione varia nelle differenti particelle virali e nelle diverse fasi dell’infezione.
Fig.3 HBV: organizzazione del genoma
In definitiva l’espressione della sola regione S porta alla sintesi della proteina S “small” (24kD), l’espressione della regione pre-S1 + pre-S2 + S determina la sintesi della proteina L “large” (39kD) e l’espressione della regione pre-S2 + S determina la sintesi della proteina M “medium” (31kD).
La proteina S è quella maggiormente espressa sulla superficie delle particelle virali mentre le proteine L ed M sono espresse in quantità minore rappresentando rispettivamente il 5-15% e 1-2% del totale.
L’espressione della regione pre-S sembra essere comunque fondamentale nell’evocare risposte immuni efficienti.
In effetti la risposta immune all’HBsAg è maggiore quando questo è costituito anche dalla proteina grande (L) e media (M) (che vengono incluse pertanto nei vaccini ricombinanti).
La proteina L svolgerebbe un ruolo centrale nell’assemblaggio virale e sembra svolgere un ruolo fondamentale nel mediare il legame della particella virale ai recettori cellulari epatocitari garantendone l’infettività (molti studi sottolineano il ruolo della regione pre-S1 per il legame a recettori cellulari e l’inizio dell’infezione).
Il gene C codifica per la proteina del capside costituente l’HBcAg, mentre la regione pre-C codifica per una proteina che viene scissa dalla proteina capsidica e prendendo la via del corpo di Golgi e delle vescicole secretorie viene espulsa dalle cellule infettate per esocitosi costituendo l’HBeAg.
Il gene P codifica per la DNA-polimerasi virionica che agisce da trascrittasi inversa sull’RNA pregenomico durante il ciclo replicativo.
Il gene X codifica la proteina regolatoria X che agisce da attivatore di promotori del gene S e del gene C. Potrebbe agire inoltre nella cellula infetta da attivatore trascrizionale di geni critici implicati nella regolazione del ciclo replicativo svolgendo in tal modo un ruolo nello sviluppo di tumori epatici.
Una volta penetrata nel citoplasma la particella virale inizia un processo di scapsidamento e viene traslocata verso il nucleo mediante un segnale di localizzazione nucleare presente sulla proteina capsidica (fig. 4).
Il DNA virale entra nel nucleo utilizzando un recettore presente sulla membrana nucleare che funge da trasportatore e gli enzimi di riparazione del DNA presenti nella cellula completano la sintesi del filamento S generando una molecola completa di DNA bicatenario circolare chiusa covalentemente (cccDNA o “covalently closed circular DNA”).
Il cccDNA si ritrova nel nucleo come minicromosoma ed agisce come stampo per la trascrizione degli mRNA virali (9).
A questo livello la RNA-polimerasi II cellulare trascrive il filamento L generando due classi di molecole di RNA poliadenilate: RNA pregenomico ed RNA subgenomici.
L’RNA pregenomico (3.5 kb) funge da intermedio replicativo essendo successivamente sottoposto a trascrizione inversa da parte della DNA polimerasi virale. Contiene la potenzialità codificante per tutte le proteine virali rappresentando l’RNA messaggero per la sintesi della proteina capsidica (HBcAg) e dell’HBeAg nonché della DNA-polimerasi virionica.
Fig.4 Ciclo di replicazione di HBV
Gli RNA subgenomici rappresenano gli RNA messaggeri per la proteina maggiore, media e grande dell’HBsAg (molecole di 2.4 e 2.1 kb) ma anche per la proteina X (molecola da 0.7 kb).
Nei capsidi in via di assemblamento nel citoplasma vengono incorporate una molecola di RNA pregenomico e la DNA-polimerasi virale.
Quest’ultima attua la retrotrascrizione dell’RNA-pregenomico in una molecola di DNA monocatenario a polarità negativa (corrispondente ad un nuovo filamento L) degradando al contempo l’RNA mediante la propria attività ribonucleasica. Soltanto un frammento di 20 basi di RNA non viene degradato essendo utilizzato da innesco per la sintesi del filamento S attuata dalla stessa DNA-polimerasi virale.
Patogenesi dell’infezione da HBV
Il virus dell’epatite B non sembra svolgere attività citotossica diretta sulle cellule che infetta.
Questo fatto viene confermato dall’evidenza che molti pazienti che presentano un’infezione da HBV anche in fase replicativa possono tuttavia risultare del tutto asintomatici e presentare soltanto minimi segni di danno epatico agli accertamenti bioumorali.
L’ipotesi prevalente sulla genesi del danno epatico nel corso dell’infezione da HBV è che questo sia prevalentemente immunomediato con un’azione diretta degli effettori dell’immunità a livello epatocellulare ed in particolare sulle cellule infettate da HBV. Questa ipotesi risulta in accordo con l’evidenza che in molti pazienti in fase di immunotolleranza nei confronti dell’infezione, così come in molti pazienti immunodepressi, anche infezioni fortemente replicative determinino soltanto un modesto danno epatico (8).
I meccanismi immunitari che si attivano nell’infezione da HBV ed il loro ruolo nella patogenesi del danno epatico non sono tutti completamente chiariti.
Un ruolo fondamentale nel controllo dell’infezione, come avviene per altre infezioni virali o da microrganismi intracellulari, viene attribuito alla immunità cellulo-mediata sia nella branca mediata dall’interazione tra linfociti T CD4 - molecole MHC di classe II, che nella branca direttamente citotossica mediata dall’interazione tra linfociti T CD8 – molecole MHC di classe I (fig.5).
Diversi studi hanno in effetti sottolineato il fatto che una forte risposta cellulo-mediata all’infezione da HBV, ed in particolare la risposta citotossica dei linfociti T CD8 nei confronti degli epatociti infetti, sia il presupposto fondamentale per un’evoluzione favorevole dell’infezione acuta con guarigione clinica ed assenza di cronicizzazione (10)(11).
Nel corso dell’infezione una forte risposta immunitaria cellulo-mediata sia citotossica che “helper” si esplica nei confronti di numerosi antigeni virali
(proteina capsidica, proteine del pericapside, DNA polimerasi virale), tuttavia questa risposta appare di minore intensità nei pazienti che in seguito all’infezione acuta non riescono a raggiungere una “clearance” della viremia evolvendo verso la cronicizzazione del processo infettivo.
Fig.5 Risposta immunitaria acquisita cellulo-mediata all’infezione da HBV ( Fonte: NEJM. Hepatitis B Virus infection – Natural History and Clinical consequences).
Le risposte immunitarie umorali nell’infezione da HBV sono sempre intense nei confronti dei vari antigeni virali.
La produzione di anticorpi svolge un ruolo protettivo in particolare nei confronti del virus libero favorendone la neutralizzazione e la rimozione da parte del sistema monocito-macrofagico.
Gli anticorpi possono inoltre concorrere all’eliminazione delle cellule infette che espongano antigeni virali in superficie mediante i meccanismi di ADCC (citotossicità cellulare anticorpo-dipendente) e CDCC (citotossicità cellulare complemento-dipendente).
Sebbene la risposta anticorpale sia vigorosa nei confronti di tutti gli antigeni virali, anticorpi liberi verso l’HBsAg non sono riscontrabili né nelle forme acute né nelle forme croniche di infezione (portatore attivo o inattivo di HBsAg) perché l’eccesso di HBsAg prodotto dal virus determina la saturazione di tutti i siti di legame anticorpale (formazione di immunocomplessi) non consentendo la circolazione di anticorpi liberi.
Sebbene sia la branca citotossica (CD8) che helper (CD4, in particolate Th1) della risposta immunitaria acquisita contribuiscano al controllo dell’infezione ed alla “clearance” virale nelle infezioni acute ad evoluzione favorevole, diversi studi evidenziano che il danno citotossico diretto sugli epatociti mediato dai linfociti T CD8 ha dimensioni contenute e che il numero degli epatociti infetti direttamente uccisi dai linfociti citotossici è molto piccolo.
Questo suggerisce che gran parte del danno epatico, associato alla risposta immunitaria diretta verso l’infezione possa, essere determinato da altri mediatori dell’infiammazione rilasciati sia dai linfociti T CD8 che dai linfociti T CD4 e macrofagi da questi attivati.
Tra le molecole certamente coinvolte vi sono TNF-α, IL-1, radicali liberi, specie reattive dell’ossigeno e proteasi.
Alcune citochine come IFN-γ (rilasciato dai linfociti T CD4 attivati) e TNF-α (rilasciato dai macrofagi attivati) hanno inoltre dimostrato di possedere un effetto antivirale diretto sia sulle cellule già infettate che su quelle suscettibili di infezione che non prevede la loro distruzione favorendo invece il raggiungimento di uno stato di minor suscettibilità e permissività nei confronti dell’infezione virale.
Oltre alle popolazioni cellulari tipiche della risposta immunitaria secondaria anche elementi dell’immunità innata come le cellule NK (natural killer) possono in una certa misura contribuire a contrastare l’infezione contribuendo pertanto alla genesi, come effetto collaterale inevitabile della loro attività, di una certa quota del danno epatico (12).
Storia naturale dell’infezione da HBV
Le possibili manifestazioni cliniche dell’infezione da HBV sono numerose e si estrinsecano in due distinte forme di malattia: la forma acuta e la forma cronica (8) (13).
L’infezione acuta può decorrere del tutto asintomatica oppure manifestarsi come epatite acuta anitterica, itterica o fulminante.
L’infezione cronica può invece manifestarsi nello stato di portatore inattivo di HBsAg o in una epatite cronica di maggiore o minore gravità che può condurre nel corso degli anni a complicanze quali cirrosi ed epatocarcinoma (4)(6).
In seguito alla trasmissione il periodo di incubazione varia da 1 a 6 mesi.
Nel 70% dei casi al periodo di incubazione seguirà una forma subclinica o una modesta epatite anitterica mentre soltanto nel 30% dei casi si svilupperà una forma itterica franca.
Per ciò che riguarda le forme sintomatiche di malattia si può avere una fase prodromica caratterizzata da sintomi quali febbre, artralgie e rash cutaneo a cui segue dopo circa una settimana la fase di stato caratterizzata frequentemente da dolore o “fastidio” in ipocondrio destro, epigastralgia, nausea, vomito, a cui si aggiungono ittero cutaneo, mucoso e sclerale nelle forme itteriche.
L’incremento delle transaminasi può essere molto marcato, normalmente con ALT > AST, mentre la bilirubina può rimanere nell’intervallo di normalità (forme anitteriche) o raggiungere livelli molto elevati.
Nelle forme acute la normalizzazione delle transaminasi in genere si ottiene entro i sei mesi dall’esordio, mentre una persistenza di transaminasi elevate oltre i sei mesi indica una progressione verso la cronicizzazione del processo infettivo.
La possibilità di evoluzione cronica dell’infezione è legata soprattutto all’età in cui viene acquisita l’infezione. Tanto più precoce è l’età di acquisizione dell’infezione quanto maggiore risulta il rischio di cronicizzazione.
In effetti l’evoluzione cronica si realizza in meno del 5% degli adulti infettati, in oltre il 90% dei casi a trasmissione perinatale, nel 30-50% delle infezioni acquisite tra 1 e 5 anni di età.
Sebbene fino a pochi anni fa si ritenesse che la guarigione dall’epatite acuta B comportasse la “clearance” del virus dall’organismo è oggi evidente che anche nei pazienti che presentano viremia non rilevabile e presenza di anticorpi anti-HBs ed anti-HBc il virus può persistere a lungo all’interno degli epatociti con occasionali possibili rilevazioni di basse viremie plasmatiche.
In questi pazienti l’infezione viene mantenuta silente grazie all’efficienza dei meccanismi immunitari, tuttavia in condizioni di immunodepressione il virus può nuovamente andare incontro a riattivazione e replicazione.
Durante l’infezione acuta l’evoluzione verso una forma di insufficienza epatica fulminante avviene raramente (0.1-0.5% dei casi) ed i meccansmi immunopatologici che la favoriscono non sono chiari, sebbene l’assunzione concomitante di sostanze epatotossiche o la coinfezione con altri virus epatotropi possa giocare un ruolo favorente.
Si ritiene comunque che il processo di necrosi epatocitaria massiva sia prevalentemente immunomediato con distruzione degli epatociti infetti da parte del sistema immunitario (14).
Non vi sono attualmente indicazioni alla terapia antivirale specifica nell’epatite acuta da HBV, tuttavia l’utilizzo di analoghi nucleos(t)idici può essere preso in considerazione in alcune particolari situazioni cliniche: casi di epatite acuta B grave ed a decorso protratto, pazienti con coinfezione da altri virus epatotropi o con patologie epatiche sottostanti, pazienti immunodepressi, pazienti con epatite fulminante non candidabili a trapianto di fegato (6)(15).
L’evoluzione verso una forma cronica, come visto in precedenza, avviene in una minoranza dei soggetti adulti infettati e nella grande maggioranza dei neonati.
Sebbene l’evoluzione in cronicizzazione possa seguire un classico episodio di epatite acuta, la maggior parte delle persone con infezione cronica da HBV non presenta nella storia clinica episodi di epatite sintomatica.
In questi casi l’evoluzione dell’infezione verso la cronicizzazione ha avuto un decorso indolente.
La maggior parte delle persone con epatite cronica da HBV risulta asintomatica (tra i possibili sintomi da segnalare astenia e dispepsia).
I reperti clinici che accompagnano l’epatite cronica da HBV sono scarsi ed all’esame obiettivo può essere rilevata epatomegalia in assenza di altri reperti patologici di rilievo.
L’evoluzione verso un quadro di fibrosi franca sarà accompagnato dai reperti clinici tipici della cirrosi.
Dal punto di vista bioumorale l’epatite cronica da HBV si accompagna generalmente a lieve o moderato rialzo dei valori delle transaminasi (ALT>AST), con incremento più consistente durante gli episodi di riacutizzazione (ALT fino a 50 volte oltre il limite superiore del valore normale). L’alfa-fetoproteina correla con attività di malattia e rigenerazione epatocitaria incrementando anch’essa notevolmente durante le riacutizzazioni.
La storia naturale dell’epatite cronica da HBV è determinata dalla costante interazione tra risposta immunitaria dell’ospite e replica virale. Altri fattori, tra cui infezioni virali concomitanti (ad esempio HDV, HCV, HIV), assunzione di alcolici o aflatossine alimentari, possono inoltre inserirsi in questo delicato equilibrio giocando un ruolo nel favorire la più o meno rapida progressione verso la cirrosi e l’epatocarcinoma.
Vi sono due principali fasi viroimmunologiche che caratterizzano il decorso dell’epatite cronica da HBV: una fase altamente replicativa in cui è presente a livello sierico l’HBeAg ed una fase con scarsa replica virale in cui scompare l’HBeAg e compaiono gli anticorpi anti-HBe.
Nell’epatite cronica HBeAg positiva si rileva in genere una malattia epatica in fase attiva con elevati livelli sierici di transaminasi ed alta viremia.
Nell’epatite cronica HBeAg negativa si rileva invece scarsa replica virale con transaminasi lievemente alterate o nella norma.
I pazienti di questo gruppo che presentano viremia stabilmente non rilevabile con livelli normali di transaminasi pur in presenza di HBsAg a livello sierico vengono definiti portatori o “carrier” inattivi di HBsAg e non presentano generalmente segni di infiammazione o danno alla biopsia epatica.
Viceversa nei pazienti che presentano un’epatite cronica HBeAg negativa con livelli moderati di replica virale e livelli persistentemente alterati di transaminasi sono in genere presenti segni di infiammazione cronica alla biopsia epatica. L’attività di malattia può essere dovuta in questi casi sia al ceppo wild-type che a mutanti nella regione precore o core-promoter che non sono in grado di produrre l’HBeAg.
Lo “switch” tra fase altamente replicativa HBeAg positiva e fase non replicativa HBeAg negativa può avvenire spontaneamente nel decorso naturale dell’infezione oppure essere favorito dalla terapia con interferone o analoghi nucleos(t)idici.
Vi è anche la possibilità di una regressione da una fase scarsamente replicativa ad una altamente replicativa sia spontaneamente che in seguito ad immunodepressione (ad es. trattamenti chemioterapici).
Per ciò che riguarda l’epatite cronica da HBV acquisita nel periodo neonatale si distinguono generalmente tre fasi nella storia naturale della malattia (6): una fase di immunotolleranza, un fase di “clearance” o attivazione immune ed una fase tardiva non replicativa. La fase di immunotolleranza in genere dura 10-30 anni ed è caratterizzata da alta replica virale in presenza di HBeAg ed in assenza di significativo danno a livello epatico, come dimostrato dalla presenza di transaminasi nella norma ed assenza di significative alterazioni alla biopsia epatica.
L’esatto meccanismo che determina la presenza di tolleranza immunitaria nei confronti dell’infezione non è noto ma affonda le proprie radici nella precoce esposizione del sistema immunitario all’agente virale.
La progressione verso una fase di “clearance” immune con perdita dell’HBeAg, rara nei primi 10 anni, tende ad incrementare per frequenza nella seconda e terza decade di età ed è spesso accompagnata da riacutizzazioni dell’infezione (“flares”) con incremento notevole delle transaminasi e danno epatico immuno-mediato.
Pertanto durante la fase di “clearance” immune il paziente può rimanere del tutto asintomatico o sviluppare segni e sintomi tipici dell’epatite acuta.
Il titolo degli anticorpi anti-HBc IgM può incrementare (segno di danno epatico) così come l’alfa-fetoproteina ed il quadro clinico, se il paziente non risulta già noto come affetto da epatite cronica HBV-correlata, può essere confuso con quello di un’epatite acuta da HBV.
La “clearance” dell’HBeAg può non essere raggiunta al primo episodio di riacutizzazione, ed episodi ricorrenti di riacutizzazione (con transitoria scomparsa dal siero dell’HBV-DNA con o senza “clearance” dell’HBeAg) possono susseguirsi prima che la fase non replicativa tardiva sia raggiunta. Quest’ultima è generalmente caratterizzata dalla normalizzazione delle transaminasi, dalla clearance dell’HBV-DNA e dell’HBeAg con contemporanea comparsa degli anticorpi anti-HBe.
Soltanto una minoranza dei pazienti con epatite cronica da HBV, nel corso della storia naturale dell’infezione, raggiunge la “clearance” dell’HBsAg.
La “clearance” spontanea dell’HBsAg in assenza di terapia può essere raggiunta dopo un periodo più o meno prolungato di remissione sostenuta in portatore inattivo di HBsAg ed avviene con un’incidenza dello 0.7-2.4 % per anno come rilevato da studi con una durata del follow-up > 5 anni.
La “clearance” dell’HBsAg è più frequente nei soggetti di età più avanzata, con una più lunga storia di stato di portatore inattivo di HBsAg alle spalle, ed è più frequente in pazienti infetti da genotipo A o B rispetto ad altri genotipi (16). Il raggiungimento della scomparsa dell’HBsAg con eventuale sieroconversione anti-HBs è un risultato prognostico molto favorevole sebbene non escluda completamente la progressione verso le complicanze come l’epatocarcinoma. In effetti la scomparsa dell’HBsAg dal siero del paziente non corrisponde alla completa eradicazione del virus dall’organismo, potendo il suo DNA persistere all’interno degli epatociti in uno stato di quiescenza, sia in forma episomale (cccDNA) che integrato nel DNA cellulare, ed essendo occasionalmente rilevabili basse viremie plasmatiche.
Fisiopatologia delle riacutizzazioni e riattivazioni dell’infezione da
HBV
È ormai noto da molti anni che un’infezione da HBV acuta o cronica apparentemente “guarita” con scomparsa dell’HBsAg ed eventuale sieroconversione anti-HBs in condizioni di immunocompromissione possa riattivarsi e determinare un episodio di epatite acuta (4)(17).
In particolare negli ultimi anni la sempre più diffusa introduzione nella pratica clinica di potenti immunosoppressori ha enormemente amplificato la portata di questo problema, destando tra l’altro un forte interesse circa i meccanismi che conducono alla persistenza e latenza virale di HBV nel tessuto epatico ed alle modalità con cui la riattivazione virale può innescare nuovamente il danno epatocellulare.
Per ciò che riguarda la fase cronica di infezione da HBV si distinguono differenti categorie virologiche di pazienti (tabella 1). In particolare si distinguono portatori conclamati (HBsAg positivi) ed occulti (HBsAg negativi ed anti-HBc IgG postivi) (17)(18).
Tra i portatori conclamati vanno distinti i pazienti con replicazione virale attiva ed epatite cronica (ipertransaminasemia, carica virale ≥ 20.000 UI/ml in caso di HBeAg positività o carica virale ≥ 2.000 UI/ml in caso di HBeAg negatività), ed i pazienti con replicazione inattiva ed assenza di significativa epatopatia (transaminasi nella norma, HBeAg negatività, carica virale <2.000 UI/ml).
L’infezione occulta da HBV viene invece definita dalla presenza nel tessuto epatico del genoma di HBV in soggetti che risultano HBsAg negativi (19).
Nella maggior parte dei casi il portatore occulto non presenta viremia plasmatica determinabile, sebbene possano essere occasionalmente rilevate basse viremie (in genere inferiori a 200 UI/ml) ed esistano in letteratura numerose segnalazioni di trasmissione dell’infezione da parte di portatori occulti in ambito trasfusionale, trapiantologico, e materno-infantile (20).
Considerato che nel paziente con infezione occulta da HBV raramente si effettuano biopsie epatiche che consentirebbero di rilevare la presenza dell’HBV DNA nel tessuto epatico, la positività per anti-HBc IgG (in presenza o assenza di positività per anti-HBs) viene in genere considerato il “marker” sierico correlabile alla condizione di portatore occulto.
Tabella 1: categorie virologiche dei pazienti con infezione da HBV
(Fonte: Italian Association for the Study of the Liver. Prophylaxis and treatment of hepatitis B in immunocompromised patients →bibliografia).
Ne deriva che tutti i soggetti anti-HBc positivi che vanno incontro ad immunodepressione, in quanto possibili portatori occulti, sono da considerare a rischio di riattivazione.
Particolarmente importante risulta inoltre l’evidenza, emersa con forza negli ultimi anni, che sebbene l’infezione occulta da HBV sia frequentemente associata alla presenza di anticorpi circolanti specifici (in particolare anti-HBc ed in misura minore anti-HBs), possono esistere portatori occulti (stimati nell’ordine del 20%) che non presentano alcun marcatore sierico di infezione da HBV (18)(19).
Questi portatori probabilmente sono andati incontro nel corso del tempo ad una riduzione dei livelli anticorpali anti-HBc ed anti-HBs tale da non consentirne la
rilevazione con le comuni metodiche, tuttavia all’interno degli epatociti continuano ad albergare il cccDNA virale.
In base a queste considerazioni attualmente l’infezione occulta da HBV può pertanto essere distinta in sieropositiva (in presenza di anti-HBc con o senza anti-HBs) o sieronegativa (in presenza soltanto di HBV-DNA a livello del tessuto epatico con eventuali occasionali basse viremie plasmatiche) (21).
Nel tessuto epatico del portatore occulto di infezione da HBV è possibile rilevare mediante metodiche di biologia molecolare il DNA virale presente nella maggior parte dei casi in forma episomale di cccDNA (covalently closed circular DNA) che rappresenta un intermedio replicativo stabile (9).
Il genoma virale in questa forma presenta inalterate capacità di replicazione e trascrizione sebbene sia mantenuto in uno stato di latenza biologica dalla pressione dei meccanismi immunitari (immunosorveglianza).
La stabilità e la persistenza a lungo termine delle molecole di cccDNA all’interno del nucleo assieme alla lunga vita degli epatociti sono le caratteristiche che consentono all’infezione virale da HBV di persistere, per lo meno in forma latente, anche per tutta la vita.
Nell’infezione occulta si realizza tuttavia una forte inibizione della replica e dell’espressione genica virale a cui consegue la mancata sintesi ed immissione in circolo di HBsAg ma anche l’assenza di viremia quantificabile (possibile saltuaria presenza di minimi livelli di HBV-DNA a livello sierico).
Il “vero” portatore occulto va inoltre distinto dal “falso” portatore occulto che è in realtà un portatore conclamato di HBV con viremia determinabile (spesso con elevati livelli plasmatici) in cui non è possibile rilevare a livello sierico l’HBsAg per la presenza di mutazioni nel gene S che determinano la comparsa di varianti antigeniche dell’HBsAg non riconosciute dagli anticorpi dei tests commerciali (17)(19).
Per escludere la possibilità di non identificare correttamente un “vero” portatore occulto distinguendolo da un “falso” portatore occulto, è opportuno nel soggetto
anti-HBc positivo immunocompromesso o candidato a terapia immunosoppressiva, effettuare la determinazione della viremia basale.
Lo stato di portatore occulto può essere la naturale evoluzione nel tempo di un’epatite acuta da HBV (sintomatica o subclinica) andata incontro a guarigione clinica e biochimica, oppure l’evoluzione di un’epatite cronica da HBV con definitiva perdita dell’HBsAg.
La valutazione iniziale del portatore occulto immunodepresso o candidato ad immunosoppressione iatrogena deve pertanto definire l’eventuale presenza di un’epatopatia basale (dovuta ad una pregressa epatopatia cronica HBV-correlata o legata ad altri fattori), poiché l’eventuale riattivazione dell’infezione da HBV presenta una prognosi tanto peggiore quanto più evoluta è l’epatopatia sottostante.
La riattivazione dell’infezione da HBV nel portatore occulto immunodepresso si manifesta dal punto di vista laboratoristico con la cosiddetta “siero-reversione”, ossia la ricomparsa a livello plasmatico dell’HBsAg, e con la comparsa o notevole incremento della viremia plasmatica.
A questo segue, in particolare nella fase di immunoricostituzione, un incremento delle transaminasi con innesco di un quadro di epatite di gravità variabile (da forme subcliniche a forme fulminanti) (22).
Tutte le categorie virologiche di pazienti con infezione da HBV sopra menzionate in corso di immunosoppressione possono andare incontro a riattivazione/riacutizzazione dell’infezione con sviluppo di danno epatico tanto maggiore quanto più profondo risulta lo stato di immunocompromissione raggiunto.
In particolare nell’immunosoppressione iatrogena ogni singolo farmaco agisce con meccanismi e cinetica propri sui differenti meccanismi della risposta immunitaria, limitando la capacità di controllo della replicazione virale in modo più o meno marcato e per periodi più o meno prolungati.
Proprio in base alle differenze nella farmacodinamica e farmacocinetica dei vari farmaci ad azione immunosoppressiva utilizzati ed in base alla patologia di base del paziente con gradi variabili di compromissione immunologica (ad esempio linfomi, leucemie, tumori solidi), la fase di immunoricostituzione (momento critico per lo sviluppo del danno epatico) può essere precoce o tardiva, rapida o più graduale con notevoli differenze nell’intensità della riacutizzazione del danno epatico (17)(23)(24).
In Italia a fronte di 900.000 portatori cronici di HBsAg è stimabile la presenza di qualche milione di soggetti con infezione occulta da HBV (presenza almeno dell’anti-HBc).
Lungi dal poter essere considerati completamente guariti dall’infezione, questi individui sono nella maggior parte dei casi di età avanzata rappresentando un bacino potenziale sempre più ampio di possibili candidati a trattamenti immunosoppressivi in ambito oncoematologico, reumatologico, trapiantologico, ed in altre aree della medicina.
In corso di immunosoppressione farmacologica la riacutizzazione virale da HBV può avvenire in una fase molto precoce quando il deficit del sistema immunitario è massimale, oppure in una fase più tardiva durante l’immunoricostituzione (4)(17).
La prima forma di riattivazione, assai rara, è legata ad una massiva replica virale con danno acuto sull’epatocita per sovvertimento delle normali funzioni epatocellulari da accumulo intracellulare di elevate quantità di antigeni virali. Il quadro clinico che ne deriva, spesso grave con possibile evoluzione verso l’epatite fulminante, dal punto di vista istologico presenta l’aspetto di un’epatite fibrosante colestatica.
Questa forma risulta scarsamente responsiva alla terapia antivirale perché quando si hanno i segni clinici o laboratoristici del danno epatico le funzioni dell’epatocita risultano già fortmente compromesse dall’intensa replica virale.
La riattivazione tardiva, che si manifesta invece nella fase di immunoricostituzione, ha una latenza che varia a seconda del farmaco o schema terapetico immunosoppressivo utilizzato e della capacità di recupero del sistema immunitario del paziente, essendo importante da questo punto di vista il tipo di patologia di base (sono comuni latenze da 1 mese a 3 anni).
Il danno epatico si manifesta dal punto di vista istologico con un’epatite lobulare, in questo caso non direttamente attribuibile alla replica virale ma piuttosto alla ripresa della risposta immunitaria nei confronti di quest’ultima (danno tissutale immuno-mediato).
La gravità della riacutizzazione è in questo caso estremamente variabile tanto da potersi palesare clinicamente (anche con forme gravi o fulminanti) o soltanto laboratoristicamente (ipertransaminasemia).
La prognosi è peggiore quando la riacutizzazione si verifica su un fegato già compromeso o in evoluzione fibrotica (17).
I farmaci che possono determinare immunosoppressione e di conseguenza riattivazione/riacutizzazione dell’epatite B sono molti. In particolare negli ultimi anni l’attenzione si è focalizzata sui farmaci biologici ed in particolare su rituximab anticorpo monoclonale chimerico (umano-murino) anti-CD20 (utilizzato in monoterapia o in ambito oncoematologico anche associato a vari schemi di chemioterapia) che esplicando una forte attività citotossica sui linfociti B normali, oltre che sulle cellule neoplastiche di derivazione B, determina una forte soppressione sia dell’immunità umorale che cellulo-mediata (per gli intimi meccanismi di cooperazione tra linfociti B e T) potendo favorire la riattivazione dell’infezione da HBV nel portatore occulto e la riacutizzazione nel portatore attivo o inattivo (22).
È da sottolineare che la fase di immunoricostituzione dopo terapia con rituximab può essere estremamente lunga (fino a 12 mesi) e ciò giustifica la possibilità di riacutizzazioni a notevole distanza di tempo dal termine della terapia.
Rituximab (Mabthera®): principali caratteristiche del farmaco
Rituximab è un anticorpo monoclonale chimerico murino/umano ottenuto con tecniche di ingegneria genetica, costituito da una immunoglobulina glicosilata con le regioni costanti IgG1 di origine umana e con le sequenze della regione variabile della catena leggera e della catena pesante di origine murina.
Le indicazioni terapeutiche da scheda tecnica sono:
• Linfomi non Hodgkin: in particolare linfoma follicolare e linfoma diffuso a grandi cellule B CD 20 positivo in cui il farmaco viene associato a differenti schemi di chemioterapia (classicamente CHOP nel trattamento del linfoma diffuso a grandi cellule B CD 20 positivo) o in alcune condizioni utilizzato in monoterapia.
• Leucemia linfatica cronica: come prima linea associato a chemioterapia.
• Artrite reumatoide: in associazione a metotrexato viene utilizzato nei casi di artrite reumatoide attiva di grado grave in pazienti che non hanno risposto favorevolmente o hanno presentato intolleranza a farmaci antireumatici modificanti la malattia compresi uno o più inibitori del TNF.
Il farmaco viene tuttavia utilizzato “off-label” in svariate ulteriori condizioni cliniche ematologiche (oncologiche e non oncologiche), reumatologiche (a genesi autoimmunitaria e non), dermatologiche, nefrologiche, neurologiche.
Proprietà farmacodinamiche: rituximab si lega in modo specifico all’antigene transmembranario CD20, una fosfoproteina non glicosilata che si trova sui linfociti pre-B e sui linfociti B maturi. L’antigene viene espresso dal 95% di tutti i linfomi non-Hodgkin a cellule B.
Il CD20 si ritrova nelle cellule B normali e neoplastiche, ma non sulle cellule staminali emopoietiche, sulle cellule pro-B, sulle plasmacellule normali o su altri tessuti normali. Il dominio Fab del rituximab si lega all’antigene CD20 sui linfociti B e il dominio Fc può attivare le funzioni effettrici del sistema immunitario con lo scopo di provocare la lisi delle cellule CD 20 positive.
I meccanismi possibili della lisi cellulare mediata dall’anticorpo monoclonale chimerico comprendono la citotossicità complemento-dipendente (CDC) attraverso il legame con il C1q e la citotossicità cellulare anticorpo-dipendente (ADCC) mediata da uno o più recettori Fc sulla superficie di granulociti, macrofagi e cellule NK.
È stato tuttavia dimostrato che il legame del rituximab all’antigene CD20 sui linfociti B induce anche la morte cellulare per apoptosi.
La conta delle cellule B periferiche successivamente alla somministrazione della prima dose di rituximab scende al di sotto dei valori normali.
Nei pazienti trattati per tumori ematologici, il ripristino delle cellule B inizia in genere entro 6 mesi dal trattamento, per ritornare ai livelli di normalità tra i 9 e 12 mesi dopo il completamento della terapia.
Rituximab induce deplezione delle cellule B nel 70-80% circa dei pazienti, ma questo evento è stato associato ad una diminuzione delle immunoglobuline sieriche solo in una minoranza di pazienti.
Effetti collaterali: i possibili effetti avversi alla somministrazione endovenosa di rituximab sono molto numerosi (sindrome da lisi tumorale o da rilascio di citochine, reazioni nel sito di infusione, ipersensibilità, intensa astenia, crisi ipo o ipertensive, infezioni, patologie cardiache tra cui infarto del miocardio e aritmie severe, patologie respiratorie tra cui broncospasmo con dispnea severa, patologie gastrointestinali frequentemente associate a vomito e/o diarrea, patologie ematologiche tra cui leucopenia e neutropenia, patologie cutanee e dei tessuti molli, patologie del sistema muscolo scheletrico, disturbi del metabolismo, disturbi psichiatrici, patologie del sistema nervoso centrale e periferico, alterazioni degli organi di senso).
Tra le infezioni che si sono verificate in seguito alla somministrazione di rituximab in monoterapia o in combinazione con chemioterapia sono da segnalare infezioni batteriche (anche setticemiche), infezioni fungine, infezioni virali spesso da riattivazione causate da CMV, VZV, HSV 1 e 2, virus JC (con sviluppo di leucoencefalopatia multifocale progressiva).
In particolare sono state segnalate esacerbazioni di infezioni croniche da HCV e riacutizzazioni (portatori attivi e inattivi) o riattivazioni (portatori occulti) di infezioni croniche da HBV.
Un altro anticorpo monoclonale chimerico (umano-murino) utlilizzato in ambito ematologico nel trattamento della leucemia linfatica cronica a cellule B per cui sono state segnalate riacutizzazioni/riattivazioni di infezioni da HBV conclamate od occulte è alemtuzumab (25).
Questo ha come target la proteina CD 52 espressa prevalentemente sulla superficie cellulare dei linfociti B e T normali e maligni (ma presente in misura minore anche su monociti/macrofagi e timociti).
Sebbene la terapia corticosteroidea presenti un potere immunosoppressivo minore rispetto a rituximab, dosaggi elevati e ripetuti nel tempo sono da considerare ad alto rischio per riacutizzazione di infezioni croniche da HBV ed eventuali riattivazioni di infezioni occulte.
Gli steroidi sembrano presentare la caratteristica, non ancora ben definita dal punto di vista molecolare, di stimolare direttamente la replica virale (fenomeno rilevabile anche per HCV), ed il loro ampio utilizzo in vari ambiti della medicina amplifica il problema relativo al loro potere immunodepressivo.
Altri farmaci fortemente immunodepressivi ed a elevato rischio di riacutizzazione/riattivazione di infezioni da HBV sono i chemioterapici classici utilizzati in oncologia ed oncoematologia tra cui in particolare antracicline (doxorubicina e daunorubicina), fludarabina, vincristina/vinblastina, agenti alchilanti, antimetaboliti.
Farmaci con un potenziale più basso di riattivazione sono poi alcuni immunosoppressori utilizzati in particolare, ma non esclusivamente, in ambito trapiantologico (ad esempio ciclosporina, micofenolato, tacrolimus), altri farmaci biologici (anticorpi monoclonali rivolti contro il TNF → infliximab, adalimubab) (26), farmaci che inibiscono l’attività del TNF (etanercept), metotrexato ed azatioprina (27).
Ogni farmaco immunodepressivo in base alla propria potenza, ai meccanismi dell’immunità che coinvolge, alla durata di azione nel tempo, ha dunque una possibilità maggiore o minore di innescare una riacutizzazione/riattivazione dell’epatite da HBV.
Questa possibilità è determinata anche dalla cinetica stessa dell’immunoricostituzione che dipende in parte dalla modalità di azione del farmaco ma in parte anche dalla patologia di base per cui il soggetto è stato trattato e dalla capacità di recupero del sistema immunitario.
In generale in soggetti sottoposti ad immunodepressione iatrogena in assenza di profilassi o terapia con analoghi nucleos(t)idici la possibilità di riacutizzazione o
riattivazione dell’infezione da HBV è possibile sia nei soggetti HBsAg positivi (portatori attivi o inattivi) sia nei portatori occulti, sebbene in misura minore. In uno studio effettuato ad Hong Kong pubblicato nel 2007 su 626 pazienti neoplastici trattati con chemioterapia 78 risultavano HBsAg positivi. Di questi, 34 hanno sviluppato in seguito al trattamento chemioterapico un’epatite che è risultata correlabile a riattivazione di infezione da HBV in 15 pazienti (3 forme gravi).
Quindi il 19% dei pazienti HBsAg positivi sottoposti a chemioterapia ha sviluppato un’epatite correlabile a riattivazione di infezione da HBV (28).
In uno studio italiano pubblicato nel 2008 su 1087 pazienti con linfoma non Hodgkin 394 sono risultati positivi soltanto per anti-HBc. Di questi 245 sono stati trattati con CHOP e 74 con R-CHOP.
Riattivazioni di infezione da HBV si sono verificate nello 0.8% dei pazienti del primo gruppo e nel 2.7% dei pazienti del secondo gruppo (29).
Le riacutizzazioni/riattivazioni da HBV sia nel portatore conclamato attivo o inattivo che nel portatore occulto si osservano più frequentemente in campo onco-ematologico dove l’utilizzo di farmaci come rituximab, alemtuzumab ed i chemioterapici classici fortemente immunodeprimenti sono utilizzati in modo estensivo e dove spesso le patologie di base dei pazienti comportano già di per sé un importante grado di immunocompromissione.
In ambito trapiantologico riattivazioni di infezioni da HBV si sono osservate storicamente in particolare nel trapianto di fegato, tanto che le numerose esperienze cliniche accumulate hanno portato all’introduzione di una profilassi con analoghi nucleos(t)idici ed immunoglobuline specifiche anti-HBV (HBIG) efficace nel prevenire la recidiva di infezione nella maggior parte dei casi (18)(30). In trapiantologia epatica la classica riattivazione dell’infezione da HBV si osserva nel paziente HBsAg positivo che viene sottoposto a trapianto di fegato in assenza di profilassi.
Tuttavia anche nei soggetti HBsAg negativi è possibile l’insorgenza di un’infezione da HBV in seguito a trapianto epatico quando l’organo donato provenga da un soggetto anti-HBc positivo HBsAg negativo (portatore occulto). Questa condizione è chiamata “infezione de novo” e può risultare a volte molto aggressiva con scompenso dell’organo trapiantato, insufficienza epatica e morte del paziente.
Gli altri organi del paziente anti-HBc positivo possono invece essere utilizzati in soggetti HBsAg negativi con un bassissimo rischio di determinere “infezioni de novo” da HBV e questo conferma l’ipotesi che nel portatore occulto virus potenzialmente infettante (in particolare cccDNA) continui ad essere albergato nel tessuto epatico ma non in altri organi e che la riattivazione dell’infezione che segue il trapianto di fegato venga determinata dall’immunosoppressione iatrogena.
Nei pazienti HBsAg negativi che vengono sottoposti a trapianto di fegato da donatore anti-HBc positivo la presenza di pregressa immunità nei confronti del virus (anti-HBc e/o anti-HBs positività) o l’immunoprofilassi con HBIG in associazione alla chemioprofilassi con lamivudina, riducono significativamente il rischio di “infezioni de novo” (18)(31).
In generale in molte unità trapiantologiche viene fornito al paziente HBsAg negativo, che riceve un fegato da donatore anti-HBc positivo, un regime profilattico combinato a base di lamivudina e HBIG. Nel caso di pazienti riceventi il trapianto a basso rischio di riattivazione (anti-HBc positivi) in molti casi viene effettuata soltanto una profilassi con lamivudina o HBIG (18).
Per completare il quadro delle possibili categorie virologiche donatore/ricevente, in caso di trapianto di fegato da donatore HBsAg negativo ed anti-HBc negativo in ricevente HBsAg negativo anti-HBc positivo il rischio di riattivazione dell’infezione da HBV risulta basso (5-15%) e non viene effettuata alcuna profilassi attuando sul paziente un semplice follow-up.
Nel raro caso di donatore HBsAg positivo e ricevente HBsAg positivo la probabilità di trasmissione dell’infezione è molto alta e l’effetto neutralizzante delle HBIG è molto scarso. In questa condizione particolare la riattivazione dell’infezione potrebbe essere controllata dall’uso combinato di due analoghi nucleos(t)idici a lungo termine (32).
Altri ambiti clinici in cui il problema della riattivazione/riacutizzazione dell’infezione da HBV si può presentare, sebbene in misura più contenuta, sono la reumatologia, la gastroenterologia e la dermatologia a causa del crescente utilizzo di rituximab, farmaci steroidei, anticorpi monoclonali anti-TNF, inibitori della calcineurina (ciclosporina e tacrolimus) nell’ambito di patologie a genesi autoimmune o infiammatoria cronica.
Linee guida per la profilassi e terapia dell’infezione da HBV nel
paziente immunocompromesso
Secondo le linee guida dell’Associazione Italiana per lo Studio del Fegato (AISF) e dell’Associazione Europea per lo Studio del Fegato (EASL) sulla gestione dell’infezione da HBV nel paziente immunocompromesso o candidato a terapia immunosoppressiva risulta di fondamentale importanza definire la categoria virologica e la categoria clinica del paziente stesso (17)(18).
La categoria virologica si stabilisce in base alla determinazione dei “markers” di infezione da HBV e come visto in precedenza si distinguono tre categorie di soggetti di con infezione cronica.
Tra i pazienti con infezione cronica conclamata, che risultano HBsAg positivi, si distinguono portatori attivi (HBeAg positivi o HBeAg negativi con viremia rispettivamente ≥20.000 UI/ml e ≥2.000 UI/ml) ed inattivi (HBeAg negativi con viremia <2.000 UI/ml).
I pazienti con infezione occulta risultano invece HBsAg negativi ed anti-HBc IgG positivi, in presenza di HBV-DNA a livello del tessuto epatico (e più raramente a livello sierico con modeste viremie <200 UI/ml).
Nella pratica clinica tutti i soggetti che risultano anti-HBc positivi (con HBsAg negativo) devono essere considerati come potenziali portatori occulti (data la bassa frequenza di biopsie epatiche effettuate su questa categoria di pazienti che consentirebbero l’identificazione dell’HBV-DNA a livello del fegato).
Da sottolineare inoltre che il 20% circa dei portatori occulti può risultare negativo per tutti i marcatori sierici di infezione da HBV pur albergando a livello del tessuto epatico cccDNA virale.
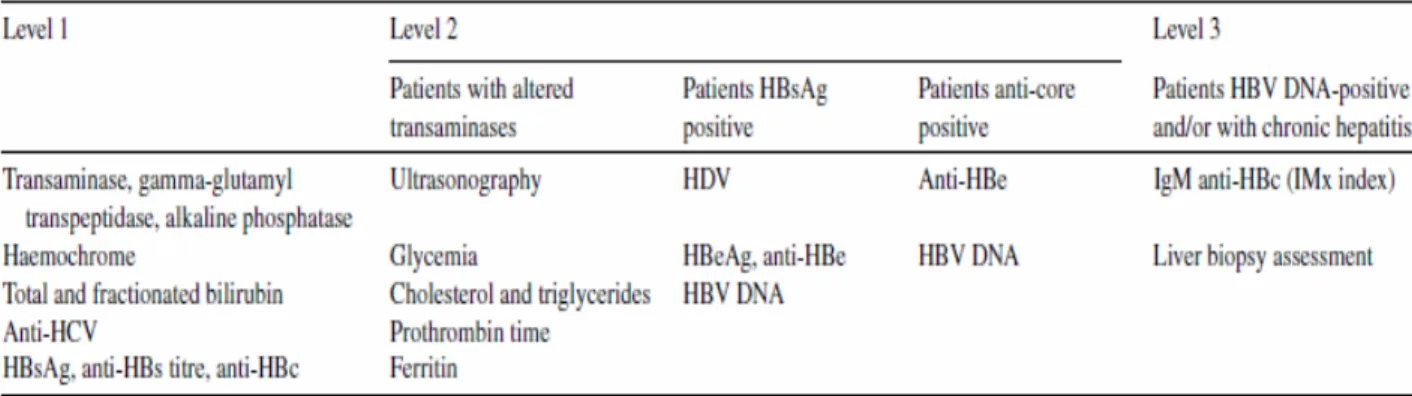
Per ciò che riguarda la categoria clinica del paziente immunocompromesso, questa deve essere stabilita mediante una valutazione basale comprendente una serie di accertamenti che consenta di definire la presenza di comorbidità e di epatopatia cronica (tabella 2).
Tabella 2. Valutazione basale per definire la categoria clinica del paziente
(Fonte: Italian Association for the Study of the Liver. Prophylaxis and treatment of hepatitis B in immunocompromised patients → bibliografia).
In effetti come più volte sottolineato la riattivazione/riacutizzazione dell’epatite B ha una prognosi tanto peggiore quanto minore risulta la riserva funzionale epatica del paziente.
Nel paziente candidato a terapia immunosoppressiva che presenti transaminasi (in particolare ALT) nei valori della norma deve essere effettuata una valutazione bioumorale comprendente: emocromo, creatinina, bilirubina, γGT, fosfatasi alcalina, ALT, AST, protidemia con elettroforesi delle proteine sieriche, INR, HBsAg, anti-HBs, anti-HBc IgG, anti-HCV (nei pazienti HBsAg e/o anti-HCV positivi effettuare anche test Elisa per HIV).
Nei pazienti che presentano valori di ALT elevati rispetto ai valori di riferimento deve essere effettuata un’ecografia addominale, oltre alle indagini sopra elencate è opportuno inoltre escludere un’eziologia tossica ed in particolare alcolica essendo questa la più frequente causa di transaminasi persistentemente alterate in assenza di segni di infezione virale.
Una volta escluso l’abuso etanolico entrano in diagnosi differenziale la steatosi epatica non alcolica (NAFLD), la steatoepatite non alcolica (NASH), l’emocromatosi (dosaggio di sideremia, ferritina, transferrina, saturazione della transferrina con successiva eventuale ricerca di mutazioni del gene HFE), la
malattia celiaca (ricerca di anticorpi IgA anti-transglutaminasi) o eziologie più rare di specifica competenza epatologica.
Nei pazienti che risultano HBsAg positivi le indagini virologiche devono essere approfondite valutando la presenza di HBeAg, anti-HBe, anti-HBc IgM (index), HBV-DNA, anti-HDV e/o HDV-RNA.
I portatori conclamati attivi (HBsAg positivi, HBeAg o anti-HBe positivi con viremia rispettivamente ≥20.000 UI/ml o ≥2.000 UI/ml) immunodepressi o candidati a trattamenti immunosoppressivi devono essere attentamente valutati in base al valore delle transaminasi, alla presenza o meno dell’HBeAg, all’esito dell’ecografia addominale e di una eventuale biopsia epatica. Per questi pazienti viene sempre raccomandata una vera e propria terapia antivirale che deve essere prolungata considerato il rischio di riattivazione virale alla sospensione del trattamento.
Nei pazienti che risultano HBsAg negativi ed anti-HBc positivi è raccomandato valutare la presenza di anti-HBe e HBV-DNA su sangue che generalmente risulta non rilevabile o presente a basso titolo.
La presenza di marcatori di avvenuta infezione da parte di HBV ed in particolare la presenza di anti-HBc IgG deve portare a considerare il paziente come potenziale portatore occulto di infezione. I pazienti anti-HBc positivi che risultano anti-HBs negativi potrebbero essere sottoposti a vaccinazione con HBsAg ricombinante dato che in caso di risposta anticorpale anti-HBs una riattivazione dell’infezione in seguito ad immunodepressione risulta improbabile (33).
Nei pazienti che risultano anti-HCV positivi l’infezione cronica da HCV deve essere confermata effettuando la PCR quantitativa o qualitativa dell’RNA virale. La genotipizzazione dell’HCV può essere utile in previsione della terapia con interferone e ribavirina. La biopsia epatica in questi casi può essere indicata per meglio definire a livello istologico il quadro infiammatorio epatico e l’eventuale presenza di fibrosi. La presenza di infezione da HCV comunque non
controindica un trattamento immunosoppressivo e non necessita di profilassi specifica.
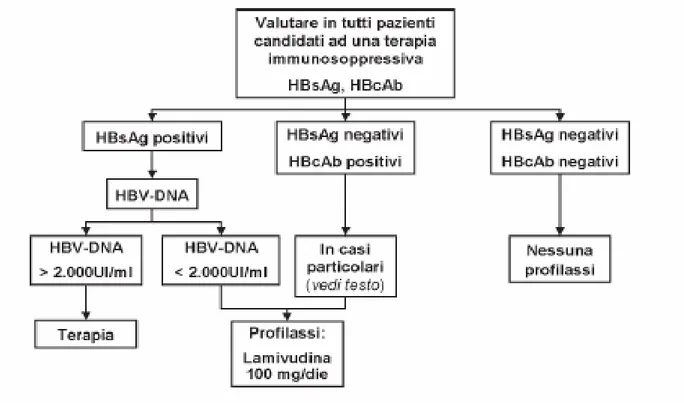
Nel caso dei portatori occulti o dei portatori conclamati inattivi di infezione da HBV immunodepressi o candidati a terapia immunosoppressiva per evitare la riattivazione/riacutizzazione dell’infezione viene indicato un trattamento di tipo profilattico con analoghi nucleos(t)idici utilizzando farmaci a bassa barriera genetica come lamivudina (fig.5).
Fig 5 Infezione da HBV: prevenzione della riattivazione/riacutizzazione nel paziente
candidato a trattamento immunosoppressivo.
In questi pazienti tale approccio è reso possibile dalla bassa possibilità di selezionare resistenze data l’assenza o la presenza di bassa viremia plasmatica. In particolare per ciò che riguarda il portatore occulto o potenziale occulto (anti-HBc positivo) viene raccomandata una profilassi preventiva universale nel paziente oncoematologico in previsione di: 1) trapianto di midollo osseo 2) chemioterapia in particolare se a base di antracicline o fludarabina 3) utilizzo di rituximab o alemtuzumab (17)(18)(19).
La profilassi deve essere iniziata da 1 a 4 settimane prima della prevista terapia immunosoppressiva, il farmaco di scelta è lamivudina che deve essere proseguito per tutto il trattamento immunosoppressivo e per almeno 6-12 mesi dopo la sua sospensione (anche 18 mesi in ambito ematologico) (20).
Durante la profilassi il paziente deve essere sottoposto a controlli mensili delle transaminasi ed a controlli trimestrali di HBsAg ed HBV-DNA (questi ultimi due test devono essere inoltre effettuati in caso di alterazione delle transaminasi). In caso di comparsa di HBV-DNA a livello plasmatico o di incremento di 10 volte dei valori basali è indicato effettuare la ricerca di resistenze alla lamivudina.
Dopo l’interruzione della profilassi con lamivudina è infrequente ma possibile il verificarsi della “siero-reversione” (“shift” del paziente da anti-HBc positivo/HBsAg negativo ad anti-HBc positivo/HBsAg positivo) con riattivazione dell’infezione, pertanto è opportuno effettuare regolari controlli delle transaminasi per un anno dopo la sospensione della profilassi.
Negli altri casi di immunocompromissione stabilmente presente o indotta da farmaci in portatore occulto o potenziale occulto viene invece raccomandato il solo monitoraggio dell’HBsAg e delle transaminasi ogni 1-3 mesi per individuare precocemente la eventuale “siero-reversione” ed attuarne tempestivamente il trattamento.
In caso di portatore occulto o potenziale occulto anti-HBs negativo è stata proposta la vaccinazione con HBsAg ricombinante in modo che l’eventuale risposta anticorpale possa prevenire la riattivazione dell’infezione (33)(34) sebbene non esistono attualmente studi che confermino l’efficacia di questo trattamento e sia nota la possibilità di riattivazione anche in presenza anticorpi anti-HBs. Nel portatore conclamato inattivo (HBsAg ed anti-HBe positivo con carica virale <2.000 UI/ml) il trattamento in regime di profilassi universale viene raccomandato in tutti i casi di immunodepressione. Pertanto oltre che in ambito oncoematologico (chemioterapie, utilizzo di rituximab associato o meno a