INDICE
RIASSUNTO...1
1 INTRODUZIONE...2
1.1 Epidemiologia...2
1.2 Alterazioni della funzione renale nell'insufficienza cardiaca...5
1.3 Sindrome cardio-renale...10
1.4 Fisiopatologia dell'interazione cardio-renale...20
1.5 Aspetti diagnostici e nuovi marcatori di funzionalità renale...29
1.6 Terapia dell'insufficienza cardiaca e funzione renale: diuretici dell'ansa...34
2 SCOPO DELLA TESI...47
3 MATERIALI E METODI...48
4 RISULTATI...54
4.1 Caratteristiche dei pazienti all'ammissione...54
4.2 Caratteristiche alla dimissione...56
4.3 Andamento del peso e della funzione renale durante la degenza...57
4.4 Follow-up...58
4.5 Confronto tra gruppi in base alla funzione renale...60
4.6 Confronto tra gruppi in base alla recidiva...70
5 DISCUSSIONE...79
5.1 Scelta della modalità di somministrazione del diuretico...79
5.2 Efficacia della terapia diuretica sul sovraccarico di volume...80
5.3 Effetti della terapia diuretica sulla funzione renale...83
5.4 Confronto tra gruppi in base alla funzione renale...84
5.5 Confronto tra gruppi in base alla recidiva...90
6 CONCLUSIONI...94
RIASSUNTO
Insufficienza renale e scompenso cardiaco sono condizioni frequentemente associate e correlate tra loro da una complessa rete di meccanismi fisiopatologici. L’esistenza di una disfunzione renale in pazienti con scompenso cardiaco è associata a un aggravamento della prognosi e a resistenza alla terapia diuretica e spesso ostacola l’impostazione del trattamento.
Questo studio ha valutato l'efficacia e la sicurezza dei diuretici dell’ansa, somministrati in infusione continua, in 40 pazienti ricoverati per riacutizzazione di scompenso cardiaco, con particolare attenzione alle variazioni degli indici di funzione renale nell’arco del ricovero.
Nell’intera popolazione, il trattamento ha determinato un netto decremento ponderale, con riduzione delle pressioni di riempimento e dei livelli di BNP. Si è osservato, durante il ricovero, un miglioramento della funzione renale, valutata mediante la creatininemia e il GFR calcolato con formula MDRD. I pazienti sono stati suddivisi in due gruppi in base all’entità del deficit di funzione renale documentato all’ingresso: i pazienti con funzione renale inizialmente più compromessa hanno mostrato un miglioramento più marcato degli indici di funzione renale durante il ricovero. Non si è riscontrata una correlazione tra il grado di disfunzione renale iniziale e l’incidenza di nuovi episodi di riacutizzazione di scompenso durate il follow-up.
1 INTRODUZIONE
1.1 Epidemiologia
L'insufficienza cardiaca o scompenso cardiaco è quella condizione fisiopatologica in cui un'alterazione della funzione cardiaca è responsabile dell'incapacità del cuore di espellere la quantità di sangue adeguata a soddisfare le necessità metaboliche dell'organismo1, o della
possibilità che questo avvenga solo attraverso un incremento delle pressioni di riempimento ventricolare.
L'insufficienza cardiaca è uno dei problemi di salute pubblica di maggior rilievo epidemiologico; la prevalenza di questa patologia nei Paesi industrializzati è stimata tra l'1 e il 2% della popolazione e aumenta nelle fasce di età più avanzate.
Un recente studio condotto negli Stati Uniti ha evidenziato una prevalenza del 2,2% nella popolazione generale sopra i 45 anni, con un incremento progressivo a partire dai 50 anni fino a superare l'8% nella popolazione di età superiore ai 75 anni e il 10% in quella di età superiore agli 80. L'incidenza dello scompenso cardiaco non appare aumentata negli ultimi 20 anni, ma, a causa dell'aumento dell'età media della popolazione e delle migliorate possibilità di trattamento delle sindromi coronariche acute, delle miocardiopatie idiopatiche e acquisite e delle valvulopatie, il numero assoluto dei pazienti affetti da insufficienza
cardiaca è in aumento2.
Anche l'analisi delle diagnosi di ricovero mette in luce l'impatto dell'insufficienza cardiaca sulla salute pubblica: negli Stati Uniti, oltre 1 milione di pazienti sono ospedalizzati ogni anno con una diagnosi principale di scompenso cardiaco e un numero analogo di ricoveri è ipotizzabile per l'Europa. La European Society of Cardiology ha analizzato in un suo studio le caratteristiche dei pazienti ricoverati per scompenso cardiaco acuto, riscontrando una durata media di degenza di 9 giorni e un tasso di mortalità intra-ospedaliera del 6,7%. L'età media dei pazienti con insufficienza cardiaca in Europa e di 74 anni3.
In Italia, l'insufficienza cardiaca è la principale causa di ospedalizzazione per i soggetti di età superiore ai 65 anni, con un'età media dei pazienti ricoverati di 73 anni; in accordo con la casistica europea, la durata media di ospedalizzazione per scompenso cardiaco acuto in Italia è di 9 giorni, mentre il tasso di mortalità durante il ricovero risulta del 7,3%. A 6 mesi dalla dimissione, la mortalità globale è del 12,8% e il tasso di riospedalizzazione è del 38,1%4.
Considerando separatamente i ricoveri per insufficienza cardiaca acuta di nuovo riscontro e quelli per riacutizzazione di insufficienza cardiaca cronica, sia la mortalità a 6 mesi, sia il tasso di riospedalizzazione appaiono superiori nel secondo gruppo5.
anziana, l'insufficienza cardiaca è frequentemente accompagnata da altre condizioni morbose. Le comorbidità influenzano sensibilmente la prognosi, la durata della degenza, il tasso di riospedalizzazione e la qualità della vita dei pazienti con insufficienza cardiaca6; in particolare,
l'insufficienza renale, che frequentemente coesiste con lo scompenso cardiaco, è stata identificata come un fattore prognostico negativo indipendente.
1.2 Alterazioni della funzione renale nell'insufficienza cardiaca
L'insufficienza renale, meglio definita come malattia renale cronica, è, al pari dello scompenso cardiaco, una condizione largamente diffusa nella popolazione; la sua incidenza, inoltre, è attualmente in aumento, soprattutto nella popolazione anziana, a causa della crescente prevalenza di fattori di rischio come il diabete mellito, l'ipertensione e l'età avanzata7.
Come dimostrato da una notevole quantità di studi, la malattia renale cronica interessa un'alta percentuale dei pazienti con scompenso cardiaco e incide sensibilmente sulla prognosi.
Una revisione sistematica della letteratura condotta da Smith et al ha contribuito a chiarire la prevalenza della disfunzione renale tra i pazienti con scompenso cardiaco e il suo impatto sulla mortalità: l'analisi di studi precedenti ha evidenziato la presenza di una riduzione della funzione renale di qualsiasi grado (eGFR < 90 mL/min o creatinina sierica > 1,0
mg/dL) in oltre il 50% dei pazienti ospedalizzati o ambulatoriali con scompenso cardiaco e una prevalenza del 29% di insufficienza renale moderato-severa (eGFR < 53 mL/min o creatinina sierica > 1,5 mg/dL), con percentuali inferiori nei pazienti ambulatoriali rispetto a quelli ricoverati. Una volta eliminata la variabilità attribuibile alle differenze demografiche e allo stadio clinico, la presenza di insufficienza renale appariva correlata alla mortalità con Hazard Ratio = 1,56. Inoltre, la mortalità risultava correlata in modo lineare al grado di compromissione della funzione renale, suggerendo una relazione di tipo dose-risposta. I pazienti con deficit di funzione renale configurano dunque una popolazione ad alto rischio nell'ambito di quelli affetti da scompenso cardiaco, con un incremento prossimo al 50% del rischio relativo di mortalità rispetto ai pazienti con funzione renale preservata; il rischio relativo aumenta del 100% se vengono considerati i pazienti con insufficienza renale moderato-grave8.
Uno studio più ampio ha preso in esame 118.465 pazienti ricoverati con diagnosi di scompenso cardiaco acuto, valutando il grado di funzione renale al momento del ricovero (eGFR calcolato secondo la formula MDRD semplificata): una volta stratificati in base alla classificazione proposta dalla National Kidney Foundation, solo il 9% dei pazienti presentava funzione renale normale (stadio I), mentre una compromissione lieve (stadio II) e moderata (stadio III) si osservavano rispettivamente nel 27% e nel 44% dei pazienti; infine, il 13% dei pazienti aveva una funzione renale gravemente compromessa (stadio IV)
e il 7% rientrava nello stadio V. Complessivamente, oltre il 63% dei pazienti presentava una velocità di filtrazione glomerulare inferiore a 60 mL/min/1,73m2, compatibile con la definizione di insufficienza renale.
Al decrescere della funzione renale erano associati un aumento della durata media di degenza (da 5,3 a 7 giorni), un incremento del tasso di mortalità intraospedaliera (da 1,9% a 7,6%) e un'aumentata necessità di ricorso all'Unità di Terapia Intensiva9.
Numerosi altri studi hanno posto in evidenza il rapporto tra compromissione della funzione renale, documentata al momento dell'ospedalizzazione, e mortalità intra-ospedaliera10, 11, mortalità nel
periodo di follow-up successivo alla dimissione12, 13, 14, 15, 16, 17, durata
della degenza18 e necessità di riospedalizzazione19, 20.
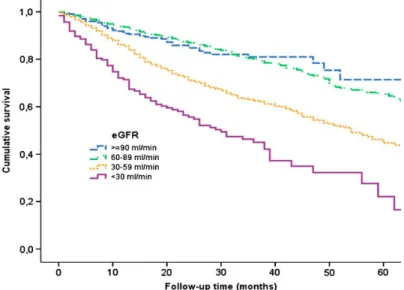
La correlazione inversa tra funzione renale e mortalità è stata documentata anche tra i pazienti ambulatoriali: da uno studio su 3605 pazienti, di cui il 44,9% presentava una disfunzione renale clinicamente significativa (eGFR < 60 mL/min/1,73m2), è emerso che l'eGFR
costituiva un fattore indipendente predittivo di sopravvivenza a 5 anni21.
Un recente studio su una popolazione di 1301 pazienti con insufficienza cardiaca cronica ha evidenziato la presenza di malattia renale cronica nel 26% dei casi: i pazienti con insufficienza renale cronica mostravano tassi di sopravvivenza a lungo termine sensibilmente inferiori rispetto ai pazienti con funzione renale inalterata e la mortalità appariva correlata, sebbene in modo non statisticamente significativo, con lo stadio di
insufficienza renale22.
Figura 1: Curva di sopravvivenza di Kaplan-Meyer di pazienti con scompenso cardiaco
stratificati in base al GFR21.
Diversi criteri di definizione del deficit di funzione renale sono stati adottati nei vari studi, con diversi cut-off per i valori di creatinina sierica, eGFR o azoto ureico: ciò mette in risalto la necessità di stabilire una definizione unanime di disfunzione renale, che permetta di valutarne in modo quantitativo l'impatto prognostico nei pazienti con insufficienza cardiaca23. Anche i metodi con cui viene valutata la funzione renale
appaiono molto eterogenei nei diversi studi precedentemente citati.
Mentre l'impatto prognostico di una preesistente disfunzione renale nei pazienti con insufficienza cardiaca è studiato da tempo, solo in anni più recenti è stato stabilito il nesso tra modificazioni dinamiche della funzione renale durante il ricovero e outcome: il peggioramento della funzione renale è stato riconosciuto come un fattore predittivo di una
peggiore prognosi e si propone come un parametro utile per la stratificazione del rischio nei pazienti con scompenso cardiaco.
Damman et al hanno elaborato i dati provenienti da 8 studi con lo scopo di analizzare la correlazione tra peggioramento della funzione renale (worsening renal function, WRF) e prognosi: il peggioramento della funzione renale, identificato da un aumento della creatinina plasmatica > 0,2 mg/dL o da una riduzione dell'eGFR > 5 mL/min/1,73m2, risultava
associato a un incremento del 61% della mortalità a 6 mesi; la correlazione con la mortalità era più forte in caso di marcato peggioramento della funzione renale, definito come incremento della creatininemia superiore a 0,5 mg/dL o riduzione del filtrato glomerulare stimato superiore a 15 mL/min/m2 24.
Uno studio su pazienti ricoverati per insufficienza cardiaca acuta ha documentato un incremento della creatinina sierica > 0,3 mg/dL durante l'ospedalizzazione in 152/416 casi: sebbene transitorio nella maggioranza dei pazienti, l'incremento della creatininemia si associava a una durata media del ricovero più prolungata (15,3 giorni invece di 12,1) e a un aumentato rischio di eventi avversi (morte o nuova ospedalizzazione) dopo la dimissione (HR = 1,74)25.
Un altro studio prospettico, condotto su pazienti ospedalizzati con diagnosi di scompenso cardiaco acuto, ha definito il peggioramento della funzione renale come un incremento assoluto > 0,3 mg/dL della creatinina sierica associato a un incremento relativo > 25% rispetto ai valori basali: questo criterio più selettivo è stato adottato allo scopo di
correggere l'errore legato alla proporzionalità esponenziale tra livelli sierici di creatinina e GFR26. Il declino della funzione renale è stato
osservato nel 32% dei pazienti ed è apparso correlato in modo statisticamente significativo con una degenza più prolungata e con una maggiore incidenza di morte per cause cardiovascolari o riospedalizzazione nel follow-up successivo alla dimissione27.
1.3 Sindrome cardio-renale
Risulta evidente che la riduzione della funzione renale, preesistente allo scompenso cardiaco o di nuova insorgenza in corso di riacutizzazione, condiziona in modo sostanziale la prognosi. Nei pazienti con insufficienza cardiaca, l'alta prevalenza di alterazione della funzione renale e la predittività di quest'ultima per un outcome sfavorevole suggeriscono un'interazione bidirezionale tra i due organi.
Questa interdipendenza è stata descritta con il termine “sindrome cardio-renale”, che, in senso lato, può indicare una condizione in cui “o il rene o il cuore non riescono a compensare il deficit funzionale dell'altro organo, creando un circolo vizioso che conduce, in ultima analisi, allo scompenso dell'intero sistema cardiocircolatorio”28.
Per risolvere l'ambiguità intrinseca in questa definizione, una consensus
conference convocata dal Acute Dialysis Quality Initiative (ADQI)
Working Group ha sviluppato una classificazione che distingue, nell'ambito della sindrome cardio-renale, cinque sottotipi caratterizzati in
base alla relazione temporale, alla fisiopatologia e alla natura dell'interazione cuore-rene29. La classificazione di Ronco e coll ha
permesso di includere nella definizione di sindrome cardio-renale molteplici condizioni, acute e croniche, in cui l'alterazione primitiva della funzione può risiedere a carico dell'uno o dell'altro organo.
Sindrome cardio-renale acuta (CRS tipo 1)
La sindrome cardio-renale di tipo 1 è caratterizzata da un rapido deterioramento della funzione cardiaca (come avviene in caso di riacutizzazione di scompenso cardiaco, shock cardiogeno, sindromi coronariche acute, ma anche in corso di chirurgia del cuore) che conduce a un danno renale acuto. L'insorgenza di danno renale acuto è più frequente nei pazienti che hanno una preesistente disfunzione renale e costituisce un fattore di rischio indipendente per la mortalità a un anno, suggerendo un suo ruolo attivo nell'accelerare la disfunzione cardiocircolatoria. Il manifestarsi di danno renale acuto, inoltre, influenza sensibilmente la scelta del trattamento, scoraggiando la somministrazione di diuretici ad alte dosi, ACE-inibitori, antagonisti del recettore dell'angiotensina e antialdosteronici: questo fatto potrebbe rappresentare un ulteriore meccanismo di aggravamento del quadro clinico29.
Il concetto di “danno renale acuto” (Acute Kidney Injury, AKI) è stato ridefinito nel 2007 ed include l'intero spettro di manifestazione dell'insufficienza renale acuta: i nuovi criteri di definizione hanno
evidenziato il significato clinico di modificazioni modeste della funzione renale e suggeriscono che una riduzione della funzione renale documentata entro un lasso di tempo di 48 ore dal ricovero sia diagnostica per danno renale acuto30.
Studi osservazionali hanno stimato che tra il 27% e il 45% dei pazienti ricoverati per riacutizzazione di scompenso cardiaco sviluppino una danno renale acuto, evidenziato da un aumento della creatinina sierica pari o superiore a 0,3 mg/dL; l'incidenza della sindrome cardio-renale di tipo 1 è comunque altamente variabile in base alla popolazione presa in esame e alla definizione di danno renale acuto31.
Il tempo che intercorre tra la riacutizzazione di scompenso cardiaco e la comparsa del danno renale acuto è stato valutato in diversi studi: Gottileb et al hanno riportato che il 47% dei casi di CRS di tipo 1 compariva entro 3 giorni dal ricovero31 e Cowie et al hanno riscontrato il
50% dei casi entro i primi 4 giorni32.
Uno studio su 20.063 pazienti ospedalizzati per scompenso cardiaco acuto ha evidenziato una prevalenza di sindrome cardio-renale di tipo 1 del 17,8% durante il ricovero: a un anno dalla dimissione, il 35,4% dei pazienti che avevano manifestato danno renale acuto era deceduto e il 64,5% era andato incontro a riospedalizzazione, configurandosi il peggioramento della funzione renale come un fattore predittivo indipendente per la mortalità a un anno33.
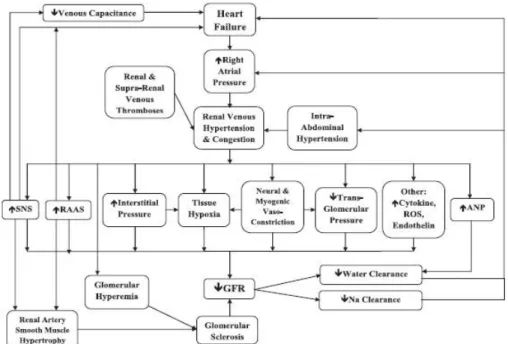
La fisiopatologia della sindrome cardio-renale di tipo 1 non appare tuttora chiara, ma si ipotizza che molteplici e complessi meccanismi sottendano alla comparsa del danno renale acuto. Il ruolo centrale precedentemente attribuito alle alterazioni emodinamiche è stato messo in discussione dall'evidenza che il danno renale acuto può svilupparsi anche in caso di frazione di eiezione ventricolare sinistra conservata31,
nonostante il danno renale sia generalmente più grave nei pazienti con frazione di eiezione ridotta.
Figura 2: Fisiopatologia della sindrome cardio-renale di tipo 131.
Sindrome cardio-renale cronica (CRS tipo 2)
Nella sindrome cardio-renale di tipo 2, anomalie croniche della funzione cardiaca (ad esempio, insufficienza cardiaca cronica congestizia) sono causa di una malattia renale cronica progressiva29. Poiché insufficienza
riconoscono fattori di rischio e meccanismi patogenetici comuni (diabete, ipertensione, aterosclerosi), è difficile determinare a carico di quale organo si sia instaurata primitivamente la disfunzione34.
È interessante notare che la prevalenza di malattia renale cronica è sovrapponibile se vengono considerati separatamente i pazienti con funzione ventricolare sinistra conservata e quelli con ridotta frazione di eiezione; lo studio ESCAPE ha evidenziato come l'unico parametro emodinamico significativamente correlato al grado di disfunzione renale fosse la pressione atriale destra, suggerendo un ruolo patogenetico della congestione renale19.
Meccanismi potenzialmente implicati nel danno renale progressivo comprendono lo squilibrio cronico dei fattori neuro-ormonali, con prevalenza di mediatori che inducono vasocostrizione (tono simpatico, angiotensina, endotelina) e riduzione della secrezione e/o della sensibilità nei confronti dei fattori endogeni vasodilatatori (peptidi natriuretici, ossido nitrico). Lo stesso trattamento dello scompenso cardiaco cronico è stato chiamato in causa per spiegare il peggioramento della funzione renale: potrebbero contribuire all'insorgenza di questa sindrome l'ipovolemia causata dall'uso di diuretici, l’inibizione del sistema renina-angiotensina-aldosterone e l'ipotensione indotta dai farmaci vasodilatatori29. È inoltre ipotizzabile che l'insufficienza cardiaca
di lunga durata porti a malattia renale progressiva attraverso ripetuti episodi di danno renale acuto35.
Sindrome reno-cardiaca acuta (CRS tipo 3)
La sindrome cardio-renale di tipo 3 è caratterizzata da un brusco e primitivo deterioramento della funzionalità renale, che comporta secondariamente una disfunzione cardiaca acuta: quest'ultima può consistere in una sindrome coronarica acuta, un'aritmia o un'insufficienza cardiaca acuta29. Esempi di condizioni che comportano
un peggioramento acuto della funzione renale sono la glomerulonefrite acuta, l'ischemia renale e la necrosi corticale acuta.
L'epidemiologia della sindrome reno-cardiaca acuta è di difficile definizione, a causa delle molteplici condizioni che possono portare a un peggioramento acuto della funzione renale e della variabilità dei fattori di rischio che predispongono all'insorgenza della disfunzione cardiaca. Inoltre, il danno renale acuto non viene definito in modo omogeneo nei diversi studi36.
Uno studio multicentrico pubblicato nel 1998 ha riportato l'associazione tra insufficienza renale acuta e insufficienza multi-organo e ha evidenziato un incremento della mortalità al crescere del numero di organi compromessi: tra i pazienti ricoverati in Unità di Terapia Intensiva, il numero di organi compromessi risultava correlato con la mortalità e l'insufficienza cardiovascolare si accompagnava all'insufficienza renale acuta nel 60% dei casi. Un altro studio su pazienti con danno renale acuto ha riportato un Odds Ratio di 7,7 per la morte da insufficienza cardiaca, risultando quest'ultima la principale causa di
mortalità37.
Il danno renale acuto influenza negativamente la funzione cardiaca attraverso meccanismi che possono essere suddivisi in diretti e indiretti; i meccanismi diretti sono stati studiati prevalentemente in modelli animali di danno renale indotto da ischemia-riperfusione, in cui le anomalie cardiache secondarie apparivano associate a incrementati livelli di IL-1 e TNF e aumentata espressione di ICAM-138: la disfunzione cardiaca
sembrerebbe pertanto riconducibile alla presenza di mediatori dell'infiammazione, all'infiltrazione di neutrofili e alla conseguente apoptosi dei miociti. I meccanismi indiretti di danno cardiaco includono il sovraccarico di liquidi, lo squilibrio elettrolitico, l'acidosi e l'accumulo di tossine uremiche: la ritenzione idrosalina determina un sovraccarico di volume, che può contribuire allo sviluppo di edema polmonare acuto; iperpotassiemia e acidosi contribuiscono ad aumentare il rischio di aritmie; l'acidosi determina aumento delle resistenze nel circolo polmonare e deprime la contrattilità miocardica; infine, l'uremia riduce la contrattilità miocardica e può condurre a infarto miocardico o a pericardite37.
Sindrome reno-cardiaca cronica (CRS tipo 4)
La sindrome reno-cardiaca cronica è stata definita come una condizione di malattia renale cronica che comporta l'insorgenza di una progressiva disfunzione cardiaca e/o un aumentato rischio di eventi cardiovascolari avversi29.
I pazienti con insufficienza renale cronica presentano un'aumentata mortalità per cause cardiovascolari, con un rischio relativo variabile tra 1,4 e 3,7 rispetto alla popolazione generale; la mortalità di origine cardiovascolare tra i pazienti con nefropatia cronica è pari al 58% della mortalità per tutte le cause39. In pazienti non dializzati, la prevalenza di
malattie cardiovascolari aumenta progressivamente con la gravità dell'insufficienza renale e con il tempo intercorso dalla diagnosi40. Anche
per gradi lievi di insufficienza renale, l'incrementato rischio di malattia cardiovascolare rimane presente; comunque, l'associazione segue un andamento di tipo dose-risposta, diventando particolarmente significativa quando l'eGFR si riduce al di sotto di 60 mL/min/1,73m2 41.
Gli stadi intermedi dell'insufficienza renale si associano a un aumentato rischio di sviluppare scompenso cardiaco; lo studio ARIC (Atherosclerosis Risk in Community) ha preso in analisi oltre 15.000 soggetti sottoposti a ripetute valutazioni del GFR, escludendo dal campione coloro che presentavano una preesistente insufficienza cardiaca: i soggetti con eGFR inferiore a 60 mL/min/1,73m2 hanno
mostrato un'incidenza significativamente maggiore di scompenso cardiaco di nuova insorgenza, con un rischio relativo raddoppiato, una volta eliminati i fattori di confondimento, rispetto ai soggetti con eGFR > 9042.
Tra i pazienti sottoposti a dialisi, la prevalenza di alterazioni ecocardiografiche compatibili con la diagnosi di scompenso cardiaco è estremamente alta, con disfunzione sistolica conclamata nel 15%,
ipertrofia ventricolare sinistra nel 74% e dilatazione del ventricolo sinistro nel 36% dei casi43.
L'aumentato rischio cardiovascolare nei pazienti con insufficienza renale cronica potrebbe essere riconducibile sia a un ruolo patogenetico della stessa disfunzione renale, sia all'esistenza di fattori di rischio comuni all'insufficienza renale cronica e alle malattie cardiovascolari, sia, infine, alla ridotta tendenza a prescrivere terapie che riducono il rischio cardiovascolare in pazienti con funzione renale ridotta36.
La disfunzione cardiovascolare può essere la conseguenza della prolungata esposizione al “milieu uremico”, che comporta aumento dello stress ossidativo, stato infiammatorio e accelerazione dell'aterosclerosi. Lo scompenso cardiaco può instaurarsi come risultato del sovraccarico di pressione e di volume. Le aritmie possono essere legate agli squilibri elettrolitici, oppure insorgere secondariamente ad altre alterazioni cardiovascolari, come malattia coronarica, ipertensione o insufficienza cardiaca41.
Sindrome cardio-renale secondaria (CRS tipo 5)
Nella sindrome cardio-renale di tipo 5, la disfunzione renale e la disfunzione cardiaca si instaurano in modo combinato, per effetto di un disturbo sistemico acuto o cronico29.
cuore e il rene: tra queste, il diabete mellito, l'ipertensione, la sarcoidosi, il lupus eritematoso sistemico (LES), l'amiloidosi sistemica, la tubercolosi, la malattia di Fabry, la granulomatosi di Wegener, il mieloma multiplo. Il coinvolgimento cardio-renale è generalmente simultaneo se la condizione scatenante è di tipo acuto, mentre nelle malattie croniche un organo può essere colpito prima dell'altro: può essere difficile, in questi casi, attribuire un tipo di sindrome cardio-renale44.
I dati riguardanti l'epidemiologia della sindrome cardio-renale secondaria sono tuttora carenti, a causa della recente definizione di questa condizione e dell'eterogeneità dei disturbi che possono causarla. Non è chiaro se, nell'ambito della sindrome cardio-renale di tipo 5, la disfunzione dei due organi sia semplicemente concomitante, oppure esista un'effettiva interazione bidirezionale tra cuore e rene36.
Tra le condizioni acute, la sepsi rappresenta la più comune e grave causa di disfunzione cardio-renale concomitante. L'infiammazione e le alterazioni micro-vascolari costituiscono la base patogenetica del coinvolgimento sia renale che cardiovascolare in corso di sepsi: la depressione della funzione miocardica sembra riconducibile all'ischemia generalizzata, prodotta dalle alterazioni del flusso coronarico, e all'azione di mediatori infiammatori (come IL-1, TNF, NO), che possono deprimere la contrattilità miocardica e alterare l'autoregolazione coronarica; il danno renale acuto che si verifica nella sepsi sembra allo stesso modo dipendere da alterazioni emodinamiche, con ridistribuzione
preferenziale del flusso ematico alla corticale, e dall'azione di mediatori dell'infiammazione44.
1.4 Fisiopatologia dell'interazione cardio-renale
Fattori emodinamici dell'interazione tra cuore e rene
Il peggioramento della funzione renale nel contesto dell'insufficienza cardiaca è stato classicamente attribuito alla riduzione della gittata sistolica e, conseguentemente, della perfusione renale e della velocità di filtrazione glomerulare. Anche la deplezione di volume intravascolare, causata da un eccessivo uso di diuretici, è stata chiamata in causa per spiegare la riduzione della funzionalità renale nei pazienti con scompenso45.
In tempi più recenti, l'interesse della ricerca si è rivolto verso il ruolo della congestione venosa e gli studiosi hanno indagato la relazione tra aumento della pressione di riempimento delle sezioni destre e la funzione renale.
Damman et al hanno analizzato una coorte di pazienti con ipertensione polmonare, che presentavano sia ridotta gittata cardiaca, sia congestione venosa sistemica: i pazienti sono stati sottoposti a cateterismo del cuore destro, con misurazione dei parametri emodinamici (pressione arteriosa media, pressione atriale destra, pressione di incuneamento polmonare, resistenze vascolari polmonari e sistemiche, gittata cardiaca), e a
misurazione del flusso plasmatico renale e del GFR mediante traccianti radio-marcati. La funzionalità renale, espressa come GFR, è risultata inversamente proporzionale alla pressione atriale destra, che costituiva l'unico parametro significativamente associato alla riduzione della filtrazione glomerulare nelle analisi multivariate46.
Figura 3: Prevalenza di peggioramento della funzione renale in pazienti stratificati in base a
pressione venosa centrale (CVP), indice cardiaco (CI), pressione arteriosa sistemica (SBP) e pressione di incuneamento polmonare (PCWP)47.
Mullens e coll hanno nuovamente evidenziato la stretta correlazione tra pressione venosa centrale e funzionalità renale. In pazienti ricoverati per insufficienza cardiaca avanzata, sottoposti a valutazione emodinamica invasiva e a misurazione della pressione di perfusione renale, è stato osservato che la pressione venosa centrale era l'unico parametro emodinamico a costituire un fattore predittivo indipendente per la riduzione della funzionalità renale48.
Già molti anni prima, studi di fisiologia avevano dimostrato in modelli animali che l'incremento della pressione venosa renale, invece di promuovere la filtrazione attraverso un aumento della pressione idrostatica glomerulare, a causa dell'inestensibilità della capsula renale si traduce in una compressione sul tratto tubulare del nefrone, con riduzione del gradiente pressorio attraverso la membrana glomerulare49.
L'incremento della pressione venosa renale risulta dunque in un aumento della pressione interstiziale, che ostacola la filtrazione glomerulare riducendo l'escrezione di sodio e il flusso ematico renale.
Figura 4: Bilancio tra forze favorenti e ostacolanti la filtrazione glomerulare in pazienti con
pressione atriale destra normale e aumentata50.
Un'ulteriore correlazione è stata identificata tra riduzione del filtrato glomerulare ed elevata pressione intra-addominale in pazienti con insufficienza cardiaca: l'ipertensione endo-addominale, studiata approfonditamente in ambito chirurgico, è associata a disfunzione degli organi endoaddominali e in particolare a compromissione renale51, 52.
presenza di versamento ascitico. L'aumento della pressione endo-addominale può agire negativamente sulla funzione renale sia attraverso una riduzione della perfusione glomerulare, sia incrementando la pressione venosa renale, sia esercitando una compressione sull'uretere. Mullens e coll hanno valutato la pressione intra-addominale, misurata per via trans-vescicale, in 40 pazienti con classe funzionale NYHA III-IV: il 60% dei pazienti presentava elevata pressione intra-addominale (> 8 mmHg) e il 10% ipertensione addominale franca (> 12 mmHg), pur in assenza di sintomi addominali; l'elevata pressione addominale è apparsa correlata in modo statisticamente significativo con i livelli basali di creatinina e le variazioni della pressione erano associate a modificazioni concordi della funzione renale, con mantenimento del trend nel follow-up53.
Il ruolo dell'ipertensione venosa nel determinare un'“insufficienza renale congestizia” è stato studiato anche in contesti diversi da quello dello scompenso cardiaco, delucidando ulteriori aspetti fisiopatologici coinvolti in tale fenomeno54.
Figura 5: Meccanismi fisiopatologici proposti nella relazione tra ipertensione venosa,
congestione e disfunzione renale54.
Uno studio recente ha evidenziato l'importanza della congestione venosa sistemica, piuttosto che dell'insufficienza anterograda, nella patogenesi di un danno secondario concomitante a carico del fegato e del rene55.
La conseguenza logica di queste osservazioni sarebbe che l'impostazione di un trattamento volto a preservare la funzione di filtrazione glomerulare si focalizzi sulla risoluzione della congestione venosa e non solo sul miglioramento della perfusione renale.
Fattori neuro-endocrini dell'interazione tra cuore e rene
L'interazione tra cuore e rene appare comunque troppo complessa per essere spiegata in base ai soli meccanismi emodinamici. La fisiopatologia del cross-talk cardio-renale è stata approfonditamente
analizzata da Bongartz e coll., che, estendendo il modello proposto da Guyton, hanno delineato quattro fattori chiave (i “connettori cardio-renali”) che influiscono negativamente sia sul cuore, sia sul rene28.
Guyton aveva descritto il ruolo centrale del rene, del sistema renina-angiotensina e dei suoi antagonisti (peptidi natriuretici, NO) nel regolare il volume dei liquidi extracellulari, la pressione ematica e la gittata cardiaca: questo modello non appariva tuttavia sufficiente a spiegare l'accelerata progressione del danno strutturale e funzionale che si realizza in presenza di una disfunzione combinata del cuore e del rene e l'importante mortalità correlata56.
Bongartz ha identificato nel sistema renina-angiotensina, nello squilibrio tra NO e specie reattive dell'ossigeno (ROS), nell'infiammazione e nell'attivazione del sistema nervoso simpatico i protagonisti dell'interazione fisiopatologica tra insufficienza renale cronica e scompenso cardiaco, delineando una complessa rete in cui i quattro meccanismi interagiscono in modo sinergico57.
Figura 6: Interazione fisiologica (spiegata dal modello di Guyton) e fisiopatologica
Sistema Renina-Angiotensina-Aldosterone
Nell'insufficienza cardiaca, la riduzione dell'indice cardiaco e, conseguentemente, del volume ematico intra-arterioso determina un'inattivazione dei barocettori dell'arco aortico e del seno carotideo, attenuando l'inibizione tonica del parasimpatico afferente sul Sistema Nervoso Centrale e incrementando il tono efferente del sistema simpatico: questo, a sua volta, attiva il sistema renina-angiotensina-aldosterone e stimola il rilascio non-osmotico di ormone anti-diuretico (ADH)58. A livello del glomerulo, l'angiotensina II provoca
vasocostrizione dell'arteriola efferente, decremento del flusso ematico renale e aumento della frazione di filtrazione: ne conseguono un incremento della pressione oncotica e una riduzione della pressione idrostatica nei capillari peritubulari, che si trovano a valle dell'arteriola efferente, per cui si accentua il riassorbimento di sodio dal tubulo prossimale. L'angiotensina II, inoltre, stimola in modo diretto il riassorbimento di sodio nel nefrone prossimale, attivando il co-trasportatore sodio/bicarbonato e lo scambiatore sodio/idrogeno59.
L'aumentato riassorbimento prossimale di sodio riduce il carico idro-sodico che raggiunge il nefrone distale, stimolando la secrezione di renina da parte delle cellule della macula densa e generando così un'amplificazione dell'attivazione neuro-ormonale60. Infine,
l'angiotensina II promuove il rilascio di aldosterone, che induce il riassorbimento di sodio nella parte distale del nefrone.
L'incrementato riassorbimento idrosalino è responsabile del sovraccarico di fluidi, che si ripartisce prevalentemente a carico del sistema venoso.
L'attivazione del sistema renina-angiotensina-aldosterone, oltre a giocare un ruolo centrale nella fisiopatologia dello scompenso cardiaco, è una caratteristica dell'insufficienza renale cronica, in cui si associa a un ipertono del sistema nervoso simpatico. Oltre a promuovere la vasocostrizione e la ritenzione idro-elettrolitica, l'angiotensina II incrementa la produzione di ROS a livello di diversi tipi cellulari, attraverso la stimolazione della NADPH ossidasi. L'alterazione del potenziale redox della cellula, a sua volta, è probabilmente la causa dell'attivazione della via dell'NFκB, che media l'espressione di geni pro- infiammatori57.
Squilibrio NO/ROS
Nella sindrome cardio-renale, il bilancio tra NO (mediatore che induce vasodilatazione, natriuresi ed inibizione del feedback tubulo-glomerulare) e specie reattive dell'ossigeno (tra cui l'anione superossido, che possiede effetti opposti) è a favore di queste ultime. La condizione di stress ossidativo è particolarmente marcata nei pazienti dializzati.
La riduzione dei livelli di NO è dovuta sia all'inattivazione diretta da parte dei ROS, sia all'inibizione della ossido nitrico sintasi (NOS) ad opera della dimetil-arginina asimmetrica (ADMA). L'anione superossido sembra incrementare l'attività del sistema nervoso simpatico; inoltre, l'alterazione di DNA, proteine e lipidi mediata dai ROS genera sostanze dotate di azione pro-infiammatoria. Infine, la deficienza di ossido nitrico può compromettere il flusso ematico a livello della midollare renale61,
mentre il danno ossidativo alle strutture tubulari e interstiziali può alterare il meccanismo di feedback del sistema renina-angiotensina,
incrementando l'attività di quest'ultimo57.
Infiammazione
L'infiammazione è un aspetto caratteristico dell'insufficienza renale terminale e si ipotizza un suo ruolo nell'aggravamento dell'insufficienza cardiaca. Lo stato infiammatorio si associa a un'aumentata produzione di ROS, che a sua volta sensibilizza le cellule all'azione dell'angiotensina II. Inoltre, sembra che le citochine promuovano la produzione di renina, mentre l'infiammazione dell'interstizio peritubulare può contribuire al danno strutturale al livello del rene57.
Evidenze sperimentali e cliniche indicano che nell'insufficienza cardiaca c'è un aumento della produzione e del rilascio di citochine infiammatorie, attivazione del complemento, produzione di auto-anticorpi e iper-espressione del complesso maggiore di istocompatibilità e di molecole di adesione62.
Lo specifico pattern di citochine è altamente dipendente dall'eziologia dell'insufficienza cardiaca e dall'eziologia dipende probabilmente anche lo stimolo che induce l'attivazione del sistema immunitario (ad es. stimolazione antigenica diretta, sovraccarico emodinamico, danno ai miociti, ecc)63.
A livello miocardico, citochine prodotte in altre sedi possono avere effetti negativi sulla contrattilità e produrre danno diretto ai miociti e fibrosi; sia il TNF-α, sia l'IL-6 esercitano un effetto diretto sulle cellule cardiache, probabilmente mediato dall'ossido nitrico, con inibizione della contrattilità e induzione dell'apoptosi63.
Sistema Nervoso Simpatico
Il sistema nervoso simpatico presenta un'incrementata attività sia nell'insufficienza cardiaca, sia nell'insufficienza renale terminale57. Oltre
a stimolare il rilascio di renina, l'attivazione simpatica protratta induce a livello miocardico ipertrofia, apoptosi miocitaria e necrosi focale; a lungo termine si verifica inoltre una desensibilizzazione dei recettori adrenergici, che può essere responsabile della ridotta variabilità della frequenza cardiaca osservata nello scompenso cardiaco64.
A carico del rene, l'attivazione sovra-fisiologica del sistema simpatico causa la contrazione del flusso ematico midollare49.
1.5 Aspetti diagnostici e nuovi marcatori di funzionalità renale
Il riconoscimento dell'importanza della disfunzione renale nell'identificare una popolazione ad altro rischio tra i pazienti con insufficienza cardiaca e del possibile ruolo di variazioni acute della funzionalità renale nel condizionare la prognosi impone la necessità di criteri diagnostici accurati e tempestivi, che permettano di identificare precocemente una sindrome cardio-renale e di impostare strategie di trattamento appropriate nei pazienti più a rischio.
La creatininemia è il parametro più utilizzato nella valutazione clinica della funzionalità renale: la creatinina è una molecola endogena prodotta a velocità pressoché costante ed escreta prevalentemente per filtrazione, nonostante il contributo della secrezione tubulare possa variare dal 10 al 40%. La concentrazione plasmatica di creatinina, comunque, dipende da
numerosi fattori oltre che dalla funzionalità renale e necessita di un tempo prolungato (fino a 7 giorni) per raggiungere lo stato stazionario: per questo motivo, la creatininemia non fornisce informazioni accurate e tempestive sulla funzionalità renale e costituisce principalmente un
marker retrospettivo di danno renale65.
Il GFR è considerato il migliore indice di funzione renale e può essere stimato a partire da marcatori endogeni, prima fra tutti la creatinina sierica, con un buon livello di affidabilità66.
Le due equazioni più utilizzate nella pratica clinica per il calcolo dell'eGFR sono la formula di Cockcroft-Gault e la Modification of Diet in Renal Disease (MDRD); di recente, Matsushita et al hanno proposto una nuova formula (Chronic Kidney Disease Epidemiology
Collaboration, CKD-EPI), che sembrerebbe maggiormente predittiva per
il rischio renale a lungo termine67.
Nello specifico contesto dello scompenso cardiaco, le equazioni che correggono la creatininemia per la superficie corporea sono teoricamente più accurate nella stima del GFR e, in particolare, la MDRD a 6 variabili risulterebbe essere quella con maggior valore predittivo68. Tuttavia, altri
studi hanno fornito risultati contrastanti, indicando in alcuni casi un miglior valore predittivo per la formula di Cockroft-Gault69; Zamora et
al, ad esempio, hanno preso in considerazione le tre formule più frequentemente usate nella pratica clinica per stimare il filtrato glomerulare (Cockcroft-Gault, MDRD-4 e CKD-EPI) e ne hanno confrontato il valore prognostico, analizzando la mortalità in una coorte
di 925 pazienti ambulatoriali con scompenso cardiaco: tutte e tre le equazioni hanno mostrato un alto valore predittivo per la mortalità a lungo termine, con una lieve superiorità per la formula di Cockcroft-Gault70.
Le discrepanze tra i risultati possono comunque essere attribuite alla diversa selezione del campione di pazienti: ad esempio, la formula di Cockcroft-Gault risulta generalmente superiore nei pazienti anziani, nelle donne e in soggetti con basso peso corporeo71.
Nonostante l'eGFR fornisca un'adeguata stima della funzione renale in pazienti stabili, come nel caso delle sindromi cardio-renali di tipo 2 e 4, esso non permette di documentare tempestivamente il peggioramento acuto della funzione renale che si verifica nella sindrome cardio-renale di tipo 1: numerosi biomarker sono stati studiati allo scopo di identificare il danno renale acuto in tempo utile per mettere in atto strategie nefro-protettive.
Cistatina-C
La cistatina-C è un inibitore delle proteinasi a basso peso molecolare, sintetizzato e dismesso nel plasma da tutte le cellule nucleate con velocità costante, liberamente filtrato attraverso la membrana glomerulare e completamente riassorbito e degradato dalle cellule tubulari; i suoi livelli plasmatici non sono influenzati dalla massa corporea, dallo stato nutrizionale, dall'età o dal sesso. Queste proprietà
rendono la cistatina-C potenzialmente utile per la valutazione della funzione renale e la stima del GFR, in particolare in pazienti critici, anziani o pediatrici. Poiché i livelli di cistatina-C si innalzano più precocemente di quelli della creatinina, essa costituisce un promettente
marker di danno renale acuto61.
Uno studio su 292 pazienti ospedalizzati per insufficienza cardiaca acuta ha evidenziato che un incremento dei livelli plasmatici di cistatina-C > 0,3 mg/L, riscontrato a 48 ore dal ricovero, predice con alta specificità (90%) e buona sensibilità (77%) un danno renale acuto; la cistatina-C è risultata superiore alla creatinina plasmatica nel rilevare precocemente il deterioramento della funzione renale, mentre il suo valore predittivo per la mortalità era sovrapponibile a quello di creatininemia ed eGFR72.
Trattandosi di una molecola fisiologicamente implicata nella regolazione del sistema immunitario, la cistatina-C è soggetta a variazioni in modo correlato alla concentrazione sierica di Proteina c-Reattiva; i suoi livelli possono essere inoltre influenzati da terapie immunosoppressive, diabete, disfunzioni della tiroide, terapia corticosteriodea e, potenzialmente, malattie cardiovascolari61.
Lipocalina associata alla Gelatinasi Neutrofila (NGAL)
La NGAL è una proteina espressa e secreta dai neutrofili e da diversi tipi di cellule epiteliali, tra cui gli epatociti e le cellule tubulari renali, in vari stati patologici61; è coinvolta nel danno tubulare di origine ischemica e
nei relativi processi di riparazione e regola il traffico di ioni Ferro.
Diversi studi indicano che la NGAL rappresenta un promettente
biomarker di danno renale acuto, con un buon valore predittivo dei
livelli sierici misurati al momento dell'ospedalizzazione per il susseguente sviluppo di sindrome cardio-renale di tipo 173: uno studio su
91 pazienti con riacutizzazione di scompenso cardiaco ha evidenziato una sensibilità del 100% e una specificità dell'86,7% nel predire il rischio di peggioramento della funzione renale durante il ricovero quando il cut-off per la NGAL sierica era stabilito a 170 ng/mL74.
La concentrazione sierica e urinaria di NGAL è aumentata in pazienti con insufficienza cardiaca cronica ed eGFR solo lievemente ridotto e correla con altri indici di funzionalità renale (creatininemia, Cistatina-C), perciò si ipotizza un suo ruolo nel predire precocemente e in modo sensibile la disfunzione renale progressiva nello scompenso cardiaco cronico75, 76; l'aumento della NGAL nelle urine è ritenuto un indice di
danno diretto alle cellule tubulari, suggerendo che una lesione organica possa sottendere alla disfunzione renale osservata nell'insufficienza cardiaca76: il danno tubulare sembra a sua volta correlato a un
peggioramento della prognosi nei pazienti con scompenso cardiaco, indipendentemente dalla funzione di filtrazione glomerulare77.
Altri markers di danno renale, tra cui la Kidney injury molecule-1 (KIM-1) e la N-acetil-β-D-glucosaminidasi (NAG), sono stati studiati nel contesto dell'insufficienza cardiaca: le concentrazioni urinarie di KIM-1
e di NAG sono risultate predittive per il rischio di morte o riospedalizzazione per scompenso cardiaco, indipendentemente dai valori di GFR77.
Mentre questi nuovi biomarker rappresentano una prospettiva promettente nella diagnosi e nella guida del trattamento delle sindromi cardio-renali, non esiste ancora una standardizzazione delle metodiche di laboratorio utilizzate per la loro misurazione, né un consenso circa i
cut-off da attribuire. È possibile che in futuro la combinazione di indicatori
consolidati e nuovi marker permetta un precoce riconoscimento dei pazienti con sindrome cardio-renale, portando a una limitazione della morbilità e della mortalità.
1.6 Terapia dell'insufficienza cardiaca e funzione renale: diuretici dell'ansa
Il sovraccarico di volume liquido extracellulare e la congestione sono responsabili delle manifestazioni cliniche principali dell'insufficienza cardiaca, tra cui la dispnea, l'aumento ponderale, il turgore giugulare, gli edemi declivi e l'edema polmonare e il trattamento di questi aspetti è di importanza centrale nella gestione dello scompenso: la terapia diuretica rappresenta la pietra angolare del trattamento delle manifestazioni congestizie dello scompenso cardiaco e i diuretici sono somministrati alla grande maggioranza dei pazienti78.
linea di trattamento nella riacutizzazione di scompenso cardiaco ed e attualmente somministrata in circa il 90% dei pazienti ricoverati con questa diagnosi79 la somministrazione endovenosa di furosemide induce
tipicamente un effetto diuretico entro 30 minuti, con picco di azione a 90 minuti; la via endovenosa è preferita rispetto a quella orale in condizioni di acuzie per il più rapido inizio d'azione e perché elimina l'incertezza legata all'assorbimento gastroinetstinale78.
Nonostante il loro uso sia pressoché ubiquitario, non esistono studi prospettici randomizzati che guidino l'uso dei diuretici e, per di più, alcuni dati osservazionali suggeriscono che il loro impiego possa essere dannoso. Le attuali linee guida raccomandano l'impiego in prima linea di diuretici nell'insufficienza cardiaca acuta (intervento di classe I), ma il livello di evidenza con cui sono indicate le modalità di somministrazione e la dose raccomandata è minimo (strength of evidence C, expert
opinion) per la scarsità di trial clinici randomizzati80.
Efficacia dei diuretici dell'ansa: resistenza ai diuretici
Dati provenienti dal Acute Decompensated Heart Failure National
Registry (ADHERE) indicano che fino al 22% dei pazienti con
insufficienza cardiaca acuta, benché trattati con diuretici dell'ansa, non ottengono un calo ponderale nel corso del ricovero81. Non è chiaro se
questo fatto sia dovuto a una reale inefficacia della terapia diuretica in una quota di pazienti, o sia riconducibile a un'applicazione subottimale della terapia diuretica stessa.
La variabilità dell'efficacia della terapia diuretica è attribuibile a diversi meccanismi che complessivamente definiscono la “resistenza ai diuretici”, fenomeno comune tra i pazienti con scompenso cardiaco e inscrivibile nel quadro della sindrome cardio-renale. La resistenza ai diuretici può essere definita come un'inadeguata risposta immediata o nel tempo al diuretico somministrato per os o per via endovenosa in rapporto agli obiettivi terapeutici.
Un primo meccanismo di resistenza è legato al fatto che i diuretici dell'ansa possiedono una dose soglia, il cui superamento è necessario per sortire un effetto farmacodinamico: esiste una relazione di tipo sigmoidale tra la dose di diuretico e l'escrezione urinaria di sodio e cloro. Nel paziente con insufficienza cardiaca, la curva dose-risposta è spostata verso il basso (diminuzione della risposta massima ottenibile) e verso destra (necessità di dosi maggiori per ottenere lo stesso effetto diuretico)82.
I pazienti con insufficienza renale cronica mostrano uno spostamento verso destra (ma non verso il basso) della curva dose-risposta, dovuto alla ridotta secrezione tubulare del farmaco per competizione con altre molecole anioniche e alla minore dose che conseguentemente raggiunge il sito d'azione sul versante luminale delle cellule del tratto ascendente spesso dell'ansa di Henle83.
Figura 7: Curve dose-risposta ai diuretici dell'ansa83.
Contribuisce alla resistenza ai diuretici anche il “braking phenomenon”, riconducibile sia ad alterazioni emodinamiche a livello del glomerulo, sia a cambiamenti adattativi del nefrone distale: entrambi i meccanismi sembrano essere almeno in parte mediati dal sistema renina-angiotensina e dal sistema nervoso simpatico. Le cellule del tubulo contorto distale vanno incontro a ipertrofia in risposta al persistente carico di sodio che raggiunge il nefrone distale: questo porta a un incremento del riassorbimento di sodio, che contrasta l'azione natriuretica prossimale dei diuretici dell'ansa84. Un ulteriore meccanismo di resistenza deriva dalla
ritenzione di sodio “di rimbalzo”, che si verifica quando la concentrazione di diuretico nel fluido intratubulare si riduce al di sotto della soglia terapeutica85.
resistenza ai diuretici, tra cui l'ipotensione, la presenza di sintomatologia congestizia grave, l'iponatriemia, una disfunzione cardiaca di grado severo e una diminuita funzione renale86.
La resistenza ai diuretici può essere vinta ottimizzando la posologia o la modalità di somministrazione, combinando i diuretici dell'ansa con diuretici che agiscano sul tubulo distale87, oppure ricorrendo a tecniche
non farmacologiche di rimozione dei fluidi in eccesso.
Infusione continua di diuretici dell'ansa
Una meta-analisi di numerosi piccoli studi ha suggerito che la furosemide somministrata in infusione sia più efficace e meglio tollerata rispetto alla somministrazione intermittente88 e, in particolare, risulti
superiore nella popolazione di pazienti che presentano una ridotta funzione renale89. Tuttavia, i risultati di questa meta-analisi non sono
conclusivi per l'eterogeneità degli studi presi in considerazione: in particolare, i risultati sono condizionati in modo importante da un singolo studio su 107 pazienti sottoposti a infusione per soli 30 minuti e a concomitante infusione di soluzione salina ipertonica90.
Vari studi retrospettivi che confrontano la somministrazione di furosemide in bolo con quella in infusione mostrano una maggiore efficacia (valutata come volume della diuresi, natriuresi, variazione di peso) e, in certi casi, una minore nefro-tossicità di quest'ultima91, 92, 93; in
particolare, uno studio retrospettivo su 116 pazienti ospedalizzati per riacutizzazione di scompenso cardiaco indicava che i pazienti trattati con
furosemide in infusione avevano una minore durata del ricovero e una minore incidenza di riospedalizzazione entro 30 giorni93.
Il trial “Diuretic Optimization Strategies Evaluation in Acute Heart
Failure” (DOSE), conclusosi nel 2011, è stato il primo studio prospettico
randomizzato in doppio-cieco a confrontare le due modalità di somministrazione della furosemide; lo studio assegnava un totale di 308 pazienti alla somministrazione di furosemide in infusione continua o in bolo a intervalli di 12 ore, con alti o bassi dosaggi. È stato riscontrato che i pazienti che ricevevano furosemide in modo intermittente richiedevano con maggior frequenza un incremento della dose entro 48 ore rispetto a quelli trattati con infusione continua, mentre non sono state riportate differenze statisticamente significative nella valutazione complessiva dei sintomi riportati dal paziente (espressa mediante Visual
Analogue Scale), nel cambiamento della creatininemia dopo 72 ore, nella
perdita di peso e nell'eliminazione netta di liquidi94.
Diuretici dell'ansa e Ultrafiltrazione
Il problema della resistenza ai diuretici ha stimolato un forte interesse nella ricerca di trattamenti alternativi mirati a risolvere il sovraccarico di fluidi con efficacia e sicurezza, senza attivare i meccanismi neuro-ormonali controregolatori50; in passato, l'ultrafiltrazione extracorporea
mediante membrana emodialitica95, 96 e la dialisi peritoneale97 sono state
impiegate nei pazienti con scompenso cardiaco refrattari alla terapia diuretica.
dall'introduzione di macchinari portatili per l'ultrafiltrazione, non basati sull'emodialisi e che possono essere utilizzati al letto del paziente.
Il trial RAPID-CHF (Relief for Acutely Fluid-Overloaded Patients with
Decompensated Congestive Heart Failure) è stato il primo studio
randomizzato che ha messo a confronto l'ultrafiltrazione, in aggiunta alla terapia convenzionale, con la sola terapia abituale in 40 pazienti con scompenso cardiaco: la rimozione di fluidi e il calo ponderale, nonché la risoluzione della sintomatologia dispnoica, sono risultati maggiori nel gruppo sottoposto a ultrafiltrazione98.
Lo studio prospettico UNLOAD (Ultrafiltration Versus Intravenous
Diuretics for Patients Hospitalized for Acute Decompensated Congestive Heart Failure) ha preso in considerazione una più ampia popolazione di
pazienti (N = 200), che sono stati assegnati in modo casuale al trattamento con ultrafiltrazione o con terapia diuretica endovenosa (in infusione continua o intermittente). La perdita di peso dopo 48 ore è risultata superiore, in modo statisticamente significativo, nel gruppo sottoposto a ultrafiltrazione e una minor quota di pazienti trattati con ultrafiltrazione ha richiesto somministrazione di farmaci vasoattivi nelle prime 48 ore; la valutazione della dispnea a 8 e 48 ore non ha evidenziato differenze nei due gruppi. Non sono state riscontrate differenze nella variazione della creatininemia e la percentuale dei pazienti con elevazione dei livelli di creatinina > 0,3 mg/dL era simile nei due gruppi. Dopo 90 giorni dalla dimissione, i pazienti sottoposti a ultrafiltrazione mostravano una minore incidenza di riospedalizzazione
per insufficienza cardiaca (18% contro 32%) e un minor ricorso a visite non programmate o accessi in Pronto Soccorso (21% contro 44%)99.
Un recente trial randomizzato su 118 pazienti con riacutizzazione di scompenso cardiaco, deterioramento della funzione renale e segni di congestione persistente ha portato a conclusioni opposte. I pazienti sono stati trattati con ultrafiltrazione o con terapia farmacologica incrementale: il trattamento con ultrafiltrazione si è dimostrato inferiore dal punto di vista dell'impatto sulla funzione renale, con un incremento medio della creatininemia di 0,23 mg/dL, laddove il gruppo che riceveva terapia farmacologica mostrava una lieve riduzione dei livelli di creatinina; la perdita di peso e la quota di fluidi rimossi non differivano significativamente tra i due gruppi, ma il gruppo sottoposto a ultrafiltrazione mostrava una più alta percentuale di eventi avversi gravi (72% vs. 57%, P = 0.03)100.
Complessivamente, questi studi non permettono di trarre conclusioni circa la maggiore o minore efficacia dell'ultrafiltrazione rispetto alla terapia diuretica, poiché quest'ultima e somministrata con modalità e dosaggi eterogenei. I vantaggi teorici dell'ultrafiltrazione risiedono nella possibilità di un accurato controllo del volume di fluidi sottratti, una maggiore rimozione di sodio a parità di volume rimosso, il ridotto rischio di squilibri elettrolitici, l'efficacia in pazienti con resistenza alla terapia diuretica, la minore attivazione a lungo termine dell'asse renina-angiotensina-aldosterone e la possibilità di ripristinare la risposta ai diuretici dopo un periodo di sospensione. Gli aspetti negativi di questo
tipo di trattamento sono la necessità di terapia anticoagulante sistemica, le complicanze legate all'accesso venoso, il rischio di ipovolemia e di riduzione della funzione renale, gli alti costi e la necessità di un operatore con esperienza nei trattamenti extracorporei86.
Le attuali linee guida suggeriscono di prendere in considerazione l'ultrafiltrazione una volta che l'ottimizzazione della terapia diuretica associata a restrizione idro-sodica abbia fallito101.
Sicurezza dei diuretici dell'ansa
Uno studio del 2002 ha individuato nella resistenza ai diuretici un indicatore prognostico che correla con il rischio di morte nei pazienti con scompenso cardiaco cronico: poiché la resistenza ai diuretici può essere superata con l'impiego di dosi maggiori di farmaco, ne risulta un'associazione indipendente tra assunzione di alte dosi di diuretici e mortalità102.
Una varietà di studi ha richiamato l'attenzione sull'associazione tra somministrazione di alte dosi di diuretici e peggioramento della funzione renale103, che potrebbe rappresentare un meccanismo attraverso il quale i
diuretici dell'ansa ad alti dosaggi determinano un peggioramento dell'outcome.
La correlazione tra alte dosi di diuretici e outcome avverso nei pazienti con riacutizzazione di scompenso cardiaco104, 105 e in pazienti
ambulatoriali102, 106, 107 con insufficienza cardiaca di grado avanzato è stata
evidenziata da vari studi; in particolare, l'analisi dei risultati del trial ESCAPE (Evaluation Study of Congestive Heart Failure and Pulmonary
Artery Catheterization Effectiveness) ha riportato una relazione
pressoché lineare tra la dose di diuretici dell'ansa e mortalità a 6 mesi in pazienti ospedalizzati per insufficienza cardiaca di grado avanzato108.
Nonostante questi studi sembrino suggerire un ruolo negativo dei diuretici dell'ansa, esistono fattori di confondimento che impediscono una corretta interpretazione dei dati: i pazienti che ricevono più alti dosaggi di diuretici hanno una malattia di stadio più avanzato rispetto a quelli che possono essere trattati con successo con dosi minori: è probabile dunque che il dosaggio di diuretico funga da indicatore surrogato della gravità dello scompenso109.
Nel 2011, uno studio prospettico randomizzato condotto su 308 pazienti con riacutizzazione di insufficienza cardiaca (trial DOSE) ha confrontato il trattamento con basse dosi (equivalenti al dosaggio che il paziente assumeva abitualmente in precedenza) di furosemide con il trattamento ad alte dosi (pari a 2,5 volte la dose precedentemente assunta per via orale): il confronto ha evidenziato una più efficace risoluzione della congestione, valutata come perdita netta di liquidi, calo ponderale e sollievo dalla dispnea, nel gruppo di pazienti trattati con alte dosi, che però manifestavano con maggior frequenza (23% contro 14%) un transitorio peggioramento della funzione renale. Contrariamente a quanto dedotto dai precedenti studi, i pazienti trattati con alte dosi di
furosemide hanno mostrato una minore incidenza di eventi avversi gravi, tra cui aritmie, infarto del miocardio e insufficienza renale. Una rivalutazione dopo 60 giorni dalla dimissione non ha evidenziato differenze nell'outcome dei pazienti trattati con alte e basse dosi94.
È possibile che il peggioramento della funzione renale che si accompagna a una terapia diuretica più aggressiva sia transitorio in una certa quota di pazienti e non abbia impatto a lungo termine sulla prognosi; nel 2010, Aronson e coll avevano confrontato le implicazioni di un transitorio peggioramento della funzione renale, riscontrato durante il ricovero per scompenso cardiaco acuto, con quelle dell'insufficienza renale persistente e avevano riscontrato che la mortalità durante il
follow-up, laddove nettamente superiore nei pazienti con peggioramento
persistente della funzione renale (46,1%), non differiva significativamente tra i pazienti senza peggioramento (17,3%) o con riduzione transitoria (20,5%) della filtrazione glomerulare110.
La possibilità di un'azione dannosa dei diuretici dell'ansa viene ricondotta a vari meccanismi fisiopatologici: la somministrazione di diuretici in pazienti con scompenso cardiaco induce attivazione del sistema renina-angiotensina-aldosterone e del sistema nervoso simpatico, che giocano un ruolo chiave nella progressione dello scompenso111;
l'attivazione dell'asse contro-regolatorio sembra avvenire non solo attraverso un meccanismo emodinamico, ma anche mediante una stimolazione diretta del rilascio di renina data dal blocco del riassorbimento di cloruro di sodio al livello della macula densa e una
sovra-regolazione dell'espressione del gene della renina112. Questi
meccanismi possono rendere conto delle osservazioni secondo le quali i diuretici dell'ansa comporterebbero un incremento delle resistenze vascolari sistemiche e indurrebbero un iniziale incremento delle pressioni di riempimento111.
Il peggioramento della funzione renale è stato attribuito ad alterazioni del flusso plasmatico renale e della pressione di filtrazione glomerulare; tuttavia, diversamente dalle altre classi di diuretici, i diuretici dell'ansa tendono a preservare la velocità di filtrazione glomerulare e il flusso ematico renale, nonostante questi possano diminuire in risposta a una contrazione del volume di fluidi extracellulare83.
Una terapia diuretica eccessivamente aggressiva può condurre a una deplezione di volume intravascolare, che a sua volta può essere causa di deterioramento della funzione renale; se la velocità della diuresi supera quella con cui i liquidi extravascolari sono richiamati all'interno dei vasi, si assiste a una transitoria emoconcentrazione, segnalata dall'aumento dell'ematocrito e della concentrazione di proteine plasmatiche.
Testani e coll hanno preso in considerazione l'associazione tra emoconcentrazione, decremento della filtrazione glomerulare e outcome a lungo termine nei pazienti del trial ESCAPE: l'incremento dell'ematocrito o dell'albuminemia tra il ricovero e la dimissione è risultato associato in maniera statisticamente significativa alla somministrazione di dosi più alte di diuretici, a un maggior calo ponderale e a una maggiore riduzione delle pressioni di riempimento;
inoltre, l'emoconcentrazione appariva fortemente correlata al peggioramento della funzione renale, con Odds Ratio = 5,3. Il dato più sorprendente che è emerso da questo studio è stata, comunque, la significativa riduzione della mortalità a 180 giorni nel gruppo di pazienti con emoconcentrazione (Hazard Ratio = 0,31); una volta stratificati i pazienti per le caratteristiche di base, l'associazione con la ridotta mortalità è risultata rinforzata, poiché i pazienti di questo gruppo avevano in media una malattia di stadio più avanzato109, 113 .
In quest'ottica, il trattamento diuretico aggressivo può essere considerato almeno in parte responsabile dell'associazione tra emoconcentrazione e miglioramento della sopravvivenza; questa conclusione è in accordo con l'ipotesi secondo la quale pazienti dimessi con incompleta risoluzione del quadro congestizio ed elevate pressioni di riempimento siano a maggior rischio di mortalità114, 115116.