Università degli Studi di Pisa
Facoltà di Scienze Matematiche Fisiche e Naturali
Corso di laurea in Scienze Fisiopatologiche Generali
Tesi di laurea:
“Messa a punto di un metodo per la determinazione di
isoforme di γ-glutammiltransferasi nel siero”
Candidato
Ghiri Emiliano
Relatori
Prof. Aldo Paolicchi
Dr. Emilia Bramanti
Indice
Riassunto VII Abstract VIII Abbreviazioni X1. Introduzione
1 1.1 γ-glutammiltransferasi 1 1.1.1 Localizzazione e struttura 1 1.1.2 Espressione genica, biosintesi e processamento della GGT3
1.2 Attività catalitica della GGT 5
1.3 Il glutatione 6
1.4 Funzioni della γ-glutammiltransferasi 9 1.4.1 Metabolismo del glutatione e funzione antiossidante 9
1.4.2 Escrezione degli acidi biliari 10 1.4.3 Azione proosidante della GGT 11
1.4.4 Effetti della GGT sulle lipoproteine LDL 14 1.4.5 Azione modulatoria della GGT 15 1.4.6 Modulazione della proliferazione cellulare e dell’apoptosi 18
1.4.7 Metabolismo dei leucotrieni 19
1.4.8 Metabolismo dell’S-nitrosoglutatione (GSNO) 22
1.5 GGT sierica e malattie cardiovascolari 23
1.6 GGT nella placca 28
1.7 Metodi per la separazione e caratterizzazione delle isoforme di
GGT sierica 30
2. Scopo della tesi
373. Materiali e metodi
393.1 Reattivi chimici 39
3.3 Condizioni cromatografiche 40
3.4 Apparato per la determinazione on-line delle frazioni di GGT 41
4. Risultati
4.1 Ottimizzazione delle condizioni di reazione on-line post.colonna 44 4.1.1 Ottimizzazione della concentrazione di substrato 44 4.1.2 Curve di calibrazione della GGT bovina a varie
concentrazioni di γ-glutammil 7-amido 4-metilcumarina 46 4.1.3 Ottimizzazione della concentrazione dell’accettore,
Glicilglicina (GlyGly) 48
4.1.4 Ottimizzazione della spira di reazione 49 4.1.5 Ottimizzazione della durata della reazione post-colonna 52
4.1.6 Curva di calibrazione in flow-injection della GGT bovina nelle
condizioni ottimizzate 53
4.2 Applicazione del metodo alla determinazione di frazioni di GGT nel
4.3 Applicazione del metodo all’analisi del plasma di quaranta donatori sani 61 5. Conclusioni 66 6. Bibliografia 70
Riassunto
La rilevanza clinica della γ-glutammiltrasferasi sierica (sGGT) è recentemente aumentata a causa di numerose associazioni epidemiologiche oltre a quelle della patologia epatica. Il test della determinazione della GGT sierica totale risulta aspecifico in quanto numerosi fattori patologici e fisiologici concorrono ad alterarne il valore.
In questo lavoro di tesi è stata messa a punto una metodologia basata sulla cromatografia in gel filtrazione seguita dall’iniezione post-colonna di un substrato fluorescente per la GGT (γ-glutammil 7-amido 4-metilcumarina), un metodo che permette la quantificazione delle frazioni di GGT nel plasma.
Sono state ottimizzate le condizioni di reazione post-colonna (concentrazione di substrato e di accettore, tempo della reazione, geometria e materiale della spira di reazione). La distribuzione dei pesi molecolari è stata analizzata in volontari sani (20 maschi; età media (SD) 38 (10) anni; femmine; 44 (13) anni; GGT totale rispettivamente 21 (11) e 13 (7), P< 0.01).
Questo metodo risulta sensibile (limite di determinazione: 0.5 U/L) con un range dinamico lineare tra 0.5 e 150 U/L per tutte le frazioni. Sono state individuate quattro frazioni in tutti i soggetti, in entrambi i sessi. Il volume di eluizione dalla colonna non varia per le singole frazioni ed è stato possibile determinarne il peso molecolare. Le frazione sono state nominate big-GGT (b-GGT), medium-GGT (m-GGT), small-GGT (s-GGT) associate a lipoproteine, PM>2000, 940, 140 KDa rispettivamente, e una frazione libera nel plasma (f-GGT, 70 KDa).
Questa tecnica permette l’identificazione delle specifiche frazioni di GGT, ciò può aumentare la sensibilità e la specificità del test di determinazione della GGT.
Abstract
Clinical relevance of serum γ-glutamyltransferase (GGT) activity has been recently increased by several epidemiological associations, other than with hepatic function. Still, GGT remains a non-specific test, due to the influence of various pathophysiological factors.
In my thesis I optimized a procedure based on gel filtration chromatography, followed by post-column injection of fluorescent GGT substrate (γ-glutamyl 7-amido 4-methylcoumarine) permitting the quantification of GGT fractions in serum or plasma. I optimized the reaction conditions of post-column (GGT substrate and acceptor concentration, time of the reaction, geometry and material of the reaction coil). Plasma GGT molecular weight distribution was analyzed in healthy volunteers (20 males; mean (SD) age 38 (10) years; 20 females; age 44 (13); total GGT 21 (11) vs 13 (7), respectively, P <0.01). Clinical relevance of serum γ-glutamyltransferase (GGT) activity has been recently increased by several epidemiological associations, other than with hepatic function. Still, GGT remains a non-specific test, due to the influence of various pathophysiological factors.
This method is highly sensitive (determination limit: 0.5 U GGT/L), with a linear dynamic range between 0.5 and 150 U/L for each fraction. Four GGT fractions were found in all subjects in both genders, different for molecular
weight (MW): b-GGT, m-GGT, s-GGT (likely lipoprotein-bound, MW >2000, 940, 140 kDa, respectively), and a free fraction (f-GGT, 70 kDa). This novel technique permits the identification of specific GGT fractions. GGT fraction analysis might increase the sensitivity and specificity of GGT activity test.
Abbreviazioni
AMC 7-Amino 4-Metilcumarina
γ-GluAMC γ-glutammil 7-Amino 4-Metilcumarina GSH Glutatione ridotto
GGT Gamma-glutammiltransferasi
sGGT Gamma-glutammiltransferasi sierica GlyGly GlicilGlicina
HDL Lipoproteine ad alta densità
LDL Lipoproteine a bassa densità VLDL Lipoproteine a densità molto bassa LTs Leucotrieni GSNO S-Nitrosoglutatione Cys-Gly CisteinilGlicina b-GGT Big GGT m-GGT Medium GGT s-GGT Small GGT f-GGT Free GGT
1.Introduzione
1.1 γ-glutammiltransferasi
1.1.1 Localizzazione e struttura
La γ-glutamil-transferasi (GGT) è un enzima localizzato sulla membrana plasmatica di molti tipi cellulari che catalizza il primo passaggio del processo di idrolisi del glutatione (GSH) attraverso la scissione del legame γ-glutammilico (Tate e Meister, 1981).
In condizioni fisiologiche la GGT è presente preferenzialmente a livello di tessuti epiteliali implicati in attività secretorie e di assorbimento. La più alta attività di GGT è stata trovata nel rene, sulla superficie luminale delle cellule del tubulo convoluto prossimale, mentre le cellule del tubulo distale e dei glomeruli ne sono praticamente prive. Nel fegato la GGT è concentrata nelle cellule epiteliali delle vie biliari extraepatiche e dei canalicoli epatici. Nel pancreas la maggiore attività di GGT è presente nelle cellule acinose. Studi immunoistochimici hanno dimostrato che sono GGT positive anche le cellule endoteliali dei capillari del cervello (es. del plesso corioideo e del corpo ciliare) e del midollo spinale, le cellule delle ghiandole sudoripare, delle ghiandole sottomandibolari, dei dotti galattofori, dell’epitelio bronchiale, dell’epididimo, delle vescicole seminali, della prostata (Hanigan e Pitot, 1985; Hanigan e Frierson, 1996).
Durante la vita fetale la GGT è presente anche a livello degli epatociti, dai quali però scompare entro i primi 2/3 giorni dopo la nascita. La GGT presente nel
siero è quella rilasciata dalle membrane cellulari dei parenchimi dei vari organi, di conseguenza le sue variazioni riflettono le modificazioni quantitative della produzione e del rilascio dell’enzima nel sangue (Iannaccone e Koizumi, 1983). Dal punto di vista strutturale, la GGT è una glicoproteina dimerica sintetizzata a partire da un unico propeptide (Curthoys e Hughey, 1979) che viene scisso in 2 subunità mature, una pesante (55-62 KDa) e una leggera (20-30 KDa), prima di raggiungere la membrana plasmatica (Barouki et al., 1984; Finidori et al., 1984); Sulla porzione ammino-terminale della catena pesante è presente un dominio idrofobico che permette l’inserzione dell’enzima sul lato esterno della membrana cellulare, la subunità leggera, che presenta un ectodominio carbossi-terminale con attività catalitica, è unita alla subunità pesante tramite interazioni elettrostatiche (Tate e Meister, 1981); in questo modo entrambe le subunità risultano in contatto con l’ambiente extracellulare (Fig 1.1) (Finidori et al., 1984).
Fig 1.1 Rappresentazione della GGT. Il sito catalitico dell’enzima è sulla subunità leggera situata sul lato extra-cellulare della membrana. La GGT pertanto agisce su substrati extra-cellulari. (Hanigan,1998).
Il sito catalitico dell’enzima è situato sulla subunità leggera permettendo alla GGT di agire su substrati extracellulari.
Gardell e Tate (1979) hanno dimostrato in particolari condizioni sperimentali che la subunità leggera della GGT purificata dal rene di ratto, di bovino e di coniglio è una proteasi, infatti è in grado di idrolizzare la stessa.
1.1.2 Espressione genica, biosintesi e processamento della GGT.
Nel genoma umano è presente una famiglia multigenica per la GGT, composta da almeno sette membri (Courtay et al., 1994), mappati sul cromosoma 22 nella regione 22q11.1-q11.2 vicino ai loci BCR (breakpoint cluster region) e IG-λ (Bulle et al., 1987; Collins et al., 1997). Sequenze correlate, probabilmente pseudogeni, sono state identificate sui cromosomi 18, 19, 20 (Figlewicz et al., 1993).
In una genoteca umana, costituita con DNA estratto da una linea cellulare di linfoblasti cariotipicamente normali, sono stati identificati dei cloni rappresentati da tutti i sette geni, ciò esclude che questi sette tipi di cloni genomici siano alleli di un singolo gene altamente polimorfico (Courtay et al., 1994). Di questi sette geni è stata analizzata l’espressione e per cinque di essi è stato individuato l’RNA, ma tra questi solo il gene I ha espressione ubiquitaria e dà origine ad una proteina completa e funzionale. Per gli altri quattro geni espressi non è stata ancora identificata la relativa proteina (Courtay et al., 1994). Studi di traduzione in vitro hanno permesso di stabilire che l’mRNA di tipo I completo è tradotto in un unico propeptide senza attività di GGT. La sequenza
idrofobica all’estremità amminica permette alla proteina di essere traslocata nel lume del reticolo endoplasmatico.
Nel 1995, Branningan et al. hanno riconosciuto una superfamiglia di proteine chiamate idrolasi nucleofile N-terminali (Nucleofilo N-ter). Questa superfamiglia è caratterizzata da una struttura αββα nel sito catalitico. Tutte le idrolasi nucleofile N-terminali vengono trascritte e tradotte in un singolo propeptide processato autocataliticamente ad enzima attivo contenente un nucleofilo localizzato all’estremità N-terminale, il quale catalizza l’idrolisi del legame amminico.
Tra i membri di questa superfamiglia si ricordano la penicillina G amilasi, il proteasoma, l’aspartilglucosaminidasi, la glutammica PRPP aminotrasferasi (GAT) e l’ L-amminopeptidasi-D-Ala-esterasi/amidasi (Oinonen and Rouvinen, 2000).
La GGT avendo tutte le caratteristiche appena menzionate può essere considerata un membro della superfamiglia delle idrolasi nucleofile N-terminali (Suzuki and Kumagai, 2002) infatti:
1. L’analisi della struttura cristallizzata della GGT di E.Coli mostra la presenza del core strutturale αββα (Okada et al., 2006).
2. L’mRNA della GGT è trascritto e tradotto come un singolo propeptide (Barouki et al., 1984) di 569 amminoacidi idrolizzato a dare uno eterodimero stabile con una subunità pesante (HSU, anfipatica, 380 amminoacidi) e una subunità leggera (LSU, di 189 amminoacidi). Il taglio proteolitico avviene quando la
GGT è ancora all’interno del reticolo endoplasmatico (Kinlough et al., 2005) attraverso un processo autocatalitico.
3. La Treonina N-terminale, il primo amminoacido di LSU è il nucleofilo catalitico (Inoue et al., 2000; Kinlough et al., 2005).
4. La GGT idrolizza il legame ammidico tra il gruppo carbossile in posizione γ dell’acido glutammico e un gruppo amminico.
1.2 Attività catalitica della GGT
La GGT catalizza l’idrolisi di γ-glutamil composti attraverso il trasferimento del gruppo γ-glutammilico da un substrato donatore al gruppo amminico di un accettore amminoacidico o dipeptidico (Curthoys e Hughey,1979) (fig.1.2).
Fig1.2. Reazione catalizzata dalla GGT. (Hanigan, 1998).
I principali accettori del gruppo γ-glutammilico sono: L-cisteina, L-glutammato, L-alanilglicina, glicilglicina, L-serilglicina (Griffith et al., 1979; Tate e Meister, 1981). Il glutatione è il più significativo substrato fisiologico dell’enzima, ma la GGT può agire su un’ampia varietà di γ-glutammil composti (Magnan et al., 1982).
Diverse sostanze sono in grado di inibire l’attività catalitica della GGT (Meister, 1983), tra queste troviamo l’acivicina [acido L-(αS,5S)-α-ammino-3-cloro-4,5-diidro-5-isossazolo-acetico], un potente inibitore irreversibile della GGT che si lega stabilmente alla serina in posizione 406 sulla catena leggera dell’enzima (Smith et al., 1995) e il complesso serina-borato, che agisce con un meccanismo di inibizione competitiva in quanto la serina mima la struttura α-carbossilica del gruppo γ-glutammilico del substrato (Tate e Meister, 1978).
1.3 Il glutatione
Il glutatione è un tripeptide ubiquitario presente in molte piante, microrganismi e in tutti i tessuti dei mammiferi. Composto da acido glutammico, cisteina e glicina (γ-glutamilcisteinil glicina), presenta la particolare caratteristica di avere i residui di acido glutammico e di cisteina uniti non da un normale legame peptidico, ma da un legame γ-glutammilico: è infatti il gruppo carbossilico (-COOH) sul carbonio γ dell’acido glutammico ad essere legato al gruppo amminico (-NH2) sul carbonio α della cisteina (Fig.1.3.).
Fig. 1.3 Rappresentazione della struttura del glutatione (γ-glutammilcisteinilglicina). La freccia indica il legame γ-glutammilico (Lu, 1999).
Il GSH rappresenta circa l’80% dei tioli non proteici a basso peso molecolare presenti nella cellula ed è distribuito in tre compartimenti: il 90% circa è dislocato a livello citosolico, il 10% nei mitocondri e una residua percentuale nel reticolo endoplasmatico (Meredith e Reed, 1982; Hwang et al., 1992; Lu, 1999).
Il glutatione può esistere in forma ridotta (GSH) e in forma ossidata (GSSG), la forma ossidata deriva dalla formazione di un ponte disolfuro tra due molecole di GSH. La forma ridotta è ampiamente predominante all’interno della cellula, con un rapporto che in condizioni normali è dell’ordine di 1:10/1:100 (Meister e Anderson, 1983; Reed et al., 1983; Lu, 1999). La presenza del gruppo sulfidrilico della cisteina conferisce al GSH proprietà antiossidanti che gli permettono di interagire con specie reattive dell’ossigeno o con altre sostanze elettrofile nell’ambito di numerosi sistemi antiossidanti intracellulari.
Come conseguenza del metabolismo aerobico, gli organismi aerobi sono soggetti ad un certo livello di stress ossidativo fisiologico. Gli intermedi che si formano (perossido di idrogeno ed anione superossido), possono indurre una ulteriore produzione di radicali dell’ossigeno che possono causare danno cellulare e perossidazione lipidica. Il glutatione interviene nel metabolismo dell’acqua ossigenata e di altri perossidi organici operando come substrato degli enzimi della famiglia delle glutatione perossidasi che catalizzano la reazione:
Come risultato si ha la formazione del glutatione nella forma ossidata GSSG, quest’ultimo viene ridotto nuovamente a GSH dall’enzima glutatione reduttasi, a spese di una molecola di NADPH:
GSSG + NADPH + H+ → 2 GSH + NADP+
In severe condizioni di stress ossidativo la cellula può perdere in parte la sua capacità di ridurre il GSSG a GSH, con conseguente accumulo di GSSG nel citosol. In questo caso il GSSG può o essere attivamente trasportato all’esterno della cellula (Sharma et al., 1990), oppure può reagire con i gruppi sulfidrilici delle proteine determinando la formazione di disolfuri misti; quest’ultimi possono determinare l’inattivazione di molti enzimi. Per questo motivo le cellule mantengono livelli intracellulari di GSSG molto bassi in condizioni fisiologiche. Il GSH risulta quindi essenziale per il mantenimento dell’equilibrio redox della cellula (DeLeve e Kaplowitz, 1991; Lu, 1999).
Il GSH interviene anche nella detossificazione dei farmaci xenobiotici e dei loro metaboliti, nella modulazione di importanti processi cellulari (es. sintesi del DNA e risposte immunitarie) e rappresenta una riserva di cisteinil-glicina, che ossidandosi rapidamente nell’ambiente extracellulare, può potenzialmente generare radicali liberi tossici (Meister, 1988; Fernández-Checa et al.,1992; Lu, 1999).
1.4 Funzioni della γ-glutamiltransferasi
1.4.1 Metabolismo del glutatione e funzione antiossidante
La GGT catalizza il primo passaggio nell’idrolisi del GSH extracellulare, altrimenti inattaccabile da qualsiasi altra proteasi. La GGT infatti idrolizzando il legame γ-glutammilico e trasferendo la porzione γ-glutammilica su un accettore amminoacidico o dipeptidico (Meister et al., 1981; Tate e Meister, 1981) genera γ-glutamil-amminoacidi e cisteinil-glicina. I primi vengono trasportati all’interno della cellula e sono il substrato dell’enzima γ-glutamil-ciclotransferasi che li scinde nei corrispettivi amminoacidi (Griffith et al, 1979; Tate e Meister, 1981), e in 5-oxoprolina, la quale può essere nuovamente convertita in acido glutammico dall’enzima 5-oxoprolinasi e usata quindi per la resintesi del GSH intracellulare (Meister e Anderson, 1983). Il dipeptide cisteinil-glicina è idrolizzato dalle dipeptidasi di membrana in cisteina e glicina, che sono riassorbite dalla cellula e possono essere riutilizzate nella sintesi de novo del GSH (Allison e Meister, 1981; Hanigan e Ricketts, 1993). La GGT inoltre favorisce il recupero del GSH perso dalla cellula secondo gradiente di concentrazione. L’insieme delle reazioni collegate all’attività di GGT e quelle che portano alla sintesi ed all’efflusso del GSH costituiscono quello che viene definito il “ciclo del γ-gutammile o ciclo di Meister”
Il GSH è uno degli agenti riducenti più importanti ed è inoltre cofattore degli enzimi coinvolti nel metabolismo dell’acqua ossigenata, di perossidi organici e di radicali liberi. Poiché la GGT dà inizio alla degradazione del GSH
extracellulare rendendo possibile la successiva captazione degli amminoacidi che lo compongono da parte della cellula (ciclo del γ-glutammile), viene considerata un enzima ancillare dei sistemi antiossidanti basati sul GSH; da questo punto di vista l’enzima potrebbe avere un ruolo protettivo contro il danno ossidativo intracellulare (Hanigan e Pitot, 1985; Hanigan, 1998). (Fig 1.4)
Fig 1.4 Ciclo del γ-glutammile (Lieberman et al., 1995)
1.4.2 Escrezione degli acidi biliari
Nel fegato l’attività di GGT è regolata dagli acidi biliari liberi e coniugati. Gli acidi biliari liberi (colato, chenodesossicolato, desossicolato) stimolano l’attività enzimatica della GGT con conseguente incremento delle reazioni di idrolisi e di transpeptidazione del GSH fondamentali per il rifornimento di amminoacidi utilizzati nei processi di coniugazione. Gli acidi biliari coniugati con glicina e taurina stimolano la reazione di idrolisi a livello di dotti biliari, ma inibiscono
quella di transpeptidazione con un meccanismo di feed-back negativo, riducendo così la disponibilità degli amminoacidi necessari per la formazione dei coniugati (Abbott e Meister, 1983).
1.4.3 Azione proossidante della GGT
Le prime evidenze sperimentali di una possibile funzione proossidante della GGT risalgono ad esperimenti condotti in vitro in cui viene descritta la capacità della GGT di determinare la produzione di radicali liberi e specie reattive dell’ossigeno, con conseguenze che portano all’ossidazione delle proteine ed alla perossidazione dei lipidi poliinsaturi della membrana plasmatica.
Questi eventi, che possono innescarsi esclusivamente all’esterno della membrana plasmatica, ma le cui conseguenze si ripercuotono su tutta la cellula, sono basati sulla capacità dei tioli, come il GSH, ma anche dei prodotti derivanti dalla sua idrolisi ad opera della GGT, quali la cisteinil-glicina e la cisteina, di interagire con i metalli di transizione, ed in particolare con il Fe3+ (Stark et al.,1993) (Fig 1.5). Infatti, la dissociazione del gruppo tiolico –SH ad anione tiolato –S¯ consente la cessione, da parte di quest’ultimo, di un elettrone al Fe3+, che viene ridotto a Fe2+, dando luogo contemporaneamente alla formazione di un radicale tiile –S˙.
Il radicale tiile e il Fe2+ sono in grado di innescare una successione di eventi che porta alla produzione di anione superossido e quindi di acqua ossigenata per azione dell’enzima superossido dismutasi. L’anione superossido e l’acqua ossigenata, in presenza di Fe3+, libero (reazione di Fenton) o chelato all’ADP
radicale tiile danno inizio alle reazioni a catena della perossidazione lipidica, con conseguente perdita della struttura e della stabilità della membrana cellulare, nonché delle sue importanti funzioni (Zalit et al., 1996)
LPO OH° + OH- O2
GSH Fe2+-ADP (Haber Weiss reaction)
GGT H+ H2O2 2H+ O2
O2- °
CG CG- Fe3+ O2- ° H2O2 Thiolate anion Superoxide
dismutase
LPO CG° Fe2+ O2
Thiyl radical
Fig.1.5 Reazioni proossidanti conseguenti all’attività della GGT.
La capacità della GGT di stimolare la perossidazione lipidica a seguito del catabolismo del GSH può essere dimostrata in sistemi contenenti complessi di ioni ferrici (Fe3+) come catalizzatori e acido linoleico purificato come substrato perossidabile (Stark et al., 1993). Tutti questi fenomeni, avvenendo all’esterno della cellula, sono al di fuori della portata dei sistemi di difesa in essa contenuti (Maellaro et al., 2000).
Gli effetti proossidanti sono attribuiti prevalentemente alla formazione della cisteinil-glicina e cisteina che riducono il Fe3+ più efficientemente del GSH (Tien et al., 1982; Spear e Aust, 1994; Paolicchi et al., 1999). Usando molecole di GSH modificate in laboratorio, è stato dimostrato che il GSH sarebbe di per sé un riducente del complesso ADP-Fe3+, ma il gruppo α-carbossilico dell’acido
glutammico è in grado di bloccare l’interazione tra il gruppo tiolico ed il Fe3+ (Paolicchi et al., 1999). La massima riduzione del complesso Fe3+-ADP da parte del GSH si osserva in una miscela nella quale sia presente anche la GGT che, rimuovendo l’acido glutammico dal GSH, rende libero il gruppo –SH della cisteinil-glicina di interagire con il Fe3+. Inoltre, poiché il pKa della cisteinil-glicina è più basso di quello del glutatione (6,4 e 8,56 rispettivamente) (Stark et al., 1989), a pH fisiologico la cisteinil-glicina sarà prevalentemente nella forma di anione tiolato (Stark et al., 1993).
La cisteinil-glicina è capace di ridurre il complesso ADP-Fe3+ più efficacemente del GSH formando Fe2+ nella stessa quantità osservata nella miscela contenente GSH e GGT. Risultati simili sono stati ottenuti con la cisteina che viene prodotta dall’idrolisi della cisteinil-glicina operata dalle dipeptidasi di membrana.
L’interazione del GSH con il Fe3+, seppur possibile, è fortemente limitata dalle proprietà chelanti del gruppo α-carbossilico del glutammato (Spears e Aust 1994); in accordo a quanto detto il glutatione-dimetilestere (GSH-DME), un derivato del GSH metilato sul residuo di glutammato, è in grado di promuovere la riduzione del Fe3+ in modo analogo a quanto osservato per cisteina, cisteinil-glicina e complesso GSH-GGT (Paolicchi et al., 1999).
L’azione proossidante della GGT è legata alla presenza di metalli redox attivi nell’ambiente extracellulare, cosa che in vivo è fortemente prevenuta grazie alla formazione di complessi quali ferritina, transferrina e ceruloplasmina che non permettono ai metalli di catalizzare reazioni con radicali liberi. A tal proposito è
interessante osservare che l’attività di GGT è in grado di ridurre e di promuovere il rilascio degli ioni ferro legati alla transferrina (Drozdz et al., 1998; Dominici et al., 2003a) e che l’azione proossidante è stata osservata anche in presenza di ceruloplasmina (Glass e Stark 1997), ovvero due sorgenti fisiologiche di ioni di metalli di transizione. Inoltre il rilascio di ioni ferro dalle loro forme di immagazzinamento è stato osservato in molte condizioni fisiopatologiche, un processo questo che potrebbe rendere i metalli disponibili per promuovere l’azione proossidante della GGT (Paolicchi et al., 2002a).
E’ stato anche osservato che l’attività di GGT può promuovere l’ossidazione GSH-Ferro dipendente delle lipoproteine a bassa densità (LDL) umane isolate promuovendo un processo che si ritiene giocare un ruolo fondamentale nella formazione della placca aterosclerotica e del danno vascolare (Berliner e Heinecke, 1996; Paolicchi et al., 1999).
1.4.4 Effetti della GGT sulle lipoproteine LDL
Come già descritto nel paragrafo 1.4.3 in presenza di Fe2+ l’attività catalitica della GGT promuove la formazione di specie reattive dell’ossigeno (ROS) i quali a loro volta possono causare la perossidazione lipidica (Minotti, 1993). Studi successivi sono stati dedicati a verificare la possibilità che la Cys-Gly prodotta durante il catabolismo del GSH mediato dalla GGT, potesse promuovere la riduzione del ferro e quindi la perossidazione lipidica (Paolicchi et al., 1999). Gli esperimenti mostrano che in miscele di reazione che includono i complessi ADP-Fe3+ e GSH quest’ultimo può ridurre il ferro ma la velocità di
tale reazione aumenta significativamente in presenza di GGT e di GlyGly. Questo effetto è osservato in un intervallo esteso di attività di GGT (0-200 mU/ml) e di concentrazione di GSH (0-2 mM). (Paolicchi et al. 1999).
Esperimenti aggiuntivi hanno indicato che l’ossidazione delle LDL dipendente dal GSH può essere promossa sia dalla GGT in presenza della trasferrina come sorgente di ioni ferro, sia da cellule esprimenti un elevato livello di attività di GGT sulla superficie, come ad esempio le cellule di epatoblastoma (HepG2) o le cellule monoblastoidi (U937) (Paolicchi et al., 1999). Le cellule in questo caso possono essere considerate come sorgente sia di GGT che di GSH, quest’ultimo infatti è normalmente rilasciato dalle cellule (Meister, 1995). Queste ultime due scoperte sono una prima indicazione che l’ossidazione delle LDL mediata dal sistema GSH e GGT possa avvenire in condizioni fisiologiche.
1.4.5 Azione modulatoria della γ-glutamiltransferasi
Le specie reattive dell’ossigeno giocano un ruolo fondamentale nella modulazione di molte funzioni cellulari. In questo contesto la GGT e le reazioni proossidanti, conseguenti alla sua attività enzimatica, possono partecipare alla regolazione del metabolismo cellulare.
L’azione proossidante GSH/GGT dipendente può interferire con lo stato ossido-riduttivo dei gruppi tiolici delle proteine di membrana. Infatti queste sono il bersaglio primario delle molecole proossidanti generate extracellularmente dall’azione della GGT. L’ossidazione dei gruppi sulfidrilici delle proteine è
infatti aumentato in seguito alla stimolazione dell’attività di GGT mentre il processo è prevenuto dalla sua inibizione (Dominici et al. 2003).
Il coinvolgimento dell’H2O2 nel processo è indicato dal fatto che l’ossidazione
dei gruppi sulfidrilici delle proteine è significativamente prevenuta dalla catalasi mentre un decremento della riduzione dei gruppi sulfidrilici delle proteine è dovuto all’inibizione della GGT con acivicina.
L’ossidazione dei tioli proteici della superficie cellulare non sembra essere dovuta alla sola interazione dell’H2O2, prodotta dall’attività della GGT, con i
gruppi sulfidrilici delle proteine (Radi, 1991; Quesada, 1996), ma è anche legata a processi di S-tiolazione proteica promossi dalla GGT.
Il GSSG che si accumula in seguito a condizioni di elevata attività di GGT, può interagire con i residui di cisteina delle proteine: si formano in questo modo dei disolfuri misti tra il glutatione e i gruppi sulfidrilici delle proteine. Il processo, definito S-glutatiolazione, può essere così schematizzato:
GSSG + proteina-SH ↔ proteina-SSG + GSH
Poiché anche altri tioli non proteici, a basso peso molecolare, come cisteina, omocisteina e cisteamina, possono partecipare a questo processo, si parla più in generale di S-tiolazione.
Molti dei gruppi sulfidrilici delle proteine si trovano nei siti attivi degli enzimi, la S-tiolazione ha quindi la duplice funzione di proteggere i sulfidrili delle proteine da un’ossidazione irreversibile mediata dalle specie reattive dell’ossigeno, e di alterare, in modo reversibile, la funzione di certi enzimi
(Coan et al., 1992; Schuppe-Koistinem et al., 1994; Sahaf et al., 2005), infatti la “detiolazione”, processo attraverso cui si ha la riduzione dei disolfuri misti, ne ripristina la funzione alterata (Del Corso et al., 1993; Ravichandran et al., 1994, Cabiscol e Levine, 1996).
Un numero sempre maggiore di molecole è riconosciuto essere modulato tramite S-tiolazione, sia proteine di membrana che proteine citosoliche (Sen e Parker, 2002; Sies e Parker, 2002). La S-glutatiolazione può, infatti, interessare componenti cellulari implicati nella trasduzione di segnali implicati nella proliferazione cellulare, come H-ras (Mallis et al., 2001), la chinasi p59 delle cellule T (Hehner et al., 2000), la fosfatasi PTP1B (Barrett et al., 1999), c-jun (Klatt et al., 1999) NF-kB/p50 (Pineda-Molina et al., 2001) e la caspasi 3, implicata in processi apoptotici (Davis et al., 1997). I residui di cisteina, presenti sul dominio di legame al DNA di p53 possono subire modificazioni derivanti dall’ossidazione, con specifici effetti sulla capacità di legare il DNA (Parks et al., 1997).
In maniera del tutto analoga anche la cisteinil-glicina originatasi dal catabolismo del GSH ad opera della GGT può concorrere alla formazione di ponti disolfuro con le proteine (Pompella et al., 2003; Corti 2005)
La S-cisteinilglicilazione così come la S-tiolazione può assumere due significati. In primo luogo, può essere interpretata come una difesa nei confronti dei danni ossidativi irreversibili (Coan et al., 1992; Thomas et al., 1995; Seres et al., 1996). In quest’ottica, essendo la GGT espressa ad alti livelli sia nei tumori che nelle metastasi, potrebbe contribuire alla resistenza delle cellule cancerogene nei
confronti degli effetti citotossici dello stress ossidativo come nel caso di molti farmaci antitumorali ad attività proossidante (Daufeub et al., 2002; Paolicchi et al., 2002b; Paolicchi et al., 2003). In secondo luogo S-cisteinil-glicilazione può avere una funzione regolatoria. E’ stato osservato che, l’aumento della S-cisteinil-glicilazione comporta una diminuzione della S-glutatiolazione, ciò potrebbe essere considerato un meccanismo mediante il quale le cellule esprimenti attività di GGT, come le cellule tumorali (Tew et. al, 1996), riescono a modulare lo stato redox e la funzione di proteine importanti presenti nella matrice extracellulare e sulla superficie di altri tipi cellulari, quali per es. le cellule del sistema immunitario o endoteliali (Corti et al., 2005).
1.4.6 Modulazione della proliferazione cellulare e dell’apoptosi
Il termine “apoptosi” o morte cellulare programmata è usato per descrivere una serie di processi e cambiamenti morfologici che caratterizzano un nuovo tipo di morte cellulare, fisiologica e non accidentale (Kerr et al., 1972). L’apoptosi ha un importante ruolo biologico di regolazione nella maggior parte dei processi fisiologici come il differenziamento, l’omeostasi e la rimozione di cellule anormali in tutti i tessuti (Granville et al., 1998). Il controllo del meccanismo di morte cellulare programmata è modificato se non addirittura eliminato in cellule tumorali. E’ nota da tempo l’interconnessione tra proliferazione cellulare, regolazione del ciclo e apoptosi, tanto che una disregolazione del ciclo cellulare, peraltro inevitabilmente presente nelle cellule cancerose, può influenzare in maniera diretta la sensibilità della cellula agli stimoli apoptotici (Rudin e
Thompson, 1997). I dati raccolti nel corso di ricerche sulla linea cellulare di carcinoma ovarico umano A2780 hanno messo in evidenza come l’H2O2 e
l’ossidazione dei tioli prodotti dall’attività di GGT durante il catabolismo del GSH svolgono una azione antiproliferativa (Perego et al., 1997), mentre nella linea cellulare U937 di istiocitoma umano, l’H2O2 funzionerebbe come un
segnale antiapoptotico, infatti in questo secondo caso moderate condizioni di stress ossidativo possono neutralizzare gli stimoli apoptotici, e l’inibizione dell’attività di GGT determina arresto della crescita, diminuzione di attività ed espressione della poli (ADP-ribosio) polimerasi, frammentazione del DNA e ingresso della cellula in apoptosi. I bassi livelli di H2O2 prodotti dalla GGT sono
in grado di generare una sorta di “segnale di vita” nelle cellule U 937 al punto di mantenere le cellule in proliferazione e proteggerle dall’apoptosi (Del Bello et al. 1999).
1.4.7 Metabolismo dei leucotrieni
I leucotrieni (LTs) sono una classe di mediatori lipidici derivanti dall’acido
arachidonico prodotti dall’azione dell’enzima lipossigenasi .Questa classe di molecole comprende il diidrossieicosatetraenoato LTB4 e i cisteinil leucotrieni (LTC4 ,LTD4 e LTE4) che rappresentano costituenti biologicamente attivi da tempo conosciuti come “sostanze della risposta breve all’anafilassi”. I leucotrieni, C4 e D4 inclusi, legano specifici recettori sulle cellule muscolari liscie causando prolungata broncocostrizione (Anderson et al., 1982; Bernstrom and Hammarstrom, 1982).Il leucotriene LTC4 è coniugato ad una molecola di
GSH ed è convertito in LTD4 dall’attività enzimatica della GGT ,l’idrolisi del residuo di Gly dall’LTD4 porta alla formazione dell’LTE4 (Lewis et al., 1990). Il metabolismo dei cisteinil-leucotrieni è stato recentemente studiato in tre pazienti con deficienza di GGT (Mayatepek et al., 2004). Questi mostrano incremento nella concentrazione plasmatica e urinaria di LTC4 insieme alla totale assenza di LTD4 e LTE4, mentre la sintesi di LTB4 non varia. La deficienza di GGT può essere considerata come un errore ereditario della sintesi di cisteinil-leucotrieni. La deficienza nella sintesi di LTC4 è associata con una sindrome dello sviluppo che risulta fatale, la quale include una severa ipotonia muscolare, ritardo psicomotorio, sterilità e microcefalia (Mayatepek et al., 1998). Diversi disordini neurologici sono correlabili con la deficienza di GGT, in particolare per quanto riguarda l’associazione della deficienza dell’enzima con il metabolismo dei leucotrieni. Infatti l’eccesso di LTC4 come la mancanza di LTD4 e LTE4 possono contribuire all’insorgenza dei sintomi osservati.
E’ stato dimostrato inoltre che i cisteinil-leucotrieni sono vasocostrittori particolarmente potenti delle arterie coronariche e sono associati con eventi ischemici (Allen et al Circulation, 1998). Inoltre è noto che, inibitori dell’enzima 5-lipoossigenasi e antagonisti dei recettori per i cisteinil-leucotrieni, sono efficaci per ridurre l’estensione dell’infarto e dell’aritmia indotta dalla riperfusione in modelli animali e in ischemie indotte sperimentalmente. Il fatto che il livello di produzione di cisteinil-leucotrieni aumenti nei pazienti con malattia coronarica è un ulteriore prova che i cisteinil-leucotrieni siano effettivamente implicati negli eventi coronarici e cardiaci. Per capire l’effettivo
coinvolgimento dei leucotrieni nella risposta contrattile è stata confrontata l’entità di questo evento con la capacità delle arterie coronariche, arterosclerotiche e non, di legare il LTC4 e il LTD4. Le arterie non
arterosclerotiche non rispondono ai leucotrieni LTC4 e LTD4, questi invece
inducono contrazione dose-dipendente sulle arterie arterosclerotiche, che rispondono con potenti contrazioni al LTC4 e con contrazioni più modeste al
LTD4. L’iper-reattività delle arterie coronariche arterosclerotiche ai leucotrieni
LTC4 e LTD4 non risente dell’azione di mediatori derivati dall’endotelio (Allen
et al Circulation, 1998), ma è piuttosto dovuta ad un aumento del numero dei recettori e quindi al potenziamento del sistema di trasduzione del segnale. Invece non sembrano essere presenti recettori per cisteinil-leucotrieni nelle arterie coronariche non arterosclerotiche come suggerisce l’incapacità di LTC4 e LTD4
di indurre la loro contrazione.
1.4.8 Metabolismo dell’ S-nitrosoglutatione (GSNO)
L’ S-Nitrosoglutatione (GSNO) è un metabolita del GSH e dell’ossido nitrico (Hart, 1985). Il GSNO ha diverse attività farmacologiche; queste comprendono l’inibizione dell’aggregazione piastrinica (De Belder et al., 1994) e l’attivazione della forma solubile di guanilina ciclasi. In aggiunta, il GSNO ha un effetto protettivo nei confronti del danno da riperfusione cardiaca e l’esposizione delle cellule ad agenti ossidanti (Konorev et al., 1995) ed ha anche un duplice ruolo pro o anti-apoptotico, in dipendenza della concentrazione e del tipo cellulare
ma sono ancora poco conosciuti il suo metabolismo ed i meccanismi della sua decomposizione.
Il GSNO fa parte della classe dei composti γ-glutamilici e in quanto tale è un possibile substrato per la GGT. Hogg et al. (1997) hanno infatti dimostrato che in vitro la GGT, in presenza di Gly-Gly come accettore della reazione di transpeptidazione catalizza la conversione del GSNO a S-nitroso-cysteinyl-glycine (CG-SNO) con una Km di 28 µM, mentre la Km per il GSH è di 5-10 µM (Singh et al., 1995). Il CG-SNO in presenza ioni metallici di transizione si dissocia spontaneamente in Cys-Gly e NO.
Zeng et al. (2001) hanno studiato il meccanismo di decomposizione del GSNO usando cellule endoteliali di aorta bovina (BAEC). Essi alla fine hanno concluso che il meccanismo di decomposizione del GSNO mediato da tali cellule endoteliali coimporta la riduzione di disolfuri extracellulari a gruppi sulfidrilici che a loro volta riducono il GSNO. Pertanto questi autori ipotizzano che il GSNO si degradi in seguito ad una modificazione dell’ambiente extracellulare. La GGT potrebbe partecipare a tali modificazioni promuovendo reazioni proossidanti che comportano una modulazione dei gruppi tiolici delle proteine sulla superficie esterna della membrana cellulare (Dominici, 2003; Corti, 2005) .
1.5 GGT sierica e malattie cardiovascolari
La determinazione dei livelli di GGT nel siero o nel plasma è un test impiegato nella valutazione della funzionalità epatica. L’ attività di GGT nel sangue fornisce indicazioni di alterazioni patologiche a livello epatico ed è il parametro di scelta utilizzato nel monitoraggio dell’abuso di alcol. La sua associazione con il rischio di morbilità era inizialmente riportato in questa prospettiva (Kristenson et al., 1980; Peterson et al., 1983). Conigrave et al., (1993) per primi hanno osservato che la GGT potesse avere un valore prognostico indipendentemente da malattie epatiche o dal consumo di alcol. Studi successivi hanno confermato il ruolo della GGT come predittore indipendente di mortalità per tutte le cause. (Brenner et al., 1997; Arndt et al., 1998; Karlson et al., 2000). In particolare per quanto riguarda le malattie cardiovascolari, è stato osservato che i livelli di GGT sierica possono essere correlati con un aumentato rischio di infarto del miocardio. (Betro et al., 1973; Hood et al., 1990; Wannamethee et al., 1995). Questa associazione può essere spiegata in parte dalla già conosciuta correlazione positiva tra la GGT e i noti fattori di rischio coinvolti nella patogenesi dei disordini cardiovascolari, come ad esempio il cambiamento della composizione dei lipidi nel sangue (Van Barnevel et al., 1989; Nilssen et al., 1990; Jousilahti et al., 2000), l’indice di massa corporea (Nilssen et al., 1990; Daeppen et al., 1990), l’ipertensione (Miura et al., 1994; Yamada et al., 1995), l’intolleranza al glucosio (Umeki et al., 1989), l’insulino resistenza (Rantala et al., 2000) e il diabete di tipo 2 (Perry et al., 1998; Lee et al., 2003), mentre
di GGT correlano positivamente anche con nuovi fattori di rischio cone la proteina C-reattiva, il fibrinogeno e gli F2-isoprostani (Lee et al., 2003). E’ importante ricordare che molti degli studi appena menzionati associano l’aumentato rischio con valori sierici di GGT compresi nella fascia di riferimento, e quindi finora considerati non patologici. Di particolare interesse è lo studio di Wannamethee et al. (1995), dove l’attenzione è focalizzata sulle malattie ischemiche del cuore (ischemic heart disease , IHD). In uno studio prospettico su larga scala (7613 uomini di mezza età) i livelli di GGT nell’intervallo fisiologico sono fortemente associati con il rischio di mortalità per tutte le cause e questa osservazione si spiega con l’incremento delle morti per malattie ischemiche del cuore nel quintile superiore della distribuzione della GGT. Dopo aver corretto l’analisi statistica per gli altri fattori di rischio, elevati livelli di GGT (top quintile, > 24 U/L) risultano ancora associati con un significativo aumento di mortalità per tutte le cause e per IHD. L’aumentato rischio di mortalità per IHD risulta più marcato nei pazienti con una manifesta malattia ischemica del cuore al momento del reclutamento e particolarmente in quelli con un precedente infarto del miocardio. Queste osservazioni suggeriscono l’esistenza di un collegamento tra la GGT sierica e l’evoluzione dell’aterosclerosi (Wannamethee et al. 1995). La presunta connessione della GGT con la patologia aterosclerotica ha ricevuto un ulteriore conferma in studi prospettici condotti da Emdin et al. (2001). Lo studio prevedeva un follow-up di sei anni su 469 pazienti con sindrome ischemica e malattia coronarica (CAD) documentata angiograficamente. Dopo correzione per altri fattori di rischio
cardiovascolari (età, fumo di sigaretta, colesterolo, frazione di eiezione del ventricolo sinistro, indice di massa corporea, diabete mellito) e per fattori confondenti (alanina amminotransferasi sierica, consumo di alcol) il valore prognostico dell’attività della GGT sierica per morte cardiaca e infarto non fatale è stato confermato. In particolare, il significato della GGT sierica è più evidente in un sottogruppo di pazienti che risultano più propensi a complicazioni della placca, caratterizzata dall’ associazione di aterosclerosi diffusa (multivessel disease) ed una precedente storia di infarto del miocardio. Il rischio risulta aumentato usando due differenti valori soglia di GGT (25 o 40 U/l) e la maggiorparte degli eventi cardiaci risultano concentrati nei primi tre anni dopo il primo infarto. Il significato prognostico della GGT sierica risulta così correlato con la diffusione delle lesioni aterosclerotiche nelle arterie coronariche. Ancora più interessante, il fatto che il valore prognostico di GGT scompare nei soggetti sottoposti a rivascolarizzazione mediante angioplastica o by-pass, procedure che comportano la stabilizzazione della placca. (Amoroso et al., 2001). Quindi la prognosi sfavorevole segnalata dall’elevata GGT sierica sembra essere applicabile su pazienti con placche vulnerabili, suggerendo che esista una connessione tra la GGT e i processi coinvolti nella destabilizzazione della placca.
Un recente studio prospettico di Ruttmann et al. (2005), condotto su 163944 soggetti adulti austriaci ha definitivamente mostrato che i livelli di GGT nel siero sono un fattore prognostico indipendente per eventi fatali di forme croniche di malattia coronarica (CAD, coronary artery disease) e per eventi cardiaci acuti. Questa conclusione risulta vera per entrambi i sessi con una chiara relazione dose-risposta e una maggiore importanza nei soggetti giovani (età < 60 anni). Ruttmann et al. hanno stabilito che i valori sierici di GGT che assumono significato prognostico per gli eventi cardiovascolari sono compresi nell’intervallo fisiologico. In questo studio sono stati individuati i valori limite sia per i maschi che per le femmine (maschi, 15.5 U/l corrispondenti a 27.6 U/l a 37 °C ; femmine, 10.5 U/l corrispondenti a 18.7 U/l a 37 °C).
Fig 1.6 Correlazione tra la sopravvivenza e il livello di sGGT (A) Sopravvivenza a 6 anni di 168 pazienti con CAD, precedenti infarti al miocardio e multiple vessel disease (119 con GGT sierica >40 U/L; 49>40 U/L) (B) Sopravvivenza a 6 anni di un sottogruppo
della stessa popolazione sottopostosi a rivascolarizzazione tramite angioplastica
Studi epidemiologici successivi hanno ulteriormente confermato il significato prognostico dell’attività sierica di GGT nell’ambito delle malattie cardiovascolari legate ad aterosclerosi. Inoltre la GGT sierica sembra essere un marcatore per l’insorgenza di sindrome metabolica, di diabete di tipo 2 in soggetti obesi e di insufficienza renale. Di seguito sono riportate le principali conclusioni dei suddetti studi:
1. In uomini apparentemente sani (1878 soggetti), la GGT sierica è un forte predittore di eventi coronarici acuti indipendentemente dagli altri fattori di rischio per malattie cardiovascolari. (Meisinger et al., MONICA/KORA study group, Germany).
2. Esiste un associazione indipendente tra la GGT sierica e la malattia coronarica nella popolazione generale. Un’associazione più forte è presente nei soggetti con meno di 60 anni e tra i consumatori di alcol. In particolare la misura della GGT sierica nei soggetti con diabete di tipo 2 può essere di aiuto per valutare il rischio futuro di CAD. (Lee D.H. et al., Finland).
3. I livelli di GGT sierica predicono l’insorgenza della sindrome metabolica, l’incidenza e la morte per malattie cardiovascolari. Si suggerisce che la GGT sia un marcatore del rischio metabolico e cardiovascolare. (Lee D.S. et al., the Framingham Heart Study).
4. E’ stato individuata un’associazione positiva tra l’obesità e il diabete di tipo 2 solo negli individui con GGT nella fascia alta dell’intervallo di riferimento (≥ 36 U/L). Quindi l’attività di GGT associata ai valori di indice di massa corporea permette di individuare soggetti con un alto
5. La GGT sierica sembra essere un marcatore indipendente e precoce di sviluppo di insufficienza renale cronica. (Seungho Ryu, 2007)
1.6 GGT nella placca
Gli studi epidemiologici suggeriscono una correlazione tra la GGT circolante e l’evoluzione dell’aterosclerosi, ma non è ancora conosciuto come i due fenomeni siano connessi. Studi istochimici rivelano un’intensa attività di GGT nel core lipidico di lesioni aterosclerotiche umane, dove sono localizzate anche le cellule schiumose derivate dai macrofagi CD 68+ (Paolicchi et al., 1999; Paolicchi et al., 2004). Attività di GGT è stata trovata co-localizzata con LDL ossidate (Emdin et al., 2002) ed è stata riscontrata in microtrombi aderenti alla superficie dell’ateroma. (Dominici et al., 2003a).
L’origine dell’attività di GGT riscontrata nelle lesioni aterosclerotiche non è comunque chiara. Una possibilità è che l’espressione di GGT sia per qualche ragione aumentata nei macrofagi presenti nell’intima che normalmente esprimono bassi livelli di attività di GGT (Bauvois et al., 1995). Un’alternativa è che l’attività di GGT ritrovata nelle placche aterosclerotiche possa originare dalla GGT circolante, con un meccanismo simile a quello dello stravaso delle lipoproteine LDL nell’intima.
Particolarmente interessante è che la GGT sierica è parzialmente adsorbita con le lipoproteine circolanti, incluse le LDL (Huseby, 1982; Watanabe et al.,
1984). L’associazione della GGT con le lipoproteine potrebbe avvenire tramite il dominio lipofilico localizzato all’estremità ammino-terminale e responsabile della normale inserzione dell’enzima nella membrana plasmatica. Ciò è confermato dal fatto che nell’enzima associato alle LDL è presente la catena pesante della GGT completa del segmento idrofobico N-terminale, il che indica che è coinvolta solo la forma anfipatica dell’enzima. (Paolicchi et al., 2006a).
I dettagli dell’associazione della GGT con le LDL sono stati recentemente studiati in una popolazione di pazienti con malattia delle arterie coronarie (CAD) documentata angiograficamente (Paolicchi et al. 2006a). Sia nei controlli sia nei CAD, la quantità di GGT associata con le β lipoproteine, che includono le LDL, IDL e VLDL, è direttamente proporzionale al livello totale di GGT nel siero; comunque nei pazienti con CAD la frazione di GGT associata con le β- lipoproteine è significativamente più bassa. È stato così proposto che la diminuzione della GGT associata alle β-lipoproteine nei pazienti CAD può essere dovuta: alla riduzione dell’associazione tra la GGT e le LDL; o all’aumentato rilascio della GGT dalle LDL; oppure dall’aumentata internalizzazione dei complessi LDL-GGT all’interno della lesione aterosclerotica. Le lipoproteine LDL potrebbero rappresentare il mezzo di accumulo dell’attività di GGT nella placca.
L’ossidazione delle LDL rappresenta un evento cruciale nella patogenesi dell’aterosclerosi, principalmente nell’iniziazione delle lesioni (Stocker and Keaney, 2004). Ricerche successive hanno comunque mostrato l’implicazione
dei processi ossidativi nell’aterosclerosi. Reazioni di ossido-riduzione sono infatti coinvolte nello stimolare la proliferazione delle cellule muscolari lisce dell’intima, contribuendo sia allo sviluppo che all’espansione della lesione. Il potenziale ruolo della GGT nella patogenesi dell’aterosclerosi è suggerito dalle prove biochimiche che indicano l’azione proossidante della GGT come produttore di agenti ossidanti. Ricerche future stabiliranno se la GGT potrà essere aggiunta alla lista degli enzimi proossidanti presenti nella placca.
1.7 GGT sierica e metodi per la separazione e caratterizzazione delle frazioni di GGT.
Dal 1961 la determinazione della GGT sierica è utilizzata come marcatore diagnostico in numerose disfunzioni epatiche (Szczeklik et al., 1961), neoplasie incluse (Whitfield, 2001). L’attività sierica di GGT è influenzata da varie condizioni sia fisiologiche che patologiche.
Come già detto, nel genoma umano esiste una famiglia di geni per la GGT ma solo il gene I è trascritto e tradotto nella proteina completa e cataliticamente attiva (Courtay et al.,1994). Per cui non esistono isoforme enzimatiche dal punto di vista della struttura proteica, invece la glicosilazione è tessuto specifica e contribuisce all’eterogeneità di peso molecolare e di carica osservate nelle proteine estratte dai vari tessuti (Huseby, 1978).
La GGT sierica presenta forme che differiscono per carica, dimensione e densità in quanto veicolata da vari trasportatori plasmatici. In questi complessi ad alto peso molecolare (> 200000 Da), la GGT sembra essere associata con le lipoproteine del siero, compresi i chilomicroni (Huseby, 1982a; Sacchetti et al., 1988). Una forma idrofilica e solubile della GGT sierica, apparentemente identica a quella ottenuta dopo il trattamento proteolitico utilizzato nel corso di processi di purificazione, è presente in piccola quantità (Huseby,1982a; Huseby, 1982b; Huseby, 1982c).
La maggior parte della GGT sierica è di origine epatica come dimostrato da studi che indicano che la GGT nel siero presenta le stesse caratteristiche molecolari di quella presente nel fegato per quanto riguarda sia il contenuto di residui di acido sialico che il grado di glicosilazione (Huseby, 1982). La misurazione dell’attività sierica della GGT mediante il saggio con il substrato γ-glutamil-p-nitroanilide è un semplice test di laboratorio ed è considerato il marker più sensibile nella diagnosi di colestasi e di altre patologie epatiche, anche indotte dall’alcool o da farmaci. I livelli di GGT sierica sono tuttavia influenzati da molte altre condizioni cliniche, per cui il suo valore diagnostico è limitato e aspecifico. Data l’eterogeneità dell’enzima nel siero sono state messe a punto varie metodologie analitiche basate sulle proprieta’ chimico-fisiche dei complessi con attività di GGT nel tentativo di separare, caratterizzare e determinare le varie frazioni di GGT in relazione ad un quadro clinico specifico.
Le procedure elettroforetiche sono state quelle più comunemente utilizzate in questo ambito di ricerca, in particolare elettroforesi in acetato di cellulosa, in gel d’agarosio e agar, accoppiate alla rivelazione dell’attivita’ di GGT nelle bande mediante substrati cromofori quali: L-γ-glutamil-p-nitroanilide, γ-glutamil-α (o β)–naftilamide, γ-glutamil-7-amido-4-metilcumarina. (γGluAMC, Nemesànszky et al, 1985).
E’ stata anche impiegata la gel cromatografia seguita dalla determinazione nelle frazioni raccolte dell’attivita’ di GGT mediante γGluAMC. Ma questa tecnica risulta molto laboriosa e inappropriata per i laboratori clinici.
Con l’elettroforesi l’utilizzo di diversi supporti e substrati per la rivelazione della GGT porta a cambiamenti nel numero e nella posizione della bande identificate. Infatti, come dimostrato nella tabella e nella figura sottostanti, le bande identificate con lo stesso supporto (acetato di cellulosa) nei soggetti sani variano da due a tre e sono riscontrabili nella regione delle α1 e delle α2
-globuline (Sacchetti et al. 1998). Mentre al variare del supporto e del substrato la variabilità è ancora maggiore e coinvolge sia il numero che la mobilità delle bande. I risultati ottenuti, pertanto, risultano difficilmente comparabili.
Fig 1.7 a. Separazione delle frazioni di GGT con elettroforesi in acetato di cellulosa. In alto sono mostrate le cinque classi di proteine sieriche. Nelle righe successive il pattern nei soggetti sani e con diverse patologie. Le bande a righe rappresentano moderata attività, la banda in grigio rappresenta attività intermedia, le bande con linee incrociate rappresentano elevata attività
Fig 1.7 b. Diverse bande visualizzate al variare del supporto e del substrato rivelatore. 1: L-γ-glutamil-p-nitroanilide, 2: γ-glutamil-β -naftilamide, 3: γ-glutamil-α-naftilamide, 4: γ-glutamil-7-amido-4-metilcumarina.
studio su soggetti normali e pazienti affetti da neoplasia epatica, cirrosi, cirrosi con colestasi intraepatica ed extraepatica, ittero ostruttivo. La composizione isoenzimatica della GGT è stata analizzata prima e dopo la precipitazione di lipoproteine LDL, VLDL, HDL. Con questo metodo sono risultate identificabili diverse frazioni di GGT, due per i soggetti sani, quattro variabili a seconda della patologia per i pazienti. Queste sono state chiamate con il nome della frazione proteica plasmatica con la quale co-migrano (alb-GGT, α1-GGT, α2-GGT, β-GGT, γ-GGT e una forma non migrante dep-GGT).
In tutti i soggetti normali sono state identificate due forme, α1 e α2 GGT . Tutti i
campioni di plasma sono stati poi trattati in modo da favorire la precipitazione delle lipoproteine. La β-GGT, la γ-GGT e la dep-GGT scompaiono dopo la precipitazione delle LDL e delle VLDL, la α1-GGT presente in individui con cirrosi non cambia dopo la precipitazione di LDL e di VLDL ma diminuisce da 150 a 50 U/l dopo la precipitazione delle HDL. Nessun cambiamento veniva invece osservato nelle α1-GGT e α2-GGT nei pazienti sani né per l’alb-GGT presente nel pattern isoenzimatico degli individui con neoplasia al fegato. Ciò ha permesso di indicare con questa tecnica l’associazione di alcune forme di GGT con le lipoproteine in corso di patologie epatobiliari.
Lo studio di Wenham (1985) svolto utilizzando elettroforesi in gel di poliacrilammide e gel cromatografia in Sephacril S300 con raccolta di frazioni evidenzia tre principali frazioni sulla base della massa molecolare.
Una forma ad alta massa molecolare (1000000 Da) la quale eluisce con il volume vuoto nella cromatografia e non migra rimanendo all’origine nella corsa
elettroforetica. Questa forma risulta presente nel siero di soggetti sani ed è la predominante in quello dei pazienti con patologie epatiche ostruttive.
Della forma intermedia (500000-250000 Da), sono state riscontrati due tipi difficilmente distinguibili con l’elettroforesi; banda 2A e banda 2B. La banda 2A, molto eterogenea ,è presente in corso di patologie epatiche, la banda 2B è predominante nei pazienti con ittero dovuto ad ostruzione extraepatica.
Una frazione leggera (120000 Da) risulta idrofilica, diversamente dalle altre due che sono idrofobiche.
Questo studio si è concentrato sulla forma ad alta massa molecolare, è stato possibile osservarne l’aumento in corso di malattie ostruttive extraepatiche. Tuttavia questo studio mostra che anche la banda 2B può essere utilizzata per distinguere l’ostruzione biliare extraepatica dalle altre patologie epatiche e la misurazione concomitante dell’attività di entrambe le forme dell’enzima non aumenta la discriminazione tra pazienti che hanno e che non hanno ittero ostruttivo extraepatico.
Insiemi specifici di isoforme di GGT sono state infine evidenziati nella cirrosi e l’abuso di alcol cronico (Bellini et al., 1997) e nel carcinoma epatocellulare (Pompili et al., 2003).
Nello studio sui danni epatici da abuso di alcol è stata impiegata l’elettroforesi in gel d’agarosio con rivelazione tramite aggiunta di γgluAMC. Sono stati presi in esame cinque gruppi di soggetti: alcolizzati, con epatite cronica, con cirrosi post-epatite, epilettici, sani.
E’ stato possibile identificare 11 bande (denominate 0a, 0b, 1a, 1b, 2a, 2b, 2c, 3a, 3b, 4a. 4b, le quali hanno mobilità elettroforetica decrescente) con pattern diversi intra ed inter-categoria. Sono state identificate 9 bande negli alcolizzati, 10 bande nei soggetti sani, 9 bande nei pazienti con epatite cronica, 10 bande nei pazienti con cirrosi post-epatite, 10 bande negli epilettici.
Nello studio sull’epatocarcinoma (Pompili et al. 2003) è stata impiegata la tecnica dell’elettroforesi in acetato di cellulosa accoppiata alla rivelazione con γ-glutammil 7-amido 4-metilcumarina. In questo caso è stato possibile identificare due isoforme in tutti i campioni analizzati, α1 e α2 e bande addizionali co-migranti con proteine β, γ del siero e con l’albumina solo nei soggetti con patologia epatobiliare.
La alb-GGT risulta un marker diagnostico sia dell’epatocarcinoma che dell’epatocarcinoma come complicanza della cirrosi.
Quindi molti indizi mostrano l’utilità clinica delle diverse frazioni della GGT sierica, specialmente per superare la mancanza di specificità della misurazione dell’attività totale dell’enzima nel sangue. Sfortunatamente le differenti metodologie impiegate per la separazione delle varie forme di iso-GGT mostrano risultati contrastanti per quanto riguarda il numero e l’interpretazione delle frazioni ottenute. Inoltre tali metodologie sono poco adatte ad un laboratorio diagnostico perché lunghe e laboriose.
2. Scopo della tesi
L’aumento dell’attività di GGT è normalmente interpretato come un indice di disfunzione epatobiliare e come un marker non specifico di abuso di alcol. Recenti studi hanno dimostrato che valori elevati di GGT ma tuttavia interni all’intervallo di riferimento sono predittori dell’insorgenza di malattie quali: diabete di tipo 2, sindrome metabolica, ictus, morte cardiaca dovuta ad infarto, patologia renale cronica. Tuttavia la mancanza di specificità della determinazione dei valori di GGT nei confronti della causa di malattia impedisce l’effettivo utilizzo diagnostico di tali valori.
La GGT è presente nel siero come parte di complessi molecolari, con proprietà chimico-fisiche distinte, alcuni di questi sono associati a precise patologie, come l’ittero intra ed extra-epatico, il carcinoma epatocellulare, la cirrosi e i danni epatici da alcol. Sfortunatamente, la bassa sensibilità e riproducibilità delle procedure adottate fino ad ora per separare e identificare le diverse frazioni di GGT sierica non hanno permesso di mettere a punto una procedura diagnostica da affiancare alla determinazione del valore totale di GGT.
Lo scopo di questa tesi è stato quello di sviluppare una nuova metodologia per la determinazione delle frazioni di GGT serica.
Il nuovo metodo si basa sull’impiego della cromatografia liquida allo scopo di separare le diverse frazioni di GGT sulla base del loro peso molecolare, accoppiata ad una reazione enzimatica post-colonna in cui un substrato
fluorescente (γ-glutamyl-7-amido-4-methylcoumarine, γGluAMC) viene idrolizzato secondo la reazione:
γ-Glu-AMC + GlyGly γ-Glu-GlyGly + AMC
Dove la GlyGly, presente nel tampone di corsa, costituisce l’accettore della reazione.
Il prodotto dell’idrolisi enzimatica (7-amino-4-methylcoumarine, AMC) viene rivelato fluorimetricamente con λex=380 nm e λem=440 nm.
Il nuovo metodo deve:
• permettere l’analisi dell’enzima in forma nativa, senza la necessita’ di proteolizzare il vettore plasmatico superando così un limite di alcune tecniche usate precedentemente quali la cromatografia per affinità e la cromatografia per gel-filtrazione;
• essere veloce e prevedere una semplice procedura di preparazione del campione;
3. Materiali e metodi
3.1 Reattivi chimici
γ-Glutamil-7-amido-4-metilcumarina (γGluAMC, G7261), Glicilglicina (GlyGly, G1002), γ-glutamiltransferasi bovina (G8040), Kit proteine a peso molecolare noto (Sigma-Aldrich; MWGF1000; bludestrano, apoferritina, anidrasi carbonica, BSA , albumina umana). I reagenti chimici sono stati utilizzati senza essere stati ulteriormente purificati.
La soluzione madre di γGluAMC è stata preparata settimanalmente alla concentrazione di 3.6 mmol/L disciolta in NaOH 0.005 N e subito diluita 20 volte in tampone Tris-HCl, 0.25 M, pH 8.5 e suddivisa in aliquote da 50 ml conservate al buio a 4°C. La soluzione di substrato è stata protetta dalla luce anche in fase di utilizzo.
3.2 Preparazione dei campioni di plasma
I campioni di sangue sono ottenuti da 40 donatori di sangue (20 maschi e 20 femmine), il prelievo viene effettuato a digiuno tra le ore 8:00 e le ore 9:00. L’età media dei maschi è 38 ± 10 anni (intervallo 21 - 54); mentre per le femmine è di 44 ± 13 anni (intervallo 22 - 60 ). I donatori hanno valori di GGT: maschi: 6 - 47 U/L, femmine: 6 – 34 U/l. I campioni di sangue, raccolti in presenza di EDTA come anticoagulante, sono centrifugati a 1500 x g per 15 minuti, a temperatura ambiente. Il plasma così ottenuto è raccolto, conservato a
Prima dell’iniezione i campioni vengono nuovamente centrifugati (10000 x g , 10 min , a 4 oC) o filtrati con un filtro PVDF ( Millipore ), 0.45 µm di larghezza delle maglie. Il plasma così preparato è diluito due volte in tampone sodio fosfato (pH 7.4) e iniettato.
3.3 Condizioni cromatografiche
Per le analisi e’ stata impiegata una pompa HPLC Gold apparatus (Beckman 126) equipaggiata con una spira di iniezione di 100 µl (iniettore Rheodyne 7200) e un rivelatore spettrofluorimetrico (821-FP, Jasco).
Nelle condizioni finali ottimizzate in questo lavoro di tesi la separazione è stata messa a punto tramite la cromatografia in gel-filtrazione, fatta impiegando una colonna Superose 6 HR 10/300 GL (GE Healthcare, V=25 mL), in grado di separare ed identificare proteine con peso molecolare compreso tra 5 e 5000 KDa. La fase stazionaria della colonna e’ costituita da gel a diversa porosità: le molecole con dimensioni molecolari minori si inseriscono nei pori della fase stazionaria e avendo un volume maggiore da percorrere presentano tempi di ritenzioni piu’ lunghi. Molecole con pesi molecolari maggiori non si inseriscono nei pori, seguono un percorso piu’ breve e presentano, pertanto, tempi di ritenzioni minori.
Le condizioni di eluizione prevedono un’ eluizione isocratica in 0.1 mol/l di tampone sodio-fosfato (pH 7.4) contenente 0.2 mol/l di NaCl, 0.1 mmol/l di EDTA e 4.5 mmol/l di GlyGly come accettore della reazione enzimatica. Il flusso della pompa è 0.5 ml/min e la durata di ogni corsa 50 minuti.
La colonna viene usata seguendo le indicazioni del costruttore. Prima dell’utilizzo è stata effettuata una calibrazione dei pesi molecolari con proteine a peso molecolare noto (Bludestrano, 2000000 Da; Apoferritina, 443000 Da; Anidrasi carbonica, 29000 Da; BSA, 66000 Da; Albumina umana, 60000 Da). Il volume di eluizione delle singole proteine è stato poi confrontato con il volume di eluizione delle frazioni di GGT permettendone l’identificazione del peso molecolare delle stesse (Fig 3.1).
Calibrazione della colonna
y = -6,1392x + 50,338 R2 = 0,9944 0 5 10 15 20 25 4 4,5 5 5,5 6 6,5 Log PM Ve
Fig 3.1. Retta di calibrazione della colonna con proteine a peso molecolare noto.
3.4 Apparato per la determinazione on-line delle frazioni di GGT
L’eluato della colonna va a mescolarsi post-colonna con il substrato fluorescente γGluAMC erogato da una pompa d’iniezione (Braun), operante al
8.2 in una spira di reazione di perfluoroalcossietilene (PFA) con volume 2.6 mL mantenuta a temperatura costante di 37 oC in un bagnetto d’acqua (Figura 3.2).
Fig 3.2.Schema apparecchio; la separazione delle proteine tramite la gel-filtrazione è accoppiata alla reazione post-colonna e quindi alla rivelazione spettrofluorimetrica.
Il segnale derivante dalla reazione viene captato da un rivelatore a fluorescenza operante alla lunghezza d’onda di eccitazione λex.di 380 nm e ad una lunghezza
d’onda di emissione λem.di 440 nm caratteristiche del prodotto della reazione
(AMC).
La concentrazione del substrato erogato dalla pompa a iniezione 0.18 µM che corrispondono ad una concentrazione pari a 30 µM nella spira di reazione, considerato che il flusso dell’iniezione post-colonna (0.1 ml/min) partecipa in rapporto 1:5 con il flusso dell’HPLC (0.5 ml/min).
4. Risultati
4.1 Ottimizzazione delle condizioni di reazione on line post colonna.
Per ottimizzare la determinazione on-line dell’attività delle frazioni di GGT sierica separate in cromatografia liquida si è operato in flow injection, omettendo la colonna cromatografica dall’apparto descritto in figura 3.2.
Ciò permette di realizzare velocemente una valutazione della reazione e del rapporto segnale/rumore nelle varie condizioni di lavoro esplorate. In questa fase e’ stato utilizzato un preparato commerciale di GGT bovina.
Le condizioni di lavoro studiate hanno previsto l’ottimizzazione dei seguenti parametri:
i) concentrazione dell’accettore GlyGly nell’intervallo da 1 a 20 mmol/l; ii) concentrazione del substrato γGluAMC nell’intervallo da 0.1 a 50
µmol/l;
iii) materiale e dimensioni della spira di reazione; iv) durata e temperatura di reazione post-colonna.
4.1.1. Ottimizzazione della concentrazione di substrato
In questa parte del lavoro di tesi si e’ variata la concentrazione di γGluAMC a partire dalla concentrazione comunemente usata in letteratura (50 µM) al fine di ottimizzare il rapporto segnale/rumore.
Tabella 4.1
Condizioni di lavoro Valore Flusso in colonna
(HPLC) 0.5 ml/min
Flusso della pompa d’iniezione post-colonna
0.5 ml/min
Spira di rezione PFA, 0.75 mm id; V=2.6 ml Temperatura della
reazione 37°C
Concentrazione di GlyGly
20 mM
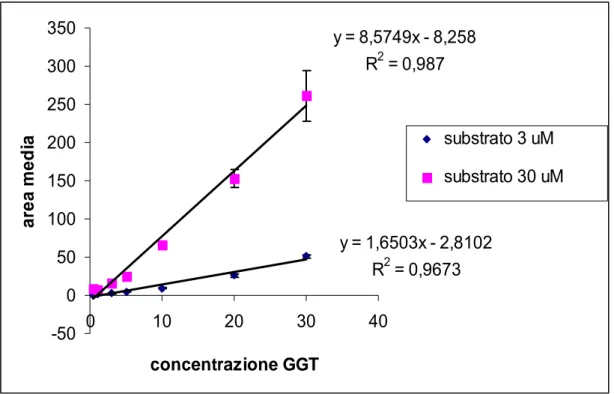
La Figura 4.1. mostra l’andamento dell’area del picco della GGT bovina iniettata in flow injection al variare della concentrazione del substrato nell’intervallo 50 -0.1 µM. y = 2,4293x + 5,4835 R2 = 0,9832 0 20 40 60 80 100 120 140 0 10 20 30 40 50 60 concentrazione substrato ( uM ) area del pi cc o
Fig 4.1. Andamento dell’area del picco della GGT bovina (concentrazione iniettata 10 mU/ml) in flow injection al variare della concentrazione del substrato nell’intervallo 50 -0.1 µM.