Università di Pisa
DIPARTIMENTO DI PATOLOGIA CHIRURGICA,
MEDICA, MOLECOLARE E DELL’AREA CRITICA.
Corso di laurea Specialistica in Odontoiatria e Protesi Dentaria
Presidente: Prof. Corrado Blandizzi
TESI DI LAUREA
Deficit ossei vestibolari negli alveoli postestrattivi: studio prospettico.
Relatore:
Chiar.mo Prof. Ugo COVANI
Candidato:
Andrea BIZZARRI
1
1. INTRODUZIONE 2
1.1ANATOMIA MAXILLO FACCIALE 2
1.1.1OSSO MASCELLARE 2
1.1.2MANDIBOLA 4
1.1.3TOPOGRAFIA DEL PROCESSO ALVEOLARE 6
1.2CRESTA ALVEOLARE EDENTULA 6
1.2.1CONSIDERAZIONI CLINICHE 6
1.2.2ALTERAZIONI DEL PROCESSO ALVEOLARE IN SEGUITO A ESTRAZIONE DI DENTI 11
1.2.3TOPOGRAFIA DELLA CRESTA EDENTULA 15
1.3PROCEDURE DI INCREMENTO DI CRESTA 15
1.3.1INTRODUZIONE 15
1.3.2MORFOLOGIA OSSEA 16
1.3.3MORFOLOGIA DEI TESSUTI MOLLI 18
1.3.4MATERIALI DA INCREMENTO 18
1.3.5RISULTATI SUL LUNGO PERIODO 22
1.3.6CLASSIFICAZIONE DEI DIFETTI OSSEI PERIMPLANTARI 23 1.4SOSTITUZIONE DI UN ELEMENTO SINGOLO IN ZONA ESTETICA 30
1.4.1INTRODUZIONE 30
1.4.2REVISIONE DELLA LETTERATURA 31
1.4.3FATTORI LIMITANTI CHE INFLUENZANO IL TRATTAMENTO 31
1.5ESTETICA DEL SETTORE FRONTALE 36
1.6TEMPISTICA DELL’INSERIMENTO IMPLANTARE 38
1.6.1INTRODUZIONE 38
1.6.2TIPO 1: POSIZIONAMENTO DI UN IMPIANTO COME PARTE DELLA STESSA
PROCEDURA CHIRURGICA IMMEDIATAMENTE DOPO L’ESTRAZIONE DENTALE 39
1.6.3TIPO 2: RIEMPIMENTO TOTALE DELL’ALVEOLO DENTALE CON TESSUTI MOLLI 40
1.6.4TIPO 3: COSPICUO RIEMPIMENTO OSSEO DELLA CAVITÀ POSTESTRATTIVA 41
1.6.5TIPO 4: GUARIGIONE DELLA CRESTA ALVEOLARE DOPO LA PERDITA
DELL’ELEMENTO DENTALE 41
2. MATERIALI E METODI 42 3. RISULTATI 52 4. DISCUSSIONE 57 5. CONCLUSIONI 64 6. BIBLIOGRAFIA 65 7. RINGRAZIAMENTI 85
2
1. INTRODUZIONE
1.1 Anatomia maxillo facciale
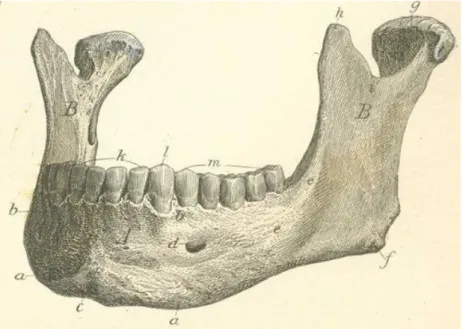
1.1.1 Osso mascellare[109]
Il mascellare è costituito da un corpo centrale, scavato dal seno mascellare, e da quattro processi, frontale, zigomatico, palatino e alveolare.
Il corpo del mascellare ha la forma di una piramide triangolare la cui base volge verso la cavità nasale e il cui apice prosegue lateralmente nel processo zigomatico. Le tre facce della piramide si distinguono in superiore o orbitaria che forma la maggior parte del pavimento dell’orbita, antero-laterale o malare che forma parte dello scheletro della faccia e postero-laterale o infratemporale che volge verso la fossa infratemporale.
Il processo frontale, si solleva dall’angolo antero-mediale del corpo e si porta verso l’alto, dove si continua con l’osso frontale. Un secondo processo che corrisponde all’angolo laterale del corpo, si unisce all’osso zigomatico e prende pertanto il nome di processo zigomatico. Il processo palatino ha origine dal margine inferiore della faccia mediale del corpo e si dirige orizzontalmente, mettendosi in giunzione con l’omonimo processo del mascellare
controlaterale costituendo così i due terzi del palato duro. Infine il mascellare presenta un processo alveolare ricurvo, che si proietta verso il basso e presenta al suo interno delle cavità denominate alveoli i quali rappresentano gli alloggiamenti in cui sono accolti i denti
dell’arcata superiore. Quest’ultimo processo si trova sulla faccia inferiore del corpo dell’osso mascellare. È formato da due lamine ossee circa parallele, che si uniscono dietro l’ultimo dente molare per dar luogo a una piccola prominenza rugosa, il tubercolo alveolare, al cui interno si trova spesso una cavità contenente midollo osseo. La lamina alveolare laterale o esterna continua verso l’alto nella superficie antero-laterale e postero-laterale del corpo mascellare; la lamina alveolare interna continua invece nel processo palatino e, dietro
l’estremità inferiore di quest’ultimo, nella superficie nasale del corpo mascellare. Il profondo solco che risulta delimitato dalle due lamine alveolari viene diviso da numerose laminette ossee radiali che individuano i singoli alveoli per gli elementi dentari.
L’osso mascellare è innervato dalla branca mascellare del trigemino (V) e vascolarizzato da rami arteriosi provenienti dalla carotide esterna (figure 1.1 e 1.2).
3
Figura 1.1 - Faccia laterale dell’osso mascellare.
4
1.1.2 Mandibola[109]
La mandibola è costituita da un corpo a forma di ferro di cavallo che si continua
posteriormente in un ramo diretto verso l’alto e verso l’indietro. Il corpo si presenta ispessito con il margine inferiore arrotondato; sul margine superiore si trova invece il processo
alveolare. Quest’ultimo è costituito da due lamine di osso compatto denominate lamina alveolare interna ed esterna. Esse sono riunite da setti radiali interdentali che delimitano gli alveoli, con modalità analoghe a quelle viste per l’osso mascellare. Il processo alveolare, inoltre, a partire dalla sinfisi posta in corrispondenza della linea mediana si estende indietro fino al margine anteriore del ramo. Il ramo mandibolare si presenta per la maggior parte come una lamina ossea quadrilatera che, dal solco per l’arteria faciale (incisura antigoniale), si dirige posteriormente comprendendo la regione dell’angolo mandibolare. Il ramo si porta anche verso l’alto dove termina in due processi di cui uno, anteriore, è il processo coronoideo che dà inserzione a fibre muscolari (muscolo temporale), mentre l’altro, posteriore, prende il nome di processo condiloideo e rappresenta un’eminenza articolare.
A livello del corpo mandibolare troviamo a livello della superficie laterale del corpo della mandibola, fra le radici del primo e del secondo premolare i forami mentonieri. Attraverso questi fori passano il nervo e i vasi mentali, rispettivamente rami del nervo alveolare inferiore (a sua volta ramo del nervo mandibolare, terza branca di divisione del trigemino) e rami dell’arteria alveolare inferiore (a sua volta ramo dell’arteria mascellare interna, ramo finale dell’arteria carotide esterna).
Sempre osservando il corpo mandibolare, notiamo che il processo alveolare si solleva dal corpo mandibolare presentando una curvatura più ristretta rispetto a quella del corpo
mandibolare stesso. Pertanto, mentre il corpo continua in direzione postero-laterale, processi alveolari risultano sporgenti verso l’interno, in direzione del piano mediano di simmetria. Il ramo, che continua secondo il piano del corpo mandibolare, si trova perciò situato, in tutta la regione dei denti molari, ben più lateralmente rispetto al piano in cui si trova il processo alveolare.
Perciò il margine anteriore del ramo continua sull’asse del corpo lateralmente al processo alveolare con un rilievo smusso, la linea obliqua, che decorre in basso e in avanti per scomparire circa a livello del primo dente molare.
Sulla parte posteriore della faccia inferiore del mento si trovano due depressioni ovalari dal fondo rugoso che prendono il nome di fossette digastriche da cui origina il ventre anteriore del
5
muscolo digastrico. Poco sopra il margine inferiore, sulla faccia interna dell’osso, la sinfisi mandibolare si solleva in proiezioni ossee, le spine mentali o apofisi geni. Tali strutture sono la zona di origine del muscolo genioglosso superiormente e del muscolo genioioideo
inferiormente.
A livello della regione del terzo molare, sempre sulla superficie interna del corpo della mandibola, ha origine una cresta rugosa e leggermente irregolare, la cresta miloioidea, che si estende obliquamente in basso e in avanti. Da questa cresta ha origine il muscolo miloioideo che costituisce il pavimento della cavità orale. L’area al di sotto di tale muscolo si presenta leggermente concava e prende il nome di fossa sottomandibolare in quanto prende rapporto con la ghiandola sottomandibolare, mentre al di sopra della parte anteriore del muscolo, troviamo una depressione poco accentuata che prende il nome di fossa sottolinguale e accoglie la ghiandola omonima.
A livello del ramo mandibolare, nella regione dell’angolo, la mandibola si presenta rugosa sia internamente sia esternamente. Queste irregolarità sono determinate da due muscoli che prendono inserzione sull’angolo della mandibola, cioè il muscolo massetere lateralmente e il muscolo pterigoideo interno medialmente. Circa al centro della faccia mediale del ramo mandibolare si trova il foro d’ingresso del canale mandibolare che si presenta come
un’apertura piuttosto ampia che prende il nome di forame mandibolare. In corrispondenza del suo limite anteriore si trova un processo osseo variabilmente sviluppato denominato spina dello Spix. Il canale mandibolare, come accennato in precedenza, dà passaggio al nervo alveolare inferiore e ai vasi omonimi (figura 1.3).
6
1.1.3 Topografia del processo alveolare
Viene definito processo alveolare quella parte di mandibola o mascellare superiore che contiene gli alveoli dentali e che si continua senza un limite netto con l’osso basale delle due ossa. Esso è formato da due pareti esterne dette lamine corticali buccale e linguale/palatale e da una parte interposta di osseo spugnoso contenente trabecole e midollo osseo. Le lamine corticali sono in continuità con l’osso che va a rivestire gli alveoli e che prende il nome di osso fascicolato (poiché vi prendono inserzione le fibre di Sharpey del legamento
parodontale) o osso alveolare proprio.
Le lamine corticali si continuano con l’osso alveolare proprio a livello della cresta del setto interdentale a una distanza posta 1-2 mm apicalmente rispetto alla CEJ del dente adiacente. Nel settore anteriore si può avere la mancanza di osso spugnoso e quindi la fusione delle due lamine corticali con l’osso alveolare proprio.
Le lamine corticali sono composte da tessuto osseo lamellare mentre il tessuto osseo spugnoso è costituito da numerose trabecole ossee circondate da adipociti e cellule
pluripotenti dello stroma mesenchimale. Queste possono differenziarsi sia in cellule tipiche del tessuto osseo che in cellule emopoietiche. Una caratteristica del tessuto osseo spugnoso è quella di avere trabecole ossee solo apparentemente disordinate poiché in realtà queste sono orientate in direzioni tali da permettere l’assorbimento e la distribuzione degli stress dovuti alla masticazione e quindi al contatto con gli altri elementi dentari.
1.2 Cresta alveolare edentula
1.2.1 Considerazioni cliniche
Il processo alveolare si forma in concomitanza con lo sviluppo e l’eruzione degli elementi dentari e regredisce gradualmente in seguito alla perdita degli stessi. La presenza quindi dell’osso alveolare dipende strettamente dalla presenza del dente stesso. L’osso alveolare segue il dente per ciò che riguarda dimensioni e forma e inclinazione condizionando l’aspetto estetico tant’è che soggetti con denti lunghi e stretti tenderanno ad avere un processo
alveolare più delicato, una lamina ossea buccale più sottile e una maggiore tendenza a presentare fenestrazioni. I denti e i tessuti circostanti – cemento radicolare, legamento alveolare e osso alveolare - su cui questi vanno a formare un’unità funzionale in grado di disperdere attraverso l’osso alveolare le forze che vengono applicate con la masticazione sulle superfici occlusali dei vari elementi dentari.
7
è venuta a formare. Nel caso di estrazioni dentali multiple in particolare questa subirà modifiche dimensionali sia in senso orizzontale sia in senso verticale riducendo quindi notevolmente anche il perimetro complessivo dell’arcata[9,10,30,84,85]
. Anche in seguito alla perdita di un singolo dente la cresta alveolare diminuirà marcatamente e l’entità di questo cambiamento è stata studiata da Pietrovski e Massler nel 1967[134] in uno studio che ha rivelato come il riassorbimento di tessuto osseo fosse più considerevole a livello della superficie buccale piuttosto che a livello linguale/palatale. Come conseguenza di questo differente rimaneggiamento il centro del sito edentulo si spostava quindi verso la faccia linguale/palatale della cresta. Misurazioni cliniche[145] e su modelli d’impronta hanno quantificato il riassorbimento in senso bucco-linguale/palatale del processo alveolare nei primi tre mesi dopo l’estrazione in una riduzione del 30% e del 50% a distanza di anno. Inoltre la lamina buccale risultava situata più apicalmente di circa 1,2 mm rispetto alla controparte linguale/palatale.
Rimaneggiamento osseo nella cresta edentula
L’utilizzo di radiografie[145]
a sottrazione ha permesso agli studiosi di valutare la formazione di tessuto osseo in alveoli di denti estratti. Le radiografie venivano fatte subito dopo le
estrazioni e dopo tre, sei e dodici mesi. Nei primi mesi si verificava una perdita ossea a livello della cresta alveolare. Inoltre le radiografie hanno permesso di osservare che la crescita ossea, soprattutto in altezza, che si verificava all’interno dell’alveolo aveva luogo soprattutto nei primi tre mesi. Un ulteriore apporto di osso si aveva nei successivi tre mesi mentre nei sei mesi ancora successivi si aveva un rimodellamento con riduzione della quantità di tessuto mineralizzato.
Classificazione di Cawood e Howell
Cawood e Howell[32] hanno fornito una classificazione dei mascellari edentuli che si basa su 6 classi:
- Classe I: dentatura presente;
- Classe II: cresta alveolare postestrattiva immediata;
- Classe III: cresta alveolare estrattiva tardiva con riossificazione dell’alveolo post-estrattivo e processo alveolare arrotondato ma adeguato in altezza e spessore;
- Classe IV: cresta con altezza adeguata ma spessore insufficiente, definita “a lama di coltello”;
8
- Classe VI: (solo per la mandibola) cresta depressa, con atrofia dello stesso osso basale. Le varie classi si associano a morfologie ossee differenti a seconda della sede (mascellare anteriore o posteriore, mandibola anteriore o posteriore). Inoltre settori diversi dello stesso mascellare possono presentare simultaneamente differenti classi di atrofia (figura 1.4). Tra i fattori individuali in grado di accelerare il riassorbimento dei mascellari vi sono l'utilizzo di protesi incongrue, fattori endocrini e metabolici, il tipo di alimentazione (insufficiente apporto di calcio e vitamina D).
Figura 1.4 – Classificazione dei mascellari edentuli secondo Cawood & Howell.
Classificazione del rimaneggiamento osseo
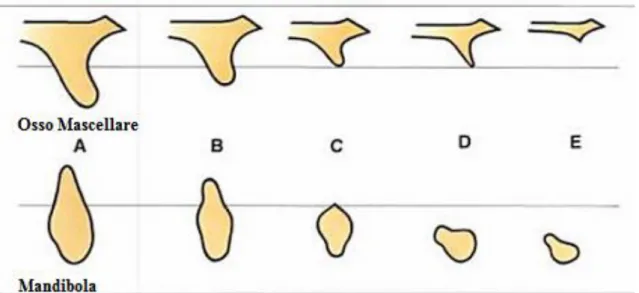
Classificazione di Lekholm e ZarbSulla base del volume osseo i siti edentuli si possono classificare[102] in cinque differenti gruppi. Nei gruppi A e B è presente una quantità cospicua di processo alveolare mentre nei gruppi C, D e E si hanno pochi mm rimanenti (figura 1.5). La qualità dell’osso è invece classificata in 4 classi. Le classi 1 e 2 sono caratterizzate da lamine corticali spesse e da un parvo volume osseo midollare mentre le classi 3 e 4 hanno lamine sottili di osso corticale con abbondante tessuto osseo spugnoso compreso tra le stesse (figura 1.6).
9
Figura 1.5 - Disegno schematico che illustra la classificazione della forma dei residui di osso mascellare e mandibola.
Figura 1.6 - Disegno schematico che illustra la qualità dell’osso mascellare e della mandibola.
Classificazione di Misch
Un’altra classificazione utilizzata è quella di Misch[117]
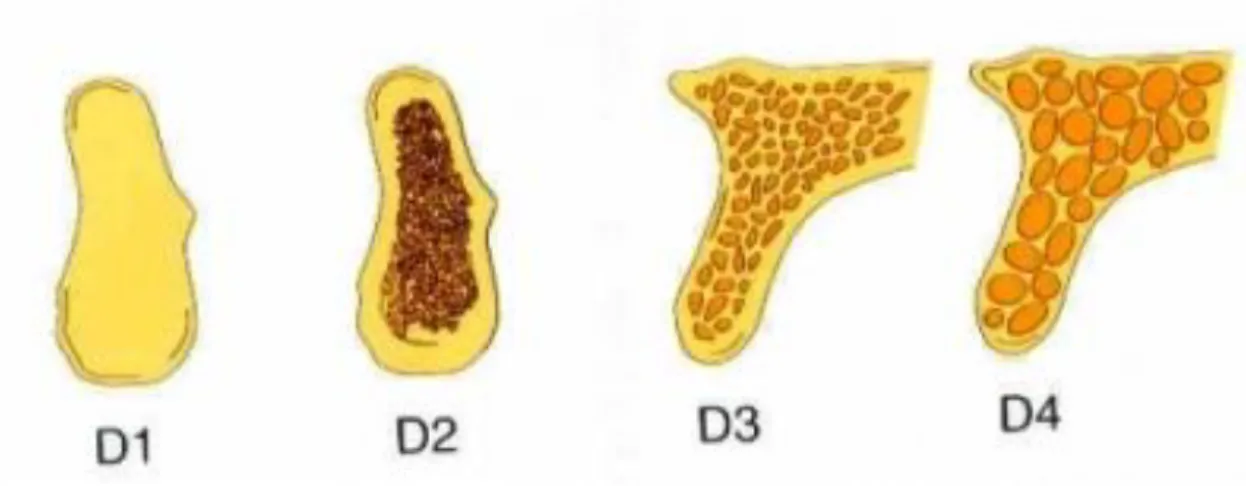
. Questa si basa sulla misurazione dell’attenuazione che un fascio fotonico subisce, dopo aver attraversato il corpo oggetto di studio, durante un esame tomografico. L’attenuazione è direttamente proporzionale alla densità elettronica del tessuto, la quale viene misurata secondo la scala Hounsfield (HU, Hounsfield Unit) che comprende 2001 diverse tonalità di grigio, dal nero al bianco. I valori in HU ottenuti dall’indagine radiografica, vengono rapportati alla densità dell’acqua che per convenzione misura 0 HU. In questo modo avremo ai due estremi, l’aria che misura -1000 HU e il tessuto osseo compatto che misura +1000 HU. In base alla densità, quindi, siamo in grado di distinguere quattro tipologie di osso identificate dalla lettera “D” associata a un numero da 1 a 4 (figura 1.7), definite secondo lo schema seguente:
10
- Tipo D1: osso corticale denso. Tipico della regione basale sinfisaria. È scarsamente irrorato quindi guarisce più lentamente, inoltre richiede un maggior torque per la
preparazione e questo provoca un maggior riscaldamento dell’osso. Per questo motivo è poco indicato per il posizionamento di impianti e la fissazione di innesti.
- Tipo D2: osso corticale crestale denso o poroso di un certo spessore, con grossolana. Rappresenta la qualità ossea ottimale ed è presente nel corpo mandibolare e nella zona frontale trabecolatura interna del mascellare. La corticale è sufficientemente spessa per garantire una stabilità primaria ai mezzi di fissazione e agli impianti. La buona
vascolarizzazione della spongiosa garantisce adeguato sostegno ai fenomeni riparativi ossei.
- Tipo D3: osso con sottile cresta corticale porosa e fine trabecolatura interna. Ha caratteristiche ideali. Lo possiamo ritrovare nella zona fronto-laterale del mascellare e nella zona laterale della mandibola.
- Tipo D4: la fine trabecolatura spongiosa occupa quasi tutto il volume osseo. È un osso poco denso. La sua corticale è molto sottile e non permette un’adeguata stabilità primaria degli impianti inseriti. Non è dunque valido dal punto di vista chirurgico.
- Tipo D5: osso immaturo, demineralizzato.
È necessario specificare che la valutazione di densità ossea (D1, D2, ecc.) è puramente clinica e che la relazione densità ossea/ unità Hounsfield ha valore indicativo e non deve essere considerata in senso assoluto.
Figura 1.7 – Disegno schematico che illustra le quattro diverse densità della classificazione di Misch.
11
1.2.2 Alterazioni del processo alveolare in seguito a estrazione di denti
Le alterazioni che si verificano nella cresta alveolare in seguito all’estrazione di un singolo dente possono essere suddivise in due serie di eventi tra loro correlate che vanno sotto il nome di processi intralveolari e processi extralveolari.
Processi intralveolari
La guarigione degli alveoli di denti estratti è stata studiata da Amler[2] con una tecnica bioptica che ha permesso di studiare il processo di guarigione dell’alveolo nella sua parte marginale. Egli ha evidenziato che nelle successive ventiquattro ore si verifica la formazione di un coagulo sanguigno all’interno dell’alveolo e che questo è rimpiazzato da tessuto di granulazione dopo due-tre giorni. Intorno al quarto-quinto giorno la proliferazione da parte dell’epitelio va a ricoprire il tessuto di granulazione precedentemente formato. A distanza di sette giorni dall’estrazione dell’elemento si osservano all’interno dell’alveolo la presenza di tessuto di granulazione, tessuto connettivo di nuova formazione e osteoide che inizia a formarsi nella parte apicale della tasca. Dopo tre settimane si osservano i primi segni di mineralizzazione dell’osteoide con l’epitelio che ha completamente ricoperto la ferita. Dopo circa sei settimane è invece evidente la formazione di osso nell’alveolo con trabecole
neoformate. Per ciò che riguarda le fasi di guarigione successive esse sono state descritte grazie a uno studio nel cane più recente condotto da Cardaropoli[29].
Pattern complessivo di guarigione dell’alveolo
L’alveolo fresco di estrazione è riempito da un coagulo e le sue pareti sono in continuità con l’osso alveolare proprio dei denti adiacenti. Leucociti PMN e macrofagi migrano all’interno del coagulo andando a fagocitare gli elementi di tessuto necrotico (processo di pulizia della ferita). Germogli di vasi sanguigni di nuova formazione e cellule mesenchimali totipotenti provenienti dal legamento parodontale reciso penetrano nel coagulo andando a formare il tessuto di coagulazione che successivamente sarà progressivamente sostituito da tessuto connettivo provvisorio che a sua volta sarà interessato dalla deposizione di osso immaturo a fibre intrecciate. Le pareti ossee dell’alveolo (osso alveolare proprio) sono riassorbite e l’alveolo si riempie di tessuto osseo a fibre intrecciate. Nelle fasi successive si avrà il rimodellamento di quest’osso provvisorio con la formazione di osso lamellare e midollo osseo.
12 Eventi importanti nella guarigione dell’alveolo
Coagulo sanguigno
Subito dopo l’estrazione dentaria, il sangue proveniente dai vasi recisi invade la cavità
riempiendola. Le proteine di derivazione vasale e le cellule danneggiate innescano una cascata di eventi che porta alla formazione di una fitta rete di fibrina. Le piastrine aggregandosi
interagiscono con la fibrina dando luogo al coagulo sanguigno che occludendo i vasi recisi porta all’arresto del sanguinamento. Il coagulo oltre a quest’azione di “tappo” è importante ai fini della guarigione dell’alveolo perché contiene al suo interno fattori di crescita ovvero sostanze che indurranno in fasi successive la migrazione dei vari tipi di cellule presenti nel sito di guarigione dell’alveolo verso la proliferazione, la differenziazione e verso
un’importante fase di sintesi. Affinché si possano creare le condizioni necessarie per la creazione di nuovo tessuto occorre che il coagulo vada incontro a fenomeni di disgregazione che vanno sotto il nome di processo di “fibrinolisi”.
Pulizia della ferita
I Neutrofili prima e i macrofagi in un secondo momento migrano nella ferita e iniziano la loro attività di “spazzini” fagocitando i batteri e i brandelli di tessuto danneggiando ivi presenti. I macrofagi oltre all’azione fagocitante devono essere ricordati anche per la loro importante liberazione di fattori di crescita e di citochine promuoventi un’ulteriore migrazione,
proliferazione e differenziazione delle cellule mesenchimali. Una volta raggiunta la sterilità della ferita, i neutrofili vanno incontro ad apoptosi e i loro resti vengono fagocitati dai macrofagi che provvederanno in un secondo momento a ritirarsi dalla ferita.
Formazioni di tessuto
I germogli di tessuto vascolare e le cellule mesenchimali simil-fibroblastiche si spostano dal legamento parodontale reciso verso l’alveolo. Qui queste cellule proliferano e provvedono alla deposizione dei componenti della matrice in sede extracellulare. Il tessuto di granulazione neoformato rimpiazzerà il coagulo. Le cellule grazie ai fattori di crescita direzioneranno il tessuto verso un’ulteriore differenziazione che porterà alla formazione del tessuto connettivo provvisorio. Questo non è altro che il risultato della fibroplasia intesa come la sintesi dei componenti della matrice da parte delle cellule mesenchimali e della angiogenesi ovvero la formazione di nuovi vasi.
Le cellule osteoprogenitrici migrano lungo i vasi neoformati e differenziandosi in osteoblasti provvederanno alla formazione di una matrice composta prevalentemente da collagene
13
intrecciato che andrà a formare il tessuto osseo primitivo, l’osteoide. All’interno di questa struttura inizia il processo di mineralizzazione e gli osteoblasti intrappolati diventeranno così osteociti. A mano a mano che l’osteoide mineralizza, si vengono a formare le trabecole di tessuto osseo che inspessendosi danno origine all’osso a fibre intrecciate. a mano a mano che gli osteociti rimangono intrappolati, si assiste alla formazione della prima serie di osteoni, gli osteoni primari. Successivamente l’osso è rinforzato dalla deposizione delle fibre parallele le cui fibre sono caratterizzate da una disposizione concentrica. E’ importante notare come in questa prima fase di guarigione il tessuto osseo delle pareti alveolari (tessuto fibroso) è rimosso e sostituito da osso a fibre intrecciate.
Modellamento e rimodellamento del tessuto
La formazione iniziale di tessuto osseo spugnoso primitivo avviene in poche settimane e garantisce uno scaffold stabile, un adeguato rifornimento di cellule osseo progenitrici che provvederanno e un’ottima vascolarizzazione. L’osso a fibre intrecciate con i suoi osteoni primari verrà rimpiazzato da osso lamellare e midollo osseo grazie alla formazione di osteoni secondari. In particolare l’osso a fibre intrecciate è riassorbito inizialmente fino a un certo livello determinato dalla cosiddetta linea d’inversione da dove si formerà il nuovo osseo con osteoni secondari. Sebbene questo processo di rimpiazzamento inizi dopo poche settimane dall’estrazione del dente dal suo alveolo, bisognerà aspettare parecchi mesi prima che venga riassorbito tutto l’osso a fibre intrecciate e che questo sia quindi rimpiazzato con osseo lamellare che si continuerà con la lamina corticale della periferia dell’alveolo. Questo processo prende in particolar modo il nome di corticalizzazione dell’alveolo.
L’alveolo ormai guarito andrà irrimediabilmente incontro a modificazione dovute
all’adattamento del tessuto osseo alle nuove richieste funzionali e quindi dalla scomparsa dello stress che veniva prima prodotto dalle forze che venivano esercitate dal dente attraverso il suo apparato di sostegno fino al livello osseo. Il cappuccio duro situato all’apice
dell’alveolo sarà sostituito anch’esso da midollo osseo.
Processi extralveolari
In un esperimento nel cane[4] sono state esaminate attentamente le alterazioni del profilo della cresta edentula che si verificavano dopo l’estrazione del dente. In questo studio erano estratti i premolari mandibolari di un’emiarcata previo sollevamento di un lembo a tutto spessore e successivamente venivano prelevati i campioni bioptici di ogni singolo alveolo dopo l’estrazione e delle radici adiacenti dopo una, due, quattro e otto settimane di guarigione. I
14
blocchi dei campioni venivano sezionati sul piano buccale-linguale e venivano analizzati. Ciò che emergeva era che il tessuto duro presente sul versante linguale era più cospicuo della controparte buccale. La parte marginale della parete linguale risultava formata da osso fibroso solo per la sua parte più interna così come l’apice della cresta mentre la parte buccale
presentava un maggior spessore di tessuto fibroso di circa 1-2 mm. A questo proposito è necessario ricordare che il tessuto osseo fibroso facendo parte dei tessuti di attacco del dente risente dell’estrazione dello stesso non svolgendo più la sua funzione e andando quindi incontro a naturale riassorbimento.
Una settimana dopo l’estrazione del dente: l’alveolo viene occupato dal coagulo e
successivamente viene presidiato all’esterno e all’interno delle pareti ossee buccali e linguali da osteoclasti a indicare che il tessuto osseo fibroso è in fase di riassorbimento.
Due settimane dopo l’estrazione del dente: l’osso immaturo a fibre intrecciate occupa le zone apicali e laterali dell’alveolo mentre la zona centrale è occupata da tessuto connettivo
provvisorio. Numerose zone di tessuto osseo fibroso sono già state rimpiazzate da tessuto osseo a fibre intrecciate.
Quattro settimane dopo l’estrazione del dente: l’intero alveolo è occupato da tessuto osseo immaturo e gli osteoclasti si sono ormai portati sia a livello della parte marginale delle pareti dell’alveolo sia a livello delle trabecole neoformate. Il tessuto osseo immaturo neoformato sta per essere rimpiazzato da tessuto osseo più maturo.
Otto settimane dopo l’estrazione del dente: è avvenuto il processo di corticalizzazione per il quale uno strato di osso corticale copre l’accesso al sito di estrazione. L’osso immaturo è stato completamente sostituito da midollo osseo e da trabecole di tessuto osseo lamellare.
All’esterno e all’apice delle pareti vi sono segni indicanti il riassorbimento in corso. A livello della cresta la parete ossea buccale è localizzata in sede più apicale rispetto alla controparte linguale.
Le ragioni per le quali il livello “coronale” della parete buccale si trova situato più
apicalmente rispetto alla controparte linguale che nel suo complesso rimane quasi invariata, sono almeno due. In primis ciò avviene perché al momento dell’estrazione 1-2 mm della cresta della parete buccale sono occupati da tessuto fibroso (funzionale) mentre la controparte linguale ne contiene una frazione notevolmente minore. In secundis bisogna notare come lo spessore della parete ossea linguale sia notevolmente più ampio rispetto alla controparte linguale.
15
1.2.3 Topografia della cresta edentula
I processi di modellamento e rimodellamento che s’innescano a seguito di estrazione dentaria portano quindi a un riassorbimento pronunciato della cresta alveolare e in particolare della sua parete ossea buccale rispetto a quella linguale/palatale. Da ciò consegue che il centro della cresta risulterà maggiormente spostato in direzione linguale/palatale. In casi estremi si può anche assistere a una perdita completa della cresta e in questo caso rimarrà presente solo l’osso basale.
Per quel che riguarda i tessuti molli, la cresta è rivestita da mucosa di spessore variabile a seconda del biotipo, dell’osso (mascellare superiore o mandibola), del posizionamento della giunzione mucogengivale, dalla profondità del vestibolo linguale e buccale e dell’entità del riassorbimento di tessuto duro. Il sito edentulo può essere tappezzato da mucosa masticatoria cheratinizzata o da mucosa di rivestimento non cheratinizzata.
Le pareti esterne del processo alveolare sono formate da osso alveolare con la lamina ossea buccale che è comparativamente sottile mentre quella linguale/palatale comparativamente spessa. All’interno delle lamine corticali è racchiuso osseo spugnoso contenente osso
lamellare e midollo osseo popolato da numerose strutture vascolari e da cellule mesenchimali pluripotenti. La cresta del sito edentulo mascellare contiene più osso spugnoso di quello mandibolare.
1.3 Procedure di incremento di cresta
1.3.1 Introduzione
Il buon esito della terapia implantare dipende dalla disponibilità di un volume osseo adeguato nel sito d’inserimento dell’impianto[103] un deficit, infatti, influisce in maniera negativa sulla prognosi a lungo termine degli impianti dentali. Tra i vari metodi attraverso cui aumentare il tasso di formazione ossea e incrementare il volume dello stesso abbiamo la GBR (guided bone regeneration), che permette agli spazi preservati dalle membrana-barriera di essere riempiti da osso di nuova formazione[44,46,99,130] e che è senza dubbio la metodica più documentata e con livelli di predicibilità e di successo molto simili ai livelli che possiamo ottenere in aree senza difetti[72]. Essa permette di utilizzare impianti endossei in regioni in cui il volume osseo iniziale è insufficiente al posizionamento implantare. Questa mancanza di osso può essere dovuta a varie cause tra cui difetti congeniti, post-traumatici, postoperatori oppure può essere il risultato di processi patologici.
16
La comprensione generale dei meccanismi che portano alla rigenerazione dei tessuti desiderati coincide ancora con i concetti pubblicati inizialmente[92,129,131]. In sostanza, quando si forma uno spazio vuoto, le cellule provenienti dai tessuti adiacenti proliferano al suo interno fino a formare di nuovo il loro tessuto “genitore”, cioè il tessuto dal quale sono migrate. Per favorire la crescita di precise cellule provenienti da tessuti desiderati si ricorre all’utilizzo di
membrane con funzioni selettive, che impediscono l’accesso a quello stesso spazio di cellule di altra provenienza, non desiderate.
1.3.2 Morfologia ossea
I difetti ossei possono essere classificati in difetti intralveolari, orizzontali e verticali. Nell’esaminare il problema clinico riguardante la morfologia ossea, diventa di grande importanza terapeutica valutare la presenza del difetto osseo, la dimensione dello spazio edentulo (uno o più elementi) e il livello osseo in corrispondenza dei denti adiacenti al difetto.
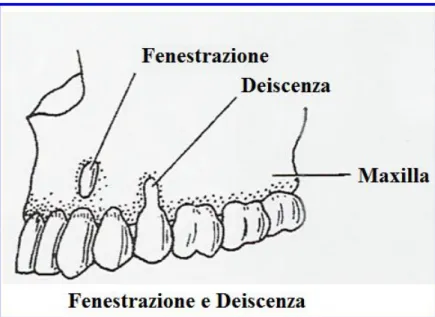
Deficit ossei orizzontali
I deficit ossei orizzontali costituiscono senza dubbia la tipologia di difetto maggiormente riscontrata e includono la deiscenza e la fenestrazione (figura 1.8). Numerosi studi hanno dimostrato come il trattamento di questi tipi di difetto abbia buone potenzialità di
riuscita[11,88,112,115,154]. Inoltre sono state impiegate con successo sia membrane bioriassorbibili sia non riassorbibili[39,43,71,74,111,141,144,149].
In uno studio clinico controllato, erano trattati 18 impianti con superfici esposte, in nove pazienti. In siti sperimentali venivano usate membrane bioriassorbibili all’acido polilattico e poliglicolico (PLA/PGA), mentre ai siti controllo venivano applicate membrane non
riassorbibili in politetrafluoroetilene espanso (e-PTFE). Prima dell’adattamento della membrana, veniva anche applicata una certa quantità di osso autogeno a copertura dei filetti implantari esposti. Gli esiti al rientro, sei-sette mesi dopo, riportavano una rigenerazione ossea e una buona guarigione sia nei siti controllo sia in quelli sperimentali, con i siti controllo che evidenziavano quantità di rigenerazione lievemente maggiori. In caso di presenza di difetto osseo in un sito dove sia impossibile ottenere una stabilità primaria di un impianto o dove sia impossibile inserire un impianto in una posizione ideale il metodo di elezione è costituito dalla GBR prima dell’inserimento implantare.
La ricerca sperimentale sull’incremento crestale ottenuto tramite GBR si deve a Seibert e Nyman[146] che nei primi anni 90 ha sperimentato sul cane la metodica. Venivano, infatti, predisposti chirurgicamente difetti della cresta di ampie dimensioni sia nel mascellare
17
superiore sia in quello inferiore e successivamente attraverso l’analisi morfologica e istologica si rivelava che nei siti trattati con le membrane, con o senza aggiunta di impianti, l’osso andava a colmare tutto lo spazio compreso tra la membrana e l’osso mascellare. In assenza di membrane invece la formazione ossea era carente. E’ stato inoltre dimostrato come
l’incremento crestale in direzione laterale sia in particolar modo una tecnica di prevedibile successo[18,26,45,126,130,171]. Per quel che riguarda invece l’incremento della cresta alveolare in senso verticale, non sono ancora presenti tecniche efficaci ben consolidate.
Figura 1.8 - Disegno schematico che illustra i difetti ossei orizzontali: la fenestrazione e la deiscenza.
Deficit ossei verticali
L'incremento verticale di cresta costituisce senza dubbio l'indicazione più impegnativa per la terapia con GBR. Tecniche consolidate prevedono l'utilizzo di innesti ossei autogenici, polverizzati o in blocchetti, e sostituiti ossei abbinati alle membrane e-PTFE di varie
configurazione[35,151,153,163,164]. Le membrane erano sostenute o solamente dall'innesto oppure anche dall'impianto che sporgeva verticalmente dall'osso per lunghezze diverse. Gli esiti dopo la guarigione in condizione sommersa evidenziavano sempre la formazione ossea che
superava il margine precedente della cresta. La quantità di osso nuova formazione poteva raggiungere i 4 mm e attraverso vari studi è stato possibile dimostrare come gli impianti presentassero osteointegrazione anche in quest'osso di recente formazione.
Purtroppo il limite di questa metodica è la mancanza di una buona predicibilità. Spesso, infatti, permane un gap tra la membrana e l'osso di nuova formazione che viene occupato da tessuto non mineralizzato[151].
18
1.3.3 Morfologia dei tessuti molli
La morfologia dei tessuti molli ha notevole importanza per garantire una buona guarigione e per un risultato estetico soddisfacente. La mancanza di tessuti molli può impedire un recupero importante di volume osseo a causa dell'impossibilità di ricoprire l'area destinata alla
rigenerazione. In tali situazioni può essere dapprima consigliabile aumentare il volume dei tessuti molli per poi effettuare in su secondo tempo la procedura di incremento osseo. Ha particolare importanza il livello dei tessuti molli in corrispondenza dei denti prossimi allo spazio edentulo e il biotipo gengivale oltre a eventuali cicatrici presenti sull'area dei tessuti molli che ricoprono il difetto.
1.3.4 Materiali da incremento
Innesti ossei e sostituti d’innesto osseo
È ormai universalmente accettato che i meccanismi biologici alla base della buona riuscita della terapia con innesto osseo includono 3 processi di base: osteogenesi, osteoconduzione, osteoinduzione.
L’osteogenesi si ha quando osteoblasti e precursori degli osteoblasti sono trasferiti con il materiale da innesto nel difetto osseo, sede in cui possono dare luogo a centri di formazione ossea. Gli innesti di osso midollare e di osso prelevato dalla cresta iliaca sono esempi di trapianti con proprietà osteogeniche.
L’osteoconduzione avviene quando del materiale non vitale serve da impalcatura (scaffold) per la proliferazione nel difetto dei precursori degli osteoblasti. Da ciò ne discende che, per essere efficace, il materiale osteoconduttivo deve essere inserito in diretto contatto con tessuto osseo. Questo processo è di solito seguito dal graduale riassorbimento del materiale. Esempi di materiali con proprietà osteoconduttive sono l’osso eterologo e l’osso omologo. Questi materiali hanno un potere osteoconduttivo simile, tuttavia la loro degradazione e sostituzione con l’osso del sito ricevente è spesso limitata. Se il materiale innestato non è riassorbibile, come nel caso di materiali a base di idrossiapatite, l’apposizione ossea avviene solamente sulla superficie del materiale innestato ma non si osserva nessuna sostituzione durante la fase di rimodellamento.
L’osteoinduzione implica la nuova formazione di tessuto osseo attraverso la differenziazione di cellule del tessuto connettivo in cellule osteogeniche, sotto l’influenza di agenti inducenti. Il materiale osteoinduttivo ha in sé, quindi, la capacità di suscitare la formazione di osso
19
anche in un tessuto ospite non osseo. La matrice ossea demineralizzata (DMB) e le proteine
morfogenetiche dell’osso (BMP) sono esempi di materiali che godono di tale proprietà[64,139] . Sebbene trattati separatamente, questi eventi sono coinvolti contemporaneamente nella rigenerazione ossea. Di fatto, è improbabile assistere all’osteogenesi senza osteoconduzione e osteoinduzione, dal momento che quasi nessuna delle cellule dell’innesto osseo autologo sopravvive al trapianto. La funzione dominante del materiale da innesto è, perciò, fungere da impalcatura per la proliferazione delle cellule dell’ospite. Inoltre, osteoblasti e osteociti del tessuto osseo circostante mancano della capacità di migrare e dividersi. Ciò significa che l’innesto verrà “invaso” da cellule mesenchimali che in seguito si differenzieranno in osteoblasti.
Secondo quanto detto sopra, possiamo definire tre condizioni di base che devono essere soddisfatte per avere rigenerazione ossea:
1. Capacità di far arrivare cellule osteogeniche o cellule in grado di differenziarsi in
cellule osteogeniche.
2. Presenza di stimoli osteoinduttivi per indurre la differenziazione di cellule mesenchimali in osteoblasti.
3. Presenza di un ambiente osteoconduttivo in grado di fungere da scaffold sopra il quale il tessuto può proliferare e nel quale cellule progenitrici attivate possono differenziarsi in osteoblasti e formare osso[108].
Gli innesti ossei hanno trovato a lungo applicazione nella chirurgia ricostruttiva allo scopo di aumentare il volume osseo nella pregressa area del difetto. Gli innesti ossei e i materiali ossei sostitutivi sono classificabili in due gruppi principali: materiali autogenici e xenogenici. Il termine innesto autogenico si riferisce a quei tessuti trapiantati all’interno di uno stesso organismo mentre quelli xenogenici comprendono i materiali di origine diversa rispetto all’organismo ricevente e possono essere ulteriormente suddivisi in materiali provenienti dalla stessa specie da ma da individui differenti, materiali provenienti da specie diverse e prodotti di origine inorganica. Gli innesti ossei abbinati alla tecnica GBR devono soddisfare alcuni requisiti tra cui sostenere adeguatamente la membrana per fornire un volume predefinito d’osso rigenerato, servire da struttura guida all’interno della quale l’osso possa crescere e infine indurre, se possibile, produzione ossea. Ne consegue che i vasi capillari e le cellule perivascolari possano rispettivamente formarsi e migrare facilmente all’interno degli spazi
20
vuoti offerti dal materiale di sostegno. Le cellule di formazione successiva possono popolare gli spazi e produrre nuovo osso. Infine il materiale di sostegno dovrebbe essere riassorbito e sostituito da osso del paziente[61,83].
La necessità di applicare membrane abbinate ai blocchetti d’innesto è stata analizzata in uno studio clinico randomizzato prospettico per il quale erano stati arruolati 13 pazienti[3]. I pazienti erano curati con innesti ossei onlay semplici o ulteriormente rivestiti da membrane in e-PTFE. La larghezza delle creste era poi valutata clinicamente subito dopo l’inserimento implantare e al momento della rimozione della membrana a distanza di sei mesi. Nel gruppo al quale erano state applicate le membrane, il grado di riassorbimento era significativamente inferiore. Questo studio clinico controllato conferma i dati provenienti dalla sperimentazione animale ed è conforme agli studi di coorte che riferiscono un marcato riassorbimento degli innesti ossei[40,82,169,177].
Una recente revisione sistematica concludeva che la scarsità dei dati scientifici disponibili preclude la possibilità di raccomandare esplicitamente la scelta di un materiale di sostegno specifico per le procedure di GBR[36].
In genere, gli studi per valutare gli esiti clinici dell’incremento crestale laterale ottenuto con procedure di GBR concomitanti a inserimenti implantari adottavano, come materiale di riempimento, osso autogenico abbinato a membrane non riassorbibili[26,126]. Sono disponibili pochi dati sull’applicazione di sostituti ossei e membrane bioriassorbibili allo scopo di incrementare la cresta prima dell’inserimento implantare[58,73,186]
.
In uno di questi studi, 12 pazienti, per un totale di 15 siti, che mostravano difetti ossei laterali venivano trattati utilizzando blocchetti di minerale osseo deproteinizzato di origine bovina e membrane bioriassorbibili al collagene[73]. La dimensione dei difetti precludeva la possibilità di posizionamento implantare in assenza di un incremento osseo preliminare. Inizialmente la larghezza media crestale era di 3,2 mm. In occasione dell’intervento di rientro, 9-10 mesi dopo, la larghezza media della cresta era salita a 6,9 mm. In tutti i casi ad eccezione di uno, il volume osseo risultante era sufficiente a inserire l’impianto in posizione ottimale dal punto di vista protesico. In un caso, per motivi sconosciuti, non si era verificato alcun recupero di volume osseo.
Se negli studi clinici precedenti in corrispondenza dell’impianto venivano corretti piccoli difetti ossei con DBBM (demineralized bovin bone matrix, matrice ossea demineralizzata di origine bovina)[58,70,76,185], in questa serie di casi clinici si procedeva con successo alla rigenerazione di difetti ossei di maggiori dimensioni[73].
21
evita i rischi correlati alla raccolta di osseo autogenico[127,170]. Questo rappresenta un significativo vantaggio per il paziente, nonché una fase importante nello sviluppo delle procedure di GBR. Le future ricerche dovrebbero concentrarsi su questo tipo di esiti, basati sul paziente. Lo sviluppo di biomateriali, idealmente abbinato all’incorporazione di fattori di crescita ossea e di peptidi bioattivi, costituisce un’importante linea di ricerca in questa direzione[88].
Membrane
Per realizzare la GBR sono stati utilizzati numerosi materiali tra cui il politetrafluoroetilene (PTFE), PTFE in espansione (e-PTFE), collagene, fascia lata liofilizzata, innesti eterologhi di dura madre, polyglactin 910, acido polilattico, acido poliglicolico etc. I criteri essenziali che devono soddisfare le membrane usate per la GTR[75] sono: la biocompatibilità, occlusività delle cellule, integrazione da parte dei tessuti ospite, maneggevolezza clinica e capacità di creare spazio. Oltre a queste le membrane riassorbibili devono anche garantire minime reazioni tissutali derivanti dal riassorbimento tali da non influire negativamente sulla rigenerazione dei tessuti desiderati[66].
Membrane non riassorbibili
Dalla loro introduzione le membrane in e-PTFE sono diventate ben presto uno standard nella rigenerazione ossea. L'e-PTFE è considerato un polimero a elevata stabilità resistente alla distruzione operata dai tessuti ospite e non in grado di innescare reazioni immunologiche. Una possibile complicanza correlata all'applicazione della membrana concomitante con l'inserimento implantare è l'esposizione con annessa contaminazione della membrana stessa. La deiscenza della ferita e l'esposizione della membrana modificano la quantità di osso rigenerata[63].
Membrane riassorbibili
Le membrane riassorbibili hanno il grande vantaggio di non dover sottoporre il paziente a un secondo intervento chirurgico di rimozione con lo stress e il rischio di danno tissutale che ne conseguono. Oltre a questo vantaggio esse presentano anche altri vantaggi supplementari tra cui una migliore guarigione dei tessuti molli[105,183], l'incorporazione delle membrane da parte dei tessuti ospite (in base alle proprietà dei materiali) e un rapido riassorbimento in caso di esposizione, eliminando così le microstrutture aperte soggette alla contaminazione
22
alle categorie dei polimeri naturali o sintetici. I gruppi di polimeri a uso medico più conosciuti sono il collagene e i poliesteri alifatici. Le membrane attualmente testate e in uso sono
prodotte in collagene, o poliglicolidi e /o polilattidi, o relativi copolimeri[79].
Un'ampia gamma di membrane bioriassorbibili sono state oggetto di numerosi studi clinici che hanno dato risultati buoni grazie anche a basse percentuali di complicanze tuttavia occorre prendere atto che in una recente revisione sistematica della letteratura non è stato possibile stabilire un confronto ragionevole fra membrane bioriassorbibili e non riassorbibili, a causa della mancanza di studi ben progettati[36]. Sono stati identificati solamente pochi studi che confrontassero i due tipi di membrane e i risultati emersi ci dicono che non c'è molta
differenza fra le due modalità di trattamento. Sono stati segnalati da numerosi studi fallimenti terapeutici derivanti dall'utilizzo di membrane polilattiche[143]. Esiti convincenti nella
rigenerazione ossea sperimentale sugli animali venivano invece segnalati per le membrane in collagene[78,181]. Allo stesso modo sono stati pubblicati casi clinici singoli o serie di casi clinici o serie di casi clinici controllati[70] o anche studi clinici controllati[183] che descrivono il buon risultato delle membrane in collagene per la GBE in corrispondenza di superfici
implantari esposte.
In assenza di una morfologia del difetto osseo molto favorevole, le membrane bioriassorbibili non riescono tuttavia a mantenere uno spazio sufficiente. Pur riuscendo inizialmente a
ricavare lo spazio necessario in genere, alla lunga non riescono a mantenere la loro resistenza meccanica. Esiti favorevoli si hanno in quei casi in cui i margini ossei sostengono
adeguatamente la membrana. Qualora i difetti ossei non mantengono autonomamente lo spazio, si osserva il fallimento della rigenerazione ossea[116,182]. Ne consegue quindi che alla membrana debba essere garantita una forma di sostegno. Sostanzialmente gli studi clinici dimostrano come sia possibile applicare con successo le membrane bioriassorbibili in vista della rigenerazione ossea in corrispondenza d’impianti a superfici esposte. Tuttavia sembra che le membrane bioriassorbibili forniscano generalmente performance migliori rispetto a quelle non riassorbibili. E' dunque consigliabile l'utilizzo di membrane bioriassorbibili a patto che la morfologia del difetto non ne impedisca l'applicazione.
1.3.5 Risultati sul lungo periodo
Le recenti revisioni sistematiche hanno esaminato la letteratura per ciò che riguarda le percentuali di sopravvivenza e di successo relative agli impianti parzialmente o
completamente inseriti in osso rigenerato[36,56,72]. La percentuale di sopravvivenza relativa agli impianti posizionati in sito con osso rigenerato/aumentato usando membrane-barriera variava
23
fra il 79% e il 100% con gran parte degli studi che segnalavano oltre il 90% dopo almeno un anno di funzionamento. Le percentuali rinvenute tramite queste revisioni sistematiche non si discostavano da quelle normalmente riportate per gli impianti inseriti in modo convenzionale in siti che non richiedono incremento osseo.
Alcuni studi fornendo dati di controllo interno[116,185] hanno permesso di confrontare le
percentuali di sopravvivenza e di successo tra impianti inseriti in osso rigenerato e in osso non rigenerato. I dati mostravano percentuali di differenza non significative. Inoltre la perdita di osso crestale in corrispondenza d’impianti sperimentali e impianti controllo era uguale[113]. La stabilità sul lungo periodo dell’osso sottoposto a procedure d’incremento in senso verticale è stata valutata in uno studio multicentrico che includeva 123 pazienti[152]. Gli esiti hanno dimostrato come i cambiamenti del livello dell’osso marginale rientrassero nella gamma delle variazioni segnalate per gli impianti posizionati in letti ossei integri. L’analisi sul lungo periodo della stabilità dell’osso rigenerato si concentra quasi esclusivamente sulle valutazioni radiografiche dell’osso interprossimale e sulla sopravvivenza implantare. Per valutare il destino della lastra ossea buccale, rigenerata o no, è necessario tuttavia condurre ulteriori studi. Com’è stato suggerito in occasione di studi precedenti, la stabilità dell’osso rigenerato è valutabile attraverso varie misurazioni cliniche e radiografiche[34].
1.3.6 Classificazione dei difetti ossei perimplantari
L’analisi della morfologia del difetto osseo è la base per decidere quale strategia di
trattamento seguire e quali materiali usare per la GBR. Fondamentalmente le procedure sono due: una procedura monofase (metodo combinato) e una a due fasi (metodo organizzato/ a fasi). Ogni volta che la morfologia ossea consente un ancoraggio implantare con stabilità primaria in posizione protesicamente adeguata, viene preferito il metodo monofase. Nei casi invece in cui la morfologia del difetto osseo precluda la stabilità primaria implantare, si preferisce optare per la procedura a due fasi, con la quale in primo luogo viene aumentato il volume osseo fino a livello che consenta, successivamente e tramite un secondo intervento, l’inserimento dell’impianto. La classificazione dei difetti ossei è intesa come guida si
riferimento per la scelta delle tecniche e dei materiali migliori per la GBR, da applicare ai siti implantari (figura 1.9).
24
Figura 1.9 Conservazione della cresta
Nei casi di cospicua mancanza di tessuti molli e/o duri può essere consigliabile applicare tecniche di miglioramento della guarigione dei tessuti duri, nonché di quelli molli- Sono stati fatti dei tentativi di conservazione del profilo crestale, inserendo materiali non riassorbibili nell’alveolo postestrattivo. Dentro all’alveolo venivano posizionanti coni
d’idrossiapatite[48,137]
. Anche se in questo modo si riusciva a ridurre il riassorbimento crestale, gli esiti generali non erano soddisfacenti. Si notava, infatti, una forte deiscenza dei tessuti molli e in alcuni casi i coni dovevano essere addirittura rimossi[100]. La GBR è stata applicata per conservare o aumentare la cresta alveolare all’atto della rimozione dell’elemento dentario. I materiali di sostegno venivano posizionati negli alveoli postestrattivi e poi ricoperti con membrane non riassorbibili. Come già detto uno dei problemi riscontrati, è la mancanza di tessuto molle sufficiente a coprire interamente la sede della GBR. Per risolvere questo problema si è fatto ricorrere a lembi fatti scivolare lateralmente e/o coronalmente o a innesti di tessuto molle. In alcuni studi non è stato fatto nessun tentativo di contenere il materiale di riempimento tramite membrane né il tessuto molle veniva manipolato allo scopo di avere una guarigione per prima intenzione. In questi casi, e quando si verificava una necrosi dei tessuti molli di rivestimento, una delle risultanza comuni era la perdita di particelle d’innesto[125]. L’analisi istomorfometrica delle biopsie rivelava che l’osso più vitale si era formato in corrispondenza dei siti trattati con GBR, rispetto ai siti lasciati alla guarigione spontanea. I ricercatori attribuivano questa risultanza positiva alle caratteristiche dei materiali di
riempimento. Apparentemente, sia l’osteoconduttività sia la capacità di riassorbimento dei materiali influivano in modo positivo sulla nuova formazione di tessuto osseo[60,157].
Nell’applicazione delle procedure della GBR l’osservazione clinica evidenziava come il tasso di riassorbimento del processo alveolare potesse essere ridotto, se confrontato con quello
25
relativo ai siti controllo non trattati[104,105,180]. I siti trattati con GBR, però, presentavano frequentemente complicanze correlata alla deiscenza dei tessuti molli[57,179]. Anche se la tecnica per ridurre la perdita di volume cresta con GBR è ben documentata, in molte
situazione cliniche la sua applicazione non è pratica per i seguenti problemi; richiede un lungo periodo di guarigione, prima di poter passare alla terapia implantare; è un metodo invasivo e soggetto alla perizia della tecnica applicata; la crescita quantitativa ottimale dei tessuti molli è difficile da ottenere e può portare a un risultato estetico compromesso; è costosa.
Un approccio diverso, volto a creare le condizioni ottimali per la terapia implantare rispetto al profilo della cresta alveolare, ha portato all’elaborazione di tecniche che mirano al
miglioramento della condizione dei tessuti molli. Casi clinici presentati in passato
descrivevano l’uso d’innesti di tessuti molli autogenici per sigillare gli alveoli postestrattivi precedentemente[101] o contestualmente all’inserimento dell’impianto[52,101,159]. Si tratta di procedure che presentano molti problemi, tra i quali la necrosi della mucosa trapiantata e un’integrazione cromatica insoddisfacente in corrispondenza del sito ricevente. Per affrontare il problema in modo sistematico, su 20 pazienti che richiedevano estrazioni dentali, è stato innestato del tessuto molle, allo scopo di sigillare l’entrata dell’alveolo del dente appena estratto[87]. In primo luogo, veniva inserito nell’alveolo del materiale da innesto, così da mantenere il profilo crestale. Veniva poi suturato con cura un innesto di tessuto molle, raccolto dal palato, onde conservare il materiale da innesto e isolare l’alveolo dal cavo orale. Sei settimane dopo venivano valutate la vitalità dell’innesto e la corrispondenza cromatica rispetto alla mucosa circostante. Oltre il 99% del tessuto impiantato appariva vitale. La misurazione digitale della differenza cromatica fra i tessuti impiantati e i tessuti adiacenti evidenziava valori inferiori alle soglie normalmente rilevabili in situazioni analoghe. Questa tecnica, dunque, ha influito in modo favorevole sulle condizioni dei siti estrattivi, in funzione del successivo posizionamento implantare e della gestione dei tessuti molli, rispetto alla guarigione spontanea. In ragione dell’impegno della spesa che la sua applicazione comporta, questa tecnica di trattamento è soprattutto indicata per le situazioni ad alta priorità estetica. Può succedere che l’impianto sia inserito totalmente nell’osso nativo, ma che il profilo buccale dei tessuti duri e molli non sia sufficiente a conseguire un risultato terapeutico
ottimale. Potrebbe essere questo il caso in cui si richiedano esigenze estetiche particolarmente elevate. Per migliorare il risultato estetico viene adottata una procedura di incremento (classe 0). Per promuovere la formazione di osso in senso labiale e ottenere i profili tessutali
26
Alveoli postestrattivi (classe I)
Le procedure che prevedevano il posizionamento di impianti in alveoli postestrattivi sono state descritte diversi anni fa ma hanno trovato applicazione clinica solo negli ultimi anni. Nei casi in cui i denti debbano essere sostituiti da impianti, durante la pianificazione del trattamento occorre decidere se l’impianto debba essere posizionato subito dopo l’estrazione dentale oppure se, prima dell’inserimento, debba passare alcune settimane per consentire la guarigione dei tessuti molli e duri della cresta alveolare. Se gli impianti immediatamente posizionati negli alveoli postestrattivi richiedono un incremento osseo, si consiglia di seguire la procedura seguente. Sollevare un lembo per permettere un facile accesso in corrispondenza del sito, inserire l’impianto. Adattare un materiale di sostegno a supporto della membrana stessa. In base alla morfologia del difetto osseo il materiale viene posizionato nello spazio fra le pareti dell’alveolo postestrattivo e la superficie implantare. Inoltre, in alcuni casi,
soprattutto in zona estetica, può essere necessario aumentare l’osso oltre la parete labiale dell’alveolo. Pertanto, il materiale di sostegno alla membrana viene applicato anche per correggere il profilo crestale e ottenere così un profilo tissutale più prominente in senso buccale. Viene poi posizionata una membrana di sostegno, avendo cura di ricoprire con essa il materiale di sostegno e una ristretta zona ossea adiacente; segue il riposizionamento e la sutura del lembo. Ogni qualvolta si riscontri una perdita parziale o totale della parte buccale dell’alveolo, viene applicata la procedura descritta per i difetti deiscenza.
Difetti di deiscenza (classi II e III)
Possono variare da una lieve mancanza di osso marginale alla presenza di ampie zone di superfici implantari denudate. Fino a che l’impianto può essere saldamente ancorato all’osso esistente, è possibile procedere contemporaneamente al suo inserimento e alla generazione ossea. Se il difetto è abbastanza piccolo, non è certo se una procedura di rigenerazione migliorerà o no il risultato terapeutico e la stabilità implantare sul lungo periodo. In caso di esigenze estetiche elevate, di norma si suggerisce di praticare una procedura di incremento laddove le raccomandazioni per altre aree della bocca non sono altrettanto rigorose. Occorre però comprendere bene che i dati scientifici a nostra disposizione non permettono di
affermare con certezza quali sia il confine tra le situazioni che richiedono l’incremento di osso e quelle che non lo richiedono[36].
Nei casi in cui si decida di procedere per la GBR, il materiale scelto deve soddisfare le seguenti condizioni: aver dimostrato la propria efficacia; essere stato sottoposto a ricerche
27
esaustive e scientificamente documentate; essere controllato a intervalli regolari. Studi clinici recenti hanno dimostrato che l’applicazione di sostituti ossei, abbinata al posizionamento di impianti, porta alla copertura soddisfacente delle superfici implantari precedentemente esposte[71,123,183]. La raccolta di osso autogenico per trattare difetti di deiscenza potrebbe, dunque, non essere sempre necessaria per il buon esito della terapia. Il materiale da innesto dovrebbe sostenere in modo affidabile l’intera area destinata all’incremento osseo, permettere, o meglio promuovere, la crescita interna di cellule di formazione ossea e sostenere la formazione del contatto osso-impianto. Tra tutti i materiali, il minerale osseo deproteinizzato di origine bovina è stato molto ben analizzato e ha sempre prodotto esiti clinici eccellenti[51].
Per scegliere la membrana adatta serve la stessa documentazione di base richiesta per i materiali di sostegno. Serve dunque che ne sia stata dimostrata l’efficacia, che sia stata sottoposta ad analisi accurate e scientificamente documentate, e che venga sottoposta a controlli a intervalli regolari. Altri parametri di scelta della membrana più adatta includono le proprietà meccaniche, il rischio di deiscenza dei tessuti molli e la facilità di manipolazione in fase clinica. Rispetto alle caratteristiche scientifiche e cliniche richieste, nella maggioranza dei casi di difetto di deiscenza la scelta di una membrana bioriassorbibile di collagene risulta ottimale. Al contrario, le membrane e-PTFE sono più adatte nei casi in cui la morfologia del difetto richieda di migliorare la stabilità dell’area da rigenerare. Oltre al notevole rischio di deiscenza dei tessuti molli, e della successiva infezione locale, lo svantaggio principale delle membrane non bioriassorbibili è costituito dalla necessità di un secondo intervento di
rimozione della membrana. Di conseguenza le membrane bioriassorbibili sono da preferire, per quanto possibile, in caso di trattamento di difetti di deiscenza di lieve e maggiore entità. Il protocollo clinico che promuova la formazione ossea in funzione del buon esito della copertura delle superfici implantari esposte prevede i punti seguenti: inserimento
dell’impianto dopo il rialzo di un lembo; nell’area del difetto di deiscenza buccale viene posizionato il materiale di sostegno alla membra, allo scopo di promuovere la formazione ossea per l’integrazione dell’impianto e ottenere un aspetto naturale dei profili ossei e dei tessuti molli della cresta alveolare; si provvede poi ad adattare e posizionare una membrana a copertura del materiale di sostegno e del difetto. Occorre in seguito stabilire come la
membrana alle pareti intatte del difetto osseo, facendola aderire tramite pin (chiodini), suturandola ai tessuti molli, o adattandola all’impianto. In seguito il lembo viene adattato e suturato, così da consentire la guarigione sommersa o transmucosa del sito implantare. Dopo
28
4-6 mesi di guarigione, il vecchio difetto è stato colmato da nuovo osso. Lo stesso protocollo clinico viene applicato al trattamento di difetti di deiscenza di maggiori dimensioni.
Difetti orizzontali (classe IV)
Il trapianto di un blocchetto autogenico rappresenta lo standard di riferimento per il trattamento di difetti crestali orizzontali[18,26,169]. Sono state descritte procedure di prelievo osseo sia da sei intraorali sia da sedi extraorali. Vengono preferiti i siti intraorali, in particolar modo per il trattamento dei difetti ossei localizzati in arcate parzialmente edentule[86]. A livello intraorale, i normali siti donatori sono il mento la regione retromolare della mandibola. Le procedure di raccolta intraorale presentano anche alcuni svantaggi, quali una disponibilità limitata di tessuto e complicanze tra cui una sensibilità alterata a livello dentale, disturbi neurosensoriali, deiscenza della ferita, infezione[127,170].
I vantaggi offerti dagli innesti di blocchetti autogenici consistono in disponibilità di un’ampia documentazione scientifica e clinica, buone proprietà di manipolazione, stabilizzazione dell’area destinata alla rigenerazione grazie alla possibilità di assicurare gli innesti in loco tramite viti in metallo, caratteristiche biologiche ottimali. Tra gli svantaggi si ricordano la morbilità del sito donatore, procedure di raccolta tecnicamente difficili e l’impossibilità di usare l’innesto come vettore dei fattori di crescita.
Le procedure cliniche richiedono la raccolta dell’innesto, l’adattamento dell’area del difetto, il fissaggio delle viti, la copertura con una membrana e la chiusura primaria con un lembo di tessuto molle. Durante il secondo intervento chirurgico, trascorsi quattro-nove mesi di guarigione, sono visibili i risultati della procedura di incremento e si può così procedere al posizionamento implantare.
Come descritto in precedenza, casi clinici e studi di coorte singola recentemente hanno descritto l’uso di osso deproteinizzato di origine bovina abbinato a membrane bioriassorbibili in collagene, riscontrando il buon esito dell’incremento osseo in corrispondenza di difetti laterali della cresta[58,73,185]. In gran parte dei casi, durante il secondo intervento chirurgico era stato possibile inserire gli impianti in posizione ottimale dal punto di vista protesico.
Questi studi recenti indicano come l’incremento crestale senza l’uso di blocchetti d’innesto autogenico possa diventare una procedura standard, purché siano garantiti gli opportuni protocolli.
29
Difetti verticali (classe V)
Le indicazioni per l’incremento crestale verticale comprendono i casi in cui l’altezza ossea residua sia troppo limitata per l’opportuno ancoraggio degli impianti orali, quando il risultante rapporto corona: impianto sia sfavorevole e quando la mancanza di tessuti duri e molli residui configuri la possibilità di risultati estetici sfavorevoli.
Le procedure raccomandate per il trattamento del paziente sono le stesse descritte per i difetti di classe IV, fatto salvo che il blocchetto osseo viene parzialmente o totalmente posizionato sopra la cresta perché il recupero osseo avvenga in senso verticale. A parte questo, i materiali e le tecniche applicati sono identici a quelli usati per l’incremento osseo laterale attraverso innesti ossei. Ovviamente, l’adattamento del lembo è più difficoltoso, a causa del maggior volume destinato alla rigenerazione che il lembo stesso deve rivestire.
Sembra che, in base al tipo di protocollo di trattamento clinico, si possibile recuperare
quantità variabili di altezza ossea. Non sono stati chiariti i fattori fondamentali del successo o del fallimento del protocollo. Inoltre, attualmente non esistono dati disponibili che indichino se esista un limite massimo biologicamente limitato di recupero osseo e, in caso affermativo, quali siano i parametri che influiscono su tale massimo.
30
1.4 Sostituzione di un elemento singolo in zona estetica
1.4.1 Introduzione
In seguito alla perdita di denti mascellari anteriori quasi tutti i pazienti hanno una reazione emozionale ben diversa rispetto a quella suscitata dalla perdita di denti posteriori. Appare necessaria la sostituzione del dente e le considerazioni economiche diventano meno
importanti. Nella regione anteriore contrariamente a quanto avviene nelle regioni posteriori il clinico trova maggiore resistenza da parte del paziente all’idea di preparare gli elementi adiacenti per un restauro protesico fisso a ponte. Questo poiché il paziente ritiene questo tipo di restauro protesico non in grado di soddisfare il suo bisogno estetico.
Nei pazienti giovani con perdita di uno degli incisivi in seguito a trauma il genitore è ansioso di provvedere alla loro sostituzione e ritiene l’impianto singolo la migliore sostituzione possibile. A causa di questi fattori psicologici uno dei siti più comuni per un impianto per un dente singolo è rappresentato proprio dall’incisivo centrale o laterale superiore. Nel 1994 il numero degli impianti utilizzati negli Stati Uniti era in media meno di due per paziente[172]. Dal 1990 al 1994 il numero degli impianti utilizzati in media per paziente è aumentato fino a tre volte[187]. Mentre la sostituzione di un dente con un impianto singolo in regione non estetica è diventata una procedura semplice e di routine quella di sostituzione di un dente in zona estetica è tuttora una delle procedure più complicate di tutta la chirurgia implantare. La difficoltà di questo trattamento è dovuta alla necessità estetica di dover restaurare sia i tessuti duri (osso e denti) sia i tessuti molli. La festonatura dei tessuti molli è spesso la parte più complicata del trattamento. Le possibili cause di mancanza di un dente singolo anteriore superiore sono le seguenti:
- Agenesia - Trauma - Fallimento endodontico - Frattura - Riassorbimento - Carie
Come ho detto in precedenza la sostituzione di un dente singolo mascellare è una della ricostruzioni più complesse. Tuttavia la terapia implantare è divenuta il trattamento di scelta alla luce dei vantaggi che questa metodica comporta: mantenimento dell’osso, ridotte complicanze a carico dei denti pilastro e loro aumentata sopravvivenza.
31
1.4.2 Revisione della letteratura
Solo intorno alla metà degli anni ’90 sono stati pubblicati i primi studi a lungo termine sulla sostituzione di un dente singolo con impianto osteointegrato[81]. I risultati di questi studi indicavano una percentuale di successo che variava dal 96% al 98,6%[65,119]. In una revisione sistematica di Creugers et al.[42] veniva riportata una percentuale totale di successo a 4 anni del 97%, con l’83% con un mantenimento senza complicazioni. Lindhe et al.[107] hanno pubblicato una meta-analisi su impianti con 9 studi su impianti singoli, con un totale di 570 corone singole con un follow-up da 1 a 8 anni e una percentuale di sopravvivenza del 97,5%. L’impianto per un dente singolo mascellare anteriore ha la più alta percentuale di successo rispetto a qualsiasi altra opzione di trattamento per sostituire denti mancanti con un restauro implantare (cioè overdenture, FPR corte, FPD dell’intera arcata o impianto per un dente singolo).
Di recente, è emersa la tendenza verso lo stadio unico che prevede l’estrazione e l’immediato inserimento implantare. Questa procedura appare particolarmente interessante nella zona estetica poiché la festonatura del tessuto molle è ideale prima dell’estrazione e poiché il paziente è contento di avere subito una sostituzione fissa. Vari studi hanno supportato questa metodica riportando una percentuale di successo del 99%[93] utilizzando impianti a uno stadio unico e a due stadi o addirittura raccomandando in situazioni specifiche lo stadio unico e il carico immediato[37,67,90].
Oltre alle percentuali di sopravvivenza dei singoli impianti diventa importante anche la prognosi degli elementi adiacenti agli impianti che risulta molto migliorata rispetto alle altre opzioni. Una casistica a 10 anni[136] ha indicato che i denti adiacenti prossimi all’impianto hanno minori carie, rischio endodontico, sensibilità, ritenzione di placca e anche un’evidenza minore di perdita dei denti adiacenti. Supportato da numerose evidenze scientifiche l’impianto per un dente singolo mascellare anteriore è diventato il trattamento di scelta quando i
parametri di osso e di spazio sono sufficienti oppure possono essere ricreati.
1.4.3 Fattori limitanti che influenzano il trattamento
Le percentuali di successo implantare nelle regioni mascellari sono molto elevate. Tuttavia le grandi aspettative del pazienti, i requisiti estetici ottimali e la difficile gestione dei tessuti molli e duri rendono complesso il restauro dei denti anteriori. Una corona singola supportata da impianto rappresenta una difficile sfida per il protesista[118]. I fattori limitanti che possono influenzare il piano di trattamento per la sostituzione di un dente singolo anteriore superiore