1
INTRODUZIONE
4
1.
LA
TIROIDE
5
1.1GLI ORMONI TIROIDEI 8
2.
PATOLOGIE
NODULARI
DELLA
TIROIDE
12
2.1CLASSIFICAZIONE ED EPIDEMIOLOGIA 12
2.2DIAGNOSTICA DEL NODULO TIROIDEO CLINICAMENTE MANIFESTO 14
3.TUMORI
ALLA
TIROIDE
17
3.1EPIDEMIOLOGIA E FATTORI DI RISCHIO DEL CANCRO ALLA TIROIDE 17
3.2ADENOMI 20 3.3TUMORI MALIGNI 21 3.3.1 Carcinoma papillare 21 3.3.2 Carcinoma follicolare 22 3.3.3 Carcinoma midollare 23 3.3.4 Carcinoma anaplastico 24
4.
ANALISI
CITOMORFOLOGICA
SU
AGO
ASPIRATO
26
5.
MARCATORI
TUMORALI
29
6.
LA
PROTEOMICA
32
7.
SELDI-TOF-MS
38
7.1COMPONENTI DEL PROTEINCHIP®SELDISYSTEM 40
7.1.1 ProteinChip®Arrays 41
7.1.2 ProteinChip®Reader 46
2
8.
STUDI
PROTEOMICI
SU
BIOMARCATORI
TUMORALI
DELLA
TIROIDE
54
8.1MARCATORI MOLECOLARI DELLA TIROIDE 54
8.2STUDI PROTEOMICI SU TESSUTO 56
8.3STUDI PROTEOMICI SU SIERO 60
8.4STUDI PROTEOMICI SU FNA 61
SCOPO DELLA TESI
67
MATERIALI E METODI
69
9. SELDI-TOF-MS: PROFILO PROTEOMICO DI FNA 70
9.1MATERIALI E STRUMENTAZIONE 70
9.2RECLUTAMENTO DEI PAZIENTI E RACCOLTA DEI CAMPIONI 70
9.3DOSAGGIO PROTEICO DC/BIORAD 72
9.3.1 Interferenza dell‟emoglobina 74
9.4PREPARAZIONE DEI PROTEINCHIP ARRAYS 75
9.5ACQUISIZIONE DEGLI SPETTRI 78
10.
ANALISI
STATISTICA
DEI
DATI
79
10.1ANALISI UNIVARIATA:TEST T-STUDENT 79
10.2ANALISI MULTIVARIATA:PCA(PRINCIPAL COMPONENTS ANALYSIS) 80
RISULTATI 84
11.
ANALISI
STATISTICA
SU
DATI
CITOLOGICI
85
3
CONCLUSIONE
102
4
5
1. LA TIROIDE
Il suo nome deriva dal termine greco “thyreoides”, che definisce la forma a scudo della ghiandola, la prima ad essere identificata come tale sulla base dello studio dei sintomi associati alla sua iper o ipofunzione. E‟ costituita da due lobi laterali, a forma di piramide triangolare ad apice superiore, del peso complessivo di 15-20 grammi nell‟adulto, riuniti inferiormente da un cordoncino orizzontale, l‟istmo della tiroide, dal quale si diparte un prolungamento sottile ascendente, il lobo piramidale, di lunghezza variabile, che rappresenta una variante normale (Fig.1).
6
La tiroide deriva embriologicamente da un‟estroflessione dell‟endoderma associato alla tasca faringea, che si sviluppa verso il basso fino a raggiungere la sua posizione nella regione cervicale anteriore, ai lati della trachea.
La ghiandola riceve una ricca irrorazione sanguigna dall‟arteria tireocervicale: il flusso ematico tiroideo raggiunge i 500-700 ml/min · 100g.
E‟ innervata dal sistema nervoso autonomo, da fibre ortosimpatiche e fibre vagali, che stimolano indirettamente la secrezione della ghiandola agendo sui vasi sanguigni.
La tiroide viene isolata superficialmente da un involucro di tessuto connettivo denso (capsula fibrosa) che proietta sottili sepimenti all‟interno della ghiandola, i quali si risolvono in una fine trama intorno alle strutture parenchimali, anch‟esse riccamente vascolarizzate.
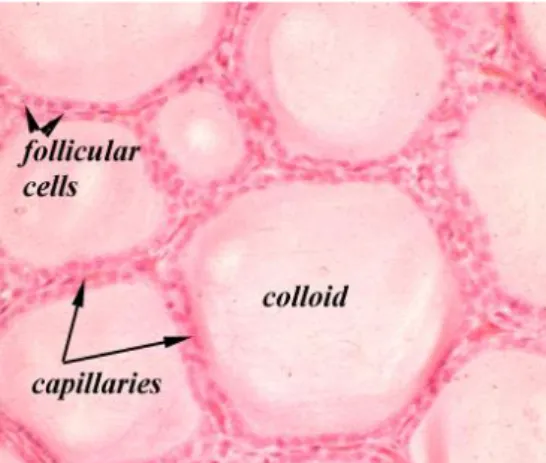
Il parenchima tiroideo è costituito da cellule di tipo epiteliale cubico che producono l‟ormone, disposte in modo da formare follicoli circolari di circa 200-300 m di diametro (fig.2). Un raggruppamento di 20-40 follicoli è definito lobulo.
7
L‟ormone neo sintetizzato viene accumulato nel lume follicolare sottoforma di materiale mucoide giallastro, la colloide.
Ciascuna cellula è rivestita alla base da una membrana basale ed è connessa, tramite giunzioni serrate, alle cellule adiacenti, sia a livello della regione basale sia di quella luminale. Quando la ghiandola è sottoposta a stimolazione intensa le cellule endocrine aumentano di volume e assumono una forma più cilindrica, con il nucleo spostato verso la base. Il lume dei follicoli appare allora frastagliato, a causa dell‟attiva digestione proteolitica della colloide che contiene l‟ormone. Sparse tra le cellule follicolari e negli interstizi tra i follicoli si apprezzano nidi o cordoni cellulari che corrispondono ad aggregati di cellule C o cellule parafollicolari. Sono una popolazione di cellule minoritaria che producono l‟ormone calcitonina, il quale è coinvolto nel controllo dell‟omeostasi del calcio, favorendone l‟escrezione renale, ostacolando l‟assorbimento intestinale e stimolandone la deposizione nelle ossa, in modo da inibire il riassorbimento dell‟osso da parte degli osteoclasti (azione ipocalcemica) Goodman&Gilman, 2006; Berne R.M., Levy M.N., 2000.
8
1.1 Gli ormoni tiroidei
La tiroide produce e mette in circolo un importante gruppo di ormoni, derivati amminoacidici iodati della tirosina (fig.3): la tetraiodotironina o tiroxina (T4) e la triiodotironina (T3). T3 è qualitativamente simile a T4
nella sua attività biologica, ma è molto più potente su base molare (circa 15 volte più attiva).
Figura 3 Formula di struttura della tirosina
La tiroide possiede la capacità di immagazzinare grandi quantità di ormone in sede extracellulare, come residui aminoacidici della tireoglobulina (Tg), che costituisce la maggior parte della sostanza colloidale dei follicoli tiroidei. La Tg è una glicoproteina precursore degli ormoni della tiroide, costituita per l‟1% da iodio, di cui il 60% in forma di iodotirosina e il 30% di iodotironine; contiene galattosio, galattosamina e mannosio.
Essa è biologicamente attiva, come gli ormoni tiroidei, ma è scarsa nel sangue. Gli ormoni tiroidei sono liberati a seconda delle esigenze dell'organismo. La funzione della ghiandola è controllata da un ormone rilasciato in circolo dalle cellule tireotrope dell‟adenoipofisi, la tireotropina o TSH (Thyroid Stimulating Hormone), una glicoproteina costituita dalle subunità α e β, che viene secreta in modo pulsatile e secondo un ciclo circadiano.
9
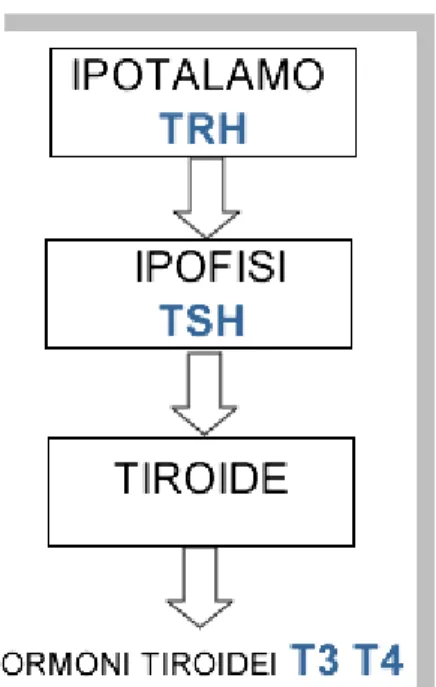
Le concentrazioni sieriche degli ormoni tiroidei sono finemente regolate dal TSH, in un classico sistema a feedback negativo. La secrezione ipofisaria di TSH è regolata a sua volta dall‟ormone di rilascio dell‟ormone tireotropo, o TRH (Thyrotropin Releasing Hormone) (fig.4).
Il TRH è un tripeptide ipotalamico, sintetizzato dai neuroni dell‟eminenza mediana e dei nuclei paraventricolari. Tramite il sistema portale ipotalamo-ipofisario, il TRH raggiunge le cellule tireotrope dell‟adenoipofisi, dove, interagendo con i propri recettori di membrana, stimola il rilascio dai granuli secretori del TSH preformato e la sintesi „ex novo‟ delle subunità α e β della tireotropina.
Anche la produzione del TRH a livello ipotalamico è regolata dal tasso ematico degli ormoni tiroidei, secondo un meccanismo a “feedback negativo”.
Figura 4 Gli ormoni tiroidei (T3 e T4) vengono secreti dalla tiroide in
risposta all'ormone ipofisario TSH, la cui produzione è a sua volta regolata dall'ormone ipotalamico TRH.
10
Per la sintesi degli ormoni tiroidei sono necessarie alcune componenti, quali la tirosina, messa a disposizione dalla Tg, lo iodio, che viene trasportato contro gradiente all‟interno del tireocita, e un enzima che permetta l‟organificazione dello iodio nella tireoglobulina.
La maggior parte dello iodio organico circolante è costituito dalla tiroxina, mentre la triiodotironina rappresenta una percentuale relativamente minore ( circa il 5%) e deriva per l‟80% dalla desiodazione di T4 in periferia.
Nel circolo sanguigno gli ormoni tiroidei sono trasportati da alcune proteine plasmatiche, tra le quali TBG (thyroxine-binding globulin o globulina legante la tiroxina) e TTR (prealbumina legante la tiroxina).
o TBG è una glicoproteina acida che costituisce il principale „carrier‟ degli ormoni tiroidei, legando una molecola di T4, con affinità più
elevata rispetto a T3.
o TTR (o transtiretina ) è una proteina di legame per il retinolo, presente in concentrazioni più elevate di TBG, costituita da quattro subunità apparentemente identiche, ma in realtà possiede solamente un sito di legame ad alta affinità sempre per T4.
Il legame alle proteine plasmatiche protegge gli ormoni tiroidei dal metabolismo ed escrezione, assicurando un‟emivita più duratura in circolo.
Solo gli ormoni “liberi” hanno attività metabolica: i livelli sierici biologicamente attivi sono mantenuti entro limiti piuttosto ristretti (0.03% di tiroxina e 0.3% di triiodotironina), che tuttavia assicurano una rapida disponibilità tissutale.
11
Gli ormoni tiroidei sono in grado di penetrare nelle cellule bersaglio e interagire con i propri recettori nucleari (TR).
La T4 si lega ai recettori con affinità notevolmente minore rispetto alla
T3. Il legame con TR media le azioni principali degli ormoni modulando
la trascrizione di specifici geni. T4 e T3 possiedono un ruolo critico nello
sviluppo dei vari apparati, soprattutto quello scheletrico e cerebrale. Anche nell‟adulto agiscono mantenendo l‟omeostasi metabolica e influenzando le funzioni di quasi tutti gli apparati, con una specifica azione termogenetica.
In generale, il risultato delle loro funzioni è un generale aumento della velocità del metabolismo basale Goodman&Gilman, 2006; Berne R.M., Levy M.N., 2000.
12
2. PATOLOGIE NODULARI DELLA TIROIDE
2.1 Classificazione ed epidemiologia
Le malattie della tiroide sono comuni e si presentano clinicamente secondo due modalità: cambiamento della dimensione o della forma della ghiandola (gozzi, iperplasie, neoplasie) e alterazioni della produzione ormonale, come quadri dovuti ad eccesso di ormoni tiroidei (ipertiroidismo) o insufficienza degli stessi (ipotiroidismo) Robbins, 2000.
I disturbi alla tiroide rivestono un‟importanza notevole, in quanto la maggior parte è suscettibile di trattamento medico o chirurgico e, comunque, è sempre possibile tenere sotto controllo la malattia
Goodman&Gilman, 2006.
Un nodulo tiroideo è una lesione discreta nella ghiandola tiroide che è palpabile e/o distinguibile ultrasonograficamente dal parenchima circostante. Sono l'espressione clinica di numerose patologie tiroidee: possono essere unici o multipli, in una ghiandola per altri versi normale o ingrandita. Pertanto, dal punto di vista clinico-patologico i noduli tiroidei possono essere classificati in Mazzaferri EL, 1993:
BENIGNI
o Noduli colloidi (in assoluto i più frequenti)
o Cisti (semplici, o a contenuto necrotico o emorragico)
o Adenomi (macrofollicolari, microfollicolari, a cellule di Hurtle; questi ultimi hanno probabilità elevata di trasformazione maligna)
13
MALIGNI
o Carcinoma papillare (il più frequente, 75-85%, tra le lesioni maligne)
o Carcinoma follicolare (10%) o Carcinoma midollare (5-10%)
o Carcinoma anaplastico (<5%, rappresenta la forma più aggressiva)
La crescita anormale delle cellule dei noduli della ghiandola è il problema endocrino più comune, soprattutto nelle aree caratterizzate da insufficiente apporto nutrizionale di iodio, responsabile di endemia gozzigena.
E‟ riscontrata sempre più di frequente anche nelle popolazioni in cui la carenza alimentare di iodio è stata corretta, come negli Stati Uniti, dove l‟incidenza di noduli tiroidei clinicamente valutabili varia tra il 4-7%, aumentando nel corso della vita adulta Gharib H, 2004 .
Il carcinoma tiroideo si manifesta generalmente come patologia nodulare tiroidea e quindi la diagnostica del nodulo tiroideo è di fondamentale importanza per selezionare la patologia tiroidea benigna da quella maligna Kim DL et al., 2008; Cooper DS et al., 2006.
Fortunatamente, la grande maggioranza dei noduli si rivelano lesioni benigne, sia condizioni localizzate non neoplastiche (iperplasia nodulare, cisti semplici o focolai di tiroidite) sia adenomi ( in oltre il 90% dei casi di neoplasia).
Soltanto una piccola percentuale dei noduli palpabili (5-10%) si rivela una lesione maligna Belfiore A. et al., 1992; Aghini-Lombardi F, et al., 1999.
14
Nella maggior parte dei casi i noduli non provocano problemi particolari, tanto da passare del tutto inosservati od essere occasionalmente scoperti. Solo in una minoranza dei pazienti i noduli tiroidei instaurano il quadro sintomatologico tipico della tireotossicosi (eccesso di ormoni tiroidei) o crescono al punto tale da creare problemi di fonazione e deglutizione, per compressione delle strutture circostanti quali esofago e trachea Marqusee et al., 2000.
2.2 Diagnostica del nodulo tiroideo clinicamente manifesto
Diversi criteri clinici possono essere utilizzati per avere una indicazione circa la natura di un certo nodulo tiroideo Mazzaferri EL, 1993; Krause K, et al., 2007:
o Un nodulo solitario è più facilmente neoplastico di quanto non lo siano i noduli multipli.
o Più giovane è il paziente e più alto è il rischio di una neoplasia. o Un nodulo in un maschio è più sospetto che in una donna
(rapporto tra donne e uomini che presentano noduli solitari è di 4/1).
o Un pregresso trattamento radioterapico della testa e del collo (per acne, ipertrofia del timo o delle tonsille) è associato ad un aumento dell‟incidenza di neoplasie tiroidee.
15
Dopo la raccolta dei dati anamnestici personali (identificazione dei fattori di rischio) e l‟effettuzione di un attento esame obiettivo della regione del collo del paziente (palpazione), gli accertamenti successivi includeranno:
Esami ematochimici ( FT3, FT4, TSH, Tg, Calcitonina, Anticorpi
anti-Tg o anti Tireoperossidasi) per verificare il funzionamento della tiroide.
L‟ecografia del collo, per verificare la presenza di uno o più noduli
e le loro caratteristiche (solido, liquido, ipo- iper- o isoecogeno, a margini definiti, la presenza di calcificazioni interne) o per guidare la tecnica dell‟agoaspirazione. Inoltre può essere arricchita con lo studio color e powerdoppler, che fornisce indicazioni sulla vascolarizzazione a livello nodulare.
La scintigrafia tiroidea crea immagini della tiroide con l‟uso dei radioisotopi, in particolare con I131. Serve per valutare se il nodulo
ha la capacità di concentrare lo iodio (nodulo “caldo”, soprattutto nei pazienti con ipertiroidismo) oppure non riesce a captarlo (nodulo “freddo”).
L‟agoaspirazione del nodulo tiroideo, mediante ago sottile (FNA),
permette di prelevare un discreto numero di cellule dall‟interno del nodulo stesso. E‟ utilizzato per la diagnosi citologica; deve essere sempre eseguito in presenza di un nodulo solitario scintigraficamente freddo.
16
In ultima analisi, a causa del numero elevato di esami citologici di FNA con diagnosi inconclusiva (circa 15%), sarà l‟esame morfoistologico del tessuto, eseguito dopo asportazione chirurgica, a identificare la natura del nodulo Yassa L et al., 2007¸ Cooper DS et al., 2006.
La classificazione istologica dei tumori epiteliali della tiroide è attualmente lo standard per discriminare i noduli benigni dai maligni e definirne i sottotipi specifici.
I principali criteri istologici che definiscono la malignità delle lesioni con diagnosi citologica inconclusiva sono l‟invasione capsulare e l‟invasione vascolare.
L‟invasione capsulare è definita come l‟interruzione completa della capsula che circonda la neoplasia che deve essere sempre dimostrata. L‟invasione vascolare è la presenza o protrusione, nei vasi adiacenti al tumore, di masse cellulari follicolari rivestite da endotelio.
Tuttavia, per alcune varianti tumorali, questi criteri sono di difficile attuazione.
Il loro limite risiede, in parte, nella loro soggettività, riscontrabile nella discreta variabilità interosservatore, soprattutto per le varianti follicolari; d‟altra parte, esiste la probabilità di perdere un‟invasione capsulare e vascolare durante la resezione chirurgica Franc B, et al., 2003; Pulcrano M et al., 2007.
L‟obiettivo principale nella classificazione dei differenti sottotipi tumorali è la distinzione dei diversi aspetti patobiologici, per migliorare sia la predittività della prognosi che la scelta delle diverse strategie terapeutiche.
17
3.TUMORI ALLA TIROIDE
3.1 Epidemiologia e fattori di rischio del cancro alla tiroide
Il cancro alla tiroide è la malattia più comune del sistema endocrino, rappresentando approssimativamente 1% di tutti i tumori maligni Liu S,et al., 2001; Farahati J., et al., 2004.
Secondo le più recenti ricerche epidemiologiche, nei Paesi Occidentali la sua incidenza ha avuto un rapido incremento, in particolare per i carcinomi tiroidei a basso rischio. Infatti, l‟incremento è inversamente correlato alle dimensioni del tumore, alla presenza di linfoadenopatie laterocervicali palpabili e di metastasi a distanza.
Oltre alla progressiva diffusione della patologia nodulare, i fattori che incidono su questo parametro sono: il miglioramento dell'educazione sanitaria nella popolazione, l'introduzione e diffusione dell'ecografia nella diagnostica delle patologie tiroidee, il miglioramento delle tecniche di diagnosi anatomo-patologica, in particolare per quanto concerne la diagnosi citologica su ago-aspirato delle lesioni nodulari, terapeutiche e di follow-up, che hanno consentito la diagnosi di un elevato numero di carcinomi tiroidei asintomatici ed in fase preclinica.
In generale,l‟aumento di incidenza sembra più apparente e dovuto ad una più accurata e precoce diagnosi. Si può osservare, inoltre, una riduzione del tasso di mortalità per patologia tumorale tiroidea (causa solo lo 0,29% delle morti per cancro) e ciò trova spiegazione anche nel maggiore apporto alimentare di iodio, che influenza l'istotipo del tumore e quindi la prognosi Jemal A, et al.,2009; Davies L et al., 2006.
18
Infatti, quando viene eseguito un corretto management terapeutico, la sopravvivenza a 5 anni dalla diagnosi è approssimativamente del 85-90%. La percentuale residua comprende forme molto aggressive e relativamente resistenti alla chemioterapia o alle radiazioni esterne
Gimm O., 2001.
Ad oggi, il tumore alla tiroide è la sesta patologia tumorale più comune nelle donne, la seconda nelle donne sotto i 40 anni.
Al contrario, i casi in età giovanile e quelli dell‟età adulta avanzata non mostrano predilezione di sesso Gagel RF, 1996; Enewold L et al., 2009. Come per la maggior parte delle neoplasie solide, anche per i tumori della tiroide l'eziologia sembra essere multifattoriale, risultato di una complessa interazione di fattori genetici ed ambientali nei soggetti a rischio. Tra i fattori di rischio del cancro alla tiroide troviamo Nagataki S et al., 2002; Mack WJ et al., 2002:
o Età e genere dell‟individuo (sono più facilmente maligni nei soggetti maschi, in quelli oltre i 60 anni, nei bambini e negli adolescenti);
o precedente esposizione a radiazioni ionizzanti (incidenti nucleari, irradiazione esterna della regione del collo, soprattutto in età infantile);
o familiarità per carcinoma tiroideo o poliposi familiare; o preesistente patologia tiroidea benigna;
o fattori ormonali e gravidanze; o massa corporea (obesità); o apporto alimentare di iodio
19
E‟ stato osservato, come principale fattore di rischio, l‟esposizione a radiazioni ionizzanti. In passato la terapia radiante è stata utilizzata ampiamente per il trattamento di un certo numero di lesioni della regione del collo in neonati e bambini, come la tonsillite o l‟acne o per neoplasie oncologiche ed ematologiche, come il linfoma o le leucemie
Pui CH et al., 2003.
E‟ nota in questi soggetti l'aumentata incidenza di patologia tiroidea, in particolare di carcinoma, rispetto ai coetanei non sottoposti a tali interventi terapeutici. Infatti, fino al 9% degli individui sotto terapia nella fanciullezza hanno poi sviluppato neoplasie maligne, generalmente alcune decadi dopo l‟esposizione Schlumberger MJ, 1998; Pui CH et al., 2003.
In alcune aree geografiche e in alcuni periodi della storia, i tumori tiroidei sono insorti dopo contaminazione dell‟ambiente da parte di scorie nucleari: l‟esplosione della centrale nucleare di Chernobyl è stato un evento drammatico esemplificativo Stsjazhko VA et al., 1995; ; Leenhardt L et al., 2000.
Il tempo tra l‟esposizione alle radiazioni e l‟insorgenza del tumore tiroideo e‟ piuttosto lungo, in media 25 anni Hegedus L, 2004; Mandel SJ, 2004.
Fattori ereditari che possono predisporre l‟insorgenza di un tumore della tiroide sono rilevanti soprattutto per un particolare tipo di tumore poco differenziato, il carcinoma midollare Laure Giraudet A et al., 2008].
20
3.2 Adenomi
Tradizionalmente gli adenomi tiroidei si differenziano dalle lesioni iperplastiche perchè si presentano come noduli solitari circondati da una sottile capsula fibrosa.
A parte rarissime eccezioni, derivano dalle cellule follicolari, quindi vengono chiamati adenomi follicolari (FTA).
Essi possono essere classificati secondo la dimensione o presenza di follicoli, tipo e grado di cellularità. Sono comuni aree di emorragia, fibrosi, calcificazione e degenerazione cistica simili a quelle dei gozzi multinodulari. Un‟attenta valutazione dell‟integrità capsulare è importante per distinguere un adenoma capsulare da un adenoma follicolare ben differenziato.
Si riconoscono vari sottotipi istologici di adenomi, basati sul grado di formazione di follicoli ed il loro contenuto di colloide: macrofollicolare (colloideo semplice), microfollicolare (fetale), embrionale (trabecolare), a cellule di Hurthle (ossifile od oncocitario), atipico e papillare.
Gli adenomi colloidei semplici (macrofollicolari) rappresentano la forma più comune e ricordano strettamente il parenchima tiroideo normale. Gli altri ricapitolano differenti stadi dello sviluppo embriologico della tiroide normale e condividono caratteri architetturali con il carcinoma follicolare. Sono classificazioni su base puramente istologica, dotate di un limite intrinseco, poiché sono comuni le forme miste, e inoltre non vengono presi in considerazione gli aspetti funzionali e molecolari. Clinicamente sono di difficile distinzione, da una parte da focolai di iperplasia follicolare e, dall‟altra, dai più rari carcinomi follicolari
21
3.3 Tumori maligni
I carcinomi differenziati della tiroide, il carcinoma papillare (PTC) e quello follicolare (FTC), comprendono la grande maggioranza (90%) dei tumori a carico della ghiandola.
Quelli poco differenziati sono rari, ma la loro aggressività è molto elevata e inevitabilmente portano alla morte entro pochi mesi Pulcrano M, et al., 2007.
3.3.1 Carcinoma papillare
E‟ la forma più comune di carcinoma tiroideo, può manifestarsi a qualunque età, ma insorge più spesso tra la terza e la quinta decade. Rappresenta la maggioranza dei tumori maligni della tiroide associati a pregressa esposizione a radiazioni ionizzanti Schlumberger MJ, 1998. E‟ aggressivo nei bambini e nelle persone che hanno più di 40 anni, nettamente meno nei giovani adulti Franssila K, 1975.
Dal punto di vista anatomo-patologico questo tumore rappresenta l‟oncotipo delle forme differenziate. Microscopicamente la lesione può avere dimensioni diverse: il suo diametro può variare da pochi millimetri a molti centimetri.
PTC è costituito da lesioni solitarie o multifocali. Esistono varianti che devono essere riconosciute in quanto alcuni di questi tumori possono essere ben circoscritti e persino incapsulati, mentre altri, a margini irregolari, possono infiltrare il parenchima adiacente e metastatizzare preferibilmente nelle stazioni linfonodali regionali. Sono improbabili le metastasi a distanza.
22
La diagnosi è basata su caratteri nucleari, piuttosto che sull‟architettura papillare: i nuclei contengono cromatina finemente dispersa che conferisce un aspetto otticamente chiaro. Spesso si notano i corpi psammomatosi, cioè calcificazioni lamellari nell‟ambito della lesione, di solito al centro delle papille Robbins, 2000.
La maggior parte delle lesioni papillari appare come un nodulo freddo, solitamente solitario, asintomatico, anche se la prima manifestazione può essere data da una massa in un linfonodo cervicale.
3.3.2 Carcinoma follicolare
FTC sono la seconda forma, in ordine di frequenza, delle neoplasie maligne tiroidee (dal 10 al 20%). L‟incidenza di queste neoplasie aumenta soprattutto nelle zone a carenza di iodio, suggerendo che un gozzo multinodulare è una condizione idonea per il loro sviluppo Gagel RF, et al., 1996.
E‟ definito come un qualsiasi tumore maligno della tiroide con differenziazione cellulare follicolare. Sono noduli solitari indolenti che possono essere ben circoscritti o infiltranti. Le lesioni nettamente demarcate possono essere di distinzione macroscopica molto difficile dagli adenomi follicolari. Le lesioni di dimensioni maggiori possono invadere la capsula e dare luogo a infiltrazione ben oltre di essa nei tessuti cervicali adiacenti. Hanno scarsa propensione all‟invasione linfatica, quindi le stazioni regionali appaiono raramente coinvolte, mentre l‟invasione vascolare è comune, con diffusione a ossa, polmoni, fegato e altre sedi. Non avendo peculiari caratteristiche morfologiche, criteri certi di malignità sono la presenza di invasione capsulare,
23
invasione vascolare ed infiltrazione del parenchima adiacente.
La necessità di avere un esame istologico definitivo obbliga i pazienti con "proliferazione follicolare" a subire un intervento di emitiroidectomia con finalità diagnostica.
La prognosi dipende sostanzialmente dalle dimensioni al momento della diagnosi, dall‟estensione dell‟invasione capsulare e dei vasi ematici e dal livello di anaplasia della lesione Schlumberger MJ, 1998.
3.3.3 Carcinoma midollare
A differenza delle altre forme di carcinoma tiroideo già descritte, il carcinoma midollare (MTC) è una neoplasia neuroendocrina di derivazione dalle cellule parafollicolari della tiroide. Queste neoplasie presentano insorgenza sporadica nell‟80% dei casi circa. Nel rimanente 20% si verificano nell‟ambito di una sindrome MEN IIA o IIB (Neoplasie Endocrine Multiple) o come neoplasie familiari svincolate da una sindrome MEN. La calcitonina soddisfa i criteri per essere considerata biomarcatore sierico per MTC [Holyoke, E.D. et al., 1981].
La sua determinazione riveste un importante ruolo nella diagnosi e nel monitoraggio postoperatorio del paziente con MTC, risultando più sensibile e specifica per le forme familiari Ball DW, et al., 1996; Laure Giraudet, A et al., 2008].
In combinazione con l‟esame citologico di ago aspirato tiroideo, la calcitonina è in grado di ottimizzare la sensibilità e la specificità della diagnosi di MTC.
Tuttavia, non è un test infallibile e le misurazioni sono diverse a seconda del test utilizzato [Bieglmayer, C. et al., 2007].
24
Inoltre, l‟aumento dei livelli di calcitonina non è esclusivo di MTC, ma è stato osservato in altre condizioni, quali iperplasia delle cellule C, noduli della tiroide, l'aumento dell'età e dell'indice di massa corporea, fumo di sigaretta, allattamento al seno e carcinoma a piccole cellule del polmone [van Veelen, W. Et al., 2009].
Tuttavia, l‟ipercalcemia si verifica in queste situazioni con una prevalenza inferiore al 5% [d'Herbomez, M. et al., 2007].
Il suo livello nelle forme sporadiche e in quelle correlate a MEN IIB è associato con la crescita della massa tumorale. E‟ dimostrata la sua presenza nei carcinomi di grandi dimensioni con linfonodi o metastasi a distanza [Laure Giraudet, A et al., 2008].
Le forme familiari non associate a MEN sono lesioni piuttosto indolenti e spesso la diagnosi avviene grazie al controllo dei livelli di calcitonina nei familiari di un paziente già portatore di carcinoma. Al contrario, in pazienti con tumore MTC metastatizzante poco differenziato sono stati trovati bassi livelli di calcitonina, a causa dell‟eterogeneità cellulare, mentre sono stati rilevati alti livelli dell‟antigene carcinoembrionale (CEA). Queste sono le lesioni più aggressive, con disseminazione ematogena e tasso di sopravvivenza a 5 anni dalla diagnosi di circa il 50% Lippman S.M. et al., 1982.
3.3.4 Carcinoma anaplastico
I carcinomi anaplastici della tiroide sono neoplasie indifferenziate dell‟epitelio follicolare tiroideo. Meno del 5% dei carcinomi tiroidei rientrano in questa categoria. In netto contrasto con le forme differenziate, i carcinomi anaplastici sono molto aggressivi, con una
25
mortalità prossima al 100% Tan RK, 1995.
Insorgono più spesso in individui di maggiore età rispetto agli altri isotipi, con una media di 65 anni. Circa la metà dei pazienti presenta una storia di gozzo multinodulare, il 20% una di carcinoma differenziato, dal 20 al 30% presenta una concomitante neoplasia differenziata, frequentemente papillare.
Queste osservazioni hanno portato a ipotizzare che la forma anaplastica possa derivare da tumori meglio differenziati, come risultato di più alterazioni genetiche avvenute nel tempo. Ad esempio, mutazioni puntiformi inattivanti nel gene oncosoppressore p53 sono rare nei carcinomi tiroidei ben differenziati, ma comuni nei tumori anaplastici
Ito T, et al., 1992; Fagin JA, et al., 1993.
Si accresce rapidamente, con invasione delle strutture iuxtatiroidee quali l'esofago e la trachea, comportando disfagia e dispnea. Può presentare pattern istologici diversi, nei quali o non è più riconoscibile una componente epiteliomorfa o nei quali sono presenti aree di differenziazione epiteliale talvolta con componente squamoide. Questo istotipo ha un'evoluzione rapida con prognosi infausta e coinvolgimento massivo delle strutture adiacenti e metastasi linfonodali ed ematiche. Nella maggior parte dei casi, al momento della diagnosi la neoplasia ha già oltrepassato la capsula tiroidea e invaso i tessuti circostanti o metastatizzato ai polmoni. Non esiste allo stato attuale una terapia efficace e la malattia risulta invariabilmente fatale. Nonostante sia comune la metastatizzazione a sedi distanti, la morte sopravviene, quasi sempre in meno di un anno, a causa della crescita aggressiva e della compromissione di strutture vitali del collo Robbins, 2000.
26
4. ANALISI CITOMORFOLOGICA SU AGO ASPIRATO
Applicazione della tecnica FNA nella diagnosi differenziale
L‟agoaspirazione (FNA) consiste nel prelievo del materiale, solido o liquido, contenuto nelle tumefazioni che si possono formare in varie parti del corpo.
In particolare, il materiale è prelevato dal nodulo tiroideo mediante un sottile ago inserito attraverso il collo, successivamente viene esaminato in laboratorio, al fine di scoprirne la natura. Devono essere sottoposti ad ago aspirazione tutti i noduli palpabili, soprattutto se singoli, o noduli non palpabili, dimostrabili ecograficamente.
La tecnica è diventata strumento clinico di primo impatto e a maggior resa in termini di rapidità e accuratezza nella diagnosi della natura delle lesioni tiroidee nodulari, in particolare del carcinoma papillare, anaplastico, midollare e delle patologie infiammatorie.
Ha funzione principale di screening: è l‟esame di prima scelta per la diagnosi di malignità o benignità di un nodulo tiroideo in situazione di eutiroidismo. Generalmente, seleziona i pazienti che necessitano di intervento chirurgico o di un trattamento adeguato Layfield L et al., 2009.
Confrontato con l‟istologia, se il materiale prelevato è sufficiente, presenta un‟accuratezza compresa tra il 70% ed il 93%, una specificità del 92-98% ed una sensibilità del 65-99% Chen H, et al., 1997; Yang, G et al., 2001. In base ai risultati ottenuti con l‟esame citologico, il 60-75% dei noduli osservati si rivelano benigni, il 5-15% maligni, mentre, nel 15-20% dei casi, il nodulo è classificato come “sospetto” o
27
“indeterminato” in quanto non è effettuabile una corretta diagnosi. Come supporto viene usata la tecnica eco guidata, per aumentare l‟adeguatezza del prelievo nei noduli minori o uguali a 1 cm, non palpabili, o quando il prelievo si è rivelato non diagnostico in un esame precedente. Per il raggiungimento di risultati ottimali è necessaria un‟elevata preparazione ed esperienza sia nell‟esecuzione dell‟esame che nell‟interpretazione del materiale citologico; per questo può essere definita una metodica particolarmente “operatore dipendente”.
L‟aspirazione di un nodulo della tiroide non richiede ricovero in ospedale nè alcuna preparazione del paziente. Dopo l‟esame è possibile riprendere immediatamente le proprie attività abituali.
Il 15-20% degli esami citologici su FNA è classificato citologicamente come “sospetto” o “indeterminato” e i pazienti rischiano di essere sottoposti ad inutili interventi chirurgici Brown LM, et al., 2006.
Tra le lesioni “non diagnosticabili” sono presenti i noduli follicolari, caratterizzati da una predominanza di cellule epiteliali follicolari raggruppate in microfollicoli con scarsa colloide Carling T,et al., 2005. Nel quadro citologico microfollicolare è compreso un gruppo eterogeneo di lesioni, con differente istologia: l‟iperplasia follicolare benigna, l‟adenoma follicolare, il carcinoma follicolare e la variante follicolare del carcinoma papillare. I criteri citologici per la diagnosi dei carcinomi follicolari differenziati sono del tutto sovrapponibili a quelli degli adenomi microfollicolari, non permettono di distinguere l‟adenoma follicolare dal carcinoma ed il carcinoma follicolare dalla variante follicolare del carcinoma papillare Mesonero CE, et al., 1998; Baloch ZW et al.,2003.
28
Recentemente è stata proposta una suddivisione della generale categoria “a citologia indeterminata” in tre sottocategorie, con una probabilità predittiva crescente di tumore malignoBaloch ZW et al., 2008:
o FLUS, lesione follicolare di significato indeterminato o Neoplasia follicolare o oncocitica (a cellule di Hűrtle) o Malignità sospetta
Tra gli interventi di rimozione dei noduli tiroidei sospetti, solo per 8-56% dei casi è stata riscontrata una lesione maligna Baloch ZW,et al., 2002 (a); Mazzaferri EL, 1993; Yassa L et al., 2007.
Si tende a rimuovere chirurgicamente gran parte delle lesioni nodulari tiroidee più per problemi diagnostici che per reale necessità terapeutica, praticando interventi di asportazione della tiroide parziali o totali.
Una volta rimossa la tiroide, il paziente è costretto ad assumere farmaci per rimpiazzare gli ormoni che la ghiandola normalmente produce. Il notevole numero di operazioni contribuisce ad aumentare la morbilità e il costo della sanità Callcut RA, et al., 2004.
Inoltre, 1-3% dei noduli diagnosticati benigni nella citologia si rivelano maligni in follow up successivi (falsi negativi): la mancanza di trattamento durante il periodo antecedente alla diagnosi definitiva mette questi pazienti a rischio di progressione della malattia Cooper DS, et al., 2006.
Poiché gran parte dei noduli microfollicolari si rivelano benigni all‟esame istologico, sarebbe auspicabile possedere alcuni strumenti che permettano un‟accurata diagnosi differenziale preoperatoria Carling T,et al., 2005.
29
5. MARCATORI TUMORALI
Da molti anni si avverte la necessità di identificare nei liquidi biologici di portatori di forme neoplastiche composti che possano costituire degli indicatori della loro presenza nell‟organismo.
Questi composti dovrebbero consentire una diagnosi precoce, prima che siano resi evidenti i segni clinici della malattia e, di conseguenza, permettere un intervento terapeutico tempestivo.
Inoltre potrebbero essere usati clinicamente per monitorare il trattamento terapeutico o le ricadute nella malattia. Tali sostanze sono indicate con il termine di marcatori tumorali.
Un marcatore tumorale, per essere definito ideale, dovrebbe perciò possedere diversi requisiti e precisamente Herberman R.B., 1977:
o Avere un‟alta sensibilità, vale a dire presentare valori patologici nella gran maggioranza dei soggetti affetti da neoplasia e quindi non fornire risultati falsi negativi, cioè valori normali in soggetti affetti da tumore;
o Avere un‟alta specificità, vale a dire risultare normale in soggetti non affetti da neoplasia, sia sani che affetti da forme morbose non neoplastiche: deve quindi fornire un minimo numero di risultati falsi positivi, cioè di valori patologici in soggetti non affetti da neoplasia. Inoltre deve essere selettivo per un determinato tipo di tumore in modo da consentire una diagnosi specifica e non generica di neoplasia
30
o Trovarsi nei liquidi biologici in quantità sufficiente da poter essere determinato con metodi relativamente semplici, riproducibili e poco costosi tali da poter essere adatti per un‟indagine di massa;
o Avere una concentrazione nei liquidi biologici correlata con il volume della massa neoplastica;
o Essere in grado di monitorare le possibili ricadute.
È bene sottolineare che, al momento attuale, non esiste alcun marcatore tumorale assoluto, ovvero nessuna sostanza che sia esclusivamente presente e misurabile in una determinata neoplasia e assente in condizioni di normalità o in corso di patologie non neoplastiche. Questo accade perché le cellule tumorali sono molto simili alle cellule normali nella produzione di una o più sostanze esclusive di quella condizione. La principale differenza è dovuta al forte aumento dell‟attività metabolica e al relativo rilascio in circolo di elevate quantità di sostanze da parte delle cellule tumorali rispetto alle cellule in condizioni normali.
L‟utilità dei marcatori oncologici come spia della presenza di una neoplasia si basa, quindi, su un criterio quantitativo e sulla determinazione di un livello soglia (cut-off) al di sopra del quale si ritrova la maggior parte dei pazienti affetti da neoplasia maligna. Infatti, quanto più elevato è il livello di un marcatore, tanto maggiore è la probabilità che il paziente abbia un tumore Federici G, et al., 2003. Sono passati più di 40 anni da quando furono introdotti per la prima volta marcatori biologici per cercare di rilevare e gestire il cancro alla tiroide Milhaud G et al.,1974.
Alla prima generazione appartengono i biomarcatori sierici calcitonina e tireoglobulina, che hanno contribuito a migliorare la gestione del cancro
31
della tiroide. Ciononostante, con l‟evoluzione delle conoscenze sulla patogenesi molecolare del carcinoma è arricchito/cambiato anche il concetto di biomarcatore, come strumento utile non solo per la diagnosi precoce in sè, ma anche per selezionare i pazienti che possono essere osservati in sicurezza nel tempo da quelli che necessitano dell‟intervento di tiroidectomia o lobectomia, per rilevare recidive o predire l'efficacia della chemioterapia [Srinivas, P.R et al., 2001; Shibru D et al., 2008]. La ricerca di saggi per un unico biomarcatore da utilizzare nella diagnosi precoce si sta rivelando un approccio fallimentare, perché è sempre più ovvio che i sistemi fisiologici e patologici hanno una genesi multifattoriale.
Inoltre, a causa dell‟eterogeneità della popolazione, un biomarcatore può indicare malattia in un gruppo, ma essere statisticamente non significativo per un altro.
32
6. LA PROTEOMICA
Il termine proteoma fu coniato per descrivere il completo assetto delle proteine codificato da un genoma.
Questa prima definizione non prendeva in considerazione il suo carattere altamente dinamico, che muta in base allo stato delle cellule (età, malattia) e all‟ambiente extracellulare: cellule dello stesso tipo possono esprimere proteine diverse in condizioni diverse Choudhary J, et al. 2004.
Lo studio di una popolazione o di tutte le proteine espresse da un organismo, tessuto o cellula, in un preciso istante e stato fisiologico, offre vantaggi che vanno oltre quelli ottenuti con l‟analisi del genoma
Wilkins MR et al., 1996.
Gli studi sul genoma e trascriptoma hanno migliorato significativamente la comprensione della carcinogenesi, tuttavia è riconosciuto che da soli hanno valenza limitata, poiché il cancro è una malattia non solo a livello genico, ma coinvolge anche l‟assetto proteico. Le informazioni acquisite dal proteoma riflettono non solo l‟espressione del profilo genomico della cellula, ma anche i cambiamenti post traduzionali, non rilevabili a livello del mRNA, e i cambiamenti nei livelli d‟espressione proteica, in tempi diversi, durante il processo di trasformazione maligna Srinivas, P.R,et al., 2001; Wilkins M.R,et al., 1996; Krause K,et al., 2009.
Infatti le proteine sono i principali effettori molecolari delle nostre funzioni vitali e la funzione di una proteina dipende dalla sequenza amminoacidica, struttura tridimensionale, modificazioni post-traduzionali, concentrazione proteica, dalle interazioni con altre
33
proteine e dalle condizioni dell‟ambiente extracellulare.
Le cinque categorie di studio del proteoma sono le seguenti: identificazione delle proteine, analisi quantitativa del contenuto proteico, interazioni tra proteine, modificazioni post-traduzionali e analisi strutturale del proteoma.
La proteomica può essere suddivisa in due settori principali:
o proteomica profiling fornisce la descrizione dell‟intero proteoma di una cellula, organismo o tessuto. Lo scopo è l‟identificazione delle proteine presenti nel campione.
o proteomica funzionale fornisce la caratterizzazione di alcune proteine (attività, interazioni, modificazioni post-traduzionali) per comprendere meccanismi cellulari a livello molecolare. Lo scopo è caratterizzare un piccolo numero di proteine implicate nella questione biologica studiata, nella specifica funzione o fenotipo. Le metodiche di proteomica funzionale sono adatte allo studio delle vie di trasduzione del segnale, in particolare rendono possibile il monitoraggio di eventuali cambiamenti nel pattern proteico di cellule, tessuti o organismi in seguito a stati morbosi o a trattamenti con farmaci Godovac-Zimmermann J,et al., 1999; Stults JT,et al., 2005.
Quindi, la proteomica è in grado di informarci sull‟impatto delle mutazioni geniche sui processi funzionali e dinamici mediati dalle proteine all‟interno della cellula. E‟ uno stimolante campo di ricerca per identificare le proteine, svelarne le correlazioni con definiti quadri fisiopatologici e usare queste conoscenze per la creazione di targets terapeutici o biomarcatori diagnostici Stults JT,et al., 2005.
34
Le analisi proteomiche sono un valido strumento per determinare la presenza di biomarcatori o pattern di questi, per confrontare profili d‟espressione tra differenti gruppi e produrre una lista di peptidi/proteine che siano differenzialmente espresse Petricoin EF et al., 2004.
La presenza di proteine diversamente modificate può riflettere uno specifico fenotipo maligno e quelle specifiche proteine possono diventare importanti marcatori tumorali Godovac-Zimmern J, et al., 1999; Chen G et al., 2002.
Le principali tappe nella ricerca di biomarcatori (biomarker discovery) mediante analisi proteomica sono le seguenti:
o Study Design: comprende la definizione del quesito clinico, la selezione di campioni prestabiliti e relativi controlli, l‟esecuzione di studi pilota.
o Discovery: ricerca ed identificazione di proteine differenzialmente espresse.
o Validation: utilizza un set indipendente e numeroso di campioni per convalidare i migliori marcatori identificati con predittività elevata, indaga la loro presenza nei fluidi biologici interessati. o Assay: sviluppo di un saggio per la ricerca e validazione del
biomarcatore .
A causa della eterogeneità delle proteine, per la ricerca proteomica sono state sviluppate varie tecnologie che integrano metodi biologici, chimici ed analitici.
Il primo metodo che permise di visualizzare e risolvere simultaneamente centinaia di proteine fu l‟elettroforesi bidimensionale (2D-GE),
35
sviluppata negli anni settanta. Ad oggi l‟applicazione sta avendo una nuova rinascita nello studio comparativo dei profili d‟espressione, grazie allo sviluppo delle conoscenze e tecnologie di base.
Nel 2D-GE le proteine sono separate in due fasi consecutive:
o la prima dimensione separa le proteine contenute nel campione secondo il loro punto isoelettrico, mediante metodo elettroforetico IEF (“isoelettrofocusing”), che utilizza come supporti delle strips di gel di poliacrilammide. Questa fase è importante per la risoluzione del campione.
o la seconda dimensione separa i polipeptidi secondo il peso molecolare, mediante SDS-PAGE (“elettroforesi su gel di poliacrilammide”), una tecnica elettroforetica che utilizza gel di poliacrilammide.
Dopo la separazione bidimensionale, gli spots possono essere visualizzati mediante colorazione all‟argento o al Coomassie Colloidale.
Le differenze nell‟espressione delle proteine possono essere confrontate, quantificando i rapporti d‟intensità degli spots presenti in gels indipendenti di differenti campioni.
Le proteine d‟interesse possono essere identificate tramite spettrometria di massa.
Matrix-assisted-lase-desorption-ionization time-of-flight mass-spectrometry (MALDI-TOF-MS) è particolarmente utilizzata, in combinazione con la 2D-GE, per identificare gli spot proteici dei gels preparativi colorati al Coomassie Colloidale Wilkins MR et al., 1996; Pandey A et al., 2000.
36
Questa procedura possiede alcuni limiti in campo clinico, tra cui la difficile applicazione in programmi di screening su larga scala.
La bassa capacità di prestazione è il problema maggiore per l‟identificazione di biomarcatori validi e utili clinicamente, perchè sarebbe auspicabile un confronto tra centinaia di campioni.
Inoltre la metodica richiede tempo, non riesce a separare proteine/peptidi di piccola massa (<15.000 Da) o con valori di pI estremi. Tuttavia la proteomica ha a disposizione nuove tecnologie ad elevate capacità di prestazione, basati sulla spettrometria di massa, che possono essere usati per la ricerca di nuovi biomarcatori.
Un approccio su „biomarker discovery‟ utilizza MS in combinazione con una tecnica di ionizzazione (MALDI-TOF, SELDI-TOF o l‟electrospray ionization), che migliora la sensibilità e rapidità di rilevazione di specifici biomarcatori o profili proteici Srinivas PR,et al., 2001; Wulfkuhle JD,et al., 2003; Gillette MA,et al., 2005.
SELDI-TOF-MS è una tecnologia succedanea al MALDI, che consente la rilevazione simultanea dei livelli d‟espressione delle proteine, trattenute su una superficie cromatografica, comprese in un vasto range di pesi molecolari, di campioni biologici, di condizioni diverse.
Le differenze nei livelli d‟espressione proteica possono quindi essere utilizzate per identificare uno stato di malattia, o per distinguerne diverse fasi.
L‟analisi dei patterns proteici è un approccio innovativo per la diagnosi di malattia e le tecnologie ProteinChip® hanno la possibilità di entrare a
far parte della clinica di laboratorio come strumenti di routine Wiesner A., 2004.
37
Un secondo metodo utilizza la tecnica di digestione proteolitica, esponendo i campioni proteici alla cromatografia liquida ad alta efficienza e combinandola con analisi tandem MS (LC-MS) Shen, Y,et al., 2004; Gillette MA,et al., 2005.
Con l‟avvento di tecnologie sempre più all‟avanguardia, la MS è diventata strumento di routine nel campo della proteomica per l‟identificazione delle proteine.
Pertanto, tecnologie sofisticate come MALDI-TOF-TOF e MALDI-Q-TOF consentiranno frammentazioni estese da permetterne l‟identificazione univoca Wulfkuhle JD,et al., 2003.
38
7. SELDI-TOF-MS
(Surface enhanced laser desorption ionization-time of flight-mass spectrometry )
E‟ una tecnologia brevettata da Bio-Rad Laboratories Inc.
Combina la tecnologia di spettrometria di massa con il sistema ProteinChip® (Ciphergen Biosystems Inc.), progettato per trattenere le
proteine di interesse, provenienti dal campione di partenza, incorporandole su diverse superfici cromatografiche degli arrays.
I campioni possono essere direttamente esposti in condizioni native alle superfici, senza pretrattamenti o prefrazionamenti, in modo che siano trattenute selettivamente alcune specie proteiche, Wiesner A., 2004. Qualsiasi campione contenente proteine può essere analizzato, anche fluidi biologici complessi, come siero, saliva o urina.
La riduzione della complessità del campione proteico è desiderabile ed essenziale per rilevare la frazione proteica a basso peso molecolare, che può essere un contenitore importante di informazioni, composto da prodotti proteolitici e peptidi che potrebbero essere atipicamente secreti dalle cellule in risposta ad una malattia Yates JR., 1998; Tang N,et al., 2004.
La tecnologia possiede numerose aree di applicazione: in clinica è utilizzata per confrontare profili spettrali di differenti classi diagnostiche, per scoprirne le differenze, le peculiarità e infine identificarne i potenziali biomarcatori.
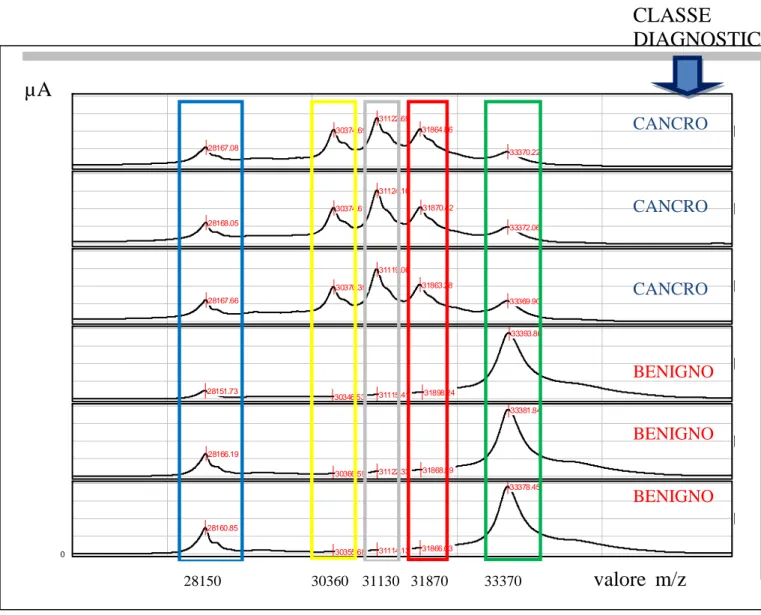
Il confronto dei patterns di picchi proteici ottenuti da campioni rappresentanti diverse popolazioni fornisce un dettagliato modello
39
diagnostico, classificante lo stato patologico. Diversi studi riguardanti la diagnosi precoce del cancro sono già stati pubblicati a proposito (ad esempio alle ovaie, al seno e alla prostata) Petricoin EF et al., 2002; Li J et al., 2002; Adam BL et al., 2002.
E‟ provato statisticamente che un pannello di fattori fra loro indipendenti, ma correlati ad un gruppo in studio (esempio ad uno stato di malattia), sono meno inclini alle influenze genetiche e ambientali rispetto ad un singolo biomarcatore Seibert V,et al., 2005.
I risultati ottenuti mediante SELDI-TOF-MS creano una impronta unica e caratteristica di un campione, costituita dalle intensità associate ai valori del rapporto massa su carica (m/z) risultanti dal profilo spettrale, tuttavia andranno successivamente confrontati e convalidati con altre tecniche MS o software bioinformatici, perché non ha le qualità necessarie per identificare specificamente ogni proteina.
Sebbene il profilo prodotto potrà avere la valenza di marcatore diagnostico, consentendo di stabilire un‟accurata prognosi e un trattamento corretto Hanash SM,et al., 2008, tuttavia, prima di una potenziale applicazione biomedica, devono ancora essere superati molti ostacoli, tra cui la ripetibilità della metodologia in esperimenti indipendenti, condotti in diversi laboratori, e l‟applicazione in studi di follow up su grandi popolazioni Baker SG, et al., 2002.
40
I vantaggi che rendono il metodo un potente strumento per l‟analisi dei profili proteici sono:
o Capacità di lavorare su campioni grezzi, non processati; o Elevata sensibilità;
o Limitata quantità di campione richiesta per l‟analisi (fino a 2 µg/ml di proteine totali in 10 µl);
o Elevate capacità di prestazione e analisi dei dati in entrata per mezzo di sistemi bioinformatica.
Numerosi fattori preanalitici ed analitici influiscono sullo studio. Il confronto tra tanti campioni richiede un‟attenta selezione e preparazione del materiale.
L'uso efficace del sistema dipende da un buon disegno sperimentale e dall‟elevata qualità biologica dei campioni Baker SG et al., 2002.
7.1 Componenti del ProteinChip®SELDI System Il ProteinChip®Seldi System si compone di tre fasi successive:
separazione dei costituenti del campione su ProteinChip® Arrays
rilevazione degli analiti ionizzati dal ProteinChip® Reader
41
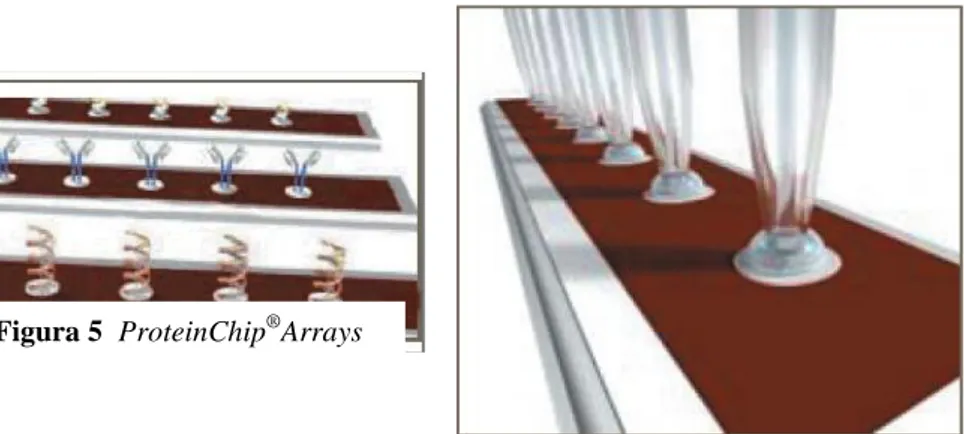
7.1.1 ProteinChip®Arrays
Ciascun ProteinChip®Array (fig.5) è dotato di una superficie
cromatografica formata da una specifica resina contenente siti di legame in grado di trattenere proteine e peptidi dei campioni attraverso interazioni chimico-fisiche (idrofobiche, acide, basiche) oppure biologiche (affinità per metalli bivalenti).
Il campione viene applicato direttamente su uno degli otto pozzetti che costituiscono la superficie del chip, anche senza subire purificazione, rimozione di sali o aggiunta di detergenti, che di norma interferiscono con altre tecniche di MS, nè precedenti prefrazionamenti quando è possibile (Fig.6).
Figura 6 Applicazione dei campioni su ProteinChip®Array
Le proteine che non sono state trattenute, insieme agli altri contaminanti, sono allontanate tramite alcuni lavaggi con soluzione tampone, in modo da limitare l‟interferenza delle proteine ad elevata concentrazione, anche se il rischio è che altre proteine di interesse possano essere escluse dall‟analisi trascinate via con un meccanismo di co-deplezione. Alcune condizioni in fase di separazione, esempio il pH o la concentrazione dei sali nelle soluzioni tampone e di lavaggio,
42
influiscono sulla selettività di legame e devono essere standardizzate in protocolli stabiliti nel disegno sperimentale.
Sono disponibili quattro differenti ProteinChip®Arrays con differenti
superfici cromatografiche: H50, Q10, CM10, IMAC-Cu++.
1. ProteinChip®H50, o reverse phase, tipo C8 C12
I gruppi caratteristici della superficie cromatografica sono catene alchiliche C8-C12 (fig.7) a cui le proteine
si legano tramite interazioni idrofobiche, per mezzo di residui di alanina, leucina, valina, isoleucina, fenilalanina, triptofano, tirosina. Le proteine all'interno del campione si partiscono tra la fase lipofila della superficie del pozzetto e la soluzione tampone. Solo le proteine più idrofobiche del tampone verranno trattenute dall‟array. Se si incrementa il contenuto di solvente organico del tampone di lavaggio si aumenta anche la sua natura idrofobica, migliorando la selettività del legame.
2. ProteinChip®Q10
Viene utilizzato per l‟analisi di molecole con carica negativa superficiale. E‟ l‟array dotato di superficie a scambio anionico forte, contenente gruppi cationici, ammonici
quaternari, che tramite interazioni
elettrostatiche si legano con residui di acido aspartico o glutammico delle proteine del campione (fig.8). La superficie del pozzetto cattura i peptidi che possiedono carica negativa a un determinato pH. Il pH della soluzione tampone o dei tamponi di lavaggio può essere diminuito per incrementare la selettività di legame di proteine con basso pI. Il legame con l‟array può essere influenzato anche dalla variazione della forza
Figura 7 Superficie H50
43
ionica del tampone: se si aumenta la concentrazione dei sali si genera competizione tra le proteine cariche sulla superficie e gli ioni del tampone.
3. ProteinChip®CM10
Possiede una superficie a scambio cationico debole (fig.9), contenente gruppi anionici (carbossilati), che legano tramite interazioni elettrostatiche le cariche positive dei residui di lisina, arginina o istidina sulle proteine di interesse. E‟ utilizzato per l‟analisi di molecole con carica positiva superficiale a un determinato pH e diventa selettivo per proteine con alto punto isoelettrico (quando il pH della soluzione tampone o dei tamponi di lavaggio è elevato). Il legame può essere influenzato anche dalla variazione della forza ionica del tampone: se aumenta la forza si genera competizione tra le proteine cariche sulla superficie e gli ioni del tampone.
4. ProteinChip®IMAC-30-Cu2+
E‟ l‟array affine a proteine leganti i metalli, in particolare i bivalenti. La superficie contiene gruppi nitrilotriacetici
(NTA), in grado di chelare questi ioni metallici (fig.10). Prima dell‟uso, i gruppi NTA devono essere attivati, ad esempio con il Cu2+.
I metalli bivalenti presenti nelle proteine legati a residui di istidina, triptofano e cisteina spiazzano il Cu2+.
Figura 9 Superficie CM10
44
Per una maggior selettività, le soluzioni tampone ed i tamponi di lavaggio possono contenere concentrazioni più o meno elevate di competitori (es. imidazolo o glicina).
I ProteinChip®Arrays vengono posti nel ProteinChip®Array Bioprocessor (fig.11).
Questo strumento alloggia 12 chips contemporaneamente, permettendo il caricamento di molti campioni (fino a 96), in modo da incrementare la riproducibilità del sistema.
Inoltre, l‟esposizione della superficie del pozzetto a una maggiore quantità di campione (si può caricare un volume massimo di 250 µl) migliora il limite di rilevazione, ovvero la sensibilità del sistema.
Il Bioprocessor è formato da un supporto di base (base clamp assembly), un caricatore per alloggiare i ProteinChip® Arrays (ProteinChip® array
cassette) e un serbatoio per caricare il campione (bioprocessor reservoir). Il ProteinChip®Bioprocessor viene smontato prima della fase di
addizione della matrice (EAM) su ciascun pozzetto.
45
In una fase successiva ai lavaggi, la superficie dei pozzetti viene lasciata asciugare, quindi viene addizionata la matrice o EAM.
Il termine EAM è generico per descrivere le molecole che favoriscono le fasi di desorbimento e ionizzazione.
Sono piccole molecole di acidi deboli solubilizzate in un solvente organico.
La soluzione (matrice) è applicata sulla superficie del ProteinChip®Array
per interagire con gli analiti.
Allontanando il solvente, essa cristallizza includendo le proteine in un suo eccesso (fig.12).
I cristalli assorbono le frequenze emesse dalla sorgente laser, che viene utilizzata per l‟eccitazione delle molecole di campione, e le convertono in energia termica, che facilita la ionizzazione e l‟evaporazione delle proteine.
Figura 12 Superficie di un pozzetto: analiti proteici incorporati entro la struttura cristallina della
matrice
Matrice
Proteine
46
La scelta del tipo di matrice da utilizzare si basa sulla natura chimica e peso molecolare dell‟analita.
L‟acido sinapinico (SPA, di PM 224.2 Da) è consigliato per buona parte delle proteine, lavorando bene anche con i peptidi.
Generalmente viene utilizzata una soluzione satura al 50% SPA per proteine con pesi molecolari maggiori di 3 KDa.
EAMs vengono fornite in provette da 5 mg di polvere secca.
La soluzione viene ricostituita di fresco con appropriati solventi (aceto nitrile e acido trifluoroacetico) e conservata prima dell‟uso lontano da fonti luminose perché EAMs sono sensibili alla luce.
7.1.2 ProteinChip®Reader
Le proteine vengono rilevate dallo spettrometro di massa ProteinChip®Reader (fig.13), costituito fondamentalmente da tre parti:
La sorgente, dove si producono gli ioni in fase gassosa per l‟analisi.
L‟analizzatore (o lettore) di massa, che separa gli ioni provenienti dalla sorgente calcolando il loro rapporto tra massa e carica (m/z).
Il rivelatore, che riporta in intensità di segnale i dati m/z generati dall‟analizzatore (per ogni m/z rileva la quantità degli ioni che provengono dall‟analizzatore).
47
La tecnologia di ionizzazione si basa sull‟eccitazione delle molecole del
campione per produrne la
vaporizzazione e la ionizzazione. La sorgente viene messa sotto vuoto e, in sequenza, i pozzetti vengono investiti da un raggio laser pulsato all‟azoto (fig.14).
La ionizzazione degli analiti risulta dall‟interazione tra l‟energia del laser, la matrice e gli analiti; in pratica, l‟energia del laser induce prima la ionizzazione delle proteine (le quali si caricano positivamente grazie alle molecole acide della matrice che cedono i protoni), poi un loro cambiamento di stato, dalla fase cristallina alla fase gassosa, che permetterà loro di muoversi rapidamente sotto l‟applicazione di una differenza di voltaggio.
Applicando un campo elettrico, i peptidi carichi vengono accelerati, focalizzati verso un tubo di volo e trasferiti all‟analizzatore.
Nel tubo si mantiene il vuoto per limitare la probabilità che collisioni con molecole gassose disturbino la migrazione degli ioni provenienti dalla sorgente.
Figura 14 Raggio laser all’azoto investe un pozzetto del ProteinChip®Array
Figura 13
48
Il tempo di volo, o TOF, è il tempo, in µs, che impiega ciascuna proteina ionizzata a percorrere il tubo e raggiungere l‟analizzatore.
Applicando una differenza di voltaggio si mantiene un‟energia cinetica EK costante per tutti gli analiti, per cui la velocità di ciascun ione (TOF)
dipenderà solo dalla sua massa, mediante una relazione inversamente
proporzionale (
E
K=mv²/2
, dovem
è la massa dello ione ev
la suavelocità).
L‟analizzatore registra il TOF di ciascun analita e lo riporta come rapporto m/z; è in grado di calcolare con accuratezza la massa di piccole molecole o peptidi a partire da 500 Da fino a proteine oltre 150 KDa. Il rivelatore converte l‟energia cinetica delle particelle in arrivo in segnale elettrico; registra ogni TOF come intensità di risposta, correlata alla quantità di analita sulla superficie del pozzetto.
Il campione deve essere equamente distribuito con la EAM sull‟area del pozzetto, affinchè l‟intensità del segnale corrisponda con accuratezza alla concentrazione relativa della proteina.
7.1.3 ProteinChip®Data Manager Software
ProteinChip®Data Manager Software controlla ogni aspetto del sistema
TOF-MS, utilizzando un‟interfaccia Windows che presenta numerose funzioni, tra cui la possibilità di visualizzare i dati in diversi formati, per confrontare i profili d‟espressione delle proteine e rendere più agevole la ricerca di biomarkers.
Il ProteinChip®Data Manager Software riporta i dati registrati dal
49
profilo proteico del campione, mappa dell‟abbondanza relativa degli ioni in funzione del rapporto tra massa e carica (fig.15).
Ordina sull‟asse delle ordinate la misura dell‟intensità del segnale e sull‟asse delle ascisse i rapporti m/z calcolati o la massa. In uno spettro, ogni picco possiede un particolare valore m/z.
Figura 15 Rappresentazione grafica di uno spettro con range di massa tra 0 e 100000 Da
Ogni spettro è suddiviso in tre regioni principali:
1) Matrix attenuation range, la regione iniziale dello spettro, in cui il segnale è generato dalla matrice, che viene esclusa dall‟analisi dei dati;
2) Low mass range, la regione in cui si trovano picchi ben risolti e definiti (fino a 20 KDa);
3) High mass range, la regione in cui i picchi sono più ampi e con intensità ridotte, a causa dell‟eterogeneità chimica (oltre i 20 KDa).
Affinchè il software converta i dati relativi al TOF in dati di massa (in dalton), è necessaria la calibrazione del lettore misurando il TOF di proteine o peptidi con una precisa massa nota (calibration standards), generando un‟equazione di taratura (calibration equation) che utilizza i dati ottenuti per calcolare le masse degli analiti sconosciuti.
25000 50000 75000 100000 0 200 400 600 uA 118 25000 50000 75000 100000 µA Valori m/z
50
Quindi a ciascun picco viene assegnata una massa, usando un algoritmo che tiene conto del centroide, ovvero il punto appartenente al picco da
cui parte una linea che lo divide in due parti congruenti. L‟intensità di un picco, corrispondente alla quantità relativa di analita, è
calcolata con un altro algoritmo, che si basa sulla misura della distanza tra la punta del picco e la base predefinita (baseline) dello spettro. La baseline deve essere relativamente piatta e costituire la base di tutti i
picchi. Idealmente il suo valore di intensità deve avvicinarsi a zero. Il software identifica automaticamente i picchi che superano una certa
soglia di rilevazione, costituita da un determinato valore del rapporto tra intensità del picco, “S”, e rumore di fondo, “N” ( signal to noise ratio, o S/N).
Il valore “N” rappresenta l‟intensità media del rumore presente in una delimitata regione dello spettro, per cui è una misura di variazione del segnale.
Il rapporto S/N permette di discriminare i picchi di proteine e peptidi
rispetto a quelli generati da rumori elettronici e chimici. Il ProteinChip®Data Manager Software utilizza parametri di default per
preparare i dati all‟analisi statistica poichè, spesso, devono essere ottimizzati per risultare idonei alle condizioni sperimentali.
Tra i parametri più importanti troviamo:
1) “Baseline subtraction”: è l‟applicazione di uno specifico algoritmo ad ogni spettro, che sottragga il contributo del rumore di fondo alla baseline, per calcolare in modo più accurato le intensità dei picchi.