INDICE
RIASSUNTO………pag. 2 1. INTRODUZIONE………pag. 4 1.1 DEFINIZIONE DI ARTRITE REUMATOIDE………....pag. 4 1.2 EPIDEMIOLOGIA...pag. 4 1.3 EZIOPATOGENESI……….pag. 5 1.4 QUADRO CLINICO……….pag. 9 2. GLI AUTOANTICORPI NELL'ARTRITE REUMATOIDE………pag. 12 2.1 CITRULLINAZIONE………pag. 15 2.2 ISTONI...………..pag.19
3. SCOPI DELLO STUDIO...pag. 23 4. PAZIENTI E METODI………..pag. 23 4.1 DETERMINAZIONE DEGLI ANTICORPI ANTI-VCP1 E -VCP2…...pag. 25 4.2 DETERMINAZIONE DEGLI ANTICORPI ANTI-TBA-25 E TB-A26…...pag. 25 5. ANALISI STATISTICA………..pag. 26 6. RISULTATI……….pag. 27 7. DISCUSSIONE………pag. 29 8. BIBLIOGRAFIA………...…..pag. 33
RIASSUNTO
Gli anticorpi anti peptidi citrullinati (ACPA) sono una famiglia di anticorpi diretti contro sequenze peptidiche in cui l'arginina è sostituita dalla sua forma deiminata, l'aminoacido non naturale citrullina. Gli ACPA sono presenti in più del 70% dei sieri di pazienti affetti da artrite reumatoide (AR); tali anticorpi hanno un'alta specificità per la malattia (90-95%) e sono raramente presenti in sieri di pazienti affetti da altre patologie o in soggetti sani.
Gli scopi di questa tesi sono:
- valutare la frequenza degli ACPA, utilizzando come substrato per la loro determinazione due peptidi virali deiminati derivati dall'EBNA1 (VCP1) e dell'EBNA2 (VCP2) e due peptidi corrispondenti a sequenze appartenenti a proteine istoniche (TB-A25 e TB-A26);
- caratterizzare l’isotipo e la fine specificità degli anticorpi anti VCP-2;
- studiare il ruolo degli ACPA come parametro nel monitoraggio della risposta alla terapia nell’AR. Sono stati studiati 100 sieri ottenuti da pazienti affetti da AR e 206 sieri di controllo ottenuti da pazienti affetti da patologie diverse dall'AR.
Sono risultati positivi con il A25 il 43% dei sieri di AR e l’11.6% dei controlli; con il TB-A26 il 33% dei sieri di AR e il 4.2% dei controlli; con il VCP2 il 47% dei sieri di AR e l’8.4% dei controlli; con il VCP1 il 41% dei sieri di AR e il 2.1% dei controlli.
I risultati ottenuti con i 4 test sono fra loro correlati; il 62% dei sieri di AR sono positivi con almeno uno dei 4 peptidi.
I livelli anticorpali sono più elevati nei soggetti positivi per il fattore reumatoide. Non è stata invece trovata alcuna associazione con i livelli di PCR, con la presenza di artrite attiva o con manifestazioni extra articolari di malattia. La presenza di anticorpi anti VCP 2 si associa con artrite di tipo erosivo.
La maggior parte dei sieri dei pazienti con AR contengono anticorpi anti VCP-1 e anti VCP-2 di tutti e tre gli isotipi (IgG, IgA e IgM) indicando che c’è una risposta policlonale a peptidi citrullinati di origine virale. Tuttavia esistono sieri in cui si rilevano anticorpi anti VCP di classe IgM e/o IgA, ma non IgG, dato che suggerisce che ogni isotipo è prodotto indipendentemente.
Inoltre, sulla base dei risultati del nostro studio, la valutazione dei livelli o della frequenza degli ACPA non sembra rappresentare un parametro valido per il monitoraggio della risposta alla terapia.
I dati ottenuti indicano che i 4 peptidi identificano popolazioni di pazienti non completamente sovrapposte, per cui il loro uso combinato aumenta la possibilità di fare diagnosi sierologica di artrite reumatoide. Si confermano anche con questi nuovi substrati per la determinazione degli ACPA i dati ottenuti con il CCP: gli ACPA sono markers di malattia e di severità di malattia, ma non di attività. La loro determinazione non sembra invece utile nel monitoraggio della risposta alla terapia.
INTRODUZIONE
1.1 DEFINIZIONE DI ARTRITE REUMATOIDE
L’ Artrite Reumatoide (AR) è una malattia autoimmune ad eziologia sconosciuta caratterizzata da una sinovite persistente che interessa generalmente le articolazioni diartrodiali in modo simmetrico e, talora, da un coinvolgimento extra-articolare (polmoni, cute, vasi, e sistema ematopoietico) (1) Nella maggior parte dei casi la malattia ha un decorso cronico che, attraverso riacutizzazioni e remissioni, conduce ad una progressiva distruzione delle articolazioni con deformità, perdita della normale funzione ed invalidità (2)
1.2 EPIDEMIOLOGIA
La frequenza dell’AR è stimata intorno allo 0,5-1% nella popolazione generale degli adulti europei e nordamericani, con differenze regionali considerevoli. Limitatamente all’area europea, la malattia sembra essere più frequente nelle popolazioni del Nord Europa. Infatti, la prevalenza stimata per i paesi nell’Europa del Nord è di 5 casi su 1000 abitanti mentre nell’Europa del Sud è di circa 3,3 ogni 1000 soggetti. Ancora più elevata la frequenza dell’AR nel Nord America, 10,7 casi ogni 1000 persone(3) , mentre in Cina la prevalenza della malattia sarebbe compresa tra i 2,8 e 3,5 per 1000 soggetti. Infine, l’AR è assente in certe regioni dell’Africa rurale ma è decisamente frequente in alcune tribù di nativi d’America dove si rileva una prevalenza del 5%.
Le donne sono più frequentemente affette degli uomini con un rapporto da 3:1 a 5:1. Il rischio di malattia per i parenti di individui affetti è del 4% per i fratelli; di circa 4,7% per i parenti di primo
grado (genitori/figli) e di circa l’1.9% per parenti di secondo grado.
Il picco di incidenza dell’AR cade intorno ai 40-60 anni anche se la malattia si può presentare ad ogni età.
1.3 EZIOPATOGENESI
Nonostante vi sia una provata evidenza che l’AR è una malattia autoimmune, non è stato ancora identificato l’autoantigene capace di innescare la reattività autoimmunitaria nei confronti delle strutture articolari e in particolare della membrana sinoviale, organo bersaglio principale della malattia. Negli ultimi anni gli anticorpi antiproteine citrullinate, che attualmente sono considerati un marker sierologico di malattia più specifico dello stesso fattore reumatoide, hanno fatto sorgere interessanti ipotesi sul ruolo delle proteine citrullinate come probabili antigeni artritogenici. Poiché la citrullinazione delle proteine (sostituzione del residuo argininico con la citrullina attraverso un processo enzimatico di deiminazione) è un fenomeno naturale che precede la loro denaturazione e digestione proteolitica, ci si è chiesti come possa innescare la malattia. Da una parte si è ipotizzato, e in parte dimostrato, che un’iperproduzione di proteine citrullinate possa avvenire, nell’ambiente articolare, in certe condizioni che normalmente favoriscono l’insorgenza dell’AR (alcune infezioni, traumi, tabagismo). Dall’altra parte si è documentata la presenza di varie condizioni di predisposizione genetica alla malattia o meglio, di aumento di rischio relativo di ammalarsi, la più importante delle quali è la presenza di alcune molecole del sistema HLA che condividono una specifica sequenza aminoacidica (shared epitope) (4). Esse sono codificate dai geni del locus DRB1, e specificatamente nei caucasici dagli aplotipi DR*0401, *0404 e *0101. Le molecole HLA hanno un ruolo fisiologico fondamentale nella presentazione, da parte di cellule predisposte a tale scopo, degli antigeni al linfocita T. La sequenza aminoacidica specifica dello shared epitope sembra favorire la presentazione di antigeni con carica elettrica negativa, proprio come sono le proteine
citrullinate. Il linfocita T, a sua volta, da un lato attiva i macrofagi e quindi la produzione da parte di essi di citochine pro-infiammatorie, come le interleuchine-1 e -6 (IL-1 e IL-6) e il Tumor Necrosis Factor-! (TNF-!), dall’altro attiva il linfocita B e ne induce la differenziazione in plasmacellula con la conseguente produzione di anticorpi specifici. Le citochine pro-infiammatorie, a loro volta, e in primis il TNF-!, sono in grado di attivare le cellule effettrici del processo, i condrociti, i fibroblasti e gli osteoclasti che, anche attraverso fenomeni proliferativi, generano il danno delle strutture articolari e ossee.
Alcuni studi hanno suggerito che lo “shared epitope” sia correlato con forme più severe e rapidamente evolutive della malattia (4)
Varie ipotesi sono state formulate sul possibile meccanismo mediante il quale sia proprio lo “shared epitope” a condurre ad una predisposizione: le molecole HLAII contenenti lo “shared epitope” potrebbero essere rilevanti per la selezione di un repertorio di cloni di linfociti T con capacità autoreattive. Lo “shared epitope”, controllando l’architettura strutturale dell’interazione MHCII-peptide-TcR, potrebbe indurre direttamente l’attivazione di cellule T effettrici; l’esistenza di un mimetismo molecolare e di reattività crociata tra lo “shared epitope” e particolari sequenze aminoacidiche di peptidi esogeni potrebbe determinare la rottura della tolleranza e la generazione di cloni T autoreattivi (5).
E’ certo comunque che lo “shared epitope” rappresenti un sito interattivo sia per il legame con il peptide sia per il riconoscimento da parte del TcR: si potrebbe pensare perciò che la sequenza “shared epitope” controlli le interazioni tra peptide, TcR e MHCII, o influenzando la specifica sequenza del peptide che si lega alla molecola di classe II, o influenzando il riconoscimento tra MHC-peptide e TcR o ancora mediante entrambi i meccanismi.
Accanto alle variazioni delle molecole HLA di classe II, sono stati identificati altri fattori di rischio genetico per lo sviluppo di AR. Un polimorfismo a singolo nucleotide nella tirosina fosfatasi PTPN22 alla posizione 1858 (C"T) che produce una mutazione non senso, è associato a diverse
malattie autoimmuni ed è un fattore di rischio HLA-indipendente per l’AR positiva al FR e agli ACPA (ma non per quella negativa agli ACPA). Infatti, il gene PTPN22 è importante nell’inibizione di vie di segnale nelle cellule T e B per cui una mutazione su tale gene abbassa la soglia di attivazione, facilitando così lo sviluppo di linfociti T e B autoreattivi.(6)
Analisi sull’intero genoma, recentemente condotte su grosse coorti di pazienti AR provenienti da paesi diversi, rivelano la presenza di oltre 500 000 polimorfismi di un singolo nucleotide (SNPs) associati alla malattia.(7) (8) Diverse di queste associazioni sono state confermate dall’analisi di casistiche indipendenti di pazienti, spesso condotte da gruppi di studio differenti. Alcuni dei polimorfismi la cui associazione con la malattia è validata si trovano a livello delle seguenti regioni: gene STAT4, un fattore di trascrizione coinvolto nel differenziamento di Th1 e Th17(9); la regione intergenica tra TNFAIP3 (proteina 3 indotta da TNF–!) e OLIG3 (fattore di trascrizione della linea degli oligodendrociti)(10) (11); TRAF1(fattore associato al recettore del TNF) e C5 (proteina del complemento) (12), geni, questi ultimi due, coinvolti nell’infiammazione cronica.
Ulteriori analisi hanno rilevato l’associazione di un polimorfismo nel gene CD40 con AR positiva agli ACPA. CD40, proteina costimolatoria presente sulle cellule presentanti l’antigene, è un membro della superfamiglia dei recettori del TNF. Il pathway di segnale di CD40 è stato implicato nello switch di classe immunoglobulinica dipendente da cellule T e nello sviluppo di cellule B di memoria. Infine uno SNP nel locus di CCL21, una chemochina coinvolta nel traffico linfocitario, sembra associato alla comparsa di AR. Va precisato che l’impatto funzionale di questi nuovi fattori di rischio è ancora poco chiaro.
La componente genetica precedentemente citata tuttavia non è da sola sufficiente a spiegare l’insorgenza dell’artrite reumatoide e quindi si pensa che anche fattori ambientali possano avere un ruolo nella sua comparsa.
Il fumo di sigaretta determina un significativo aumento di incidenza dell’AR tra i fumatori, con un rischio relativo associato al fumo di circa 1,8 (13). Come precedentemente ricordato, è stato
evidenziato che il fumo di sigaretta è in grado di indurre citrullinazione di proteine autologhe e, in soggetti portatori di shared epitope, lo sviluppo di anticorpi anti-proteine citrulli nate (14).
Si è ipotizzato che numerosi agenti infettivi, sia virali che batterici, possano essere potenziali fattori scatenanti l’AR. Fra questi troviamo Retrovirus, Micobatteri, Micoplasmi, Borrelia, Parvovirus B19, virus di Epstein-Barr ed, al momento, quest’ultimo Herpesvirus, rappresenta il principale sospettato (15). Infatti l’80% dei soggetti colpiti da AR presentano anticorpi rivolti contro antigeni specifici del virus di Epstein-Barr ed il 90% ha anticorpi anti-RANA (rheumatoid arthritis nuclear antigen), cioè diretti contro componenti antigenici nucleari estratti da cellule linfoblastoidi infettate da EBV (che compaiono solo nel 15% dei soggetti sani o affetti da altre artropatie).
Oltre a questi agenti infettivi sono stati chiamati in causa anche fattori neuro-ormonali. I dati in letteratura attestano un’insufficiente produzione di cortisolo in rapporto al processo infiammatorio cronico della malattia, con un’aumentata attività del sistema nervoso simpatico. La ragione di questo aumento dell’attivazione simpatica è presumibilmente legata alla scarsa produzione di cortisolo che si riscontra nella fase cronica della malattia. L’aumento dell’attivazione simpatica è stata inoltre presa in considerazione come uno degli elementi implicati nel processo di aterosclerosi accelerata e rischio cardiovascolare dei pazienti affetti da Artrite Reumatoide.
Numerosi studi hanno infatti dimostrato che la mortalità per eventi cardiovascolari coinvolge il 40-50% dei pazienti AR e che aumenta in rapporto all’età e all’attività della malattia(16).
Nell’ambito delle alterazioni ormonali sono state altresì riscontrate una diminuzione della produzione di androgeni a livello surrenalico e un’alterazione nel metabolismo degli estrogeni. L’ipotesi di un ruolo regolatore degli ormoni sessuali nella risposta immunitaria è legata all’osservazione di una maggior prevalenza della malattia nel sesso femminile, ipotesi rafforzata dai risultati di studi che hanno mostrato come l’AR sia più frequente nelle nullipare e come, nel corso della gravidanza, le pazienti affette riportino un significativo miglioramento clinico(17).
1.4 QUADRO CLINICO
L’esordio della malattia, così come il suo decorso e la gamma di manifestazioni ed esiti sia articolari che extrarticolari, sono estremamente variabili.
L’esordio classico dell’AR è graduale ed insidioso, con sintomi prodromici che possono anche passare inosservati (astenia, anoressia, vaghi sintomi muscolo-scheletrici) seguiti nella maggior parte dei pazienti da manifestazioni articolari, che iniziano per lo più con artralgie accompagnate o meno da rigidità mattutina di lunga durata per evolvere poi, con il passare delle settimane e dei mesi, in franca artrite. In genere l’interessamento è poliarticolare simmetrico (le più colpite sono le piccole articolazioni delle mani, dei piedi e dei polsi) ma è possibile anche un interessamento mono od oligoarticolare (spalla e ginocchio sono in questo caso le articolazioni più colpite).
Raro ma non impossibile è l’esordio acuto, in cui l’impegno articolare è fin dall’inizio caratterizzato da marcati segni di flogosi.
Altri tipi di esordio sono quello con manifestazioni sistemiche, dove febbre, astenia, perdita di peso, mialgie e rash cutaneo accompagnano le manifestazioni articolari o più raramente le precedono (di poco); quello palindromico, in cui episodi di dolore e tumefazione in una o due articolazioni durano 2-3 giorni, si risolvono senza reliquati e si susseguono ad intervalli di tempo variabili; infine quello simil-polimialgico, frequente nell’AR senile e caratterizzato da manifestazioni del tutto simili alla polimialgia reumatica (18).
MANIFESTAZIONI ARTICOLARI: come già detto sono le principali manifestazioni della malattia; le articolazioni più colpite sono le diartrodie, cioè quelle munite di membrana sinoviale. Le caratteristiche della poliartrite sono la distribuzione simmetrica, l’andamento centripeto (cioè sono coinvolte prima le piccole articolazioni di mani e piedi e
successivamente le più prossimali degli arti), e il carattere aggiuntivo (cioè la tendenza a colpire sempre nuove articolazioni senza risoluzione del processo morboso nelle sedi precedentemente interessate).
In ordine di frequenza vengono colpite le articolazioni interfalangee prossimali (IFP) delle mani, le metacarpofalangee (MCF), i polsi, le metatarsofalangee (MTF) e interfalangee prossimali dei piedi, le ginocchia, i gomiti, le caviglie, le spalle, le anche, la colonna cervicale, le temporomandibolari e le cricoaritenoidi.
Il sintomo principale è il dolore, spontaneo e continuo, aumentato dal movimento e dal carico; altro sintomo è la rigidità articolare, più pronunciata dopo lunga inattività e quindi in particolare al mattino, generalmente di lunga durata (2-3 ore); i pazienti lamentano inoltre debolezza e facile stancabilità nell’eseguire i movimenti articolari. Come segni si associano tumefazione (meglio apprezzabile sulla superficie estensoria dove la capsula articolare è più distendibile), rossore e calore della cute soprastante; si può avere inoltre, sin dalle prime fasi di malattia, una limitazione funzionale dovuta alla sinovite, al versamento e alla contrattura muscolare antalgica.
E’ anche vero però che nelle fasi iniziali o di parziale remissione tali caratteri possono mancare o essere poco evidenti.
Con il progredire della malattia si instaurano le deformità articolari e l’anchilosi.
Le deformità più tipiche della malattia sono le dita ad “asola” (en bouttonnière), iperflessione con rigidità delle IFP e iperestensione delle articolazioni interfalangee distali; le dita a “collo di cigno”, iperestensione delle IFP e iperflessione delle articolazioni interfalangee distali; il pollice a “Z”, iperflessione della MCF del I dito e iperestensione della IF; la mano a “gobba di dromedario”, sublussazione volare dei metacarpi sul carpo; la mano a “gobba di cammello”, se alla precedente deformità si associa la sublussazione volare delle falangi prossimali sulle teste metacarpali; la mano a “colpo di vento”, deviazione ulnare delle dita.
Oltre alle articolazioni la malattia può colpire tendini, guaine tendinee e borse sierose dando luogo a frequenti tenosinoviti (che più spesso coinvolgono le mani e i polsi) e borsiti (olecranica, sottoacromiale e trocanterica).
MANIFESTAZIONI EXTRARTICOLARI: colpiscono i pazienti in una percentuale non trascurabile di casi.
A livello cutaneo le principali lesioni sono rappresentate dai noduli reumatoidi e dalle vasculiti. I noduli possono essere intracutanei (più rari) e sottocutanei. Questi ultimi si formano nelle zone sottoposte a maggior pressione quali la superficie estensoria dei gomiti e degli avambracci; le dimensioni sono variabili, la consistenza duro-elastica.
La vasculite cutanea è rara, si manifesta con microinfarti periungueali, porpora e altri tipi di rash e ulcere cutanee.
Altri tipi di manifestazioni extrarticolari sono la debolezza muscolare, molto comune nei pazienti affetti da AR, sia circoscritta alle regioni articolari infiammate, sia generalizzata, fino a quadri di vera miosite, con aumento degli enzimi muscolari e segni elettromiografici di sofferenza delle fibre muscolari; le sindromi da intrappolamento (tipica è la sindrome del tunnel carpale); la neuropatia sensitiva distale, dovuta a vasculite dei vasa nervorum; il coinvolgimento del sistema nervoso centrale (estremamente raro) causato da noduli reumatoidi con conseguenti disturbi da compressione oppure dalla vasculite reumatoide; l’osteoporosi, iuxtarticolare, dovuta alla sinovite, o diffusa, dovuta alla ridotta attività fisica e all’uso prolungato di corticosteroidi.
Possono essere colpiti, anche se raramente, il rene, con alterazioni vasculitiche o più frequentemente per interessamento iatrogeno, il cuore, con lesioni endocardiche, miocardiche e del sistema di conduzione ma più spesso con pericarditi, il polmone, con possibili pleuriti, pneumopatie nodulari (che se associate a documentata esposizione a polveri di asbesto o silice raffigurano la “sindrome di Caplan”), fibrosi polmonare diffusa ed arteriti polmonari;
l’apparato gastrointestinale con manifestazioni legate alla vasculite reumatoide (perforazione ed infarto intestinale).
Possono essere presenti anche manifestazioni oculari, tra cui le più frequenti sono la xeroftalmia e la cheratocongiuntivite secca che, così come la xerostomia per interessamento delle ghiandole salivari, fanno parte della sindrome di Sjogren associata all’AR. Meno comuni sono l’episclerite e la sclerite.
Infine una modica splenomegalia e soprattutto una linfadenopatia sono abbastanza comuni nell’AR, e se queste manifestazioni dominano il quadro della malattia configurano il morbo di Still (febbre elevata, rash cutaneo sincrono alle puntate febbrili, poliartrite fugace e non erosiva, linfoadenomegalia, splenomegalia e leucocitosi) e quello di Felty (noduli reumatoidi sottocutanei, splenomegalia e neutropenia).
2. GLI AUTOANTICORPI NELL’ARTRITE REUMATOIDE
L’idea che meccanismi di autoimmunità sottostassero alla patogenesi dell’artrite reumatoide risale al 1940 con la scoperta, nel sangue di pazienti affetti da tale forma di artrite, del fattore reumatoide (FR), cioè di un autoanticorpo diretto contro la porzione Fc delle IgG. (19) (20). Il FR è presente principalmente sotto forma di IgM ma è rilevabile anche come IgG e IgA in alcuni sottogruppi di pazienti. Si ritiene che il FR, a livello delle articolazioni, formi degli immunocomplessi che attivano il complemento, con conseguente aumento della permeabilità vascolare e rilascio di fattori chemotattici che reclutano cellule effettrici immuno-competenti (21).
La presenza del FR non è, tuttavia, specifica per AR. Esso viene riscontrato anche nel 5% dei soggetti sani. Inoltre la frequenza del FR nella popolazione generale aumenta con l’età (il 10-20% dei soggetti sopra i 65 anni presenta positività per il FR), e anche numerose altre
condizioni patologiche si associano alla sua presenza: malattie autoimmuni come il Lupus eritematoso sistemico, la sindrome di Sjogren, la Sclerosi sistemica, la Connettivite mista, infezioni virali come epatiti, infezione da HIV o da EBV, infezioni parassitarie, ad esempio la malaria, o batteriche come la tubercolosi o la brucellosi(22). La presenza del FR non è perciò sufficiente per porre diagnosi di AR, dato che il suo valore predittivo per la diagnosi di AR è scarso, mentre può essere importante per la prognosi dei pazienti, visto che la presenza di elevati livelli di FR si associa alle forme più gravi di malattia.
Ulteriori alterazioni siero-immunologiche presenti nell’AR sono rappresentate dalla presenza di anticorpi anti-RA33 (anti-hnRNP-A2), anti-calpastatina (un inibitore della proteasi neutra calcio-dipendente calpaina), ANCA (anticorpi anti-citoplasma dei neutrofili), ANA (anticorpi anti-nucleo), anti-fibronectina, anti-collagene di tipo II e anti-GPI (glucosio-6-fosfato isomerasi). Anche in questo caso, tali anticorpi sono presenti in altre malattie immunitarie e perfino in individui sani. Quindi la scarsa specificità di tutti gli anticorpi fin qui citati e, nel contempo, la necessità di un biomarker di malattia precoce, hanno reso necessaria la ricerca di anticorpi che, oltre ad avere una buona sensibilità, siano caratterizzati anche da un’elevata specificità.
Tra gli autoanticorpi a più elevata specificità per AR si annoverano gli anticorpi diretti verso la proteina BiP (Heavy chain Binding Protein), presenti in circa il 65% dei pazienti con AR (23). BiP è una molecola chaperone di 78 KDa che insieme alle heat shock protein gioca un ruolo importante nell’omeostasi cellulare. E’ normalmente espressa in modo ubiquitario nel reticolo endoplasmatico. In condizioni di stress, come quelle che si verificano nel tessuto sinoviale reumatoide, BiP è sovra-espressa e traslocata parzialmente sulla membrana cellulare (24). L’antigene BiP potrebbe essere un target per la risposta immune delle cellule T nell’AR mentre non esistono dati sul valore predittivo della presenza di tali anticorpi.
coinvolti nella patogenesi di AR, sono quelli diretti contro proteine che contengono l’aminoacido non naturale citrullina (ACPA: anti-citrullinated-protein antibodies).
Nel 1998 si scoprì che un anticorpo presente nei sieri AR chiamato antiperinuclear factor (già scoperto nel 1964(25) e anticorpi diretti contro la cheratina (descritti per la prima volta nel 1979(26) riconoscevano un target comune: la filaggrina citrullinata. (27), (28) Nel frattempo reattività citrullina-specifiche contro altre proteine (per esempio fibrinogeno e vimentina) furono identificate in AR e con l’uso di nuovi metodi di determinazione (usando peptidi sintetici citrullinati ciclici, CCP) oggi si trovano anticorpi anti-proteine citrullinate nel 60-70% dei pazienti AR, ma difficilmente in altre malattie o soggetti sani, dimostrando così un’elevatissima specificità (95-98%) degli ACPA per AR. (29)
Gli ACPA possono essere rilevati nel siero diversi anni prima dell’instaurarsi dei sintomi clinici della malattia. La loro presenza predice una progressione da artrite indifferenziata a AR ed è associata ad un decorso più severo della malattia.
E’ importante ricordare che la citrullinazione è comunque un processo fisiologico. Di conseguenza, antigeni citrullinati non si trovano solo nelle articolazioni dei pazienti con AR ma possono anche essere trovati nel tessuto sinoviale di pazienti con altre patologie infiammatorie delle articolazioni. Questi dati suggeriscono l’esistenza di un meccanismo ancora sconosciuto e specifico della AR che conduce ad una perdita della tolleranza nei confronti degli antigeni citrullinati ed allo sviluppo degli ACPA.
Tra le diverse specificità di ACPA finora identificate, gli ACPA diretti contro la vimentina citrullinata hanno ricevuto una crescente attenzione, poiché la vimentina citrullinata è identica all’antigene AR-specifico conosciuto come S antigen.(30) Specifiche mutazioni della vimentina sono state rilevate recentemente nel fluido sinoviale di AR e anticorpi contro queste isoforme mutate (MCV) mostrano una forte specificità per AR ed una correlazione dei titoli con l’attività della malattia. (31)
La maggior parte degli ACPA sono dell’isotipo IgG1, benché nella maggioranza dei pazienti siano presenti anche altri isotipi.
I pazienti AR mostrano un repertorio di isotipi maggiore dei pazienti con artrite indifferenziata. Comunque, l’intero repertorio isotipico è generalmente già presente agli stadi precoci di malattia. Interessante notare che forme IgM di ACPA sono state trovate in campioni di pazienti con AR sia in fase precoce che tardiva di malattia. Questo indica che nuove cellule secernenti anticorpi sono continuamente generate come risultato di una risposta immunitaria attiva.(32)
2.1 CITRULLINAZIONE
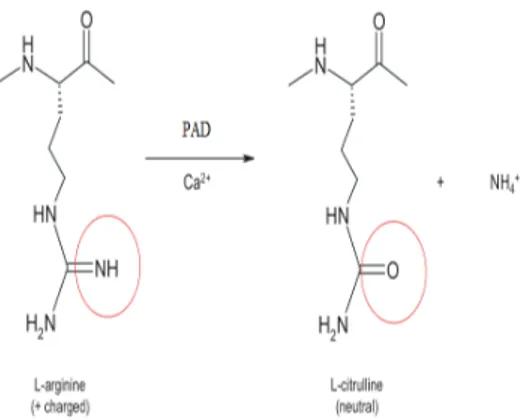
La citrullinazione o deiminazione è una modificazione post-traduzionale, catalizzata dall’enzima calcio-dipendente Peptidil-Arginina-Deaminasi (PAD), in cui un residuo di peptidil-arginina carico positivamente viene convertito in uno neutro di peptidil-citrullina. La reazione di deiminazione porta ad una alterazione di massa della proteina di 1 Da per ogni Arginina modificata, influenza la carica complessiva, la distribuzione di carica, il punto isoelettrico, e quindi le capacità della proteina di formare legami ionici e legami ad idrogeno. La PAD non può convertire residui aminoacidici liberi, ma solo residui proteici. La reazione di deiminazione prevede la formazione di un addotto tetraedrico tra un residuo di cisteina nel sito attivo dell’enzima e il gruppo guanidico
dell’arginina con liberazione di ammoniaca; una molecola di acqua idrolizza poi
l’addotto rigenerando la cisteina e formando il gruppo chetonico della citrullina.
Cinque isotipi di PAD sono stati identificati fino ad oggi: PAD1, principalmente espressa a livello di epidermide e utero, che agisce su cheratina e filaggrina; PAD2 espressa pressoché ubiquitariamente, ma in particolare in macrofagi e astrociti: ha come substrato la proteina mielinica basica nel SNC e la vimentina nel muscolo scheletrico e nella milza; PAD3 espressa soprattutto negli strati superficiali dell’epidermide e nei follicoli piliferi che agisce sulla tricoialina; PAD4 espressa nei leucociti (granulociti e monociti) ha come bersaglio le proteine istoniche e la nucleofosmina/B23, entrambe presenti nel nucleo; la PAD4 è, infatti, l’unica isoforma di PAD che presenta un NLS (Segnale di Localizzazione Nucleare) e così, sebbene l’enzima abbia una predominante localizzazione nel citoplasma, può arrivare nel nucleo durante l’attivazione cellulare (32). Per quanto riguarda PAD6 non ci sono dati sull’espressione nei tessuti umani, ma l’mRNA di questo enzima è presente nell’ovaio, nel testicolo e nei leucociti circolanti.
Studi di immunoistochimica effettuati sui lavaggi broncoalveolari e su biopsie bronchiali di soggetti fumatori e non fumatori hanno dimostrato un livello di espressione di PAD2 ed una quantità di proteine citrullinate maggiore nei polmoni dei fumatori che in quelli dei non fumatori (33). Ciò suggerisce che la PAD2 sia attivata da componenti presenti nel fumo o la cui liberazione è indotta dal fumo. In questo effetto può risiedere l’associazione del fumo con l’insorgenza di AR e con la presenza di ACPA.
Gli studi volti all’identificazione dell’isotipo di PAD espresso nel tessuto sinoviale infiammato dei pazienti con AR hanno rivelato una preponderanza di PAD2 e PAD4(34). Gli enzimi PAD necessitano di una concentrazione relativamente alta di calcio per essere attivi (10-5 M). Infatti la citrullinazione avviene tipicamente nelle cellule che stanno andando incontro ad apoptosi quando si ha un ingente ingresso di calcio sia dallo spazio extracellulare che dai depositi intracellulari.(35)
Anche l’infiammazione è uno dei momenti in cui, sia in modelli animali, sia nella sinovia dei pazienti affetti da AR, è possibile ritrovare proteine citrullinate (36). Normalmente il sistema immunitario non entra in contatto con tali proteine, che rimangono confinate all’interno delle cellule apoptotiche prima che le cellule stesse vengano fagocitate dai macrofagi; ma quando invece i meccanismi di clearance diventano inefficienti a causa, per esempio, di una massiva morte cellulare, PAD e le proteine citrullinate possono uscire dalle cellule e venire a contatto con il sistema immunitario.
Molte proteine sono inoltre deiminate in condizioni fisiologiche, per lo più in corso di differenziamento.
La citocheratina, ad esempio, è un filamento intermedio prodotto dai cheratinociti che determina la consistenza della pelle, dei capelli e delle unghie. Durante il processo di differenziamento dei cheratinociti l'ambiente intracellulare è esposto ad aumentate concentrazioni di calcio che gradualmente attivano PAD1, 2 e 3 e portano alla deiminazione di questa proteina. (37)
Un’altra importante proteina dell’epidermide fisiologicamente deiminata è la filaggrina. Essa è sintetizzata come una grande molecola, chiamata profilaggrina, e viene stoccata nelle cellule in uno stato altamente fosforilato. Durante il differenziamento terminale dei cheratinociti si verificano diverse modifiche post-traduzionali: la profilaggrina è citrullinata, defosforilata e poi scissa in unità di filaggrina. La citrullinazione è molto importante in questo processo. La vimentina è un filamento intermedio espresso da varie cellule. La citrullinazione, insieme ad altre modifiche post-traduzionali induce la depolimerizzazione di questa proteina, processo probabilmente coinvolto nei cambiamenti morfologici associati all’apoptosi.(38) (39)
La proteina basica della mielina (MBP) è sintetizzata dalle cellule oligodendrogliali. Un elemento chiave nella formazione della guaina mielinica è l’interazione lipidi-proteina. Essa si basa sulle interazioni ioniche tra fosfolipidi a carica negativa (fosfatidil-serina e gangliosidi
contenenti acido sialico) e le proteine basiche (MBP, lipofilina). Qualsiasi modifica del punto isoelettrico di queste proteine può causare cambiamenti nell'interazione con i lipidi. MBP è sintetizzata in varie isoforme che possono subire alcune modifiche post-traduzionali, quali deaminazione, deiminazione, metilazione e fosforilazione. Tali modifiche producono numerose isoforme secondarie denominate ‘isomeri carichi’, che hanno punti isoelettrici diversi. La citrullinazione di MBP (MBP-CIT) riduce l'interazione con la carica negativa della fosfatidil-serina a causa della perdita di residui basici. Il rapporto tra MBP deiminata/MBP totale è fondamentale per la fisiologica funzione del sistema nervoso centrale. La MBP citrullinata non è in grado di formare guaine compatte. La citrullinazione di MBP incide anche sulla velocità della sua degradazione da parte della metalloproteinasi catepsina D (40).
Tra le proteine deiminate in maniera fisiologica troviamo, ancora, la fibrina. Placche di fibrina si ritrovano frequentemente nel tessuto sinoviale. In condizioni fisiologiche, piccole quantità di fibrinogeno (FBG) e di altre proteine pro-coagulanti possono penetrare la parete capillare e dirigersi verso l'interstizio, dove possono essere tagliate in peptidi di fibrina che vanno a produrre placche locali. La fibrina polimerizzata è degradata dalla plasmina, una serin-proteasi che taglia vicino ai residui aminoacidici basici (Arg e Lys). La riduzione del numero di arginine dovuta alla deiminazione riduce il numero dei siti di taglio, e quindi aumenta la quantità del polimero di fibrina. La fibrina citrullinata è riconosciuta dagli ACPA.
2.2 GLI ISTONI
Gli istoni sono le proteine più abbondanti tra quelle associate ai cromosomi. Sono caratteristiche degli organismi eucarioti e sono una delle famiglie di proteine più conservate dal punto di vista evolutivo.
Gli istoni presentano un basso peso molecolare (compreso tra 11 e 15 KDa) e a causa del loro elevato contenuto di aminoacidi basici quali lisina e arginina, nell’ambiente cellulare sono tutti provvisti di cariche positive. Da un punto di vista elettrostatico queste cariche positive attraggono i gruppi fosfato del DNA carichi negativamente. Grazie a queste interazioni, ed a quelle che si instaurano fra gli stessi istoni, si formano delle unità definite nucleosomi. Quest’ultimi sono composti da un nucleo
di 8 proteine istoniche attorno a cui è avvolto il DNA.
Il nucleo centrale ha una forma a “barile”, che consta di due molecole per ciascuno degli istoni H2A, H2B, H3 e H4, con la molecola di DNA avvolta attorno a ciascun nucleosoma. H1 si lega alla superficie esterna del nucleosoma, mantenendo la corretta posizione del DNA intorno al core istonico. Lega, inoltre, il DNA linker, ovvero il DNA interposto tra due nucleosomi, che può avere una lunghezza da un minimo di 25bp ad un massimo di 95bp. Questo istone riconosce una particolare sequenza presente sul DNA linker e un'altra che si trova sull'ottamero e li lega contemporaneamente provocandone l’avvicinamento. Inoltre, grazie alle code presenti su entrambi i lati dell'istone H1, esso interagisce con istoni dello stesso tipo di nucleosomi vicini, avvicinandoli e così compattando la cromatina. In questo modo si forma una struttura definita a “filo di perla” che accorcia il DNA di circa sette volte
la sua lunghezza originaria.
La deiminazione degli istoni è un meccanismo coinvolto nella regolazione genica.
La PAD sembra essere un repressore genico: la sua attività infatti correla con la perdita di metil-arginina (41), l’acquisizione di citrullina, la deacetilazione istonica e il distacco dell’RNA polimerasi II dal promotore(42).
La deiminazione degli istoni comunque si può verificare anche nei processi difensivi messi in atto dalle cellule dell’immunità innata in seguito ad un’infezione. Infatti, si è recentemente scoperto che i granulociti neutrofili sottoposti a stimoli infiammatori liberano cromatina decondensata ed enzimi proteolitici uniti in strutture definite “trappole extracellulari dei neutrofili” (NET) che intrappolano gli agenti infettivi e contribuiscono al contenimento dell’infezione(43). Le NET contengono istoni deiminati ed è proprio l’estensiva deiminazione degli istoni che rende possibile la formazione di queste strutture (44).
DETERMINAZIONE DEGLI ANTICORPI ANTI PROTEINE /PEPTIDI CITRULINATI (ACPA)
Gli ACPA sono tra gli autoanticorpi che negli ultimi anni hanno suscitato più interesse per la diagnostica dell’AR poiché sono in grado di unire una buona sensibilità con un’ elevata specificità. Essi riconoscono come bersaglio epitopi citrullinati presenti in diverse proteine, ottenuti per digestione enzimatica ad opera della Peptidil-Arginin-Deiminasi (PAD).
Questi anticorpi sono presenti in più del 70% dei sieri di soggetti affetti da artrite reumatoide, hanno un’alta specificità per la malattia (90-95%) e sono raramente presenti in sieri di pazienti affetti da altre patologie o in soggetti sani.
Gli ACPA possono essere rilevati con metodiche ELISA, la cui specificità e sensibilità dipendono dal tipo di antigene utilizzato. Diverse proteine naturali o di origine ricombinante
possono essere impiegate quale substrato antigenico; la loro disparata origine presenta però degli inconvenienti. Le proteine di origine naturale, come la filaggrina, la mielina e il fibrinogeno, anche se ricche di arginina, hanno un numero limitato di epitopi citrullinati. Oltre a ciò non sono facilmente disponibili in grandi quantità antigeni naturali con un grado di purezza appropriato e costante. Questo può essere causa di ridotta specificità dei test per la presenza di reattività non specifiche nei confronti di altre componenti, parti non citrullinate dell’antigene stesso o anche contaminanti presenti in natura.
L’uso di peptidi citrullinati sintetici come substrato antigenico sembra supplire ad alcuni degli inconvenienti connessi all’uso di antigeni di natura estrattiva, in quanto la loro produzione e purificazione è economica, facilmente standardizzabile e consente produzioni di grandi quantità di antigeni. La ciclizzazione degli antigeni, come detto in precedenza, rappresenta un ulteriore miglioramento permettendo il riconoscimento da parte degli ACPA di epitopi conformazionali, con aumento della sensibilità del test(45).
Negli ultimi anni sono stati sviluppati ulteriori metodi basati sulla vimentina ricombinante deiminata (anti-MCV) e su peptidi derivati dalla filaggrina (anti-CCP), dalla fibrina e dall’enolasi.
Una valutazione comparativa delle sequenze riconosciute dagli ACPA ha mostrato che la caratteristica distintiva per il riconoscimento è la presenza di citrullina fiancheggiata da aminoacidi piccoli e neutri, quali glicina, serina, treonina. Simili sequenze si trovano comunemente in proteine virali.
Una delle proteine nucleari codificata dal virus di Epstein-Barr, l’EBNA 1, contiene, nella sua regione aminoterminale, una sequenza (35-58) caratterizzata da sei ripetizioni glicina-arginina. Questa sequenza di EBNA 1 è stata sintetizzata come peptide antigenico multiplo sostituendo tutti i residui di arginina con citrullina (peptide virale citrullinato o VCP1) ed è stata usata per testare sieri di pazienti con AR, sieri di pazienti con altre malattie autoimmuni
e sieri di controlli sani.
Gli anticorpi anti-VCP1 sono stati ritrovati nel 45% dei pazienti con artrite reumatoide e in meno del 5% dei controlli e delle altre malattie autoimmuni. Quindi il VCP1 può essere considerato un substrato per gli ACPA e può essere utilizzato per rilevazione degli stessi, permettendo di identificare i pazienti con AR con una sensibilità del 45% e una specificità del 95% (46).
Un’ analisi bioinformatica di banche dati contenenti sequenze di proteine di EBV ha mostrato che queste ripetizioni di residui di argina circondate da aminoacidi neutri e di piccole dimensioni sono presenti anche nella proteina EBNA-2.
E’ stato allora sintetizzato il peptide virale citrullinato 2 (VCP2), corrispondente alla sequenza 338-358 della proteina EBNA-2, modificata sostituendo ogni arginina con citrullina. E’ stato poi analizzato il potenziale di VCP2 come substrato per la rilevazione degli ACPA e i dati ottenuti suggeriscono che anche VCP2 possa essere un valido strumento per la rilevazione degli ACPA(47).
Un ulteriore substrato che può essere impiegato per la determinazione degli ACPA è rappresentato dall’istone H4 deiminato: sono state infatti identificate 2 sequenze particolarmente ricche di arginina (H4 14-34 e 31-50), che sono state sintetizzate sostituendo tutte le arginine con citrulline. Tutti questi peptidi citrullinati (VCP1, VCP2, 25, TBA-26) sono stati sintetizzati come peptidi antigenici multipli (MAP), utilizzando un core di lisine che porta 4 peptidi lineari identici, allo scopo di aumentare l’antigenicità degli stessi per mezzo dell’esposizione ottimale delle loro sequenze(48).
3. SCOPI DELLO STUDIO
Gli scopi dello studio sono quelli di valutare, in pazienti affetti da AR:
la frequenza degli ACPA, utilizzando come substrato per la loro determinazione due peptidi virali deiminati derivati dall'EBNA1 e dell'EBNA 2 e due peptidi corrispondenti a sequenze appartenenti a proteine istoniche
l’isotipo e la fine specificità degli anticorpi anti VCP-2
il ruolo degli ACPA come parametro nel monitoraggio della risposta alla terapia nell’AR.
3.1 PAZIENTI E METODI Pazienti
La frequenza degli ACPA è stata studiata in 100 pazienti affetti da AR e 206 controlli che comprendono artriti non reumatoidi (27 pazienti con spondilite anchilosante, 29 con artrite psoriasica, 11 con artrite indifferenziata, 19 con sclerosi sistemica, 25 crioglobulinemia mista, 23 con lupus eritematoso sistemico, 34 con polimialgia reumatica, 12 con sindrome di Sjogren e 26 con mononucleosi)
I pazienti, di cui 26 uomini e 74 donne, hanno un’età media di 54.3anni ed una durata media di malattia di 10 anni.
La diagnosi di AR è stata formulata sulla base dei criteri dell'American College of Rheumatology (49)
Tutti i pazienti sono stati sottoposti ad un prelievo di 10 cc di sangue venoso, che è stato centrifugato ed il siero conservato a -20° C fino al momento del test.
isotipiche degli anticorpi anti VCP-2.
La valutazione del ruolo degli ACPA come parametro nel monitoraggio della risposta alla terapia nell'AR è stata fatta studiando 74 dei 100 pazienti affetti da AR, di cui 18 uomini e 56 donne, la cui età media era di 57 anni.
Sulla base della terapia “di fondo” seguita, i pazienti sono stati suddivisi in due gruppi: a) il primo gruppo di 33 pazienti assumeva terapia con DMARDs tradizionali (metotrexate, leflunomide, ciclosporina, idrossiclorochina, salazopirina)
b) il secondo gruppo di 41 pazienti assumeva farmaci biologici (anti TNF-alfa, Rituximab, Abatacept) associati a DMARDs tradizionali
Per valutare l'attività di malattia e la risposta alla terapia abbiamo considerato i seguenti parametri:
! la conta del numero delle articolazioni dolenti e/o dolorabili ! la conta del numero delle articolazioni tumefatte
! la misurazione della VES e della PCR
! il giudizio del medico sul grado complessivo di attività della malattia ! il giudizio del paziente sul grado complessivo di attività della malattia
3.2 DETERMINAZIONE DEGLI ANTICORPI ANTI PEPTIDI CITRULLINATI
Abbiamo determinato gli ACPA mediante ELISA utilizzando come substrato due peptidi virali deiminati derivati dall'EBNA1 (VCP1) e dell'EBNA 2 (VCP2) e due peptidi corrispondenti a sequenze appartenenti a proteine istoniche (TB-A25 e TB-A26)
Determinazione degli anticorpi anti VCP-1 e anti VCP-2
Gli anticorpi anti-VCP1 e VCP2 sono stati ricercati attraverso metodica ELISA. Peptidi sintetici lineari multipli, derivati dalle proteine EBNA 1 e 2, in cui tutti i residui di arginina sono stati sostituiti con citrulline, sono stati diluiti in PBS alla concentrazione di 10 µg/ml e caricati su piastre da 96 pozzetti NUNC Maxisorp.
Dopo aver bloccato le piastre con PBS BSA al 3%, i sieri diluiti 1:200 in PBS, BSA 1%, Tween 0.05%, sono stati incubati per 3 ore a temperatura ambiente.
Dopo lavaggi con PBS Tween 1% e PBS semplice, le piastre sono state incubate con il secondo anticorpo, anti-human IgG F(ab’)2 coniugato con fosfatasi alcalina e diluito 1:3000 in PBS BSA 1% Tween 0.05%, per 3 ore a temperatura ambiente.
Dopo nuovi lavaggi l’attività dell’enzima legato è stata misurata utilizzando come substrato il paranitrofenilfosfato. I risultati sono espressi come percentuale di un controllo positivo interno: la soglia di positività del test è risultata essere 27% per gli anti-VCP1 e 13% per gli anti-VCP2 (valore fissato al 97.5° percentile di una popolazione di controlli sani).
3.3 DETERMINAZIONE DEGLI ANTICORPI ANTI TBA-25 E ANTI TBA-26
Gli anticorpi anti-TBA25 e anti-TBA26 sono stati ricercati attraverso metodica ELISA. Peptidi sintetici lineari multipli, derivati dalla proteina istonica H4, in cui tutti i residui di arginina sono stati sostituiti con citrulline, sono stati diluiti in PBS alla concentrazione di 10 µg/ml e caricati su piastre da 96 pozzetti NUNC Maxisorp.
Dopo aver bloccato le piastre con PBS gelatina 1%, i sieri diluiti 1:200 in PBS, gelatina 0.5%, Tween 0.05%, sono stati incubati per 3 ore a temperatura ambiente.
Dopo lavaggi con PBS Tween 1% e PBS semplice, le piastre sono state incubate con il secondo anticorpo, anti-human IgG F(ab’)2 coniugato con fosfatasi alcalina e diluito 1:3000 in PBS gelatina 0.5% Tween 0.05%, per 3 ore a temperatura ambiente.
Dopo nuovi lavaggi l’attività dell’enzima legato è stata misurata utilizzando come substrato il paranitrofenilfosfato. I risultati sono espressi come percentuale di un controllo positivo interno: la soglia di positività del test è risultata essere 12% per gli anti-TB-A25 e 18% per gli anti-TB-A26 (valore fissato al 97.5° percentile di una popolazione di controlli sani).
3.5 ANALISI STATISTICA
I dati sono stati analizzati mediante test chi quadro per il confronto tra frequenze di positività per i singoli peptidi nei 2 gruppi di pazienti e mediante il test U di Mann-Whitney non parametrico per il confronto circa le variabili quantitative nei due gruppi di pazienti.
4. RISULTATI
Sono risultati positivi con il A25 il 43% dei sieri di AR e l’11.6% dei controlli; con il TB-A26 il 33% dei sieri di AR e il 4.2% dei controlli; con il VCP2 il 47% dei sieri di AR e l’8.4% dei controlli; con il VCP1 il 41% dei sieri di AR e il 2.1% dei controlli (figura 3).
I risultati ottenuti con i 4 test sono fra loro correlati, il 62% dei sieri di AR sono positivi con almeno uno dei 4 peptidi.
I dati ottenuti indicano che i 4 peptidi identificano popolazioni di pazienti non completamente sovrapposte, per cui il loro uso combinato aumenta la possibilità di fare diagnosi sierologica di artrite reumatoide.
Non è stata evidenziata alcuna associazione tra il rilievo di ACPA ed i livelli di PCR, la presenza di artrite attiva o di manifestazioni extra articolari di malattia.
Un subset di pazienti, 74 dei 100 pazienti affetti da AR, è stato studiato anche per valutare il ruolo degli ACPA nel predire la risposta alla terapia.
I pazienti sono stati suddivisi in due gruppi: 33 pazienti che hanno risposto alla terapia con DMARD tradizionali, 41 che hanno dovuto associare farmaco biologico (infliximab, adalimumab, etanercept, rituximab, abatacept) per mancata risposta alla terapia di fondo. Nel gruppo di pazienti che hanno risposto al DMARD abbiamo osservato una positività per il TB-A25 del 21,2%, del 20,3% con il TB-A26, del 36,5% con il VCP2, del 35,8% con il VCP1. In questo gruppo il 27% dei pazienti hanno anticorpi contro tutti i peptidi e il 51% contro 3 peptidi.
Nel gruppo di pazienti che non hanno risposto al DMARD ed hanno dovuto aggiungere alla terapia un farmaco biologico è stata osservata una positività per il TB-A25 del 22,3%, del 20% con il TB-A26, del 29% con il VCP2, del 27% con il VCP1. Fra questi pazienti, il 14% ha anticorpi contro tutti i peptidi e il 27% contro 3 peptidi.
Dal confronto delle percentuali di positività per i singoli peptidi non emerge alcuna differenza statisticamente significativa tra i due gruppi di pazienti. Si osserva invece una tendenza alla produzione di una maggior varietà di ACPA nei soggetti che rispondono ai DMARD, che non raggiunge però la significatività.
Anticorpi anti VCP2: isotipo
Nei 100 pazienti affetti da AR e nei 206 controlli è stato valutato l’isotipo degli anticorpi anti VCP2. È emerso che il 66% dei sieri analizzati di pazienti affetti da AR presentava anticorpi anti VCP2 di classe IgG, il 46% di classe IgM e il 39% di classe IgA; mentre nel gruppo dei controlli è stata osservata una percentuale di positività degli anticorpi anti-VCP-2 inferiore al 3%. Questi dati suggeriscono che la determinazione degli anticorpi anti VCP-2 sia di classe IgG, che IgM e IgA può svolgere un ruolo chiave nella diagnosi differenziale tra artrite reumatoide e altre forme di artrite.
È stato, inoltre, osservato nel gruppo dei pazienti affetti da AR, che 22 sieri erano positivi solo ad un isotipo (20 ad isotipo IgG, 1 all’IgA e 1 all’IgM), 8 sieri erano positivi a due isotipi IgG e IgM e 1 era positivo agli isotipi IgG e IgA (Fig. 4)
È stato poi valutato se ci fossero delle variazioni nel titolo degli anticorpi anti VCP-2 in base alla presenza o assenza del fattore reumatoide (FR). È risultato che i livelli degli anticorpi anti VCP-2 sono più elevati nei soggetti positivi per il fattore reumatoide.
Anticorpi anti VCP2: fine specificità
Per valutarne la fine specificità, sono stati purificati mediante cromatografia di affinità anticorpi anti VCP-2 dal siero di sette pazienti affetti da AR. Gli anticorpi così purificati si legavano esclusivamente alla sequenza deiminata del peptide VCP-2 e non alle sequenze contenenti arginina o altri peptidi di sintesi.
5. DISCUSSIONE
I sieri dei pazienti con AR riconoscono diverse proteine citrullinate (filaggrina, collagene tipo II, enolasi, fibrinogeno, vimentna): gli anticorpi specifici per l’AR, che risultano reattivi verso tali proteine citrullinate rappresentano una famiglia di anticorpi con specificità in parte sovrapponibili, che possono essere collettivamente chiamati anticorpi anti peptidi citrullinati (ACPA).
Gli ACPA mostrano, fra tutti gli anticorpi associati all’Artrite Reumatoide, le migliori prestazioni diagnostiche. Gli odierni metodi per la valutazione degli ACPA hanno dato prova di avere una sensibilità attorno o superiore all’80% (in dipendenza delle caratteristiche della popolazione in esame), paragonabile o superiore a quella del Fattore Reumatoide, dimostrando allo stesso tempo una specificità nettamente superiore allo stesso (>97%). Grazie alla sua elevata specificità, il test risulta molto utile nella diagnosi differenziale tra AR e altre forme clinicamente simili che possono essere FR positive, come ad esempio, l’epatite cronica da HCV che presenta spesso una poliartrite simmetrica, la sindrome di Sjögren e il LES.
La determinazione di questi anticorpi è particolarmente importante dal momento che gli ACPA pos-sono essere riscontrabili nel siero dei pazienti fino a 10 anni prima della comparsa dei sintomi.. Molteplici studi hanno messo in evidenza come la contemporanea positività per il FR IgM e per gli ACPA sia in grado di distinguere quali pazienti, con artrite precoce e non ancora definita, sviluppe-ranno AR.
Gli ACPA sembrano correlare con l’evoluzione della malattia: la loro presenza all’esordio è ritenuta un fattore prognostico negativo deponendo per una forma di AR più aggressiva. Infatti, tali anticorpi hanno dimostrato di possedere un elevato valore predittivo per lo sviluppo di lesioni articolari erosive.
Al momento non sono state identificate correlazioni significative tra la positività per gli anticorpi diretti verso proteine virali deiminate (VCP-1 e VCP-2) o proteine istoniche (TB-A25, TB-A26) e i livelli di PCR, la presenza di artrite attiva o di manifestazioni extra articolari di malattia. Possiamo, quindi, affermare che gli ACPA rappresentano marcatori di malattia e di severità di malattia, ma non di attività.
Inoltre, sulla base dei risultati del nostro studio, la valutazione dei livelli o della frequenza degli ACPA non sembra rappresentare un parametro valido per il monitoraggio della risposta alla terapia. Tuttavia la nostra ricerca ha coinvolto un numero limitato di soggetti: probabilmente dati più certi potrebbero essere ricavati da una studio su un numero più ampio di pazienti.
La maggior parte dei sieri dei pazienti con AR contengono anticorpi anti VCP-1 e anti VCP-2 di tutti e tre gli isotipi (IgG, IgA e IgM); indicando che c’è una risposta policlonale a peptidi citrullinati di origine virale. Tuttavia esistono sieri in cui si rilevano anticorpi anti VCP di classe IgM e/o IgA, ma non IgG, dato che suggerisce che ogni isotipo è prodotto indipendentemente.
In conclusione, possiamo affermare che la determinazione degli ACPA risulta decisamente utile nel-la diagnosi delnel-la AR ed, in particonel-lare, nel differenziare tale forma di artrite dalle colnel-lagenopatie con artrite concomitante. Il rilievo di ACPA presenta anche un importante valore prognostico nell'e-voluzione dei danni articolari rilevabili radiologicamente e contribuisce, quindi, a stabilire il grado di severità della malattia. Tuttavia, al momento, gli ACPA non sembrano di aiuto nel monitoraggio della risposta alla terapia.
Dal momento che i sieri di pazienti con AR riconoscono in modo specifico gli istoni citrullinati e i peptidi virali deiminati è ipotizzabile, in futuro, lo sviluppo di metodi analitici di tipo multiplex in cui siano utilizzati insieme tutti questi peptidi per una diagnosi sierologica di AR più corretta possibile.
Rheumatoid arthritis. R.N. Maini, N.J.Zvaifler, in “Rheumatology”, J.H. Clipper, P.A. Dieppe Eds, Mobsy, London 1994.
2) A.A.V.V., Harrison-Principi di medicina interna, 17° edizione, 2009; pagg.2015-2023. 3) Brown M.A., Newton J.L., and Wordsworth B.P. (2002) Genetics for Rheumatologists -The molecular genetic basis of rheumatological disorders. Remedica
4) Gregersen P.K., Silver J., Winchester R.J., The shared epitope hypotesis, an approach to understanding the molecular genetics of susceptibility to rheumatoid arthritis. Arthritis Rheum 1987; 30:1205-1213.
5) Kelley’s Text of Rheumathology, 6° edizione, vol.2.
6) Wesoly J., van der Helm-van Mil AH, Toes R.E., Chokkalingam A.P., Carlton V.E., Begovich A.B., and Huizinga T.W. (2005) Association of the PTPN22 C1858T single-nucleotide polymorphism with rheumatoid arthritis phenotypes in an inception cohort. Arthritis Rheum. 52:2948-2950.
7) Kurreeman F.A.S., Padyukov L., Marques R.B., Schrodi S.J., Seddighzadeh M., Stoeken-Rijsbergen G., van der Helm-van Mil AH, Allaart C.F., Verduyn W., Houwing-Duistermaat J. et al. (2007) A Candidate Gene Approach Identifies the TRAF1/C5 Region as a Risk Factor for Rheumatoid Arthritis. Plos Medicine 4:e278
8) Wellcome Trust Case Control Consortium. (2007). Genome-wide association study of 14,000 cases of seven common diseases and 3,000 shared controls. Nature 447:661-678. 9) Remmers E.F., Plenge R.M., Lee A.T., Graham R.R., Hom G., Behrens T.W., de Bakker P.I., Le J.M., Lee H.S., Batliwalla F. et al. (2007) STAT4 and the risk of rheumatoid arthritis and systemic lupus erythematosus. N.Engl.J.Med. 357:977-986.
with risk of rheumatoid arthritis. Nat Genet. 39:1477-1482.
11) Thomson W., Barton A., Ke X., Eyre S., Hinks A., Bowes J., Donn R., Symmons D., Hider S., Bruce I.N. et al. (2007) Rheumatoid arthritis association at 6q23. Nat Genet. 39:1431-1433.
12) Plenge R.M., Seielstad M., Padyukov L., Lee A.T., Remmers E.F., Ding B., Liew A., Khalili H., Chandrasekaran A., Davies L.R. et al. (2007) TRAF1-C5 as a Risk Locus for Rheumatoid Arthritis -- A Genomewide Study. N.Engl.J.Med.
13) Klareskog L., Padyukov L., and Alfredsson L. (2007) Smoking as a trigger for inflammatory rheumatic diseases. Curr.Opin.Rheumatol. 19:49-54.
14) Klareskog L., Stolt P., Lundberg K., Kallberg H., Bengtsson C., Grunewald J., Ronnelid J., Harris H.E., Ulfgren A.K., Rantapaa-Dahlqvist S. et al. (2006) A new model for an etiology of rheumatoid arthritis: smoking may trigger HLADR (shared epitope)-restricted immune reactions to autoantigens modified by citrullination. Arthritis Rheum. 54:38-46. 15) Costenbader KH, Karlson EW. Epstein-Barr virus and rheumatoid arthritis: is there a link? Arthritis Res Ther. 2006;8(1):204.
16) Symmons DP, Gabriel SE. Epidemiology of CVD in rheumatic disease, with a focus on RA and SLE. Nat Rev Rheumatol. 2011;7(7):399-408.
17) Hazes JMW. Pregnancy and its effect on the risk of developing rheumatoid arthritis. Ann Rheum Dis 1991; 50:71.
18) Todesco S., Gambari P.F. Malattie Reumatiche, 4° edizione, 2007; pagg.137-170.
19) Waaler E. (1940) On the occurrence of a factor in human serum activating the specific agglutination of sheep blood corpuscles. Acta Pathol Microbiol Scand 17:172-188.
20) Franklin E.C., Holman H.R., Muller-Eberhard H.J., Kunkel H.G. (1957) An unusual protein component of high molecular weight in the serum of certain patients with rheumatoid arthritis. J.Exp.Med. 105:425-438.
21) Zvaifler N.J. (1973) The immunopathology of joint inflammation in rheumatoid arthritis. Adv.Immunol. 16:265-336.
22) Song YW, Kang EH. Autoantibodies in rheumatoid arthritis: rheumatoid factors and anticitrullinated protein antibodies. (2010) QJM.
23) Bläss S, Specker C, Lakomek HJ, Schneider EM, Schwchau M. (1995) Novel 68 KDa autoantigen detected by rheumatoid arthritis specific antibodies. Ann Rheum Dis
24) Bläss S, Union A, Raymackers J, Schumann F, Ungethum U, Muller-Steinbach S, De Keyser F, Engel JM and Burmester GR. The stress protein BiP is overexpressed and is a major B and T cell target in rheumatoid arthritis. Arthritis Rheum 2001;
25) Nienhuis R.L. and Mandema E. (1964) A new serum factor in patients with rheumatoid arthritis; the antiperinuclear factor. Ann.Rheum.Dis. 23:302-305.
26) Young B.J., Mallya R.K., Leslie R.D., Clark C.J., and Hamblin T.J. (1979) Anti-keratin antibodies in rheumatoid arthritis. Br.Med.J. 2:97-99.
27) Schellekens G.A., de Jong B.A., van den Hoogen F.H., van de Putte L.B., and van Venrooij W.J. (1998) Citrulline is an essential constituent of antigenic determinants recognized by rheumatoid arthritis-specific autoantibodies. J.Clin.Invest 101:273-281.
28) Girbal-Neuhauser E., Durieux J.J., Arnaud M., Dalbon P., Sebbag M., Vincent C., Simon M., Senshu T., Masson-Bessiere C., Jolivet-Reynaud C. et al. (1999) The epitopes targeted by the rheumatoid arthritis-associated antifilaggrin autoantibodies are posttranslationally generated on various sites of (pro)filaggrin by deimination of arginine residues. J.Immunol. 162:585-594.
29) Van Gaalen F., Ioan-Facsinay A., Huizinga T.W., and Toes R.E. (2005) The devil in the details: the emerging role of anticitrulline autoimmunity in rheumatoid arthritis. J.Immunol. 175:5575-5580.
Venrooij W.J., and Menard H.A. (2004) Rheumatoid arthritis specific anti-Sa antibodies target citrullinated vimentin. Arthritis Res.Ther. 6:R142-R150.
31) Bang H., Egerer K., Gauliard A., Luthke K., Rudolph P.E., Fredenhagen G., Berg W., Feist E., and Burmester G.R. (2007) Mutation and citrullination modifies vimentin to a novel autoantigen for rheumatoid arthritis. Arthritis Rheum. 56:2503-2511.
32) Verpoort K.N., Jol-van der Zijde CM, Papendrecht-van der Voort EA, Ioan-Facsinay A., Drijfhout J.W., van Tol M.J., Breedveld F.C., Huizinga T.W., and Toes R.E. (2006) Isotype distribution of anti-cyclic citrullinated peptide antibodies in undifferentiated arthritis and rheumatoid arthritis reflects an ongoing immune response. Arthritis Rheum 54:3799-3808. 32) Anzilotti C, Pratesi F, Tommasi C, Migliorini P. Peptidylarginine deiminase 4 and citrullination in health and disease. Autoimmunity Reviews (2010) 9(3),158-160.
33) Makrigiannakis D., Hermansson M., Ulfgren AK, Nicholas AP, Zendman AJW, Eklund A, Grunewald J, Skold CM, Klareskog L, Catrina AI. Smoking increases PAD2 enzyme expression in human lungs and increases citrullination in BAL cells. Ann Rheum Dis 2008; 67:1488-92)
34) Vossenaar ER, Radstake TR, van der Heijden A, van Mansum MA, Dieteren C, de Rooij DJ, Barrera P, Zendman AJ, van Venrooij WJ. Expression and activity of citrullinating peptidylarginine deiminase enzymes in monocytes and macrophages. Ann Rheum Dis. 2004;63(4):373-81.
35) Mizoguchi M, Manabe M, Kawamura Y, et al. Deimination of 70-kD nuclear protein during epidermal apoptotic events in vitro. J Hist Cytochem. 1998;46:1303–1310.
36) Cantaert T, De Rycke L, Bongartz T, Matteson EL, Tak PP, Nicholas AP, Baeten D. Citrullinated proteins in rheumatoid arthritis: crucial...but not sufficient! Arthritis Rheum. 2006;54(11):3381-9. 37) Tarcsa, E., Marekov, L. N., Mei, G., Melino, G., Lee, S. C., & Steinert, P. M. (1996). Protein unfolding by peptidylarginine deiminase. Substrate specificity and structural relationships of the natural substrates trichohyalin and filaggrin. J. Biol. Chem., 271(48), 30709–30716.
38) Asaga, H., Yamada, M., & Senshu, T. (1998). Selective deimination of vimentin in calcium ionophore-induced apoptosis of mouse peritoneal macrophages. Biochem. Biophys. Res. Commun., 243(3), 641–646.
39) Inagaki, M., Takahara, H., Nishi, Y., Sugawara, K., & Sato, C. (1989). Ca2+-dependent deimination-induced disassembly of intermediate filaments involves specific modification of the amino-terminal head domain. J. Biol. Chem., 264(30), 18119–18127.
40) Pritzker, L. B., Joshi, S., Gowan, J. J., Harauz, G.,&Moscarello, M. A. (2000). Deimination of myelin basic protein. 1. Effect of deimination of arginyl residues of myelin basic protein on its structure and susceptibility to digestion by cathepsin D. Biochemistry, 39(18), 5374–5381.
41) Wang Y., Wysocka J., Sayegh J., Lee Y. H., Perlin J. R., Leonelli L-, Sonbuchner L. S., McDonald C. H., Cook R. G., Dou Y., Roeder R. G., Clarke S., Stallcup M. R., Allis C. D., and Coonrod S. A. (2004) Human PAD4 regulates histone arginine methylation levels via demethylimination. Science 306:279–283
42) Denis H, Deplus R, Putmans P, Yamada M, Métivier R, Fuks F. (2009) Functional connection between deimination and deacetylation of histones. Mol Cell Biol. 29:4982-93.
43) Brinkmann V., Reichard U., Goosmann C., Fauler B., Uhlemann Y., Weiss D.S., Weinrauch Y., Zychlinsky A. (2004) Neutrophil extracellular traps kill bacteria. Science 303: 1532-1535
44) Wang Y, Li M, Stadler S, Correll S, Li P, Wang D, Hayama R, Leonelli L, Han H, Grigoryev S.A., Allis C.D., Coonrod S.A. (2009) Histone hypercitrullination mediates chromatin decondensation and neutrophil extracellular trap formation J. Cell. Biol. 184:205-13
45) Walther J., Van Venrooij WJ., van Beers JJBC., Pruijn Ger JM. Anti-CCP antibody, a marker for the early detection of rheumatoid arthritis. Ann. N.Y. Acad. Sci. 2008.
46) C Anzilotti, G Merlini, F Pratesi, C Tommasi, D Chimenti, P Migliorini; Antibodies to Viral Citrullinated Peptide in Rheumatoid Arthritis.The Journal of Rheumatology, 2006. 47) F Pratesi, C Tommasi, C Anzilotti, I Puxeddu, E Sardano, G.Di Colo P. Migliorini;
Antibodies to a new viral citrullinated peptide, VCP2: fine specificity and correlation with anti-cyclic citrullinated peptide (CCP) and anti-VCP1 antibodies; Clinical and Experimental Immunology, British Society for Immunology, 2011.
48) Tam JP. Synthetic peptide vaccine design: synthesis and properties of a high-density multiple antigenic peptide system. Proc Natl Acad Sci U S A 1988;85:5409–13.
49) Arnett Fc, Edworthy Sm, Bloch Da et al.: The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis. Arthritis Rheum 1988; 31: 315-24.