UNIVERSITA’ DI PISA
Corso di laurea Magistrale in Biotecnologie Vegetali e Microbiche Tesi finale
Meccanismi della degradazione di coloranti glico-coniugati da
parte di Fusarium oxysporum
Relatori:
Candidata:
Chiar.mo Prof. Giovanni Vannacci
Lisa Fiorini
Chiar.mo Prof. Lorenzo Guglielminetti
Correlatore:
Chiar.mo Giorgio Catelani
________________________
ANNO ACCADEMICO 2011-2012
INDICE
1. INTRODUZIONE
1.1 I coloranti nell’industria tessile ed il risanamento dei reflui
5
1.1.1 I coloranti azoici 7
1.1.2 I coloranti azoici glicosilati (GAD)
8
1.2 Risanamento dei reflui dell’industria tessile
9
1.2.1 Biorisanamento dei reflui
11
1.2.2 Utilizzo dei funghi nel biorisanamento dei reflui dei processi di colorazione
11
1.3 Fusarium oxysporum Complex 14
1.3.1 Biologia ed ecologia
14
1.3.2 Il genere Fusarium e la specie Fusarium oxysporum nel biorisanamento 18
1.3.3 Fusarium oxysporum e la degradazione del GAD
19
1.4 Meccanismi biologici della degradazione dei coloranti 21
2. SCOPO DEL LAVORO 27
3. MATERIALI E METODI 28
3.1 Isolato fungino 28
3.2 Substrati di crescita 28
3.4 Valutazione della degradazione del GAD da parte di Fusarium oxysporum e consumo degli
zuccheri 30
3.5 Prove di valutazione dei diversi batch di GAD 31
3.6 Valutazione della degradazione del GAD da parte di Fusarium oxysporum in presenza
di inibitori
32
3.7 Valutazione dell’influenza di diverse condizioni sperimentali nella degradazione del GAD 33
3.7.1 Valutazione dell’influenza del contenitore 33
3.7.2 Valutazione degli effetti della sterilizzazione del GAD 33
3.8 Messa a punto di un protocollo per la misurazione del radicale idrossilico 34
3.8.1 Polietilen-glicole (PEG) come sonda generica per ROS extracellulari 35
3.8.2 Valutazione dei ROS mediante Nitro Blu Tetrazolo (NBT) e DiaminoBenzidina (DAB) 37
3.8.3 Metodo di misurazione del radicale idrossilico mediante degradazione del deossiribosio 38
3.9 Quantificazione del radicale idrossilico mediante saggio del deossiribosio 42
4. RISULTATI 44
4.1 Valutazione della degradazione del GAD da parte di F.oxysporum 44
4.2 Valutazione della degradazione del GAD e consumo degli zuccheri da parte di F.oxysporum in
presenza di inibitori 45
4.2.1 Valutazione della degradazione del GAD in presenza di inibitori 45
4.2.2 Valutazione dell’assimilazione del glucosio 46
4.3. Valutazione dell’influenza di diverse condizioni sperimentali nella degradazione del GAD 47
4.3.1 Valutazione dell’influenza del contenitore sulla degradazione 48
4.3.2 Valutazione degli effetti della sterilizzazione del GAD sulla degradazione 49
4.4 Messa a punto di un sistema per la misurazione del Radicale Idrossilico 49
4.4.3 Valutazione dei ROS mediante Nitro Blu Tetrazolo (NBT) e DiaminoBenzidina (DAB) 52
4.5 Deossiribosio test per la misurazione del radicale idrossilico 53
4.5.1 Messa a punto del saggio del deossiribosio nel sistema F
.
oxysporum/ GAD 53
4.5.2. Valutazione dell’effetto dell’addizione del GAD a diversi timing al mezzo di coltura 53
4.5.3 Quantificazione del radicale idrossilico mediante saggio del deossiribosio 54
5. DISCUSSIONE 68
1. INTRODUZIONE
1.1 I coloranti nell’industria tessile ed il risanamento dei reflui
Con il termine colorante si indica una sostanza in grado di modificare il colore di un determinato materiale grazie alla capacità di legarsi ad un substrato. Una molecola colorante deve rispettivamente contenere due porzioni; il cromoforo che consiste nel gruppo che conferisce il colore e l’auxocromo, ossia il gruppo che lega la molecola del colorante al substrato da colorare. Quest’ultimo deve essere in grado di rendere il colorante solubile (o di migliorarne la solubilità) in un dato solvente.
La principale applicazione industriale dei coloranti è nell’industria tessile. L’ottenimento della colorazione desiderata è possibile grazie alla proprietà dei coloranti di modificare la capacità delle fibre di riflettere la luce. I coloranti maggiormente impiegati sono per lo più di origine sintetica. Esistono fondamentalmente due classificazioni dei coloranti; una di tipo tecnico nella quale i coloranti vengono raggruppati a seconda del sistema di applicazione (coloranti acidi; basici; diretti; sostantivi; a mordenti; premetallizzati; reattivi; allo zolfo; al tino) e una classificazione chimica che ordina i coloranti in riferimento alla loro costituzione chimica e quindi in base alla natura dei
cromofori che contengono (azo; nitroso; nitro; del difenilmetano; del trifenilmetano; indigoidi; antrachinonici; dello stilbene; azinici; ossazinici; tiazinici; della mono- e triclorotriazina).
La scelta del composto e dei metodi di applicazione sono in funzione del colorante e del tipo di fibra da trattare. Le fibre da sottoporre a tintura sono immerse in un bagno mantenuto ad una temperatura di 45-60°C. Dopo l’aggiunta dei coloranti, l’acqua del bagno è lentamente portata alla temperatura necessaria per il processo di tintura (da 80°C all’ebollizione) e vi è mantenuta fino a quando il colorante non è completamente trasferito dal bagno al tessuto (Lubello et al.2003).
Tra i diversi tipi di coloranti, quelli diretti sono tra i più utilizzati poiché presentano il grande vantaggio di poter essere applicati direttamente alla fibra senza alcun trattamento preliminare e possono essere utilizzati su un’ampia gamma di fibre quali il cotone, la lana, la seta e le fibre poliammidiche. A causa dell’elevata produzione di questi tessuti e della loro scarsa capacità di assorbire il colore, nei bagni di tintura si ha un gran consumo dei coloranti diretti che si esauriscono in piccole percentuali e che si ritrovano, in alte concentrazioni, nelle acque di scarico. Sia nella fase di produzione che in quella di utilizzazione, la perdita media stimata del colorante applicato in campo tessile si aggira intorno al 2%, nel caso di tonalità chiare, e del 10%, nel caso delle tonalità scure (Perkins,1999).
In generale, la quantità di coloranti sintetici utilizzati nell’industria tessile ammonta approssimativamente a 10,000 differenti tipi tra coloranti e pigmenti. Annualmente nel mondo si stima che ne siano prodotti più di 7x105 tonnellate, delle quali circa 50,000 tonnellate vengono
rilasciate nell’ambiente. (Lewis, 1999).
In questa ottica, appare chiaro che il trattamento dei reflui dell’industria tessile diventa un punto cruciale in questa filiera. Attualmente, i metodi maggiormente utilizzati per il risanamento di questi
reflui sono di origine chimico/ fisica (ionizzazzione, precipitazione), ma la ricerca si sta dirigendo verso trattamenti di tipo biologico come il biorisanamento, che prevede l’utilizzo di microrganismi in grado di eliminare il colorante dalle acque usate nei processi di tintura. I vantaggi dell’utilizzo di questa nuova tecnologia sono molteplici, primo fra tutti il minor impatto ambientale.
1.1.1 I coloranti azoici
I coloranti azoici rappresentano la classe di coloranti maggiormente utilizzata in campo tessile, in quanto il loro impiego presenta numerosi vantaggi. I coloranti azoici sono solubili in acqua, molto resistenti e caratterizzati dalla presenza di uno o più gruppi cromofori –N=N–. All’interno della molecola possono essere presenti anche numerosi gruppi azo; si distinguono così coloranti mono-, di- e triazoici. Presumibilmente più di 2,000 differenti tipi di coloranti azoici sono usati per la tintura di materiali come tessuti, pelle, plastica, cosmetici e cibi, facendo si che questi siano la più vasta classe di coloranti (circa il 70% del totale) contenente tutte le tipologie elencate nella classificazione tecnica.
I coloranti azoici presentano in genere colorazioni brillanti e requisiti tintoriali favorevoli, anche se la loro stabilità alla luce, al lavaggio e al candeggio è in genere meno elevata di quella dei coloranti appartenenti ad altre classi. Il loro vasto utilizzo nell’industria tessile è dovuto anche al fatto che sono in genere poco costosi.
Si stima che circa il 10% (corrispondente ad una concentrazione di 10-50 mg L-1) del colorante
usato nei processi di tintura penetra le fibre e quindi in grande quantità è rilasciato in cisterne per la raccolta delle acque reflue, o nell’ambiente. (Reisch 1996, Zollinger 1991).
Quasi tutti i coloranti azoici sono composti xenobiotici. Esiste un unico esempio della presenza in natura di un gruppo azoico in un prodotto naturale, il 4,4-diidrooxiazobenzene, (Gill e Strauch 1984). La presenza dei gruppi azoici li rende sia recalcitranti alla degradazione biologica, sia pericolosi agenti inquinanti, in quanto risultano essere potenzialmente tossici. La loro tossicità è dovuta alla capacità di formare, una volta rilasciati nell’ambiente, ammine aromatiche (aniline), sostanze carcinogene e/o mutageniche. Le aniline sono prodotte con la riduzione degradativa dell’anello azoico, che avviene, in opportune condizioni anaerobiche, per opera di alcune specie di batteri. (Chung e Stevens, 1993). Il rilascio nell’ambiente di queste sostanze altamente inquinanti causa sia problemi di tossicità che di smaltimento, oltre ad un disagio estetico dovuto alla colorazione delle acque.
1.1.2 Coloranti Azoici Glicosilati (GAD)
I coloranti azoici glicosilati (GADs) rappresentano una nuova classe di coloranti per i processi di colorazione tessile. Un esempio di colorante GAD è stato recentemente sintetizzato da un gruppo di ricerca dell’Università di Pisa. La sua struttura molecolare è caratterizzata da una porzione saccaridica naturale, il lattosio (o i suoi costituenti glucosio e galattosio), legato covalentemente ad un colorante solubile azoico. L’idea di sintetizzare questo colorante “naturalizzato” deriva dall’osservazione di alcuni coloranti naturali che presentano un’unità zuccherina legata al cromoforo (cartamina e carnicina, rispettivamente estratte da cartamo e cocciniglie) [Fig. 1].
Recentemente, per la sintesi di questi particolari coloranti è stata messa a punto una procedura semplice e le prove di tintura hanno dato risultati interessanti (Bartalucci et al., 2007; Bianchini et al., 2008). In particolare, grazie all’incremento della loro solubilità in acqua, sono capaci di tingere a valori di temperatura e pressione inferiori, in tempi brevi, differenti fibre (lana, seta, nylon,
poliestere e poliuretano) senza l’aggiunta di tensioattivi, il che rappresenta un notevole vantaggio dal punto di vista ambientale. Poiché questi coloranti “naturalizzati” mostrano un’elevata similitudine con alcuni coloranti naturali, spesso contenenti un cromoforo glicoconiugato, si ipotizza che il pathway di degradazione sia più semplice rispetto a quello dei coloranti sintetici di tipo azo. N N N OH OH O O O O O O O O O H O O O O O O O O O N N N O O O O O O O O O OH O O H OH O O O O N N N OH O O H OH O O O O HO HO 1 + 2 3 4 b a
Fig.1 Struttura e sintesi del colorante azoico glicosilato GAD
Uno dei principali problemi connessi con il trattamento dei reflui dell’industria tessile è
rappresentato dal colore, derivante dai residui dei bagni di tintura. Il colore, nonostante l’impiego di tecnologie di decolorazione che consentono di raggiungere il rispetto dei limiti imposti dalle
normative attualmente in vigore, rimane molto spesso percepibile alla vista, risultando, quindi, uno dei fattori di più difficile accettazione da parte dell’opinione pubblica. In questi termini, la
rimozione efficiente del colore diviene un punto cruciale nella filiera di trattamento dei reflui dell’industria tessile.
Fra le tecnologie esistenti atte alla decolorazione, le più usate sono il dosaggio di ossidanti, quali il perossido di idrogeno (H2O2), l’ipoclorito di sodio (NaClO) in ambiente acido, l’ozono;
l’adsorbimento su carboni attivi, la coagulazione e la precipitazione chimica. (Peroni et al. 2008). Quest’ultima rappresenta una fase di pretrattamento che consente da un lato di rimuovere una parte della frazione organica articolata (sospesa e colloidale) e dall’altra di indurre una sensibile
decolorazione del refluo (Tzitzi et al. 1994). Tale decolorazione però, non consente di raggiungere rese di decolorazione soddisfacenti e di conseguenza deve essere accoppiata con un ulteriore processo di decolorazione più spinto.
Un processo che abbina in modo efficace la precipitazione chimica a ottimi livelli di decolorazione è rappresentata dal processo Fenton che impiega H2O2 e Fe(II) in ambiente acido. Secondo Sevimil
et al. (2002), tale processo consente di raggiungere rese di decolorazione superiori al 90%. Tuttavia, l’impiego di un trattamento che utilizzi solo acqua ossigenata non sempre si è dimostrato efficace (Lubello et al. 2003): i risultati dipendono fortemente dal tipo di refluo trattato e dai tempi di trattamento ( Davis et al. 1982).
Tra i sistemi di decolorazione chimico-fisici, negli ultimi anni, si sta ponendo l’attenzione su sistemi di ossidazione avanzata (AOP) che si avvalgono della combinazione di ossidanti, quali O2,
O3, H2O2, con UV e l’eventuale impiego di catalizzatori (Lubello et al.2003). Attualmente, una delle
metodologie di decolorazione più diffusa rimane il dosaggio di NaClO, solitamente affiancato da una fase di pre-acidificazione con H2SO4. L’applicazione di questa tecnologia risulta molto
semplice, ma ha degli indubbi svantaggi ambientali dovuti all’aumento della presenza di cloro nel refluo finale (Peroni et al. 2008).
Anche se questi sistemi permettono di raggiungere livelli accettabili di decolorazione, esistono difficoltà applicative rappresentate sia dagli elevati costi energetici e gestionali, sia dal potenziale rilascio di prodotti inquinanti e fanghi dopo il trattamento (Yang et al.2003).
1.2.1 Il biorisanamento dei reflui
Nonostante l’esistenza di una grande varietà di sistemi di decolorazione del tipo appena descritto, il biorisanamento di reflui tessili sta destando sempre maggior attenzione nella comunità scientifica, in quanto si presenta come un’ottima alternativa per i suoi vantaggi di utilizzo consistenti nel basso costo di applicazione, in sintonia con la natura e favorevolmente accettato da parte dell’opinione pubblica. (Banat et al. 1996).
Il biorisanamento consiste nell’utilizzo di organismi viventi per decontaminare acque o terreni inquinati, tramite trasformazione degli inquinanti in sostanze non dannose, da parte dei
Nel corso degli ultimi anni è stato dimostrato che diversi microrganismi sono in grado, in opportune condizioni ambientali, di trasformare i coloranti azoici in prodotti non colorati o di mineralizzarli completamente.( McMullan et al. 2001; Robinson et al., 2001; Stolz, 2001).
La maggior parte dei microrganismi testati con risultati apprezzabili di decolorazione dei coloranti appartengono sia al regno dei batteri che dei funghi (Zille et al. (2005; Barragan et al. (2007).
1.2.2 Utilizzo dei funghi nel biorisanamento dei reflui dei processi di colorazione
Tra i microrganismi capaci di degradare i coloranti, quelli maggiormente studiati sono i funghi ligninolitici, anche chiamati agenti di carie bianca (white-rot fungi). Questo gruppo di organismi fitopatogeni, appartenenti alla divisione dei Basidiomiceti, gioca un ruolo centrale nel ciclo del carbonio per la capacità di degradare il principale costituente del legno, la lignina, che presenta una complessa struttura polimerica (McMullan et al. 2001).
La capacità di questi funghi di degradare varie classi di coloranti di impiego industriale, tra cui quelli azoici, è stata ampiamente trattata in letteratura (Adosina et al.2003; Romero et al.2006). Questi autori hanno dimostrato che la capacità di degradazione dei coloranti azoici si verifica attraverso l’attività di diversi enzimi coinvolti nella degradazione della lignina come la lignina perossidasi (LiP), la manganese perossidasi (MnP) e le laccasi.
Differenti approcci, mirati a migliorare la degradazione del colorante, hanno mostrato che il fungo ligninolitico Funalia (Trametes) versicolor è capace di degradare più del 90% del colorante grigio Lanaset G, usando un bioreattore per stimolare la produzione di laccasi. (Romero et al., 2006). In condizioni di crescita con limitato apporto di nutrienti, il basidiomicete Phanerochaete
una via metabolica ossidativa, senza rilascio di prodotti tossici (Paszczynski et al., 1992; Spadaro et al., 1992). Inoltre, anche solo l’uso di estratti contenenti enzimi ligninolitici si è dimostrato efficace nella decolorazione dei coloranti (Ciullini et al. 2008). Anche se i funghi agenti di carie hanno dimostrato di poter degradare i coloranti in processi di fermentazione liquida, è stato visto che una produzione su scala industriale di questi enzimi non è realizzabile.
Questo è dovuto alle difficoltà di allevamento di funghi ligninolitici in fermentatori liquidi, che rende problematica sia la crescita fungina sia la produzione ed il rilascio degli enzimi coinvolti nelle reazioni (Robinson et al. 2001).
Recentemente, alcuni gruppi di ricerca hanno focalizzato la loro attenzione su funghi filamentosi appartenenti ad altre divisioni, come gli Ascomiceti e Zigomiceti. A differenza degli agenti di carie, questi ultimi sono capaci di crescere sia in fermentatori liquidi, sia solidi mostrando la capacità di produrre una grande quantità di enzimi durante la fermentazione industriale. Ulteriori indagini in proposito hanno mostrato che il ceppo Dec1 di Geotrichum candidum, isolato da terreno, è capace di decolorare alcuni coloranti antrachinonici (Kim et al. 1995). Yang e collaboratori (2003) hanno dimostrato l’abilità di Umbelopsis isabellina e Penicillium gaestivus di decolorare completamente il colorante Reactive Black dopo sole 48 h di trattamento.
Tuttavia, le vie metaboliche coinvolte nella degradazione usate dai funghi filamentosi non sono state ancora descritte in dettaglio, ma è plausibile supporre che esse siano simili alle vie coinvolte nel metabolismo di altri idrocarburi aromatici (PAH) (Wunderwald et al., 1997). Studi condotti sulla degradazione di PAH da parte dei funghi filamentosi hanno portato ad escludere il possibile coinvolgimento di enzimi extracellulari. Veignie et al. (2003) ha dimostrato il probabile
durante la biodegradazione di benzo[a]pirene, ipotizzando il possibile coinvolgimento di questa via anche nella degradazione dei coloranti.
Oltre alla degradazione del colorante da parte dei funghi, sta emergendo una nuova tecnica chiamata bioassorbimento, che prevede l’assorbimento del colorante all’interno del micelio, eliminandole così le sostanze colorate dalle acque di scarico dell’industria tessile. Sivasamy e collaboratori, (2011) hanno recentemente testato isolati di Aspergillus niger e Trichoderma sp. per il bioassorbimento del colorante azoico Orange G, con risultati incoraggianti.
Negli ultimi anni un isolato fungino appartenente alla specie Fusarium oxysporum ha mostrato interessanti capacità di degradazione del colorante di nuova generazione GAD, risultando un potenziale candidato per il biorisanamento di reflui contenenti coloranti diazo (Porri et al., 2011).
1.3 Fusarium oxysporum Complex
1.3.1 Biologia ed ecologia
Fusarium oxysporum, la specie più diffusa del suo genere, fu descritto per la prima volta dal botanico tedesco D.F.L. von Schlechtendahl nel 1824. Si tratta di un fungo ubiquitario, isolato in regioni sia artiche (Kommendahl et al.,1988; Abbas e Mirocha,1988) sia tropicali, subtropicali e desertiche (Crowhurst et al.,1995; Benteley et al.,1995; Mandeel et al.,1995) che in zone a clima temperato (Granchinho et al.,2002). I ceppi appartenenti a questa specie possono avere caratteristiche sia saprofitarie che fitopatogene.
Mancando il fungo di strutture riproduttive sessuate, non è possibile definire le specie su basi biologiche, e si preferisce pertanto riferirsi a questa specie con il termine Fusarium oxysporum Complex (FOC), che abbraccia l’insieme dei ceppi con caratteristiche biologiche e morfologiche affini ( Lesile e Summerell,2006).
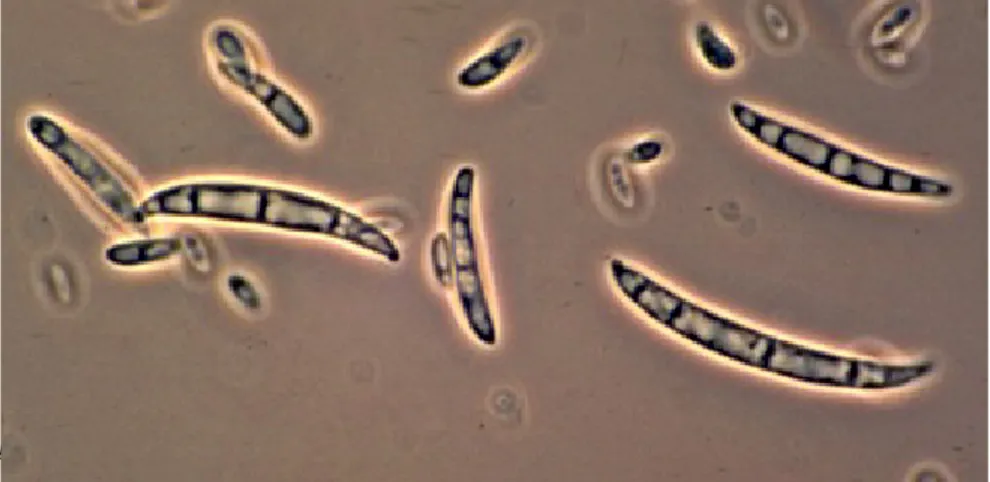
Isolati in colture di queste specie possono presentare un’alta variabilità nella morfologia e nella pigmentazione.(Fig. 2).
Fig. 2 Variabilità nella morfologia delle colture di F. oxysporum.
Su PDA (Potato Dextrose Agar) producono un micelio che può variare da bianco a viola pallido, mentre la superficie inferiore può variare da bianco a viola scuro o magenta. I macroconidi sono di
abbondanti clamidospore e microconidi ovali o reniformi su numerose e piuttosto piccole monofialidi.(Fig. 3 e Fig. 4)
Fig. 3 Macro e microconidi di F. oxysporum.
Fig.3- 4 Microconidi di F. oxysporum su corte monofalidi.
All’interno del genere Fusarium questa è considerata la specie economicamente più importante dato l’ampio spettro di ospiti vegetali che è in grado di attaccare e le ingenti perdite che può causare quando infetta una pianta, a seguito dello sviluppo della malattia conosciuta come tracheomicosi o tracheofusariosi. Molti isolati di F.oxysporum si presentano come ospite-specifici, e ciò risulta nella suddivisione del FOC in formae speciales e razze (o biotipi) che riflettono la specializzazione nei
confronti di particolari varietà o cultivar e la maggiore o minore aggressività nei confronti dell’ospite
F.oxysporum, oltre ad essere patogeno per numerose specie vegetali, è un saprofita ubiquitario ed è stato isolato sia da radici che da semi di una larga varietà di piante. (Booth 1971; Domsch et al. 1980; Mathur & Manandhar 2003).
Sebbene sia stato sporadicamente isolato da cariossidi di cereali, si è dimostrato non patogeno nei confronti del frumento in test di virulenza sotto condizioni controllate. In seguito ad approfondite indagini condotte in Nord America ed Europa F.oxysporum non è stato associato alla fusariosi della spiga d’orzo, mais, avena, segale o frumento. (Bottalico & Perrone, 2002; Logrieco et al. 2002; Parry et al. 1995).
Non è stato neppure direttamente associato a tossicosi umane o animali. In alcuni lavori, è stata riportata la produzione di enniatine, acido fusarico, moniliformine, naphtazarine e sambutoxine da parte di isolati del complesso di specie di F. oxysporum, ma non ci sono risultati riguardanti la produzione di fusarine, fusarocromanoni, o fusaproliferina. (Bacon et al. 1996; De Nijs et al 1996; Herrmann et al 1996; Kim & Lee 1994; Marasas et al 1984; Moretti et al, 2002; Rabie et al. 1982; Thiel et al. 1991; Thrane, 1989,2001). È stata descritta la capacità di alcuni isolati di F. oxysporum di produrre zearalenone e una o più micotossine appartenenti alla classe dei tricoteceni (Marasas et al. 1984), ma la maggior parte dei ceppi di F. oxysporum non è in grado di produrre micotossine appartenenti a questi tipi e manca del gene tri5 richiesto per la biosintesi dei tricoteceni (Tan & Niessen, 2003). Alcuni ceppi di F. oxysporum presentano alleli funzionali di alcuni dei geni che codificano per enzimi coinvolti nella via biosintetica dei tricoteceni (Kimura et al.2003). Possiede inoltre il gene che codifica per una 3-O- acetiltransferasi che può essere utilizzata come difesa nei confronti dei tricoteceni. (Tokai et al. 2005). F. oxysporum è produttore di fumonisine e composti ad esse associate (Cohen et al. 2002; Seo et al. 1996; Sewram et al. 2005) e sono noti per la
In conclusione, a discapito del potenziale micotossicogeno di cui dispone, F. oxysporum appare essere di minore importanza rispetto ad altre specie del suo genere (Desjardins, 2006).
Isolati non patogeni di FOC sono spesso stati proposti come agenti di lotta biologica. In molti casi, infatti, i ceppi di F. oxysporum sono micoparassiti (Benhamou et al,2002; Sands et al,1997; Weideman & Wehner, 1993) o sono parassiti di erbe infestanti o di altre piante non desiderate (Amsellem et al, 2001; Caesar, 1996; Hildebrand & McCain,1978; Yonli et al., 2004).
1.3.2 Il genere Fusarium e la specie Fusarium oxysporum nel biorisanamento
Sebbene non esistano molte informazioni riguardo Fusarium oxysporum come agente di biorisanamento, tuttavia in letteratura sono a disposizione lavori che descrivono la capacità di questa specie, e di isolati appartenenti al genere Fusarium in generale, di degradare diverse sostanze complesse, fornendo basi incoraggianti per un’ applicazione nel biorisanamento.
Da uno studio condotto nel 2003 dal CNR, Istituto per la Protezione delle Piante, in collaborazione con il centro G. Scansetti, e pubblicato su Nature Science Update, emerge che isolati appartenenti alla specie F. oxysporum si sono dimostrati tra i più efficaci, tra quelle testati, nel biorisanamento dell’amianto. Il fungo è capace di estrarre il ferro dalle fibre che compongono l’amianto, la crocidolite, eliminando così i siti attivi verosimilmente coinvolti nello scatenarsi dei meccanismi di carcinogenesi.
In un lavoro del 2006, l’isolato E033 di Fusarium sp. è risultato in grado di degradare fino al 65-70% del composto policiclico aromatico Benzo(a)pirene (BaP) presente in concentrazione di 0.4mM e trasformarlo in due prodotti non tossici. Il BaP viene prodotto mediante combustione incompleta della materia organica ed è uno dei principali inquinanti presenti sulla lista dell’US Enviromental Protection Agency (Chulalaksananukul S. et al., 2006).
Un altro esempio di degradazione di composti aromatici da parte di Fusarium sp. è stato riportato da Veignie e collaboratori (2003). In questo studio un isolato di Fusarium solani ha mostrato un’interessante abilità nel degradare il composto benzo[a]pirene, con un possibile coinvolgimento del perossido di idrogeno attraverso l’impiego del sistema Fenton.
Sebbene i composti oggetto di studio non siano coloranti, essi hanno una struttura molecolare con uno o più anelli aromatici che risultano essere molto recalcitanti all’attacco microbico e che ricordano la struttura di alcuni coloranti.
Uno studio molto interessante condotto presso il Dipartimento di Coltivazione e Difesa delle Specie Legnose “G. Scaramuzzi” (DCDSL) dell’Università di Pisa, i cui risultati sono stati il punto di partenza del presente elaborato, partito dallo screeening di 26 diversi funghi appartenenti alla divisione degli Ascomicota, ha permesso di individuare l’isolato F. oxysporum 3618 come il più efficiente in termini di degradazione di diversi tipi di coloranti industriali, tra cui anche il colorante glicoazoico GAD (Porri et al., 2011)
1.3.3 Fusarium oxysporum e la degradazione del GAD
Dalle attività di ricerca condotte dal gruppo di lavoro del DCDSL dell’Università di Pisa, in collaborazione con il dipartimento di Scienze Farmaceutiche con Sede Chimica Bioorganica e Biofarmacia dell’Università di Pisa, risultante nella pubblicazione su Fungal Biology (Porri et al., 2011), al termine dello screening dei 26 diversi isolati fungini appartenenti alla divisione degli Ascomicota, l’isolato 3618 di F.oxysporum è stato in grado di decolorare completamente il GAD dopo 7 giorni di incubazione. In una prova successiva, volta a valutare la variabilità intra-specifica della capacità di degradare il colorante di nuova generazione, è stata testata un’ampia popolazione
di F. oxysporum, contenente sia ceppi saprotrofi che formae speciales, ed è stato osservato che la capacità di degradazione risulta essere una caratteristica comune all’interno della specie (capacità specie- specifica). Tuttavia, anche in questo caso, F. oxysporum 3618 è risultato essere tra i più veloci a degradare il 100% di colorante, risultando così un candidato ideale per i processi di biorisanamento dei reflui dell’industria tessile (Porri et al., 2011).
Nel dettaglio, da ulteriori test, si è visto che, dopo sei giorni di crescita in substrato liquido contenente il GAD, l’isolato fungino è in grado di degradare completamente il colorante. Alla fine del periodo di incubazione il substrato liquido di coltura mostra il 100% di eliminazione del GAD. Incrementando l’inoculo iniziale del fungo, il colorante risulta essere completamente degradato dopo sole 24h di incubazione. Il tasso di degradazione aumenta in concomitanza con la fine della riserva di glucosio nel mezzo di coltura e l’inizio della fase stazionaria di crescita, suggerendo il passaggio da metabolismo primario a secondario come innesco del processo di degradazione.
Gli autori hanno inoltre valutato la tossicità dei prodotti risultanti dalla degradazione del GAD mediante l’utilizzo di Daphnia magna e mediante analisi GC-MS del substrato di crescita. L’uso del test di tossicità acuta di Daphnia magna ha mostrato che al termine della degradazione del GAD, dopo 144h, non vengono prodotti metaboliti tossici. L’analisi GC-MS dei prodotti derivanti dalla degradazione ha mostrato la presenza di una piccola percentuale di nitrosobenzene e anilina mentre il composto principale derivante dal cromoforo del colorante è il nitrobenzene, suggerendo un processo ossidativo.
Tuttavia rimane ancora aperta la questione riguardante i meccanismi alla base del processo degradativo del GAD messo in atto da F. oxysporum 3618. Alcuni autori, in altri lavori simili, hanno riportato alcuni pathway metabolici che potrebbero essere coinvolti nella degradazione di
coloranti tessili mediante laccasi fungine (Tauber et al., 2005; Zille et al., 2005). Essi hanno mostrato che il trattamento con laccasi di diversi coloranti commerciali porta alla formazione di chinoni e idroperossidi da processi ossidativi. I risultati derivanti dalla GC-MS dei metaboliti prodotti durante la degradazione del GAD da parte di Fusarfium oxysporum 3618, sebbene limitata alla frazione organica dei composti volatili e al brodo di coltura dopo completa decolorazione, sembrerebbero suggerire un processo ossidativo che causa la produzione di nitrobenzene come prodotto finale derivante dalla rottura del doppio legame azo. Comunque la presenza in tracce di precursori azotati meno ossidati del nitrobenzene, come aniline e nitrosobenzene, potrebbero suggerire che la rottura del legame azo avvenga nelle prime fasi della degradazione del GAD, seguito da altre ossidazioni. Studi biochimici condotti sul filtrato colturale ottenuto al termine del periodo di incubazione che porta alla degradazione del GAD non hanno evidenziato la presenza di proteine che ipotizzerebbero il coinvolgimento di enzimi extracellulari in questo processo.
1.4. Meccanismi biologici di degradazione dei coloranti
La disponibilità di un nuovo colorante glico-azotato (GAD) e l’interessante e promettente capacità dell’isolato 3618 di Fusarium oxysporum di degradare questo composto (Porri et al., 2011), hanno posto le basi per il presente elaborato finale il cui scopo era di investigare il meccanismo coinvolto nella degradazione del GAD da parte del fungo. Sulla base di indicazioni precedentemente ottenute circa il non coinvolgimento di enzimi nel processo degradativo e basandosi sulle informazioni presenti in letteratura, l’attività sperimentale è stata condotta al fine di indagare un eventuale coinvolgimento delle specie reattive dell’ossigeno (ROS). La produzione delle specie reattive dell’ossigeno è molto importante in natura, soprattutto nelle piante, poiché serve come segnale in
diversi processi tra cui la difesa dall’attacco di agenti dannosi di origine biotica ed abiotica. Recentemente, il coinvolgimento delle ROS anche in diversi processi fisiologici fungini, come differenziazione e patogenicità, è stato trattato in letteratura. (Giesbert et al., 2008; Takemoto et al.,2007).
Le specie reattive dell’ossigeno sono composti molto reattivi avente vita media di norma brevissima, costituiti da un atomo o una molecola formata da più atomi che presentano un elettrone spaiato: tale elettrone rende la particella estremamente reattiva, in grado di legarsi ad altri radicali o di sottrarre un elettrone ad altre molecole vicine. Le ROS sono le specie reattive a maggior diffusione che possono formarsi spontaneamente per reazione diretta dell'ossigeno molecolare con cationi (generalmente ferro, ma anche zinco e rame) non chelati, o enzimaticamente mediante l‘attività dell'enzima NADPH ossidasi, per poi andare incontro ad una serie di reazioni biochimiche. Le ROS, quali ad esempio l’anione superossido (O2·-), il radicale idrossilico (OH·), il perossido
d’idrogeno (H2O2) e il singoletto d’ossigeno (1O2) posso causare danni a livello cellulare attraverso
l’ossidazione di proteine, lipidi e acidi nucleici.
Il radicale idrossilico ha un’emivita molto breve in vitro (circa 10-9 secondi) e presenta un’alta
reattività. A differenza dei superossidi, che possono essere detossificati dalla superossido dismutasi (SOD), i radicali idrossilici non possono essere eliminati da una reazione enzimatica, in quanto è necessaria la loro diffusione al sito attivo dell'enzima. Poiché la diffusione è molto più lenta dell'emivita della molecola, essa reagirà con ogni composto ossidabile a sua disposizione.
I ROS sono generalmente prodotti durante il normale metabolismo cellulare, ma la loro formazione può essere incrementata da particolari condizioni ambientali quali, ad esempio, l’esposizione a radiazioni ionizzanti, l’incremento della pressione dell’ossigeno o la presenza nel mezzo di agenti
ossidanti. La tossicità dell’O2·- dipende soprattutto dall’interazione di quest’ultimo con l’H2O2.
Infatti, secondo la reazione di Haber-Weiss (Haber F & J. Weiss, 1934), l’interazione tra O2·- e
H2O2 può portare alla formazione del OH·, la più reattiva delle specie parzialmente ridotte dell’O2
secondo la reazione: O2.− + H2O2 → OH-+HO
.
+ O2
E’ stato dimostrato che la costante di questa reazione in soluzione acquosa è vicina allo zero (Richmond et al., 1981) ed essa non può avvenire alle basse concentrazioni di O2·- e di H2O2
presenti in vivo. Tuttavia la presenza in vivo di Fe+2 può catalizzare la formazione del OH·. In
presenza di un donatore di elettroni il Fe3+ viene ridotto a Fe2+ (1) e l’ossidazione di questo ione
mediante O2 porta alla formazione di O2·- (2); quest’ultimo, in seguito ad una reazione di
dismutazione, forma H2O2 (3) che a sua volta può reagire con Fe2+ mediante la reazione di Fenton
per formare OH· (4):
1) Donatorerid + Fe3+ Donatoreoxi + Fe2+
2) Fe2+ + O
2 Fe3+ + O2
.-3) O2.- + 2H+ H2O2 + O2
4)Fe2+ +H
2O2 Fe3+ + HO. + OH-
Come mostrato dall’equazione (3), O2·-, in seguito ad una reazione di dismutazione, forma O2 e
H2O2. Quest’ultimo è capace di ossidare alcuni composti organici come residui di cisteina e
composto. Perciò la tossicità del H2O2 dipende dalla sua capacità di generare OH· in presenza di O2·-
e di Fe2+.
I promotori del ferro della reazione di Fenton sembrano essere disponibili all’interno delle cellule e, in opportune condizioni, nei fluidi extracellulari (Halliwell e Gutteridge, 1985). L’aggiunta di agenti riducenti in un sistema Fenton che sta danneggiando una molecola biologica mediante la generazione di .OH spesso accelera il danno. Gli agenti riducenti che agiscono riducendo Fe3+ in
ioni Fe2+, promuovendo così la reazione di Fenton, includono, tra gli altri, il radicale superossido e
la sua forma protonata (Rush et al, 1985), l’ascorbato (Winterbourn, 1979), e diversi radicali semichinonici (Gutteridge et al, 1982).
L’ipotesi che ROS extracellulari, in special modo il radicale idrossilico, agisca come un agente non enzimatico nella degradazione di sostanze complesse è in accordo con recenti studi condotti da Hammel et al,(2002), sulla degradazione della lignina da parte di diversi Basidiomiceti agenti della carie bianca del legno. Nel caso dei funghi ligninolitici si presenta il problema che gli enzimi specifici prodotti per degradare la lignina sono molto grandi e non sono in grado di attraversare le pareti delle cellule del legno. E’ stato, quindi, ipotizzato il ruolo dei ROS come primi agenti di degradazione proponendo che questi funghi usino un sistema Fenton per la produzione di radicali idrossilici (Wood, 1988). La reazione Fenton è molto importante nei sistemi biologici per la reperibilità dei suoi reagenti, ed è stato ipotizzato il suo coinvolgimento in molti meccanismi di degradazione di sostanze complesse da parte di funghi come i composti policiclici aromatici, la cellulosa e la lignina (Vignie et al, 2003; Cohen et al, 2002; Hammel et al, 2002). Se il meccanismo di produzione dei radicali idrossilici appare chiaro, meno chiaro nel complesso il sistema messo in atto dai diversi tipi di funghi testati per la produzione continua di perossido di idrogeno e ioni
ferro(II). I radicali idrossilici necessitano di essere generati in situ mediante la produzione continua dei reagenti di Fenton. Affinché un sistema Fenton fungino possa esistere è necessario che vengano prodotti metaboliti in grado di ridurre il Fe3+ in Fe2+, o di ridurre O
2 in H2O2. Secondo Halliwell et
al,(1999), la riduzione del ferro(III) da parte dello ione superossido è la più plausibile nei sistemi biologici. In altri studi (Cohen et al, 2002) la produzione dei reagenti Fenton da parte del fungo basidiomicete Gloeophyllum trabeum è messa in atto mediante la produzione di composti fenolici extracellulari che possono ridurre il Fe3+. Recentemente, due di questi metaboliti, 2,5-
dimetossiidrochinone e 4,5-dimetossicatecolo, sono stati identificati come i metaboliti extracellulari maggiormente prodotti in presenza di glucosio da G. trabeum. Entrambi gli idrochinoni hanno mostrato la capacità di ridurre Fe3+ e O
2 rapidamente in condizioni fisiologiche di crescita, per
generare sia Fe2+ che H
2O2. Inoltre, il fungo ha mostrato la capacità di ridurre il prodotto
dimetossichinone a idrochinone, probabilmente tramite l’azione di un chinone riduttasi intracellulare. In questo modo, la crescita su glucosio di G. trabeum porta ad una produzione continua e significativa di radicali idrossilici tramite il ciclo redox del chinone. Oltre a questo meccanismo è stata proposta la produzione di perossido di idrogeno da ossigeno e la riduzione del ferro tramite l’azione dell’enzima cellobiosio deidrogenasi (Simon et al.,1997; Hammel et al,2002). La riduzione dello ione Fe3+ catalizzata dall’enzima cellobiosio deidrogenasi fornisce un percorso
per la produzione di radicali idrossilici extracellulari. La cellobiosio deidrogenasi (CDH) è un enzima extracellulare prodotto da molti Basidiomiceti agenti della carie bianca e della carie bruna del legno e da alcuni Ascomiceti agenti di marciume molle (Henriksson et al, 1995). Questo enzima può agire come una cellobiosio ossidasi, che riduce O2 per produrre H2O2. Poiché il Fe3+ è un
Fe3+. In presenza di Fe3+ e O
2, la CDH del fungo agente di carie bianca Phanerochaete
chrysosporium supporta il sistema Fenton, tramite idrossilazione dell’acido salicilico (Kremer et al, 1992).
Uno studio condotto da Veignie et al, (2003) sul coinvolgimento del perossido di idrogeno nella degradazione del benzo[a]pirene da parte di Fusarium solani, ipotizza che il fungo utilizzi un sistema Fenton simile per la degradazione del composto policiclico aromatico.
2. SCOPO DEL LAVORO
La disponibilità di un nuovo colorante glico-azotato (GAD) e l’interessante e promettente capacità dell’isolato 3618 di Fusarium oxysporum di degradare questo composto, hanno posto le basi per il presente elaborato finale il cui scopo era di investigare il meccanismo coinvolto nella degradazione del GAD da parte del fungo.
A tal fine, i punti fondamentali del presente lavoro sono stati:
- studiare l’effetto di differenti condizioni sperimentali (volume del substrato di allevamento, modalità di sterilizzazione del substrato di allevamento, influenza del momento di aggiunta del colorante nel substrato di allevamento) sulla crescita dell’isolato 3618 di F. oxysporum e sulla sua capacità di degradare il colorante GAD;
- messa a punto di un sistema di rilevazione della presenza dei ROS nel substrato di crescita contenente il GAD;
- ruolo dei ROS nella degradazione del colorante GAD a supporto del coinvolgimento della reazione di Fenton in questo processo.
3. MATERIALI E METODI
3.1 Isolato fungino
L'isolato fungino oggetto di studio del presente studio è il ceppo Fusarium oxysporum 3618, appartenente alla micoteca del Dipartimento di Coltivazione e Difesa delle Specie Legnose, Facoltà di Agraria, Università di Pisa. L’isolato è conservato sotto forma di sospensione di spore in una soluzione di acqua e glicerolo, alla temperatura di –80°C.
In tutte le prove condotte nel corso dell’attività sperimentale, il fungo è stato inoculato sotto forma di sospensione di spore, ad una concentrazione finale di 5x105 spore mL-1. La sospensione di spore è
stata ottenuta mediante lavaggio, con un’aliquota del substrato da inoculare, di Piastre Petri precedentemente inoculate con 150 µL di sospensione fungina e incubate a 24°C per 6 giorni, con un fotoperiodo buio/luce di 12h/12h . La conta delle spore nelle sospensioni è stata fatta mediante Camera di Burker.
Tutte le prove di crescita e degradazione del colorante sono state condotte a 24°C, fotoperiodo luce/buio di 12h/12h, 160 rpm.
3.2 Substrati di crescita
Di seguito sono riportate le composizioni e le modalità di preparazione dei terreni di crescita di uso generale.
• Potato Dextrose Agar (PDA)
Quantità espresse per la preparazione di 1 L di terreno:
• Liquid Medium (LM)
Quantità espresse per la preparazione di 1 L di terreno: 5.0 g glucosio
1..5 g bactopeptone 0.5 g di estratto di lievito 0.0150 g MgSO4
0.350 g KH2PO4
Correggere il pH a 5.5. Autoclavare per 20 min a 121°C.
• Liquid Medium GAD (LMG)
Preparato come il substrato LM ma addizionato del colorante GAD alla concentrazione finale di 75 mgL-1.
3.3 Colorante GAD
Si tratta di un colorante glico-azoico, di colore giallo, assorbanza 437 nm (Fig. 1). Il GAD è stato conservato in stock (10 gL-1) in etanolo a 4°C. La realizzazione e la sintesi del GAD è stata messa a
punto presso dal gruppo di ricerca guidato dal Prof. Giorgio Catelani (Università di Pisa), che ha messo a disposizione per le attività di ricerca di seguito descritte diversi batch di coloranti su cui sono state effettuate le prove di degradazione. Dal momento che si tratta di coloranti sperimentali derivanti da due diversi processi di sintesi, si è ritenuto necessario effettuare delle prove di
valutazione della degradazione del GAD da parte del nostro isolato, per poter confermare i risultati ottenuti nel lavoro precedente usando un diverso batch di GAD (Porri et al., 2011; Fiorini, 2010).
3.4. Valutazione della degradazione del GAD da parte di F. oxysporum e
consumo degli zuccheri
La prova è stata allestita in beute Erlenemeyer (250ml) contenenti 25 ml di substrato di coltura LM addizionato di colorante alla concentrazione finale di 7.5ml L-1. L’inoculo fungino è stato fatto al
tempo zero (T0) alla concentrazione finale di 5*105 spore*ml-1. Come controllo biotico è stato
utilizzato substrato LM inoculato, mentre i controlli abiotici consistevano nei substrati LM e LMG non inoculati. Tutte le tesi sono state allestite in triplo.
I campioni sono stati lasciati a incubare in agitazione per 7 giorni a 24°C, con un periodo 12ore luce/buio a 160rpm. Dal momento dell’inoculo (T0) sono stati fatti prelievi per ciascun campione
ogni 24h. Dopo essere stati centrifugati a 13000rpm per 15 minuti sono stati prelevati 500 µl di surnatante per ogni campione e sono stati conservati a -80°C fino alla lettura spettrofotometrica relativa alla quantità residua di GAD. Una piccola quantità di surnatante (50µL) è stata conservata con le stesse modalità per le letture relative alla misurazione del consumo degli zuccheri inizialmente presenti nel substrato.
Valutazione della degradazione del colorante
La quantità di colorante GAD presente nel substrato di crescita è stata determinata mediante letture spettrofotometriche ad una lunghezza d’onda di 437 nm. Le letture spettrofotometriche sono state condotte sulle aliquote prelevate per ogni campione e conservati a -80 fino al momento della lettura, momento in cui sono stati addizionati (rapporto 1:1) di Buffer sodio citrato 1M (pH 4.1). La quantità residua di colorante è stata calcolata mediante una curva di calibrazione ottenuta utilizzando quantità note di colorante diluite in un tampone sodio citrato (pH 4.1).
Valutazione dell’assimilazione del glucosio
In Porri et al. (2010) ed in Fiorini (2010) si è osservato che sembra esistere una correlazione tra termine degli zuccheri e degradazione del GAD da parte del fungo. Nel corso nelle prove descritte nel presente lavoro di tesi il residuo di glucosio è stato misurato secondo il protocollo descritto da Guglielminetti et al. (1995) in una soluzione contenente:
• 290 µL H2O
• 10 µL del surnatante ottenuto come descritto in XX
• 700 µL di Buffer (100 mM Tris-HCl, pH 7.6; 3 mM MgCl2; 2 mM ATP; 0.6 mM NADP; 1
unità di Glc6P deidrogenasi, 1 unità di esochinasi).
Dopo incubazione a 37°C per 30 min i campioni sono stati sottoposti a letture spettrofotometriche alla lunghezza d’onda di 340 nm.
La misurazione della quantità residua di glucosio è stata effettuata su un’aliquota prelevata da ogni campione con le modalità descritte per ogni prova.
3.5 Prove di degradazione dei diversi batch di GAD
Il colorante GAD utilizzato nelle prove che sono state allestite per la stesura del presente lavoro sono state ottenute con un batch diverso da quello utilizzato in precedenza (Fiorini, 2010; Porri et al. 2011). Per questo motivo, prima di procedere con le prove volte ad indagare i meccanismi d’azione della degradazione del GAD da parte di F. oxysporum 3618, si è proceduto ad un test iniziale di degradazione del colorante al fine di confermare la ripetibilità dei dati ottenuti con il vecchio batch.
La concentrazione di colorante e le condizioni generali di crescita sono state mantenute in accordo con Fiorini (2010). Per ogni prova effettuata sono stati monitorati i due seguenti parametri che rispecchiano l’andamento della degradazione e della crescita fungina:
♦ misurazione della concentrazione residua di colorante GAD presente nel substrato di crescita;
♦ valutazione dell’assimilazione del glucosio da parte del fungo.
Il monitoraggio della degradazione del GAD e dell’assimilazione del glucosio è stato effettuato come descritto precedentemente.
3.6 Valutazione della degradazione del GAD da parte di F.oxysporum in
presenza di inibitori
La prova è stata condotta al fine di valutare il coinvolgimento delle specie reattive dell’ossigeno (ROS) nella degradazione del GAD. A tale scopo sono stati utilizzati alcuni inibitori del citocromo P-450 e delle perossidasi. La scelta degli inibitori e le rispettive quantità da addizionare al substrato LMG è in accordo con la prova precedente (Fiorini L. 2010) e con Veigne et al(2003). Nella tabella sono riportate le attività e le concentrazioni dei reagenti utilizzati:
INIBITORE [C]mM ATTIVITA' SUBSTRATO
No inibitore 0 no attività LMG
Ciclopropilammina 1 Inibitore del citocromo
P-450 LMG-A
Acido salicilidrossamico 5 Inibitore delle perossidasi LMG-B
Piperonil butossido 1 Inibitore del citocromo
P-450 e delle perossidasi LMG-C
Idrossitoluene butilato 5 Inibitore del citocromo
La prova è stata condotta in beute Erlenemeyer da 250 mL contenenti 25 mL di ciascun substrato. Il fungo è stato inoculato sotto forma di sospensione di spore alla concentrazione finale di 5x105 spore
mL-1. Come controllo biotico è stato utilizzato substrato LM inoculato, mentre i controlli abiotici
consistevano nei substrati LM e LMG non inoculati. Tutte le tesi sono state allestite in triplo.
Le beute sono state incubate a 24°C, 160 rpm, con un fotoperiodo luce/buio di 12h/12h per 7 giorni. Ad intervalli regolari di 24 h, a partire dal primo giorno di incubazione, si è proceduto al prelievo di un’aliquota di 1.5 mL di substrato da ciascuna beuta. Il substrato è stato sottoposto a centrifugazione a 13000 rpm, 4°C per 10 min. Due aliquote da 500 µl di surnatante sono state trasferite in due eppendorf e conservate a -80°C per le successive valutazioni della degradazione del colorante e dell’assimilazione del glucosio.
3.7 Valutazione dell’influenza di diverse condizioni sperimentali nella
degradazione del GAD
3.7.1 Valutazione dell’influenza del contenitore
Per ragioni pratiche legate all’attività di ricerca si è cercato di valutare se fosse possibile diminuire le quantità di GAD necessarie per ogni prova allestita, e si è cambiato perciò il contenitore in cui effettuare le prove, al fine di ridurne il volume. Sono stati utilizzati barattoli da coltura in vitro da 150ml, utilizzando 12 ml di substrato LMG invece che 25 ml, rispettando così i rapporti substrato/volume contenitore.. La prova è stata allestita mantenendo inalterati tutti gli altri parametri sperimentali e testando le tesi relative alla degradazione di GAD da parte di F. oxysporum 3618 anche in presenza degli inibitori A e D.
É stata allestita una prova per valutare il possibile effetto della sterilizzazione tramite autoclave del colorante GAD sulla sua degradazione da parte di F. oxysporum 3618. A tal fine sono state allestite due tesi: nella prima il colorante è stato autoclavato insieme al substrato di coltura come descritto nelle precedenti prove; nell’altra il GAD è stato autoclavato separatamente e successivamente addizionato al mezzo LM subito prima dell’inoculo. I campioni sono stati lasciati ad incubare come già descritto per 7 giorni. Sui prelievi, effettuati ogni 24h, sono state fatte le letture relative alla concentrazione residua di colorante.
3.8 Messa a punto di un protocollo per la misurazione del radicale idrossilico
Sulla base dell’ipotesi di un coinvolgimento delle specie reattive dell’ossigeno, ed in particolar modo del radicale idrossilico, nella degradazione del colorante GAD da parte dell’isolato 3618, sono state allestite delle prove volte alla messa a punto di un protocollo per determinare la presenza di questo radicale nel substrato LMG durante la degradazione del GAD. Il radicale idrossilico, come tutti i ROS, è una molecola molto reattiva ed ha un’emivita estremamente breve, circa 109 secondi,in vitro. Per questo motivo la sua rilevazione in un sistema biologico risulta estremamente difficile. Il radicale ossidrilico viene generato nei sistemi viventi a seguito di esposizione a radiazioni ionizzanti o mediante la reazione di Fenton, quando cioè una forma ridotta di un metallo di transizione viene a contatto con acqua ossigenata. Probabilmente la via della reazione di Fenton è la più rilevante da un punto di vista biologico. Il radicale idrossilico è noto per i danni che può causare a tutte le biomolecole, incluso il DNA e le membrane lipidiche, che consistono nella formazione di un radicale carbonico nella molecola che ha subito l’ossidazione. Questo radicale può reagire con l’ossigeno dando luogo alla formazione del radicale perossido, che aggrava ulteriormente il danno (Halliwel et al., 1985). I metodi più efficaci per determinare questo ROS nelle colture fungine sono la risonanza spettroscopica dello spin dell’elettrone o l’utilizzo di specifiche sonde. La risonanza
spettroscopica dello spin dell’elettrone non si adatta però alla misurazione in un processo con un andamento lento, come nel caso della degradazione del GAD. Le sonde spesso sono molecole molto piccole in grado di entrare nelle cellule e non sono in grado perciò di discriminare tra ROS intra- ed extra-cellulari (Hammel et al 2002). Tale discriminazione è essenziale nel caso esaminato in quanto si suppone che il sito di degradazione sia extra-cellulare. Dopo un lavoro di ricerca in letteratura si è deciso di utilizzare tre differenti metodi di rivelazione di seguito descritti.
3.8.1 Polietilenglicole (PEG) come sonda generica per ROS extracellulari
Il polietilenglicole (PEG) è un polimero ampiamente utilizzato sia in campo medico che farmaceutico, oltre che a livello industriale. Le ragioni del suo ampio utilizzo sono dovute alla sua completa atossicità. Esistono diversi tipi di glicole-polietilenico, classificati in base alla lunghezza media delle molecole, ovvero al numero medio n nella formula sotto esposta (Fig. 7). A tale variazione della lunghezza media del polimero corrispondono differenti proprietà fisiche, come la viscosità, mentre le proprietà chimiche sono quasi identiche. Per valori bassi di n il prodotto è liquido, al crescere di n il polimero prende tende ad un solido ceroso con punto di fusione relativamente basso (68°C).
Fig.5 Struttura dell’unità di base del PEG .
Il PEG è stato utilizzato da Hammel e collaboratori per lo studio del coinvolgimento del radicale idrossilico nella degradazione del legno da parte di alcuni basidiomiceti (Hammel et al., 2002). Il PEG possiede diverse proprietà che lo rendono un buon rivelatore di ROS extracellulari: il radicale idrossilico, o comunque un ROS, ossida e degrada rapidamente il PEG, sottraendo gli idrogeni dal
metile (Kerem et al. 1998; Gugumus et al. 1968; Matheson et al. 1973); il PEG con peso molecolare maggiore di 1000 non è in grado di penetrare la parete fungina; essere non è idrolizzabile nelle normali condizioni fisiologiche di crescita di alcun organismo, ad eccezione di alcuni batteri (White et al. 1996). Lo svantaggio associato all’utilizzo del PEG è la sua aspecificità nei confronti del radicale idrossilico, dal momento che altri ossidanti non specifici sono in grado di ossidarlo. Sulla base di quanto descritto, abbiamo ipotizzato che l’utilizzo del PEG potesse fornire un’indicazione generale della produzione di radicali in un sistema biologico.
• Prova preliminare per la determinazione della concentrazione di PEG
Poiché il PEG si sostituisce al colorante nell’attacco del radicale, abbiamo pensato che l’aggiunta di PEG al substrato di coltura in presenza di GAD ne riducesse la degradazione. Prima di poter procedere con la prova di degradazione del colorante in presenza di PEG, è stata condotta una prova preliminare al fine di valutare la concentrazione finale alla quale il polimero doveva essere addizionato e verificare che la sua presenza disturbare non interferisse in qualche modo con la crescita fungina e condizionare, di conseguenza, la degradazione del GAD. Pertanto sono state valutate le seguenti concentrazioni finali di PEG5000 (Carlo erba) nel substrato LM, dove F. oxysporum 3618 è stato inoculato alla concentrazione di 5 105 spore mL-1:
• C1: 0.2g L-1
• C2: 0.4g L-1
• C3: 0.8g L-1
• C4: 1.6g L-1
• C5: 3.2g L-1
La valutazione dell’influenza del PEG sulla crescita fungina è stata effettuata mediante analisi delle proteine totali dopo 6 giorni di incubazione a 24°C, 160rpm con fotoperiodo luce/buio 12h. La
prova è stata effettuata in beute Erlenemeyer da 250ml con 50ml di substrato LM.
• PEG e degradazione del GAD
Sulla base dei risultati ottenuti nella prova preliminare, il PEG è stato addizionato alla concentrazione di 3.2g L-1 al substrato di coltura (LMG) in presenza del colorante GAD (7.5gL-1).
Inoltre, sono state allestite due tesi contenenti PEG e GAD a cui sono stati addizionati gli inibitori ciclopropilammina (A) e piperonil-butossido (C). Le concentrazioni finali dei rispettivi inibitori sono in accordo con Veigne et al (2003) e con Fiorini (2010). La scelta di utilizzare gli inibitori A e C deriva dal fatto che la loro presenza aumenta la velocità di degradazione del GAD. Come controlli biotici sono state allestite tutte le tesi senza l’aggiunta di PEG, mentre come controllo abiotico è stato utilizzato il substrato LMG non inoculato.. Tutte le tesi sono state inoculate al tempo zero e sono state lasciate ad incubare in agitazione per 7 giorni a 24°C, 160rpm con fotoperiodo luce/buio di 12h. Ogni 24h, a partire dal tempo zero, sono stati fatti prelievi per ogni campione e il surnatante è stato recuperato dopo centrifuga (13000rpm, 4°C per 15min) e conservato a -80°C per le successive letture volte a misurare il residuo del colorante.
3.8.2 Valutazione dei ROS mediante Nitro Blu Tetrazolo (NBT) e DiaminoBenzidina (DAB)
Il Nitro Blu Tetrazolo (NBT) e la DiaminoBenzidina (DAB) vengono comunemente usate per la detenzione microscopica rispettivamente dell’ O2- e del H2O2, dal momento che sono in grado di
reagire con questi specifici ROS dando una reazione colorimetrica visualizzabile al microscopio. Queste sostanze vengono adoperate per studiare in piastra quelle interazioni tra organismi e piante,in cui si ipotizza una produzione di questi radicali (Shinogi et al. 2003).
E’ stata allestita, quindi, una prova in cui l’isolato 3618 è stato fatto crescere su substrato LMG agarizzato. Le piastre, inoculate al centro con un dischetto di 8mm di diametro di PDA contenente il fungo in attivo accrescimento, sono state lasciate ad incubare a 24°C, con fotoperiodo luce/buio di 12h. Dopo quattro giorni di incubazione le piastre sono state trattate protocollo come di seguito descritto e in accordo con Shinogi e collaboratori.
- NBT: a ciascuna piastra sono stati aggiunti 5 mL di una soluzione di NBT allo 0.05% in buffer
sodio fosfato 0.05M a pH 7.5, e lasciate ad incubare per 1h a 24°C. Dopo incubazione le piastre sono state trattate con etanolo per fermare la reazione del NBT e mantenute in etanolo a temperatura ambiente overnight.
- DAB: a ciascuna piastra sono stati aggiunti 5 mL di una soluzione di DAB 1mg mL-1. I campioni
sono stati incubati per 8h a temperatura ambiente al buio e successivamente fissate con una soluzione di etanolo e acido acetico in rapporto 96:4 (v/v) e lasciate reagire overnight.
Le piastre trattate con NBT e DAB sono state osservate allo stereomicroscopio.
3.8.3 Metodo di misurazione del radicale idrossilico mediante degradazione del Deossiribosio
Il metodo del deossiribosio per la misurazione del radicale idrossilico non è di semplice esecuzione, ma è molto sensibile e preciso e fin dalla sua introduzione è stato largamente utilizzato (Johansson et al., 1983; Girotti et al,1984). È noto da tempo che lo zucchero pentoso, il 2-deossiribosio (Fig. 6), può essere ossidato dal periodato rilasciando una sostanza che, ad alte temperature, reagisce con l’acido tiobarbiturico (TBA) producendo un cromogeno di colorazione rosa (Waravdekar et al., 1957,1959). Una reazione simile sul deossiribosio libero, o legato al DNA, è ottenuta se sottoposto a radiazioni ionizzanti ad alta energia. Anche l’incubazione di diversi zuccheri (saccarosio, lattosio, fruttosio), oltre al deossiribosio, con Sali di Fe2+ in condizioni aerobiche porta alla formazione di
spettralmente identico ad un addotto di TBA con un’aldeide a 3 atomi di carbonio, la malonaldeide (Fig. 7), chiamata anche malondialdeide (MDA).
Fig. 6 Molecola del deossiribosio
Fig. 7 Formazione dell’addotto per reazione della MDA con l’acido TBA
Non è tuttavia chiaro se la MDA venga rilasciata direttamente dal deossiribosio o se l’anello spaccato dello zucchero produca una sostanza che, dopo trattamento ad alte temperature con TBA, forma la MDA. L’ultima ipotesi sembra la più plausibile quando la degradazione del deossiribosio è promossa da Sali di Fe2+ in condizioni aerobiche. Quando il DNA o il deossiribosio libero viene
irradiato in soluzione acquosa, o quando è degradato da ioni Fe2+ in presenza di O
2, la specie
prodotta che attacca lo zucchero è il radicale idrossilico (·OH). È stata proposta la seguente serie di reazioni (Fig. 8) che portano alla formazione del cromogeno rosa:
Fig. 8 Reazioni che portano alla formazione del cromogeno rosa.
Secondo quanto riportato in letteratura, il mix di reazione nella quale si ipotizza la produzione del radicale idrossilico è incubata a 25°C o 37°C in presenza di deossiribosio, generalmente in concentrazione 2-3mM (concentrazione finale). Nella maggior parte misture dei mix di reazione, la degradazione del deossiribosio sembra procedere linearmente per circa 60 minuti, ma ciò dovrebbe essere testato per ogni sistema preso in esame. Lo sviluppo della colorazione rosa si ottiene addizionando alla miscela di reazione (con Volume finale compreso tra 0.9-1.2 mL) 1 mL di soluzione di acido tiobarbiturico all’1% (p/v) in NaOH 50mM, seguita da 1 mL di soluzione acquosa di acido tricloroacetico (TCA) al 2.8% (p/v). Dopo aver mixato bene i reagenti, i tubi contenenti la miscela vengono riscaldati a 100°C a bagno caldo per 10-20 min e raffreddati. L’addotto rosa di TBA può essere quindi misurato con lo spettrofotometro alla lunghezza d’onda di 532nm. Se la reazione risultasse torbida, il cromogeno può essere estratto in butan-1-olo e
determinare l’assorbanza sull’estratto organico risultante.
• Curva di taratura e verifica del deossiribosio test
La curva di taratura e la verifica del funzionamento del deossiribosio test sono stati ottenuti con H2O2 (30% v/v) e FeSO4 (10mg/L).
• Messa a punto del saggio del deossiribosio nel sistema F. oxysporum/GAD
Dal momento in cui si è deciso di quantificare il radicale idrossilico mediante saggio del deossiribosio si è presentato il problema di decidere a che timing, dal momento dell’inoculo, effettuare il test. Visti i risultati ottenuti sia dalla curva di degradazione del colorante, sia dall’assimilazione degli zuccheri, si è deciso di allestire una prova preliminare in cui il saggio del deossiribosio è stato effettuato dopo 96h dall’inoculo. Inoltre è stato necessario stabilire il periodo di incubazione del deossiribosio aggiunto nel mix di reazione, parametro che, secondo protocollo, va stabilito per ogni sistema esaminato.
Trattandosi di una prova preliminare, sono stati analizzati i campioni relativi al fungo in presenza di GAD (LMG) e il rispettivo controllo. La prova è stata condotta nelle beute da 250 mL, come già descritto. Trascorse 96h dal momento dell’inoculo è stato addizionato il deossiribosio (2mM) direttamente nella beuta di coltura e sono stati fatti, quindi, prelievi a diversi tempi dall’aggiunta del deossiribosio: subito dopo l’aggiunta (T0), dopo 5min (T5), dopo 15min (T15), dopo 30min (T30),
dopo 1h (T1h) e infine dopo 24h (T24). I prelievi sono stati addizionati di acidi TBA e TCA in
rapporto 1:1 e trattati secondo il protocollo descritto precedentemente. Dopo bollitura sono stati centrifugati a 13000rpm, 4°C per 15min per eliminare la massa fungina.
• Valutazione dell’effetto dell’addizione del GAD a diversi timing al mezzo di coltura
La scelta del momento in cui effettuare il test del deossiribosio è un punto cruciale per la messa a punto del protocollo di rivelazione del radicale idrossilico, considerando la breve emivita in vitro della molecola. Il test andrebbe effettuato nel range temporale in cui si sospetta la produzione massima di radicale, e quindi nel lasso di tempo in cui la degradazione del GAD risulta essere più spinta. In base a ciò, è stata allestita una prova in cui l’aggiunta del GAD non è stata fatta per tutte le tesi al tempo zero, ma ad intervalli di 24h dal momento dell’inoculo fungino, fino alle 96h. Lo
scopo della prova era di verificare se c’è un momento nella crescita fungina in grado di influenzare maggiormente la degradazione del colorante GAD, effettuare adatto per ottimizzare il test del deossiribosio. Sono state utilizzate 3 repliche per ogni tesi, a cui il GAD è stato addizionato a diversi timing(T0, T24, T96), rispettando tutti gli altri parametri nell’allestimento della prova. Dal
momento di aggiunta del GAD al substrato LM contenete il fungo, sono stati fatti prelievi ogni 24h per le relative misure del colorante e degli zuccheri. Il tempo zero per la degradazione del colorante, per ogni tesi, non coincide con il momento dell’inoculo bensì con il momento di aggiunta del GAD (24, 48, 72 e 96h dall’inoculo), corrispondente quindi a diversi stadi di crescita fungina e risultando diverso per ogni tesi.
3.9 Quantificazione del radicale idrossilico mediante saggio del deossiribosio
Una volta messo a punto il protocollo per la valutazione del radicale ossidrilico mediantedeossiribosio, è stato condotto un ultimo test volto a determinare, nelle normali condizioni di crescita del fungo nel substrato LMG, la quantità del ROS coinvolto nella degradazione del colorante. Il saggio del deossiribosio è stato effettuato ogni 4 ore nel timing 28-60h di incubazione del fungo in presenza di GAD e GAD più inibitori. A e D. Nell’ambito della sperimentazione relativa al deossiribosio sono state effettuate due prove. La prima è stata condotta su campioni di fungo in LMG. La seconda prova è stata allestita sia su nuovo che su vecchio batch, e sono stati analizzati i campioni relativi al fungo in LMG, LMG+A con aggiunta di ciclopropilammina e LMG+D con idrossitoluen-butilato. Sui campioni sono stati fatti rilievi ogni 4 ore a partire dalla 28° ora di incubazione e su questi è stato eseguito il saggio del
deossiribosio, oltre che le letture del GAD e zuccheri. Le prove della sola degradazione del GAD e quella relativa alla degradazione del GAD in presenza di inibitori A e D sono state condotte separatamente e allestite come descritto in 3.4.3 e 3.4.4. La scelta di usare questi due
inibitori deriva dalle osservazioni per cui la presenza ciclopropilammina porta ad un incremento nella velocità di degradazione, mentre la presenza di idrossitoluen-butilato produce una
riduzione.
I campioni prelevati sono stati trattati secondo il seguente protocollo:
1. È stato prelevato 1 mL per ogni campione di ogni tesi e trasferito in un tubo Falcon da 25ml. 2. Sono stati aggiunti 100 µL di soluzione stock di deossiribosio per raggiungere la
concentrazione finale di 3mM.
3. I campioni sono stati messi a incubare a 25° per 40 min. 4. Sono stati aggiunti 1 mL di TBA e 1mL di TCA.
5. I campioni sono stati messi a bollire per 15 min.
6. Dopo bollitura i campioni sono stati centrifugati a 4° per 15 min a 13000rpm 7. Si è proceduto con le letture spettrofotometriche del surnatante a 532nm.