Università di Pisa
Dipartimento di Farmacia
Corso di Laurea Magistrale in
Chimica e Tecnologia Farmaceutiche
Tesi sperimentale:
Sintesi di eterodimeri contenenti unità di N-acetil-
D
-glucosamina come potenziali inibitori di metalloproteinasi
(MMPs)
Relatori:
Dott.ssa Felicia D’Andrea
Prof. Armando Rossello
Dott.ssa Nuti Elisa
Candidata:
Doretta Cuffaro
Secretazione dell’elaborato scritto della Tesi di Laurea
“Il contenuto di questa Tesi di Laurea è strettamente riservato, essendo presenti argomenti tutelati dalla legge come segreti. Pertanto tutti coloro che ne prendono conoscenza sono soggetti all’obbligo, sanzionato anche penalmente dagli articoli 325 e 623 del codice penale, di non divulgare e di non utilizzare le informazioni acquisite.” *
Clause Secret
The contents of this report is strictly confidential, as arguments protected by law as confidential. Therefore all those who take knowledge are required, even sanctioned fees to Articles 325 and 623 of the Criminal Code, and not to disclose not use the information gained.
(These terms are in accordance with regulations of the University of Pisa in relation to the protection of intellectual property patents.)
Identificazione per presa visione *
Indice
1. -Introduzione………1
1.1. - Ruolo biologico dei carboidrati……….……….……..1
1.2. - Interesse biologico di D-glucosamina e N-acetil-D-glucosamina……...4
1.2.1. - Stimolatori del segnale di trasduzione nelle piante………….…..6
1.2.2. - Recettori batterici………..7
1.2.3. - Glicoproteine ormonali ed enzimatiche………...………..7
1.2.4. - N-acetil-D-glucosamina come molecola segnale………...8
1.2.5. - Usi terapeutici di D-glucosamina e N-acetil-D-glucosamina ……9
1.2.6. - Interesse biologico di N-acetil-D-lattosamina…………...……...10
1.3. Metalloproteinasi (MMPs) e matrice extracellulare (ECM)………11
1.3.1. - La matrice extracellulare (ECM)………...11
1.3.2. - Metalloproteinasi (MMPs)………...13
1.3.3. - Struttura molecolare delle MMPs………18
1.3.4. - Catalisi enzimatica delle MMPs: meccanismo d’azione.……....22
1.3.5. - Inibitori sintetici delle MMPs: breve storia………….………....23
1.3.6. - Regolazione delle MMPs……….………....26
1.3.7. - Patologie dipendenti dall’attività delle MMPs………...….…....28
1.3.8. - Collagenasi-2 o MMP-8…….……….…...30
1.3.9. - Metalloelastasi o MMP-12…….………….…...33
1.3.10. - Gelatinasi B o MMP-9…...…….………….…...34
1.3.11. - MMP-9 e MMP-12 in Chronic Obstructive Pulmonary Disease (COPD).…...…….………….…...35
1.4. - Inibitori di MMPs contenenti unità saccaridiche ………...…36
1.4.1 - Azazuccheri e MMPs…….………….…...39
1.5. - Scopo della Tesi………...41
2. - Risultati e Discussione……….46
2.1. - Sintesi dei derivati N-acetil-β-D-glucosaminici (27 e 28) aventi un aglicone propilazidico……….46
2.2. - Sintesi dell’azide anomerica N-acetil-β-D-glucosaminica (32)…...…...52
2.3. - Sintesi di eterodimeri contenenti il legame tioureidico…………..………55
2.4. - Sintesi di eterodimeri contenenti il legame 1,2,3-triazolico……..……….60
2.5. - Preparazione degli eterodimeri deprotetti 34-35, 39-40, 43-44.……...66
2.6. - Valutazioni sull’attività inibitoria verso le metalloproteinasi degli eterodimeri 34-35, 39-40, 43-44………...69
3. – Parte Sperimentale……….71
3.1. - Metodiche generali: reattivi, solventi e strumentazione……...71
3.2. - Preparazione delle azidi 27a, 27b, 32.……...73
3.2.1 - Preparazione del 2-acetammido-1,3,4,6-tetra-O-acetil-2- desossi-α-D-glucopiranosio (46)…….………….…...73
3.2.2 - Preparazione del 2-ammino-3,4,6-tri-O-acetil-2-desossi- 1-O-2-N-(etan-1-il-1-ilidene)-α-D-glucopiranosio (47).…….…...73
3.2.4. - Preparazione del 3-O-tosilpropil 2-acetammido-3,4,6-tri-O-acetil
-2-desossi-β-D-glucopiranoside (48)………...….………...75
3.2.5. - Preparazione del 3-O-azidopropil 2-acetammido-3,4,6-tri-O- acetil-2-desossi-β-D-glucopiranoside (27a)……….…………...76
3.2.6. - Preparazione del 3-O-azidopropil 2-acetammido-2- desossi-β-D-glucopiranoside (51)………...…….………...76
3.2.7. - Preparazione 3-O-azidopropil-3,4,6-tri-O-benzil-2- acetammido-2-desossi-β-D-glucopiranoside (27b)……...…...77
3.2.8. - Preparazione del 2-acetammido-2-deossi-α,β-D- glucopiranosio (52)………..……….………...78
3.2.9. - Preparazione della 2-acetammido-3,4,6-tri-O-acetil-2-deossi -α-D-glucopiranosil azide (32)……….………...78
3.3. - Preparazione dei glicosidi 28 e 36, contenenti un gruppo isotiocianato……...80
3.3.1 - Preparazione 3-(isotiocianato)-propil 3,4,6-tri-O-benzil-2- acetammido-2-desossi-β-D-glucopiranoside (28)...…….………...80
3.3.2. - Preparazione del 2-acetammido-3,4,6-tri-O-acetil-2-deossi-β-D- glucopiranosil isotiocianato (36)....…….………...81
3.4. - Preparazione degli eterodimeri a struttura tioureidica 29-30, 31, 37, 38 e 41……...82 3.4.1 - Preparazione dell’eterodimero 29………...…….………...82 3.4.2 - Preparazione dell’eterodimero 30………...…….………...83 3.4.3 - Preparazione dell’eterodimero 31………...…….………...84 3.4.4 - Preparazione dell’eterodimero 37………...…….………...85 3.4.5 - Preparazione dell’eterodimero 38………...…….………...86 3.4.6 - Preparazione dell’eterodimero 41………...…….………...87
3.5. - Preparazione degli eterodimeri a struttura 1,2,3-triazolica 33 e 42...88
3.5.1 - Preparazione dell’eterodimero 33………...…….………...88
3.5.2 - Preparazione dell’eterodimero 42………...…….………...89
3.6. - Preparazione degli acidi carbossilici eterodimerici 34, 39 e 43...90
3.6.1 - Preparazione dell’eterodimero 34………...…….………...90
3.6.2 - Preparazione dell’eterodimero 39………...…….………...91
3.6.3 - Preparazione dell’eterodimero 43………...…….………...91
3.7. - Preparazione degli eterodimeri deprotetti 35, 40 e 44...92
3.7.1 - Preparazione dell’eterodimero 35………...…….………...92
3.7.2 - Preparazione dell’eterodimero 40………...…….………...93
3.7.3 - Preparazione dell’eterodimero 44………...…….………...94
1. Introduzione
1.1. Ruolo biologico dei carboidrati
I carboidrati, insieme a proteine e acidi nucleici, costituiscono un’importante classe di composti organici naturali maggiormente diffusa in natura presente in tutti i tessuti degli organismi viventi. Fino a 30 anni fa erano considerati molecole aventi solo funzione di tipo strutturale e di riserva energetica per la cellula (cellulosa, chitina, glicogeno etc.) e, non essendo stati evidenziati coinvolgimenti nei processi biologici, veniva loro attribuito uno scarso rilievo all’interno della complessa architettura fisiologica umana. Notevole evidenza hanno assunto negli ultimi anni le complesse strutture molecolari polimeriche (glicoconiugati) dove i carboidrati sono legati a proteine (glicoproteine) o lipidi (glicolipidi). Presenti nella maggior parte degli organismi viventi, risultano essere di rilevante attività biologica, nella quale assume un ruolo primario la presenza del residuo glucidico. Inizialmente tuttavia, si riteneva, che l'espletamento dell’attività biologica di queste complesse strutture fosse esercitato dal frammento non glicidico (proteico o lipidico) e che la presenza di differenti catene oligosaccaridiche fosse accessoria e casuale. Successivamente con l’avvento della glicobiologia si è assistito ad un notevole sforzo scientifico volto alla comprensione dell’attività biologica espletata da questi polimeri naturali ed è stato dimostrato che, molto spesso, la loro specificità è ascrivibile principalmente ai residui saccaridici.1 Le
glicoproteine sono classificate in due gruppi principali, le N-glicoproteine e le O-glicoproteine a seconda che la catena oligosaccaridica sia legata alla proteina rispettivamente attraverso l’amminoacido asparagina o gli amminoacidi treonina o serina. In particolare è stato evidenziato che la porzione glicidica di una glicoproteina modifica le proprietà della proteina stessa, alterandone la stabilità, la resistenza alle proteasi, la struttura quaternaria e partecipa direttamente al fenomeno di riconoscimento molecolare esercitato dai glicoconiugati presenti sulle pareti cellulari.
Le ricerche volte alla comprensione dell’attività biologica di glicoproteine e glicolipidi, hanno evidenziato un ruolo fondamentale dei residui glucidici in numerosi processi biologici,2tanto che oggi, ad essi, sono attribuite caratteristiche bio-informative
come quelle conferite agli acidi nucleici e alle proteine. Anche se esistono numerosi studi volti alla comprensione della relazione struttura-attività dei carboidrati, i risultati sono ancora lontani rispetto a quelli raggiunti con le proteine e gli acidi nucleici e ciò
spinge i ricercatori a investigare sulla glicomica nella stessa sistematica maniera utilizzata per il DNA (genomica) e per le proteine (proteomica) con lo scopo di creare un catalogo, cellula per cellula, di strutture glicidiche, glicosidasi e glicosiltransferasi coinvolte nella loro biosintesi.
Una complicazione dello sviluppo della glicomica risiede nel fatto che mentre il DNA e le proteine hanno essenzialmente sequenze lineari di venti possibili building blocks, gli zuccheri esibiscono spesso sequenze ramificate di 30 possibili building blocks tanto che, ad esempio, il numero di isomeri lineari e ramificati di un esasaccaride è di 1012. I carboidrati, avendo a disposizione un ampio ventaglio di combinazioni
possibili e diversi punti di ramificazione generano strutture complesse in grado di fornire una quantità estremamente elevata d’informazioni e l’innumerevole varietà delle unità monosaccaridiche costituenti le macromolecole, permette loro di espletare un linguaggio (glicocodice) estremamente eloquente. I decifratori di questo linguaggio generalmente sono proteine leganti gli zuccheri chiamate lectine, caratterizzate da un’elevata specificità quali, ad esempio, le galectine in grado di riconoscere in modo specifico unità β-D-galattosidiche. E’ noto, infatti, che numerose interazioni
cellula-cellula, vari meccanismi immunologici e molte condizioni patologiche sono da imputare a interazioni specifiche lectine-carboidrati. Ad esempio l’adesione batterica ai tessuti dei mammiferi è spiegata in termini di specifiche lectine che, interagendo con specifiche glicoproteine, agiscono come recettori di carboidrati.
I carboidrati sono quindi coinvolti in numerosi fenomeni di riconoscimento e adesione tra cellule, tra cellule e virus, batteri, tossine e per questa ragione sono coinvolti in processi biologicamente importanti,3 come la difesa immunitaria, la
replicazione virale e la crescita cellulare. Inoltre sono farmacologicamente rilevanti in processi infiammatori (osteoartrite e artrite reumatoide), infezioni virali e batteriche, disordini metabolici e patologie tumorali visto il loro ruolo nella trasmissione dei segnali responsabili della crescita cellulare incontrollata.
Lo studio delle funzioni biologiche delle strutture saccaridiche necessita la disponibilità di abbondanti quantità di derivati glicidici chimicamente puri, strutturalmente e stereochimicamente definiti e l’accesso a tali strutture da fonti naturali è limitato dal fatto che essi sono presenti in natura in basse concentrazioni, spesso legati ad altre strutture complesse (proteine e lipidi), e in forma micro-eterogenica, tant’è che il loro isolamento, quando possibile, è molto difficile e costoso. L’accesso a tali
composti dipende quindi essenzialmente dalla sintesi chimica che deve garantire un’elevata stereoselettività.
Con l’avvento della glicobiologia, la scienza che collega i differenti interessi dei chimici organici e dei biologi per i carboidrati, si è assistito in questi ultimi anni a un grandissimo sforzo scientifico volto alla comprensione di ogni singola attività biologica espletata dai residui glicidici delle strutture macromolecolari umane, messo in luce dall’elevato numero di pubblicazioni relative ai carboidrati che appaiono in numero sempre crescente e nelle più svariate riviste. Ciò ha incentivato la progettazione e la sintesi di molecole a struttura saccaridica da utilizzare come sostanze terapeutiche ottimali per realizzare formulazioni mono, poli- o oligosaccaridiche come ad esempio vaccini antibatterici, antivirali, anti-tumorali o immunostimolanti e per lo sviluppo di farmaci a base di carboidrati.4
I carboidrati più raffigurati nelle strutture saccaridiche biologicamente attive sono gli amminozuccheri rappresentati da aldosi e chetosi nei quali un gruppo ossidrilico è sostituito da un gruppo amminico (ad esempio le esosammine come il 2-desossi-2-ammino-D-glucosio, Figura 1). La sostituzione può avvenire in qualsiasi posizione della
molecola eccetto quella anomerica (C-1), in quest’ultimo caso infatti si parla di glicosilammine, che rappresentano una diversa classe di composti, anch’essi presenti anche in Natura sia come costituenti di importanti biomolecole che come metaboliti secondari di specie vegetali e batteriche.
Figura 1 OH O NH2 O H O H OH OH O NH2 O H OH OH NH2 O OH O H O H OH
2-desossi-2 ammino-D-glucosio 2-desosssi-2-ammino-D-galattosio D-glicosilammina
Le più comuni esosammine sono rappresentate dal 2-desossi-2-ammino-D
-glucosio (o D-glucosamina) e dal 2-desossi-2-ammino-D-galattosio (o D-galattosamina).
Le loro forme N-acetilate (N-acetil-esosamine), sono i principali costituenti di importanti polisaccaridi naturali, come la chitina, gli amminoglicani presenti nei tessuti e nelle cartilagini dei mammiferi, la condroitina solfato, il dermatan solfato, nonché il cheratan solfato, l’eparina e l’acido ialuronico. I 2-desossi-2-acetammido aldoesosi si ritrovano, inoltre, tra i componenti monosaccaridici dei polisaccaridi capsulari di batteri, delle glicoproteine e dei glicolipidi delle membrane cellulari.
Il primo amminozucchero fu scoperto nel 1876 da Ledderhose, che isolò 1a (più tardi chiamato glucosamina) (Figura 2) dall’idrolizzato acido di un guscio di aragosta; tuttavia, l’interesse verso questa classe di zuccheri crebbe solo agli inizi degli anni ’50, in parte come conseguenza della scoperta, nel 1946, che il
2-desossi-2-(metilammino)-L-glucopiranosio è un componente fondamentale dell’antibiotico streptomicina. Le
N-acetil-esosammine più importanti e diffuse in natura (Figura 2), ottenibili dall’idrolisi acida di macromolecole di origine naturale come le glicoproteine, sono la N-acetil-D
-glucosamina (GlcNAc, 1b), la N-acetil-D-galattosamina (GalNAc, 2b) e la N-acetil-D
-mannosamina (ManNAc, 3b), che si trovano in natura, libere o coniugate, sia negli organismi animali superiori (nei tessuti e nei fluidi) sia in alcuni batteri.
Figura 2 OH OH NH-X O O H OH OH O H NH-X O O H OH OH O H NH-X O O H OH 1a: X=H 1b: X=Ac (GlcNAc) 2a: X=H 2b: X=Ac (GalNAc) 3a: X=H 3b: X=Ac (ManNAc)
Ad esempio, l’unità β-D-ManNAc è un componente dello spaziatore naturale che
lega gli acidi teichioici alle catene peptidoglicaniche di alcuni batteri Gram-positivi, ed è anche molto diffusa nei polisaccaridi capsulari di batteri Gram-negativi come
Neisseria Meningitidis e Streptococcus Pneumoniae.
1.2. Interesse biologico di
D-glucosamina e N-acetil-
D-glucosamina
Il 2-ammino-2-desossi-D-glucosio (D-glucosamina, 1a) rappresenta uno dei
monosaccaridi più abbondanti in natura e si trova come costituente principale nei gusci duri dei crostacei e di altri artropodi, in molti funghi, ed è molto diffuso anche negli animali superiori (per esempio, come costituente di numerosi glicosamminoglicani e glicosamminoglicuronani). La D-glucosamina (1a) è un saccaride estremamente
importante, tanto che non c’è da stupirsi che quasi la metà della letteratura sugli amminozuccheri abbia come oggetto l’ammina 1a ed i suoi derivati,1 tra i quali il più
abbondante in natura è sicuramente l’N-acetil-D-glucosamina (GlcNAc, 1b, Figura 1),
presente in molte strutture macromolecolari saccaridiche biologicamente importanti.2
La GlcNAc è incorporata in una serie di polisaccaridi strutturali, tra i quali la chitina 4 (Figura 3) è sicuramente il più abbondante. Questo saccaride si trova nell’esoscheletro di invertebrati come insetti, artropodi, nematodi, Plasmodium
falciparum e come costituente delle pareti cellulari di numerosi funghi. Gli enzimi
chitinasi, enzimi idrolitici responsabili della demolizione totale della chitina (4) in D
-glucosamina (1b), si trovano in organismi come batteri, funghi, piante e vertebrati, ma sono assenti negli esseri umani.
Figura 3 O O O H NHAc O HO O NHAc O H O O H NHAc OH OH OH OH n 4
L’assenza di questi enzimi nell’uomo fa sì che gli inibitori delle chitinasi siano degli ottimi target per lo sviluppo di insetticidi e farmaci contro patogeni umani come la
Candida albicans o il P. falciparum, il parassita responsabile della malaria nell’uomo.
Gli inibitori delle chitinasi, sia naturali che sintetici, sono rari e quindi un’importante area di ricerca si basa sulla preparazione di strutture a potenziale attività inibitoria contenenti l’unità GlcNAc.2
Il derivato 3-O-(D-1-carbossietil), conosciuto come acido muramico (5, Figura 4)
così come il corrispondente N-acetil derivato (X=Ac), è ampiamente distribuito nelle pareti cellulari batteriche.2 La mureina, ad esempio, è un polisaccaride costituito dalla
ripetizione di unità di GlcNAc ed acido muramico. Figura 4 OH O H NH-X O RO OH 5: R = (R)-CHMeCO2H; X = H
All’interno della parete cellulare batterica, le catene polisaccaridiche formano dei
cross-link attraverso le catene peptidiche, costruendo così un’impalcatura
peptidoglicanica grazie all’azione dell’enzima transpeptidasi. Sarebbe, quindi, utile poter disporre di frammenti semi-sintetici di mureina da usare in studi di valutazione dell’attività biologica di questo enzima.2
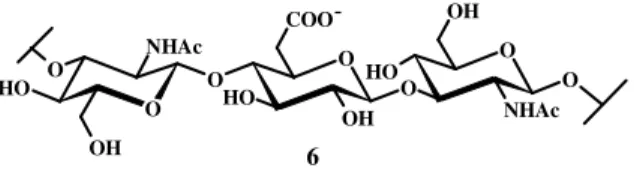
L’acido ialuronico (HA, 6, Figura 5), un glicosamminoglicano che rappresenta il principale elemento strutturale della matrice extracellulare, è responsabile delle proprietà visco-elastiche delle cartilagini e dei fluidi sinoviali.
O O H O O NHAc O O O H OH O H O O NHAc OH COO OH 6
-Questo polisaccaride lineare è coinvolto anche nelle interazioni fra proteine, influenzando processi naturali quali l’angiogenesi, la mobilità e l’adesione cellulare, l’insorgenza di tumori, nonché il processo di guarigione delle ferite. Alcuni batteri patogeni posseggono l’acido ialuronico (6) nella matrice extracellulare come rivestimento difensivo nei confronti della risposta immunitaria dell’ospite. Nucleotidi e fosfati sintetici del tipo GlcNAc-β-(1-4)-GlcUA sono stati usati come probe per studiare il meccanismo d’azione dell’enzima “acido ialuronico sintasi” (HAS), con lo scopo di chiarire alcune delle malattie legate a disordini dell’acido ialuronico.
1.2.1. Stimolatori del segnale di trasduzione nelle piante
I fattori Nod (NF, 7, Figura 6) sono molecole segnale, contenenti unità ripetitive di GlcNAc, secrete dai batteri del genere Rhizobium che, dopo essersi stabiliti all’interno dei noduli radicali delle Leguminosae, iniziano a fissare l’azoto.
Figura 6 OH O O O H NHAc O HO O NHAc O H O O H NH OCOCH3 O (CH2)5 H H C6H13 OH OSO3H n 7
Subito dopo la fissazione dell’azoto nei noduli, i fattori Nod vengono escreti e stimolano, in qualità di molecole segnale, gli sviluppi morfologici dei peli radicali e dei meristemi nella corteccia della radice della pianta ospite, nonché l’organogenesi del nodulo stesso.
1.2.2. Recettori batterici
La GlcNAc (1b) è un costituente di quei carboidrati, presenti sulla superficie cellulare, che sono coinvolti, come recettori, nell’adesione dei batteri e delle loro tossine alle cellule dell’ospite.2 Per esempio, l’epitopo GlcNAc-β-(1-4)-GlcNAc, presente nelle
glicoproteine di superficie delle cellule microvascolari endoteliali (BMEC), è un ligando per la proteina A (OmpA) della membrana esterna di E. coli K1. Questo fenomeno di riconoscimento media il passaggio di E. coli attraverso la barriera ematoencefalica causando, ad esempio, meningiti durante il periodo neonatale. Due chitooligomeri sintetici (8, Figura 7) sono stati studiati come inibitori competitivi solubili per questo riconoscimento, e potrebbero rappresentare la molecola leader per la sintesi di agenti antibatterici basati su strutture saccaridiche contenenti GlcNAc.
Figura 7 OH O O O H NHAc O HO O NHAc O H O O H NHAc OH OH OH n n = 0-1 8
1.2.3. Glicoproteine ormonali ed enzimatiche
E’ noto che le glicoproteine contenenti il residuo GlcNAc abbiano importanti attività enzimatiche ne è un esempio la bromelina (9, Figura 8), un enzima glicoproteico presente nel regno vegetale.2
Figura 8 O O O H NHAc OHO O NHAc OH O H O O H OH OH OH (1 4')-L-Asn 9
Anche nelle glicoproteine ormonali, quali l’ormone follicolo-stimolante (FSH), l’ormone luteinizzante (LH), la gonadotropina umana della menopausa (hMP), la gonadotropina del siero di giumenta gravida, l’ormone stimolante la tiroide (TSH) e la gonadotropina corionica umana (hCG, 10, Figura 9),2 sono presenti unità di GlcNAc
nella porzione polisaccaridica. Figura 9
O H O O H NHAc O O OH OH O OH O OH AcHN O OH O H O O H O OH O H O O H O O H O O H OH O O H O O H NHAc O OH O O H OH O AcHN O H O O H OHOH COOH OH (1 4')-L-Asn 10
1.2.4. N-acetil-D-glucosamina come molecola segnale
A livello fisiologico il glucosio e la D-glucosamina (1a, Figura 2) rivestono un
ruolo di primaria importanza in quanto risultano avere, oltre al tradizionale ruolo nei processi energetici di metabolismo, una funzione centrale nei processi regolatori e di mediazione cellulare. Ricerche recenti5 hanno evidenziato che le unità GlcNAc (1b,
Figura 2) sono utilizzate come sensori nella regolazione dei segnali insulinici, nel ciclo cellulare, nello smaltimento del calcio e nello stress cellulare.
L’insulina agisce riducendo i livelli di glucosio nel sangue promuovendone da una parte il riassorbimento grazie ad una sovraespressione del recettore GLUT-4 sulla membrana cellulare soprattutto all’interno dei muscoli e del tessuto adiposo, e dall’altra sopprimendo la produzione di glucosio attraverso l’inibizione della glicolisi a favore della glicogenosintetasi. E’ stato evidenziato che nei malati di diabete di tipo II l’azione dell’insulina nell’uptake del glucosio è inibita e l’aumentata presenza di GlcNAc (1b, Figura 2) altera l’uptake di glucosio come conseguenza di una modifica proteica. Per questo motivo molte proteine implicate nella cascata di segnali indotti dall’insulina sono modificate proprio da questa specifica esosamina che andrebbe a potenziare gli effetti patologici del diabete di tipo II, come ad esempio, l’aumento di placche arteriosclerotiche, l’aumento della sintesi e dell’accumulo di lipidi, l’inibizione della glicogenosintetasi.
Alterazioni nella concentrazione di glucosio e glucosamina all’esterno della cellula possono incidere sullo smaltimento del Ca2+, andando a provocare
cardiomiopatia, ovvero una ridotta contrattilità cardiaca. Recentemente5 è stato
dimostrato un miglioramento delle condizioni cardiopatiche in presenza di una modulazione dei livelli di GlcNAc.
1.2.5. Usi terapeutici di D-glucosamina e N-acetil-D-glucosamina
La D-glucosamina (1a, Figura 2) sottoforma di cloridrato e solfato e l’N-acetil-D
-glucosamina (1b, Figura 2) sono usate in terapia clinica nel trattamento dell’osteoartrite (Figura 10).6 L’osteoartrite è un disordine cronico degenerativo che rappresenta una
delle principali cause di disabilità, caratterizzato da una perdita della cartilagine articolare,con conseguente distruzione delle sue proprietà meccaniche e quelle di osso subcondrale nonché modifiche nei tessuti molli circostanti. L’utilizzo di D-glucosamina
per questa patologia è stato oggetto di discussione in quanto non considerato un vero e proprio farmaco ma piuttosto un integratore a causa della mancanza di letteratura che ne confermi la sua efficacia.
Figura 10
La presunta attività biologica è attribuita al fatto che la D-glucosamina sia un
precursore di glicosaminoglicani, componenti della cartilagine articolare, e il suo uso come integratore in questa patologia è giustificato dal basso costo e dai pochi effetti collaterali. Infatti è ormai considerata trascurabile l’ipotesi di un flebile peggioramento delle condizioni di diabete di tipo II.
La D-glucosamina e l’N-acetil-D-glucosamina sono in fase di sperimentazione nel
trattamento della sclerosi multipla (SM),7 una patologia cronica e progressiva dovuta ad
un danneggiamento delle fibre nervose a causa di un mal funzionamento del sistema immunitario. Attualmente i trattamenti per questo tipo di patologia sono limitati in efficacia costo e tossicità. Vari fattori ambientali e genetici concorrono nel peggioramento della patologia provocando un iperattività delle cellule T. Questo
disturbo autoimmunitario è causato da linfociti T autoreattivi nei confronti della mielina che riveste gli assoni e le lesioni alla guaina mielinica (demielinizzazione) rallentano la conduzione degli impulsi attraverso le vie nervose. La N-Acetil-D-glucosamina, assunta
per via orale, come integratore alimentare, agisce andando ad inibire le risposte mediate dalle cellule T Helper (Th1 e Th17) attenuando la fase di demielinizzazione e, conseguentemente il decorso della patologia.
1.2.6. Interesse biologico di N-acetil-D-lattosamina
La N-acetil-D-lattosamina (11, Figura 11) è un disaccaride, composto da un’unità di D-galattopiranosio ed un’unità di N-acetil-2-desossi-D-glucopiranosio (GlcNAc), che
spesso appare come elemento strutturale in glicoconiugati d’interesse biologico.8
Figura 11 O OH O O H OH OH O O H NHAc OH OH 11
Questo disaccaride (LacNAc) svolge un ruolo predominante nel riconoscimento degli anticorpi ed è contenuto nelle glicoproteine presenti sulla superficie delle cellule rosse del sangue (eritrociti). Questi dominanti antigenici sono caratteristici per gli individui e possono riconoscere gli anticorpi specifici dei soggetti che hanno gruppi sanguigni diversi.4 Esso risulta determinante anche nel ruolo biologico delle lectine,
proteine che legano i carboidrati con alta specificità verso l’N-acetil-D-lattosammina.9
Le cellule tumorali maligne esprimono frequentemente glicolipidi di membrana conosciuti complessivamente come antigeni associati al tumore o semplicemente marcatori tumorali. Questi antigeni giocano un ruolo importante nella diagnosi della malignità del tumore attraverso la rilevazione immunitaria con i loro anticorpi specifici.4 Ne è un esempio il Sialyl-Lewis X (12, Figura 12), conosciuto anche come
Sialyl LeX o SLeX, un epitopo che si trova sulla parte terminale dei glicolipidi presenti
sulla superficie dei leucociti, come i neutrofili, e contenente nella sua struttura un tetrasaccaride avente un’unità di LacNAc.9c Questo epitopo funziona come ligando per
che l’adesione di questo epitopo con le selectine giochi un ruolo significativo nella nascita di metastasi nel sangue.4
Figura 12 OH O OH O O O O O NHAc OH O O OH AcHN O H O O H OH OH COOH OH OH H 12
Il Sialyl LewisX svolge una funzione importante anche nei processi infiammatori in
quanto media l’adesione dei leucociti ai siti della lesione attraverso il riconoscimento della E-selectina, una molecola di adesione presente sulle cellule endoteliali dell’ospite.9a
1.3. Metalloproteinasi (MMPs) e matrice extracellulare (ECM)
Il nostro organismo è caratterizzato da quattro differenti tipi di tessuti: epiteliale, connettivo, nervoso e muscolare. Il tessuto connettivo riveste una funzione di primaria importanza in quanto è un elemento di supporto e connessione per gli altri tessuti. La sua funzione è dovuta alla sua natura morfologica che comprende vari tipi di cellule (fibroblasti, macrofagi, mastociti, plasmacellule, leucociti, cellule indifferenziate, cellule adipose o adipociti, condrociti, osteociti ecc.) immersi in un abbondante materiale intercellulare, definito ECM (ExtraCellulare Matrix), sintetizzato dalle stesse cellule connettivali.
1.3.1. La matrice extracellulare (ECM)
La matrice extracellulare rappresenta la componente acellulare dei tessuti connettivi ed è importante per la morfogenesi e il supporto strutturale dei vertebrati. Essa è un complesso stabile ma dinamico di macromolecole altamente idrofile disposte in una sorta di tela tridimensionale di natura spugnosa dove all’interno sono collocate parte delle cellule del nostro organismo (Figura 13). La matrice ECM è costituita da una componente fibrillare (collagene, fibronectina, elastina, laminina) e da una componente
amorfa ovvero una fase acquosa contenente miscele di enzimi, glicosamminoglicani, proteoglicani e glicoproteine, essenziali per la funzione di sostegno a vasi sanguigni, vasi linfatici e fibre nervose. Durante le fasi di crescita e rinnovamento i componenti della ECM sono degradati e sintetizzati tramite un sistema altamente regolato dai fibroblasti interstiziali, responsabili della produzione della matrice, degli enzimi che la degradano e dei fattori che ne modulano il turnover continuo.
Figura 13
In particolare la ECM oltre alla funzione strutturale, è necessaria per conferire agli organi forma e consistenza, protegge le cellule da urti e traumi, esercita una profonda influenza sul comportamento cellulare (adesione, diffusione, migrazione) e consente un flusso incessante di molecole (nutrienti, mediatori chimici, farmaci e sostanze di rifiuto) tra il compartimento ematico e quello cellulare. Molte patologie derivano dalla degradazione del tessuto connettivo il cui turnover e rimodellamento è correlata la degradazione della matrice extracellulare. Questo processo degradativo si attua attraverso la rottura di specifici legami peptidici ad opera di numerose endoproteasi classificate in 5 famiglie: aspartato proteasi, cisteina proteasi, serina proteasi, treonina proteasi e metalloproteasi.10
Le Metalloproteasi si suddividono a loro volta in 4 classi: Astacine, Reprolisine (un’importante sottofamiglia è rappresentata dalle ADAMs: A Disintegrin And
Metalloproteinase Domain), Serralisine e Metalloproteasi della matrice (MMPs). Oggi le MMPs e le ADAMs sono le famiglie di zinco protesi più importanti e più studiate e sono oggetto di numerose ricerche farmaceutiche e diagnostiche.11
Un’eccessiva attività delle MMPs può causare danni tissutali a livello dell’ECM degradandone componenti essenziali come ad esempio il collagene. E’ evidente che un’alterazione dell’equilibrio tra i processi di distruzione e formazione dei componenti della matrice extracellulare risulta coinvolta in numerosi processi patologici come l’invasione di cellule tumorale e la formazione di metastasi, la degradazione tissutale propria dei processi infiammatori di alcuni organi (Figura 14), patologie polmonari, sclerosi multipla e alcune patologie della cute e disordini cardiovascolari come ad esempio l’arterosclerosi, aneurismi e infarto del miocardio.
Figura 14
1.3.2. Metalloproteinasi (MMPs)
Le MetalloProteinasi di Matrice (Matrix Metalloproteinases, MMPs) sono una famiglia multigenica di enzimi proteolitici la cui attività catalitica di tipo endopeptidasico, come indicato dallo stesso nome, è dipendente dalla presenza di specifici ioni metallici come lo ione zinco. Questi enzimi proteolitici sono capaci di degradare la maggior parte, se non tutte, le componenti della ECM e risultano attivi nei processi fisiologici e patologici che coinvolgono il rimodellamento del tessuto. Il rimodellamento della matrice extracellulare è parte integrante della normale crescita e
differenziazione tissutale, così come, nei processi patologici, è coinvolto nella distruzione di tessuto e nella sua abnorme crescita.
L’espressione delle MMPs è regolata a livello trascrizionale da mediatori infiammatori, tra cui le citochine e diversi fattori di crescita: appare quindi evidente uno stretto legame tra infiammazione e MMPs. Ad eccezione delle metalloproteasi di membrana (MT-MMP) che sembrano essere attivate primariamente dall’interazione con la membrana cellulare, esse sono secrete come proenzimi inattivi che necessitano un’attivazione extracellulare per espletare la loro attività proteolitica. Una volta attivate, le MMPs possono essere inibite da un’altra famiglia di proteine, gli inibitori tissutali delle MMPs (TIMPs), anch’essi largamente distribuiti nei tessuti, tra cui l’endometrio umano.12
Ad oggi, nell’uomo sono state identificate almeno 26 MMPs codificate da 23 geni che presentano varie omologie strutturali (Figura 15)13 come un peptide segnale, un
dominio pro-peptidico, un dominio catalitico contenente l’atomo di Zn+2 catalitico
coordinato a tre istidine ed un dominio emopexino-simile collegato al dominio catalitico da una regione a cerniera o peptide linker di variabile lunghezza (hinge region).
Figura 15
Le MMPs sono quindi una famiglia di endopeptidasi zinco-dipendenti altamente regolata, classificate in 6 gruppi sulla base della loro sequenza amminoacidica e dei substrati con i quali interagiscono (Tabella 1, Figura 16). In generale, 17 MMPs vengono secrete nella matrice extracellulare e le restanti 7, chiamate Membrane-Type Metallo Proteinases (MT-MMPs), rimangono ancorate alla membrana plasmatica grazie alla presenza di un dominio trans-membrana e ad un dominio citoplasmatico all’estremità C-terminale.
Tabella 1
Figura 16
In particolare si possono distinguere (Tabella 1 e Figura 16): Collagenasi, Gelatinasi, Stromelisine, Matrilisine, Membrane-Type MMPs.14
1. Le collagenasi: appartengono a questo gruppo 1, 8, 13 e MMP-18, delle quali solo le prime tre sono presenti nell’uomo. Il loro substrato chiave è il collagene fibrillare, ma ognuna di esse presenta una specificità per vari tipi di collagene. La Collagenasi-1 o Collagenasi interstiziale (MMP-1) idrolizza maggiormente il collagene di tipo III, la Collagenasi-2 o Collagenasi neutrofila (MMP-8) ha come substrato preferenziale il collagene di tipo I ed infine la Collagenasi-3 (MMP-13) ha un’elevata affinità per il collagene di tipo II.
2. Le gelatinasi: comprendono la Gelatinasi A (MMP-2) e la Gelatinasi B (MMP-9). Entrambe idrolizzano substrati come il collagene di tipo IV, presente nelle lamine basali, e il collagene di tipo V, VII, e X più altre proteine della matrice extracellulare (ECM) come la gelatina, la fibronectina e l’elastina. La MMP-2 degrada inoltre il collagene di tipo II e III. L’attività di questi enzimi prevede un primo legame del collagene all’enzima a cui segue un tripla attività elicasica che comporta l’esposizione dei legami che verranno successivamente idrolizzati. Questa capacità idrolitica è propria sia delle collagenasi che delle gelatinasi ma la differenza è rappresentata dall’ulteriore capacità delle gelatinasi ad idrolizzare collagene denaturato.
3. Le stromelisine: le tre MMPs di questo gruppo, chiamate anche Proteoglicanasi sono Stromelisina-1 3), Stromelisina-2 10) e Stromelisina-3 (MMP-11). Non hanno attività elicasica ma degradano componenti della matrice come proteoglicani, proteine (come la laminina) e partecipano all’attivazione di altre MMPs. Al contrario delle Stromelisine 1 e 2 che sembrano funzionalmente e strutturalmente correlate, ad oggi esistono poche informazioni sulla Stomelisina 3 che si ritrova espressa nel tumore al seno e presenta un’azione serpinasica (inattiva) verso gli inibitori della serina proteasi. Questa caratteristica fa presupporre che ci possa essere una correlazione tra l’attività enzimatica della serina proteasi e quella delle MMPs.15
4. Le matrilisine come Matrilisina-1 (MMP-7) e Matrilisina-2 (MMP-26) sono caratterizzate dall’assenza del dominio emopexinico nella loro sequenza aminoacidica e presentano un’ampia specificità di substrato andando a degradare fibronectina, laminina, proteoglicani e le regioni non-elicoidali del collagene IV. In particolare la MMP-7 detta anche PUMP-1 è responsabile della processazione di diverse molecole di superficie come, ad esempio la pro-α-defensina e il pro-tumor
necrosis factor α (pro-TNFα). La MMP-26, chiamata anche Endometasi (in quanto espressa nelle cellule dell’endometrio) agisce su substrati come elastina, fibrina e fibrinogeno.
5. Le Membran-Type MMPs (MT-MMPs): sono rappresentate da 6 metalloproteinasi numerate da 1 a 6 di cui quattro sono proteine transmembrana type I (MMP-14, MMP-15, MMP-16 e MMP-24) e due (MMP-17 e MMP-25) sono proteine ancorate a residui glicosil-fosfatidil-inositolo (GPI). Esse oltre a digerire proteine della matrice extracellulare (ECM) come proteoglicani, gelatina e fibronectina, sono coinvolte nell’attivazione di pro-MMPs. Ad esempio la MMP-14 mostra un’attività collagenolitica sul collagene di tipo I, II e III ma è anche responsabile dell’attivazione della MMP-2 per idrolisi del pro-peptide.16 Alcuni studi
inseriscono in questo gruppo anche la MMP-23 o CA-MMP (Cysteine Array MMP) che è stata definita anche type II membrane protein, in quanto ospita il dominio transmembrana nella parte N-terminale del propeptide. Quest’ultima si differenzia dalle altre perché presenta una cisteina libera nel sito catalitico e manca del dominio emopexinico.
6. Altre MMPs: sono inserite in questo gruppo tutte le MMPs che non vengono
classificate nelle precedenti categorie. La MMP-12 (Figura 16) detta anche macrofagi metalloelastasi è espressa prevalentemente negli alveoli polmonari. Questa matrixina è coinvolta nei processi di degradazione dell’elastina nella parete alveolare che può causare patologie come l’enfisema ed è essenziale per la migrazione dei macrofagi dove peraltro è sovraespressa. La MMP-19 chiamata anche RASI (Rheumatoid Arthritis Synovial Infiammation) che, come deducibile dal nome, la ritroviamo a livello plasmatico in pazienti affetti da artrite reumatoide. La MMP-20 detta anche Enamelisina è stata ritrovata nello smalto dei denti e la MMP-21 di cui ad oggi si conosce ancora poco che presenta un’attività gelatinolitica. La MMP-27 espressa in particolare nei linfociti B e la MMP-28 (Epilisina) espressa in vari tessuti come quelli cartilaginei, responsabile di patologie come artrite o osteoartrite.
1.3.3. Struttura molecolare delle MMPs
Le MMPs, come altre proteasi, sono secrete come zimogeni inattivi e accumulate nell’apparato di Golgi e, solo successivamente, sono secrete nella matrice extracellulare (ECM). I membri di questa famiglia condividono numerose analogie riguardo alla loro struttura primaria, e sono costituiti da più domini (Figura 17)13,14 che, partendo
dall’estremità N-ammino terminale, sono: il peptide Segnale, il pro-peptide, il sito catalitico e il dominio emopexinico (hemopexin-like).
Il peptide segnale o pre-peptide, costituito da 17-29 amminoacidi, si trova nell’estremità N-terminale ed è responsabile del posizionamento dell’enzima nel reticolo endoplasmatico. Dopo questa prima fase di ancoraggio il pre-peptide verrà rimosso per dare luogo al corrispondente pro-enzima. Tutte le MMPs sono sintetizzate con il peptide segnale che viene scisso durante il trasporto lungo la via secretoria.
Figura 17
Il pro-peptide rappresenta un dominio altamente conservato in tutte le metalloproteinasi ed è indispensabile per la loro attivazione. Esso è costituito da 80 residui amminoacidici e si trova all’estremità N-terminale e garantisce la forma inattiva
delle MMPs che, essendo un enzima zimogeno, richiede un’attivazione che si realizza per rimozione del pro-peptide. In particolare il pro-peptide contiene un importante residuo cisteinico che, mediante il gruppo tiolico, coordina lo ione di Zn2+ catalitico e,
assieme a tre residui istidinici, impedisce l’accesso al sito catalitico ad altri substrati. L’attivazione di una metalloproteinasi può essere di tipo enzimatica o non enzimatica, può essere mediata da enzimi proteolitici come la plasmina o da altre proteasi e può avvenire anche sulla superficie plasmatica ad opera delle Membran Types. In tutti i casi è necessaria l’idrolisi del pro-peptide attraverso un meccanismo che prende il nome di “cysteine switch mechanism” (Figura 18).17 Quando avviene la rimozione del
pro-peptide viene meno l’interazione Zn-cisteina e il gruppo tiolico è sostituito da una molecola d’acqua che rende lo ione Zn2+ più accessibile ad altri substrati. Ne consegue
che nell’attivazione delle MMPs non sarebbe necessaria la rimozione del pro-peptide ma sarebbe sufficiente inibire l’interazione tra lo ione Zn2+ e il gruppo tiolico.18
Figura 18
Il sito catalitico delle MMPs è costituito da circa 170 amminoacidi organizzati in una sequenza altamente conservata (Figura 19),19 è posizionato dopo il pro-peptide e si
incontra procedendo verso l’estremità C-terminale dell’enzima. La struttura terziaria di questo dominio presenta una forma sferica costituita da 5 foglietti β ripiegati (I, II, III, IV, V), composti da 4 strand paralleli ed 1 antiparallelo, 3 α-eliche (A, B, C) e anse di connessione. Esso presenta una sequenza “HEXGHXXGXXH” altamente conservata che si trova su di un lato dell’α-elica. Nel dominio è presente uno ione Zn2+ (zinco
catalitico) coordinato da 3 istidine (due localizzate nell’α-elica e la terza posizionata in un’ansa vicina) e da una molecola di acqua. Dopo rimozione del pro-peptide il residuo
di acido glutammico (Glu202), che risiede vicino alla prima istidina, risulta fondamentale per la catalisi ovvero per esplicare l’attività proteasica (Figura 10).20
Figura 19
La dicitura “Zinco catalitico” è necessaria per distinguerlo da un altro ione Zn2+
(Zinco strutturale) presente in questo dominio, anch’esso coordinato a tre residui di istidina e a 2 o 3 ioni Ca2+. Ciò che determina la specificità nei confronti del substrato è
la presenza di alcuni sottositi dove il peptide da idrolizzare si inserisce in base a specifiche caratteristiche chimico-fisiche. Questi sottositi sono indicati come S1, S2, S3, Sn, S1', S2', S3', Sn', mentre le porzioni di substrato (peptide) che interagiscono con i
sottodomini sono denominati P1, P2, P3, Pn, P1', P2', P3' e Pn' (Figura 20). Dalla figura
si evince che il sito catalitico appare costituito da una serie di cavità poco profonde, tranne il sottosito S1', localizzato tra la cavità S3' e la cavità S1, in grado di accettare sei
residui amminoacidici.
La tasca S1ꞌ21 costituisce un elemento fortemente discriminante tra le MMPs
perché il legame che si instaura con P1' è fortemente selettivo, essa è quindi definita
“specificity pocket” perché vi si legano solo peptidi o inibitori che ne rispettano le caratteristiche chimiche. In particolare nelle proteasi 2, 9, 8 e MMP-13 il sottodominio S1' costituisce una tasca molto profonda, una sorta di tunnel che attraversa la proteina mentre nelle proteasi MMP-1, MMP-7 e MMP-11 tale tasca è praticamente occlusa rispettivamente da un’arginina, una tirosina e una glutammina.
La regione S2' risulta esposta al solvente e lega preferibilmente porzioni P2'
idrofobiche mentre la regione S3', ancora poco nota nelle MMPs, si trova a margine del
Figura 20
Ad eccezione delle matrilisine, il sito catalitico è collegato ad un dominio che, data l’elevata omologia con l’emopexina viene definito Dominio Emopexinico14 (Figura
21) costituito da circa 200 amminoacidi. Figura 21
Questo dominio è fondamentale perché determina la specificità di diversi substrati ed è necessario nell’attivazione della proMMP-2. Esso è costituito da quattro moduli disposti attorno a un poro contenente solitamente uno ione Ca(II) e uno ione cloruro.18
Tra il sito catalitico ed il dominio emopexinico è presente un peptide linker chiamato (peptide hinge), assente in MMP-23, MMP-7 e MMP-26 (Figura 17). La prima e l’ultima cisteina nel dominio emopexinico tra le varie MMPs sono altamente conservate e formano un legame disolfuro tra il modulo I e IV che stabilizza l’intero sito. Il ponte S-S è assente nelle Gelatinasi nelle quali invece sono presenti tre moduli di fibronectina che formano tra loro sei ponti di solfuro. Questo dominio costituito da 174 residui amminoacidici è presente nei pressi di S3', lega la gelatina e prende il nome di
“Collagen Binding Domain (CBD)”.
Le MMPs di tipo membranario (MT-MMPs, Figura 17) infine sono dotate di un segmento STALK che collega il dominio emopexinico alla membrana plasmatica attraverso un dominio transmembrana o un’ancora a glicosilfosfatidilinositolo (GPI).
1.3.4. Catalisi enzimatica delle MMPs: meccanismo d’azione
Come altri enzimi proteolitici, le MMPs, in una sorta di meccanismo autodifensivo, sono sintetizzate primariamente come zimogeni o proenzimi inattivi (proMMP). La latenza è garantita dal gruppo tiolico di una cisteina a livello dell’estremità C-terminale del pro-peptide che rappresenta il quarto sito di legame per lo zinco presente nel sito attivo del dominio catalitico. Quando il legame tra il gruppo tiolico e lo ione zinco viene rimosso è sostituito da una molecola di acqua con conseguente attivazione degli enzimi verso specifici legami peptidici di proteine target delle MMPs. In particolare l’acqua coordinata all’atomo di Zn2+ nel sito catalitico
svolge un ruolo fondamentale nell’idrolisi dei legami peptidici da parte delle MMPs. Essa, essendo estremamente polarizzata, si posiziona tra il glutammato, che si comporta da base e lo zinco, che si comporta da acido di Lewis e forma il complesso Glu-H2
O-Zn, illustrato in Figura 22che rappresenta l’intermedio fondamentale nell’idrolisi di un legame peptidico all’interno del sito catalitico.20
Figura 22
Il processo idrolitico avviene secondo un meccanismo d’azione concertato, che porta alla formazione di un intermedio tetraedrico gem-diolato coordinato al metallo come la struttura 3 riportata in Figura 23 dove è illustrato il meccanismo proteolitico
della stromelisina-1. La formazione di questo intermedio deriva da una serie di reazioni concertate che prevedono un primo attacco nucleofilo da parte dell’ossigeno della molecola d’acqua sul carbonio del legame peptidico, seguito da estrazione di un protone da parte del glutammato che lo veicola verso l’atomo di azoto del legame ammidico. La rottura finale del legame C-N avviene solo dopo trasferimento di un secondo protone dell’acqua all’azoto ammidico, mediato ancora una volta dal residuo di glutammato, promuovendo un riarrangiamento di elettroni in cui il carbonio della catena peptidica passa da uno stato di transizione sp3 a sp2 nuovamente (Figura 23).
Figura 23
Le diverse funzionalità delle MMPs sono ascrivibili alle loro differenze strutturali e il dominio emopexinico che ne determina la specificità di substrato.
1.3.5. Inibitori sintetici delle MMPs: breve storia
Le informazioni ricavate dall’analisi strutturale dei complessi cristallini enzima-inibitore attraverso cristallografia a raggi X e tecniche di NMR multidimensionale associate alla conoscenza delle strutture 3D e delle interazioni nel sito di binding ha reso possibile un design di inibitori structure-based e ligand-based assistito dal
computer. Attualmente la ricerca si sviluppa verso la progettazione e la sintesi di composti selettivi e specifici verso le varie MMPs.
Il metodo structure-based prevede un’attenta analisi della struttura delle varie MMPs e si avvale di tecniche computazionali e combinatoriali, mentre l’approccio ligand-based ambisce ad aumentare la selettività degli inibitori usando come target la regione altamente variabile S1' del sito catalitico.22 I dati raccolti hanno permesso di
identificare all’interno dello scaffold molecolare porzioni fondamentali che devono essere mantenute affinché una molecola si possa definire un inibitore efficace e selettivo.
I requisiti necessari affinché un composto possa essere definito come inibitore efficace delle MMPs sono:
a. la presenza di uno Zinc-Binding-Group o ZBG ovvero un gruppo funzionale avente almeno un doppietto elettronico in grado di coordinare lo ione Zn2+
catalitico presente nel sito attivo dell’enzima.
b. la presenza di almeno un gruppo funzionale in grado di formare legami a idrogeno con vari residui amminoacidici dell’enzima.
c. la presenza di una o più catene laterali in grado di stabilire interazioni di Van der Waals con i sottositi dell’enzima vicini al sito attivo.
Negli anni sono stati sintetizzati numerosi inibitori che, in base alla loro struttura chimica possono essere suddivisi in tre classi principali:23
1. gli inibitori chelanti lo zinco catalitico sono composti che presentano un gruppo ZBG che rimpiazza la molecola d’acqua chelante lo Zn2+ catalitico. Nel
processo di chelazione dello zinco l’inibitore rimane ancorato al sito attivo impedendo l’accesso al substrato endogeno dell’enzima. Gruppi come acido idrossammico, idrazide, idrossiurea o acido carbossilico sono solo alcuni esempi di ottimali ZBG (Figura 24). Paragonando inibitori che si differenziano solo per il gruppo ZBG emerge che l’attività inibitoria diminuisce nell’ordine idrossammato > fosfinato > amminocarbossilato > carbossilato. Il gruppo idrossammato agisce come un chelante bidentato, con ciascun atomo di ossigeno ad una distanza ottimale (1.9-2.3 Å) dallo zinco catalitico. La posizione dell’azoto suggerisce che sia protonato a causa di un legame a idrogeno con un ossigeno carbonilico dello scheletro dell’enzima.
Figura 24
I composti contenenti un gruppo idrossammato sono quindi gli inibitori più potenti ma la rapida escrezione per via biliare e la suscettibilità all’idrolisi al corrispondente acido carbossilico in vivo possono limitarne la loro utilità come agenti terapeutici.
2. Gli inibitori che non interagiscono con lo zinco catalitico ovvero molecole che non legano lo Zn2+ catalitico a causa dell’assenza nella struttura del gruppo
ZBG. In generale minimizzando l’interazione con lo zinco catalitico aumentando la selettività degli inibitori verso le varie MMPs, in quanto il sito catalitico è una regione altamente conservata. Sono molecole abbastanza lunghe aventi un numero variabile di anelli aromatici o comunque planari (Figura 25) e, disposti lungo la loro struttura, una serie di gruppi funzionali in grado di interagire con vari residui amminoacidici dell’enzima tramite formazione di legami a idrogeno.23
Figura 25 O N O N S O O
3. Gli inibitori Mechanism-Based, sono rappresentati da strutture che si legano covalentemente all’enzima con un meccanismo d’azione dove la molecola si comporta da substrato suicida. Si ottiene una modificazione covalente della struttura dell’enzima che porta ad una inibizione irreversibile. Un gruppo funzionale adeguato presente nella struttura, interagisce, tramite lo zolfo, con lo Zn2+ catalitico consentendo la formazione di un legame covalente con un
residuo amminoacidico dell’enzima. Ne è un esempio il meccanismo d’inibizione proposto per il composto SB-3CT (Figura 26).23
Figura 26
1.3.6. Regolazione delle MMPs
I processi di distruzione e rigenerazione della matrice extracellulare sono in uno stato di continuo equilibrio e un’alterata regolazione dell’attività proteolitica delle MMPs può favorire l’insorgere di una vasta gamma di patologie. L’espressione di MMPs a livello tissutale è promossa da un’induzione o inibizione della trascrizione generate da specifici stimoli come fattori di crescita, ormoni, citochine infiammatorie. L’attività enzimatica delle MMPs è invece controllata o dall’attivazione dello zimogeno mediante scissione del pro-peptide oppure dall’inibizione dell’attività enzimatica mediante inibitori endogeni.
Le proMMPs sono attivate a livello della matrice, ma alcune di esse possono essere attivate anche a livello intracellulare ad opera di particolari idrolasi come le furine. Anche in questo caso è necessaria la distruzione dell’interazione cisteina-Zn e la successiva rimozione del propeptide. La modulazione ad opera di mediatori endogeni avviene generalmente mediante due inibitori: la α2-macroglobulina e gli inibitori tissutali TIMPs (Tissue Inhibitors of Metallo Proteinasis).
L’α2-macroglobulina è una glicoproteina plasmatica costituita da quattro subunità proteiche24 che ha il compito di disattivare varie proteasi intrappolandole al suo interno.
Il complesso α2-macroglobulina-proteasi rappresenta il target di un recettore specifico come LDL receptor-related-protein-1.
Gli inibitori tissutali delle metalloproteasi (TIMPs) sono enzimi polipeptidici endogeni costituiti da un dominio C-terminale di 125 residui amminoacidici ed un dominio N-terminale di minori dimensioni (65 residui amminoacidici).25Essi inibiscono
l’attività delle MMPs formando legami covalenti o con le loro forme attive oppure con il loro rispettivo pro-peptide. Ad oggi sono stati identificati 4 tipi di TIMPs: TIMP-1, TIMP-2, TIMP-3 e TIMP-4.
Strutturalmente questi enzimi endogeni presentano una conformazione a cuneo e si legano al sito attivo dell’enzima che vogliono inibire, occupandolo e impedendo il legame con i substrati con cui normalmente interagisce.14 I TIMPs possono influenzare
tutti i processi MMPs-mediati (Figura 27). Figura 27
Ad esempio il TIMP-2 è in grado di inibire tutte le metalloproteasi ed in particolare MMP-9 e MMP-2. Sebbene la funzione fisiologica più conosciuta per i TIMPs sia la loro capacità di modulare la proteolisi della ECM mediata dalle MMPs, numerosi studi hanno riconosciuto ai TIMPs altre importanti funzioni biologiche non direttamente correlabili all’inibizione delle MMPs. Ad esempio il TIMP-2:
1. inibisce la crescita tumorale e le metastasi in animali ed anche in studi su colture cellulari;
2. ha attività eritroide potenziante e stimola la crescita di numerosi tipi di cellule tra cui cheratinociti e fibroblasti;
3. inibisce la crescita delle cellule endoteliali; 4. ha attività antiapoptotica.
Nella degenerazione fibrotica, un processo che si manifesta quando la normale composizione della ECM viene sostituita da tessuto fibrotico, è stato evidenziato che nelle fasi di recupero della fibrosi epatica si osserva un’elevata attività delle MMPs e una diminuzione dei livelli di TIMPs. Nel tessuto endometriale fibrotico sembra inoltre che la coespressione di TIMPs e MMPs provochi la soppressione dell’attività collagenolitica e l’aumento della fibrosi.26
1.3.7. Patologie dipendenti dall’attività delle MMPs
La matrice extracellulare (ECM)27 non svolge semplicemente funzioni strutturali e
di barriera ma influenza la crescita e la sopravvivenza delle cellule epiteliali visto che la componente amorfa funge da reservoir per diverse molecole biologicamente attive e la membrana basale, una zona dove le cellule non connettivali vengono a contatto con la componente amorfa del connettivo. Le MMPs, modulate dai TIMPs, portano alla degradazione della matrice extracellulare, svolgendo un importante funzione strutturale. L’equilibrio dinamico, regolato dall’attività di MMPs e TIMPs, è di cruciale importanza nei processi fisiologici dell’individuo e ogni sua alterazione può avere conseguenze a livello locale e sistemico causando apoptosi cellulare.
In generale la ECM di un tessuto normale è sottoposta ad un continuo turnover finemente regolato dai fibroblasti interstiziali che producono, oltre alla matrice stessa, gli enzimi responsabili di un suo riassorbimento oltre a molti fattori implicati nel mantenimento dell’equilibrio tra i suoi componenti. Un moderato livello di espressione di alcune MMPs con attività enzimatica strettamente controllata è un processo necessario per il mantenimento di questa condizione fisiologica. Citochine infiammatorie, ormoni, fattori di crescita e interazioni cellula-cellula e cellula-matrice modulano l’espressione di queste molecole attraverso cambiamenti nei livelli trascrizionali. Inoltre, come detto precedentemente, l’attività delle MMPs è regolata da attivatori locali (regolatori endogeni) come la plasmina e da specifici inibitori tessutali, i cosiddetti inibitori tessutali delle MMPs (TIMPs, Tissue Inhibitors MetalloProteinase).
Le MMPs hanno una potente azione degradativa nei confronti di componenti proteici della matrice extracellulare (ECM) e possiedono, inoltre, attività di cleavage verso molecole presenti sulla membrana cellulare e verso altre molecole proteiche
pericellulari.28 L’attività di questi enzimi è fondamentale per lo svolgimento di
numerosi processi coinvolgenti la matrice extracellulare sia fisiologici, come corretto sviluppo embrionale, rimodellamento/turn-over tissutale e riparazione di ferite nella vita adulta e sia patologici, di tipo infiammatorio e degenerativo (ad esempio artrite, artrosi) o nella crescita e nell’invasività delle neoplasie.
Risulta evidente come le MMPs, grazie alla loro attività proteolitica, siano in grado di svolgere diverse attività biologiche conseguenti alla liberazione dalla ECM di molecole o frammenti di esse.
Di marcata importanza è il ruolo delle MMPs nella proliferazione cellulare dipendente dall’azione di fattori di crescita che interagiscono con recettori presenti sulla superficie cellulare.29 Le MMPs esplicano la loro azione intervenendo sulla liberazione
o attivazione di questi fattori che presentano un’affinità per le componenti matricali e la proteolisi di tali componenti porta alla solubilizzazione degli stessi. Anche substrati che non fanno parte della matrice extracellulare come le proteine leganti gli Insuline-like Growth Factor (IGF) sono lisate dalle MMPs con conseguente attivazione dei fattori di crescita IGF. Ad esempio la proteolisi del perlecano ad opera di MMP-1 e MMP-3 porta alla liberazione del Fibroblast Growth Factor (FGF) mentre la lisi della decorina ad opera di MMP-2, MMP-3 e MMP-7 provoca il rilascio del TGF- β. Talvolta le MMPs agiscono direttamente sui fattori di crescita, attivandoli: MMP-2 e MMP-9 convertono in un ligando attivo TGF-β mentre MMP-2, MMP-3 e MMP-9 trasformano il precursore dell’interleuchina 1-β (IL1-β) nella sua forma attiva.29
Le MMPs entrano in gioco anche nella migrazione cellulare, un meccanismo
complesso che richiede la regolazione simultanea sia delle interazioni cellula-cellula sia di quelle cellula-matrice. L’attività proteolitica delle MMPs favorisce siala rimozione dei siti di adesione delle cellule alla matrice o alla membrana basale e sia l’alterazione dei dispositivi giunzionali, portando alla migrazione cellulare. Ad esempio, la proteolisi MMP-2-dipendente della laminina-5 porta indirettamente alla migrazione dei cheratinociti. Come nella proliferazione, anche in questo caso l’azione delle MMPs è duplice ed esse possono agire anche in maniera diretta come ad esempio la MMP-7 che è in grado di scindere la β-integrina e le MMP-3 e MMP-7 che scindono invece l’E-caderina. La migrazione ha spesso inizio come risposta ad uno stimolo chemotattico e, anche in questo senso, le MMPs assumono un importanza chiave, essendo capaci di
generare stimoli chemotattici, come nel caso del rilascio MMP-9 dipendente di
lunghe, o al contrario di sopprimerli come ad esempio MMP-2 che scinde e inattiva la
Monocyte Chemoattractant Protein (MCP-3), diminuendo la chemiotassi e la risposta
infiammatoria.29
Un ulteriore ruolo attribuito alle MMPs è la comunicazione intercellulare: esse consentono il rilascio di fattori che agiscono influenzando il comportamento delle diverse tipologie cellulari. La mediazione delle MMPs nella comunicazione intercellulare è stata dimostrata sia durante la risposta infiammatoria sia nell’interazione con cellule procariote. Per citare un esempio di quest’ultimo caso, l’espressione di MMP-7 a livello delle cellule di Paneth nell’intestino tenue innesca l’attivazione di pro-α-difensine, coinvolte nella risposta immunitaria innata che porta alla distruzione dei batteri.
Le MMPs svolgono un’azione modulante anche sulle patologie tumorali, tramite il controllo della sopravvivenza e proliferazione cellulare. Esse degradando la matrice extracellulare e le membrane basali, portano ad una maggiore invasività della neoplasia e facilitano lo sviluppo di metastasi.29 In numerosi studi è stato evidenziato
che l’inattivazione di una singola MMPs attenua la progressione tumorale negli stadi precoci e comunque prima dello sviluppo delle metastasi. Ne è un esempio l’inattivazione della MMP-2 che porta ad una riduzione della colonizzazione delle cellule carcinomatose polmonari dopo iniezione intravenosa. Nelle forme tumorali è probabilmente l’inibizione di più classi di proteasi a incidere sulla progressione di tumori in stadi avanzati come avviene nel processo di guarigione delle ferite, completamente impedito dall’inibizione combinata di MMPs e plasmina.
1.3.8. Collagenasi-2 o MMP-8
La collagenasi-2 (MMP-8) è un metalloproteasi che appartiene alla classe delle collagenasi sintetizzata specificatamente dai leucociti e presente, in maniera costitutiva, nei granuli dei neutrofili.30 Essa è responsabile della degradazione dei collageni
monomeri di tipo I e II e si ritrova, oltre che nei neutrofili, nei condrociti in presenza di IL-1β, nelle cellule endoteliali e nei fibroblasti sinoviali.
L’idrolisi del legame peptidico del collagene avviene a livello del sito catalitico e necessita della cooperazione del dominio emopexinico delle MMPs.31 L’enzima
MMP-8, chiamato anche “neutrophil collagenase”, è immagazzinato come pro-enzima inattivo all’interno dei granuli intracellulari dei neutrofili (cellule appartenenti al sistema immunitario) e ciò garantisce una rapida disponibilità dell’enzima nei siti