1
INDICE
RIASSUNTO………pag. 2
EPIDEMIOLOGIA………...pag. 5
CLASSIFICAZIONE E DIAGNOSI………pag. 6
PRESENTAZIONE CLINICA E ANATOMOPATOLOGICA………pag. 26
FATTORI PROGNOSTICI………..………..pag. 36
MALATTIA LOCALIZZATA RADICALMENTE OPERABILE……..……….pag. 37
MALATTIA AVANZATA……….……….…..pag. 38
TRATTAMENTO DELLA MALATTIA AVANZATA……….…….….pag. 42
FOLLOW-UP………..…...pag. 62 PREMESSA………....………….…..pag. 63 MATERIALI E METODI……….……….pag. 65 RISULTATI……….………..pag. 68 DISCUSSIONE……….pag. 77 ALLEGATI…….………...pag. 83 BIBLIOGRAFIA………pag. 92
2
RIASSUNTO
Le neoplasie neuroendocrine (NEN) sono un raro ed eterogeneo gruppo di neoplasie che
origina dal sistema neuroendocrino diffuso (APUD). Possono insorgere, quindi, in
qualsiasi distretto corporeo; nei due terzi dei casi nascono nel tratto
gastroenteropancreatico (GEP) mentre il 25% si localizza nel tratto respiratorio. La loro
incidenza è notevolmente aumentata negli ultimi decenni, in particolare è passata da 1 a 5
nuovi casi/100000 abitanti/anno. Inoltre, data la prognosi più favorevole delle GEP NEN
rispetto alle neoplasie non-neuroendocrine del tratto gastroenteropancreatico, la loro
prevalenza è di 35 casi/100000abitanti.
L’identificazione del fenotipo neuroendocrino si basa sull’impiego di specifici marcatori
neuroendocrini. Tra questi, i più attendibili in relazione a sensibilità e specificità sono la
cromogranina A (CgA) e la sinaptofisina, insieme a CD56 (N-CAM), PGP 9.5, NSE
(enolasi neurono specifica) e neurofilamenti.
Uno dei parametri su cui si basa la classificazione delle NEN secondo l’OMS è l’attività
proliferativa del tumore, espressa come grading.
Sulla base della valutazione della conta mitotica e dell’indice di proliferazione con Ki67,
vengono definiti tre gradi di differenziazione delle NEN.
- NET G1: tumore neuroendocrino G1 (<2 mitosi o Ki67 ≤ 2%)
- NET G2: tumore neuroendocrino G2 (2-20 mitosi o Ki67 3-20%)
3
Il principale marker generico, utilizzabile indipendentemente dalla presenza di un’attività
secernente specifica del tumore e dalla eventuale sindrome correlata, è la cromogranina A
(CgA).
Tutti i pazienti con NEN potenzialmente resecabile e senza importanti controindicazioni
alla chirurgia dovrebbero andare incontro a resezione chirurgica della lesione.
Per quanto riguarda la malattia metastatica, le opzioni terapeutiche disponibili per le
neoplasie neuroendocrine di grado G1/G2 sono le seguenti:
- terapia chirurgica (metastasectomia epatica, trapianto di fegato)
- tecniche ablative loco-regionali (ablazione con radiofrequenza, embolizzazione e
chemoembolizzazione, SIRT)
- terapia radiometabolica
- terapia medica (analoghi della somatostatina, IFN-alfa, chemioterapia sistemica)
- terapia a target molecolare
Gli analoghi della somatostatina sono utilizzati nella terapia di prima linea nei pazienti con
neoplasia neuroendocrina in stadio avanzato, in particolare nelle neoplasie funzionanti.
I farmaci a target molecolare everolimus e sunitinib sono stati approvati per il trattamento
della neoplasie neuroendocrine in stadio avanzato G1/G2 di origine pancreatica.
Nei pazienti che progrediscono a una prima linea di trattamento con analoghi della
somatostatina o ad altri regimi non esistono opzione terapeutiche standardizzate, ma sono
utilizzati e ancora in corso di studio diversi regimi chemioterapici.
In uno di questi studi (Bajetta et all) è stato dimostrato che il regime chemioterapico
4
moderato grado di differenziazione. Tale regime appare quindi essere una valida proposta
di trattamento in pazienti pretrattati.
Il presente studio retrospettivo riguarda una valutazione della tollerabilità, dell’attività e
dell’efficacia del trattamento di combinazione di una fluoropirimidina (5-Fluorouracile –
endovenosa- o capecitabina – somministrazione orale) associato ad oxaliplatino
(rispettivamente regime FOLFOX o XELOX) in un gruppo di 20 pazienti con NET in
stadio avanzato di diversa origine, progrediti ad una o più linee di trattamento, seguiti
presso il nostro centro dal 1995 ad oggi.
Abbiamo osservato una risposta parziale in 6 pazienti su 20, 9 pazienti hanno avuto
stabilità di malattia e, infine, 5 pazienti sono andati incontro a progressione. Non è stata
ottenuta alcuna risposta completa.
La PFS mediana è stata di 8,23 mesi (range: 2,03-34,80); l’OS mediana non è stata
raggiunta, in quanto più della metà dei pazienti (13 pazienti su 20 pazienti in studio) risulta
ancora viva.
Il trattamento, inoltre, è risultato ben tollerato.
Possiamo concludere che nella popolazione G1/G2 il trattamento con XELOX-FOLFOX è
attivo ed efficace: nonostante i pazienti fossero stati sottoposti a più linee di trattamento il
regime chemioterapico studiato ha mantenuto la sua attività e capacità di ritardare la
5 EPIDEMIOLOGIA
Le neoplasie neuroendocrine (NEN) sono un raro ed eterogeneo gruppo di neoplasie che
origina dal sistema neuroendocrino diffuso (APUD). Possono insorgere, quindi, in
qualsiasi distretto corporeo; nei due terzi dei casi nascono nel tratto
gastroenteropancreatico (GEP) [1], mentre il 25% si localizza nel tratto respiratorio.
Nonostante le NEN siano considerate neoplasie rare, la loro incidenza è notevolmente
aumentata negli ultimi decenni, come si evince da studi epidemiologici eseguiti sui registri
SEER (il più vasto database epidemiologico degli USA), che riportano un aumento da 1 a 5
nuovi casi/100000 abitanti/anno. Inoltre, data la prognosi più favorevole delle GEP NEN
rispetto alle neoplasie non-neuroendocrine del tratto gastroenteropancreatico, la loro prevalenza è di 35 casi/100000abitanti, seconda solo all’adenocarcinoma del colon-retto e
6 CLASSIFICAZIONE E DIAGNOSI
Inquadramento clinico
Le NEN vengono comunemente distinte in funzionanti e non funzionanti, in relazione alla
presenza o meno di una sindrome clinica correlata alla produzione ed immissione in
circolo di una o più sostanze ormonali da parte delle cellule neoplastiche.
Classificazione in base alla derivazione embriologica
Nel 1963 William e Sandler proposero di classificare le NEN in base alla presunta origine
embriologica delle cellule trasformate, suddividendole in neoplasie del foregut, del midgut
e dell'hindgut. I termini inglesi si riferiscono all'intestino primitivo, come lo si può
osservare nell'embrione e cioè convenzionalmente ripartito in intestino anteriore (foregut),
medio (midgut) e posteriore (hindgut). Dall'intestino anteriore si sviluppano: apparato
respiratorio, timo, tiroide, esofago, stomaco, digiuno, duodeno prossimale, fegato, colecisti
e pancreas (di conseguenza le NEN in queste sedi sono classificate come tumori
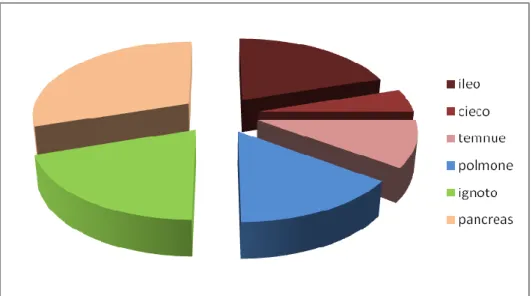
dell'hindgut); dall'intestino medio originano: duodeno distale, ileo, cieco, colon ascendente
e primi due terzi del colon trasverso (pertanto le NEN lì localizzati sono definite tumori del
midgut); dall'intestino posteriore derivano: ultimo terzo del colon trasverso, colon
discendente, sigma, retto, ano ed apparato urogenitale (quindi le NEN insorte in queste sedi
sono note come tumori del foregut).
Questa classificazione, ancora molto utilizzata per la sua semplicità, ha rappresentato il
"primum movens" per distinguere NEN apparentemente simili, ma assai diverse tra loro
7 Diagnostica anatomo-patologica
La conferma diagnostica isto-citopatologica è considerata requisito essenziale per le NEN
e dovrebbe essere effettuata da un gruppo di esperti patologi [2]
Si distinguono cinque pattern fondamentali: insulare, trasecolare (ribbon like),
ghiandolare, indifferenziato e misto. La diagnosi istologica si avvale anche di marcatori di
immunoistochimica (soprattutto cromogranina A e sinaptofisina).
La classificazione OMS del 2010 [3], di seguito riportata, considera tutte le GEP NEN
come potenzialmente maligne e le classifica in base a sede, tipo di differenziazione, grado e stadio di malattia (oltre all’eventuale caratterizzazione della produzione ormonale), [3-8]
[tabella 1]
Tabella 1. Classificazione morfologica e grading (secondo l’OMS) [Bosman 2010]
Diagnosi Grado Mitosi Ki67 Differenziazione
1.Tumore neuroendocrino (NET) 1 <2/10HPF <3% Ben differenziato 2.Tumore neuroendocrino (NET) 2 2-20/10HPF 3-20% Ben/Moderatamente differenziato 3.Carcinoma neuroendocrino (NEC) 3 >20/10HPF >20% Poco differenziato 4.Carcinoma misto adeno-- - - Poco differenziato
8 neuroendocrino (MANEC) 5.Lesioni iperplastiche e pre-neoplastiche - - - -
Le NEN del tratto respiratorio vengono, invece, distinte dall’OMS in carcinoidi tipici (TC,
di basso grado), carcinoidi atipici (AC, di grado intermedio), carcinoma neuroendocrino a
grandi cellule (LCNEC, di alto grado) e carcinoma a piccole cellule (SCLC, di alto grado)
[9] [Tabella 2]. Tale classificazione si basa sui patterns di crescita delle cellule
neoplastiche (crescita organoide versus crescita diffusa), sull’indice mitotico e sulla
presenza di necrosi [10].
Tabella 2. Classificazione delle NEN bronchiali (secondo l’OMS)
Tipo istologico Necrosi Mitosi
Carcinoide tipico assente <2/10HPF
Carcinoide atipico presente localmente 2-9/10HPF
LCNEC presente (estesa) >9/10HPF
9
Caratterizzazione morfologica
Le NEN comprendono forme ben differenziate, che presentano una crescita di tipo “organoide” (a nidi, trabecole oppure solida) con minime atipie, e forme scarsamente
differenziate (chiamate carcinoma neuroendocrino, NEC) con un tipo di crescita a
morfologia diffusa, solida, con estesa necrosi e marcate atipie citologiche. Ulteriori
specificazioni morfologiche derivano dalla successiva definizione del grado (valutazione del numero di mitosi e dell’indice Ki67) e dello stadio TNM (estensione dell’invasione
neoplastica). Una serie di altri parametri che, pur non essendo impiegati per la stadiazione,
possono essere utili nella diagnosi comprende: dimensioni del tumore, multicentricità,
presenza di invasione vascolare, capsulare o perineurale, necrosi, stato dei margini di
resezione chirurgica, distanza del tumore dai margini stessi, presenza di componenti
neoplastiche associate (forme miste di carcinomi neuroendocrini ed adenocarcinoma,
chiamati MANEC) [3]. A questi si aggiunge la ricerca di eventuali lesioni (o precursori)
nel tessuto peritumorale.
In conclusione, il referto anatomo-patologico dovrebbe specificare, oltre alla diagnosi morfologica ed immunoistochimica di NEN, il grado di differenziazione, l’indice di
proliferazione (Ki67, mitosi) e lo stadio TNM.
Immunoprofilo
L’identificazione del fenotipo neuroendocrino si basa sull’impiego di specifici marcatori
neuroendocrini. Tra questi, i più attendibili in relazione a sensibilità e specificità sono la
cromogranina A (CgA) e la sinaptofisina, insieme a CD56 (N-CAM), PGP 9.5, NSE
(enolasi neurono specifica) e neurofilamenti. Le forme tumorali poco differenziate possono
10
esprimere a livello nucleare il fattore di crescita hASH1 (human achete scute homolog-1)
[11].
La definizione del profilo di produzione ormonale (insulina, glucagone, somatostatina,
polipeptide intestinale vasoattivo, gastrina, serotonina, calcitonina) è utile complemento
alla diagnosi (soprattutto per le NEN pancreatiche e duodenali), benché la presenza di
secrezione ormonale non sia sinonimo di sindrome ormono-correlata e non indichi
funzionalità della NEN. Per definire l’origine di una NEN a primitività occulta possono
essere utili fattori trascrizionali come TTF-1 (origine tiroidea o polmonare, specialmente in
forme ad alto grado), CDX-2 (origine intestinale o colo-rettale), Isl-1 (origine pancreatica),
PDX-1 (origine pancreatica o duodenale) [12].
La ricerca immunoistochimica dei recettori della somatostatina (sstr) è, al momento,
considerata opzionale. Ove richiesta, dato il suo valore “predittivo” di risposta alla terapia
con analoghi della somatostatina, è ristretta soprattutto al tipo 2 (sstr-2) ed eventualmente
al 3 e 5, che sono i recettori bersaglio di tali agenti [13]
Grading
Uno dei parametri su cui si basa la classificazione delle NEN secondo l’OMS [3] è l’attività proliferativa del tumore, espressa come grading. Questo viene inteso come
numero di mitosi su 10 campi ad alto ingrandimento (HPF, high power field, con
ingrandimento minimo 40X) o, meglio, come valore di Ki67, parametro immunoistochimico che si ottiene misurando la percentuale di cellule positive all’anticorpo
monoclonale MIB-1 su un minimo di 2000 cellule, valutato nell’area di maggiore
11
Sulla base della valutazione della conta mitotica e dell’indice di proliferazione con Ki67,
vengono definiti tre gradi di differenziazione delle NEN. Il cut-off proposto per distinguere
tumori di grado 1 da quelli di grado 2 è di 2 mitosi/10HPF e 3% di indice Ki67. Una conta
mitotica superiore a 20/10HPF e un indice Ki67 superiore a 20% definisce i tumori di
grado 3 (solitamente NEC) [14-15].
L’unione di questi due principali parametri (aspetto morfologico e indice proliferativo)
consente, quindi, di classificare il tumore in tre principali categorie:
- NET G1: tumore neuroendocrino G1 (<2 mitosi o Ki67 ≤ 2%)
- NET G2: tumore neuroendocrino G2 (2-20 mitosi o Ki67 3-20%)
- NET G3: carcinoma neuroendocrino G3 (> 20 mitosi o Ki67 > 20%)
Staging
La stadiazione delle NEN sottoposte a intervento chirurgico radicale segue lo schema del
sistema TNM pubblicato dalla UICC/AJCC (7a edizione) per le singole sedi [16-18]. L’ENETS (European Neuroendocrine Tumor Society) ha pubblicato un sistema di
stadiazione per le NEN delle diverse sedi che è in parte simile a quello dell’UICC, mentre
si discosta da questo per le localizzazioni appendicolari e pancreatiche. In queste ultime due sedi, vista l’attuale assenza di evidenze cliniche definitive che supportino uno dei due
sistemi di stadiazione come maggiormente informativo in termini prognostici, è
12
deriva lo stadio riportato nel referto [19, 20]. Inoltre, nelle NEN del tratto intestinale è
raccomandato comunque indicare la profondità di invasione della parete intestinale. [12]
La valutazione accurata dello stadio è importante per le implicazioni terapeutiche.
Di seguito sono riportate le classificazioni secondo il sistema TNM della UICC/AJCC e
della ENETS per le singole sedi (tabelle 3, 4, 5, 6.1, 6.2, 7, 8, 9)
Tabella 3. Classificazione TNM per le NEN gastriche (ENETS e AJCC)
T Tumore primitivo
T0 Nessuna evidenza di tumore primitivo
Tis Tumore in situ/displasia (<0.5 cm)
T1 Il tumore invade la lamina propria o la sottomucosa ed è ≤1 cm T2 Il tumore invade la muscolare propria o la sottosierosa o è >1
cm
T3 Il tumore penetra la sierosa
T4 Il tumore invade le strutture adiacenti
N Linfonodi regionali
N0 Assenza di interessamento dei linfonodi regionali N1 Presenza di metastasi ai linfonodi regionali
M Metastasi a distanza
M0 Assenza di metastasi a distanza
13
Tabella 4. Classificazione TNM per le NEN di duodeno/ampolla/digiuno prossimale
(ENETS e AJCC)
T Tumore primitivo
T0 Nessuna evidenza di tumore primitivo
T1 Il tumore invade la lamina propria o la sottomucosa ed è ≤1 cm T2 Il tumore invade la muscolare propria o è >1cm
T3 Il tumore invade il pancreas o il retroperitoneo T4 Il tumore invade il peritoneo o altri organi
N Linfonodi regionali
N0 Assenza di interessamento dei linfonodi regionali N1 Presenza di metastasi ai linfonodi regionali
M Metastasi a distanza
M0 Assenza di metastasi a distanza
M1 Presenza di metastasi a distanza
Tabella 5. Classificazione TNM delle NEN di digiuno distale e ileo (ENETS e AJCC)
T Tumore primitivo
T0 Nessuna evidenza di tumore primitivo
T1 Il tumore invade la mucosa o la sottomucosa ed è ≤1 cm T2 Il tumore invade la muscolare propria o è >1cm
T3 Il tumore invade la sottosierosa
T4 Il tumore invade il peritoneo o altri organi
N Linfonodi regionali
N0 Assenza di interessamento dei linfonodi regionali N1 Presenza di metastasi ai linfonodi regionali
14 M Metastasi a distanza
M0 Assenza di metastasi a distanza
M1 Presenza di metastasi a distanza
Tabella 6.1. Classificazione TNM delle NEN del pancreas (ENETS)
T Tumore primitivo
T0 Nessuna evidenza di tumore primitivo
T1 Il tumore è limitato al pancreas e di diametro ≤ 2 cm T2 Il tumore è limitato al pancreas e di diametro tra 2 e 4 cm T3 Il tumore è limitato al pancreas e di diametro > 4 cm o invade il
duodeno o il coledoco
T4 Il tumore invade gli organi adiacenti (stomaco, milza, colon, surrene) o la parete dei grossi vasi (tronco celiaco o arteria mesenterica superiore)
N Linfonodi regionali
N0 Assenza di interessamento dei linfonodi regionali N1 Presenza di metastasi ai linfonodi regionali
M Metastasi a distanza
M0 Assenza di metastasi a distanza
15
Tabella 6.2. Classificazione TNM delle NEN del pancreas (AJCC)
T Tumore primitivo
T0 Nessuna evidenza di tumore primitivo
T1 Il tumore è limitato al pancreas e di diametro ≤ 2 cm T2 Il tumore è limitato al pancreas e di diametro >2 cm
T3 Il tumore invade i tessuti peripancreatici ma non coinvolge i grossi vasi (tronco celiaco o arteria mesenterica superiore) T4 Il tumore coinvolge i grossi vasi (tronco celiaco o arteria
mesenterica superiore)
N Linfonodi regionali
N0 Assenza di interessamento dei linfonodi regionali N1 Presenza di metastasi ai linfonodi regionali
M Metastasi a distanza
M0 Assenza di metastasi a distanza
M1 Presenza di metastasi a distanza
Tabella 7. Classificazione TNM delle NEN dell’appendice (ENETS e AJCC)
T Tumore primitivo
(ENETS)
Tumore primitivo (WHO/AJCC)
T0 Assenza di evidenza del tumore primitivo
T1 Tumore ≤ 1; invasione della
muscolare propria
T1a: tumore ≤1cm
T1b: tumore tra 1 e 2 cm
T2 Tumore ≤ 2 cm e invasione
della sottosierosa o del mesenteriolo < 3mm
Tumore tra 2 e 4 cm o con invasione del cieco
T3 Tumore > 2 cm o invasione
della sottosierosa o del mesenteriolo > 3mm
Tumore > 4 cm o con invasione dell’ileo
16
altri organi altri organi
N Linfonodi regionali
N0 Assenza di interessamento dei linfonodi regionali N1 Presenza di metastasi ai linfonodi regionali M Metastasi a distanza
M0 Assenza di metastasi a distanza
M1 Presenza di metastasi a distanza
Tabella 8. Classificazione TNM per le NEN di colon e retto (ENETS e AJCC)
T Tumore primitivo
T0 Nessuna evidenza di tumore primitivo
T1 Il tumore invade la mucosa o la sottomucosa ed è ≤ 2 cm T2 Il tumore invade la muscolare propria o è >2 cm
T3 Il tumore invade la sottosierosa e il grasso pericolico/perirettale T4 Il tumore invade direttamente altri organi e/o perfora il
peritoneo viscerale
N Linfonodi regionali
N0 Assenza di interessamento dei linfonodi regionali N1 Presenza di metastasi ai linfonodi regionali
M Metastasi a distanza
M0 Assenza di metastasi a distanza
17
Tabella 9. Classificazione TNM delle NEN polmonari (AJCC)
T Tumore primitivo
T0 Nessuna evidenza di tumore primitivo
T1 Tumore con diametro maggiore ≤ 3 cm, circoscritto dal polmone o dalla pleura viscerale, senza evidenza broncoscopica di invasione prossimale rispetto al bronco lobare
T2 Tumore ≥3 cm ma ≤ 7 cm o tumore con una delle seguenti caratteristiche: interessamento di un bronco principale a più di 2 cm dalla carena; invasione della pleura viscerale; presenza di atelettasia o polmonite che si estende alla regione ilare ma non interessa l’intero polmone
T3 Tumore ≥ 7 cm o che si estende direttamente ad una delle seguenti strutture: pleura parietale, diaframma, nervo frenico, pericardio parietale, bronco principale a meno di 2 cm dalla carena; o associato ad atelettasia o polmonite dell’intero polmone
T4 Tumore di qualsiasi dimensione che invade una delle strutture seguenti: mediastino, cuore, grossi vasi, trachea, nervo ricorrente, esofago, corpo vertebrale, carena
N Linfonodi regionali
N0 Assenza di interessamento dei linfonodi regionali
N1 Presenza di metastasi ai linfonodi peribronchiali e/o ilari omolaterali e linfonodi intrapolmonari
N2 Presenza di metastasi ai linfonodi mediastinici controlaterali, ilari contro laterali, scaleni omo- o controlaterali, o ai sovraclaveari
M Metastasi a distanza
M0 Assenza di metastasi a distanza
18 Profilo genetico
Più del 90% delle NEN è ad insorgenza sporadica; la restante percentuale (~10%) è
associata a sindromi familiari, tra cui la Neoplasia Endocrina Multipla di tipo 1 (MEN1), la
malattia di von Hippel-Lindau, la sclerosi tuberosa e la neurofibromatosi di tipo 1 [21]. Nel
sospetto di tali sindromi è opportuno il ricorso a test genetici appropriati per l’identificazione della mutazione genetica responsabile della malattia.
Il quadro morfologico delle singole NEN in pazienti affetti da sindromi familiari non
differisce da quello delle corrispondenti NEN nel contesto sporadico, se non per la
frequente multicentricità. Ciascuna di queste malattie genetiche, inoltre, si manifesta con l’insorgenza di caratteristiche patologie di natura neoplastica e non, tra cui una NEN con
percentuali di prevalenza specifiche per ogni sindrome.
In relazione alle NEN, la sindrome più importante è la MEN 1, dato che il 40-65% in
media dei pazienti affetti da questo disordine autosomico dominante sviluppa una NEN
pancreatica. Tale sindrome è causate dall’inattivazione germinale del gene
oncosoppressore MEN1 (localizzato sul cromosoma 11q13) e dalla successiva mutazione dell’allele wild-type. I pazienti affetti si caratterizzano per lo sviluppo di iperplasia/tumori
in molteplici tessuti endocrini (paratiroidi > pancreas > ipofisi > adrenocorticale) [22].
Un’altra sindrome a carattere autosomico dominante è la Sclerosi Tuberosa, caratterizzata
da amartomi, astrocitomi ed altri tumori ben differenziati di encefalo, cuore, cute, rene,
polmone e pancreas ( una NEN è presente in meno del 5% dei casi). Tale malattia è causata
dalla mutazione di TSC1 (gene che codifica per l’amartina, sul cromosoma 9q34) o di
TSC2 (gene che codifica per la tuberina, sul cromosoma 16p13.3). Il complesso amartina -
tuberina agisce normalmente come oncosoppressore, regolando negativamente il segnale di
19
del pathway con aumento della sopravvivenza, del metabolismo e della proliferazione cellulari e dell’angiogenesi [23].
Diagnostica di laboratorio
Recentemente è stato notevolmente ridimensionato, rispetto al passato, il concetto di
diagnosi biochimica di queste malattie, in relazione al numero consistente di falsi positivi
di alcuni dei markers tumorali più diffusi [24].
Le condizioni in cui la diagnostica di laboratorio conserva un ruolo clinicamente rilevante
sono le seguenti:
- Sospetto di “sindrome da carcinoide”. In questo caso, per un migliore
inquadramento della sindrome, può essere effettuato il dosaggio nelle urine delle 24 ore dell’acido 5-idrossi-indolacetico (5-HIAA), la cui accuratezza è elevata quando si rileva un
valore di almeno il doppio rispetto al valore massimo normale [25]. Il test, se rispettate
determinate accortezze dietetiche prima della raccolta del campione, ha una sensibilità di
circa il 70% e una specificità fino al 100%.
- Diagnosi di sindrome di Zollinger-Ellison (ZES) associata al gastrinoma. La
gastrinemia basale maggiore di 10 volte rispetto al valore massimo normale si osserva nel
40% circa dei pazienti [25], e tale riscontro è altamente indicativo per diagnosi di ZES. Per
una maggiore accuratezza diagnostica si può eseguire il test alla secretina: un incremento
della gastrinemia di almeno 120 pg/ml dopo stimolo sottocutaneo con secretina è
indicativo di ZES (sensibilità 94%, specificità 100%).
- Diagnosi di insulinoma. La combinazione di elevati livelli di insulinemia associati a
20
sindrome da insulinoma, soprattutto se la misurazione di tali parametri è effettuata dopo un
periodo di digiuno di 72 ore (test del digiuno).
- Diagnosi di glucagonoma. In questo caso sono raccomandati la valutazione della
glicemia ed il dosaggio del glucagone, che deve essere inappropriatamente elevato (>
500-1000 pg/ml).
Il principale marker generico, utilizzabile indipendentemente dalla presenza di un’attività
secernente specifica del tumore e dalla eventuale sindrome correlata, è la cromogranina A
(CgA). Si tratta di una glicoproteina presente nei granuli citoplasmatici di tutte le cellule
neuroendocrine diffuse nell’organismo.
La sensibilità del dosaggio plasmatico della CgA oscilla tra il 70% e il 90% [25], la
specificità varia notevolmente e risente di numerosi possibili falsi positivi, tra cui la
gastrite cronica atrofica del corpo-fondo gastrico, l’infezione da Helicobacter pylori, l’utilizzo di inibitori di pompa protonica, le malattie infiammatorie croniche, l’ipertensione
arteriosa non controllata. A causa di ciò, il suo uso è limitato ai pazienti con una diagnosi
documentata di NEN per monitorare l’andamento della malattia durante il follow up e la
risposta ad una eventuale terapia medica [26-30].
Diagnostica endoscopica
L’endoscopia del tratto digestivo superiore e di quello inferiore ha un ruolo nelle GEP
21
Le NEN gastriche e quelle rettali rappresentano le forme più comuni di GEP NEN, mentre
quelle duodenali sono piuttosto rare [32]. Queste ultime sono generalmente localizzate
nello strato sottomucoso, per cui la diagnosi endoscopica può risultare difficoltosa e si può avvalere dell’ausilio della eco endoscopia (EUS) [33].
L’EUS va oggi considerata la tecnica di scelta per la definizione diagnostica delle NEN
pancreatiche [34?]. Il valore aggiunto che questa tecnica offre è legato, oltre che all’effettuazione dello staging loco regionale, alla possibilità di ottenere un campione
bioptico, necessario ai fini diagnostici e prognostici. Va sottolineato che, al pari di altre tecniche di diagnostica strumentale, anche l’EUS deve essere considerata una tecnica
operatore-dipendente.
Il piccolo intestino, considerato fino a pochi anni fa di difficile accesso per l’endoscopia,
può essere studiato virtualmente grazie alla recente introduzione delle tecniche della
enteroscopia con doppio pallone (DBE) e della video capsula endoscopica (VCE). Queste
tecniche risultano di particolare utilità clinica nella ricerca del tumore primitivo nei casi di
NEN metastatica con primitivo occulto [35, 36].
La broncoscopia, associata se necessario ad ecoendoscopia con eventuali biopsie, è la migliore metodica per l’identificazione delle NEN polmonari a partenza dai grandi bronchi
22 Diagnostica strumentale radiologica
L’imaging morfologico ha un ruolo importante nella diagnostica e nella stadiazione delle
NEN e dovrebbe essere stabilito in base al quadro clinico [37, 38], adattando la scelta del
tipo di esame al singolo paziente e al quesito diagnostico [31].
Lo strumento diagnostico principale da utilizzare per l’ identificazione e la stadiazione
delle NEN è la TC multistrato (TCMS) del torace e dell’addome completo, integrato,
laddove non conclusivo o controindicato, con l’imaging della Risonanza Magnetica.
Secondo le linee guida AIOM del 2013, quest’ ultimo esame è da considerarsi di prima
scelta per lo studio delle metastasi ossee e del sistema nervoso centrale.
Nel sospetto di NEN del piccolo intestino l’entero-TC o l’entero-RM, previa distensione
delle anse intestinali, rappresentano l’esame di scelta per l’individuazione e per la
caratterizzazione della lesione.
Diagnostica nucleare
Le tecniche funzionali di medicina nucleare sfruttano l’espressione dei recettori della
somatostatina, in particolare il sottotipo 2 (sstr-2), da parte delle cellule tumorali
neuroendocrine o la capacità di utilizzare precursori amminici legati al metabolismo delle
cellule tumorali neuroendocrine.
Tali tecniche sono essenzialmente la scintigrafia con 111In-pentetreotide o OctreoScan® (SRS, somatostatin receptor scintigraphy) e le più innovative metodiche PET (positron
emission tomography), quali la PET con analoghi della somatostatina marcati con 68Ga, la PET con 18F-DOPA e la PET con 11C-5-HTP [38].
23
È necessario precisare che l’imaging, sia morfologico che funzionale, non dà informazioni
sul grado di differenziazione o sulla secrezione ormonale specifica del tumore.
Gli obiettivi specifici dell’imaging funzionale nelle NEN sono la localizzazione del
tumore primitivo, la stadiazione e la caratterizzazione delle lesioni tumorali in termini di
espressione di sstr, di metabolismo delle neuro amine e di consumo di glucosio, nonché la
ristadiazione della malattia durante e dopo i trattamenti. Inoltre esso costituisce un fattore
predittivo di risposta per gli analoghi radiomarcati della somatostatina (PRRT) [2].
Scintigrafia recettoriale con 111In-pentetreotide (OctreoScan®)
Il razionale della SRS consiste nell’internalizzazione recettore-mediata del complesso
recettore - radioanalogo e la sua ritenzione nel citoplasma. 111In-pentetreotide rappresenta il primo radio farmaco approvato per l’imaging della NEN ed è quello comunemente usato.
Una volta somministrato il radio farmaco, vengono acquisite le immagini, che devono
comprende immagini SPECT (single photon emission computed tomography) a 4 e 24 ore dall’iniezione, al fine di avere una sensibilità diagnostica idonea [39, 40]. Il farmaco si
distribuisce fisiologicamente in milza, fegato e reni e, in misura variabile, ipofisi, tiroide,
vescica e intestino. In generale, vengono considerate positive le aree che mostrano una
captazione superiore a quella del fegato. La sensibilità della SRS nelle GEP NEN varia dal
75 al 100% [41, 42]. I falsi negativi possono essere dovuti a una tecnica d’esame non
appropriata, alla presenza di lesioni di diametro inferiore a 1 cm, alla mancata
sovra-espressione recettoriale o, seppure sia argomento controverso, alla possibile inibizione competitiva della captazione tumorale da parte dell’analogo della somatostatina
somministrato a scopo terapeutico per via parenterale. Per quanto riguarda la specificità,
24
radioterapia o la presenza di focolaio infiammatorio in atto) o un accumulo fisiologico del
radiofarmaco nella colecisti.
PET con 68Ga-peptidi
All’inizio del 2000 è stata introdotta la PET con analoghi della somatostatina, i
DOTA-peptidi, marcati con l’emettitore di positroni Gallio-68. I tre analoghi più comunemente
usati sono DOTA-Tyr3-octreotide (DOTA-TOC), DOTA-Tyr3-octreotate (DOTA-TATE) e DOTA-Nal3-octreotide (DOTA-NOC). Questi analoghi mantengono un profilo di affinità
octreotide-simile e, in particolare, un’elevata affinità per sstr-2. La PET/TC con 68 Ga-DOTA-peptidi offre diversi vantaggi rispetto alla tecnica scintigrafica convenzionale,
soprattutto la maggior risoluzione spaziale, che consente una migliore qualità delle
immagini con il rilevamento di lesioni inferiori a 1 cm. Inoltre la rapidità dell’esame (si
effettua in un solo giorno) e la possibilità di una quantificazione standardizzata delle aree
di captazione mediante il parametro SUV (standardized uptake value), offrono ulteriori
vantaggi [43, 44]. Per questi motivi, tale esame è sempre più utilizzato nei centri
specializzati. Come per la scintigrafia convenzionale, le aree che mostrano un accumulo
del radio peptide superiore a quello del fegato sano sono considerate positive, quindi
indicanti la presenza di una lesione tumorale neuroendocrina. È stato dimostrato in un
gruppo di 84 pazienti, 62 dei quali con GEP NEN, che la PET recettoriale ha una maggiore
sensibilità (97%) rispetto alla TC (61%) e alla scintigrafia convenzionale con 111 In-pentetreotide (52%) per la rilevazione di piccole lesioni linfonodali o scheletriche, o lesioni
in sedi insolite, come mammella, utero e prostata . Sebbene non tutti gli studi in letteratura
abbiano rigorosamente confrontato la PET recettoriale con un protocollo scintigrafico
tecnicamente adeguato, è verosimile che la PET con 68Ga-DOTA-peptidi rimpiazzerà completamente la scintigrafia convenzionale in futuro.
25 PET con 18FDG
La sensibilità della PET con 18FDG per le NEN è generalmente bassa (58% in un recente studio prospettico su 96 pazienti). D’altro canto, nelle NEN bronchiali più aggressive
(LCNEC e SCLC) la PET con 18FDG dà spesso maggiori informazioni rispetto alla scintigrafia dei recettori della somatostatina.
26
PRESENTAZIONE CLINICA E ANATOMOPATOLOGICA
Pancreas
Le NEN pancreatiche (pNEN, ~30% di tutte le GEP NEN) possono essere funzionanti o
non funzionanti. La grande maggioranza (>70-80%) delle pNEN è di tipo non funzionante,
ovvero non associata ad una sindrome specifica causata dalla produzione di sostanze da
parte del tumore. La restante percentuale è associata ad una sindrome funzionale specifica
[49] legata all’eccessiva secrezione di ormoni e/o monoamine da parte delle cellule
tumorali (per es. gastrinasindrome di Zollinger-Ellison o serotoninasindrome
27
Tabella 10. Classificazione delle pNEN in base all’attività ormonale
pNEN funzionanti Nome della sindrome Ormone prodotto in eccesso Sintomatologia Gastrinoma Sindrome di Zollinger-Ellison
Gastrina Dolore (da
ulcera peptica),
sintomi esofagei
Insulinoma Insulinoma Insulina Ipoglicemia
VIPoma Verner-Morrison, colera pancreatico Peptide intestinale vasoattivo Diarrea acquosa, ipokaliemia-acloridria
Glucagonoma Glucagonoma Glucagone Dermatite specifica,
perdita di peso,
DM
Somatostatinoma Somatostatinoma Somatostatina Rara(DM, calcolosi colecistica…)
GRFoma GRFoma GRF Acromegalia
ACTHoma ACTHoma ACTH Sindrome di
28 pNE con sindrome carcinoide pNE con sindrome carcinoide Serotonina Flushing, diarrea, fibrosi endocardica pNE con ipercalcemia PTHrPoma PTHrP Sindrome da ipercalcemia
pNEN non funzionanti
La presentazione clinica delle pNEN non funzionanti è solitamente caratterizzata da sintomi/segni generici legati al cosiddetto “effetto massa”: dolore, perdita di peso,
anoressia, nausea, emorragia addominale, ittero, presenza di una massa palpabile. A causa
della specificità della sintomatologia, la diagnosi, in questi casi, è spesso tardiva e, nella
maggior parte dei pazienti (50-70%), sono già presenti metastasi a distanza all’esordio
della malattia [47, 48]. Nonostante queste neoplasie non causino alcuna sintomatologia
clinica, esse possono comunque secernere peptidi come il polipeptide pancreatico
(25-70%), la cromogranina A (60-100%), enolasi neurono-specifica (31%), ghrelina,
neurotensina e subunità di β-HCG.
pNEN funzionanti
Le forme più frequenti di pNEN funzionante sono l’insulinoma ed il gastrinoma.
- insulinoma
La maggior parte dei pazienti (90%) si presenta con sintomi da neuroglicopenia
29
da iperstimolazione del simpatico nel 60-70% dei casi (tremore, sudorazione, palpitazioni,
astenia, iperfagia). Tipicamente questi sintomi si presentano durante periodi di digiuno o
dopo esercizio fisico. Si dovrebbe sempre porre il sospetto di insulinoma in presenza della
cosiddetta triade di Whipple, che consiste in: 1. sintomi di ipoglicemia, 2. ipoglicemia
(glicemia < 40mg/dl), 3. remissione dei sintomi dopo somministrazione di glucosio [49,
50].
- gastrinoma ( sindrome di Zollinger-Ellison)
Quasi tutti i pazienti con sindrome di Zollinger-Ellison (ZES) si presentano all’esordio con sintomi correlati all’ipersecrezione di acido gastrico, dovuta al rilascio ectopico di gastrina
da parte delle cellule neoplastiche [51-53]. Solo in seguito, nel corso della malattia, una
piccola percentuale di pazienti presenta sintomi e segni legati alla presenza diretta del
tumore (dolore, ittero, sanguinamento, ecc.). I sintomi principali restano quelli dovuti alla
malattia ulcerativa peptica o a una severa malattia da reflusso gastroesofageo (dolore
addominale, nausea, gastralgia, vomito) con o senza diarrea [51, 53, 54]. Rispetto al
passato, oggi solo una piccola percentuale di pazienti (circa il 33%) presenta una
complicanza da ulcera peptica (sanguinamento, ostruzione, perforazione).
La diagnosi di ZES dovrebbe essere sospettata in ogni paziente con malattia ulcerativa
peptica/malattia da reflusso gastroesofageo accompagnata da diarrea, storia personale o
familiare di endocrinopatie, reperti di laboratorio caratteristici (ipercalcemia,
ipergastrinemia); in caso di malattia peptica/GERD insolitamente severa, refrattaria al trattamento o ricorrente; in caso di sede inusuale dell’ulcera peptica o di complicanze
(sanguinamento, ostruzione, perforazione).
30
I VIPomi si presentano caratteristicamente con diarrea acquosa di volume consistente (di
solito >3 L/die; un volume delle feci <700ml/die in genere esclude la presenza di un
VIPoma), di natura secretoria, che può portare allo sviluppo di disidratazione e
ipokaliemia, anche severe. Inoltre la sintomatologia è accompagnata da incremento dei livelli di VIP plasmatici (di solito >500 pg/ml). L’eccessiva secrezione di VIP può portare
all’insorgenza di iperglicemia (20-50%), ipercalcemia (25-50%), ipocloridria (20-50%) a
flushing (15-30%) [55, 56]
- glucagonoma
I glucagonomi si presentano tipicamente con una dermatite specifica (eritema necrolitico
migrante) (55-90%), perdita di peso (60-90%), diabete mellito o intolleranza al glucosio
(30-90%), mucositi (glossite, cheilite, stomatite) (30-40%), diarrea (10-15%) e, alle
indagini di laboratorio, anemia (30-80%) e ipoaminoacidemia (30-100%). Di solito i
tumori si presentano di grandi dimensioni (>5 cm) alla diagnosi e il 50-80% dei pazienti ha
malattia avanzata con metastasi epatiche [55, 57].
Stomaco
Le NEN dello stomaco rappresentano più del 23% di tutte le NEN del tratto digerente [58,
59].
Classificazione
Le NEN gastriche originano dalle cellule enterocromaffini-like (ECL) dello stomaco e
sono classificate come neoplasie a cellule ECL gastrina-dipendente (tipo I/II) o gastrina
31
istopatologicamente viene diagnosticata come NEN, il primo passo necessario è stabilire se
ci sia una ipergastrinemia associata, e se questa sia secondaria ad una gastrite cronica
atrofica, con relativa acloridria (pH gastrico elevato), o invece ad una ZES con relativa ipercloridria (pH gastrico acido). L’assenza di atrofia e di ipergastrinemia suggerisce la
diagnosi di “tipo III”.
- NEN gastriche di tipo I (associate a gastrite cronica atrofica ed ipergastrinemia).
Rappresentano la forma più frequente di NEN gastrica (70-80%) [59] Si associano a
gastrite cronica atrofica (GCA) del corpo-fondo. Si tratta in genere di lesioni multiple, di
piccole dimensioni (<1 cm), polipoidi, del corpo-fondo gastrico; sono in genere limitate
alla mucosa e sottomucosa, senza angioinvasione e con basso Ki67. Le lesioni sono
asintomatiche e in genere riscontrate in corso di gastroscopia eseguita per anemia o
dispepsia legata alla GCA.
La crescita delle lesioni è secondaria all’effetto trofico della gastrina, il cui incremento è
secondario alla ipo/acloridria prodotta dalla atrofia della mucosa acido secernente, sulle
cellule ECL nel corpo.fondo gastrico [60].
- NEN gastriche di tipo II (associate a ZES in MEN1)
Rappresentano il 5% circa delle NEN gastriche. Come quelle di tipo I, originano dalle
cellule ECL e sono lesioni legate alla ipersecrezione di gastrina da gastrinoma (con ZES)
come parte del quadro clinico di una MEN1 [60, 61].
Si presentano come lesioni multiple polipoidi, di dimensioni di 1-2 cm. La maggior parte
di esse ha un decorso indolente, ma interessano i linfonodi regionali più spesso rispetto alle
32
62]. Sono neoplasie asintomatiche riscontrate in corso di controlli endoscopici in malati
con ZES e MEN-1.
- NEN gastriche di tipo III (o sporadiche)
Rappresentano il 15-20% delle NEN gastriche. Si sviluppano generalmente a livello dell’antro gastrico come lesioni singole, di dimensioni variabili tra 2 e 5 cm. Sono lesioni
sporadiche, assimilabili ad un adenocarcinoma dello stomaco, senza quindi un ruolo dello
stimolo della ipergastrinemia, e presentano generalmente un comportamento aggressivo,
associato a metastasi a distanza nel 50-100% dei casi, e con una mortalità del 25%.
La neoplasia viene diagnosticata per anemia legata a sanguinamento, calo ponderale o
dispepsia, mentre la presenza di una sindrome da ipersecrezione di amine è una evenienza eccezionale. In rari casi è stata descritta una sindrome da carcinoide “atipica” legata a
produzione di istamina [63].
Intestino Tenue
Le NEN digiuno-ileali rappresentano il 30-50% di tutte le neoplasie del piccolo intestino.
Queste neoplasie frequentemente vengono scoperte durante la ricerca del tumore primitivo
in pazienti asintomatici ma metastatici, o incidentalmente, per esempio durante una
colonscopia di screening.
Il più frequente sintomo d’esordio nei pazienti con NEN dell’intestino tenue è il dolore
addominale [64-69], spesso interpretato precedentemente come manifestazione di una
sindrome del colon irritabile. Questo dolore addominale aspecifico può essere dovuto a
33
mesenterica intermittente a causa della fibrosi, diarrea secretoria e proliferazione batterica.
Altri sintomi aspecifici come perdita di peso, fatigue e (raramente) febbre di origine
sconosciuta possono essere presenti. I sintomi dovuti alla presenza della massa tumorale
che causa ostruzione intestinale con nausea e vomito, ittero in caso di colestasi e
sanguinamento intestinale, si verificano in una bassa percentuale di pazienti [64-69]. La
reazione desmoplastica che porta a fibrosi viscerale può culminare in ischemia del piccolo
intestino o idronefrosi in caso di fibrosi retroperitoneale, ma si tratta di situazioni rare.
Sintomi specifici, relativi all’ipersecrezione ormonale che porta a sindrome carcinoide
comprendono diarrea secretoria (60-80%), flushing (60-85%) e sibili bronchiali
intermittenti (<10%); a questi si aggiunge la ben più importante fibrosi del cuore destro
con sindrome carcinoide cardiaca (CHD o sindrome di Herdinger; >20% dei casi) [65, 67,
68], che può portare ad insufficienza cardiaca destra con peggioramento della prognosi.
Colon-Retto
Bisogna distinguere le NEN a partenza dal colon da quelle a partenza dal retto, poiché
queste due categorie hanno una storia naturale differente.
Colon
Le NEN del colon rappresentano il 4-7% di tutte la NEN secondo i database europei [32,
70,71]. Circa il 30-40% di queste neoplasie presenta metastasi già alla diagnosi iniziale,
probabilmente a causa della presentazione clinica tardiva che porta ad un ritardo nella
diagnosi. Questo condiziona la prognosi sfavorevole di queste neoplasie, in particolare
34
I sintomi più comuni comprendono diarrea, dolore addominale, enterorragia e perdita di
peso [72]. Possono anche essere presenti segni clinici come anemia, epatomegalia o massa
addominale palpabile. Spesso le NEN del colon vengono scoperte occasionalmente durante
una colonscopia eseguita per altre ragioni, oppure a causa di un reperto ecografico
suggestivo di metastasi epatiche.
Retto
L’incidenza delle NEN del retto è in continuo aumento. Attualmente, esse rappresentano il
18% di tutte le NEN e il 27% della NEN gastrointestinali [1]. Le NEN rettali si presentano
di solito come piccole lesioni polipoidi localizzate tra 4 e 20 cm dalla linea dentata e la
maggior parte di esse (circa il 40%) viene scoperta incidentalmente durante una
sigmoidoscopia di routine.
I sintomi più frequenti comprendono alterazioni dell’alvo, rettorragia, sintomi ano-rettali
(tenesmo, dolore, ecc.) e perdita di peso [73]. L’insorgenza di sindrome carcinoide è un’evenienza molto rara nei pazienti con NEN rettale.
La maggior parte delle NEN del retto (75-85%) si presenta localizzata alla diagnosi [1, 72].
Polmone
Circa il 70% delle NEN polmonari è localizzato nei grandi bronchi e la restante
percentuale si ritrova alla periferia del polmone. Inoltre, esse insorgono più frequentemente
35
L’origine delle NEN bronchiali è stato suggerito essere dalle cellule neuroendocrine
polmonari (PNEC), che normalmente si ritrovano come cellule solitarie o, talvolta,
aggregate sotto forma di piccoli noduli chiamati corpi neuroepiteliali, localizzati nell’epitelio ciliato. La PNEC esprimono serotonina, enolasi neurono-specifica (NSE) e il
fattore di rilascio della gastrina (GRP). [75]
Più del 90% dei pazienti con NEN polmonare a partenza dai grandi bronchi presenta una
sintomatologia caratterizzata da emottisi, tosse, infezioni polmonari ricorrenti, febbre e
dolore toracico, mentre la maggior parte dei carcinoidi periferici viene scoperta
incidentalmente [74]. La sindrome carcinoide è abbastanza rara nei pazienti con NEN
36 FATTORI PROGNOSTICI
I principali fattori prognostici negativi delle NEN sono la sede del tumore primitivo (le
NEN pancreatiche hanno generalmente una prognosi peggiore rispetto alle NEN
intestinali), lo stadio secondo il TNM, la classificazione istopatologica OMS, che considera l’aspetto morfologico del tumore e la sua attività proliferativa in termini di numero di
mitosi o indice di proliferazione (Ki67) [65, 48, 76]. Quest’ultimo parametro distingue i
pazienti in tre diverse categorie di grading ed è considerato, oggi, il più solido fattore
prognostico per le NEN in genere [77]. L’espressione dei recettori della somatostatina
(fattore predittivo di comportamento clinico più favorevole rispetto alla non espressione),
la velocità di evoluzione spontanea del tumore e l’età del paziente rappresentano ulteriori
37
MALATTIA LOCALIZZATA RADICALMENTE OPERABILE
Tutti i pazienti con NEN potenzialmente resecabile e senza importanti controindicazioni
alla chirurgia dovrebbero andare incontro a resezione chirurgica della lesione.
Dopo chirurgia curativa, non c’è indicazione ad alcun trattamento medico specifico e,
38 MALATTIA AVANZATA
Presentazione Clinica E Aspetti Anatomopatologici
Nel più vasto database epidemiologico degli USA (SEER), di tutti i casi con informazioni
disponibili, il 49% delle NEN risulta essere localizzato, il 24% con estensione
loco-regionale e il 27% è associato a metastasi a distanza [1]. Nei database europei, invece, le
metastasi a distanza da GEP NEN al momento della diagnosi sono più frequenti, e sono
riportate in una percentuale che va dal 44 [70] al 73% [65,78] nei centri specializzati.
Questo può essere in relazione a una preselezione di pazienti con malattia avanzata basata
sul riferimento a centri specializzati piuttosto che a una reale differenza. Lo stadio della
malattia è in rapporto anche alla localizzazione del tumore primitivo alla diagnosi iniziale.
In Europa e negli USA più del 77% dei pazienti con NEN pancreatiche e più del 91% dei
pazienti con NEN intestinali [65, 67, 76] si presenta con metastasi a distanza alla diagnosi
iniziale, mentre le NEN rettali le presentano in circa il 40%, le gastriche nel 20-30% e le
appendicolari in meno del 5% [65, 70]. Inoltre, la frequenza della presenza di malattia
metastatica dipende dall’estensione del tumore (T stage), dalla differenziazione e dall’
attività proliferativa (grading:G1-G3). Come atteso, nel SEER database il grado di differenziazione e l’attività proliferativa sono strettamente associati con il grading della
malattia: il 50% dei pazienti con NET scarsamente differenziato (NEC G3) presentava
metastasi a distanza al momento della diagnosi, mentre solo il 21 e il 30% dei pazienti con
NET G1 e G2 rispettivamente le presentava [1]. I databases europei confermano questi
risultati.
Il fegato è l’organo più frequentemente interessato da metastasi da GEP NEN; in circa la
39
linfonodi, il peritoneo, il polmone e lo scheletro ( raramente si possono presentare
metastasi encefaliche, cardiache e ovariche) [79-81].
Metastasi epatiche
Macroscopicamente, si distinguono 3 differenti patterns di infiltrazione epatica da
metastasi, che hanno un impatto sull’approccio terapeutico [82]:
(A) Metastasi epatiche confinate ad un lobo o limitate a due segmenti adiacenti possono essere rimosse con una resezione anatomica standard. Questo “pattern semplice” si ritrova
nel 20-25% dei casi.
(B) Metastasi epatiche con un “pattern complesso”, per esempio con un lobo
maggiormente interessato ma con satelliti più piccoli contro laterali, nel 10-15% dei casi.
Si può ancora intervenire chirurgicamente, anche con approcci ablativi.
(C) Metastasi epatiche diffuse, multifocali, si ritrovano nel 60-70% dei casi e non
dovrebbero essere trattate chirurgicamente.
La presenza di metastasi epatiche influenza ampiamente la prognosi in tutti i tipi di NEN
ed è dipendente dal sito primitivo del tumore, dal T-stage, dalla differenziazione istologica (NET vs. NEC) e dall’attività proliferativa (grading; G1-G3). In aggiunta a questi,
metastasi epatiche in progressione, il carico di tumore al fegato, la presenza di metastasi
extraepatiche e la sindrome carcinoide cardiaca sono fattori prognostici negativi.
Prognosi
La differenziazione istologica e l’attività proliferativa sono i migliori fattori predittivi di
40
nella malattia metastatica era di 33 mesi nei pazienti con NET G1-G2, ma solo di 5 mesi
nei pazienti con carcinoma scarsamente differenziato NEC G3. La sopravvivenza a 5 anni
era del 35% nei NET G1-G2 ma inferiore al 5% nei G3 [1]. Nei centri specializzati per il
trattamento dei NET tale percentuale è molto più alta. Ciò può essere dovuto a un migliore
management globale delle neoplasie neuroendocrine nei centri specializzati che hanno un
approccio multidisciplinare e accesso ad un più ampio spettro di opzioni terapeutiche. In
questi centri, le percentuali di sopravvivenza a 5 anni nei NET midgut metastatici superano
il 50% (e.g. 56% UKI NET study, 68% registro spagnolo, 75% Tampa Single Center e
persino 83% nei centri di Berlino e Parigi) [67, 70, 83]. In un’analisi multicentrica di
pazienti con NET G1-2 dal SEER database, lo stadio di malattia, il sito primitivo del tumore, la differenziazione istologica, il sesso, la razza, l’età e l’anno di diagnosi erano
tutti predittori di outcome (p<0.001) [1]. Uno stadio avanzato, la scarsa differenziazione istologica e l’età erano i più potenti predittori di peggior sopravvivenza in un’analisi di
1483 casi di NET pancreatici al Mayo Clinic [84]. In un’ analisi multicentrica di 324
pazienti con NET pancreatico, i fattori prognostici erano la recente classificazione TNM, la classificazione istologica secondo la WHO, l’attività proliferativa (misurata col Ki67) e la
chirurgia radicale [76]. In riferimento al Ki67, i valori di cut-off proposti dalla
classificazione WHO (G1: ≤2%; G2: 3-20%; G3: >20%) sono stati validati in un limitato
numero di studi [76, 85, 86], e non in uno studio prospettico e specifico per la malattia in
IV stadio. Secondo la classificazione WHO, i valori di cut-off leggermente corretti a
seconda del sito del tumore primitivo possono portare ad una più precisa stratificazione
prognostica per i NET pancreatici (e.g. <5%, 5-20% e >20%) [87, 88]. Nonostante ciò, mancano ancora analisi comparative sull’attività proliferativa dei tumori primitivi e delle
loro metastasi, e i valori prognostici e predittivi del Ki67 nella malattia in IV stadio necessitano ancora di validazione. Un’analisi unicentrica ha dimostrato l’influenza della
41
terapia sistemica con analoghi della somatostatina (SSA) o della terapia radiometabolica sull’outcome [67, 89]. La resezione precoce del tumore primitivo che includa la dissezione
linfonodale e/o la chirurgia di debulking o le terapie loco-regionali sono associate ad una
prognosi migliore [90-94], ma tali risultati derivano esclusivamente da trial retrospettivi. Il
carico di tumore epatico o il numero delle metastasi, la frazione di crescita tumorale, la
presenza di metastasi a distanza extraepatiche, eventuali comorbidità e il performance
status rappresentano addizionali fattori prognostici [48, 65, 90, 94]. Dati retrospettivi
indicano che la cromogranina A (CgA) circolante ha un valore prognostico [95, 96]; livelli
42
TRATTAMENTO DELLA MALATTIA AVANZATA
Terapia chirurgica
Resezione
La chirurgia è generalmente proposta con intento curativo a tutti i pazienti con metastasi
epatiche ben differenziate operabili da NET, indipendentemente dal sito di origine,
sebbene la resezione di metastasi da NEN del colon-retto sia rara visto che questi tumori
sono generalmente non funzionanti e con frequenti metastasi extraepatiche. Se l’intento
della chirurgia è curativo, quindi, le metastasi dovrebbero essere ben differenziate (NET
G1-G2) e dovrebbe essere confermata, tramite CT ad alta risoluzione e SPECT/CT-SRS o
PET/CT con 68Ga-SSA, l’assenza di metastasi extraepatiche e/o diffusa o non resecabile carcinosi peritoneale. I benefici della resezione chirurgica completa delle metastasi
epatiche sono stati dimostrati in termini di sopravvivenza globale e qualità della vita
[99-102] e possono essere ottenute percentuali di sopravvivenza a 5 anni del 60-80%. Al
contrario, per i pazienti le cui metastasi epatiche non sono state resecate è riportata una
percentuale di sopravvivenza di solo il 30% [92, 103]. Nonostante ciò, la preselezione dei
pazienti con un miglior performance status o malattia meno avanzata sembra condizionare in positivo l’outcome chirurgico, e sono necessari trials prospettici. La resezione è
associata ad una bassa % di mortalità (0-5%) e ad una morbilità accettabile. Può essere, inoltre, di particolare beneficio nell’alleviare la sintomatologia relativa all’ipersecrezione
di serotonina o degli altri mediatori dei tumori funzionanti [104]. Se si valuta una chirurgia palliativa, la presenza di funzionalità è uno dei principali componenti dell’iter decisionale.
Il miglioramento dei sintomi dopo la chirurgia può essere a lungo termine con una durata
43
delle metastasi epatiche, del tumore primitivo e dei linfonodi, ma anche terapie ablative
che rimuovono >90% del volume tumorale [90, 104, 105].
Uno dei fattori cruciali dopo la resezione è l’alta percentuale di recidiva dopo un tempo
mediano di 16-20 mesi, e la maggior parte avrà recidiva a 5 anni [99, 106]. La recidiva può
essere epatica e/o extraepatica. Il tempo dopo il quale si avrà recidiva dipende principalmente dall’iniziale radicalità della resezione epatica e richiede una valutazione
pre- e intra operatoria delle piccole metastasi epatiche usando la più sensibile tecnica di
imaging disponibile. La mortalità relativa alla chirurgia dovrebbe essere meno del 5%. Il
tipo di resezione chirurgica è relativo alle condizioni generali del paziente, al numero e alla
sede delle metastasi epatiche, alla complessità della resezione epatica, e alla stima del futuro volume di parenchima epatico rimanente. Riguardo quest’ultimo punto, la chirurgia
specializzata può rimuovere senza problemi il 65-70% dell’intero volume epatico (in
pazienti con parenchima epatico sano) [107, 108]. In tutti i casi in cui il paziente abbia la
sindrome carcinoide, è indicato il trattamento perioperatorio con SSA per prevenire la
comparsa di crisi carcinoide intra- e postoperatoria [109].
In pazienti selezionati, la resezione epatica può essere proposta dopo down-staging della malattia epatica all’interno di una strategia multidisciplinare predefinita [110]. Per
metastasi epatiche non resecabili, se la crescita è controllata, la resezione del tumore
primitivo può essere raccomandata per evitare complicanze locali come occlusione
intestinale, retrazione mesenterica ed emorragia.
Trapianto di fegato
Il trapianto di fegato nei pazienti con metastasi da NEN è considerato efficace per pazienti
44
dell’ epatocarcinoma, le metastasi epatiche da NEN sono quasi l’unica indicazione per il
trapianto nell’ ambito delle malattie neoplastiche [111-113]. Mentre la principale
indicazione è la presenza di sintomi ormonali refrattari alla terapia chirurgica o a qualsiasi
altra terapia, anche pazienti con tumori non-funzionanti e metastasi epatiche molto diffuse
non resecabili possono occasionalmente essere candidati al trapianto. I pazienti con NET
G1 sembrano essere i migliori candidati al trapianto di fegato [114]. I requisiti minimi per
prendere in considerazione il trapianto di fegato sono i seguenti: mortalità inferiore al 10%,
assenza di malattia extraepatica documentata da una PET/TC [113], tumore primitivo
rimosso prima del trapianto, NEN ben differenziata (NET G1-G2). I pazienti con un’età
<50 anni liberi da malattia extraepatica e con un Ki67<10% [115, 116] sono quelli che
traggono più spesso beneficio dal trapianto. Ciò nonostante, una sopravvivenza libera da
malattia a lungo termine dopo trapianto sarà un evento eccezionale anche in questo
selezionato sottogruppo.
Tecniche ablative locali e loco-regionali
Non ci sono trials clinici randomizzati che comparano l’efficacia delle terapie
loco-regionali con la chirurgia epatica palliativa o il trattamento medico [117]. La scelta della
procedura ablativa o loco-regionale (come l’ablazione con radiofrequenza, la termoterapia
laser-indotta, l’embolizzazione arteriosa selettiva epatica transcateterale TAE o la chemoembolizzazione TACE, e la radioterapia interna selettiva) dipende dall’esperienza
locale, dall’estensione (numero e dimensione delle lesioni) e dalla sede della malattia
epatica.
Se è presente malattia “bulky”, la terapia loco-regionale è indicata precocemente per i
tumori non funzionanti, ed è utile per il downstaging. Tale terapia è più frequentemente
45
opzioni di trattamento sono limitate in questo tipo di tumori. Inoltre in pazienti con tumori
funzionanti, le terapie loco regionali possono essere considerate in presenza di malattia
extraepatica se il fegato è la principale sede di malattia e frequentemente sono usate in
combinazione con gli SSA per il controllo della sintomatologia associata.
Ablazione con radiofrequenza (RFA)
A seconda della sede e dell’estensione del carico metastatico si può optare per una RFA
per via percutanea o laparoscopica [118, 119]. La combinazione di resezione e RFA
aumenta la possibilità di ottenere una completa rimozione tumorale [120, 121]. Il numero
di studi sul trattamento con RFA nei NET con metastasi epatiche è ancora limitato. Nel più
ampio studio sono stati investigati 73 pazienti con NET di varia origine. È stato osservato
miglioramento dei sintomi nel 70.6% dei pazienti con sindrome carcinoide; inoltre, è stato
ottenuto un significativo decremento dei markers biochimici in 4 su 8 pazienti con NET
pancreatico funzionante [122]. In uno studio prospettico di 63 pazienti, il 70% ha avuto un
significativo o completo controllo dei sintomi, e la durata di tale controllo è stata di 11 ±
2.3 mesi [123].
Dovrebbero essere trattate, preferibilmente, lesioni di dimensione <3 cm, in combinazione
con la resezione [124], e il numero di lesioni tumorali dovrebbe essere limitato.
Embolizzazione e chemoembolizzazione
La TAE e TACE epatica selettiva con occlusione dell’arteria epatica possono essere usate
nel trattamento della metastasi epatiche da NET G1/G2. L’embolizzazione selettiva delle
arterie periferiche induce una temporanea, ma completa ischemia. Tale procedura può
46
spesso utilizzati sono la doxorubicina e la streptozotocina [125-127]. La TACE o la sola
TAE possono essere usate, se la chirurgia non è indicata, per la riduzione tumorale nei
NET funzionanti e non funzionanti. Risposte complete o parziali per la sintomatologia, i
markers tumorali e i reperti di imaging si verificano nel 73-100%, 57-91% e 33-50%
rispettivamente. La durata della risposta sintomatologica va dai 14 ai 22 mesi [125,
127-130]. Le percentuali di sopravvivenza a 5 anni nei diversi studi vanno dal 50 all’83% dopo
TACE e dal 40 al67% dopo TAE [130]. La mortalità durante la procedura è bassa (0-3.3%)
se eseguita da personale esperto [125, 127-129]. Effetti collaterali minori come nausea e
vomito (50-70%), dolore al quadrante superiore destro (50-60%), febbre (30-60%) ed
incremento delle transaminasi (100%) sono abbastanza comuni [131]. Gli effetti collaterali
maggiori includono: necrosi della colecisti, sindrome epatorenale, pancreatite, ascesso
epatico, formazione di aneurismi.
Vista l’assenza di trials comparativi [117] rimane poco chiaro quando la TACE è da
preferire alla sola TAE, così come non è ancora chiaro il criterio di scelta dell’agente
citotossico.
Radioterapia interna selettiva (SIRT)
La SIRT è ancora considerata sperimentale. Recenti studi con 90Y-microsfere in un insieme di circa 200 pazienti indicano percentuali di risposta obiettiva del 50-60% in pazienti con
metastasi epatiche da NET. La maggior parte dei dati, tuttavia, è retrospettiva e deriva
piccoli studi di fase II [132-134].
Terapia radiometabolica (Radioterapia a target recettoriale)
Si sono sviluppati dati promettenti riguardo alla terapia radiometabolica (PRRT) nel
47
approccio terapeutico si basa sul targeting specifico delle cellule tumorali che
sovra-esprimono i recettori per la somatostatina (sstr), mediante peptidi analoghi della
somatostatina radio marcati con isotopi emettitori di particelle beta. Tali composti sono in
grado di irradiare i tumori e le loro metastasi attraverso l’internalizzazione mediata dai
sstr. Vengono utilizzati isotopi come Ittrio-90 e Lutezio-177, dotati di energia e
penetrazione tissutale idonea per scopi terapeutici. I farmaci impiegati sono 90 Y-DOTA-Tyr3-octreotide o 90Y-DOTATOC e, più recentemente, 177Lu-DOTA-Tyr3-octreotate, o
177
Lu-DOTATATE [135-138].
La PRRT può essere presa in considerazione sia nelle NEN funzionanti che non
funzionanti, purché abbiano una sufficiente densità di sstr, e quindi una captazione
adeguata all’ imaging recettoriale con OctreoScan, indipendentemente dal sito primitivo
del tumore. In generale, la PRRT è usata dopo fallimento della terapia medica di prima
linea; è riportato un miglior effetto antitumorale con l’incremento dell’espressione dei sstr2
alla SRS [138].
In base a studi di fase II, per lo più di numero esiguo e principalmente retrospettivi, le
percentuali di remissione parziale vanno da 0 a 37% [137-140] e sono più alte nei NET
pancreatici rispetto ai gastrointestinali. In uno studio multicentrico prospettico di fase II
sulla PRRT con 90Y-edotreotide/DOTATOC, un altamente selezionato gruppo di pazienti con sindrome carcinoide refrattaria ha manifestato remissione parziale nel 4% e stabilità di
malattia nel 70% dei casi. La PFS si è dimostrata favorevole con 16.3 mesi [139]. In uno
studio prospettico condotto su 51 pazienti trattati con 177Lu-octreotate, l’analisi di una sottopopolazione di pazienti in progressione al momento dell’arruolamento ha mostrato
che la PFS correlava allo stesso modo con la stabilità di malattia e la risposta, indicando che l’efficacia potrebbe essere indipendente dall’ottenimento di una vera risposta parziale
![Tabella 1. Classificazione morfologica e grading (secondo l’OMS) [Bosman 2010]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7620827.116184/7.892.119.815.692.1129/tabella-classificazione-morfologica-grading-secondo-oms-bosman.webp)