UNIVERSITA’ DI PISA
Corso di Laurea Magistrale in Medicina Veterinaria
Indagini parassitologiche su
Indagini parassitologiche su
Indagini parassitologiche su
Indagini parassitologiche su
cani e gatti in canile a
cani e gatti in canile a
cani e gatti in canile a
cani e gatti in canile a
Cernavodă (Romania)
Cernavodă (Romania)
Cernavodă (Romania)
Cernavodă (Romania)
Candidato: Gucci Elisa
Relatori: Prof. Mancianti Francesca
Dott. Macchioni Fabio
Dedico questo mio lavoro a Miciona, Micina, Pedro, Piccy, Corinna, Ralph, Toby e Squillo, piccoli compagni della giovinezza, grandi maestri di vita.
A chi, come me, ama infinitamente gli animali e a chi non capisce e non condivide quest’enorme passione; con un solo, grande augurio: possa un giorno incontrare un caldo amico peloso o piumato che sappia cambiare la sua vita e fargli capire il vero senso della nostra misera, eppur meravigliosa, esistenza…
Perché, veramente: “
Felicitas est parvus canis calidus
” (Lucy Van Pelt)INDICE INDICEINDICE INDICE ABSTRACT ABSTRACTABSTRACT ABSTRACT pag. 5 INTRODUZIONE INTRODUZIONEINTRODUZIONE INTRODUZIONE pag. 6
La La La La
Leishmaniosi
Leishmaniosi
Leishmaniosi
Leishmaniosi
11La DemodicosiLa Demodicosi La DemodicosiLa Demodicosi 16 Le DermatofitosiLe Dermatofitosi Le DermatofitosiLe Dermatofitosi 19 Affezioni da Affezioni da Affezioni da Affezioni da
Malassezia
Malassezia
Malassezia
Malassezia
24 Le parassitosi intestinaliLe parassitosi intestinali Le parassitosi intestinaliLe parassitosi intestinali 29 Pulicosi ed infestazioni da zecchePulicosi ed infestazioni da zecche Pulicosi ed infestazioni da zecchePulicosi ed infestazioni da zecche 39SCOPO DELLA RICERCA SCOPO DELLA RICERCASCOPO DELLA RICERCA
SCOPO DELLA RICERCA pag. 43
MATERIALI E METODI MATERIALI E METODIMATERIALI E METODI
MATERIALI E METODI pag. 44
La popolazione animale oggetto di studio La popolazione animale oggetto di studioLa popolazione animale oggetto di studio
La popolazione animale oggetto di studio pag. 44
RICERCA DI ANTICORPI VERSO RICERCA DI ANTICORPI VERSO RICERCA DI ANTICORPI VERSO
RICERCA DI ANTICORPI VERSO
LEISHMANIA
LEISHMANIA
LEISHMANIA
LEISHMANIA
pag. 49 La raccoltaLa raccoltaLa raccoltaLa raccolta 49 La metodica di ricercaLa metodica di ricercaLa metodica di ricercaLa metodica di ricerca 49 RICERCA DI RICERCA DI RICERCA DI RICERCA DIDEMODEX
DEMODEX
DEMODEX
DEMODEX
pag. 51 La scelta dei camLa scelta dei camLa scelta dei camLa scelta dei campionipionipionipioni 51 La metodica di ricercaLa metodica di ricercaLa metodica di ricercaLa metodica di ricerca 51 RICERCA DI DERMATOFITIRICERCA DI DERMATOFITI RICERCA DI DERMATOFITIRICERCA DI DERMATOFITI pag. 53 La raccoltaLa raccoltaLa raccoltaLa raccolta 53 La metodica di ricercaLa metodica di ricercaLa metodica di ricercaLa metodica di ricerca 53 RICERCA DI RICERCA DI RICERCA DI RICERCA DIMALASSEZIA
MALASSEZIA
MALASSEZIA
MALASSEZIA
pag. 54 La raccoltaLa raccoltaLa raccoltaLa raccolta 54 La metodica di ricercaLa metodica di ricercaLa metodica di ricercaLa metodica di ricerca 54RICERCA DI PARASSITI INTESTINALIRICERCA DI PARASSITI INTESTINALI RICERCA DI PARASSITI INTESTINALIRICERCA DI PARASSITI INTESTINALI pag. 56 La raccoLa raccoLa raccoLa raccoltaltalta lta 56 La metodica di ricercaLa metodica di ricercaLa metodica di ricercaLa metodica di ricerca 57
RICERCA E CLASSIFICAZIONE DI PULCI E ZECCHERICERCA E CLASSIFICAZIONE DI PULCI E ZECCHE RICERCA E CLASSIFICAZIONE DI PULCI E ZECCHERICERCA E CLASSIFICAZIONE DI PULCI E ZECCHE pag. 58 La raccoltaLa raccoltaLa raccoltaLa raccolta 58 La metodica di ricercaLa metodica di ricercaLa metodica di ricercaLa metodica di ricerca 58
RISULTATI DELLE RICERCHE RISULTATI DELLE RICERCHERISULTATI DELLE RICERCHE
RISULTATI DELLE RICERCHE pag. 60
RICERCA DI ANTICORPI VERSO RICERCA DI ANTICORPI VERSO RICERCA DI ANTICORPI VERSO RICERCA DI ANTICORPI VERSO
LEISHMANIA
LEISHMANIA
LEISHMANIA
LEISHMANIA
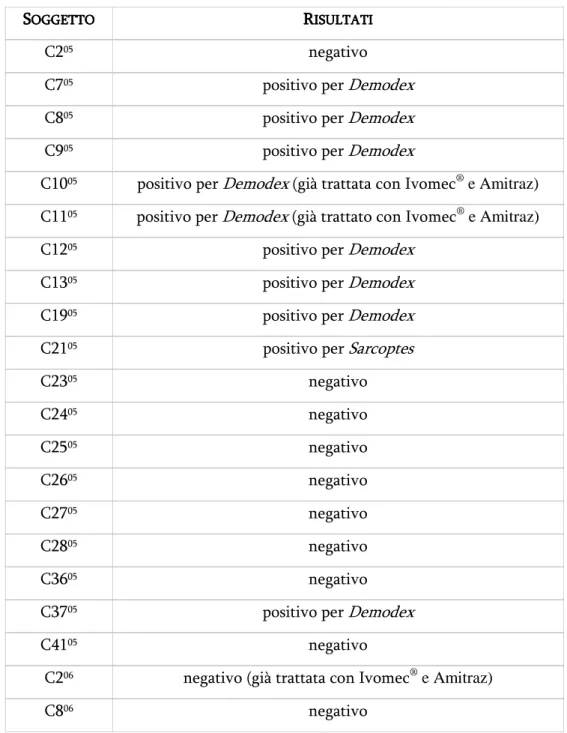
pag. 60 RICERCA DI RICERCA DI RICERCA DI RICERCA DIDEMOD
DEMODEX
DEMOD
DEMOD
EX
EX
EX
pag. 63 RICERCA DI DERMATOFITIRICERCA DI DERMATOFITI RICERCA DI DERMATOFITIRICERCA DI DERMATOFITI pag. 68 RICERCA DI RICERCA DI RICERCA DI RICERCA DIMALASSEZIA
MALASSEZIA
MALASSEZIA
MALASSEZIA
AURICOLARE AURICOLARE AURICOLARE AURICOLARE pag. 75 RICERCA DI PARASSITI INTESTINALIRICERCA DI PARASSITI INTESTINALI RICERCA DI PARASSITI INTESTINALIRICERCA DI PARASSITI INTESTINALI pag. 78 IDENTIFICAZIONEIDENTIFICAZIONE DI PULCI E ZECCHEIDENTIFICAZIONEIDENTIFICAZIONE DI PULCI E ZECCHE DI PULCI E ZECCHE DI PULCI E ZECCHE pag. 84 DISCUSSIONE DISCUSSIONEDISCUSSIONE DISCUSSIONE pag. 90 BIBLIOGRAFIA BIBLIOGRAFIABIBLIOGRAFIA BIBLIOGRAFIA pag. 102ABSTRACT ABSTRACT ABSTRACT ABSTRACT
Parole chiave Parole chiaveParole chiave
Parole chiave: Romania, randagismo, parassitosi, zoonosi.
Il randagismo è un effettivo problema in Romania; questo studio è stato svolto in un canile di un’associazione animalista, sorto a Cernavodă (Romania) con l’intento di salvaguardare i cani “senza tetto” e offrire loro la speranza di un futuro migliore.
88 cani, randagi e di proprietà, e 31 gatti, entrati nel canile per qualsiasi motivo, sono stati esaminati per la ricerca di vari parassiti quali: Leishmania, Demodex, dermatofiti, Malassezia
auricolare, pulci e zecche.
Il più delle volte gli animali presentavano importanti manifestazioni dermatologiche, sospetto delle più varie e serie parassitosi, spesso trasmissibili all’uomo, ma anche riconducibili alle ardue condizioni di una vita randagia.
Dalle strade della città sono stati raccolti 54 campioni di feci per l’evidenziazione di eventuali parassiti ivi presenti.
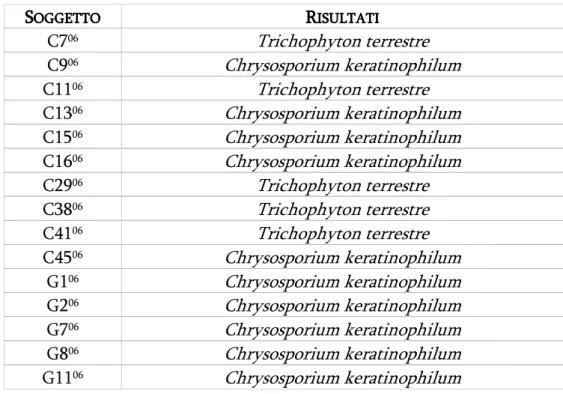
Su 84 cani testati per la ricerca di anticorpi verso Leishmania, 3 sono risultati positivi; dove gli animali mostravano segni riconducibili a Demodex, sono stati effettuati raschiati cutanei per la ricerca del parassita: su 21 sospetti, la diagnosi di demodicosi è stata confermata in 9 casi. Dalla ricerca di dermatofiti, eseguita su un totale di 119 animali, nessuno ha rivelato la presenza di Microsporum canis o di altri miceti patogeni; in alcuni campioni si è ottenuta la crescita di dermatofiti geofili (Trichophyton terrestre) e pseudodermatofiti cheratinofili (Chrysosporium keratinophilum).
Malassezia auricolare è stata diagnosticata in 14 soggetti su 119, comunque asintomatici. Dall’analisi per flottazione delle feci, si è osservata la presenza di una gran quantità di
Ancylostoma, Trichuris vulpis, ascaridi e coccidi.
Si sottolinea l’importanza di una prevenzione verso eventuali zoonosi, cosa per altro difficile da ottenere, per le cattive condizioni sanitarie in cui versa gran parte del Paese.
Key words Key wordsKey words
Key words: Rumania, stray dogs, parasites, zoonosis.
Stray dogs are a problem in Rumania; this study was carried out in Cernavodă (Rumania), in a shelter of an animalist association, born to safeguard the “homeless” dogs.
Eighty-eight dogs, stray or with an owner, and 31 cats, arrived in the shelter for any problem, were examinated for Leishmania, Demodex, dermatophytes, ear Malassezia, fleases and ticks. Often the animals showed important dermatological disorders, suspected of the most various and serious parasites, also transmittable to the human species.
From the city’s streets were picked up 54 dog’s fecal specimens to find possible parasites. Three dogs of 84 tested for antibody against Leishmania, was resulted positive.
Twenty-one dogs showed skin disease, and of theme 9 were suffering from Demodex.
On 119 animals, none had Microsporum canis or other dermatophytes, in same case we found geophylic dermatophytes (Trichophyton terrestre) or keratinophylic fungi (Chrysosporium keratinophilum).
Ear Malassezia was diagnosed in 14 subjects.
The coprological samples analised showed the several presence of Ancylostoma, Trichuris vulpis, Toxocara eggs and oocysts.
We emphasize the great importance of the zoonosis prevention, but it’s very difficult to achieve it due to the bad sanitary state of Rumania.
INTRODUZIONE INTRODUZIONEINTRODUZIONE INTRODUZIONE
La condizione di cani e gatti in Romania è particolarmente drammatica: il randagismo è una delle piaghe di questo paese che dal 1° gennaio 2007 è entrato a far parte dell’Unione Europea.
Le strade delle grandi città e delle più piccole località di campagna pullulano di cani: in ogni angolo, palazzo, portone, vivono e si riproducono branchi di questi animali che, senza ombra di dubbio, rappresentano un grande problema per la popolazione rumena.
Tutto ha avuto origine con lo spopolamento delle campagne: sotto il dominio di Ceausescu sono state rase al suolo le case per lasciare spazio ai casermoni in cui i cani di proprietà non
potevano trovare un posto. L’abbandono è stata una facile soluzione alle nuove condizioni di vita sociale e il docile cucciolo di casa si è ritrovato in mezzo alla strada: è così che il
randagismo ha avuto inizio, i cani, inselvatichitisi, si sono riprodotti esponenzialmente ed hanno riempito progressivamente le città.
Appena si arriva nella capitale, cani di qualsiasi taglia e colore affollano la tua strada, alcuni guardandoti con occhi imploranti, in cerca di un biscotto o di una carezza, altri con la sfida nello sguardo, padroni delle vie che percorrono, consapevoli della malvagità dell’Uomo.
Attraversare la Romania è entrare in un girone dantesco dove niente appare reale e soprattutto possibile: distese infinite di campi, fioriti in estate, coperti di neve in inverno, chilometri senza vedere una casa o una persona, poi scorgi
qualcosa che avanza, cani, talora soli, talaltra in gruppo, consumati dalla fame, che vagano in cerca di cibo e non si capisce dove possano trovare un boccone per vivere perché in quelle lande non c’è veramente niente.
Per porre rimedio a questa invasione il Governo ha decretato che i randagi siano prelevati dalle strade, portati nei canili e, se non ricercati dal padrone, soppressi entro breve tempo. Inutile dire che i cani catturati spesso vengono barbaramente uccisi sul posto o nel trasporto verso il rifugio-lager, dove non è assicurato né il cibo né l’aria per respirare, gli animali sono
stipati in misere, sporche gabbie in attesa dell’atroce esecuzione.
Più spesso sono i cittadini stessi a cercare di risolvere il “problema” con bocconi avvelenati, investendo gli animali o semplicemente uccidendoli nelle maniere più crudeli. Per venire incontro alla necessità di dare una civile soluzione al randagismo, organizzazioni animaliste di vari paesi europei si sono impegnate sul posto, strappando accordi con le amministrazioni comunali di varie città. E’ così che è sorto a Cernavodă, città della contea di Costanza, un canile con l’intento di prelevare randagi dalle strade, sterilizzarli gratuitamente e reimetterli sul posto in modo che la popolazione canina rimanga stabile e con gli anni si possa porre fine al problema. Da parte sua, il Sindaco s’impegna a
fermare le soppressioni, anche perché avrebbero poco senso visto che spesso, dalle città vicine, altri cani arrivano a rimpiazzare ed occupare il territorio “liberato” in precedenza.
L’obiettivo dell’associazione, sorretta da volontari europei e da personale rumeno, è anche quello di instillare nella società del paese una certa politica del non-abbandono ed una cultura più aperta ad accettare e rispettare individui di specie diversa. A tale scopo, gli aiuti dell’organizzazione sono rivolti, non solo verso i randagi, ma anche verso gli animali di proprietà e verso gli abitanti più poveri e soli.
Prendersi cura di cani e gatti ha inoltre un ruolo determinante nel cercare di arginare possibili pericoli derivanti dalla convivenza tra uomo ed animale, sia dal punto di vista strettamente sanitario sia da quello igienico.
Gli animali abbandonati a se stessi, spesso riuniti in branchi rappresentano una minaccia perché molte volte inferociti e pronti ad attaccare l’uomo. Anche la ricerca del cibo può divenire un problema: i cani si avventano sull’immondizia spargendo ovunque rifiuti urbani e spesso gli stessi cittadini hanno paura a gettare la spazzatura nei cassonetti per timore di essere aggrediti.
Generazioni di cani si rinnovano nelle discariche della città, vivendo in stretto contatto con gli abitanti
più poveri, costretti a fare di questo luogo il loro posto di lavoro, alla ricerca di materiali da riciclare da vendere per pochi
lei
.Anche lo smaltimento dei cadaveri rappresenta un grande dilemma: non esistono inceneritori o luoghi pronti ad accogliere le carcasse di animali, randagi o di proprietà, deceduti per motivi sanitari o in seguito a soppressione e che quindi vengono abbandonati per causa di forza maggiore, nella stessa discarica.
Una giusta sorveglianza sulle malattie si renderebbe necessaria per assicurare a qualsiasi abitante del luogo una buona qualità di vita.
Per quando riguarda gli animali di proprietà, raramente sono tenuti alla “maniera occidentale”: sovente sono lasciati liberi di vagare da soli e in ogni caso, anche quelli portati al guinzaglio sono ad alto rischio poiché a contatto con i randagi o con i territori che questi occupano.
Dobbiamo soffermarci anche
sul problema della
fecalizzazione: ovviamente le strade sono invase dagli escrementi degli animali con rischio di zoonosi da parassitosi ed infezioni batteriche, inoltre le deiezioni lasciate sono habitat ideale per la moltiplicazioni di altri germi ed artropodi presenti nel territorio. L’igiene urbana è dunque ad alto rischio e la cittadinanza in continua esposizione a possibili malattie così veicolate.
Gli studi condotti dall’OMS e dalla FAO ed esposti negli incontri internazionali di Ginevra (1974), Roma (1977) e San Marino (1980) illustrano la necessità di una maggiore attenzione e collaborazione affinché le varie patologie trasmissibili all’uomo direttamente dagli animali o indirettamente con i loro prodotti, possano essere ridotte al minimo. In paesi come la Romania, si rende ancora più difficile un controllo del genere per le ragioni già esposte e, non ultimo, anche per i metodi di gestione rurali utilizzati in gran parte della nazione. Si renderebbe indispensabile una crescita di consapevolezza da parte delle Autorità del luogo, per giunta spesso inapplicabile per le tristi condizioni, soprattutto storiche, da cui il Paese deve emergere.
Malattie da anni
debellate nelle
nazioni più
emancipate, ancora persistono nell’Est europeo, basti pensare all’alto tasso di tubercolosi o di echinococcosi che qui
sopravvive. Non di ultima importanza è la grande differenza sociale ed economica che s’incontra nelle varie classi, per cui, se talune persone agevolmente possono accedere ai normali servizi, altre (soprattutto la popolazione Rom) sono invece costrette a vivere in quartieri senza igiene, promiscui con cani, gatti, animali da cortile infestati da endo ed ectoparassiti che spesso pongono sullo stesso piano sanitario Uomo e Bestia.
Negli animali oggetto di questo studio sono state fatte indagini per il rilievo di varie patologie legate a parassiti potenzialmente presenti nell’ambiente; sono stati eseguiti i seguenti esami:
⋅ esami sierologiciesami sierologici per la ricerca di anticorpi verso esami sierologiciesami sierologici
Leishmania
⋅ esamiesami per la ricerca di dermatofiti, acari delle rogne, esamiesami
Malassezia
, ectoparassitosi (pulci e zecche), ed infezioni intestinali da elminti e protozoiLa La La
La lllleishmaniosieishmaniosieishmaniosieishmaniosi
La leishmaniosi è un’infezione sistemica causata da un protozoo,
Leishmania
infantum
, trasmissibile attraverso la puntura d’insetti del generePhlebotomus
. Il cane rappresenta l’ospite elettivo di questo protozoo ed è un importante serbatoio per il passaggio della malattia ad altri individui, animali ed umani.La trasmissione di
L. infantum
avviene quando la femmina ematofaga del flebotomo, a sua volta contaminatasi ingerendo col pasto di sangue cellulemacrofagiche infettate, punge il cane.
Nel vertebrato il protozoo si trova nella forma amastigote (rotondeggiante, 2-5 μm, con nucleo eccentrico, dal bleferoblasto origina un flagello molto corto che non fuoriesce dalla cellula). Il vettore ciclico succhia il sangue da un soggetto infetto ingerendo anche cellule del sistema
(da www.leishmania.org) (da www.leishmania.org) Amastigote Amastigote Amastigote Amastigote
reticolo istiocitario (SRI) contenenti parassiti in forma amastigote. Nel canale alimentare dell’insetto, gli amastigoti si trasformano in promastigoti (corpo fusiforme, 20 μm di lunghezza, nucleo centrale, bleferoblasto con lungo flagello anteriore) che si moltiplicano per scissione binaria e quindi migrano verso l’apparato buccale ove ha luogo la trasformazione in promastigoti metaciclici, altamente mobili. La trasmissione ad un nuovo ospite avviene al momento della puntura: i promastigoti, introdotti nell’organismo, entrano in circolo e penetrano nei macrofagi; il parassita può riuscire ad inibire almeno in parte la risposta immunitaria del vertebrato in cui, quindi, si sviluppa la malattia.
Il quadro clinico è straordinariamente variabile: i cani colpiti dalla malattia possono presentare ridotta resistenza all’esercizio, astenia, dimagramento, sonnolenza, polidipsia, anoressia o polifagia, diarrea, vomito, epistassi, melena, scolo nasale e tosse, zoppie da polimiositi e artrosinoviti, linfoadenopatia e splenomegalia; alla visita clinica le lesioni cutanee sono tra quelle più frequentemente rilevate ed includono: dermatite esfoliativa (amiantacea), ulcere, onicogrifosi, alopecia focale soprattutto sulla testa, mantello secco e opaco, dermatiti pustolose, eritemi, depigmentazioni, ipercheratosi del naso e dei cuscinetti plantari.
Una delle maggiori cause di morte dei soggetti colpiti è l’insufficienza renale dovuta a glomerulonefrite da immunocomplessi o l’insufficienza epatica.
La grande varietà del quadro clinico rende la malattia alquanto subdola, potendo anche decorrere in maniera asintomatica, ma non per questo meno pericolosa.
(da www.leishmania.org) Pro
Pro Pro
L. infantum
nell’uomo può dare due forme cliniche distinte: la cutanea e la viscerale. Poiché il sistema immunitario nel bambino è ancora in formazione, la malattia è particolarmente pericolosa in questa categoria, dove assume la forma viscerale; nell’adulto è accompagnata da sintomi lievi e si osserva soprattutto nella forma cutanea, eccetto che negli immunodepressi o nei malati da HIV in cui può essere facilmente mortale.Di Martino
et al.
(2004) riportano 255 casi di leishmaniosi umana in 14 anni, in giovani pazienti, osservati nell’ospedale di Santobono a Posillipo (Napoli); in Italia l’incidenza della zoonosi era diminuita nel trentennio successivo alla seconda guerra mondiale, per poi reincrementare negli anni ’80. In Sicilia Cascioet al.
(1997) hanno riportato 284 infezioni umane dal 1987 al 1995, circa 31,5 casi l’anno, 150 in bambini e 134 in adulti, tutti mostranti la forma viscerale. Trentanove (29%) degli adulti erano affetti da HIV, di questi nessuno ha sconfitto la malattia, ma è difficile attribuire i decessi a leishmaniosi, data l’alta incidenza di altre complicazioni/ infezioni riferibili alla immunodeficienza acquisita. Nel 2002, un lavoro di Cascioet al.
evidenzia la forma viscerale di leishmaniosi in 111 bambini dal 1980 al 2000.Minodier
et al.
(1998) riportano 59 casi di bambini con leishmaniosi (dal 1981 al 1997) nel sud della Francia.Baldi
et al.
(2004) asseriscono che il pericolo di zoonosi non si ha solo in zone dove la patologia è ormai endemica: in regioni come la Campania, la malattia ha un costante incremento dovuto a vari fattori, non ultimi il riscaldamento globale del pianeta che offre un habitat particolarmente gradito al vettore, l’incremento del randagismo, il maggiore movimento di cani e della popolazione, l’aumento degli immunodepressi e di persone anziane tra gli abitanti; alcuni autori, infatti, sottolineano l’incremento della leishmaniosi nel nord Italia, rilevabile anche dalla maggiore presenza diPhlebotomus
perniciosus
nel territorio, indispensabile veicolo per la trasmissione del pericoloso protozoo (Capelliet al.
, 2004).Una pubblicazione del 2007 (Tsachev
et al.
) riporta uno studio effettuato in Bulgaria, nazione geograficamente molto vicina alla Romania. Dalle indagini sierologiche per la ricerca di anticorpi controLeishmania
condotte su 220 cani di proprietà, sorprendentemente non è stato ottenuto alcun positivo nonostante la presenza del vettore nel territorio, ciò potrebbe essere dovuto alla buona cura dei proprietari, attenti a proteggere i proprie animali da eventuali pinzature, o dovuto alla predilezione del flebotomo verso altre specie rispetto al cane.
Risulta evidente che per il perpetuarsi della parassitosi è necessario il vettore nell’ambiente; vista la grande diffusione del flebotomo, si pensa possibile la sua presenza anche nell’area studiata per cui si presuppone che vi sia la leishmaniosi.
La ricerca della
Leishmania
si è resa interessante dalle osservazioni fatte nel primo viaggio a Cernavodă, compiuto nel febbraio 2005: molti animali presentavano problemi cutanei molto seri, sospette rogne, per giunta non diagnosticabili per l’assenza degli strumenti necessari, ma che potevano clinicamente indirizzare verso la patologia in esame, visto che anche nell’Italia settentrionale fino ad alcuni decenni fa la malattia era sconosciuta e molte dermatiti trattate esclusivamente come tali, ma senza risultati.La certezza della presenza o assenza del protozoo in Romania è determinante e molto importante anche per l’associazione che opera a Cernavodă e dintorni: nel piano di difesa degli animali vi è anche il progetto di adozioni internazionali, molti cani sono già emigrati verso l’Italia, l’Olanda, la Svezia ed altri stati europei; nei paesi nordici, ritenuti veramente indenni da
Leishmania
, potrebbe rappresentare un problema introdurre animali infetti per cui si renderebbe indispensabile il testare tutti i cani in volo verso queste nazioni.La demodicosi La demodicosiLa demodicosi La demodicosi
La demodicosi è una malattia parassitaria ed infiammatoria della cute di cane e gatto, conseguenza dell’incapacità da parte del soggetto di controllare la moltiplicazione e la crescita del
Demodex canis
, saprofita permanente di follicoli piliferi e ghiandole sebacee.Fattori favorenti lo scatenarsi della malattia sono: la predisposizione genetica, l’età, difetti di risposta immunologica dell’ospite, stress ambientali, denutrizione, gravidanza, estro, lattazione, dermatiti seborroiche, malattie concomitanti e trattamenti farmacologici con immunosoppressori (es. corticosteroidi).
Per LeMarie
et al.
, 1996 tra le razze maggiormente a rischio figurano lo Shar Pei, Lhasa Apso, Rottweiler, West Highland white terrier, Bulldog inglese, Shih Tzu ed il Barboncino, mentre meticci, Cocker spaniel, Labrador e Pastore tedesco sarebbero non a rischio, per Corazza (2003) invece, i soggetti più suscettibili di malattia sono il Doberman, Boxer, Pastore tedesco ed il Carlino. E’ probabile che la differenza di osservazione sia legata alla maggiore o minore presenza di talune razze nelle aree geografiche oggetto di rilievo, legate anche alle mode del momento.La ragione per cui in alcuni soggetti la malattia si rende conclamata, non è ancora del tutto chiara: si presuppone che in questi individui sia presente un fattore serico che porta a soppressione linfocitaria, tuttavia questa è influenzata anche da infezioni batteriche secondarie, di conseguenza s’ipotizza che il
Demodex
e le piodermiti secondarie provochino soppressione linfocitaria che consente l’eccessiva proliferazione dei parassiti.Gothe (1989) suggerisce la prevalenza di
Demodex
in soggetti con pregressa immunodepressione da cause primarie (ad esempio un difetto ereditario delle T-cell) e secondarie (iperadrenocorticismo, trattamenti con corticosteroidi, …); Saridomichelakiset al.
(1999) riportano demodicosi generalizzata in duesoggetti, di cui uno affetto da iperadrenocorticismo diagnosticato e l’altro con sospetto ipotiroidismo.
Nel 1994 Duclos
et al
. hanno esaminato 41 cani con demodicosi generalizzata, di questi 8 avevano un iperadrenocorticismo, 5 ipotiroidismo (sospetto o confermato), 10 erano soggetti allergici trattati con cortisonici e 6 avevano subito chemioterapia perché affetti da neoplasie maligne.Barriga
et al.
(1992) hanno osservato 9 cani di razza Beagle dei quali 3 clinicamente sani, 3 con demodicosi localizzata ed i rimanenti con generalizzazione della malattia: dagli studi effettuati il risultato ottenuto, è che l’immunosoppressione segue piuttosto che precedere le manifestazioni di demodicosi generalizzata ed ipotizzano che il fenomeno di depressione del sistema immunitario sia indotto dal parassita o dalla reazione dell’ospite.Mozos
et al.
(1999) hanno analizzato tre cani con leishmaniosi e demodicosi generalizzata: in due dei soggetti,Demodex
ed amastigoti sono stati reperiti dalle stesse lesioni, in queste vi era un grande numero di macrofagi, dei quali, in misura minore, qualcuno presentava al suo interno la forma amastigotica del protozoo. Gli studiosi hanno supposto che l’immunosoppressione cellulo-mediata indotta daLeishmania
, sia fattore predisponente per la manifestazione di demodicosi generalizzata.La demodicosi viene suddivisa in giovanile, se osservata entro i 12-18 mesi di età, e dell’età adulta, se l’esordio avviene dopo i 2-4 anni.
A sua volta la malattia può manifestarsi localmente o in maniera generalizzata, carattere importante per impostare un adeguato piano terapeutico.
Nelle forme localizzate le aree maggiormente interessate sono la zona perioculare, le labbra e gli arti anteriori.
Segni clinici classici di demodicosi sono alopecia, eritema, scaglie, iperpigmentazione, comedoni, piodermatite secondaria, prurito (più spesso legato alle infezioni secondarie che s’instaurano sulle lesioni) e, nelle forme sistemiche, possibile coinvolgimento dello stato generale con ipertermia,
linfoadenopatia, depressione e anoressia. Anche l’odore che l’animale emana può indirizzare a ricercare il parassita.
Una pubblicazione del 2003 di Rodriguez-Vivas
et al.
riporta la loro esperienza su 200 randagi analizzati nello Yucatán su cui sono stati effettuati 4 raschiati (testa, torace-addome, arti ed orecchie): il 34% presentavaDemodex canis
, il 7%Sarcoptes scabiei
ed il 3,5%Otodectes cynotis
.La malattia non è di per sé grave, si assiste spesso ad una remissione dei sintomi e ad una guarigione spontanea, ma la ricerca di questa parassitosi risulta importante per la diagnosi differenziale di patologie ben più preoccupanti quali leishmaniosi, pemfigo foliaceo, endocrinopatie e linfoma epiteliotropo.
Repertare al raschiato cutaneo la presenza di
Demodex
, non è indice di malattia: talvolta in soggetti sani è possibile riscontrare qualche acaro, ma per parlare di infestazione in fase attiva, è necessaria la presenza di numerosi parassiti con un’alta percentuale di larve e ninfe (Urquartet al
., 2002)La demodicosi, a differenza d’altre rogne come quelle sostenute da
Sarcoptes
scabiei
, non ha carattere di zoonosi per cui non rappresenta un pericolo per l’uomo che convive con un soggetto infetto.Le dermato Le dermatoLe dermato Le dermatofitosifitosifitosifitosi
Le micosi possono essere distinte sulla base del distretto colpito, in superficiali e profonde, le prime colpiscono l’apparato tegumentario o le prime vie dei diversi organi ed apparati, le seconde riescono a superare molte barriere protettive, a penetrare nell’organismo e provocare patologie ben più gravi. Tra le micosi superficiali figurano le dermatofizie, affezioni della cute causate da funghi cheratinofilici dei generi
Microsporum
,Trichophyton
edEpidermophyton
.
Per dermatofiti s’intendono quei funghi, tassonomicamente correlati, che hanno affinità per i tessuti cheratinizzati quali epidermide, peli, piume, corna e unghie (cheratinofili); la maggior parte di questi organismi è cheratinolitica, ossia in grado di digerire enzimaticamente la cheratina.
A fianco di questi funghi, si trovano gli pseudodermatofiti (ad esempio funghi del genere
Alternaria)
, così chiamati per la loro somiglianza con i dermatofiti, ma che non necessariamente cresconocome cheratinofili sul terreno, ed i miceti cheratinofili, ad esempio i
Chrysosporium
, che vivono come geofili nutrendosi di esche cheratinizzate presenti sul terreno. I dermatofiti si distinguono a loro volta in: geofili, abitanti cosmopoliti del suolo ove decompongono detriti cheratinici; in zoofili che parassitanoin primis
gli animali; in antropofili, miceti dell’uomo, che hanno spettro d’ospite molto ristretto.Le specie zoofile ed antropofile hanno tre diversi modelli di distribuzione: alcuni zoofili sono limitati ad un determinato spettro d’ospite, certi
antropofili hanno una distribuzione geografica marcata, altre specie sono invece ampiamente distribuite, ma con varianti proprie di alcune regioni.
Le specie di dermatofiti più importanti nei nostri animali sono
Microsporum
canis, Microsporum gypseum
eTrichophyton mentagrophytes
.Non tutti gli individui hanno la stessa possibilità di contrarre l’infezione, ciò dipende da fattori predisponenti quali:
⋅ l’età, soggetti maggiormente a rischio sono cuccioli ed anziani; ⋅ la razza
⋅ il clima, dal momento che la germinazione delle spore è termodipendente ⋅ l’esposizione al sole che può inibire la stessa germinazione;
⋅ l’immunosoppressione ⋅ la scarsa nutrizione
⋅ la presenza di ectoparassiti che inducono l’animali a grattarsi, trasportando le spore
⋅ patologie cutanee e disendocrinie
⋅ l’ambiente e la popolazione nel territorio.
La patologia ha inizio con l’adesione delle artrospore ai cheratinociti della cute, su cui germinano. Le ife proliferano nello strato corneo ed invadono il pelo spostandosi verso il follicolo pilifero; la cheratinasi favorisce la penetrazione nella corteccia del pelo.
Pelo spezzato ed alopecia sono indotti dalla rottura del pelo infetto quando raggiunge la cute; l’ipercheratosi e la desquamazione dalla presenza e moltiplicazione del micete nello stato corneo e dalla reazione dell’ospite.
Nella forma classica la lesione tende ad accrescersi per 2-4 settimane, quindi i peli ricrescono e tornano normali, mentre nuove lesioni nascono.
Le forme molto infiammate tendono più facilmente a risolversi spontaneamente poiché, minore è la risposta infiammatoria dell’ospite, maggiore è la sopravvivenza della malattia su quell’animale.
Le lesioni si localizzano maggiormente sulla testa e linea superiore del corpo per poi interessare tutta la superficie corporea.
I segni clinici possono essere vari in quanto legati al tipo di rapporto fungo-ospite e dal grado d’infiammazione.
Il prurito è generalmente assente, ma può essere anche ben manifesto, soprattutto nelle infezioni da
Trichophyton mentagrophytes
.Germi d’irruzione secondaria possono complicare le lesioni da dermatofiti. In molti animali la malattia può decorrere in maniera asintomatica.
Da vari studi (Mancianti
et al.
2002, Cafarchiaet al.
2004, Faggi 1987, Aho, 1980) condotti su popolazioni canine e feline in diverse parti d’Italia e d’Europa, risulta una netta prevalenza tra i dermatofiti diMicrosporum canis
(fino al 90%), seguono
Trichophyton mentagrophytes
eMicrosporum
gypseum
.Microsporum canis
è molto più frequente nel gatto rispetto al cane: il gatto è spesso portatore asintomatico dell’infezione, espressione del grande adattamento aM. canis
che permette al fungo di essere veicolato nell’ambiente.Occorre ricordare che le dermatofizie sono infezioni trasmissibili all’uomo e possono quindi rappresentare un interrogativo nella salute pubblica. Spesso i maggiori untori sono proprio gli animali asintomatici in cui la malattia non si può considerare autolimitante.
L’eliminazione delle spore nell’ambiente è fonte di reinfezione in soggetti guariti, di contagio in animali già sani e nell’uomo.
Nella specie umana risultano maggiormente suscettibili all’infezione le parti esposte come capelli, faccia, barba e braccia e le zone più umide quali inguine, piedi e ascelle. Le regioni glabre sono le più interessate da lesioni eritematose circolari. Capelli, sopracciglia e ciglia vengono principalmente colpite nei bambini con placche eritematose e scaglie. Di minor reperto sono lesioni papulo-pustolose (kerion) con follicolite profonda e perifollicolite che evolvono in lesioni bottoniformi. Talvolta si possono osservare prurito, linfoadenopatia e febbre.
Occorre quindi porre una certa attenzione laddove le popolazioni felina e canina sono molto consistenti: nell’ambiente le spore sopravvivono per almeno 18 mesi, fino a 30 se al riparo da raggi ultravioletti e se protette da materiale organico o inorganico.
In soggetti come i randagi, in cui il sistema immunitario può essere depresso o comunque continuamente impegnato e la cute soggetta ad insulti perenni che rimuovono le naturali barriere protettive, la diffusione delle dermatofitosi potrebbe essere più ampia, la disseminazione di spore maggiore e di conseguenza la zoonosi potrebbe assumere più rilevanza.
Affezioni da Affezioni da Affezioni da
Affezioni da
Malassezia
Malassezia
Malassezia
Malassezia
I lieviti del genere
Malassezia
sono comuni saprofiti della cute di uomo ed animali; se ne conoscono 11 specie, di cui 10 lipido-dipendenti ed una sola,M.
pachydermatis
, lipido-indipendente che può agire come agente opportunistico sulla cute dell’ospite (Batraet al.
, 2005).Normalmente
M. pachydermatis
si ritrova sulla pelle senza dare patologia, ma l’infezione può sfociare in malattia quando alcuni fattori predisponenti permettono al commensale di divenire patogeno; tra questi si annoverano: l’umidità (laMalassezia
predilige climi e sedi di localizzazione umidi, come orecchie, ascelle, inguine), la presenza di piaghe cutanee, predisposizione genetica (razze quali Basset hound, Cocker spaniel americano, Setter inglese, Shih Tzu, West Highland white terrier, sono maggiormente colpite da questa infezione) (Mauldinet al.
, 1997), disponibilità di fattori per la crescita del lievito. Su 45 cani affetti da diabete mellito, Peikeset al.
(2001) hanno osservato otiti (58%) e dermatiti (42%) provocate daMalassezia
, il 78% dei soggetti avevano un’anamnesi di allergie, trattamenti prolungati con glucocorticoidi, iperadrenocorticismo e disordini tiroidei.Il reperto di
Malassezia
non è di per sé clinicamente significativo, è necessario un suo isolamento massiccio in concomitanza di segni clinici, per poter parlare di malattia.Generalmente la dermatite da
Malassezia
è indotta da disordini cutanei che alterano in qualche modo l’equilibrio della cute. Dermatiti atopiche, seborrea piodermiti, disordini endocrini (Scottet al.
, 1995; Guillotet al.
, 1998; Mason e Stewart, 1993; Mauldinet al.
, 1997), possono provocare un’infiammazione che incrementa la produzione di sebo ed altera il microambiente cutaneo con aumento dei lipidi superficiali; su queste condizioni può crescere e moltiplicarsi il lievito che aggrava la malattia e la sintomatologia data dall’affezione primaria e ne permette il suo perpetuarsi (Bondet al.
, 1996).La modalità di azione patogena dei lieviti non è ancora del tutto nota, Hay (1992) ha osservato che l’adesione alle cellule dello strato corneo dell’epidermide, permette al lievito di resistere ai meccanismi di difesa cutanea. Masuda
et al.
(2001) affermano che l’attacco diMalassezia pachydermatis
alle cellule epiteliali cornificate è mediato da lipidi.Secondo Morris (1999), Scott e Miller (1995), Guillot e Bond (1999), le cause che permettono la trasformazione del saprofita in patogeno, sono legate a fattori chimici e fisici che determinano, appunto, un’alterazione del microclima cutaneo. La proliferazione nei siti d’infezione, per Gustafson, 1955 e Uchida
et al.
, 1992, sembra essere condizione necessaria per l’instaurarsi della patologia.L’attività lipasica, osservata in vitro da Catterall
et al.
, 1978 e Ranet al.
, 1993, è dovuta ad enzimi presenti nelle cellule, tali lipasi scindono i lipidi di superficie a lunga catena in acidi grassi a corta catena molto irritanti, soprattutto a livello del condotto auricolare.La fosfolipasi, prodotta in vitro, permette la sintesi, da parte di
Malassezia
, di acido arachidonico, precursore di prostaglandine e leucotrieni che innescano un processo infiammatorio responsabili di dermatiti e di varie manifestazioni cutanee (Plotkinet al.
, 1998).Inoltre lo zimogeno, componente della parete cellulare, attiva il complemento e scatena l’infiammazione ed il prurito (Reberg e Blakemore, 1999).
Malassezia pachydermatis
colonizza in particolar modo il condotto uditivo esterno ove l’umidità e la cattiva aerazione costituiscono unpabulum
ottimo per la moltiplicazione del lievito; orecchie lunghe e pendenti possono rappresentare l’ambiente ideale per tale patologia.Bond
et al.
(1998) hanno rilevato che nel 36% delle orecchie di cani sani si ritrova questo lievito, la percentuale aumenta fino al 76% in quegli animali che presentano un’otite e quindi suppongono cheStaphylococcus
spp, agente causale di molte affezioni auricolari, produca fattori capaci di stimolare lacrescita della
Malassezia
. In uno studio del 2002, Dorogi rileva la frequente associazione in tamponi auricolari diMalassezia pachydermatis
eStaphylococcus intermedius
. In un lavoro di Breitweiser (1997) su 212 tamponi auricolari effettuati da cani con otite esterna, solo 11 (5,18%) erano sterili, nel 72,1% è stata ottenuta la crescita diMalassezia pachydermatis
associata a batteri (associazione conStaphylococcus
spp. nel 31,8% dei casi), nel 21,9% in coltura pura.Trattamenti con antibiotici possono predisporre a superinfezioni da
Malassezia
: Mansfieldet al.
nel 1990 hanno dimostrato che il lievito diventa patogeno quando un antibiotico o un liquido sono immessi nel condotto auricolare; il meccanismo patogenetico è probabilmente da porre in relazione con i sottoprodotti metabolici della crescita e degenerazione dei lieviti.Dal confronto tra vari lavori eseguiti da diversi studiosi, si ricava che i dati ottenuti per la ricerca di
Malassezia pachydermatis
in soggetti con e senza otite, sono pressoché concordanti; Crespoet al.
(2002), Nardoniet al.
(2004), Cafarchiaet al
, (2005), Nardoniet al.
(2004) hanno ottenuto risultati piuttosto sovrapponibili: la positività si ha nel 40-63% del totale degli esaminati, nel 37-67% di soggetti con otite pregressa o altre affezioni cutanee e nel 17-51% di individui dermatologicamente sani è stato isolato il lievito in causa.Nel già citato studio, Cafarchia
et al.
(2005) hanno repertato che gli animali colpiti, nella maggioranza dei casi, avevano età inferiore ai 5 anni, nei gattiMalassezia
era osservata soprattutto in inverno, mentre nei cani in autunno; cani con orecchie pendule erano i più soggetti all’infezione in causa.Nel lavoro del 2005, Nardoni
et al
. hanno osservato che tre dei gatti esaminati e positivi, presentavano l’associazione di piùMalassezia
(Malassezia
pachydermatis
,M. globosa
eM. furfur
in 2 casi,M. pachydermatis
,M.furfur
eGirão
et al
. (2005) hanno effettuato tamponi da orecchie con otite (57,53% positivi), dai controlaterali, sani, di orecchie con otite esterna (14,29% positivi) e da orecchie senza alcuna visibile patologia (30% positivi); nel loro lavoro hanno osservato prevalenze di razze: il barboncino figurava il più predisposto a otite esterna sintomatica daMalassezia pachydermatis
, il pastore tedesco era la razza maggiormente affetta da tale lievito senza mostrare segni di alcunché patologia.Uchida
et al.
(1992) hanno sperimentalmente inoculato le orecchie di 8 beagle conMalassezia pachydermatis
al fine di indurne un’otite esterna: dopo 3-4 giorni, i soggetti hanno cominciato a mostrare sintomi di otite quali scuotimento della testa e arrossamento del canale auricolare, a conferma cheMalassezia
è in grado di indurre otite esterna; lo studio era rivolto alla conferma dell’efficacia della pimaricina nel trattamento delle otiti da lieviti. Morris (1999) suggerisce l’importanza di una giusta diagnosi eziologica laboratoriale in corso di otite, al fine di meglio affrontare la patologia e la successiva terapia.Poiché la
Malassezia
non sembra avere una netta specie specificità, si presuppone un probabile passaggio tra le varie specie con possibile contagio anche dell’uomo. Guéhoet al .
(1987) riportano 15 casi umani osservati, dal 1984 al 1987, in cui è stata isolataMalassezia pachydermatis
da pelle, essudato e sangue di bambini ed adulti immunocompromessi. Morriset al.
(2005) sottolineano l’importanza di una buona igiene personale nei proprietari di cani e specialmente per le persone che lavorano in ospedali:M. pachydermatis
può essere veicolata tramite le mani ed è potenzialmente patogena per i soggetti immunodepressi e nei neonati prematuri, maggiori misure igieniche andrebbero prese laddove i cani sono impiegati come strumento di pet teraphy in reparti oncologici pediatrici. Fanet al.
(2006) riportano l’isolamento diMalassezia pachydermatis
da granuloma facciale in una donna convivente con un cane , anch’esso positivo alla ricerca del lievito in causa.Tra le varie specie del lievito in esame si ha anche
M. furfur
, lipido-dipendente e propria dell’uomo. Dato che è stata isolata anche nel cane, ciò avvalora l’ipotesi del contagio tra specie diverse, possibilità ritenuta inaccettabile fino a pochi anni fa.Le parassitosi intestinali Le parassitosi intestinaliLe parassitosi intestinali Le parassitosi intestinali
Elmintiasi e infestazioni protozooarie sono di facile riscontro alla visita clinica degli animali o osservazione riportata dai proprietari; nei nostri ambienti hanno importanza relativa essendo trattabili con i comuni vermifughi, assumono, invece, carattere diverso nel cucciolo massicciamente infestato e non curato, potendo determinare gravi enteriti che compromettono l’assorbimento delle sostanze nutritive. E’ quindi necessario assicurarsi dell’assenza di tali parassiti prima di eseguire le normali vaccinazioni.
Da non sottovalutare è la possibilità di veicolare anche all’uomo le patologie da parassiti intestinali.
Protozoi intestinali
Agenti casuali d’infestioni protozoarie intestinali nel cane e nel gatto possono essere varie, tra queste si annoverano la giardiasi, la criptosporidiosi e le coccidiosi da
Isospora
.In questo lavoro saranno prese in esame le isosporiasi, di facile reperto soprattutto nei cuccioli.
L’
Isospora
(sin.Cystoisospora
) ha un ciclo biologico diretto: il contagio si ha con l’ingestione di oocisti mature che danno luogo ad una fase intestinale con comparsa, dopo una prepatenza di 10-15 giorni, di oocisti immature che vengono espulse con le feci. Nell’ambiente esterno avviene la loro maturazione e sporulazione e nuovi ospiti recettivi possono infettarsi.La sintomatologia è particolarmente grave nei cuccioli in cui si osserva diarrea, feci mucose e sanguinolente (enterite catarrale o emorragico-necrotico), anemia, dimagramento e, in casi iperacuti, morte (Urquart
et al.
; 2002).Le feci rappresentano il miglior strumento di trasmissione del parassita; il ciclo vitale del parassita è normalmente diretto anche se il rapporto predatore-preda può giocare un certo ruolo: i cani possono acquisire l’infezione dai tessuti di
roditori portatori di parassiti in stadi asessuati; infatti i roditori possono ingerire oocisti eliminate da cani e gatti, contrarre l’infezione e fungere da serbatoi (senza che si verifichi la forma sessuata).
L’ingestione di oocisti mature si traduce nella liberazione di milioni di merozoiti che possono distruggere aree intere di mucosa intestinale con superficializzazione della sottomucosa; per l’azione traumatica del bolo solido verso i capillari, si hanno processi emorragici: le feci mostreranno la presenza di sangue, melena se è colpito l’intestino tenue, sangue vivo se la localizzazione è a livello del grosso intestino.
Elmintiasi intestinali
La patogenicità degli elminti (cestodi, nematodi e trematodi) è legata alla loro azione meccanica, traumatica, spoliatrice e tossica.
Il più importante veicolo di quest’infezione è la contaminazione ambientale mediante feci di soggetti ammalati.
Le elmintiasi sostenute da cestodi sono rappresentate da infestazioni da parassiti delle famiglie
Taenidae
,Mesocestoididae
,Dilepididae
eDiphyllobothridae
.Segni clinici di teniasi sono dimagramento, anemia, polifagia, diarrea anche emorragica, feci non ben conformate, prurito anale e talvolta coliche addominali; raramente la malattia si manifesta clinicamente, generalmente decorre in maniera asintomatica e ciò soprattutto in quei soggetti largamente nutriti in cui la tanta fame viene sopperita da un aumento di cibo da parte del proprietario.
A seconda della specie di cestode in causa, la malattia può assumere caratteri importanti per la salute umana: l’echinococcosi/idatidosi è una parassitosi potenzialmente letale nell’uomo trasmessa da una piccola tenia del cane,
Echinococcus granulosus
. Il cane elimina con le feci le proglottidi che contaminano il terreno; l’ospite intermedio, ruminante o uomo, si infestatramite ingestione delle proglottidi liberate con le feci e che contengono uova. Più spesso sono in causa canidi selvatici, randagi e cani pastori; le uova sono molto resistenti agli agenti atmosferici e rimangono vitali nell’ambiente per oltre un anno. A livello intestinale e sotto l’azione di enzimi digestivi e sali biliari, dalle uova fuoriesce una larva esacanta che, penetrata nella parete intestinale, raggiunge con la via ematica il fegato e, tramite il circolo sistemico, può raggiungere qualsiasi distretto e maggiormente il polmone, sede frequente del parassita. Ovunque si trovi, la larva esacanta subisce un lento sviluppo a cisti idatidea; questa aumenta di volume causando per compressione, una disfunzione d’organo. La rottura della ciste può essere fatale per l’ospite o, se questo sopravvive, nuove cisti figlie si formano con grande aggravamento della parassitosi. Il cane si reinfesterà ingerendo carni infette, cani di pastori che ancora effettuano una macellazione familiare e randagi che si cibano di carogne sono il più grande serbatoio della parassitosi.
Educazione igienico-sanitaria degli allevatori, educazione dei consumatori, scrupolose ispezioni dei visceri al macello, trattamenti sistemici dei cani e la lotta al randagismo, sono il più efficace strumento di controllo e di eliminazione della parassitosi.
Tra i nematodi di interesse per i nostri carnivori, troviamo
Toxocara canis,
Toxascaris leonina, Ancylostoma caninum, Uncinaria stenocephala
eTrichuris
vulpis
, parassiti dell’intestino tenue eccettoTrichuris
che si localizza nel grosso intestino.Toxocara canis
è un parassita molto frequente nei nostri animali. A differenza diToxascaris leonina
in cui non si assiste alla migrazione e lo sviluppo dell’adulto avviene interamente nella parete e nel lume intestinale,T. canis
ha un ciclo vitale piuttosto complesso e un’evoluzione clinica diversa a seconda dell’infezione che causa. In condizioni ottimali, l’uovo presente nelle feci e contenente L2, diviene infestante. Dopo l’ingestione e la schiusa, le L2 migrano per via ematica al fegato e al polmone, dove avviene la seconda muta; risalitol’albero respiratorio, le L3 ritornano all’intestino dove si hanno le ultime due mute.
Nei cani oltre i tre mesi di vita, la migrazione tracheo-enterale avviene meno frequentemente e non è più presente dopo il sesto mese di età: in questi individui le L2 migrano a vari tessuti e organi quali fegato, polmone, cervello, cuore, muscolo e parete intestinale. Nelle femmine gravide, le larve si mobilitano e raggiungono il polmone del feto dove mutano a L3 (infezione prenatale). Dopo la nascita le L3 riprendono la migrazione e raggiungono l’intestino. , Nella femmina gravida alcune larve, raggiungono l’intestino, per cui, alcune settimane dopo il parto, la cagna eliminerà le uova con le feci e potrà infestare maggiormente i cuccioli. Ulteriore fonte della parassitosi nel cucciolo è rappresentata dalle L3 eliminate dalla madre durante la lattazione. L’ingestione da parte di ospiti paratenici di L2 può essere serbatoio per l’infestazione: le larve si localizzano in organi e tessuti di tali ospiti e riprenderanno il loro ciclo di sviluppo quando il cane ingerirà l’ospite paratenico. Nelle infestazioni di lievi entità, la fase migratoria comporta modificazioni minime ai tessuti e gli adulti provocano modeste reazioni a livello intestinale. Nelle infestazioni più gravi la fase di migrazione nel polmone è accompagnata da sintomi di polmonite; gli adulti possono indurre enteriti mucide con parziale o totale ostruzione del lume intestinale, provocare estensione dell’addome (addome a botte), rallentamenti di crescita e talora diarrea. Nelle forme gravi, i danni conseguenti alla migrazione possono indurre tosse, dispnea, presenza di muco nasale; esiti letali possono aversi durante la fase polmonare e pochi giorni dopo la nascita in cuccioli infettatisi per via transplacentare. Sembra che durante la migrazione, le larve possano localizzarsi anche a livello cerebrale.
L’uomo può entrare in contatto con uova larvate di ascaridi, ma la sola esposizione ad ambienti contaminati non è sufficiente a determinare l’infestazione; fonti di contagio possono essere la scarsa igiene o l’assunzione di
vegetali lavati male o poco cotti. Nella specie umana, così come in altri ospiti non propri, le larve eseguono una migrazione entero-epato-polmonare e somatica con localizzazione nei vari visceri e organi (fegato, polmone, reni, encefalo, occhio, milza, pancreas, cuore e muscoli).
Gli ascaridi possono essere implicati nella cosiddetta
larva migrans
viscerale e oculare nell’uomo, infestatosi tramite ingestione di uova presenti nel terreno e nell’ambiente. I bambini sono i soggetti più esposti all’infezione e soprattutto quelli nella cui anamnesi sono riportati atteggiamenti di pica.Larva migrans
viscerale è riportata in bambini di età compresa tra 1 e 4 anni e spesso esordisce con calo di peso, malessere generale, febbre, seri disturbi polmonari con bronchioliti ed asma. Può essere colpito anche il sistema nervoso (convulsioni, disordini psichici, encefaliti), spesso questa localizzazione, come quella miocardia, conduce il soggetto a morte.
Larva migrans
oculare è solitamente diagnosticata in bambini più grandi (7-8 anni), spesso unilaterale, si manifesta con calo della vista e strabismo.Scott Weese, Peregrine ed Armstrong (2002) riportano i risultati di un’indagine condotta negli Stati Uniti d’America: su 8457 persone sierologicamente analizzate per la ricerca di anticorpi contro gli ascaridi, il 2,8% è risultato positivo.
Le L3 di ancylostomi sono invece coinvolte nella sindrome da
larva migrans
cutanea in cui si rilevano sulla cute dell’uomo colpito, tragitti serpiginosi, pruriginosi, eritematose, causati dalla larva, presente nell’ambiente, durante la sua migrazione nel sottocute.Larva migrans
cutanea è associata adAncylostoma caninum
,A. braziliense
e meno frequentemente aUncinaria
. Maggiore fattore di rischio è la frequentazione di aree contaminate dalle larve, come spiagge e sabbiere di parchi gioco frequentate anche da animali. Biolcatiet al.
(1997) riportano l’infezione dalarva migrans
cutanea in un atleta di beach volley, probabilmente infettatosi durante una partita sulla spiaggia.Generalmente il parassita rimane nella cute per 2-8 settimane, in alcuni casi anche per tempi superiori all’anno (Esser
et al.,
1999); Richeyet al
. (1996) riportano il caso di persistenza del parassita per 2 anni nel follicolo pilifero di un uomo, refrattario a trattamento topico con tiabendazolo, è stato poi eliminato con terapia orale a base dell’antiparassitario già impiegato.In aree con cani massicciamente parassitati dagli anchilostomidi, sono segnalate anche episodi di infezione, soprattutto nei bambini, con localizzazione intestinale del parassita: gli anchilostomi adulti non sono in grado di raggiungere la maturazione sessuale, ma possono causare enteriti eosinofiliche generalmente subcliniche e dolore addominale (Marx; 1991). Taranto
et al
. (2000) hanno studiato 98 bambini dei quali 36 presentavano eosinofilia spiccata:di questi il 20,4% presentava anticorpi attivi verso L2 diToxocara canis
e 9 bambini mostravano segni clinici cutanei riferibile alarva
migrans
cutanea, i pazienti vivevano a stretto contatto con cani le cui feci, nel 77,4% dei casi mostravano uova diAncylostoma caninum
.Trichuris vulpis
è agente patogeno in causa in altre parassitosi del cane: la maggior parte delle infestazioni decorre nei nostri animali in modo oligosintomatico se non addirittura asintomatico, ma in casi gravi si possono verificare infiammazioni a carico della mucosa del cieco dovute alla localizzazione subepiteliale delle larve. Nei soggetti recettivi è possibile osservare diarrea talvolta sanguinolenta.Dunn
et al.
(2002) riportano il caso di una donna, proprietaria di cinque cani, con diarrea cronica non trattabile: dopo vari ricoveri la diagnosi è stata di infestazione daTrichuris vulpis
; questo parassita è piuttosto raro in umana, più frequente èTrichuris trichura
, specie propria dell’uomo; gli autori suggeriscono che probabilmente, data la grande somiglianza tra i due parassiti, spesso l’infezione nell’uomo viene erroneamente riferita aT. trichura
.Dipylidium
è il cestode più comune del cane e del gatto e che raramente può parassitare anche l’uomo. Ospiti intermedi del parassita sono le pulci ed ipidocchi in cui si ritrovano i cisticercoidi. L’ospite definitivo si infesta tramite l’ingestione dell’insetto. L’infezione è spesso asintomatica e diverse centinaia di parassiti possono essere presenti senza provocare alcun disturbo intestinale, unico segno di dipylidiasi è frequentemente il forte prurito anale provocato dall’irritazione derivante dal movimento delle proglottidi espulse.
Nell’uomo la malattia è molto rara, ma possibile e riportata in letteratura da diversi autori (Brandstetter
et al
, 1994; Wijesunderaet al.
, 1989; Reidet al.
,1992; Jackson
et
al.
, 1997; Molinaet
al.
, 2003).Nel controllo delle infezioni da
Dipylidium
è dunque necessario impiegare i comuni antielmintici e controllare la presenza degli ospiti intermedi con gli opportuni trattamenti antiparassitari.Molti studi sono stati condotti in varie parti del mondo allo scopo di stimare l’entità e gli agenti in causa nelle parassitosi di cani e gatti, randagi o di proprietà, anche per un interesse verso la salute pubblica.
Nella tabella 1 riportiamo la prevalenza di parassiti intestinali nel cane rilevata da vari autori in diverse parti del mondo.
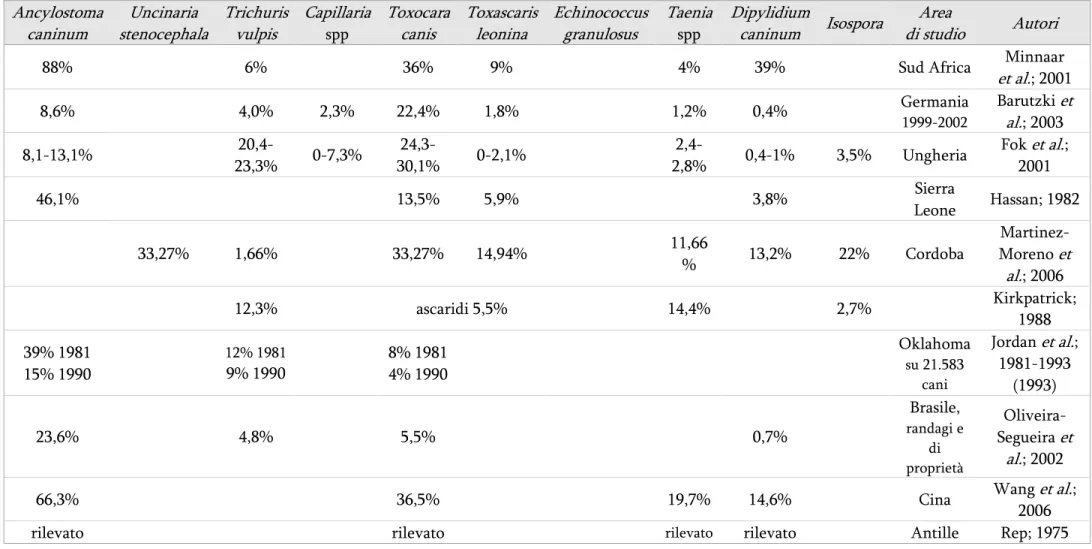
Tabella 1 Tabella 1Tabella 1
Tabella 1 – Prevalenza delle parassitosi intestinali nel cane secondo vari autori Ancylostoma caninum Uncinaria stenocephala Trichuris vulpis Capillaria spp Toxocara canis Toxascaris leonina Echinococcus granulosus Taenia spp Dipylidium caninum Isospora Area di studio Autori 3,61% 6,02% 32,53% 13,25% 65,06% 38,55% Iran, su randagi Dalimi et al.; 2006 14% 57% 33% Giordania 1978-‘80 Ajlouni et al.; 1984
72% ascaridi > 30% India Traub et al.;
2003 96,3% Uruguay, su randagi Malgor et al; 1996 23% 26% 9% 8% 1% Jamaica Robinson et al.; 1989 3% 2,6% 22,4% 1,3% 0,4% Salonicco Haralabidis et al.; 1988 13% 10% 11% 0,8% 15% Buenos Aires (2003-2004) Fontanarrosa et al; 2005 36,95% 8,69% 28,26% Nigeria Okalame 1985 58,1% 20,5 7,4% 4,4% 10% Bangkok Inpahkaew et al.; 2007 T. canis 43,5% ascaridi 21,3% 25,5% su randagi Seah et al.; 1975 62,5% 13,4% 4,2 2,5 60% Città del Messico Equía-Aquilar et al.; 2005
2,6% 0,2% 3,1% Finlandia Pullola et al.;
Tabella Tabella Tabella
Tabella 1111 – Prevalenza delle parassitosi intestinali nel cane secondo vari autori (segue) Ancylostoma caninum Uncinaria stenocephala Trichuris vulpis Capillaria spp Toxocara canis Toxascaris leonina Echinococcus granulosus Taenia spp Dipylidium caninum Isospora Area di studio Autori
88% 6% 36% 9% 4% 39% Sud Africa Minnaar
et al.; 2001 8,6% 4,0% 2,3% 22,4% 1,8% 1,2% 0,4% Germania 1999-2002 Barutzki et al.; 2003 8,1-13,1% 20,4-23,3% 0-7,3% 24,3-30,1% 0-2,1% 2,4-2,8% 0,4-1% 3,5% Ungheria Fok et al.; 2001 46,1% 13,5% 5,9% 3,8% Sierra Leone Hassan; 1982 33,27% 1,66% 33,27% 14,94% 11,66 % 13,2% 22% Cordoba Martinez-Moreno et al.; 2006 12,3% ascaridi 5,5% 14,4% 2,7% Kirkpatrick; 1988 39% 1981 15% 1990 12% 1981 9% 1990 8% 1981 4% 1990 Oklahoma su 21.583 cani Jordan et al.; 1981-1993 (1993) 23,6% 4,8% 5,5% 0,7% Brasile, randagi e di proprietà Oliveira-Segueira et al.; 2002
66,3% 36,5% 19,7% 14,6% Cina Wang et al.;
2006
Tabella Tabella Tabella
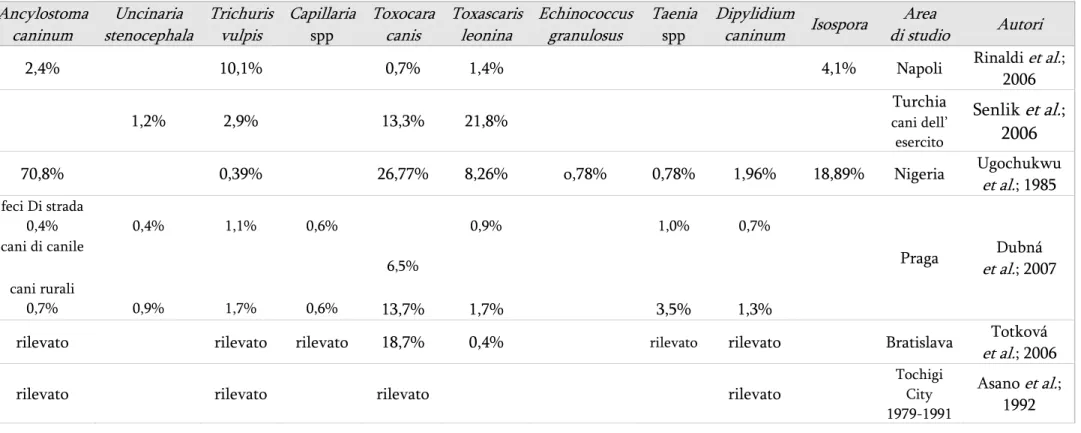
Tabella 1111 - Prevalenza delle parassitosi intestinali nel cane secondo vari autori (segue) Ancylostoma caninum Uncinaria stenocephala Trichuris vulpis Capillaria spp Toxocara canis Toxascaris leonina Echinococcus granulosus Taenia spp Dipylidium caninum Isospora Area di studio Autori
2,4% 10,1% 0,7% 1,4% 4,1% Napoli Rinaldi et al.;
2006 1,2% 2,9% 13,3% 21,8% Turchia cani dell’ esercito Senlik
et al.
; 200670,8% 0,39% 26,77% 8,26% o,78% 0,78% 1,96% 18,89% Nigeria Ugochukwu
et al.; 1985 feci Di strada 0,4% 0,4% 1,1% 0,6% 0,9% 1,0% 0,7% cani di canile 6,5% cani rurali 0,7% 0,9% 1,7% 0,6% 13,7% 1,7% 3,5% 1,3% Praga Dubná et al.; 2007
rilevato rilevato rilevato 18,7% 0,4% rilevato rilevato Bratislava Totková
et al.; 2006
rilevato rilevato rilevato rilevato
Tochigi City 1979-1991
Asano et al.; 1992
Pulicosi ed infestazione da zecche Pulicosi ed infestazione da zecchePulicosi ed infestazione da zecche Pulicosi ed infestazione da zecche
Pulci e zecche sono parassiti molto comuni nei nostri animali, questi artropodi vivono, si nutrono e compiono almeno in parte, il loro ciclo biologico sul mantello di cane e gatto.
La pulce è un insetto aptero (privo di ali), ben adattato all’ospite con cui spesso convive in modo compatibile, senza produrre irritazioni cutanee, a meno che non si sviluppi una reazione allergica.
Specie maggiormente in causa nelle infestazioni da pulci nel cane sono
Ctenocephalides felis
eCtenocephalides canis
.L’adulto vive sull’ospite per circa sei mesi, l’accoppiamento avviene sull’animale e le uova, una volta deposte, cadono nell’ambiente dove si completa il loro ciclo (larva e pupa).
Col pasto di sangue, la pulce arreca un minimo danno sottrattivo all’ospite, a meno che l’infestazione non sia veramente massiccia.
Il problema più rilevante è l’azione traumatica sulla cute dell’animale con irritazione e grattamento che, se eccessivo può predisporre a germi d’irruzione secondaria. Molti animali presentano un’ipersensibilità al morso della pulce, il cui allergene scatena la cosiddetta DAP (Dermatite Allergica al morso della Pulce), vera e propria allergia cutanea che si traduce in alopecia simmetrica autoindotta, dermatite miliare e, più raramente in placche eosinofiliche, granulomi lineari e prurito facciale.
Ctenocephalides
è anche ospite intermedio diDipylidium caninum
, per cui si consiglia al proprietario del cane o gatto con pulicosi, di effettuare anche una sverminazione o per lo meno, un’analisi accurata delle feci.Quando l’infestione da pulci è molto consistente e l’igiene dell’ambiente poco accurata, è possibile che anche l’uomo venga parassitato dall’insetto, oltre al rilevamento del parassita o delle sue uova e escrementi, si possono osservare papule molto pruriginose soprattutto sulle estremità inferiore del corpo del
nuovo ospite. Ricordiamo che le comuni pulci del cane e del gatto possono occasionalmente trasmettere l’infezione da
Dipylidium caninum
anche all’uomo che si infesta ingerendo inconsciamente l’insetto contenente il cisticerco.L’infestazione da zecche consiste nella presenza sull’animale di zecche, attaccate o no, ixodidi o argasidi. Le specie generalmente in causa alle nostre latitudini sono
Rhipicephalus sanguineus
eIxodes ricinus
.Le azioni patogene delle zecche sono ⋅ irritativa,
⋅ traumatica, per la puntura e per l’inoculo di sostanze anticoagulanti,
⋅ tossica, dovuta soprattutto alla sostanza anticoagulante, si può avere paralisi da zecca (paralisi acuta, ascendente, flaccida) dovuta a una tossina della saliva che impedisce la liberazione dell’acetilcolina: se interessa i muscoli respiratori può portare a morte,
⋅ allergica, ⋅ sottrattiva,
⋅ trasmissione di alcune malattie e microrganismi.
Le zecche sono importante veicolo di molte malattie sia del cane che dell’uomo: è dunque importante, anche in questo caso, ridurre al minimo, se non eliminare, la presenza di questi parassiti nell’ospite e nell’ambiente.
Nel 2006 Dantas-Torres
et al.
hanno riportato 4 casi, i primi diagnosticati in Brasile, di infestazione daRhipicephalus sanguineus
nell’uomo, tutti soggetti che possedevano cani parassitati dalle stesse zecche. Uspenskyet al.
(2002) hanno rilevato la grande presenza di zecche nelle abitazioni, nei giardini e nelle vicinanze delle case: ciò suggerisce la grande possibilità di parassitismo anche nei riguardi dell’uomo.Nell’uomo le zecche del cane possono veicolare e trasmettere malattie molto serie quali varie rickettsiosi tra cui la febbre bottonosa e
Rickettsia siberica
,Coxiella burneti
ed il virus della febbre emorragica.Lo stretto e prolungato contatto tra zecca e ospite offre molte opportunità per trasmettere ehrlichiosi, rickettsiosi, hepatozoonosi, emobartonellosi, borreliosi e babesiosi, gravi e preoccupanti malattie dei nostri animali.
Molte indagini sono state svolte dagli studiosi, in varie parti del mondo, per avere una stima degli ectoparassiti che maggiormente attaccano gli animali domestici, e spesso specificamente correlati a malattie infettive da loro veicolate.
La presenza dei vari parassiti cutanei segue una certa stagionalità, legata alle temperature e alle piogge; dalle osservazioni di Cruz-Vasques
et al.
(1999) si rileva che in primavera ed estate, l’intervento degli ectoparassiti è influenzato da un clima piovoso, in inverno, invece, maggiormente dalla temperatura. Mumcuoglu e colleghi (1993) hanno osservato cheRhipicephalus sanguineus
è molto più frequente sulle femmine e che la localizzazione è diversa anche tra estate ed inverno: nella stagione calda la zecca è stata ritrovata prevalentemente su orecchie ed addome, durante l’inverno soprattutto su orecchie e testa.Nella tabella 2 riporteremo dati ottenuti da vari autori in indagini per la ricerca di ectoparassiti, quali artropodi, sui cani in diverse parti del mondo
Tabella Tabella Tabella
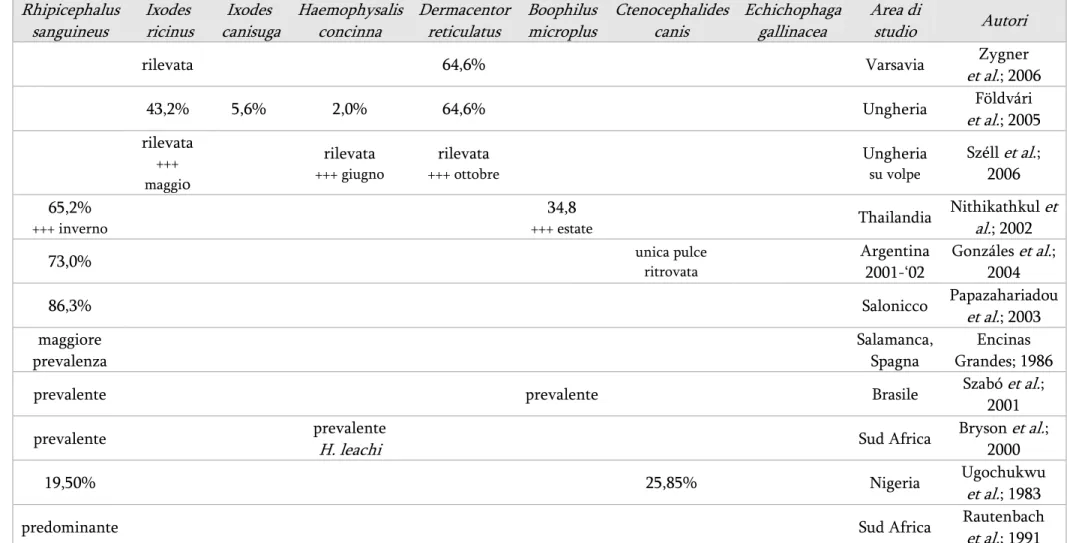
Tabella 2222 – Prevalenza di pulci e zecche secondo vari autori Rhipicephalus sanguineus Ixodes ricinus Ixodes canisuga Haemophysalis concinna Dermacentor reticulatus Boophilus microplus Ctenocephalides canis Echichophaga gallinacea Area di studio Autori
rilevata 64,6% Varsavia Zygner
et al.; 2006 43,2% 5,6% 2,0% 64,6% Ungheria Földvári et al.; 2005 rilevata +++ maggio rilevata +++ giugno rilevata +++ ottobre Ungheria su volpe Széll et al.; 2006 65,2% +++ inverno 34,8 +++ estate Thailandia Nithikathkul et al.; 2002
73,0% unica pulce ritrovata Argentina
2001-‘02 Gonzáles et al.; 2004 86,3% Salonicco Papazahariadou et al.; 2003 maggiore prevalenza Salamanca, Spagna Encinas Grandes; 1986
prevalente prevalente Brasile Szabó et al.;
2001
prevalente prevalente
H. leachi Sud Africa
Bryson et al.; 2000
19,50% 25,85% Nigeria Ugochukwu
et al.; 1983
predominante Sud Africa Rautenbach
SCOPO DELLA RICERCA SCOPO DELLA RICERCA SCOPO DELLA RICERCA SCOPO DELLA RICERCA
Il lavoro in esame si è rivolto alla ricerca di varie parassitosi nelle popolazioni canina e felina, sia in randagi, sia in animali di proprietà i cui proprietari si sono rivolti al centro di Cernavodă per qualsiasi necessità.
Gli animali esaminati provenivano dalle città di Cernavodă e Medgidia e loro dintorni, dislocati nei più vari distretti e quartieri. Tra i randagi figurano anche quei soggetti che sono in qualche maniera accuditi: spesso i vari
block
, così chiamati i palazzi, accolgono per le loro scale uno o più animali di cui qualcuno si prende cura, le varie industrie hanno nei loro ambienti gruppi di cani stanziali, come accade nella centrale nucleare che sorge nella città o nei cantieri dell’autostrada in costruzione nelle vicinanze.I prelievi sono stati eseguiti in due periodi: luglio 2005 e giugno 2006 e sono stati rivolti alla ricerca di dermatofitosi,
Malassezia
auricolare, anticorpi contro leishmania, ectoparassitosi da pulci e zecche, e parassitosi intestinali.Dove gli animali mostravano sintomi sono stati ricercati parassiti cutanei quali acari delle rogne, anche in soggetti già trattati per tali sospette infestazioni. Lo scopo di questo studio è quindi quello di determinare la prevalenza dei parassiti in esame, a volte ritenute presenti sul territorio, o credute assenti come nel caso della