UNIVERSIT
UNIVERSIT ÀÀ DEGLI STUDI DI PISA DEGLI STUDI DI PISA
Facoltà di Scienze Matematiche, Fisiche e Naturali
Corso di Laurea Specialistica in Biodiversità ed Evoluzione
TESI DI LAUREA TESI DI LAUREA:
Utilizzo di biomarker in bivalvi di acqua dolce per la valutazione della
qualità ambientale lungo il corso del fiume Cecina
Relatore: Prof. Marco Nigro
Relatrice: Dott.ssa Giada Frenzilli Candidata: Patrizia Guidi
INDICE
INDICE
::
. RIASSUNTO
. RIASSUNTO
. ABSTRACT
. ABSTRACT
1.INTRODUZIONE
1.INTRODUZIONE
p.61.1 BATTERIA DI BIOMARKER
p.9 - IL DANNO GENETICO p.9Rotture del DNA p.11
Comet assay p.12
Diffusion assay p.12
Micronucleo p.13
Il test del micronucleo p.14
- IL DANNO CELLULARE p.15
tempo di ritenzione del rosso neutro p.16
- BIOACCUMULO p.17
spettrometria ad assorbimento atomico p.17
- STRESS OSSIDATIVO p.18
il metodo tosca p.19
1.2 AREA DI STUDIO
p.202.SCOPO DELLA TESI
2.SCOPO DELLA TESI
p.223.MATERIALI E METODI
3.MATERIALI E METODI
p.23
3.1 SITI D’INDAGINE
p.233.2 SPECIE UTILIZZATA E TRAPIANTO
p.233.3 ANALISI EFFETTUATE
p.26test di ritenzione del rosso neutro p.27
comet assay p.29
attività delle difese antiossidanti e bioaccumulo p.31
analisi delle capacità antiossidanti totali (TOSC-A) p.34
4.RISULTATI E DISCUSSIONE
4.RISULTATI E DISCUSSIONE
p.37
mortalità p.37
test di ritenzione del rosso neutro p.37
test del micronucleo p.39
comet assay p.42
attività delle difese antiossidanti p.42
tosc assay p.48 bioaccumulo p.50
5.CONCLUSIONI
5.CONCLUSIONI
p.55
6.RIFERIMENTI BIBLIOGRAFICI
6.RIFERIMENTI BIBLIOGRAFICI
p.57
.
. RINGRAZIAMENTI
RINGRAZIAMENTI
p.66
RIASSUNTO
RIASSUNTO
Le indagini ecotossicologiche ed il monitoraggio ambientale acquistano maggiore completezza affiancando alla tradizionale misura della concentrazione chimica degli inquinanti, valutazioni di risposte biologiche (biomarker) per descrivere gli effetti prodotti dai contaminanti su organismi ed ecosistemi. Simili studi divengono particolarmente importanti in regioni soggette ad elevata antropizzazione come quella comprendente il bacino del fiume Cecina, (Toscana centro-meridionale), nel quale attività antropiche attuali e pregresse, insieme a manifestazioni d’origine naturale, concorrono alla contaminazione ambientale. Analisi chimico-fisiche hanno indicato una contaminazione dei sedimenti e del biota da parte di alcuni metalli pesanti, in particolare il mercurio.
Il presente studio ha come obiettivo il perfezionamento di alcune metodologie atte ad analizzare la qualità dell’ambiente fluviale secondo i criteri dell’ approccio ecotossicologico utilizzando molluschi d’acqua dolce come organismi sentinella.
Bivalvi filtratori (Unio pictorum), campionati nel Lago Maggiore, sono stati trapiantati per 30 giorni in tre siti del corso del fiume Cecina caratterizzati da un diverso livello di inquinamento. Il primo, di controllo, è stato localizzato in un’area a monte contraddistinta da bassa presenza antropica; gli altri sono stati individuati in due distinte aree a valle dove le acque del fiume scorrono addizionate di scarichi industriali e civili. In ogni sito sono state posizionate tre gabbie contenenti ciascuna quindici organismi.
Tutti gli individui sono stati recuperati e sono state condotte analisi su cellule branchiali, per valutare gli effetti genotossici, e su cellule emolinfatiche, per misurare l’alterazione della funzionalità lisosomale. Nel primo caso sono stati effettuati il Test della Cometa, per valutare le rotture della doppia elica del DNA, ed il Test del Micronucleo, per stimare la presenza di cellule micronucleate. Nel secondo caso è stato utilizzato il test di ritenzione del rosso neutro.
Le risposte fornite da quest’ultimo biomarker hanno differenziato significativamente (p<0.01) il livello di contaminazione ambientale nei tre siti. I risultati preliminari ottenuti dai test di genotossicità non sembrano invece discriminare le tre stazioni e contemporaneamente rivelano un’alta percentuale di cellule apoptotiche nei preparati di tutti gli individui. É possibile che l’alto tasso di apoptosi abbia interferito sull’interpretazione dei dati di genotossicità; tale fenomeno suggerisce la necessità di un’ulteriore revisione dei parametri sperimentali utilizzati per la valutazione del danno al DNA.
Allo stadio attuale Unio pictorum sembra una specie che ben si adatta al monitoraggio ambientale anche se, per una maggiore completezza interpretativa dei risultati ottenuti, sono state effettuate misurazioni di bioaccumulo di metalli pesanti nei tessuti molli e valutazioni delle risposte antiossidanti.
ABSTRACT
ABSTRACT
Researches on environmental monitoring acquire thoroughness when biomarker evaluations join traditional analysis of chemical concentration of pollutants in order to describe the effects produced by pollutants on organisms and ecosystems.
Such researches achieve greater importance in areas where human activities are massive. An example is the area around the river Cecina (southern Tuscany), where present and past human activities, together with natural events, harden environmental pollution.
Chemical and physical analysis pointed out how heavy metals have polluted sediments and biota, particularly mercury.
The main purpose of this work is to improve the procedures that analyse fluvial environment quality according to an ecotoxicological approach, with freshwater mussels used as bioindicators.
Filter-feeding bivalves (Unio pictorum) from Maggiore Lake have been transplanted for 30 days in Cecina river, in three sites characterized by different degrees of pollution. The first site was a control-site and located in a protected area, with low human presence. The other two were located in two different areas where the water is polluted by industrial and urban contaminants. In each site there were three cages containing fifteen mussels each. All bivalves were removed and analysed. Gill cells were studied for genotoxicity assays, while hemolymphatic cells were evaluated to assess lysosomal membrane stability. In the first case, Comet assay was performed in order to examine how the DNA double strand breaks, and Micronucleus assay to estimate the presence of micronucleus cells. In the second case, neutral red retention test was used.
The latter biomarker marked the difference between sites (p<0,01) for enviromental contamination. Genotoxicity assay didn’t mark the three different enviroments, probabily due to apoptotic process observed in gill cells.
Unio pictorum seems to be a good bioindicator for environmental monitoring;
1. INTRODUZIONE
1. INTRODUZIONE
Molti composti chimici sia naturali che derivati dall’azione dell’uomo sono immessi continuamente nell’ambiente; nella sola Comunità Europea 10.000 composti di sintesi vengono prodotti in quantità eccedenti i 500 kg per anno; fra di essi circa 200 vengono usati in quantità eccedenti 50.000 tonnellate per anno (Fossi, 2000).
Nel 1994 l’OECD (Organization for Economic Cooperation and Development) stimò che annualmente circa 1.500 nuovi composti si vanno ad aggiungere ai 100.000 già presenti nell’ambiente naturale (Steinberg H.J. et al. 1994 ). Dati aggiornati al 2000 illustrano che annualmente, su scala globale, l’industria chimica sintetizza 25.000 nuove molecole, delle quali 500-1000 possono trovare un utilizzo commerciale ed essere così impropriamente immesse nell’ambiente, con rischiose conseguenze per il biota.
In questo scenario, gli organismi sono esposti ad una miscela d’inquinanti, i cui effetti sinergici sono difficilmente interpretabili e prevedibili basandosi unicamente su analisi chimiche; alcuni contaminanti possono essere, ad esempio, pesantemente accumulati nei tessuti degli organismi senza indurre effetti tossici, mentre altri sono caratterizzati da un’alta tossicità anche a bassi livelli di esposizione. Inoltre gli studi di monitoraggio ambientale sono resi ancora più complessi sia dagli eventi di biotrasformazione che dalle variabili chimico-fisiche caratterizzanti il comparto naturale oggetto di studio.
Il legislatore ha cominciato ad intervenire su questi fenomeni anche individuando aree pilota dove sperimentare tecniche di analisi ambientale integrate al fine di mettere a punto un’adeguata strategia di gestione; tra i principali interventi legislativi basti menzionare la direttiva comunitaria “Water Frame Directive” (2000/60 CE) che ricorre a metodologie moderne per raggiungere una buona qualità delle acque anche attraverso iniziative di bonifica, nel caso gli ambienti analizzati risultino degradati, entro il 2015.
Uno degli obiettivi fondamentali dell’ecotossicologia è proprio quello di definire gli effetti provocati dalla miscela degli inquinanti nel mezzo ambientale sulle popolazioni e sulle comunità naturali. L’ecotossicologia, battezzata nel 1969 da Truhaut dell’Università di Parigi, nasce dall’unione di due discipline: l’ecologia e la tossicologia; si differenzia dalle metodologie d’indagine ambientale pregresse dal momento che, per la prima volta, considera l’insieme dei fattori che concorrono a creare l’effetto complessivo di un contaminante ambientale sugli organismi viventi (Vighi & Bacci, 1998) e non si limita a misurare le concentrazioni dei singoli inquinanti presenti nel mezzo ambientale.
bioindicazione basata sulla valutazione dei livelli di contaminanti all’interno dell’organismo bioindicatore. Questa metodologia si sviluppa sul principio ecotossicologico del bioaccumulo, secondo il quale un organismo animale o vegetale tende, per fattori intrinseci o estrinseci, ad accumulare concentrazioni dell’inquinante superiori, anche di molti ordini di grandezza, a quelli del comparto ambientale nel quale si trova. Conoscere le concentrazioni dei contaminanti all’interno degli organismi è un elemento utile negli studi ecotossicologici, ma tanto la chimica ambientale quanto la bioindicazione di per sé sono metodologie inefficaci per individuare esaurientemente i meccanismi attraverso i quali i contaminanti perturbano le comunità sia animali che vegetali.
Per raggiungere questo tipo d’informazione, agli inizi degli anni ‘80 venne approfondita la possibilità di usare le “risposte” che l’organismo bioindicatore genera nei confronti degli insulti chimici ambientali come strumento di diagnosi e prognosi di salute ambientale: naquero, in questo contesto di ricerca, i biomarkers.
La “National Academy of Science” li definisce come “quella variazione biochimica, cellulare, fisiologica o comportamentale, che può essere misurata in un tessuto, in un fluido biologico o a livello dell’intero organismo (individuo o popolazione) la quale fornisce l’evidenza di un’esposizione e/o un effetto ad uno o più composti inquinanti”.
Individuiamo così, nelle diverse risposte che un organismo genera nei confronti di un insulto chimico, altrettanti “markers” potenziali indicatori di contaminazione ambientale. Dall’osservazione di singoli biomarker non può, però, essere dedotto lo stato di salute dell’organismo; negli studi ecotossicologici che riguardano aree impattate è sicuramente raccomandabile l’utilizzo di un’ampia batteria di risposte.
L’approccio multimarker è importante anche per studiare i meccanismi attraverso i quali gli insulti ambientali causano alterazioni biologiche: possono instaurasi complesse relazioni tra le diverse alterazioni molecolari-cellulari, e le fluttuazioni o le cinetiche di un tipo di
biomarker possono influenzare quelle di altre risposte (Regoli et al., 2004). Infatti, proprio
attraverso l’utilizzo di numerose, e soprattutto diversificate, risposte biologiche (Bayne et
al., 1985), possiamo ottenere una più accurata analisi ambientale (Depledge, 1994). Possiamo distinguere, e scegliere per le analisi, tipi diversi di biomarker, classificati a seconda della classe di contaminanti responsabile della risposta biologica, del tipo di risposta, o del tempo necessario all’organismo per reagire.
In base alla risposta temporale dell'organismo si individuano biomarcatori precoci, nel caso in cui la risposta si manifesti nell’arco di ore o giorni (risposte molecolari e cellulari), e bioindicatori lenti in caso le risposte impieghino tempi più lunghi per manifestarsi (risposte
a livello fisiologico).
A seconda della loro specificità di risposta nei confronti degli inquinanti, i biomarkers possono essere suddivisi in due categorie: generali e specifici. I biomarkers generali traducono una risposta dell'organismo a un insieme di inquinanti, senza consentire di determinare la natura degli inquinanti stessi. I biomarkers specifici traducono invece una risposta dell'organismo ad una specifica famiglia di inquinanti.
In merito all’induzione della risposta, i biomarkers possono essere ulteriormente suddivisi in altre due categorie principali (Peakall & Shugart 1993): di esposizione e di effetto. I biomarkers d’esposizione forniscono informazioni sul grado di esposizione ad uno o più inquinanti presenti nell'ambiente, ma non sugli effetti tossici che questi generano a livello dell'organismo. I biomarkers d’effetto o di tossicità indicano sia l'eventuale esposizione che gli effetti tossici.
In base al danno subito dall’organismo invece, si distinguono le seguenti categorie di biomarker: alterazione del DNA; alterazione del sistema immunitario; alterazione istopatologiche; risposte in termini di induzione/inibizione della sintesi delle proteine.
Attraverso i biomarkers non otteniamo una valutazione quantitativa dei livelli di tossico a cui l’organismo è sottoposto, ma determiniamo il “livello di salute” in cui la popolazione si trova (Fossi, 2000).
La composizione della batteria di biomarker da utilizzare dipende quindi da quali informazioni pregresse posseggo sulla contaminazione dell’area di studio o dai composti chimici somministrati in laboratorio.
Un’altra scelta da effettuare per un corretto programma di biomonitoraggio, oltre alla composizione della batteria di biomarcatori, riguarda il tipo di organismo da utilizzare come “sentinella”. In linea generale gli organismi bioindicatori devono possedere alcune caratteristiche fondamentali quali:
• Optimum ecologico ed ampia distribuzione nell'area di studio; • Facile identificazione sistematica;
• Adeguate conoscenze sull'anatomia, fisiologia ed ecologia della specie; • Facile reperibilità stagionale.
Nella scelta dell’organismo bioindicatore ricopre fondamentale importanza anche la sua “mobilità”, dal momento che l'informazione che ci fornisce l'organismo è relativa all'area vitale dove esso si muove e si alimenta.
Nel caso di un organismo sedentario o sessile otterremo un'informazione di tipo puntiforme, mentre nel caso di un organismo mobile avremo un'informazione integrata
dell'intera area vitale.
L’utilizzo dei biomarcatori è particolarmente utile in zone sottoposte ad un forte impatto antropico quali gli ambienti acquatici; durante le decadi passate, sono state sviluppate ricerche sui biomarcatori come indicatori precoci della perturbazione delle popolazioni sia in ambienti marini sia salmastri che dulciacquicoli.
Nell’ambiente acquatico, specie sessili (non mobili) sono particolarmente utilizzati negli studi di monitoraggio ambientale (Dixon et al., 2002).
Gli organismi biondicatori più approfonditamente studiati sono, nel complesso, i molluschi acquatici; specialmente i bivalvi marini del genere Mytilus o le sue controparti d’acqua dolce Dreissena polimorfa, e rappresentanti delle Unionacea, sembrano ben riflettere la contaminazione ambientale. (Gundacker, 1999).
Queste diverse varietà di molluschi sono conosciuti per accumulare significativamente elementi essenziali e non essenziali presenti nell’ambiente.
I molluschi bivalvi sono sensibili bioindicatori dell’inquinamento degli ecosistemi acquatici; anche le specie caratteristiche degli ambienti dulciacquicoli sono ben adattabili ad esperienze di biomonitoraggio dal momento che hanno un’adeguata dimensione, sono per lo più sessili, longevi, largamente distribuiti e disponibili in grandi quantità (Green et al.,
1989). Bivalvi d’acqua dolce, del genere Unio, sono conosciuti per la capacità di
accumulare vari inquinanti e possono essere considerati come bioindicatori dell’inquinamento ambientale (Petushok et al., 2002). Sono organismi stazionari, filtratori, e soprattutto capaci di concentrare la maggior parte dei contaminanti anche se presenti in basse concentrazioni (Labieniec et al., 2006).
Di fronte alla crescente richiesta di conciliare le esigenze dello sviluppo con la conservazione della natura appare chiara la rilevanza di estendere l’impiego di tecniche basate su risposte biologiche (biomarker) per valutare la qualità dell’ambiente e promuoverne l’inserimento nella normativa in materia di gestione delle risorse naturali.
1.1 BATTERIA DI BIOM
1.1 BATTERIA DI BIOMARKERARKER
IIL DANNO G ENETICOL DANNO G ENETICO
Molti composti rilasciati nell’ambiente sono potenzialmente genotossici, in grado, cioè, di interagire con il materiale genetico direttamente o a seguito di attivazione metabolica. Composti di questo genere sono stati testati in animali acquatici, tessuti isolati e differenti
tipi cellulari, e raggruppati in quattro classi a seconda della loro interazione con il DNA: (I) composti che agiscono direttamente sul DNA; (II) composti i cui metaboliti causano danno al DNA; (III) composti che causano la produzione di specie reattive dell’ossigeno che possono danneggiare il DNA; (IV) composti che inibiscono la sintesi e i sistemi di riparazione del DNA. In più, diversi tipi di contaminanti chimici possono apportare danni al materiale genetico attraverso meccanismi multipli (Lee & Steinert, 2003).
Il metabolismo cellulare delle sostanze genotossiche è un fenomeno complesso e la mancanza di una detossicazione completa può portare alla formazione di metaboliti elettrofili altamente reattivi, che possono attaccare i centri nucleofili in macromolecole come DNA, lipidi, proteine e RNA.
L’interazione con il DNA si manifesta primariamente attraverso alterazioni strutturali di questa molecola: addotti, alterazione chimica delle basi azotate, legami crociati e rotture a livello di singolo e doppio filamento (strand breaks). Nel caso in cui i normali meccanismi di riparazione non siano sufficienti o efficaci, tali alterazioni possono essere fissate e portare ad anomalie nel materiale genetico come aberrazioni cromosomiche, mutazioni geniche fino a causare effetti a lungo termine come il cancro nei vertebrati, uomo compreso. Se le genotossine colpissero le cellule della linea germinale, potrebbero, inoltre, essere causa di difetti ereditabili.
Numerosi eventi mutageni sono stati correlati con riduzioni della fitness darwiniana degli organismi; una riduzione delle capacità riproduttive e di adattamento può limitare la sopravvivenza di una popolazione fino alle estreme conseguenze come l’estinzione. Danni al DNA in organismi acquatici provenienti da siti contaminati sono associati ad effetti sulla crescita, sulla riproduzione e sulla dinamica di popolazione (Lee & Steinert,
2003).
L’esposizione a genotossine può provocare, quindi, una cascata di eventi in grado di cambiare l’integrità del DNA fino a ripercuotersi sulle popolazioni naturali. L’identificazione e la quantificazione dei vari eventi, nell’iter dall’esposizione alla fissazione e all’espressione del danno genetico, possono essere utilizzate come biomarker in organismi esposti ad ambienti contaminati da composti genotossici.
Nelle passate tre decadi sono state utilizzate più metodologie per sviluppare analisi relative alla genotossicità nelle cellule e negli stadi precoci di vita degli organismi invertebrati. Questi diversi tipi d’approccio possono essere divisi, per comodità, in due categorie d’analisi distinte, basate sulle dimensioni del bersaglio: (I) quelli operanti a livelli molecolari o biochimici (microlesioni), e (II) effetti visibili a livello dei cromosomi
(macrolesioni) (Brusick, 1978).
Il primo gruppo di test riguarda i metodi per rintracciare macrolesioni che richiedono cellule in divisione come: aberrazioni strutturali e numeriche dei cromosomi, scambi di cromatidi fratelli, e micronuclei. Il secondo gruppo riunisce quei metodi che possono essere applicati a cellule in interfase per rintracciare microlesioni come: single gel electrophoresis (Comet) assay, gel electrophoresis assay, alkaline elution, unwinding assay e analisi degli addotti del DNA.
ROTTURE DEL DNA
La produzione di rotture nella doppia elica (strand breaks, SB) è correlata con le proprietà mutagene e cancerogene di numerose sostanze; la determinazione quantitativa della presenza di rotture nella doppia elica viene frequentemente utilizzata come biomarker per valutare l’effetto genotossico di contaminanti ambientali (Mitchelmore & Chipman, 1998).
Le rotture del DNA a livello di singolo e doppio filamento possono essere prodotte sia direttamente dall’azione di alcune sostanze o dall’azione di taglio degli enzimi di riparazione; sia indirettamente attraverso l’attivazione metabolica. Per esempio è stato mostrato che alcuni contaminanti ambientali, come l’arsenico, il cadmio ed il mercurio, non hanno direttamente capacità genotossiche; ma pre-trattando cellule brachiali di mitilo con queste sostanze l’efficacia dei meccanismi di riparazione del DNA subisce un decremento (Pruski & Dixon, 2002).
Il danno al DNA può essere prodotto anche attraverso meccanismi non direttamente correlati alla genotossicità di un agente chimico; può essere significativamente influenzato da fattori fisici quali la temperatura, le variabili dipendenti dall’ossigeno (oxygen factors) e la salinità; o da fattori fisiologici come i cambiamenti dovuti alla fase di crescita, o alla stagione, o l’età alla quale è associata anche una diversa necessità e capacità dei meccanismi di risposta e di riparazione. Tutti questi elementi sono conosciuti come possibili cause di danno al DNA che si manifesta come conseguenza dello stress generale (Dixon et al., 2002).
L’effetto genotossico di un’ampia serie di composti può essere misurato attraverso l’analisi delle modifiche complessive indotte nel DNA, qualunque sia il processo attraverso il quale vengono generate.
L’interpretazione dei risultati dei test di genotossicità è complicata sia dal fatto che non è facile distinguere tra il materiale genetico danneggiato a causa di composti chimici specifici e il DNA danneggiato a causa di altri fattori; sia dal fatto che non esiste una
semplice relazione tra il danno e suo impatto biologico (Oliver & Banáth, 2006).
La maggior parte delle analisi per gli SB si basa sul principio secondo il quale la percentuale di DNA a singolo filamento che si separa dalla doppia elica, ad un pH elevato, è proporzionale al numero di SB nella molecola di DNA. In queste condizioni, i siti labili agli alcali, come siti caratterizzati dalla presenza di addotti, vengono solitamente convertiti in SB (Shugart, 1994).
La “gel elettroforesi” rappresenta una delle tecniche analitiche per la valutazione quantitativa degli SB nel monitoraggio ambientale, che può consentire la misura del danno genetico su singola cellula. Sotto condizioni alcaline, l’elettroforesi del DNA su gel di agarosio, risulta in una migrazione dei frammenti di DNA denaturato, all’interno di questo gel, che dipende dalle dimensioni dei frammenti. I preparati vengono colorati con bromuro di etidio ed analizzati al microscopio a fluorescenza. Le tipiche immagini a cometa che si ottengono con questa metodica giustificano il nome di “Comet Assay”.
Comet assay
Alla prima quantificazione di danno al DNA in singole cellule, incluse in agarosio, su vetrini da microscopio e lisate in condizioni moderatamente alcaline di Rydberg e Johanson nel 1978, è seguita quella microelettroforetica per la visualizzazione diretta del danno al DNA in singole cellule in condizioni neutre di Östling e Johanson (1984).
Il grado di frammentazione del DNA era valutato mediante la misura della migrazione dei frammenti di DNA dal nucleo verso l’anodo. Le immagini risultanti furono chiamate comete per il loro aspetto.
Attualmente la versione più diffusamente applicata è quella nota come Single Cell Gel
Electrophoresis modificata da Singh e collaboratori che, nel 1988, introdussero l’utilizzo di
condizioni alcaline per la lisi e l’elettroforesi per enfatizzare la presenza di tagli a livello di singolo filamento; le condizioni neutre iniziali, infatti permettevano di individuare i tagli solo a livello di doppio filamento, ma non consentivano di rilevare i tagli a livello di singolo filamento fornendo solo un quadro parziale del danno al DNA.
Lo sviluppo di vari programmi d’analisi informatici dell’immagine ha, inoltre, permesso di velocizzare la quantificazione di alcuni parametri della cometa, come la percentuale di DNA migrato dal nucleo verso l’anodo e la lunghezza della coda della cometa.
Studi recenti dimostrano che SCGE può essere utilizzato anche in esperienze di campo, ad esempio per valutare una riduzione nella qualità delle acque causata da inquinamento chimico (Frenzilli et al., 2001).
quali, la difficoltà nel distinguere tra SB verificatisi a seguito di un’esposizione, da quelli dovuti ad altri fattori ambientali, o da quelli dovuti al normale metabolismo (per esempio a seguito di un aumento di specie radicaliche) e la possibilità che si abbia riparazione degli SB prima dell’analisi; nel progettare un’esperimento, soprattutto per gli studi di campo, ricoprono particolare importanza la scelta dei controlli e delle condizioni sperimentali. Nell’interpretazione del saggio, devono essere chiaramente prese in considerazione le differenze della risposta e della capacità di riparazione dipendenti dall’età.
L’utilizzo del comet assay per la valutazione del danno al DNA presenta, comunque, dei vantaggi che vanno dalla sensibilità del saggio per rintracciare il danno al DNA, al piccolo numero di cellule necessario per il suo svolgimento, al fatto che può essere effettuato su tutti i tipi di cellula eucariotica, ed è eseguito su singole cellule.( Lee & Steinert, 2003). È opportuno, comunque, al fine di interpretare la rilevanza biologica del danno, comparare i risutati del Comet assay con altre misure di genotossicità quali, ad esempio, il test del micronucleo, le aberrazioni cromosomiche, i livello di addotti e di mutazioni.
Figura 1 :Comet assay, immagini di comete: nucleo con DNA non danneggiato (I); nuclei con DNA frammentato che è migrato verso l’anodo (II, III).
MICRONUCLEO
I micronuclei possono essere formati da uno o più frammenti cromosomici acentrici o da cromosomi interi che rimangono indietro all’anafase, non venendo così inclusi nel nucleo principale al momento della sua formazione, a causa di un’anomala divisione mitotica. In entrambi i casi si osservano come piccoli agglomerati di cromatina al di fuori del nucleo principale di una cellula, circondata da membrana nucleare (Evans, 1997). Questa ha lo scopo di proteggere il contenuto dei micronuclei nel citosol e di permettere la replicazione
e la trascrizione del DNA micronucleare, che avviene in sincrono con quella del DNA della cellula madre.
La comparsa di micronuclei, contenenti cromosomi interi, è dovuta principalmente a mutazioni nelle proteine del cinetocore o ad anomalie dell’apparato mitotico (Fenech, 1993), oppure ad alterazioni della fisiologia cellulare (Albertini et al., 2000).
I frammenti acentrici, invece, possono essere dovuti a rotture, indotte da mutageni esogeni ed endogeni, delle due eliche del DNA, che non sono state riparate (Fenech,
1993), oppure alla replicazione di DNA danneggiato.
Il test del micronucleo (Schmid, 1975) permette di valutare il danno cromosomico spontaneo o indotto in termini di frequenza di micronuclei. Un aumento della frequenza di cellule contenenti micronuclei può essere un buon biomarker di genotossicità prodotta da agenti clastogeni (che danneggiano direttamente il DNA inducendo rotture cromosomiche) o da agenti aneuploidogeni (che, invece, alterano il numero cromosomico non agendo direttamente sul DNA, ma per esempio, andando a danneggiare le fibre del fuso).
Il test del micronucleo, comunque, non permette la discriminazione tra micronuclei, che hanno avuto un'origine clastogena, da quelli di origine aneuploidogena (Heddle et al.,
1991). Per questo è spesso affiancato dalla tecnica di ibridazione in situ florescente o FISH (Bauman et al., 1980; Migliore et al., 1999) che, grazie all'uso di sonde di DNA specifiche per le sequenze centromeriche dei cromosomi e marcate con fluorocromi, permette l'identificazione della presenza di centromeri nei micronuclei e, quindi, di determinarne il meccanismo di formazione.
Il test del Micronucleo
Il saggio del micronucleo ha caratterizzato significativamente gli studi sugli invertebrati acquatici ed è stato applicato largamente a diverse specie di bivalvi esposti sia in condizioni di laboratorio che in natura (Dixon et al.,2002). Cellule branchiali ed emolinfatiche di molluschi bivalvi sono state ampiamente usate per questo tipo di analisi. La frequenza dei micronuclei nelle cellule branchiali subisce una significativa influenza a causa di fattori fisiologici (età, cambiamenti stagionali e dovuti alla crescita), e fisici (temperatura e variabili dell’ossigeno) (Brunetti, et al. 1992).
A
Figura 2: Cellula branchiale di U. pictorum senza micronuclei (A); cellula branchiale di U. pictorum con un micronucleo indicato dalla freccia (B).
IIL DANNO CELLULAREL DANNO CELLULARE
Grazie ad una serie di risposte molecolari, biochimiche e strutturali le cellule sono capaci di sopravvivere a molti tipi di danno cellulare.
Indagini a livello subcellulare possono rivelare alterazioni a stadi precoci della risposta, prima che il danno cellulare integrato si sposti ai livelli di organo o di processi fisiologici dell’intero animale. In molti casi, le alterazioni rintracciabili più precoci sono associate ai lisosomi (Moore, 1985).
I lisosomi sono una particolare classe di organelli subcellulari principalmente coinvolti nella digestione intracellulare, nei meccanismi di difesa cellulare, nel turnover di proteine e di organelli, e nella regolazione di processi di secrezione. Si presentano come vescicole delimitate da membrana contenenti un corredo di enzimi idrolitici in grado di degradare la maggior parte delle sostanze biologiche presenti all'interno della cellula nei loro costituenti elementari per poi, quando possibile, venire riutilizzati in altro modo o essere espulsi. I lisosomi vengono impiegati sia nella fagocitosi di materiale estraneo che nel riciclaggio di componenti citoplasmatici all’interno della cellula durante i normali processi di mantenimento e riparazione intracellulare, infatti, possono degradare macromolecole come proteine, lipidi e carboidrati o anche materiale ingerito dalla cellula.
I lisosomi sono anche coinvolti nel metabolismo dei metalli pesanti; la capacità di accumulare diversi metalli e contaminanti organici tossici, è stata osservata da molti autori (Regoli, 1992). Il loro ruolo li espone, quindi, a particolari situazioni di vulnerabilità nei confronti di alcuni xenobiotici, alterazioni lisosomali sono state osservate in più tipi di invertebrati marini esposti a contaminati come idrocarburi policiclici armatici (Moore,
1985).
Le risposte lisosomali all’esposizione a xenobiotici, o, più in generale allo stress ambientale, si dividono essenzialmente in tre categorie: un aumento nelle dimensioni dei
lisosomi, una riduzione della stabilità di membrana, cambiamenti nel contenuto dei lisosomi.
Diverse fonti di stress ambientale (inquinamento chimico, cambiamenti nella salinità, temperature elevate, malnutrizione, stress riproduttivo) possono provocare un aumento nelle dimensioni dei lisosomi della ghiandola digestiva dei molluschi (Regoli, 1992). Questo aumento sia in volume che in superficie, delle dimensioni dei lisosomi secondari può essere dovuto ad un aumento dei fenomeni di fusione tra vacuoli e di autofagia.
Inoltre, è stato ampiamente dimostrato che gli stress ambientali possono ridurre la stabilità delle membrane lisosomali, misurata, di solito, in termini di ridottuzione del tempo di ritenzione di un colorante vitale come il rosso neutro (Moore 1988, Wiston et al., 1991,
Cajaraville et al., 1995, Nicholson 1999, Lowe and Fossato, 2000).
Tempo di ritenzione del rosso neutro
L’insorgenza di compromissioni a carico del sistema lisosomale può essere valutata analizzando il tempo di ritenzione di un colorante vitale, come indice di integrità della membrana.
Nel 1984 Borenfreund e Puerner pubblicarono una metodica che utilizzava come indicatore di danno cellulare le alterazioni nella capacità della cellula di assumere il colorante rosso neutro: le cellule sane trattengono più a lungo una quantità maggiore di colorante rispetto a quelle danneggiate. Monitorando e quantificando l’andamento del rosso neutro all’interno della cellula al microscopio ottico è possibile discriminare cellule sane da quelle danneggiate. Nel caso di cellule danneggiate, si osserva la fuoriuscita del colorante nel citosol; il danno cellulare è misurato utilizzando il tempo di ritenzione del colorante (Lowe et al., 1992, Lowe & Pipe, 1994, Lowe et al., 1995a, Lowe et al., 1995b).
Figura 3: Cellule emolinfatiche di Unio pictorum; con membrana lisosomale integra (A), con membrana lisosomale danneggiata (B).
B
BIO ACCUM ULO IO ACCUM ULO
La misura della concentrazione di sostanze presenti nell’ambiente all’interno degli organismi, è stato uno dei primi parametri presi in considerazione dalle analisi ambientali con approccio ecotossicologico. I contaminanti ambientali possono essere assunti dall’organismo attraverso varie vie, solitamente esiste un equilibrio tra uptake ed escerzione; le concentrazioni nei tessuti dipendono dall’efficacia di questi due meccanismi che nel caso di efficienza compromessa vengono accumulati nell’organismo.
Gli organismi invertebrati, sono stati ampiamente studiati (ed utilizzati come bioindicatori), per la loro capacità di accumulare tracce di elementi sia essenziali che non-essenziali presenti nell’ambiente. In particolar modo i molluschi bivalvi sembrano riflettere i livelli di contaminazione ambientale sia negli ambienti marini, che in quelli dulciacquicoli (Gundacker 2000). Il bioaccumulo di sostanze come i metalli varia fortemente a seconda del tipo di organismo preso in esame, dell’organo e del tessuto esaminato; e da caratteristiche proprie dell’individuo quali l’età, la dieta e l’ambiente.
Negli invertebrati si ritiene che l’epatopancreas si comporti come il fegato dei vertebrati filtrando l’emolinfa proveniente dall’apparato gastro-intestinale (Gaggi, 1998) e nel caso gli organismi non siano in grado di espellere un contaminante, questa è uno delle principali sedi deputate all’accumulo.
Le tecniche di spettrometria ed assorbimento atomico sono tra le più comunemente utilizzate per la determinazione dei metalli in tracce ed altri elementi presenti nei tessuti di orgasmi bioindicatori.
Spettrometria ad assorbimento atomico
Le tecniche di spettrometria ad assorbimento atomico si distinguono a seconda del sistema di atomizzazione utilizzato sia esso termico, elettrotermico o chimico.
Per determinare la quantità di un elemento in un campione, lo si può atomizzare, eccitare i suoi atomi con radiazioni di opportuna lunghezza d’onda e misurare la radiazione assorbita.
Nella maggior parte dei casi l’atomizzazione viene realizzata riscaldando il campione in modo energico per formare atomi liberi sul cammino della radiazione eccitante.
L’emissione della radiazione eccitante è prodotta da un catodo cilindrico cavo, costituito dall’elemento da analizzare e da una sua lega. Il bulbo della lampada, in vetro con una finestra di quarzo, è riempito di argon o di neon. Quando viene applicata un’opportuna differenza di potenziale agli elettrodi, il gas di riempimento si ionizza parzialmente, gli ioni
positivi, accellerati dal campo elettrico, urtano il catodo e provocano l’espulsione degli atomi superficiali.
Si formano così atomi vaporizzati che, eccitati dagli urti con il gas di riempimento, emettono energia radiante.
Con i comuni sistemi di atomizzazione termica, almeno il 99.9 % degli atomi di un elemento si trova nel livello elettronico fondamentale; in prima approssimazione, dunque, tutti gli atomi generati dal sistema di atomizzazione, vengono eccitati dalla radiazione che li investe, e di cui si misura l’assorbimento.
L’assorbimento, che dipende dal numero di atomi nello stato fondamentale, è direttamente proporzionale all’intera popolazione di atomi presenti sul cammino ottico della radiazione e quindi alla concentrazione dell’elemento nel campione. In queste condizioni l’assorbimento atomico, segue la legge analoga alla legge di Beer, descritta per l’assorbimento molecolare.
S
STRESS O SSIDATIVOTRESS O SSIDATIVO
L’interesse per lo stress ossidativo nelle applicazioni di ecotossicologia è basato sul “paradosso dell’ossigeno” (oxygen paradox); questa molecola è fondamentale per molte reazioni biochimiche degli organismi aerobici, ma il suo consumo genera la formazione intracelluare di specie potenzialemente tossiche dell’ossigeno (Regoli et al., 2002).
Specie altamente reattive dell’ossigeno (ROS) quali: il radicale superossido (.O2-) e il
radicale idrossilico (.OH) o il perossido di idrogeno (H2O2); sono continuamente prodotte
da svariate attività metaboliche del metabolismo aerobico. La loro potenziale tossicità sulle componenti biologiche è normalmente controbilanciata dalla presenza di complessi di enzimi antiossidanti e di molecole scavengers a basso peso molecolare atti a prevenire la loro formazione ed eliminare quelli eventualmente formatisi. In condizioni fisiologiche normali, l’efficienza dei sistemi antiossidanti riflette la pressione proossidante basale degli organismi influenzati da vari fattori biologi e ambientali inclusi, pressione dell’ossigeno, esposizione alla luce, temperatura, disponibilità di nutrienti, attività metabolica, stato di salute e fase del ciclo riproduttivo (Bocchetti et al., 2003). Diversi contaminanti ambientali, o i loro metaboliti possono esercitare effetti tossici attraverso il meccanismo dello stress ossidativo (Wiston & Di Giulio, 1991).
Molte forme di disturbo ambientale causano un incremento della generazione di ROS intraccellulari e sbilanciamento tra i fattori prossidanti e le difese antiossidanti. La
conseguenza di questa alterazione fisiologica sono cambiamenti nello stato redox cellulare, la perossidazione dei lipidi, l’ossidazione di proteine funzionali e l’alterazione del DNA.
La perossidazione lipidica è una delle principali cause della perdita di funzioni cellulari in condizioni di stress ossidativo; questo processo è avviato a causa dell’attacco da parte dei radicali liberi agli acidi grassi polinsaturi, contenuti nelle membrane, la cui fluidità puo’ essere compromessa proprio a seguito di questa reazione. L’attacco alle proteine, in particolare da parte del radicale idrossilico, può modificarne gli aminoacidi e ossidare i gruppi sulfidrilici portando a cambiamenti conformazionali, o ad un’alterata attività enzimatica (Stadman, 1992; Sies, 1993). I ROS possono anche danneggiare il DNA modificandone le basi, ossidandole, o provocando rotture nell’ossatura zucchero-fosfato. I meccanismi antiossidanti comprendono sia complessi enzimatici che non enzimatici, questi ultimi includono il glutatione (GSH) che è il substrato di alcuni enzimi antiossidanti, e svolge un azione di scavenger contro i radicali idrossilici e l’ossigeno singoletto. Il rapporto fra il glutatione ridotto e quello ossidato (GSH/GSSG) nella cellula, perciò, è un buon indicatore di stress ossidativo.
Il sistema di difesa, poi, ha evoluto una batteria d’enzimi atti a combattere la formazione dei radicali dell’ossigeno, tra i quali la superossido dismutasi (SOD), che trasforma l’anione superossido in perossido d’idrogeno, la catalasi (CAT), che metabolizza il H2O2 ad ossigeno molecolare ed acqua, o la perossidasi-glutatione-dipendente (GPOX), che riduce il H2O2 ad acqua con la contemporanea ossidazione del glutatione ridotto (GSH); la reduttasi che catalizza la reazione di riconversione alla forma ridotta (GSH) del glutatione ossidato (GSSG), la trasferasi (GST) che detossifica varie forme di composti tossici che contengono un gruppo elettrofilo utilizzando GSH come cofattore per produrre un composto idrosolubile di più facile espulsione.
L’attività degli enzimi antiossidanti costituisce, potenzialmente, un utile biomarker nelle valutazioni della qualità ambientale.
Essendo difficoltoso interpretare lo stato di efficienza del sistema antiossidante dalle singole risposte, sono stati sviluppati alcuni metodi in grado di quantificare la capacità, di diversi campioni biologici, di neutralizzare i ROS e di fornire un indice di resistenza (o suscettibilità) allo stress ossidativi. Tra questi, la tecnica, nota come Total Oxyradical
Scavenging Capacity Assay (TOSC-A), è in grado di valutare la resistenza totale fornita
Il metodo TOSCA
Il metodo TOSCA è basato sulla reazione tra diverse forme di radicali dell’ossigeno e l’acido a-cheto-g-metiolbutirrico (KMBA), che viene ossidato a gas etilene. In presenza di antiossidanti cellulari, questi competono con il KMBA per i radicali dell’ossigeno, generati artificialmente, e la produzione di etilene è inibita quantitativamente. La cinetica di formazione dell’etilene durante il test è monitorata mediante analisi cromatografiche e la capacità antiossidante di un campione è calcolata in base alla sua abilità nell’inibire la formazione di etilene, rispetto ai controlli (solo ROS e KMBA). Ad ogni campione viene quindi attribuito un valore sperimentale TOSC che varia da 0 a 100 ed indica, rispettivamente, assenza di inibizione della formazione di etilene e massima capacità antiossidante con assenza di ossidazione del KMBA.
1.2 AREA DI STUDIO 1.2 AREA DI STUDIO
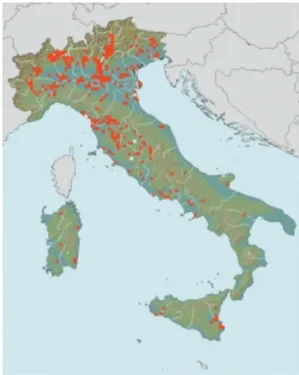
Il fiume Cecina (Toscana centro-meridionale) con i suoi 85 km raccoglie le acque di un bacino idrografico che si estende per circa 900 km2 comprendendo aree di grande valore naturalistico e paesaggistico.
Il corso del fiume è anche soggetto ad una forte pressione antropica, a causa di attività industriali ed estrattive, attuali e pregresse, responsabili sia dell’immissione di contaminati, che del forte emungimento che ne intacca le capacità di autodepurazione. Inoltre, il fiume Cecina risente della presenza di rocce ofiolitiche nel suo bacino, il cui dilavamento determina un fondo naturale elevato per alcuni metalli.
Per quanto riguarda l'impatto antropico, lungo il corso del fiume si registra la contaminazione da metalli pesanti come mercurio, cromo, arsenico, boro, pesticidi di derivazione agricola e fertilizzanti provenienti dagli scarichi degli allevamenti di animali. L’immissione di mercurio in questo ambiente è legata soprattutto all’utilizzo di elettrodi a mercurio utilizzati nei processi produttivi che impiegano il salgemma come materia prima. Esiste poi una contaminazione da boro e arsenico, confinata essenzialmente nell'acquifero del subalveo del fiume Cecina, proveniente da una sorgente localizzata nel bacino del torrente Possera nella valle di Larderello.
La contaminazione da mercurio è localizzata sia nel sedimento del Botro Santa Marta di Saline di Volterra (Comune di Volterra), sia nel suolo e nel sottosuolo dell'area della Concessione Mineraria "Doccini" in località "Canova" nel Comune di Pomarance.
interessa l'acquifero confinato in sponda sinistra del fiume all'altezza della periferia orientale della città di Cecina.
Data la presenza di numerose zone deteriorate, sono in corso iniziative di bonifica in varie aree: nel Botro Santa Marta di Saline di Volterra (Comune di Volterra), è attiva una procedura di bonifica ai sensi del DM 471/99; l’area della Concessione Mineraria "Doccini" è inserita nel Piano Regionale delle Bonifiche (Del. 384 del 21.12.1999); per quanto riguarda, poi, il torrente Possera, risulta in fase di completamento la bonifica di un’area di stoccaggio di minerali di boro all'interno dell'area di pertinenza dello stabilimento chimico di Larderello.
Resta ancora sconosciuta la sorgente di contaminazione responsabile delle alte concentrazioni di boro ed arsenico rilevate nelle acque del torrente Passera, che si riflettono in un degrado qualitativo di tutta l'asta fluviale del Cecina a valle della confluenza.
Il problema della contaminazione del fiume Cecina è stato, inoltre, preso in considerazione nell'ambito della direttiva europea (Water Frame Directive 2000/60 EC) ed è stato pianificato un progetto dettagliato per il risanamento di tale area e per la bonifica dei siti contaminati che prevede il raggiungimento degli obiettivi entro il 2015.
2.
2. SC
SC OPO DELLA TESI
OPO DELLA TESI
Il presente studio ha come obiettivo il perfezionamento di alcune metodologie atte ad analizzare la qualità dell’ambiente fluviale secondo i criteri dell’ approccio ecotossicologico utilizzando molluschi d’acqua dolce come organismi sentinella.
L’attività di tesi si è concentrata su uno studio pilota finalizzato a verificare la possibilità di impiegare un bivalve di acqua dolce, Unio pictorum, per il monitoraggio degli ambienti fluviali.
La procedura scelta è stata quella del “trapianto” degli organismi sentinella all’interno dell’area oggetto dell’indagine.
I biomarker indagati valutano la genotossicità, le alterazioni a carico dei lisosomi, l’attività delle difese antiossidanti ed il bioaccumulo di metalli ed appartengono alla categoria dei
biomarker generali.
Questa ricerca preliminare si inquadra in un più ampio progetto di monitoraggio del Fiume Cecina, finanziato dalla Regione Toscana, al quale partecipano anche ARPAT, ICRAM, CNR per quanto riguarda l’analisi chimica dei sedimenti e delle acque. L’approccio non esclusivamente chimico-fisico dell’analisi ambientale, è contemplato dall’attuale normativa comunitaria che prevede anche saggi sul biota al fine di esprimere una valutazione di qualità ambientale più completa e verosimile possibile.
Figura 4: Mappa del corso del fiume Cecina, differenti qualità ambientali dei siti scelti per il trapianto.
3. MATERIALI E METODI
3. MATERIALI E METODI
3.1 SITI D’INDAGINE3.1 SITI D’INDAGINE
Per lo svolgimento del presente sudio sono state individuate tre stazioni lungo il corso medio-alto del fiume Cecina, caratterizzate da un diverso grado di contaminazione.
Come stazione di controllo è stata scelta la località nota col nome di “Masso degli specchi” nell’area protetta di Berignone, localizzata a monte delle principali fonti di immissione di contaminati. Due siti interessati dalle attività antropiche sono stati individuati presso la confluenza tra il Botro S. Marta e il
Fiume Cecina, nella località di Saline di Volterra (i cui sedimenti sono fortemente contaminati da Hg), e in corrispondenza dell’abitato di Ponteginori (circa 6 Km più a valle rispetto al Botro Santa Marta).
In ognuno di questi tre siti sono stati trapiantati esemplari della specie “sentinella” Unio pictorum
provenienti dal Lago Maggiore, data la difficoltà di reperire, in tutte le stazioni oggetto della ricerca, specie di invertebrati locali idonei all’uso dei biomarker.
3.2
3.2 SPECIE UTILIZZATA E SPECIE UTILIZZATA E TRAPIANTO TRAPIANTO
Molluschi bivalvi (filtratori) hanno capacità di bioaccumulo elevata nei confronti dei principali contaminanti ambientali e sono quindi in grado di fornire un dato integrato nel tempo secondo la biodisponibilità delle sostanze presenti nell’ambiente e gli effetti biologici da esse prodotti. Inoltre, non essendo mobili possono fornire dati riferibili alla stazione di campionamento a differenza dei pesci che, data l’alta mobilità, non consentono di riferire gli effetti biologici osservati alle caratteristiche chimico-fisiche delle stazione i campionamento.
Figura 5: esemplari di Unio pictorum.
ambientale, come specie sentinella per la qualità degli ambienti di acque dolci; sono molluschi bivalvi filtratori, sedentari, specialmente soggetti alla bioaccumulazione e alla concentrazione di contaminanti. Possono essere facilmente trasferiti da un sito di controllo e trapiantati in aree contaminate. Unio è un genere bentonico che può essere utile nel monitoraggio della contaminazione ambientale dei sedimenti dal momento che è una specie altamente sensibile all’inquinamento organico (Charissou A.M. et al. 2003).
Unio pictorum è un mollusco bivalve di acqua dolce dalla conchiglia tipicamente ovale e
allungata, di colore giallo-brunastro. Le dimensione di Unio pictorum possono raggiungere anche i 15 cm di grandezza, e sono correlate a varie classi d’età.
Unio pictorum predilige ambienti con acque abbastanza
veloci, fiumi e laghi in zone di corrente dove vivono infossati nel fondo; scavando il substrato grazie al piede e lasciando all’esterno solo i sifoni inalanti ed esalanti. Le branchie, oltre che alla respirazione, servono anche alla cattura del cibo in quanto funzionano da filtri che convogliano alla bocca i piccoli organismi acquatici. Sono in grado di filtrare fino a 40/l di acqua ogni ora.
A differenza dei bivalvi appartenenti al genere Mytilus, il genere Unio non secerne il bisso (fili di muco che si induriscono con l'acqua di mare che servono per l'ancoraggio) ma produce una sostanza collosa atta allo stesso scopo.
Gli Unionidi sono organismi a sessi separati, a fecondazione esterna. Rilasciano spermii e uova quando la temperatura è favorevole per la loro riproduzione, solitamente con temperature del fondo che superano i 12/14° C.
Le uova sono incubate nelle "tasche incubatrici" del mollusco fino alla formazione della larva glochidium. Questa larva, priva di bocca e ano, vive parassita sulla pelle o sulle branchie di pesci d'acqua dolce e si nutre tramite cellule fagocitarie del mantello della larva. Il glochidio si attacca all'ospite con un filamento adesivo; dopo circa 3-6 settimane le larve si trasformano in giovani che si liberano e si lasciano cadere sul fondo. La maturità sessuale è raggiunta non oltre il terzo anno d’età. L’areale di distribuzione della specie
Unio pictrotum comprende i paesi che si affacciano sul bacino del Mediterraneo. In Italia la
sua presenza è segnalata in tutti i maggiori bacini della penisola, della Sicilia e della Saregna.
Data la difficoltà di reperire lungo il corso del fiume Cecina e nei tre siti oggetto d’indagine, un numero adeguato d’invertebrati idonei all’uso dei biomarker, si è proceduto secondo la
metodologia del “trapianto” degli organismi sentinella all’interno dell’area oggetto dell’indagine.
Un numero sufficiente di organismi sono stati prelevati manualmente in data 6 febbraio 2007 dal Lago Maggiore (Loc. Spiagge d’Oro) dove la specie è particolarmente abbondante (56 individui in media per m2). La qualità delle acque del lago è reputata buona tanto da poterlo considerare come uno tra i migliori laghi italiani e svizzeri (Ricerche sull’evoluzione del Lago Maggiore. Programma quinquennale 2003 - 2007).
Dal momento che la taglia degli individui influenza la diversa capacità di accumulare metalli (Ravera O. et al. 2003), sono stati recuperati individui dalle dimensioni omogenee, variabili tra i 6,5 cm ed i 7,5 cm.
Gli individui dopo essere stati trasportati a Pisa in acqua di lago, sono stati immersi in due vasche areate da miscelatore per un periodo di stabulazione. Il giorno successivo 10 esemplari sono stati analizzati. Altri 10 esemplari sono stati analizzati trascorsi i 13 giorni di stabulazione, passati i quali, gli individui rimanenti, sono stati trapiantati nei tre siti d’interesse. In ogni sito sono stati trapiantati circa 40 individui suddivisi in tre gabbie di plastica (30x30x10cm) contenenti circa 12-15 organismi ciascuna, zavorrate all’esterno da sassi di fiume. Le gabbie sono state poste alla profondità di 1m-1,5m a contatto con il sedimento, ancorate e facilmente recuperabili dalla riva.
Trascorsa una settimana è stato effettuato il primo recupero: da ciascuna delle 9 gabbie sono stati prelevati 5 individui, trasportati in laboratorio in ambiente fresco e umido ed analizzati la mattina successiva. Dopo un mese di permanenza nei siti di studio tutti gli organismi rimanenti sono stati recuperati, trasportati in ambiente fresco ed umido e, un numero pari a 20 organismi per sito, è stato analizzato la mattina successiva alla rimozione.
Figura 6: Areale di distribuzione di Unio pictorum
Figura 7: trapianto in gabbie. da Viarengo et al. modificato.
Figura 8: recupero delle gabbie contenenti Unio pictorum nel sito di Ponteginori
3.3 ANALISI EFFETTUATE 3.3 ANALISI EFFETTUATE
Per il Test di ritenzione del Rosso Neutro sono state usate cellule emolinfatiche. Gli emociti fanno parte di un sistema vascolare aperto, sono quindi omogeneamente esposte ai contaminanti; saggi di laboratorio hanno dimostrato la loro sensibilità agli inquinanti
(Dixon et al., 2002). Negli organismi filtratori le branchie, rappresentano l’organo che
maggiormente si interfaccia con il mezzo ambientale dal momento che sono usate sia per la respirazione che per la nutrizione. Le cellule branchiali tendono ad essere il primo target per i contaminanti per questo motivo sono state scelte per le analisi genotossicologiche (test del micronucleo e comet assay) (Dixon et al., 2002).
La ghiandola digestiva è stata sottoposta, invece alle analisi di biaccumulo e utilizzata nella valutazione di stress ossidativo; negli invertebrati si ritiene che l’epatopancreas sia una delle principali sedi deputate all’accumulo, nel caso gli organismi non siano in grado di espellere un contaminante.
Sia gli organismi provenienti dal Lago Maggiore, sia quelli analizzati dopo i tredici giorni di stabulazione nelle vasche, che quelli trascorsi sette e trenta giorni dal trapianto nei siti d’interesse nel fiume Cecina; hanno subito la stessa manipolazione in laboratorio al fine di eseguire i test descritti.
Test di ritenzione del Rosso Neutro
Gli Unio vengono leggermente aperti sollevando le valve, utilizzando un piccolo scalpellino o una spatola. Si prende una siringa ipodermica da 2,5 ml, modificata con ago che ha calibro di 23 o 25 G. All’interno di questa devono essere contenuti 0,5 ml di acqua minerale. L’ago deve essere fatto passare tra le valve e inserito nel muscolo adduttore anteriore o posteriore dell’individuo, e si aspirano 0,5 ml di emolinfa. Successivamente al prelievo si inietta il contenuto della siringa in provette Eppendorf siliconizzate da 1,5-2 ml. E’ necessario almeno un vetrino per ogni individuo. Circa 50 µl di una soluzione di emolinfa sono posti sui vetrini e sospesi su di un portapipette in una camera umida, consistente, di una vaschetta isolata poco profonda contenente ghiaccio sul fondo, coperto con dei fogli di carta bagnata (temperatura di incubazione di circa 10°C per 15 minuti). L’eccesso di soluzione viene portato via con una pipetta; successivamente 40 µl di soluzione contenente il rosso neutro sono aggiunti al vetrino. Si copre con un coprioggetto 22x22 mm. Si lasciano incubare nella camera umida al riparo dalla luce per 15 minuti. La lettura si esegue con un microscopio ottico a 400 o 500 X. Le cellule appaiono tondeggianti con molti granuli rapporto nucleo/citoplasma basso (granulociti), o con pochi granuli rapporto nucleo/citoplasma alto (ialinociti). Le cellule che vanno contate sono i granulociti, che a bassa temperatura possono presentare espansioni della membrana. Si contano le cellule fino a quando non è stato raggiunto il 50% di cellule rosse e quello è il tempo di ritenzione del colorante al 50 %. La lettura dei vetrini si effettua ad intervalli di 15 minuti per un tempo massimo di due ore.
Analisi statistica del test di ritenzione del Rosso Neutro:
È stata esguita un’analisi multifattoriale della varianza MANOVA e Multiple range test. Le variabili prese in considerazione sono state il tempo di ritenzione del colorante vitale da parte delle mambrane lisosomali ed i diversi siti di studio.
Test del Micronucleo
Una piccola porzione di branchia (1-1,5 cm) di ogni organismo viene posta in 5 ml di PBS (in provette a fondo tondo). Dopo aver eliminato il liquido si aggiungono 2 ml di DISPASI/PBS (1,5 mg/ml). Il preparato viene incubato per 20 minuti a 37°C; passati i quali si blocca l’attività enzimatica della Dispasi versando in ciascuna provetta 4 ml di PBS. Il
contenuto di ogi provetta viene fatto passare attraverso retini di nylon da 50-100 µm e recuperato in piastre pietri sciacqunado bene il retino utilizzato con altri 2 ml di PBS. Tutto il filtrato così recuperato, viene messo in provette a fondo conico. Vengono prelevati a questo punto 100 µl di sovranatante che verranno utilizzati per l’analisi del Comet-assay. Il precipitato cellulare è trattato con 800 µl di una soluzione di prefissativo composto da: Acido Acetico al 5 % , Etanolo al 3 % e 92% di PBS e tenuto a temperatura ambiente. In seguito viene effettuata una centrifugazione per 5minuti a 2000 rpm. Viene eliminato il sovranatante e fissato il precipitato con una soluzione fissativa fredda e fresca costituita da Acido Acetico ed Etanolo in raporto di 1:5. Il preparato resta per 5-10 minuti a temperatura ambiente e successivamente subisce una seconda cetrifuga di 5 minuti a 2000 rpm. Segue un secondo lavaggio con il solito fissativo e un’ulteriore centrifugazione impostata come la precedente. Il precipitato finale di ciascuna provetta viene risospeso delicatamente con una pipetta Pasteur; qualche goccia è fatta cadere su due vetrini da microscopia precedentemente sgrassati con alcool e numerati per ogni organismo. Una volta asciutti, i vetrini, sono colorati con Giemsa al 5%; ed una volta secchi si montano con vetrino coprioggetto e DPX. I preparati sono pronti per essere osservati al microscopio elettronico. Per ogni vetrino sono state lette 500 cellule da lettori diversi; per ogni individuo la frequenza di micronuclei è stata espressa come numero di cellule micronucleate per 1000 cellule lette.
La genotossicità viene espressa come frequenza media di micronuclei ottenuta rispetto al valore medio nei campioni di controllo mantenuti nelle stesse identiche condizioni sperimentali.
Il micronucleo è stato distinto in base alle seguenti caratteristiche: forma rotondeggiante od ovale; dimensioni comprese tra 1/10 e 1/30 del nucleo principale; colore e intesità paragonabili a quelle del nucleo principale; non rifrange alla luce; non presenta connessioni con il nucleo principale.
Analisi statistica del Test del Micronucleo:
Per l’interpretazione statistica dei dati si esegue un’analisi multifattoriale della varianza MANOVA e Multiple range test. Le variabili prese in considerazione sono state la frequenza di micronucleo su 1000 cellule per organismo ed i diversi siti di studio.
Comet assay:
I 100 µl, isolati durante il test del micronucleo, sono stati subito centrifugati per 5 minuti a 1000 rpm, il sedimento risultante è stato unito a 75 ml di low melting agarose (LMA) allo 0.5% dissolto in PBS a 37°C per ogni vetrino che si voleva ottenere. 75 ml della soluzione ottenuta dal mescolamento del sedimento cellulare con LMA, sono stati stratificati su un vetrino da microscopia, adagiato su di una piastra metallica fredda e precedentemente ricoperto con uno strato di NMA (normal melting agarose) 1% secondo Klaude e collboratori, 1996. La deposizione sul vetrino di un coprioggetto ha lo scopo di far distendere lo strato di gel. Quindi il vetrino è stato posto a solidificare al buio per 5 minuti a 4°C. Poi è stato tolto il coprioggetto e sono stati aggiunti 85 ml di LMA. Il vetrino, di nuovo coperto con il coprioggetto è stato lasciato solidificare a 4°C per 5 minuti.
Dopo la solidificazione del terzo strato di gel, è stato delicatamente tolto il vetrino coprioggetto ed i vetrini sono stati immersi nella soluzione di lisi e tenuti in frigorifero per almeno un’ora, al buio, a 4°C. I vetrini così preparati possono rimanere in lisi per non più di un mese.
I vetrini preparati sono stati tolti dalla soluzione di lisi e disposti in una camera elettroforetica orizzontale. Quindi, sono stati ricoperti con una soluzione tampone alcalina fredda (NaOH 300 mM, Na2EDTA 1 mM, a pH ≥13) allo scopo di denaturare la doppia elica del DNA, per 10 minuti. Avvenuta la denaturazione del DNA, è stata eseguita la corsa elettroforetica della durata di 5 minuti a 25 V e 300 mA.
Dopo la corsa i vetrini sono stati trattati per tre volte con 2 ml di una soluzione neutralizzante (Tris-HCl, pH 7.5) al fine di ripristinare un pH quasi neutro e consentire la successiva colorazione.
Successivamente i vetrini sono stati immersi nel metanolo freddo (-20°) per tre minuti per un migliore e più veloce essiccamento. I vetrini così preparati, una volta asciutti, possono essere conservati in scatole portavetrini, in ambiente secco.
Al momento dell’osservazione i vetrini sono stati colorati con 100 ml di bromuro di etidio (2 mg/ml) ed analizzati al microscopio a fluorescenza (Jeneval) a 50 ingrandimenti. La migrazione del DNA verso l’anodo, proporzionale al danno genetico, è stata valutata mediante un sistema di analisi dell’immagine collegato al microscopio (Komet 4, Kinetic imaging, Ltd). Il parametro utilizzato per valutare il danno al DNA è la percentuale di DNA migrato nella coda che dà origine a formazioni simili a "comete"; la lunghezza della "coda" è direttamente proporzionale all'entità del danno (Singh et al. 1988; Singh et al. 1990). Per ogni animale sono stati preparati 2 vetrini, per ogni vetrino sono state lette 50 cellule.
Tutte le operazioni sono state svolte ad una temperatura di 20°C ed in condizione di luce gialla per non indurre ulteriori rotture al DNA.
La metodica del test del Comet, condotta nella versione alcalina (pH >13), permette di evidenziare non solo discontinuità nello scheletro fosfodiesterico del DNA che possono interessare sia il singolo (SSB, single-strand breaks) che il doppio filamento (DSB, double-strand breaks) della molecola dell'acido nucleico, ma anche siti aperti dall'azione incompleta dei sistemi enzimatici di riparo per escissione, nonché quelle alterazioni che le condizioni alcaline del test riconducono a rotture della molecola di DNA (siti alcali-labili, SAL) come, ad esempio, i siti apurinici e apirimidinici.
Analisi statistica del Comet Assay
Le differenze nella percentuale di frammentazione del DNA sono state analizzate tramite analisi multifattoriale della varianza (MANOVA). E’stata analizzata la differenza tra siti.
Diffusion assay
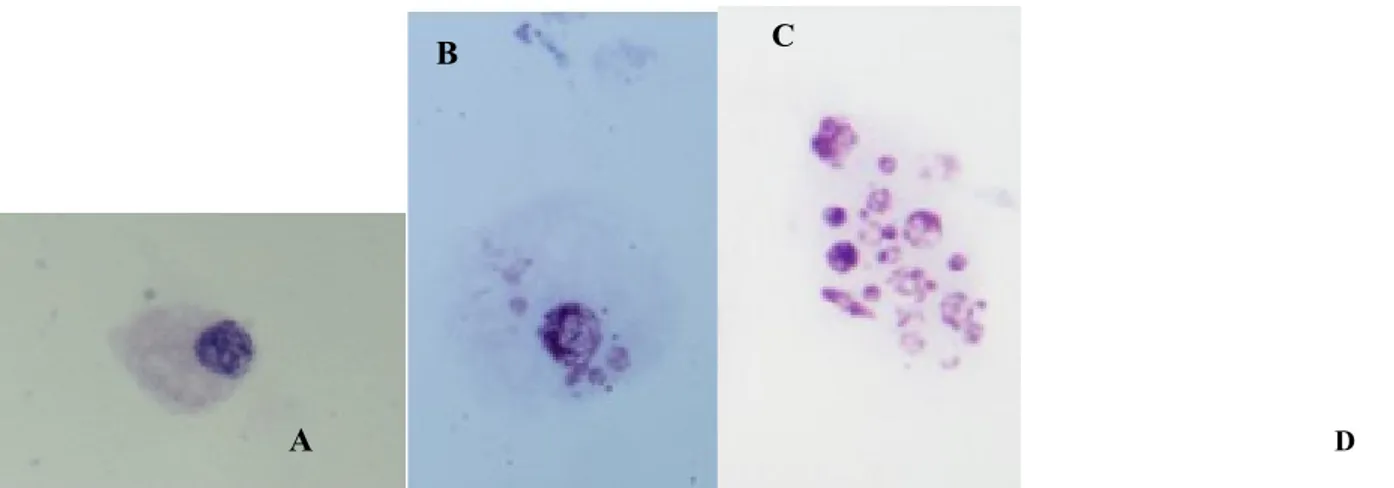
Nel Diffusion Assay, un test di diffusione del DNA nel gel di agarosio, i vetrini sono preparati secondo lo stesso protocollo del test della Cometa con la differenza che vengono tolti dalla soluzione di lisi passata un’ora dalla loro immersione, non sottoposti ad elettroforesi, lavati con un tampone neutro, colorati con bromuro di etidio ed osservati al microscopio a fluorescenza. Le cellule apoptotiche vengono distinte in base al caratteristico pattern di colorazione del DNA, estremamente diffuso (figura 9). Infatti, in condizioni neutre, non usando elettroforesi, un’estensiva diffusione del DNA si può verificare solo se questo ha un peso molecolare molto basso ed ha subito un’ampia degradazione a seguito di DBS.
Cellula apoptotica
Figura 9. Diffusion assay: pattern di diffusione del DNA nel gel, di una cellula non danneggiata (A); cellule con vari gradi di danno al DNA ma non apoptotiche (B, C e D) ed una cellula apoptotica (E).
Attività delle difese antiossidanti e bioccumulo
Una volta prelevata l’emolinfa e sezionate le branchie,ad ogni individuo analizzato, è stato dissezionato l’epatopancreas, incartato in alluminio e immerso in azoto liquido; conservato poi a –80°C e trasportato in giaccio secco presso il dipartimento di biologia e gentica dell’Università Politecnica delle Marche per valutare le attività delle difese antiossidanti, ed il bioaccumulo di metalli.
Attività delle difese antiossidanti
Le attività e concentrazioni dei vari sistemi antiossidanti analizzati in questa tesi sono state misurate con specifici saggi spettrofotometrici, utilizzando uno spettrofotometro dotato di sistema per la termostatazione dei campioni.
Per il saggio del glutatione totale, al momento dell’analisi, sono stati preparati degli omogenati 1:5 (rapporto peso/volume) di tessuto epatico, in un working-buffer contenente: acido sulfosalicilico al 5% (o acido perclorico 8 M) ed EDTA 4 mM. L’omogenato ottenuto è stato lasciato in ghiaccio per 45 minuti, necessari per la deproteinizzazione, centrifugato in a 37.000 x g per 10-15 minuti ed il sovranatante è stato utilizzato per il saggio del glutatione totale.
Questo saggio segue il metodo enzimatico di Akerboom e Sies (1981), dove il glutatione ossidato viene prima ridotto dalla glutatione reduttasi, e quindi reagisce, insieme a quello originariamente presente in questa forma, con l’acido 5,5’-ditio-bis-nitrobenzoico (DTNB), secondo la seguente reazione:
2GSH + DTNB → 2TNB + GSSG
Da questa reazione si forma il glutatione ossidato e il TNB, la cui formazione è seguita spettrofotometricamente a lunghezza d’onda pari a 412 nm. Il tasso di formazione di TNB è proporzionale alla concentrazione di glutatione totale, che viene valutata grazie ad un confronto con l’assorbanza di soluzioni standard di glutatione ridotto (5-15 µM) diluite in tampone K-fosfato 100 mM, pH 7. Dai valori di assorbanza ottenuti dagli standards viene poi sottratto quello del “bianco”. Le condizioni finali in saggio in 1 ml totale sono: standard (o “bianco” o campione), DTNB 0.1 mM, NADPH 5 mM, GR 1 U in tampone K-fosfato 100 mM, pH 7.