ALMA MATER STUDIORUM
UNIVERSITA' DI BOLOGNA
__________________________
FACOLTA' DI SCIENZE MATEMATICHE FISICHE E NATURALI
Corso di laurea magistrale in BIOLOGIA MARINA
CARATTERIZZAZIONE DEI PARAMETRI FISIOLOGICI DI
MICROALGHE UTILIZZABILI NEI PROCESSI DI
FITODEPURAZIONE
Tesi di laurea in Botanica Marina Applicata
Relatore
Presentata da
Prof.ssa Rossella Pistocchi Giuseppina Larivera
III sessione
_____________________________
Anno Accademico 2010/2011
III Sommario
INTRODUZIONE ... 1
1.1LE MICROALGHE E LE LORO APPLICAZIONI ... 1
1.2TECNICHE DI COLTIVAZIONE DELLE MICROALGHE PER SCOPI INDUSTRIALI ... 5
1.3DEPURAZIONE DELLE ACQUE REFLUE ... 8
1.3.1 Depurazione dei reflui: metodo tradizionale... 8
1.3.2 Depurazione dei reflui con l’utilizzo di microalghe... 9
1.4FATTORI ABIOTICI E BIOTICI CHE REGOLANO LA CRESCITA ALGALE ... 12
1.4.1 Mescolamento o mixing ... 12
1.4.2 Nutrienti ... 13
1.4.2.1 Uptake di nutrienti ... 16
1.4.3 Temperatura ... 18
1.4.4 Luce e fotosintesi ... 19
1.4.4.1 Fluorescenza della clorofilla, quenching fotochimico e non fotochimico. ... 22
1.4.4.2 Relazione tra assorbimento della luce e fotosintesi netta ... 24
1.4.4.3 Fotoacclimatazione ... 26
1.4.5 Rapporti con altri livelli trofici ... 27
MATERIALI E METODI ... 31
3.1PIANO SPERIMENTALE ... 31
3.2SPECIE ALGALI UTILIZZATE ... 32
3.3TERRENO DI COLTURA ... 37
3.4COLTURE BATCH E IN SEMICONTINUO ... 37
3.5ANALISI DELLE PROTEINE ... 38
3.6ANALISI POLISACCARIDI ... 40
3.6.1 Estrazione dei polisaccaridi ... 40
3.6.2 Determinazione dei polisaccaridi ... 40
3.7ANALISI DELLA CLOROFILLA A ... 41
3.8MISURA DELL’ATTIVITÀ FOTOSINTETICA ... 41
3.8.1 Induction curve e Light curve ... 44
3.9ANALISI QUALITATIVA E QUANTITATIVA DEL FITOPLANCTON ... 46
3.9.1 Conservazione dei campioni ... 46
3.9.2 Preparazione dei campioni per il conteggio ... 46
3.9.3 Conteggio dei campioni ... 46
3.9.4 Calcolo del biovolume ... 47
3.10ANALISI NUTRIENTI ... 49
3.10.1 Analisi dei fosfati ... 49
3.10.2 Analisi dei nitrati ... 50
3.10.3 Analisi nitriti ... 50
3.10.4 Analisi dell’azoto ammoniacale ... 51
RISULTATI E DISCUSSIONE ... 53
4.1COLTURA DI SCENEDESMUS SP. IN SEMICONTINUO... 53
4.2POPOLAZIONE NATURALE IN COLTURA BATCH ... 66
CONCLUSIONI ... 75
1
Introduzione
1.1 Le microalghe e le loro applicazioni
Le microalghe, insieme ai cianobatteri che con le microalghe condividono il metabolismo bioenergetico (la fotosintesi ossigenica) ma ne differiscono per la struttura cellulare (eucariotica nelle prime, procariotica nei secondi), sono organismi unicellulari fotoautotrofi che, a partire da CO2 ed energia solare, producono
zuccheri per il proprio metabolismo energetico e biosintetico, ed ossigeno che in parte usano con la respirazione ed in parte rilasciano nel mezzo esterno; sono inoltre direttamente responsabili di quasi il 50% della fotosintesi sulla terra (Tredici, 2007).
Comunemente questi microrganismi presentano un contenuto di proteine, carboidrati e grassi che varia notevolmente secondo le specie e le caratteristiche dell’ambiente in cui crescono: i lipidi, ad esempio, sono compresi tra un minino dell’1 % ed un massimo del 40 % del loro peso secco. Tali quantità possono variare in relazione alle condizioni di allestimento delle colture e alla temperatura così, quando le alghe unicellulari crescono in situazioni di carenza di sostanze nutritive, possono incrementare la resa di lipidi ad oltre il 70 % del loro peso secco e raggiungere valori di produttività pari a 12-14 g DW (peso secco) m-2 day-1 (Walker, 2009; Mata, 2010 ).
Gli studi svolti per potenziare l’impiego delle alghe come coltura a uso energetico in diverse regioni del mondo hanno evidenziato la loro flessibilità. E’ stato dimostrato che la crescita delle microalghe risulta notevolmente più rapida di quella delle piante terrestri se le alghe sono opportunamente fornite di nutrienti, luce e CO2
(Pulz, 2001). Diverse aziende stanno infatti dimostrando come le alghe possano essere utilizzate nella produzione di carburante per i trasporti e di ingredienti per mangimi, o persino quale fonte di combustione per la generazione di energia da biomassa (Rittmann, 2008).
2
Rispetto ad altre colture energetiche, le alghe presentano diversi vantaggi: comprendono organismi con cicli di crescita brevi e, a differenza di altre colture stagionali, possono essere coltivate tutto l’anno. Ma soprattutto non ha bisogno di terreni agricoli o di acqua pulita e, di conseguenza, non sottrae risorse per l’agricoltura e quindi non va a sottrarre spazio per la produzione di fonti alimentari. Le alghe non necessitano, come detto, di acque particolarmente pulite: grazie alla loro naturale resistenza sono infatti in grado di prosperare perfino nelle acque reflue. Se confrontato direttamente con altre colture energetiche, inoltre, l'uso di questi organismi risulta più vantaggioso in termini economici data la loro maggiore produttività per ettaro di terreno rispetto al granturco, alla soia o alla palma da olio e, a differenza di queste colture, la biomassa che generano può essere utilizzata interamente nei prodotti finiti (Brennan, 2010). Ad esempio, mentre da un ettaro di palma da olio, la coltura oleaginosa a più alto rendimento in grasso, è possibile recuperare circa 6.000 litri di prodotto, è stato stimato che dalla stessa superficie coltivata a microalghe è possibile ottenere quasi 20.000 litri di olio. Le microalghe hanno strutture cellulari semplici e quindi è semplice controllare la loro composizione cellulare senza andare a diminuire la produttività, inoltre possiedono valori di rendimento quantico, legato alla fotosintesi, che varia dal 3% all’8% dell’energia solare che è convertita in biomassa e, se confrontata con le piante terrestri (0,5%), risulta notevolmente maggiore (Verma et al., 2010). Questi organismi, poi, oltre a poter essere impiegati nella produzione di biocarburanti rinnovabili, contribuendo pertanto a ridurre la dipendenza dai combustibili fossili, sono in grado di trarre nutrimento dalle emissioni di CO2 derivanti dalle centrali
elettriche a combustibili fossili e di abbatterne le emissioni producendo al contempo biomasse ricche di oli (Scott, 2006).
Si ritiene che la prima coltivazione di alghe sia avvenuta a opera di Beijerinck nel 1890 utilizzando la microalga Chlorella che tutt’oggi è una delle microalghe più coltivate per scopi commerciali. I primi studi sulla possibilità di coltivare le microalghe per fini energetici invece risalgono alla fine degli anni quaranta del secolo scorso quando Hans Gaffron individuò una microalga, del genere Scenedesmus, in grado di produrre idrogeno in condizioni di anaerobiosi (Graffron, 1942). L’attenzione verso nuove fonti di energia alternative a quelle fossili, ha rinnovato gli sforzi della ricerca circa l’impiego di tale risorsa, tuttavia a causa degli
3
elevati costi capitali e di gestione degli impianti non è stata ancora avviata la fase di produzione commerciale. Le ricerche puntano ad ottenere valori di produzione con rendimenti prevedibili e, per far sì che il bilancio energetico della produzione di biocombustibili da microalghe risulti positivo, è basilare mettere a punto sistemi di coltura e processi a basso costo. Lo sviluppo su scala industriale di queste tecnologie contribuirà a ridurre la dipendenza dalle fonti energetiche non rinnovabili di molti Paesi e favorirà la diffusione di biocombustibili realmente sostenibili. Microalghe di varie specie, come Haematococcus pluvialis, Arthrospira platensis e Dunaliella salina, vengono già prodotte a livello commerciale in vari Paesi per l’estrazione di carotenoidi o per la produzione di integratori alimentari; nell’industria mangimistica le microalghe rivestono particolare importanza per l’allevamento di avannotti, di molluschi bivalvi, e per la formulazione di alimenti per il bestiame poiché ricche di acidi grassi ω3 e ω6. Per l’industria alimentare è utilizzata la presenza, nelle microalghe, di sostanze come il ß-carotene, che viene utilizzato come colorante alimentare e integratore dietetico; il glicerolo, un altro prodotto delle microalghe, è usato negli alimenti, nei cibi e nelle bevande. Infine nell’industria farmaceutica le microalghe sono utilizzate per l’estrazione di acidi grassi polinsaturi ad elevato valore nutraceutico, come ad esempio l’Epa (acido eicosapentaenoico) e il Dha (acido docosaesaenoico), e per la produzione di diagnostici avanzati come le ficobiliproteine su cui si basa la realizzazione di biosensori (Mc Hugh, 2003; Pulz et al., 2004).
Ancora in fase sperimentale sono le coltivazioni di specie utili per il risanamento di reflui contaminati da xenobiotici e metalli pesanti e per la produzione di biodiesel e idrogeno. Le ricerche in tal senso sono volte a conseguire elevati volumi di produzione con rendimenti prevedibili e programmabili, tali da riuscire a soddisfare significativamente il fabbisogno di carburanti per veicoli, poiché al momento i costi risultano ancora non economicamente vantaggiosi. Alcune analisi economiche dimostrano che il biodiesel di origine algale, anche in relazione all’ottimizzazione della tecnologia e alla crescita incontrollata del prezzo del petrolio, potrà diventare entro breve tempo competitivo con i carburanti tradizionali (Chisti, 2008). Recenti pubblicazioni hanno dimostrato inoltre che a partire dall’olio algale è possibile produrre biocarburanti utilizzabili anche nel settore dell’aeropropulsione (Daggett et al., 2007).
4
Un ulteriore campo di applicazione in cui sono utilizzate le alghe è quello del trattamento dei reflui di origine urbana o industriale. Questo impiego inoltre potrebbe essere associato alla produzione di biodiesel riducendo significativamente i costi di produzione utilizzando le acque reflue civili o industriali (Schenk et al., 2008; Godos, 2009). Le attività sociali, produttive e ricreative, principalmente in ambito urbano, richiedono ed utilizzano una grande quantità di acqua. La conseguenza diretta dell'utilizzo dell'acqua è la produzione di scarichi che, per poter essere restituiti all'ambiente, devono necessariamente essere sottoposti ad un trattamento depurativo. Le acque reflue prodotte dai centri abitati, che in passato contenevano quasi esclusivamente sostanze biodegradabili, presentano attualmente maggiori problemi di smaltimento a causa della presenza sempre più ampia di composti chimici di origine sintetica, impiegati prevalentemente nel settore industriale. Il mare, i fiumi ed i laghi non sono in grado di ricevere una quantità di sostanze inquinanti superiore alla propria capacità autodepurativa senza vedere compromessa la qualità delle proprie acque ed i normali equilibri dell'ecosistema. E' possibile quindi depurare le acque reflue urbane attraverso il sistema di fitodepurazione riproducendo processi biologici che avvengono naturalmente nei corpi idrici, la depurazione risulta però molto più veloce negli impianti rispetto ai corsi d’acqua grazie all’energia impiegata. Le acque reflue urbane, quindi possono essere utilizzate come fonte di nutrienti per la coltivazione di microalghe per vari fini commerciali. Lo sfruttamento dei reflui in tal senso permette di ridurre il costo di produzione delle microalghe, poiché i sali nutritivi necessari non devono essere acquistati ma provengono da una fonte a costo zero.
Una particolare attenzione va ai reflui industriali poiché contengono una gran varietà di inquinanti (svariate sostanze chimiche organiche, petrolio e i suoi derivati, metalli come Hg, As, Pb, Cr, sali minerali e composti chimici inorganici, sabbie e detriti, sostanze o scorie radioattive) e la loro composizione varia secondo il tipo di processo produttivo. È accertato che per quanto riguarda alcuni metalli pesanti le microalghe riescono a sopravvivere e a depurare il refluo ma le conoscenze riguardo alla depurazione di altre sostanze tossiche sono ancora poco conosciute.
5
1.2 Tecniche di coltivazione delle microalghe per scopi
industriali
La coltivazione delle microalghe su larga scala avviene in bacini, vasche, fotobioreattori e fermentatori con tecniche e volumi diversi, secondo la specie coltivata e le particolari applicazioni. La coltivazione in bacini (open ponds) o vasche è largamente usata per scopi commerciali; strutture simili sono i raceway ponds, bacini di maggiore estensione e profondità rispetto ai primi, nei quali le microalghe seguono percorsi simili a circuiti (raceway ponds). Un’elica, in continuo movimento, evita l’accumulo delle alghe sul fondo, assicurando una sufficiente quantità di luce per lo svolgimento della fotosintesi (Figura1.1). La profondità di questi bacini è inversamente correlata alla concentrazione cellulare e alla quantità di luce disponibile. Profondità di 15-40 cm rappresentano un compromesso fra esigenze contrastanti quali il dispendio di energia per l’agitazione e la raccolta (pale rotanti, pompe per acqua) e l’escursione termica diurna (Barbato, 2009; Godos, 2009).
Figura 1.1 In alto a sinistra: Raceways ponds di Haematococcus pluvialis. Impianto Cyanotech (Hawaii). In alto a destra: particolare delle pale che permettono il movimento continuo della coltura. In basso a sinistra: Open ponds di Dunaliella salina in Australia. In basso a destra: Raceways ponds.
6
Sono stimati valori di produttività per Chlorella pari a 15 - 25 g DW m-2 day-1 in
open pond con una superficie che va dai 500 ai 5.000 m2 ad una profondità di 10-30
cm. La crescita di Chlorella e Scenedesmus è stata inoltre sperimentata in un particolare sistema all’aperto chiamato Thin-Layared Sloping System, che ha la particolarità di avere una vasca con un piano inclinato e un sistema di pompe che permettono alla coltura di scorrere continuamente e ricevere quindi maggior luce. I risultati che si sono ottenuti sono rispettivamente pari a 24 g DW m-2 day-1 per
Chlorella e 19 g DW m-2 day-1 per Scenedesmus (Grobbelaar, 2010). Questi
impianti sebbene sono costituiti da strumentazioni semplici presentano l'inconveniente di mantenere mutevoli i parametri ambientali come la temperatura, la concentrazione salina e dei gas disciolti nell'acqua. Ad esempio, il volume dell'acqua può diminuire a causa dell'evaporazione o aumentare per le precipitazioni, mentre la temperatura può avere delle escursioni termiche giornaliere e stagionali. La produttività, poi, può ridursi per l'attività di alcuni parassiti o predatori che contaminano le acque: per ovviare a questo inconveniente spesso si coltivano le alghe unicellulari in ambienti con elevata salinità. Questo accorgimento, però, se da un lato evita la competizione con altre specie acquatiche dall'altro limita le specie di alghe che possono essere impiegate nel processo (Di Termini, 2011). Così, per ottenere rese in biomassa più elevate, coltivare anche varietà algali che prediligono concentrazioni saline più basse, mantenere costanti le variabili ambientali ed impedire la contaminazione di altri microrganismi sono stati sperimentati i fotobioreattori, strutture chiuse nelle quali le alghe unicellulari non sono a contatto diretto con l'esterno. È stato dimostrato come questi sistemi abbiano un elevata efficienza e permettono di raggiungere valori alti di biomassa (da 2 a 5 g/L) rispetto agli open ponds (Lee, 2001; Wang et al., 2008) con valori di produttività da 50 a 200 g DW m-2 day-1 (Grobbelaar, 2009). In regimi di irradianza elevata, la massima velocità di produzione di ossigeno, prodotto finale della fotosintesi, in un tipico fotobioreattore tubolare, può essere superiore ai 10 gO2 m -3
min-1. Livelli di ossigeno molto superiori ai valori di saturazione corrispondenti alla composizione dell’aria possono inibire la fotosintesi (Molina et al., 2001). Inoltre, un’elevata concentrazione di ossigeno disciolto in combinazione con alte intensità luminose può determinare processi foto-ossidativi in grado di danneggiare le cellule
7
algali. Per questo motivo si devono porre in essere degli accorgimenti impiantistici che consentano l’eliminazione dell’ossigeno dalla coltura quando i livelli di quest’ultimo crescono oltre determinati limiti.
Attualmente sono disponibili differenti modelli di fotobioreattori (Figura 1.2), sebbene tutti possono essere ricondotti a quattro tipologie fondamentali, quali: a colonna, grossi cilindri posti verticalmente, realizzati in vetro o plexiglas; a tubi (tubular reactors), simili ai precedenti ma caratterizzati da un diametro inferiore e disposti orizzontalmente od obliquamente; a pannelli (flat panels), vasche in vetro con una faccia molto più estesa dell'altra e collocate in successione; a sacco (plastic bags), grandi buste di plastica trasparente di forma varia.
Indipendentemente dalla tipologia, tutti i sistemi chiusi presentano una gestione più complessa ed un costo capitale e operativo degli impianti molto più alto degli open ponds. I numerosi vantaggi presentati dai fotobioreattori hanno spinto molti studiosi a ritenere che i fotobioreattori si diffonderanno in futuro più delle semplici vasche all'aperto sebbene, prima di sostenere una simile previsione, si dovrebbe valutare attentamente sia i costi di produzione della biomassa algale sia il consumo energetico derivante dell'impiego dei reattori chiusi. Nonostante i miglioramenti tecnici apportati ai fotobioreattori essi continuano ad avere un elevato costo e una gestione più complessa e dispendiosa rispetto agli open pond.
8
1.3 Depurazione delle acque reflue
1.3.1 Depurazione dei reflui: metodo tradizionale
Il trattamento delle acque di scarico si basa normalmente su processi di ossidazione. L’obiettivo primario del trattamento delle acque consiste nella rimozione o riduzione della domanda biochimica di ossigeno (BOD) dei solidi sospesi, dei nutrienti, dei batteri coliformi e della tossicità. Il BOD è una misura della richiesta respiratoria dei batteri che metabolizzano la sostanza organica presente nello scarico. I sistemi di depurazione degli scarichi non basati su alghe dipendono comunque da popolazioni microbiche naturali e dalle loro attività quali crescita, respirazione e fermentazione, che trasformano la materia organica in biomassa microbica e in prodotti terminali quali metano, CO2, ammonio, ecc.. È stato
dimostrato che circa l’80% dell’ossigeno dissolto nelle vasche di sedimentazione primaria deriva dall’attività fotosintetica delle microalghe e che quindi l’apporto di ossigeno alle vasche di depurazione dipende maggiormente dall’attività algale che dallo scambio gassoso che avviene tra aria ed acqua (Pearson, 2003). I sistemi di depurazione presentano alcune limitazioni ad esempio nel fatto che i rifiuti non vengono completamente stabilizzati e che il processo non ha nessun altra utilità. Il D.M. del 18 settembre 2002, n. 198 ―Modalità di attuazione sullo stato di qualità delle acque, ai sensi dell'art. 3, comma 7, del D.Lgs. 11 maggio 1999, n. 152‖ riguarda i dati e le informazioni relative all'attuazione delle direttive europee 91/271/CEE concernente il trattamento delle acque reflue urbane. In particolare, le informazioni relative al settore 2 del Decreto che riguarda la disciplina degli scarichi (Parte A - TRATTAMENTO DELLE ACQUE REFLUE URBANE e Parte B - SCARICHI INDUSTRIALI E DA INSEDIAMENTI PRODUTTIVI).
In un impianto di depurazione possiamo distinguere vari livelli di trattamento dei reflui:
Trattamenti preliminari: Trattamenti finalizzati alla rimozione di parti grossolane, sostanze abrasive e oleose, che non possono essere ammesse ai trattamenti successivi (Masotti, 1987).
9
Trattamento primario: Trattamento delle acque reflue mediante un processo fisico e chimico che comporta la sedimentazione dei solidi sospesi e, a seguito del quale il BOD5 delle acque reflue in arrivo sia ridotto almeno del 20% prima dello scarico e i solidi sospesi totali delle acque reflue in arrivo siano ridotti almeno del 50% (D. Lgs.n.152/99).
Trattamento secondario: Trattamento delle acque reflue mediante un processo che in genere comporta il trattamento biologico con sedimentazioni secondarie, o un altro processo mediante il quale siano rispettati per lo scarico i requisiti di cui all'allegato 5 del D.Lgs. 152/99 (D. Lgs.n.152/99).
Trattamento terziario: Trattamento successivo che subisce l'effluente di un impianto dopo il trattamento secondario ossidativo e di sedimentazione. Si ha la rimozione dei solidi sospesi residui solitamente tramite filtrazione su mezzo granulare.
Sono chiamati così anche i trattamenti di abbattimento dei nutrienti (azoto e fosforo) (Masotti, 1987).
Disinfezione: è essenziale per l'abbattimento della carica microbica dell'acqua in uscita dall'impianto, riducendola a valori di concentrazione residua accettabili dal punto di vista sanitario e ambientale.
1.3.2 Depurazione dei reflui con l’utilizzo di microalghe
Recentemente il nuovo campo della fitodepurazione è centrato sull’uso di microalghe al posto delle macrofite al fine di ottenere numerosi vantaggi come la diminuzione della superficie utilizzata e dei costi effettivi inoltre richiedono meno energia inoltre viene incrementata la produzione di biomassa algale utilizzabile (Um e Kim, 2009;Park e Craggs, 2010). Nei sistemi basati sulle alghe l’ossigenazione dipende dall’attività fotosintetica e non dalla fornitura meccanica di aria. Perché il processo di rimedio abbia successo, la quantità di O2 prodotta con la fotosintesi deve
superare il valore di BOD misurato. L’attività fotosintetica delle microalghe produce l’ossigeno necessario per ossidare la materia organica presente nelle acque di scarico in entrata al sistema; l’azione inversa, svolta da particolari batteri presenti in natura, tende a scindere le sostanze organiche complesse in sostanze semplici
10
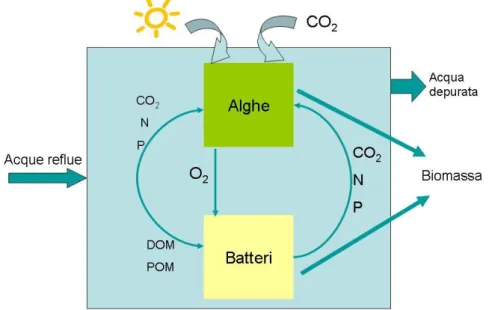
inorganiche (processo di mineralizzazione) (Figura 1.3). A seconda della tipologia di batteri che intervengono nel processo, ad esempio batteri aerobi come Nitrosomonas e anaerobi come Nitrobacter, la semplificazione della sostanza organica può avvenire o meno in presenza di ossigeno; in tal caso si sviluppano le condizioni rispettivamente di aerobiosi e di anaerobiosi. Sono ampiamente approvati gli studi che affermano la relazione tra batteri e alghe negli impianti di depurazione (Garcìa et al., 2008; Kim, 2007). Sia in ambiente naturale (autodepurazione) che artificiale (impianto di trattamento), l'azione di popolazioni microbiche diverse e in cooperazione tra loro porta alla degradazione delle sostanze inquinanti presenti nelle acque attraverso processi di mineralizzazione e di raccolta in un materiale semisolido (fango) che in seguito può essere separato dalle acque per sedimentazione. I batteri eterotrofici aerobi, responsabili dell’ossidazione, utilizzano l’ossigeno disciolto e producono anidride carbonica (CO2), azoto (N) e fosforo (P)
che insieme all’irradiazione solare permettono il processo di crescita algale.
Figura 1.3 Rappresentazione schematica del processo di biorimedio da parte delle alghe e interazione con i batteri.
La depurazione attraverso trattamenti biologici, come detto, sfrutta tecnologie basate essenzialmente su fenomeni naturali fatti svolgere in ambienti creati artificialmente, in modo che i parametri che regolano tali processi possano essere
11
controllati in maniera ottimale. Le microalghe utilizzate in questo processo necessitano di particolari condizioni ambientali, i principali parametri che vengono monitorati per controllare e migliorare la crescita algale sono luce e temperatura, è stato dimostrato che l’intensità e la qualità delle radiazioni luminose influenzano la crescita e la riproduzione degli organismi algali, i quali possono fotoacclimatarsi a varie intensità di energia luminosa ed avere un’efficienza fotosintetica più elevata a bassi o alti regimi di luce (Grobbelaar, 2003; Rawat 2011). Per trattamenti biologici intendiamo sistemi solitamente impiegati come trattamenti secondari, finalizzati alla rimozione delle sostanze organiche biodegradabili; tali trattamenti comprendono altresì la rimozione dei solidi in forma colloidale, non sedimentabili e quindi non separabili con trattamenti di tipo fisico. Per via biologica possono essere rimossi anche l'azoto (tramite i processi di nitrificazione-denitrificazione) e il fosforo. La comunità di microrganismi, utile al processo di depurazione, è costituita principalmente da batteri, microalghe e da una variegata microfauna, che in parte sono già presenti nel liquame da trattare, in parte provengono dall'ambiente circostante. Lo sviluppo e la crescita di questa comunità biologica è quindi determinata dalla sostanza organica contenuta nel liquame da depurare. Sono stati ideati diversi tipi di bacini con la funzione di depurare le acque reflue attraverso le microalghe, ad esempio i bacini algali ad alta velocità (HRAP). Queste vasche hanno una bassa profondità (20-100cm) è presente inoltre un sistema di mescolamento che impedisce la stratificazione termica e la sedimentazione delle alghe con una velocità della massa d’acqua di 0,15-0,3 m/s, il tempo di residenza idraulico, cioè il tempo medio nel quale il volume totale di substrato che si trova all’interno del sistema va da 2 a 8 giorni, le alghe principalmente usate sono Chlorella, Scenedesmus e Spirulina (Park et al., 2011). Un altro sistema è quello a bacini integrati, consiste in un sistema di depurazione formato da 3 o più bacini che operano in serie. Il trattamento iniziale avviene in bacini anaerobi, questi hanno la funzione di far sedimentare la massa solida oppure in bacini facoltativi che sono in grado di trattenere il materiale sedimentabile e abbattere buona parte del BOD; seguono le HRAP e quindi i bacini di maturazione per la purificazione finale dell’effluente.
12
1.4 Fattori abiotici e biotici che regolano la crescita algale
In un sistema di coltivazione microalgale è fondamentale tenere sotto controllo, quando possibile, alcuni parametri che regolano la crescita di questi organismi (Tabella 1.1). Nei seguenti paragrafi sono discussi i principali fattori che influiscono sulla crescita algale in sistemi di coltivazione delle microalghe.
Fattori abiotici Fattori biotici Fattori operativi [ ] Nutrienti Patogeni (batteri, virus) Mixing
Salinità Predazione da parte dello zooplancton [ ] Sostanze tossiche Competizione
[ ] O2, [ ] CO2, pH
Temperatura Luce
Tabella 1.1 Fattori che influenzano la crescita algale, modificato da (De La Noie, 1992).
1.4.1 Mescolamento o mixing
La fonte di energia preferibile per la fotosintesi delle alghe coltivate è il sole, negli impianti di coltivazione che hanno bassa profondità le alghe tendono a sedimentare e ad allontanarsi dalla luce e adagiandosi sul fondo potrebbero consumare i nutrienti presenti nell’acqua circostante per cui è importante che, per ottimizzare la crescita, le colture vengano mescolate. La crescita delle microalghe quindi dipende strettamente dal mixing che viene effettuato nei sistemi di coltivazione delle alghe sia negli open ponds che nei fotobioreattori. Per mantenere in sospensione le microalghe è necessario fornire alla coltura un’aerazione, con aggiunta di CO2,
moderata ma continua come ad esempio nei fotobioreattori o un movimento regolare fornito da pale meccaniche nel caso degli open ponds che, oltre ad evitare che le microalghe precipitino sul fondo, fa sì che ogni singola alga riceva adeguate quantità di luce e di nutrienti.
13
1.4.2 Nutrienti
Tra tutti i fattori ecologici capaci di influenzare la crescita algale, la disponibilità di nutrienti è senza dubbio uno dei più importanti, dopo luce e temperatura (Morabito, 1997). Il fitoplancton necessita di macro e micronutrienti, i macronutrienti sono quelli necessari in maggiori quantità e sono i componenti strutturali delle cellule o sono elementi importanti per l’osmoregolazione ad es.: C, H, O, N, P, S, Mg, Ca, K, Na, Cl e Si. I micronutrienti sono necessari in quantità minime e sono catalizzatori di reazioni enzimatiche, alcuni tra i più importanti sono : Cu, Mn, Fe, Zn, Co e Mo. Dopo l’azoto gassoso (N2) la forma più abbondante di azoto inorganico (DIN) nelle
acque è il nitrato (NO3-), le altre sono il nitrito (NO2-) e l’ammonio (NH4+). Tutte e
tre le forme, comprese piccole molecole organiche, possono essere utilizzate; l’assimilazione del nitrato nelle cellule avviene tramite una sua riduzione ad ammonio e richiede maggiore dispendio di energia, tuttavia nel caso della fitodepurazione si deve tenere presente che le acque reflue raggiungono elevati valori di ammonio che possono risultare tossici per le microalghe. Il fosforo è presente come fosforo inorganico (DIP) o fosforo organico (DOP). Il DIP è prevalentemente presente come ortofosfato ed è l’unica forma che può essere utilizzata dalle microalghe tuttavia molte specie possiedono una fosfatasi alcalina extracellulare che permette loro di staccare il fosfato dalle molecole organiche. Il rapporto atomico con cui i principali elementi sono presenti nel plancton è noto come rapporto di Redfield e prende in considerazione soprattutto carbonio, azoto e fosforo con i seguenti rapporti atomici C:106 N:16 P:1. Nell’ottica della pura ricerca, ma anche nella gestione applicata di ambienti eutrofici, il concetto di nutriente limitante si è rilevato da sempre al centro dell’attenzione. L’idea è stata per la prima volta chiaramente espressa da Justus Liebig nel 1840. La sua definizione che ―la crescita di un’ alga dipende dalla risorsa presente in quantità minima‖ è conosciuta come la ―legge‖ del minimo di Liebig. Sono state formulate due limitazioni dell’applicabilità di questa legge: la prima sta nel fatto che essa è strettamente applicabile solo in condizioni di equilibrio stazionario (il flusso in entrata, di energia e materiali deve bilanciare quello in uscita). La seconda considerazione importante è l’interazione dei fattori. Infatti, un’elevata concentrazione, o disponibilità, di certe sostanze o l’influenza di un certo fattore,
14
diverso da quello limitante, può modificare la velocità di utilizzazione del fattore limitante stesso (Tilman, 1982). A volte gli organismi sono in grado di sostituire, almeno in parte, una sostanza chimica con un’altra, che sia affine alla prima e che scarseggia nell’ambiente.A partire dai primi anni ’70 sono stati fatti degli studi per capire quali sono i nutrienti maggiormente limitanti per lo sviluppo delle alghe, soprattutto nell’ambiente marino. Dagli studi è emerso che la crescita algale viene controllata dalla silice, dall’azoto, e soprattutto dal fosforo; tuttavia si è visto che la carenza di solfato comporta una diminuzione dei pigmenti e di enzimi con conseguente riduzione dell’attività fotosintetica. La limitazione da nutrienti in natura è un fenomeno estremamente raro, quest’affermazione non significa che le singole specie non siano soggette a tale limitazione, ma che la comunità algale è in grado di modificare la propria composizione specifica per rimediare ad eventuali limitazioni.
Nell’ambiente naturale è stato visto che i tempi, ma anche i modi in cui i nutrienti si rendono disponibili, possono rivelarsi come importanti fattori di controllo della popolazione. La competizione interspecifica viene evitata, visto che specie diverse hanno differenti periodicità giornaliere nell’assimilare i nutrienti. Alla fine del periodo estivo, con il continuo impoverimento di nutrienti, possono essere favorite le specie di grandi dimensioni, capaci di accumulare nutrienti al loro interno; ma anche la pressione predatoria può indurre un analogo cambiamento della composizione specifica. Generalmente, nel momento in cui si riscontra un rapporto tra richiesta e disponibilità inferiore all’unità, vengono favorite le specie opportunistiche, le specie r, di piccole dimensioni, capaci di riprodursi in modo esponenziale; invece quando lo stesso rapporto assume un valore unitario o superiore, allora saranno predominanti le specie caratterizzate da uno sviluppo lento, ma dotate di capacità competitive superiori, ovvero le specie K.
Carbonio
La biomassa microalgale contiene circa il 50% di carbonio rispetto al peso secco totale (Miròn et al., 2003) e le microalghe risultano essere dieci volte più efficienti nella fissazione biologica della CO2 atmosferica rispetto alle piante terrestri; i valori
sono ampiamente variabili a seconda delle varie specie con range che va da 0,26 mg CO2 m-3 h-1 (Cheng et al., 2006) a 1,33 g CO2 m-3 h-1 (Hirata, 1996). La fonte
15
principale di carbonio nell’ambito della coltivazione delle microalghe è la CO2 e le
sue concentrazioni nella coltura sono correlare con i valori di pH, pertanto quest’ultimo costituisce un importante parametro da monitorare, nel caso dei fotobioreattori, durante il processo di crescita algale. I valori di pH dovrebbero infatti essere compresi in un campo di valori tra 5,5 e 8. Tuttavia man mano che il processo fotosintetico avanza il consumo di CO2 da parte delle alghe determina un
incremento del pH. È necessario quindi prevedere delle immissioni ulteriori di CO2
laddove si determini una crescita incontrollata del pH e quindi l’instaurarsi di un ambiente basico che inibisce la crescita algale. Per ottimizzare la crescita microalgale quindi è necessario fornire alla coltura alte concentrazioni di CO2 in
quantità maggiori rispetto alle concentrazioni naturali di CO2 presenti in ambiente
(Pulz, 2007); questo è un requisito essenziale per rendere la produzione di microalghe economicamente vantaggiosa. A tal proposito sono stati sperimentati fotobioreattori che consentono la captazione diretta delle emissioni di CO2
provenienti da centrali termoelettriche o da altre sorgenti di emissione.
Azoto
Dopo il carbonio, l’azoto è sicuramente il nutriente più importante per la crescita algale in quanto contribuisce direttamente alla produzione di biomassa, il contenuto di azoto intracellulare può variare dall’1% fino a superare il 10% e questo è dovuto principalmente alla disponibilità di nutrienti nel mezzo (Richmond, 2004). Quando le alghe crescono in condizioni di limitazione da azoto, il più importante effetto osservato è la degradazione specifica dei ficobilisomi nei cianobatteri (Collier e Grossman, 1992) che provoca una decolorazione nelle cellule, ma più in generale si osserva un accumulo di carbonio organico dovuto ad aumento di polisaccaridi e acidi grassi (Becker, 1994). L’azoto è presente in gran parte sotto forma di nitrato (NO3-) ma spesso anche l’azoto ammoniacale (NH4+) e l’urea possono essere
utilizzati dalle alghe, è stato dimostrato infatti che le microalghe hanno tassi di accrescimento simili per le varie forme di azoto disponibili (Kaplan, 1986). Quando l’azoto ammoniacale è l’unica fonte di azoto disponibile, il pH potrebbe diminuire significativamente a causa del rilascio di ioni H+ e questo comporterebbe la diminuzione di zooplancton presente nell’ambiente. Numerosi studi inoltre mostrano che la biosintesi e l’accumulo di lipidi è incrementato in limitazione di
16
azoto, in particolare l’aumento di lipidi neutri nella forma di triacilgliceroli (Thompson, 1996). L’accumulo di carotenoidi è un’altra caratteristica di molte alghe quando si trovano a crescere in condizioni limitanti di azoto che è spesso accoppiato ad una diminuzione del contenuto di clorofilla cellulare. Ben-Amotz et al. (1982) hanno osservato un aumento di ß-carotene nell’alga Dunaliella in limitazione di azoto. Borowitzka et al. (1991) e Zhekisheva et al. (2002) in due studi distinti hanno mostrato che la bassa concentrazione di azoto è il fattore principale nella sintesi e nell’accumulo di astaxantina in Haematococcus pluvialis.
Fosforo
Il fosforo è un altro macronutriente essenziale che svolge un ruolo importante nei processi metabolici cellulari attraverso la formazione di vari componenti funzionali e strutturali richiesti per la crescita delle microalghe come acidi nucleici, DNA, ATP e NADPH. Quando i nutrienti sono presenti in eccesso e la luce risulta il fattore limitante molte specie algali mostrano un’elevata concentrazione di fosforo cellulare che rappresenta circa l’1% del peso secco (Goldman, 1980). Alcuni effetti dovuti alla limitazione da fosforo risultano simili a quelli osservati nelle culture in carenza di azoto. Il contenuto di clorofilla a tende a diminuire mentre il contenuto di carboidrati aumenta (Carr e Whitton, 1982). Nei cianobatteri, rispetto alla mancanza di azoto, in condizione di limitazione da fosforo si osserva una riduzione di ficobilisomi; questo non è dovuto alla degradazione dei pigmenti fotosintetici ma al fatto che la loro produzione si arresta mentre la divisione cellulare prosegue (Collier e Grossman, 1992). L’esaurimento di fosforo nel mezzo di coltura porta un accumulo di ß-carotene in Dunaliella (Ben-Amotz et al., 1982) e l’accumulo di astaxantina in Haematococcus (Boussiba, 1992).
1.4.2.1 Uptake di nutrienti
L’uptake di nutrienti è legato a tutti quei fattori che regolano la crescita algale quali la luce, la temperatura, e il mixing della coltura.
Fauchot et al. (2000) hanno mostrato come i raggi UV-B influenzano l’utilizzo di azoto da parte del fitoplancton. L’esclusione dei raggi UV-B aumenta i tassi di
17
uptake di nitrati e azoto ammoniacale; in particolare, l’utilizzo dell’urea è risultato molto sensibile alle radiazioni UV-B in quanto la progressiva diminuzione di queste ultime aumentava l’uptake dell’urea dal 17% fino al 130% con un effetto favorevole da parte della crescita delle microalghe. Nelle colture algali dove i diversi fattori ambientali sono tali da non limitare la crescita algale, gli organismi crescono a spese di un substrato e, man mano che questo viene utilizzato, si ha un andamento esponenziale della crescita che continua sino a quando vi sia una disponibilità bilanciata dei nutrienti nel mezzo di coltura (Figura 1.4).
Figura 1.4 Cinetica dell’uptake di nutrienti. La velocità di uptake dei nutrienti V è messa in relazione con la concentrazione di nutrienti [S].
Dopo l’esaurimento di uno dei nutrienti nel mezzo di coltura nutraceutico, la crescita algale continuerà grazie all’apporto delle riserve intracellulari ma tenderà progressivamente a declinare man mano che la concentrazione intracellulare tenderà a ridursi. L’uptake di nutrienti può essere osservato durante la crescita del fitoplancton come diminuzione nel mezzo di coltura. I parametri fondamentali per descrivere le caratteristiche del trasporto dei nutrienti (Vmax e Ks ) si ottengono
18
mettendo in relazione la velocità di uptake con la concentrazione di substrato secondo l’equazione di Michaelis-Menten:
V =
V
max([S]/
K
s+[S])La velocità di uptake dei nutrienti nelle diverse specie è influenzato dalla dimensione delle cellule, da eventuali fenomeni di tossicità in presenza di alte concentrazioni di nutrienti, da fattori genetici e dallo stato nutrizionale in quanto la cellula può prelevare più nutrienti di quelli ci cui ha bisogno per accumularli come riserva o, in alternativa, le cellule prelevano meno nutrienti poiché esiste una limitazione dovuta alla presenza di riserve interne.
1.4.3 Temperatura
Grazie ai suoi molteplici effetti, si può affermare che la temperatura rappresenta il fattore più importante nel determinare la distribuzione degli organismi viventi sulla superficie terrestre e negli ambienti acquatici (Davison, 1991). Da un punto di vista ecologico essa rappresenta uno dei principali fattori climatici che esercita un’azione incisiva sulle caratteristiche degli ecosistemi e condiziona sensibilmente l’attività metabolica e lo sviluppo degli organismi viventi. L’influenza della temperatura sui fenomeni vitali è dovuta in primo luogo ai suoi effetti sulle proprietà chimico-fisiche dell’acqua, che è il principale componente dei sistemi biologici. Al di sotto di 0°C, la cristallizzazione dell’acqua in ghiaccio comporta un aumento di volume che determina la rottura delle membrane biologiche e quindi la morte cellulare. L’effetto della temperatura sulla cinetica delle reazioni biochimiche è uno dei fattori ambientali più importanti che influenzano la composizione biochimica delle alghe. E’ stato dimostrato che alte temperature possono indurre la formazione di radicali attivi dell’ossigeno nelle cellule algali causando uno stress ossidativo che induce la produzione di carotenoidi (Tjahjono et al., 1994; Liu e Lee, 2000). Inoltre la temperatura può determinare variazioni biochimiche, ad esempio, la diminuzione della temperatura porta ad un aumento degli acidi grassi insaturi nelle membrane lipidiche tilacoidali al fine di proteggere e mantenere efficienti le funzioni
19
dell’apparato fotosintetico (Nishida e Murata, 1996). È stato dimostrato in molte alghe che l’aumento della temperatura porta ad un aumento degli acidi grassi saturi mentre con temperature più basse aumentano gli acidi grassi insaturi (Renaud et al., 2002). La temperatura influenza la cinetica delle reazioni chimiche, poiché ad ogni incremento di 10°C di temperatura si ha un aumento di circa il doppio della velocità di reazione (fattore Q10). Per la coltivazione delle biomasse algali questo comporta
approssimativamente il doppio dell’uptake di nutrienti per ogni aumento di 10°C nel sistema. Il metabolismo cellulare e la crescita algale, dipendono strettamente dall’intensità luminosa e dalla temperatura. Inoltre, l’intensità di luce, necessaria a saturare la fotosintesi, cresce all’aumentare della temperatura. Tutte le specie algali sono caratterizzate da un optimum di temperatura che garantisce la massima attività fotosintetica; esiste però, una temperatura minima, che permette ancora di svolgere la fotosintesi. I valori di soglia più bassi sono stati riscontrati tra le diatomee, mentre i cianobatteri preferiscono chiaramente temperature più elevate.
1.4.4 Luce e fotosintesi
La luce è sicuramente il parametro più importante per la crescita algale più nello specifico questa è influenzata dalla quantità e qualità della luce incidente e dalla densità cellulare delle colture (Richmond et al., 2000; Jeon et al., 2005).
La fotosintesi è un processo fisiologico tramite il quale le microalghe, utilizzando la luce come fonte di energia, sintetizzano molecole complesse come i carboidrati a partire da molecole semplici quali anidride carbonica, acqua e sali minerali. Si tratta cioè di un processo fotochimico, ovvero un cambiamento chimico derivato dall’assorbimento di radiazione luminosa da parte di molecole biologiche.
6 CO
2+ 6 H
2O energia → C
6H
12O
6+ 6 O
2Evidenze chimiche e numerosi ritrovamenti fossili indicano che tale processo si affermato sulla Terra circa 3,5 miliardi di anni fa ad opera di batteri autotrofi, che operavano una fotosintesi di tipo anossigenico. La comparsa della fotosintesi ossigenica, con la conseguente immissione di ossigeno nell’atmosfera, si ebbe
20
quando i cianobatteri acquisirono la capacità di utilizzare l’acqua come donatore di elettroni. Un successivo evento di endosimbiosi tra un procariote fotosintetico ossigenico (cianobatterio) e una cellula eucariote ancestrale eterotrofa, ha dato origine ai cloroplasti che sono la sede del processo fotosintetico (Richmond, 2004; Cavalier-Smith, 2002). Da un punto di vista strutturale, i cloroplasti sono organelli delimitati da una doppia membrana, che racchiude un ambiente interno, lo stroma, nel quale si trova un sistema di membrane ben organizzato detto sistema tilacoidale (Pupillo et al., 2003). Nei tilacoidi sono inseriti i complessi funzionali in grado di condurre il trasporto di elettroni dall’acqua al NADP+ nella fase luminosa della fotosintesi, ossia: il fotosistema II (PSII), il complesso dei citocromi b6/f (cit b6/f) e il fotosistema I (PSI). E’ anche presente il complesso ATP-sintasi che opera nella sintesi di ATP. La fotosintesi avviene per tappe riunibili in due fasi: la fase luminosa e la fase di fissazione del carbonio o fase oscura. Nella fase luminosa l’energia solare arriva a livello dell’apparato fotosintetico nelle membrane tilacoidali ed è convertita in energia chimica fornendo NADPH2 e ATP. Nella fase
oscura, che avviene nello stroma, NADPH2 e ATP sono utilizzate nelle riduzioni
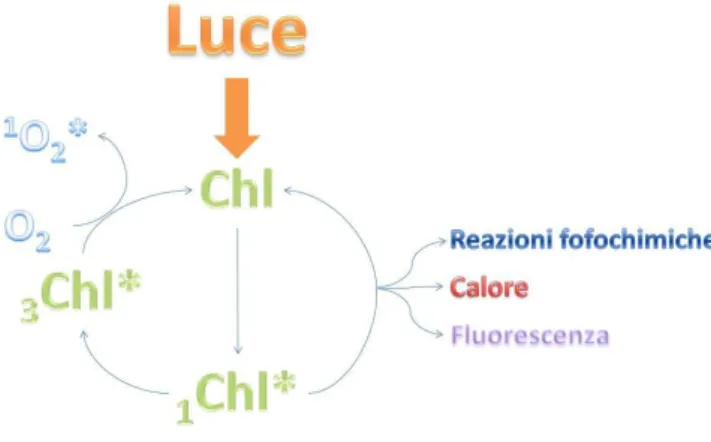
biochimiche dell’anidride carbonica per formare carboidrati come prodotto finale. L’energia luminosa assorbita dalle molecole di clorofilla può andare incontro a 3 diversi destini: può essere usata nella fotosintesi (reazioni fotochimiche), dissipata come calore o riemessa sotto forma di fluorescenza (Figura 1.5).
21
Questi tre processi sono in competizione tra loro, così che qualsiasi aumento dell’efficienza di uno di essi causerà una diminuzione degli altri due. Di conseguenza, misurare la resa della fluorescenza della clorofilla fornisce informazioni sulle variazioni dell’efficienza delle reazioni fotochimiche e della dissipazione come calore, questo nonostante la quantità totale di fluorescenza della clorofilla sia molto piccola (solo 1 o il 2% della luce totale assorbita).
La radiazione luminosa attiva nei processi fotosintetici, occupa la porzione dello spettro compresa tra 400 nm e 700 nm e rappresenta circa il 45% di quello totale (Gao et al., 2007). Per essere utilizzata la luce deve essere in qualche modo catturata e, tra i vari pigmenti responsabili dell’assorbimento luminoso, troviamo le diverse clorofille e i carotenoidi. Il principale fotorecettore responsabile dell’assorbimento della radiazione luminosa, nelle alghe è la clorofilla a, ma anche clorofilla b o la clorofilla c e i carotenoidi svolgono un ruolo di primaria importanza (Hosikian et al., 2010). Le clorofille assorbono la luce visibile nella fascia del rosso (tra 550 e 700 nm) e del blu (sotto i 480 nm) ed emettono fluorescenza nel rosso a lunghezze d’onda poco superiori a quelle di assorbimento.
La molecola di clorofilla a (chl a) è costituita da una testa ad anello porfirinico e da una coda idrofoba fitilica. L’anello porfirinico, che consiste in un poliene ciclico, è composto da quattro anelli pirrolici ed un quinto anello non pirrolico (ciclopentanone); al centro dell’anello porfirinico è collocato un atomo di magnesio (Mg2+) legato ai quattro atomi di azoto dei pirroli, rivolti verso l’interno della molecola. La coda fitilica è una lunga catena idrocarburica legata all’anello IV della testa porfirinica. L’idrofobicità di questa porzione della molecola è fondamentale per garantire il legame con le regioni lipidiche delle proteine-leganti la clorofilla e con le membrane tilacoidali dei cloroplasti. Esistono diversi tipi di clorofille: la clorofilla a si ritrova i tutti gli organismi fotosintetici eucarioti e nei cianobatteri, mentre gli altri batteri fotosintetici contengono le batterioclorofille. La clorofilla b (chl b) è presente nelle Chlorophyceae ed Euglenophyceae, mentre nelle altre alghe è sostituita dalla clorofilla c. La differenza sostanziale tra queste molecole risiede nei sostituenti delle catene laterali legate all’anello porfirinico; quindi, ciò che distingue la clorofilla b dalla a è che la prima presenta un gruppo aldeidico (-CHO), mentre la seconda un gruppo metilico (-CH3). Proprio a causa delle differenze nella
22
relativi picchi di assorbimento; l’attività massima della clorofilla b si manifesta intorno ai 460 nm, dove la clorofilla a assorbe meno, d’altra parte il picco di assorbimento della clorofilla a intorno a 680 nm è maggiore rispetto a quello della clorofilla b. Questa caratteristica di sovrapposizione degli spettri è fondamentale dal momento che risulta un’integrazione dell’attività di assorbimento della luce da parte dei diversi fotorecettori. In particolare la clorofilla b svolge, assieme ai carotenoidi, il ruolo di pigmento accessorio. I pigmenti accessori ―catturano‖ quelle lunghezze d’onda che la clorofilla a assorbe meno e convogliano l’energia verso una particolare forma di quest’ultima, attiva nel processo fotochimico.
1.4.4.1 Fluorescenza della clorofilla, quenching fotochimico e
non fotochimico.
L’analisi della fluorescenza emessa dall’apparato fotosintetico è misurata tramite fluorimetro ad ampiezza di impulsi modulata rappresenta attualmente una metodologia molto efficace negli studi ecofisiologici delle microalghe, poiché permette di ottenere una grande quantità di dati in tempi contenuti e senza essere invasiva (Maxwell, 2000). In particolare, la fluorescenza può fornire dettagli sulla capacità di un alga di tollerare stress ambientali e sulla presenza di danni all’apparato fotosintetico, infine, permette di capire qual è l’irradianza ottimale per la crescita di una specifica alga.
A temperatura ambiente, quasi la totalità della fluorescenza ha origine dal fotosistema II (Baker e Webber, 1987); la fluorescenza può essere misurata esponendo l’alga ad una luce di una lunghezza d’onda definita e misurando la quantità di luce riemessa a lunghezze d’onda maggiori. Ciò significa che tutte le analisi devono includere una forma di normalizzazione e una grande varietà di differenti parametri di fluorescenza devono essere calcolati. Le variazioni di fluorescenza della clorofilla sono state osservate per la prima volta nei primi anni 60 da Kautsky quando scoprì che, in seguito al trasferimento di materiale fotosintetico da buio alla luce, avveniva un aumento della resa di fluorescenza della clorofilla in un periodo di circa 1 secondo. Questo aumento è stato successivamente spiegato come una conseguenza della riduzione degli accettori di elettroni nella catena di reazioni fotosintetiche, a valle del PSII, probabilmente a livello del plastochinone
23
QA. Una volta che il PSII assorbe la luce ed il QA ha accettato un elettrone, esso non
è più in grado di accettarne un altro fino a quando non lo ha trasferito nel successivo trasportatore di elettroni (QB). Durante questo periodo, il centro di reazione è
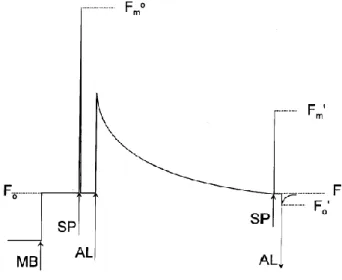
definito chiuso. La presenza di una parte di centri di reazioni nello stato chiuso causa la riduzione totale dell’efficienza delle reazioni fotochimiche e quindi l’aumento della fluorescenza. Quando l’alga è trasferita dal buio alla luce, i centri di reazione del PSII si chiudono progressivamente, questo causa l’aumento della fluorescenza della clorofilla. In seguito a questo evento, comunque, il livello di fluorescenza comincia solitamente a diminuire nuovamente, in un tempo di pochi minuti. Questo fenomeno, chiamato estinzione della fluorescenza (fluorescence quenching) si può spiegare in due modi. Innanzitutto avviene un aumento del tasso a cui gli elettroni sono trasportati fuori dal PSII; questo è dovuto principalmente all’attivazione indotta degli enzimi coinvolti nel metabolismo del carbonio. Questa estinzione è chiamata estinzione fotochimica (photochemical quenching, qP). Allo stesso tempo, avviene un aumento dell’efficienza con cui l’energia viene convertita in calore; quest’ultimo processo è definito estinzione non fotochimica (Roháček, 2002). Lo studio della fluorescenza consente di seguire i processi fotochimici nei centri di reazione. I centri che si trovano nello stato aperto sono fotosinteticamente attivi, mentre quelli chiusi sono fotosinteticamente inattivi. Al fine di avere dati affidabili sull’efficienza fotosintetica è necessario essere in grado di distinguere i contributi dell’estinzione fotochimica e non fotochimica. L’approccio più usato è quello di spegnere uno dei due processi, in particolar modo la fotosintesi, cosicché si possa stimare la fluorescenza in presenza solo dell’altro. In vitro, questo può essere ottenuto utilizzando la tecnica del raddoppiamento della luce, che permette l’annullamento dell’estinzione fotochimica (Quick e Horton, 1984). Con questo approccio, l’alga viene sottoposta a un flash di luce di breve durata e di alta intensità, il cui effetto e quello di chiudere temporaneamente tutti i centri di reazione del PSII. Il flash saturante è talmente breve da non influire significativamente sulla fotosintesi. Durante il flash, la fluorescenza raggiunge un valore equivalente a quello che potrebbe essere ottenuto in assenza di estinzione fotochimica, la fluorescenza massima (Fm). Il confronto di questo valore con lo stato costante della
fluorescenza alla luce (Ft) e al valore di fluorescenza in assenza di luce attinica (Fo)
24
del PSII. Così come avviene per le reazioni fotochimiche, l’efficienza di dissipazione del calore (estinzione non fotochimica) può variare a seconda di vari fattori interni ed esterni, che si riflettono come variazioni di Fm. Al contrario delle
reazioni fotochimiche, non è possibile inibire totalmente la dissipazione del calore e quindi non è possibile misurare la fluorescenza della clorofilla in assenza di estinzione non fotosintetica.
1.4.4.2 Relazione tra assorbimento della luce e fotosintesi netta
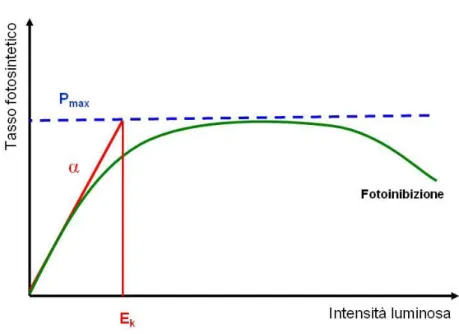
La quantità di luce assorbita e la fotosintesi sono correlate tramite un parametro chiamato rendimento quantico della fotosintesi, che indica il rapporto tra moli di CO2 fissate per moli di fotoni assorbiti (PAR) dalla reazione fotochimica. La resaquantica della fotosintesi può essere misurata valutando la velocità di fotosintesi di una coltura algale sottoposta ad intensità luminose crescenti (curve P/E o light curve); queste curve rappresentano uno strumento molto valido per la valutazione di parametri fotosintetici utili per lo studio della fisiologia di una determinata alga (Figura 1.6). Ad un certo livello di intensità luminosa bassa la velocità di fotosintesi netta è appena sufficiente per bilanciare la velocità di respirazione, questo è chiamato punto di compensazione in cui la fotosintesi netta è uguale a zero. Il tasso di respirazione corrisponde in genere al 5-10% del tasso di fotosintesi equivalente alla luce di saturazione (Figueroa, 2003). A qualsiasi livello superiore di luce l’alga avrà un guadagno netto di fotosintesi rispetto alle perdite dovute alla respirazione. Si distingue una fase lineare in cui l’aumento di luce porta ad un aumento corrispondente di fotosintesi e la pendenza di questa retta, o parametro α ha come dimensioni:
moli di O2 prodotto/quanta di luce incidente /unità di superficie
oppure:
moli di O2 prodotto/unità di clf/ quanta di luce incidente/unità di superficie.
Man mano che la luce aumenta, l’efficienza di utilizzo della luce cala e i successivi incrementi di luce causeranno piccoli aumenti o nessun aumento di fotosintesi fino a raggiungere un plateau. La velocità di fotosintesi massima è definita dal parametro Pmax che ha come dimensioni:
25 O2 prodotto/unità di clf/unità di tempo
In questa situazione la velocità di assorbimento dei fotoni supera la velocità di trasporto degli elettroni dall’acqua alla CO2.
L’intercetta tra la pendenza α e Pmax fornisce il parametro Ek che rappresenta il
livello di irradianza a cui la fotosintesi si satura e quindi il livello ottimale per una determinata specie algale in quelle condizioni fisiologiche.
Ek può essere definito come:
E
k=
P
max/
α
Figura 1.6 Grafico di una curva P/E standard in cui si mette in relazione il tasso fotosintetico P con l’intensità luminosa E.
La bassa resa quantica in condizioni di luce in eccesso avviene perché il tasso di assorbimento dei fotoni da parte della clorofilla supera il tasso di consumo di ATP e di NADPH da parte del ciclo di Calvin Benson e questo può provocare dei seri danni ai fotosistemi. Fotoinibizione e fotoossidazione possono allora avvenire quando le alghe ombreggiate sono improvvisamente esposte a luce intensa. Per questo motivo, le microalghe hanno sviluppato una varietà di meccanismi per minimizzare i danni causati dall’assorbimento della luce in eccesso per mezzo di: 1)
26
Processi fotoprotettivi fotochimici che dissipano l’energia in eccesso utilizzandola nei processi fotosintetici (estinzione fotochimica, qP); 2) Processi fotoprotettivi non fotochimici che dissipano l’energia in eccesso mediante il ciclo delle xantofille (una classe di carotenoidi che assorbono l’energia dallo stato eccitato della clorofilla e lo dissipano come calore) .
1.4.4.3 Fotoacclimatazione
Nell’ ambiente naturale, gli organismi fotosintetici possono essere soggetti a frequenti cambiamenti di irradianza e per questo le microalghe hanno sviluppato diversi meccanismi di acclimatazione alla luce. E’ stato dimostrato che durante i processi di acclimatazione i livelli di Rubisco sembrano essere costanti (Sukenik et al., 1987) e che il controllo avviene a livello del PSII. La regolazione di quest’ ultimo può avvenire tramite la modulazione della capacità di utilizzo della luce o modificando il numero di centri di reazione a livello del PSII. Colture con densità cellulare elevata richiedono un’intensità luminosa maggiore per ottenere il massimo dell’attività fotosintetica che, in ogni caso, risulta inferiore a quella che può essere raggiunta in una coltura con bassa densità cellulare, in quanto la luce è attenuata dall’elevata concentrazione dei microorganismi che si schermano fra di loro (Jeon et al., 2005). Le colture con un’alta densità cellulare che comporta ombreggiamento, quindi, possono essere inibite nella crescita (Richmond e Ning, 1999); le alghe, tuttavia, si possono fotoacclimatare sia agli alti livelli di intensità luminosa (HL, High light), che a quelli più bassi (LL, Low Light). Le microalghe che si acclimatano ad alte intensità di luce (Grobbelaar et al., 2003) tipicamente hanno: - un alto tasso fotosintetico
- un basso contenuto di clorofilla per unità di biomassa - alti livelli di pigmenti accessori come i carotenoidi - bassa efficienza fotosintetica
D’altra parte, le microalghe che si acclimatano a basse intensità luminose (Grobbelaar et al., 2003) hanno:
- basso tasso fotosintetico
27
- bassi livelli di pigmenti ausiliari come i carotenoidi - alta efficienza fotosintetica
1.4.5 Rapporti con altri livelli trofici
La composizione delle specie e la biomassa totale della comunità microalgale in sistemi all’aperto sono determinate da fattori abiotici ma anche dalle relazioni che si vengono a formare con gli altri organismi appartenenti ad altri livelli trofici. L’effetto del grazing da parte dello zooplancton è un fattore importante da considerare nelle relazioni trofiche, in molti sistemi acquatici infatti è il fattore prevalente di mortalità algale. Diversi tipi di organismi zooplanctonici si nutrono di alghe dai protisti microscopici, come flagellati, amebe e ciliati, a rotiferi e a crostacei, come copepodi e cladoceri. Lo zooplancton quindi può influire negativamente sullo sviluppo algale attraverso la predazione, di cui risentono maggiormente le alghe di minori dimensioni, che di solito sono quelle con i più alti tassi di crescita e di assimilazione dei nutrienti. Inoltre esiste una relazione tra la dimensione dello zooplancton e il tasso di grazing (Hélène, 1998), da questo è deducibile una differente pressione predatoria a seconda del tipo di zooplancton presente nel sistema acquatico. È quindi probabile che gli effetti contrastanti dello zooplancton agiscano in modo da avvantaggiare certe specie algali e svantaggiarne altre. Accanto al controllo top-down esercitato dallo zooplancton sulle alghe, esiste anche un’efficiente azione di controllo bottom-up, esercitata dai batteri, i quali possono entrare in competizione con le alghe per i nutrienti. Il rapporto tra alghe e batteri è peraltro molto complesso. In varie occasioni si osserva una sorta di mutualismo tra i due gruppi di organismi: i batteri mineralizzano il fosforo per le alghe e queste producono carbonio per la crescita batterica. Lo spostamento da una situazione di competizione ad una di mutualismo sembra essere legato alle disponibilità di carbonio e di fosforo. Quando il rapporto C:P è molto elevato la crescita batterica è limitata dal fosforo e si instaura la competizione con le alghe per questo elemento. Se invece questo rapporto è più basso, al punto che sia C che P divengono fattori limitanti per la crescita batterica, la competizione si riduce (l’assimilazione di fosforo da parte dei batteri richiede carbonio come fonte
28
energetica) e si tende verso una forma di cooperazione. Poiché il rapporto C:P è spesso condizionato dallo stato trofico, è evidente come quest’ultimo influenzi anche la natura del rapporto tra alghe e batteri. In ambienti oligotrofi la disponibilità di fosforo può essere un fattore limitante per entrambi: questa situazione innesca di solito fenomeni di competizione che vedono prevalere i batteri. In ambienti eutrofici, invece, il rapporto C:P si abbassa, riducendo il vantaggio dei batteri, che diventano dipendenti dalle alghe per il rifornimento di carbonio: la competizione lascia così il posto al mutualismo.
29
Scopo della tesi
La depurazione è un processo finalizzato a ridurre in modo significativo le sostanze inquinanti presenti nelle acque reflue prima del loro rilascio in ambiente. Gli impianti di depurazione tradizionali, sfruttano i processi biochimici attuati in natura dai batteri decompositori, concentrando il refluo in appositi spazi ed adottando opportuni accorgimenti per aumentarne la velocità di reazione. L’uso delle alghe in impianti di depurazione di acque reflue prende il nome di ficorimedio e potrebbe rappresentare un’alternativa o una integrazione alla depurazione tradizionale dei reflui per il fatto che le alghe operano la rimozione di nutrienti e metalli pesanti dalle acque e al tempo stesso possono fornire biomassa utilizzabile come nuova fonte di energia.
L’obiettivo della ricerca riportata in questa tesi è stato di porre l’attenzione ad alcuni aspetti del recupero e trattamento biologico dei reflui provenienti da scarichi civili o industriali attraverso l’uso delle microalghe. In particolare è stata studiata la microalga Scenedesmus sp., prelevata in un bacino artificiale di acqua dolce nella provincia di Forlì-Cesena, in vista di una sua possibile coltivazione in vasche all’aperto; tali vasche, in costruzione al momento dello svolgimento di questa tesi, sono finalizzate alla depurazione dei reflui e al tempo stesso alla produzione di biomassa per un’eventuale applicazione nella produzione di oli o nella combustione/digestione per la produzione di energia. Per raggiungere questi obiettivi in un sistema aperto l’organismo prescelto deve, non solo raggiungere valori di produttività elevati, ma deve anche essere maggiormente competitivo rispetto ad altre alghe ed essere poco sensibile alla pressione dei grazers e dei patogeni.
Esperimenti svolti in precedenza con Scenedesmus sp. avevano dimostrato un’elevata capacità depurativa su due tipi di substrati di origine civile, l’effluente primario e il secondario di un depuratore cittadino di HERA. L’alga aveva mostrato maggiore crescita nell’effluente primario con rimozione di tutti i nutrienti nei primi 3 giorni. Inoltre era stata valutata la resistenza dell’alga ad elevate concentrazioni di
30
ammonio, una sostanza che può essere presente nei reflui urbani in quantità variabili e tali da poter causare un effetto tossico sulla crescita delle alghe.
Nel presente studio ci si è rivolti ad altri aspetti riguardanti la crescita di questa microalga in acque reflue, tramite esperimenti eseguiti in laboratorio con piccoli volumi. Il primo esperimento è stato realizzato in modo tale da simulare un sistema continuo di crescita di Scenedesmus sp. andando a ricreare le stesse condizioni di un sistema all’aperto come negli open ponds, in particolare prelevando periodicamente una parte di biomassa e sostituendola con terreno nuovo. Sono state applicate tre diverse condizioni per analizzare quale metodo permetteva di ottenere maggiori quantità di biomassa e per valutare come questa si diversifica nel tempo nella sua componente biochimica, tramite l’analisi di polisaccaridi e proteine; inoltre si è valutata anche la componente fisiologica, attraverso la misura dell’efficienza fotosintetica. L’efficacia di queste condizioni nel processo di fitodepurazione è stata invece oggetto di studio di una tesi parallela.
Nel successivo esperimento è stata utilizzata una popolazione algale naturale, proveniente dalla vasca di sedimentazione terziaria del depuratore di Ravenna, e fatta crescere nell’effluente primario. L’esperimento era volto a comprendere i processi di successione delle microalghe in un sistema aperto, attraverso uno studio della composizione delle specie nel tempo, e a confrontare la crescita e l’efficienza di fitodepurazione della popolazione mista con quelle di Scenedesmus sp.
31
Materiali e metodi
3.1 Piano sperimentale
Sono stati effettuati due tipi di esperimenti:
1) Il primo esperimento è stato eseguito con la modalità delle colture semicontinue. Colture di Scendesmus sp. sono state allestite nell’acqua prelevata dall’effluente primario del depuratore HERA di Cesena applicando tempi di residenza idraulica di 1.5, 3 e 5 giorni ed effettuando ogni condizione in replica. Si sono allestite perciò sei colture in bottiglie ognuna delle quali con 70 ml della coltura di Scendesmus sp. e 980 ml di acqua dell’effluente primario in maniera tale da ottenere un volume finale di 1050 ml per ciascuna bottiglia con una concentrazione dell’alga di 0,1 g/L (Figura 3.1). Le bottiglie sono state riposte per tutta la durata dello studio in una camera ad una temperatura di 24°-26° con all’interno lampade fluorescenti con intensità luminosa di 400 µE m-2 s-1 e un fotoperiodo di 16 ore di luce e 8 di buio, inoltre le colture sono state areate con una miscela di aria e CO2 92/2 v/v. Le colture
sono state seguite per 15 giorni fino alla fine della fase esponenziale, valutando la crescita con misure di torbidità effettuate ogni giorno, mentre a intervalli regolari sono stati effettuati i prelievi per le analisi di proteine, clorofilla, polisaccaridi e lipidi.
Figura 3.1 Allestimento colture in semicontinuo con tempi di residenza idraulica (HRT) di 1.5,3 e 5 giorni.
![Figura 1.4 Cinetica dell’uptake di nutrienti. La velocità di uptake dei nutrienti V è messa in relazione con la concentrazione di nutrienti [S]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7479959.102981/21.892.200.643.473.816/figura-cinetica-nutrienti-velocità-nutrienti-relazione-concentrazione-nutrienti.webp)