Corso di Laurea Specialistica in Medicina Veterinaria Dipartimento di Scienze Veterinarie
Tesi di Laurea
VALUTAZIONE DI MARCATORI DI STRESS
OSSIDATIVO IN CANI IN INSUFFICIENZA
RENALE CRONICA A VARI STADI DI
GRAVITÀ
Relatore: Prof.ssa Grazia Guidi
Candidata: Giulia Fiorentino
Correlatore: Dott.ssa Ilaria Lippi
A mia madre
“Il cane possiede la bellezza senza la vanità. La forza senza l’insolenza. Il coraggio senza la ferocia. E tutte le virtù dell’uomo senza i suoi vizi.”
Lord Byron
“Il cane è quella cosa a metà strada tra un angelo e un bambino.” Antonio De Curtis, “Totò”
INDICE
CAPITOLO 1 ... 8
L’INSUFFICIENZA RENALE CRONICA ... 8
1.1 Introduzione ... 8 1.2 Eziologia ... 9 1.3 Patogenesi ... 11 1.4.1 Apparato gastroenterico ... 13 1.4.2 Apparato urinario ... 15 1.4.3 Apparato cardiovascolare ... 16 1.4.5 Apparato neuromuscolare ... 17
1.5 Stadiazione IRIS della CKD ... 18
1.5.1 Sotto-stadiazione sulla base della proteinuria ... 22
1.5.2 Sotto-stadiazione sulla base della pressione arteriosa ... 24
CAPITOLO 2 ... 29
LO STRESS OSSIDATIVO ... 29
2.1 Introduzione ... 29
2.2 Reactive Oxygen Species (ROS) ... 30
2.3 I sistemi di difesa antiossidanti ... 33
2.3.1 Superossido dismutasi ... 34
2.3.2 Catalasi ... 35
2.3.3 Glutatione perossidasi ... 36
2.4 I danni dello stress ossidativo ... 38
2.5 Risposta dell’organismo allo stress ossidativo moderato ... 39
CAPITOLO 3 ... 42
CKD E STRESS OSSIDATIVO ... 42
3.1 Lo stress ossidativo renale ... 42
3.2 Fattori chiave per l’instaurarsi dello stress ossidativo renale ... 43
3.3 Ruolo dello stress ossidativo nella patogenesi delle complicazioni associate a CKD . 46 3.3.1 Stress ossidativo e malattie cardiovascolari ... 46
3.3.3 Incidenza tumorale e CKD ... 48
3.4 Biomarkers di stress ossidativo e infiammazione in CKD ... 49
CAPITOLO 4 ... 58
MATERIALI E METODI ... 58
4.1 Animali utilizzati ... 58
4.2 Campioni per la classificazione della CKD ... 62
4.5 Preparazione degli emolisati per la determinazione di superossido dismutasi (SOD), catalasi (CAT) e glutatione perossidasi (GPx) ... 65
4.5.1 Misurazione attività SOD ... 67
4.5.2 Misurazione attività GPx ... 67
4.5.3 Misurazione attività CAT ... 68
4.5 Analisi statistiche ... 69
CAPITOLO 5 ... 70
RISULTATI ... 70
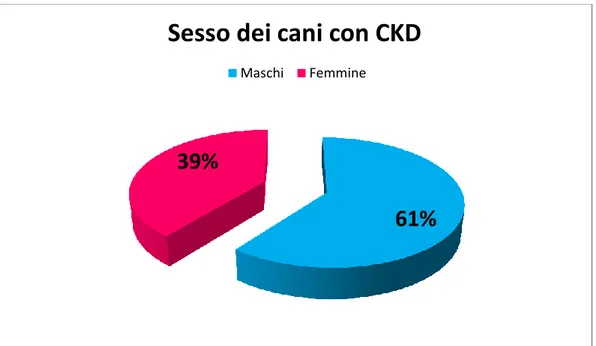
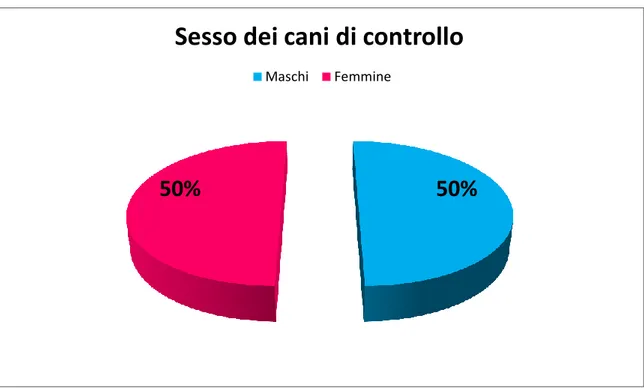
5.1 Sesso dei cani inclusi nello studio... 70
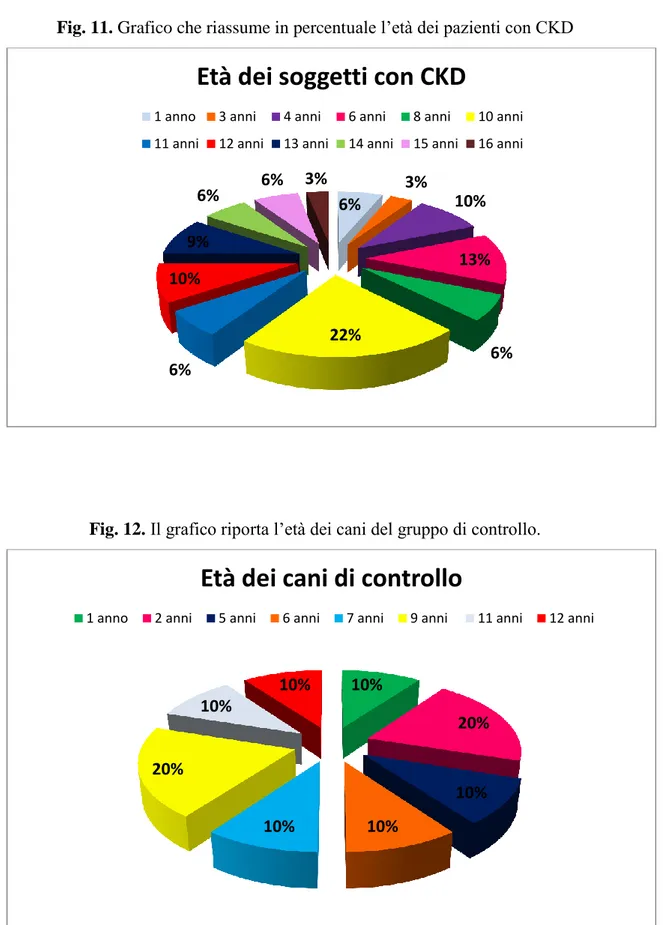
5.2 Età dei soggetti inclusi nello studio ... 71
5.3 Razza dei soggetti inclusi nello studio ... 73
5.4 Attività enzimatiche ... 74
CAPITOLO 6 ... 100
DISCUSSIONI E CONCLUSIONI ... 100
BIBLIOGRAFIA ... 107
5 Riassunto
Parole chiave: cani, insufficienza enale cronica, Superossido dismutasi, Catalasi, Glutatione perossidasi. Background: Superossido dismutasi (SOD), Catalasi (CAT) e Glutatione Perossidasi (GPx) sono
antiossidanti enzimatici endogeni, coinvolti nel controllo della produzione di radicali liberi nell’organismo. In medicina umana, le concentrazioni plasmatiche ed eritrocitarie di SOD, CAT e GPx sono state valutate in diversi studi, mentre in ambito veterinario, è stata indagata l’attività enzimatica della sola GPx in pazienti con insufficienza renale cronica (o CKD= Chronic Kidney Disease) e sono stati ottenuti risultati contrastanti.
Scopo: Nel presente studio, abbiamo ipotizzato l’esistenza di una correlazione tra i diversi stadi IRIS
(International Renal Interest Society) della CKD e l’attività di SOD, CAT e GPx, al fine di comprendere il ruolo dello stress ossidativo, come fattore di progressione dell’insufficienza renale cronica.
Materiali e Metodi: Nello studio sono stati inclusi 33 cani di proprietà, affetti da CKD a vari stadi di
gravità ed eterogenei per razza, sesso ed età e sono stati comparati con 10 cani sani.
L’attività enzimatica degli antiossidanti è stata rilevata attraverso tecnica spettrofotometrica, in campioni di 1 ml di sangue emolisato.
Risultati: I risultati ottenuti hanno evidenziato una generale riduzione dell’attività enzimatica nei soggetti
malati rispetto al gruppo di controllo. Sono emerse, inoltre, correlazioni tra l’attività di SOD ed i livelli dei creatininemia negli stadi IRIS 3 ed IRIS 4 e tra l’attività della GPx e la creatininemia nello stadio IRIS 3. Nel totale dei pazienti con CKD è emersa correlazione tra CAT e creatininemia, tra GPx e BCS e tra GPx e UP/UC.
Abstract
Keywords: dogs, chronic kidney disease, superoxide dismutase, catalase, glutathione peroxidase.
Background: Superoxide dismutase (SOD), Catalase (CAT), Glutathione Peroxidase (GPx), are
endogenous antioxidant enzymes, which are involved in control of free radical production in the organism. In human medicine, erythrocyte and plasma concentration of SOD, CAT and GPx has been valued in different studies, while in Veterinary only the GPx activity has been analyzed in Chronic Kidney Disease (CKD) patients and there are conflicting results about it.
Objective: In the current study, we hypothesize the existence of a correlation between IRIS (International
Renal Interest Society) stages of CKD and SOD, CAT and GPx activity in dogs, in order to examine the involvement of oxidative stress in the progression of renal failure.
Materials and Methods: 33 client-owned dogs with CKD at different stages and heterogeneous for breed,
sex, age were included in the study and compared to 10 healthy dogs.
Antioxidant enzyme activity has been measured in 1 ml of hemolyzed blood samples, with spectrophotometric analysis.
Results: The results showed a decrease in antioxidant enzyme activity in CKD patients, compare to the
control group. We also found a correlation between serum creatinine level in IRIS stage 3 with GPx activity and between serum creatinine in IRIS 3 and 4 stages and SOD activity. We also analysed these relation in the totality of cases and found a correlation between CAT and serum creatinine level, GPx and BCS and GPx and UP/UC.
6
Premessa
In questo studio, si è voluta effettuare una valutazione del comportamento dei principali sistemi di difesa antiossidante di natura enzimatica, nel cane affetto da insufficienza renale cronica.
In medicina veterinaria, le conoscenze sulla concentrazione degli antiossidanti nel corso della malattia renale, sono ancora limitate ed in letteratura esistono risultati contrastanti sul comportamento della barriera antiossidante nell’insufficienza renale. Inoltre, nella maggior parte degli studi, i soggetti patologici sono stati presi in considerazione come appartenenti ad un gruppo unico, quando invece l’insufficienza renale cronica è una malattia caratterizzata da un complesso quadro patologico, e da diversi stadi di gravità. Attraverso il monitoraggio delle modificazioni nella concentrazione plasmatica di antiossidanti enzimatici (SOD, CAT e GPx), in pazienti inclusi nei diversi stadi IRIS dell’insufficienza renale cronica, si è cercato di comprendere ed interpretare le variazioni riscontrate, mettendole in relazione alla capacità di adattamento dell’organismo, nel corso della progressione della malattia.
7
8
CAPITOLO 1
L’INSUFFICIENZA RENALE CRONICA
1.1 Introduzione
L’insufficienza renale si verifica quando il rene non è più in grado di assolvere alle proprie funzioni emuntorie, endocrine e tampone. Tale condizione può essere primariamente suddivisa in due grandi raggruppamenti: Insufficienza renale funzionale ed insufficienza renale organica. Nel primo caso si può differenziare in pre-renale o post-renale ed in entrambe le circostanze l’insorgenza è perlopiù acuta. Le forme di insufficienza renale organica possono, invece, presentare sia andamento acuto che cronico.
L’insufficienza renale diviene evidente nel momento in cui oltre il 75% dei nefroni risulta non funzionante (Di Bartola S.P. 2002 ; Guyton A.C. 2006). In questo caso si definisce ―scompensata‖, poiché la massa renale residua non è tale da garantire la compensazione della perdita di funzionalità. Infatti, una funzionalità renale in grado di mantenere l’omeostasi, non necessità della normale funzionalità del 100% dei nefroni. Questo concetto è fondamentale per distinguere una nefropatia da un’insufficienza d’organo, formulare una prognosi realistica e attuare una terapia specifica, sintomatica e di sostegno (Osborne C.A. 1988). L’insufficienza renale cronica (IRC o CKD = Cronic Kidney Disease) è la patologia renale più comune nel cane (Polzin D.J.2002). A partire da una perdita di funzionalità che interessa il 60% dei nefroni, si riscontra una diminuzione della capacità di concentrazione delle urine. Quando la
9
disfunzione riguarda il 75%, ed oltre, delle unità funzionali, si rileva iperazotemia, intesa come un’anormale concentrazione di urea, creatinina ed altre sostanze azotate non proteiche contenute nel sangue, nel plasma o nel siero (Polzin D.J.2002).
E’ per definizione una patologia progressiva. La sua insorgenza deriva molto probabilmente da un danno renale continuato, che si instaura nel corso di mesi o anni, indotto da qualsiasi processo patologico che sia responsabile del suo esordio (Brown S.1992). Può essere causata da molte disfunzioni di natura glomerulare, tubulare, interstiziale, vascolare o mista, congenite o acquisite. E’ stato accertato che l’insufficienza renale può anche progredire, fino all’insufficienza, terminale, attraverso meccanismi che sono indipendenti dalla lesione iniziale (Shimamura T.1975).
A causa delle notevoli connessioni fisiologiche tra i reni e gli altri apparati, questa condizione genera delle conseguenze che si ripercuotono a livello sistemico (Polzin D.J.2002).
1.2 Eziologia
La CKD presenta un’eziologia complessa, alla quale non sempre è possibile risalire con precisione. Essa può, infatti, originare da una singola lesione o da una combinazione di tipologie di danno diverse. Può essere congenita o acquisita. Le cause congenite o familiari possono essere sospettate sulla base della razza, dell’anamnesi familiare, sull’età del soggetto al momento dell’ insorgenza della malattia o sul rilievo di riscontri radiografici o ecografici (es. rene policistico o displasia renale).
10
Le forme acquisite, al contrario, possono originare da qualsiasi processo patologico che interessi il glomerulo, il tubulo, l’interstizio o la componente vascolare del rene e che sia tale da determinarne una perdita della funzionalità (Brown S. 1992).
Tra le cause più comuni di CKD (Guidi G. 2006) si possono includere:
Disturbi immunitari: patologie degli immunocomplessi, produzione di autoanticorpi o immunodeficienze;
Neoplasie: primarie e secondarie;
Amiloidosi;
Nefrotossine;
Processi infiammatori: di origine infettiva, pielonefriti, calcolosi;
Ischemia renale;
Ostruzioni del flusso urinario;
Fattori ereditari: displasia renale, rene policistico, predisposizioni di razza ( Sharpei, Cocker Spaniel, Beagle);
Forme idiopatiche (Guidi G. 2006; Bricker N. 1978);
Quando la patologia è diagnosticata nel suo stadio terminale, le lesioni a carico del rene sono, spesso, tali da rendere impossibile l’identificazione della causa scatenante. Questo anche perché le lesioni progressive ed irreversibili, inizialmente localizzate in una porzione del nefrone, tendono a diffondere all’intero parenchima (Brown S. 1992).
11
1.3 Patogenesi
In corso di CKD l’iperazotemia è causata da una patologia o da un danno del parenchima renale che si è sviluppato durante un periodo di tempo sufficientemente lungo (almeno tre mesi). La condizione di danno renale cronico può svilupparsi e decorrere in modo clinicamente silente per periodi di tempo relativamente lunghi (mesi, anni). Negli stadi iniziali, infatti, la CKD presenta un andamento subdolo, poiché il paziente si trova spesso in una situazione di stabilità in cui i nefroni rimasti intatti e funzionanti compensano la mancata attività dei nefroni danneggiati. Questa fase è anche detta fase stazionaria dell’insufficienza renale
cronica e corrisponde allo stadio I nella classificazione IRIS. I pazienti
in stadio IRIS I sono generalmente asintomatici e presentano valori di creatinina ed urea all’interno del range di riferimento.
Infatti a distanza di settimane o mesi dall’instaurarsi del danno, il rene ha migliorato la sua capacità di concentrazione e la funzione escretoria, grazie alla capacità dei nefroni residui di compensare la perdita funzionale. Tale concetto è anche conosciuto con il nome di “Teoria del
nefrone intatto” (Giudi G. 2006). Nel momento in cui subentrano eventi
stressanti o malattie concomitanti, di varia eziologia, l’insufficienza renale può divenire clinicamente evidente fino a portare alla comparsa della sindrome uremica (Shimamura T. 1975). Infatti la compensazione dei nefroni è in grado di mantenere l’omeostasi solo entro una certa soglia di disfunzione tissutale, oltre la quale l’insufficienza si estende ai nefroni rimanenti. I meccanismi responsabili dell’automantenimento spontaneo dell’insufficienza renale sembrerebbero essere in relazione proprio con le conseguenze derivanti dagli adattamenti compensatori che seguono la riduzione del numero dei nefroni funzionanti. Infatti, sebbene
12
questi adattamenti possano risultare inizialmente benefici, a lungo termine risultano lesivi per il tessuto superstite, portando a lesioni glomerulari che favoriscono l’automantenimento e la progressione della patologia. Questa riduzione determina un aumento delle concentrazioni plasmatiche di composti normalmente escreti per via renale. L’accumulo di queste sostanze si ritiene possa essere responsabile, almeno in parte, della costellazione di segni clinici nota come “sindrome
uremica”. La ricerca sulle tossine uremiche non ha finora identificato
nessuna singola tossina come causa dei segni uremici, ma l’associazione ben riconosciuta tra i segni clinici dell’uremia e la quota proteica della dieta, supporta l’idea che i prodotti del metabolismo delle proteine agiscano come tossine uremiche. (Polzin D.J. 1995) La restrizione proteica infatti riduce l’azoto ureico ematico e migliora i segni clinici dell’uremia. (Polzin D.J. 1995) Le tossine uremiche, tuttavia, non sono l’unica causa dell’uremia, come è evidenziato dal fatto che non è possibile identificare una sostanza che, somministrata ad animali da esperimento, induca tale sindrome. Questa osservazione, insieme al fatto che la sindrome uremica ha molteplici manifestazioni cliniche, suggerisce che essa sia il risultato della somma dei metaboliti tossici con gli squilibri idrici, acido-base, elettrolitici, endocrini, nutritivi ed enzimatici (Osborne C.A. 1995).
Nel caso in cui l’intervento terapeutico di tipo dietetico-conservativo non si riveli una misura efficace, l’unica scelta da intraprendere, ad oggi possibile in campo veterinario, rimane la terapia emodialitica.
13
1.4 Sintomatologia
La CKD è rappresentata da un punto di vista clinico da un quadro di sintomi estremamente complesso, in cui si riscontrano sintomi aspecifici, quali depressione, abbattimento, anoressia e perdita di peso, e sintomi specifici a carico di diversi organi e apparati.
1.4.1 Apparato gastroenterico
A carico dell’apparato gastroenterico possono essere presenti, singolarmente o associati, i seguenti segni clinici:
Anoressia e perdita di peso;
Gastrite;
Vomito;
Stomatite;
L’anoressia e la conseguente perdita di peso possono essere il risultato della combinazione tra l’eccessiva assunzione di liquidi per polidpsia, gli squilibri metabolici e ormonali che si instaurano, come l’alterazione del metabolismo dei carboidrati (aumento dei valori sierici di glucosio ed insulina), l’aumento del catabolismo muscolare, i fattori catabolici legati all’uremia e all’acidosi metabolica, l’ipergastrinemia che porta a gastrite uremica.
14
La gastrite uremica ha un’eziologia multifattoriale e può verificarsi a causa della difettosa eliminazione renale di gastrina, che si mantiene quindi in circolo a livelli elevati ed induce un’ipersecrezione gastrica di acido cloridrico, sia attraverso stimolazione diretta dei recettori della parete gastrica, sia indirettamente stimolando il rilascio di istamina (Nelson 2006). Questo comporta ulcerazioni gastriche e necrosi ischemiche della mucosa per mezzo di un meccanismo vascolare caratterizzato da dilatazione di piccole vene e capillari, aumento della permeabilità endoteliale e trombosi intravascolare. La diffusione retrograda di HCl e pepsina nello stomaco può determinare emorragia, infiammazione e rilascio di istamina da parte dei mastociti, con l’innesco quindi, di un circolo vizioso, in quanto l’istamina derivante dai mastociti determina un’ulteriore stimolazione alla produzione di H+ da parte delle cellule parietali. Altri fattori che sono implicati nella genesi della gastropatia uremica comprendono lo stress psicologico legato alla malattia, che può determinare un aumento della secrezione acida gastrica, le erosioni causate dall’iperammoniemia, l’ischemia causata da lesioni vascolari e la diminuzione del turnover cellulare della mucosa gastrica (Polzin D.J. 2002).
Il vomito può derivare dalla diretta stimolazione centrale della zona chemorecettoriale nel IV ventricolo, dall’ipergastrinemia e dall’aumento nella produzione di sostanze acide a livello gastrico.
Un altro segno clinico gastroenterico caratteristico dell’insufficienza renale in fase terminale è la cosiddetta stomatite uremica, che può presentarsi caratterizzata dalla presenza di ulcere orali, necrosi delle gengive, xerostomia e caratteristica alitosi, come esito della forte gastrite, del vomito cronico e dell’erosione mucosale causata
15
dall’iperammoniemia generata dalla decomposizione di batteri ureasi-produttori.
Sebbene rappresenti un reperto non costante, si può riscontrare nel cane un’enterocolite con diarrea, anche emorragica, associata all’insufficienza renale (Osborne C.A.1988).
1.4.2 Apparato urinario
Il primo aspetto rilevabile a carico dell’apparato urinario è rappresentato dalla progressiva perdita, da parte del rene insufficiente, della capacità di concentrare le urine. Come conseguenza di tale condizione, il paziente presenta poliuria, non sempre riscontrata dal proprietario e distinguibile dalla pollachiuria. Più facilmente, quest’ultimo riporterà un aumento dell’assunzione di acqua, polidipsia, conseguente all’incremento del volume urinario ed incapace, tuttavia, a compensare la progressiva disidratazione del paziente.
La poliuria deriva dalle conseguenze dell’―ipotesi del nefrone intatto‖, per cui l’iperfiltrazione compensatoria, che si verifica a carico dei nefroni residui, esita, a lungo termine, in un’alterazione dell’emodinamica conseguente al fatto che i nefroni residui vanno incontro ad una rapida risposta ipertrofica, con riduzione delle resistenze arteriolari ed aumento del flusso plasmatico glomerulare (Guidi G.2006). Il tono dell’arteriola afferente, si riduce in misura minore di quello dell’arteriola efferente e, di conseguenza, la pressione idrostatica nei capillari glomerulari e la quantità di filtrato per ogni singolo nefrone aumentano (Remuzzi G.1997; Brenner B.M.1996). Questi cambiamenti
16
aumentano la capacità di filtrazione dei nefroni residui, minimizzando così le conseguenze funzionali della perdita numerica di nefroni, ma sono in ultima analisi causa di danno renale. Inoltre, si verifica un calo del gradiente di sodio, normalmente presente nella midollare del rene, provocato dalla riduzione del numero di nefroni funzionanti e quindi un calo anche dell’attività della pompa sodio-potassio, che si traduce in una riduzione della tonicità della midollare. Il gradiente di pressione osmotica all’interno della midollare pertanto si riduce, andando ad influire negativamente sul riassorbimento di acqua a livello del tubulo distale e del dotto collettore (Nelson 2006).
Alla poliuria concorrono anche la disarchitettura della midollare e la perdita della risposta renale all’ADH. La perdita della sensibilità renale all’ADH può derivare da un’aumentata velocità del flusso nei tubuli renali distali, la quale limita l’equilibrio tra i liquidi tubulari e l’interstizio midollare ipertonico.
1.4.3 Apparato cardiovascolare
Le alterazioni principali che in corso di CKD interessano l’apparato cardiovascolare sono l’anemia e l’ipertensione sistemica.
L’anemia, tipicamente non rigenerativa, è una manifestazione comune in corso di uremia. Le cause di anemia associate a CKD sono da imputarsi alla ridotta sintesi renale di eritropoietina, all’inibizione degli eritroblasti nel midollo osseo da parte delle tossine uremiche, all’effetto negativo che le tossine hanno sulla longevità dei globuli rossi, all’azione inibitoria del paratormone nei confronti dell’eritropoiesi e alle carenze nutrizionali
17
da disoressia. Poiché i fattori eziologici alla base dell’anemia possono essere molti, occorre tenere presente il significato potenziale di ognuno di essi per poter formulare la terapia specifica atta a correggerli (Polzin D.J.2002).
L’ipertensione nell’insufficienza renale cronica, sembra svilupparsi principalmente come conseguenza dell’aumento di volume del fluido extracellulare, della sclerosi dei capillari e delle arteriole glomerulari, della ridotta sintesi renale di prostaglandine ad azione vasodilatatoria e dell’attivazione del sistema renina-angiotensina-aldosterone (Schiffrin E.L.2007).
Questi effetti possono essere aggravati dall’attivazione del sistema simpatico, che sembra mediata da un segnale afferente derivante dai reni alterati (Converse R. Jr 1992). Alcuni studi hanno inoltre riportato che la maggior parte dei cani e dei gatti con ipertensione cronica mostra segni di ipertrofia ventricolare sinistra (Littman M.1990). In tali pazienti si osserva comunemente un murmure mitralico di bassa entità e cardiomegalia. Nei cani sono anche state riportate lesioni vascolari tipiche dell’ipertensione sistemica cronica. (Cowgill L.1986)
1.4.5 Apparato neuromuscolare
In corso di CKD i soggetti possono presentare uno stato del sensorio completamente normale, oppure alterazioni neurologiche quali, sonnolenza, barcollamenti, mioclonie, convulsioni e coma. Tali alterazioni dello stato mentale sono principalmente secondarie ad una condizione di encefalopatia uremica. L’encefalopatia uremica può essere
18
secondaria alla presenza di tossine uremiche, tra cui la maggiore importanza è rivestita dal paratormone che aumenta la sua attivata a causa dell’iperparatiroidismo secondario renale e che determina alti livelli di calcio intracellulare.
Altre cause possono essere riconducibili all’ipertensione arteriosa, come già citato, con aumento della pressione intracranica ed eventuali emorragie; in questo caso l’insorgenza è generalmente acuta o iperacuta, con comparsa di convulsioni e morte.
1.5 Stadiazione IRIS della CKD
La CKD è una malattia cronica progressiva, tuttavia la sua progressione in alcuni pazienti è più rapida che in altri. In tali soggetti si assiste ad un costante declino della funzionalità dell’organo, che culmina inesorabilmente in una condizione di uremia. In questi casi la prognosi è determinata dalla progressione di tale declino, che può essere influenzata dalla tipologia di patologia sottostante, dalla presenza di complicazioni, dalla capacità dell’individuo di mettere in atto adattamenti compensatori e dalla terapia.
Intuire lo sviluppo a lungo termine della malattia non è semplice, poiché nella maggior parte dei casi non è possibile risalire all’eziologia specifica dell’insufficienza renale. Per questo motivo il decorso della malattia dovrebbe essere monitorato in maniera seriale, nel corso dei mesi o degli anni. In molti casi, infatti, la funzionalità renale può mantenersi stabile per lunghi periodi della vita e progredire poi in maniera imprevedibile.
19
Per questa ragione il riscontro di una funzionalità organica ridotta, ma stabile, non permette di escludere a lungo termine una repentina ulteriore riduzione.
Per facilitare il trattamento ed il monitoraggio di cani e gatti con CKD, si fa riferimento alla stadiazione IRIS (International Renal Interest
Society).
L’ International Renal Interest Society è un’organizzazione che nasce con lo scopo di facilitare la comprensione delle malattie renali dei piccoli animali. A questo scopo, la società ha proposto delle linee guida, riconosciute a livello internazionale, che suggeriscono una stadiazione del paziente renale cronico, che va di pari passo con la capacità di stadiare la malattia. La stadiazione IRIS prevede tre passaggi successivi. In tale sistema di classificazione il paziente viene inquadrato in base ai seguenti criteri: (www.iris-kidney.com)
1. Stadiazione sulla base dei livelli di creatininemia;
2. Sotto-stadiazione sulla base dell’entità della proteinuria;
3. Sotto-stadiazione sulla base della pressione arteriosa sistemica.
Il primo approccio al paziente prevede la misurazione della creatinina sierica. Si tratta di un importante metabolita, muscolare derivante dalla fosfocreatina e per questo la sua concentrazione ematica è determinata dalla massa muscolare individuale del soggetto. Non risente invece dell’apporto dietetico né dell’entità del catabolismo proteico.
E’ eliminata dall’organismo soltanto attraverso il filtro glomerulare e non viene sostanzialmente né riassorbita, né secreta dalla parete tubulare.
20
Sulla base di questo, una volta stabilito il flusso urinario nell’unità di tempo (GFR), la determinazione della clearance della creatinina risulta l’esame più attendibile per la valutazione della funzionalità glomerulare. La creatininemia dovrebbe essere rilevata in almeno due occasioni, sul soggetto stabile e a digiuno. In base a questo rilevamento si ha un primo inquadramento del paziente in uno dei cinque stadi riportati nella seguente tabella:
-Tabella 1: Stadiazione sulla base dei livelli di creatininemia nel cane (parametri riferiti a soggetti di taglia media).
Stadio Creatininemia (mg/dl)
Commenti
A rischio
< 1,4 L’anamnesi suggerisce un rischio maggiore di sviluppare CKD in virtù della razza, dell’esposizione a nefrotossine, della prevalenza di malattie infettive nell’area, ecc…
IRIS I < 1,4 Non presente iperazotemia ma altre alterazioni renali: inadeguata capacità renale di concentrare le urine; palpazione renale, quadro ecografico o biopsia renale anormali; aumento della creatininemia rilevato in più campioni.
IRIS II
1,4-2,0 Lieve iperazotemia. Segni clinici minimi o assenti.
21
IRIS III
2,1-5,0 Moderata iperazotemia. Possono essere presenti numerosi segni clinici.
IRIS IV
>5,0 Insufficienza renale conclamata fino all’uremia.
Come si osserva nella tabella, pazienti con livelli di creatininemia <1,4 mg/dL possono essere inclusi nello stadio IRIS I, oppure nello stadio IRIS 0, sulla base della presenza o dell’assenza dei segni tipici dell’insufficienza renale. I soggetti stadiati come IRIS 0 vengono considerati a rischio e devono essere rivalutati con cadenza mensile e contemporaneamente gestiti con particolari accortezze, volte a prevenire l’esposizione a fattori che possono portare alla perdita della stabilità della condizione di patologia cronica del rene e alla comparsa dei sintomi.
Il paziente classificato invece come IRIS I, presenta di solito sintomi come PU/PD, proteinuria e reperti ecografici e bioptici anormali. Per questo motivo la condizione di insufficienza renale viene ulteriormente sottostadiata sulla base dei valori della proteinuria e della pressione arteriosa. Tale paziente dovrebbe essere sottoposto periodicamente ad esami biochimici, analisi delle urine e di diagnostica per immagini.
Nei soggetti nei quali i livelli ematici di creatinina risultano compresi tra 1,4 e 2,0 mg/dl, è consigliabile un’analisi delle urine. Se da questa risultano un peso specifico < 1030 e la presenza di proteinuria, è consigliabile valutare quantitativamente l’entità della proteinuria mediante UP/UC e sottoporre il paziente ad esame ecografico che, se nella norma, viene sottoposto ad un esame radiografico che, se nella
22
norma, ci permettono di rivalutare il soggetto entro due mesi, mentre se risultano alterazioni, portano ad inquadrare il paziente come appartenente allo stadio IRIS II e a sotto-stadiare la sua malattia sulla base dei successivi steps. Nel caso in cui, invece, dal primo esame delle urine risulti un peso specifico > 1030, può essere sufficiente sottoporre il soggetto alla sola visita clinica e, nel caso, non si riscontrino anomalie, rivalutarlo a distanza di sei mesi.
I soggetti con creatinina superiore a 2,0 mg/dL devono essere valutati al fine di comprendere l’origine dell’iperazotemia. Possono risultare azotemici per cause pre o post renali e in questo caso è necessario correggere le alterazioni alla base dell’anomalia, oppure possono risultare azotemici per cause renali e venire classificati all’interno degli stadi IRIS III o IV e sotto-stadiati sulla base della proteinuria e della pressione arteriosa. (www.iris-kidney.com)
1.5.1 Sotto-stadiazione sulla base della proteinuria
Il secondo stadio della classificazione prevede la valutazione della proteinuria. La proteinuria si definisce come presenza di proteine nelle urine. Queste derivano principalmente dalle albumine e dalle globuline plasmatiche. La loro presenza può essere fisiologica o patologica, in corso di sindrome nefrosica, glomerulonefriti, pieliti, cistiti o altri stati infiammatori dell’apparato urinario.
Per essere ritenuta significativa ai fini della sotto-stadiazione, la proteinuria deve essere di origine renale. Devono quindi essere scartate le proteinurie di origine pre-renale e post-renale.
23
Con l’assunzione di una dieta ad alto contenuto proteico si assiste al rilevamento di alti livelli di proteinuria che si mantengono stabili nel tempo. Quando si assiste ad un suo progressivo aumento, non associato ad elevata quantità di proteine assunte con la dieta, siamo probabilmente di fronte ad un danno glomerulare.
In questo caso una restrizione nell’assunzione di proteine con la dieta può ridurre la proteinuria, poiché riduce l’ipertensione a livello glomerulare. Lo scopo della sotto-stadiazione mediante il valore di proteinuria del soggetto è funzionale alla quantificazione della quota proteica persa con le urine e può essere un ausilio nella localizzazione del danno.
La valutazione della proteinuria renale è importante poiché può essere espressione della gravità del meccanismo lesivo operante a livello glomerulare oppure può rappresentare un fattore di progressione della nefropatia, determinando sclerosi mesangiale (Guidi G. 2006).
L’analisi della proteinuria quantitativa si basa sull’indagine del rapporto tra proteinuria e creatininuria (UP/UC). Tale parametro deve essere misurato su almeno tre campioni, prelevati nell’arco di un periodo di tempo minimo di due settimane.
E’ opportuno, inoltre, che al momento della valutazione non siano presenti stati di infiammazione o emorragie delle vie urinarie e che siano state precedentemente escluse disprotidemie da cause diverse. La classificazione IRIS prevede tre stadi di gravità progressiva, basati sul valore di UP/UC. Vengono considerati pazienti non proteinurici i soggetti il cui UP/UC risulti inferiore a 0,2; borderline proteinurici soggetti con UP/UC compreso tra 0,2 e 0,5 e proteinurici soggetti il cui UP/UC sia superiore a 0,5.
24
-Tabella 2: Sotto-stadiazione sulla base dei livelli di UP/UC.
UP/UC Sottostadio
< 0,2 Non proteinurico
0,2-0,5 Borderline proteinurico (BP) > 0,5 Proteinurico (P)
Nei pazienti in classe borderline proteinuria, è consigliabile rivalutare la proteinuria ogni 2 mesi. L’entità della proteinuria non è correlata alla gravità e alla progressione della patologia. Pazienti in stadio IRIS III e IV possono, infatti, non mostrare alcuna perdita urinaria di proteine (www.iris-kidney.com).
1.5.2 Sotto-stadiazione sulla base della pressione arteriosa
I pazienti in CKD vengono sottostadiati anche in base al valore di pressione arteriosa. Questo rilievo risulta particolarmente significativo poiché rappresenta un importante indice di progressione della malattia. L’ipertensione infatti può causare lesioni sia a livello dei reni che degli altri organi bersaglio.
La valutazione della pressione arteriosa dovrebbe essere effettuata nelle condizioni e con le strumentazioni adatte a minimizzare la comparsa di artefatti. L’accuratezza dei dati raccolti dovrebbe essere confermata mediante l’effettuazione di misurazioni seriali, anche in giorni diversi. L’animale dovrebbe essere posto nelle migliori condizioni possibili, al fine di ridurre il più possibile ansia ed eccitazione. In base ai valori di pressione arteriosa i pazienti vengono classificati in quattro categorie di
25
rischio di gravità progressivamente maggiore. In base a tale classificazione, un paziente viene considerato a rischio minimo (sottostadio 0) per valori di pressione sistolica e diastolica rispettivamente inferiori a 150 mmHg e 95 mmHg; a basso rischio (sottostadio 1) per valori di pressione sistolica compresi tra 150 e 159 mmHg e diastolica tra 95 e 99 mmHg; a rischio moderato (sottostadio 2) tra 160 e 179 mmHg di sistolica e 100 e 119 di diastolica, a rischio elevato (sottostadio 3) per valori superiori a 179 mmHg di sistolica e superiori a 119 mmHg di diastolica.
-Tabella 3: Sotto-stadiazione sulla base dei livelli di pressione arteriosa. Pressione sistolica (mmHg) Pressione diastolica (mmHg) Sottostadio < 150 < 95 0= rischio minimo 150-159 95-99 1= basso rischio 160-179 100-119 2= rischio moderato > 179 > 119 3= rischio elevato
La valutazione del rischio in questa sottostadiazione prende in considerazione anche l’eventuale presenza di alterazioni a livello degli organi bersaglio (cuore, occhio, cervello) o di complicanze. (www.iris-kidney.co
26
Fig.1 Algoritmo per la stadiazione della CKD nel cane, a partire dai livelli ematici
27
28
Fig.3 Algoritmo per la sotto-stadiazione della CKD in base ai valori di pressione
29
CAPITOLO 2
LO STRESS OSSIDATIVO
2.1 Introduzione
In medicina umana esistono numerosi studi che hanno dimostrato il ruolo dello stress ossidativo sia come fattore di progressione dell’insufficienza renale cronica, che come meccanismo patogenetico alla base di molte delle complicanze ad essa associate (Vaziri 2004; Levey 2005).
Con il termine stress ossidativo si definisce una condizione in cui la produzione di radicali liberi nell’organismo supera la capacità di difesa dei sistemi antiossidanti endogeni (Vaziri 2004).
I radicali liberi sono composti chimici altamente instabili a causa della presenza, nella loro struttura, di uno o più elettroni spaiati. Questa loro caratteristica distribuzione elettronica li rende molto reattivi e fa sì che tendano a sottrarre elettroni ad altri composti cui si legano. La reazione che si verifica durante questo tipo di interazione è un’ossidoriduzione, nella quale il radicale libero, detto specie ossidante, acquista un elettrone, mentre la molecola con cui entra in contatto lo perde e rappresenta la specie riducente. Questo meccanismo dà luogo ad una reazione a catena in grado di generare nuovi radicali liberi instabili che vanno ad interagire con molecole indispensabili alla vita cellulare, come il DNA, le proteine e i lipidi, alterandone la natura. Tali alterazioni sono spesso alla base di stati fisio-patologici come la senescenza, l’aterosclerosi, la neurodegenerazione, il diabete ed il cancro.
30
Questa serie di reazioni è tenuta sotto controllo dai sistemi antiossidanti, che possono essere endogeni all’organismo o esogeni, assunti con gli alimenti.
2.2 Reactive Oxygen Species (ROS)
L’ossigeno molecolare è di vitale importanza per la sopravvivenza della cellula. Durante il metabolismo aerobio, nel processo di riduzione dell’ ossigeno ad acqua, sono generate circa 30 molecole di adenosina trifosfato (ATP) a partire da una singola molecola di ossigeno. In un’ipotetica condizione ideale, le cellule utilizzano ossigeno per produrre acqua e ATP senza alcun prodotto tossico. In realtà la respirazione cellulare porta alla continua sintesi di molecole potenzialmente dannose, in particolare specie reattive dell’ossigeno o ROS (Reactive Oxygen Species) (Pieczenik S.R. 2007).
I ROS costituiscono i radicali liberi maggiormente rappresentati nei sistemi biologici. Poiché la respirazione cellulare avviene a carico dei mitocondri, questi organelli costituiscono la principale fonte di ROS dell’organismo. (Pieczenik S.R. 2007)
I prodotti della riduzione dell’ossigeno molecolare possono essere distinti in due categorie principali: i radicali liberi appunto, come l’anione superossido (O
-2) e il radicale ossidrilico (OH
-), e le molecole
non radicaliche come il perossido di idrogeno (H2O2). In questo processo la prima tappa di riduzione dell’ossigeno comporta la formazione dell’anione superossido, cui segue quella del perossido di idrogeno, del radicale ossidrilico ed infine di acqua. (Fig. 4)
31
Fig. 4. Riduzione dell’ossigeno ad acqua.
O2 → O -•2 → H2O2 → •OH → H2O
Questo complesso di reazioni, che prende il nome di fosforilazione ossidativa, non è altro che un insieme continuo di ossido-riduzioni, durante il quale la formazione di ATP avviene in seguito al trasferimento di elettroni dal nicotinammide adenin dinucleotide (NADH) all’ossigeno molecolare attraverso una catena di trasporto localizzata nella membrana mitocondriale interna. La catena di trasporto degli elettroni è costituita dal complesso I (NADH-ubichinone ossido reduttasi), complesso II
(succinato-ubichinone ossido reduttasi), complesso III (ubichinolo-citocromo c reduttasi) e dal complesso IV ((ubichinolo-citocromo c ossidasi).
Durante la normale respirazione cellulare, la riduzione parziale dell’ossigeno da parte del complesso I o III determina la produzione di O-2 (anione superossido). L’O-2 è un radicale tossico che pur non essendo dotato di elevata reattività, può a sua volta dare origine a composti ancora più instabili. Due molecole di anione superossido reagiscono, infatti, formando rapidamente perossido di idrogeno e ossigeno molecolare, in una reazione catalizzata da un sistema enzimatico, che include, tra gli altri, l’enzima superossido dismutasi (SOD).
Il perossido di idrogeno, pur essendo una molecola non radicalica, ha una spiccata reattività; penetra facilmente le membrane biologiche e costituisce un composto intermedio nella sintesi del radicale ossidrilico, attraverso la reazione di Fenton, mediata dallo ione Fe2+. (Fig. 5) La sintesi del perossido di idrogeno è contrastata dai sistemi enzimatici quali catalasi, glutatione perossidasi e perossiredossine.
32
Il radicale ossidrile è la specie più instabile e perciò più reattiva. E’ inoltre la più pericolosa e dannosa per le strutture cellulari poiché non esistono sistemi antiossidanti endogeni in grado di controllarne la sintesi.
Fig. 5. Reactive Oxygen Species: generazione e reazioni.
Sulla base di questo è importante comunque chiarire che l’ossigeno molecolare non rappresenta un radicale libero; tuttavia, possedendo due elettroni spaiati in due diversi orbitali, reagisce rapidamente con molti altri radicali, dando luogo alle specie radicaliche molto reattive sopra citate, che si rendono responsabili dell’ossidazione di lipidi, proteine o DNA (Hallivell 2007).
Occorre precisare che i ROS non svolgono solamente un’azione negativa nell’organismo. L’anione superossido ad esempio è prodotto dai fagociti (neutrofili, monociti ed eosinofili) per indirizzare la sua azione tossica nei confronti di microrganismi patogeni (Babior B.M. 2004).
In condizioni normali il potenziale tossico dei radicali liberi è neutralizzato da un complesso sistema di fattori antiossidanti che
Ossigeno molecolare (O2) Anione superossido (O -• 2 ) Perossido di idrogeno (H2O2) Radicale ossidrile (•OH) NADPH ossidasi, Cyt P450, NOS, COX, Lipogenasi Superossido dismutasi Reazione di Fenton (Fe2+ )
33
rappresenta il meccanismo fisiologico di difesa: il rapporto tra fattori ossidanti e difese antiossidanti rappresenta il cosiddetto "bilancio ossidativo".
In condizioni fisiopatologiche o per disfunzioni mitocondriali, i fattori ossidanti possono superare le difese antiossidanti, endogene ed esogene e, tale condizione può portare ad accumulo di ROS. Il danno biologico che ne deriva è definito appunto stress ossidativo.
2.3 I sistemi di difesa antiossidanti
Gli antiossidanti sono elementi indispensabili per la protezione delle strutture cellulari dall’insulto derivante dai ROS. Sono, infatti in grado di inibire o controllare l’ossidazione del substrato da proteggere, fornendo ai radicali liberi gli elettroni di cui sono privi. (Fig. 6)
Fig. 6. Meccanismo antiossidante: la molecola antiossidante fornisce un elettrone al composto radicalico che presenta un orbitale incompleto.
34
Gli antiossidanti possono essere classificati in rapporto a diversi criteri: sulla base dell’origine, in esogeni ed endogeni, sulla base della struttura chimica, in enzimatici e non enzimatici e sulla base della solubilità, in liposolubili e idrosolubili.
La difesa antiossidante enzimatica è composta da proteine in grado di rimuovere ROS:
1. Superossido dismutasi (SOD) 2. Catalasi (CAT)
3. Glutatione perossidasi (GPx) (Matés J.M.1999).
Gli antiossidanti non enzimatici comprendono varie molecole dette ―scavenger‖ (spazzini), come l’ascorbato, la vitamina E, i carotenoidi, il glutatione ridotto (GSH) e la metallotioneina (MT).
2.3.1 Superossido dismutasi
La SOD è un enzima che si trova nel citoplasma delle cellule eucariote e nel periplasma delle cellule batteriche. Catalizza la reazione che, a partire da due molecole di anione superossido, porta alla formazione di ossigeno molecolare e perossido di idrogeno:
2O•2 + 2H+
→ H2O2 + O2
La reazione determina dunque, la formazione di ROS, per quanto si tratti di perossido di idrogeno e, quindi, di una specie non radicalica. È
35
importante comunque ricordare che in presenza di ferro allo stato libero, il perossido di idrogeno può generare, secondo la reazione di Fenton, il radicale ossidrile, ovvero il più lesivo tra i radicali. In condizioni fisiologiche ciò è scongiurato dagli altri sistemi enzimatici che intervengono su questo substrato: CAT e GPx (Landis G.N. 2005).
Sono state identificate tre isoforme dell’enzima: SOD1 (CuZnSOD), presente nei globuli rossi, SOD2 (MnSOD), localizzata primariamente nei mitocondri e SOD3, presente a livello extracellulare (Ceballos-Picot 1996; Zelko I.N. 2002).
2.3.2 Catalasi
La CAT (ossidoreduttasi del perossido d’idrogeno) è un enzima costituito da quattro subunità proteiche, ognuna contenente ferro eme e una molecola di NADPH (Kirkman H.N. 1987). Si trova soprattutto nei perissosomi, ove inattiva il perossido di idrogeno, catalizzando la sua scissione in acqua e ossigeno molecolare:
Catalasi-Fe3+ + 2H2O2 → Catalasi-Fe2+ + 2H2O + O2
La CAT lavora pertanto in maniera sequenziale rispetto alla SOD (Marklund S. 1982).
L’enzima presiede anche alla detossificazione di altri substrati, tra cui fenoli ed alcoli.
36
2.3.3 Glutatione perossidasi
La GPx è implicata nella riduzione del perossido di idrogeno, degli idroperossidi organici e dei fosfolipidi idroperossidi. È formata da 4 subunità apparentemente uguali e contiene selenio, pertanto, la carenza di questo elemento provoca una marcata riduzione dell’attività dell’enzima. Presente nel citosol e nei mitocondri, la GPx agisce attraverso un meccanismo piuttosto complesso che prevede un ciclo di reazioni nel quale sono coinvolti anche la glutatione transidrogenasi e la glutatione reduttasi. Sembra, comunque, che la GPx agisca quando i bassi livelli di perossido d’idrogeno non sono sufficienti ad attivare la catalasi.
La GPx può anche rimuovere molecole di idroperossidi lipidici derivati dai processi di lipoperossidazione.
La sua attività dipende dalla disponibilità intracellulare di glutatione ridotto, che è, a sua volta, il prodotto dell’attività dell’enzima glutatione reduttasi (Splittgerber A.G. 1979). Il glutatione è un tripeptide costituito da acido glutammico, cisteina e glicina, ha una diffusione ubiquitaria nei mammiferi e può esistere in una forma ridotta (GSH) oppure in una forma dimerica, ossidata (GS–SG).
L’interconversione dall’una all’altra forma, resa possibile grazie al gruppo tiolico della cisteina, è sfruttata dalle GPx per catalizzare reazioni di ossidoriduzione finalizzate all’inattivazione del perossido di idrogeno o di altri perossidi (Gibson D.O. 1985). I livelli di glutatione intracellulare aumentano fortemente in presenza di elevate concentrazioni di perossidi.
37
La GPx, cosiddetta ―classica‖ appena descritta, catalizza la riduzione del perossido d’idrogeno ad acqua ed ossigeno molecolare attraverso la conversione (ossidazione) del GSH a GS–SG:
H2O2 + 2 GSH → 2 H2O + GS–SG
Esiste anche una GPx, selenio-indipendente, indicata con la sigla SeI-GPx che non metabolizza il perossido di idrogeno ma solo i perossidi organici, con un ruolo, quindi, preferenziale, di protezione specifica nei confronti della lipoperossidazione (Forstrom J.W. 1978). In condizioni ideali la SOD, la CAT e la GPx agiscono in maniera ordinata e
sequenziale potenziandosi nel loro ruolo di antiossidanti. (Fig. 7)
38
Alla base dello squilibrio nel bilancio ossidativo può esserci la riduzione dell’assunzione dietetica di antiossidanti (vitamine E, C, D, flavonoidi e carotenoidi) e di micronutrienti (ferro, rame, zinco, selenio) che risultano importanti per la funzionalità di alcuni antiossidanti enzimatici (CAT, SOD e GPx). Anche molte patologie associate ad ipoproteinemia sono state correlate, in medicina umana, a bassi livelli di glutatione. In queste condizioni la somministrazione terapeutica di antiossidanti ha comportato notevoli benefici (Halliwell, B. 2007).
Lo stress ossidativo può, inoltre, risultare dall’aumentata produzione di ROS per esposizione a tossine (paraquat, fumo di sigaretta) e per attivazione di enzimi endogeni (NADPH ossidasi) in patologie infiammatorie ad andamento cronico (Halliwell B. 2007).
2.4 I danni dello stress ossidativo
Nell’ambito dei danni causati dai ROS, quelli al DNA sono potenzialmente i più pericolosi, poiché inducono alterazioni che possono essere la base di mutazioni genetiche e dello sviluppo di neoplasie. Entrambe le coppie di basi azotate, purine e pirimidine, reagiscono con il radicale ossidrile per formare prodotti specifichi che, se non riparati, portano ad errori di trascrizione nella sintesi proteica e all’espressione di geni errati (Halliwell B. 2007). I danni al DNA consistono in modificazioni delle basi azotate o degli zuccheri dei nucleotidi (B. N. Ames 1989), crosslink tra nucleotidi con scambi anomali di basi e rottura delle catene degli acidi nucleici (W. A. Schulz 1994). Tra le basi azotate, la guanina risulta la più sensibile all’ossidazione.
39
Significativi e spesso irreversibili sono anche i danni che i ROS possono causare alle proteine che svolgono funzioni enzimatiche e alle proteine strutturali dell’organismo, che possono subire inattivazione e denaturazione.
Altro bersaglio dei ROS è rappresentato dai lipidi, importanti per la loro presenza nelle membrane che circondano ogni cellula. L’azione ossidativa a carico dei lipidi procede con un meccanismo radicalico a catena definito lipoperossidazione. I principali bersagli di questo fenomeno sono gli acidi grassi poliinsaturi, che sono presenti in elevate concentrazioni nei fosfolipidi delle membrane cellulari. La perossidazione dei lipidi a questo livello porta ad una perdita della fluidità della membrana plasmatica, con possibilità di causare lisi cellulare (Lawrence J. 1987).
Anche i carboidrati possono essere interessati dal danno ossidativo, con conseguenza importanti per quanto riguarda la funzione di recettori cellulari, inclusi quelli associati agli ormoni e ai neurotrasmettitori (Lawrence J. 1987).
2.5 Risposta dell’organismo allo stress ossidativo moderato
Come già affermato, esistono molecole ad azione antiossidante in grado di contrastare i danni dei ROS. Paradossalmente, la continua esposizione a dosi moderate di specie ossidanti, comporta in realtà un aumento nella sintesi di antiossidanti enzimatici. Ciò rappresenta un meccanismo intrinseco attraverso il quale le cellule tentano di ripristinare il bilancio
40
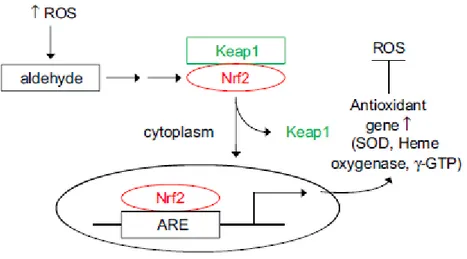
ossidativo. Le componenti cellulari coinvolte in questo meccanismo sono tre:
1. Kelch-like associated protein 1 (Keap1);
2. Nuclear factor erythroid 2-related factor 2 (Nrf2); 3. Antioxidant response elements (ARE)
Nello specifico è stato osservato che il legame di queste molecole con il DNA, stimolato dall’aumento nella produzione di ROS, induce la trascrizione di geni che codificano per la sintesi di molecole citoprotettive e antiossidanti, incluse SOD, CAT e GPx (Fig. 8) (Balaraman Kalyanaraman).
Fig. 8. Attivazione di Keap1-Nrf2-ARE da parte di ROS.
Il dimero Keap 1 ed il fattore Nrf2 formano un complesso nel citoplasma; in seguito allo stimolo fornito da un’aumentata concentrazione di ROS, il Keap 1 si dissocia e permette il passaggio del
41
Nrf2 nel nucleo, dove la molecola può attivare il gene per la trascrizione di antiossidanti, in seguito a legame con gli elementi ARE (Tong K. 2006; Tong K.I. 2007).
42
CAPITOLO 3
CKD E STRESS OSSIDATIVO
3.1 Lo stress ossidativo renale
Nell’insufficienza renale cronica è ormai dimostrata, sia nell’uomo che nel cane, la condizione di stress ossidativo, essendo il rene, costituisce, infatti, già di per sé, un ambiente facilmente esposto all’accumulo di specie reattive (Danousi E. 2006; Kargin F. 2001; Puchades M.J. 2009; Zachara B.et al 2004).
Nell’uomo i biomarker di stress ossidativo risultano significativamente elevati in pazienti CKD (Grone, H.J. 2002). Per questo numerosi studi in campo umano si sono concentrati sul ruolo dello stress ossidativo, sia come complicanza che come fattore patogenetico di CKD (Vaziri, N.D. 2004; Levey, A.S. et al. 2003; Levey, A.S. et al 2007).
Importanti generatori di ROS a livello renale, sono le cellule glomerulari, tubulari e i macrofagi attivati (Galle J. 2001). Come in tutte le cellule, anche a questo livello la fosforilazione ossidativa causa una riduzione nella produzione di ROS. Se lo stato redox cellulare favorisce l’ossidazione o se si verifica un drammatico aumento della fosforilazione ossidativa, si può assistere ad un accumulo di ROS.
Le cellule renali, in particolare quelle dell’epitelio tubulare, sono le cellule metabolicamente più attive dell’organismo. Il rene mantiene ad alti livelli la fosforilazione ossidativa ed il flusso arterioso, creando un ambiente in cui è fisiologicamente prevedibile una certa produzione di ROS.
43
In presenza di uno squilibrio nel bilancio ossidativo tra fosforilazione e sistemi antiossidanti, si ha stress ossidativo renale e danno del tessuto. Questo risulta particolarmente problematico nella CKD, poiché il tessuto renale residuo diviene iperfunzionale, andando incontro ad un importante aumento della fosforilazione ossidativa cellulare. In medicina umana e da studi sperimentali effettuati su ratti, si è osservato infatti che nei pazienti renali questa condizione si accompagna all’aumento dei marker di stress ossidativo (Agarwal R. 2003). Si ritiene che ciò possa verificarsi ugualmente in pazienti canini e felini. Inoltre la CKD è associata ad una perdita di efficienza dei sistemi antiossidanti di difesa (Locatelli F. 2003).
Occorre aggiungere che, pazienti con CKD si trovano spesso in condizioni concomitanti, sia fisiologiche che patologiche, che accelerano la formazione di ROS, quali età avanzata, attivazione del sistema renina-angiotensina e infiammazione sistemica.
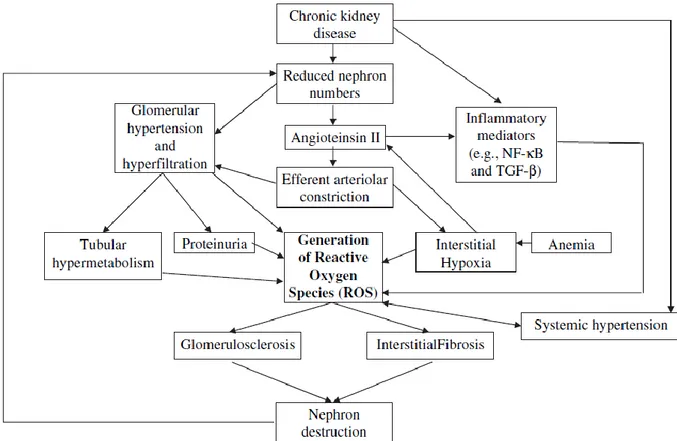
3.2 Fattori chiave per l’instaurarsi dello stress ossidativo renale
Oltre all’insieme di fattori predisponenti precedentemente citati, che rendono il rene molto sensibile ad uno squilibrio del bilancio ossidativo, si possono riconoscere degli importanti promotori di stress ossidativo renale che si instaurano in corso di CKD:
La fibrosi interstiziale e l’ischemia;
L’anemia;
44
L’Angiotensina II;
L’ipertensione glomerulare e sistemica;
L’iperfiltrazione tubulare;
L’infiammazione locale. (Fig. 9)
Fig. 9. La produzione di ROS è aumentata nella CKD, come risultato di una complessa interazione tra fattori pro-ossidanti.
La presenza di fibrosi interstiziale e di aree di ischemia renale porta ad una disfunzione mitocondriale a livello locale, dove si avrà una minor disponibilità di ossigeno e maggior produzione di ROS (Magalhaes J. 2005).
L’anemia aggrava questo problema poiché l’ipossia che ne deriva favorisce la sintesi di ROS. Inoltre, gli eritrociti svolgono, tra l’altro,
45
un’importante funzione antiossidante a livello renale. Gli eritrociti, infatti, giocano un ruolo chiave nel mantenimento locale e sistemico dei sistemi antiossidanti di difesa; per questo, la valutazione dei parametri eritrocitari di SOD, GSH-Px e CAT risulta particolarmente importante nella comprensione della funzionalità di tali sistemi.
Anche l’Angiotensina II è un promotore importante di stress ossidativo a livello del nefrone. Promuove, infatti, la vasocostrizione delle arteriole glomerulari, che porta ad ipertensione, a relativa ipossia a livello delle arteriole efferenti e ad iperfiltrazione, che di conseguenza richiede all’epitelio tubulare di svolgere un lavoro straordinario di riassorbimento.
L’ipertensione sistemica, comune nel cane in corso di CKD, determina spesso aumento della GFR. Ciò contribuisce all’instaurarsi di un circolo vizioso, poiché l’aumentata produzione di ROS che ne deriva, porta a sua volta ad un aumento della pressione arteriosa sistemica (Kitiyakara C. 2003).
Un altro importante fattore di stress ossidativo renale è rappresentato dalla proteinuria. Nel paziente renale umano, in associazione alla proteinuria, si riscontrano marker di stress ossidativo nelle urine (Agarwal R. 2003). Le proteine urinarie subiscono un tasso di ossidazione molto più veloce rispetto alle proteine plasmatiche (Agarwal R. 2003). L’albumina, soprattutto se presente nella sua forma ossidata, attraversato il filtro glomerulare danneggiato, stimola la produzione di citochine pro-infiammatorie a livello delle cellule tubulari, determinando quindi fibrosi interstiziale ed infiammazione, che instaurano nuovamente un circolo vizioso poiché i mediatori dell’infiammazione portano ad un aumento di ROS. Questa attivazione è promossa dall’Angiotensina II
46
(Singh D. 2006). Si instaura quindi un meccanismo autoperpetuante tra mediatori dell’infiammazione e ROS.
Sulla base di queste osservazioni è possibile ipotizzare che così come nell’uomo, anche nel cane con CKD, lo stress ossidativo renale contribuisca alla fibrosi renale interstiziale, alla glomerulosclerosi, all’ipertensione glomerulare e sistemica, alla flogosi renale e sistemica ed al progressivo declino della funzionalità dell’organo.
3.3 Ruolo dello stress ossidativo nella patogenesi delle complicazioni associate a CKD
3.3.1 Stress ossidativo e malattie cardiovascolari
Lo stress ossidativo sembra avere un ruolo centrale nella genesi dei processi fisiopatologici associati all’uremia, incluse le alterazioni cardiovascolari (CVD = cardiovascular disease). Tale complicazione rappresenta la principale causa di mortalità associata a CKD riscontrata nell’uomo (Port F.K. 1998). Alcuni studi hanno preso in considerazione altri fattori di rischio di patologia cardiovascolare, eventualmente concomitanti alla CKD (ad esempio fumo, obesità, diabete mellito, dislipidemia, ecc...), ma questi non sarebbero in grado di giustificare da soli l’entità della CVD in corso di insufficienza renale (Kidney Foundation; Baigent C.2000; Goicoechea M.2005). Recentemente, è stato inoltre suggerito che, pazienti con CKD, sono oltretutto esposti ad altri fattori di rischio correlati all’uremia, quali ad esempio anemia,
47
alterazioni del metabolismo di calcio e fosforo, flogosi, malnutrizione e stress ossidativo (Kidney Foundation; Baigent C.2000). Queste condizioni si instaurano precocemente in corso di danno renale progressivo e sono probabilmente responsabili della maggior parte dei casi di CVD associata a CKD (Foley R.N.1998).
Numerosi studi hanno, inoltre, messo in luce il ruolo dei radicali liberi nella patogenesi del danno da riperfusione post-ischemico a livello miocardico, dell’aterosclerosi, dell’ipertensione e dell’insufficienza cardiaca. (Zweir J.L.1987; Sakamoto H.2002).
3.3.2 Apoptosi dei neutrofili ed immunosoppressione
Lo stress ossidativo è un componente chiave dell’immunosoppressione in corso di CKD (Vanholder R.2008) e può ostacolare l’attività dei neutrofili. Questa condizione aumenta il rischio di mortalità causata da infezioni batteriche secondarie a disfunzione neutrofilica associata a stress ossidativo (Rysz J.2004).
I neutrofili sono, tra l’altro, responsabili degli effetti benefici dei ROS, poiché, come già accennato, il loro potere battericida si esplica proprio attraverso la produzione di anione superossido. Tuttavia, quando i radicali liberi sono generati in eccesso, il danno che ne deriva a carico delle strutture cellulari, accelera il processo di apoptosi, che va ad interessare anche le cellule del sistema immunitario (Kato S.2008). Il fenomeno dell’apoptosi è in questo caso indotto da una varietà di stimoli, tra cui il danno agli acidi nucleici, le tossine uremiche, l’ossidazione
48
cellulare e specifiche citochine, in particolare TNF-α (C.C.Wu J-S. Chen 2005).
L’aumento dell’anione superossido nei neutrofili di pazienti umani con CKD, altera la funzione delle cellule endoteliali, mesangiali e dei podociti e riduce il flusso e l’escrezione renale di sodio (Vaziri ND et al.2003; Nistala R.2008).
Analogamente, nel cane, in seguito a studi effettuati in vitro (Barbosa T.S.2010) e a conferme riscontrate in vivo (Rodrigues Almeida Silva A.C.2014) è stata appurata la relazione tra gli stadi avanzati di CKD (IRIS 3 e 4) e una diminuita attività neutrofilica, alla base della quale sembra esserci proprio lo stress ossidativo.
La riduzione del metabolismo ossidativo dei neutrofili determina ridotta produzione neutrofilica di SOD a scopo battericida, diminuita vitalità dei neutrofili e conseguente deficit nella risposta immunitaria.
Tali studi trovano corrispondenza con l’ipotesi che, nei primi stadi della CKD, si verifichi, al contrario, un aumento del metabolismo ossidativo dei neutrofili, con conseguente accumulo di sostanze ossidanti e potenziale danno cellulare, in grado di accelerare, progressivamente, l’apoptosi dei neutrofili negli stadi più avanzati della malattia (Cendoroglo M.1999).
3.3.3 Incidenza tumorale e CKD
Gli stadi avanzati della malattia renale nell’uomo sono stati associati ad una maggiore incidenza nello sviluppo di neoplasie a carattere maligno (P. Maisonneuve 1999; M. Teschner 2002). È stato dimostrato che lo
49
stress ossidativo e la flogosi sono direttamente coinvolti nella patogenesi del cancro correlato a CKD, soprattutto a causa del danno ossidativo al DNA, che può determinare espressione di oncogeni e mutazione di geni tumor-suppressor (K. ˇSebekov´a 2007; S. Loft 1996; H. Stopper 2004). Per questi motivi, gli indicatori di danno ossidativo al DNA possono rappresentare marker utili per rilevare il rischio di sviluppare il cancro (Bo-hyun Choi 2014).
3.4 Biomarkers di stress ossidativo e infiammazione in CKD
La valutazione dello stress ossidativo può essere effettuata sia prendendo in considerazione gli effetti indotti dalle specie ossidanti sulle biomolecole del corpo, sia sul sistema di difesa antiossidante. I valori maggiormente considerati per quanto riguarda i marker di stress ossidativo sono rappresentati da:
Metaboliti reattivi dell’ossigeno: ROOMS;
Perossidazione lipidica: acroleina, malondialdeide, 4-idrossinonenale, sostanze reattive dell’acido tiobarbiturico, F2 isoprostano, ALE (Advanced Lipid oxidation End-products), anticorpi per LDL ossidate;
Ossidazione delle proteine: AOPP (Advanced Oxidation Protein Products);
Ossidazione dei glucidi: AGE (Advanced Glycation End-products);
50
Per quanto concerne invece gli antiossidanti, possono essere valutati i seguenti marcatori:
Enzimatici: SOD, CAT, GPx;
Non enzimatici: Glutatione, Vitamina E, Vitamina C, ferritina, transferrina, albumina, acido urico, ecc.;
BAP: (Biological Antioxidant Potential);
ORAC: (Oxygen Radical Adsorbance Capacity);
TAC: (Total Antioxidant Capacity)
Nella clinica umana, i livelli di marker di ossidazione di lipidi, proteine e DNA sono notevolmente aumentati nei pazienti CKD, rispetto ai soggetti sani (Tab. 4). L’aumento della malondialdeide (MDA), un biomarker di ossidazione lipidica, è implicato nella grave glomerulosclerosi che si verifica nel corso della malattia (Kuo, H.T.2005). Altri studi (Grone, H.J.2002) hanno dimostrato che livelli di acido ipocloroso (HCIO), altro radicale spiccatamente reattivo, aumentano in maniera significativa nei podociti e nei glomeruli renali dei malati di CKD. Elevati livelli di 8-idrossi-2’-diidroguanosina sono associati a danno del DNA da ROS, nei soggetti affetti (Fujiwara, N.2011).
In particolare, secondo uno studio effettuato in medicina umana, da un confronto tra F2 isoprostano, MDA, rapporto glutatione ossidato/ridotto, AOPP e 8-idrossi-2’-deossiguanosina, quest’ultima risulterebbe il parametro più attendibile di danno ossidativo (Puchades M.J.2009).
51
Livelli di geni codificanti per molecole antiossidanti, come SOD, CAT e GSH sono risultati d’altra parte ridotti nei pazienti CKD (Ceballos-Picot, I.1996; Ongajooth, L.1996; Shurtz-Swirski R.1995).
In letteratura esistono risultati contrastanti sul comportamento della barriera antiossidante enzimatica in corso di CKD. Alcuni studi, sia in ambito veterinario che nel campo della medicina umana (Zachara B 2003; Zachara B.2004; Kargin 2001; Lippi I.2011), si sono concentrati in particolare sull’andamento della GPx in relazione alla progressione dell’insufficienza renale. Come già affermato, le GPx sono una classe enzimatica di notevole importanza per la prevenzione della perossidazione lipidica. Sono state identificate una GPx plasmatica ed una eritrocitaria. Il principale sito per la sintesi di GPx plasmatica è rappresentato dal tubulo prossimale del rene (Avissar N.1994). Questo enzima è risultato significativamente ridotto nei pazienti renali umani e, per questo motivo, può essere considerato un fattore diagnostico e prognostico di CKD nell’uomo (Ceballos-Picot, I.1996; Zachara B et al.2006; Schiavon R.1994). La GPx eritrocitaria è presente negli eritrociti, nel rene e nel fegato. (Arthur JR.2005). Entrambe le componenti enzimatiche appaiono diminuite in un confronto tra le concentrazioni nei soggetti malati rispetto a quelle rilevate nei soggetti sani (Zachara BA et al.2004; Durak I.2007; Ongajooth L.1996). In contrasto con queste rilevazioni, è emerso da altre ricerche, che non esisterebbero invece differenze significative nell’attività della GPx eritrocitaria, tra soggetti affetti da insufficienza renale e soggetti sani (Zachara BA et al.2006; Zachara BA et al.2004). È stato valutato anche l’andamento della concentrazione dei due enzimi in relazione alla progressione dell’insufficienza renale, ed è emersa una riduzione, nella fasi iniziali della malattia, sia della componente plasmatica che