Introduzione
L'artrite reumatoide (AR) è una malattia infiammatoria sistemica, caratterizzata da un processo di sinovite cronica prevalentemente a carico delle piccole e delle grandi articolazioni diartrodali, ad impronta destruente, spesso associata con la positività del fattore reumatoide. La prevalenza in Italia è nell'ordine 0,5%,1 con netta predilezione per il sesso femminile (rapporto uomini: donne di 1:3). L'AR presenta un'espressività clinica polimorfa, in rapporto alla topografia, al grado di evoluzione dell'impegno articolare ed alla possibile presenza di manifestazioni extra-articolari.
L'AR, se non adeguatamente trattata, ha un decorso cronico ad impronta progressivamente invalidante: dopo 10 anni di malattia oltre il 25% dei pazienti non è più in condizione di svolgere la propria attività lavorativa.2
Eziopatogenesi
L'eziopatogenesi dell'AR non è ancora completamente conosciuta. L'ipotesi che attualmente gode di maggiori consensi prevede che la malattia si sviluppi quando un individuo geneticamente predisposto a sviluppare la malattia entri in contatto con un antigene scatenante (non ancora conosciuto). Tale incontro determinerebbe un'attivazione del
sistema immunitario che, attraverso una serie complessa di eventi,
coinvolgente sia l'immunità umorale che quella cellulare, porterebbe allo sviluppo di un processo infiammatorio acuto e successivamente al suo automantenimento e cronicizzazione.
Perchè la malattia si sviluppi è necessario, pertanto, che le tre componenti, predisposizione genetica, stimolo antigenico e sistema
immunitario interagiscano tra loro. L'esistenza di una predisposizione
genetica a contrarre l'AR è stata inizialmente ipotizzata sulla base di alcune osservazioni epidemiologiche in gemelli affetti da AR. Successivamente con la scoperta del Sistema Maggiore di
Istocompatibilità nell'uomo (HLA), che sovrintende le risposte immunitarie, è stato possibile dimostrare l'associazione tra AR e l'antigene HLA-DR4 nel 60-70% dei pazienti con AR. L'antigene scatenante in grado di attivare il processo immunitario nei soggetti predisposti potrebbe essere un virus, un batterio o sostanze derivate da un'infezione (superantigene) come pure un autoantigene, cioè un elemento normalmente presente nell'organismo ma che il sistema immunitario, erroneamente, riconosce come estraneo.
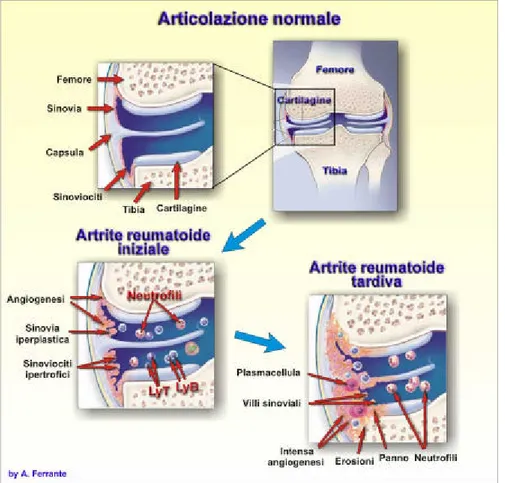
Una volta che il sistema immunitario è stato attivato, si assiste ad una modificazione delle normali difese immunitarie per cui il processo infiammatorio si automantiene, poichè gli anticorpi e le cellule immunitarie, normalmente attivi contro gli agenti estranei ed infettivi, aggrediscono invece le strutture articolari, che sono il principale organo bersaglio della malattia; a questo livello, il tessuto sinoviale , sia delle articolazioni che dei tendini, diviene sede di un processo infiammatorio cronico che, dopo mesi o anni, può determinare danni permanenti ed alterazioni meccaniche indotte, in articolazioni in cui i capi articolari non sono più tra loro congruenti.
Oltre alle articolazioni il processo infiammatorio, di tipo vasculitico, può interessare anche altri organi ed apparati.
Sulla base di modelli sperimentali e di recenti indagini isto-patologiche in vivo sono state definite 5 fasi o tappe patogenetiche ad ognuna delle quali corrisponde un preciso stadio clinico e radiologico: secondo questi studi pertanto dalla fase iniziale di attivazione del sistema immunitario, umorale ( IL-1, IL-2, TNFa, INFg etc) e cellulare ( Macrofagi, Linfociti TCD4, Linfociti B etc) si giunge alla fase finale di proliferazione del "panno sinoviale" e di invasione progressiva della cartilagine ed osso subcondrale, con distruzione della struttura interessata.3
Figura 1 :danno articolare in paziente con AR
Manifestazioni cliniche
Nel 70% dei pazienti l'esordio della malattia è insidioso ed avviene in un arco di poche settimane o mesi. Un esordio acuto può registrarsi in una quota limitata di casi. Il dolore infiammatorio articolare, la limitazione funzionale e la tumefazione secondaria al versamento intrarticolare o alla sinovite proliferativa sono le principali espressioni cliniche del processo infiammatorio. È spesso presente un aumento della temperatura locale, correlabile con l'entità dell'impegno flogistico.
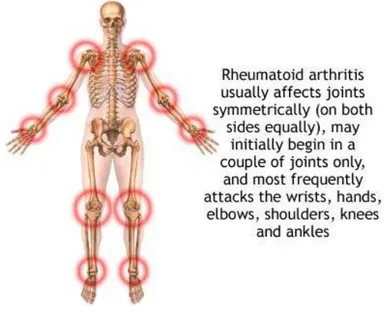
Figura 2: interessamento articolare simmetrico AR
I polsi e le piccole articolazioni delle mani e dei piedi sono i distretti più frequentemente coinvolti.
Con l'evolvere della malattia possono instaurarsi gravi deformità, quali la mano "en boutonnière" (contrattura in flessione dell'interfalangea prossimale ed iperestensione dell'interfalangea distale), le dita "a collo di cigno" (iperestensione della interfalangea prossimale e flessione dell'interfalangea distale) e la deviazione ulnare delle dita con aspetto "a colpo di vento".
L'impegno dei tendini estensori e flessori delle dita è pressoché costante fin dalle fasi di esordio della malattia e può essere agevolmente documentato all'indagine ecografica (distensione della guaina tendinea, proliferazione sinoviale, aumentata perfusione dei tessuti molli).4 5
L'interessamento dell'articolazione radio-carpica è frequente e carat-teristico e può determinare la sub-lussazione dorsale dell'ulna (sindrome del "caput ulnae"), nonché la compressione del nervo mediano, con conseguente sindrome del tunnel carpale (diminuzione della sensibilità sulla superficie palmare del I, II e III dito e sul versante radiale del IV dito). L'interessamento del piede è frequente, precoce ed invalidante (dita "a martello", valgismo dell'alluce, cedimento dell'arco plantare, perdita di allineamento delle teste metatarsali). Il coinvolgimento delle grandi articolazioni portanti tende a manifestarsi nelle fasi più tardive della malattia e caratterizza le varianti più aggressive. La sinovite del ginocchio può causare instabilità articolare, deformità in valgismo o varismo e formazione di cisti poplitee che possono determinare una compressione venosa (sindrome pseudotromboflebitica). L' impegno dell' anca è meno frequente e generalmente più tardivo rispetto a quello del ginocchio e spesso altamente invalidante. Un'osteonecrosi asettica della testa del femore può osservarsi in pazienti sottoposti a trattamento protratto con steroidi. L'impegno del rachide cervicale può determinare la comparsa di un'intensa sintomatologia dolorosa e di manifestazioni neurologiche, che possono causare compressione midollare e gravi complicanze neurologiche. La sinovite cronica dell' articolazione atlo--odontoidea può determinare la comparsa di erosioni del dente dell' epistrofeo e lassità del legamento traverso, con conseguente sub-lussazione posteriore o craniale del processo odontoideo e mielopatia da compressione.
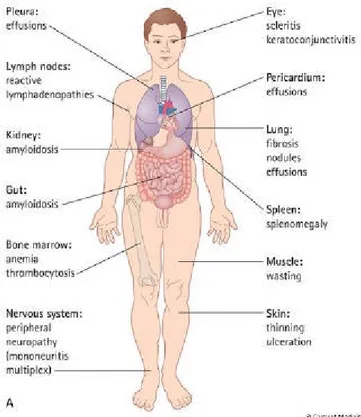
Manifestazioni extra-articolari
Le manifestazioni extra-articolari sono frequenti, spesso elusive e di rilevanza clinica variabile nei diversi casi. L'interessamento polmonare in corso di AR rappresenta una delle principali manifestazioni extra-articolari della malattia ed ha assunto negli ultimi anni un ruolo di notevole importanza sia per la sua elevata frequenza sia per il suo signifi-cato prognostico, risultando la seconda causa di decesso (18%) dopo le infezioni (27%). Il polmone in corso di AR viene interessato soprattutto nella sua componente pleurica, con conseguente pleurite essudativa o altre rare manifestazioni pleuriche rappresentate dall'empiema, dal pneumotorace o dal piopneumotorace ed in quella interstiziale le cui principali espressioni sono riconducibili ad una malattia interstiziale polmonare (MIP) o a quadri di polmonite interstiziale. La malattia polmonare può, inoltre, esprimersi con il coinvolgimento delle vie aeree, con la comparsa di noduli polmonari e più raramente con vasculite polmonare, responsabile di ipertensione polmonare.
La pleurite è la più comune manifestazione intratoracica dell'AR, con una prevalenza del 5% per il versamento pleurico, del 20% per il dolore toracico di tipo pleuritico e variabile dal 40% al 75% in studi autoptici; talvolta può precedere o accompagnare l'esordio dell'AR. Il versamento pleurico, talora associato a versamento pericardico, è più frequente nei pazienti di sesso maschile, generalmente bilaterale, di modesta entità ed asintomatico, ma quando è unilaterale più spesso occupa il cavo pleurico sinistro; occasionalmente può essere massivo e causare insufficienza respiratoria. La pleurite può essere anche acuta ed associata a febbre. La prevalenza della MIP associata all'AR è diversa a seconda dei criteri impiegati per la sua valutazione e viene riportata in percentuali variabili dall'1,6% all'80% dei pazienti. Le caratteristiche cliniche della MIP associata all' AR sono simili a quelle della fibrosi polmonare idiopatica; i sintomi più comuni sono la dispnea da sforzo e la tosse scarsamente produttiva; nelle fasi più avanzate la dispnea è presente anche a riposo. All' esame obiettivo si rilevano rantoli crepitanti prevalenti alle basi polmonari e nelle fasi tardive, cianosi delle estremità con ippocratismo digitale. Nella maggior parte dei casi l'AR precede anche di vari anni la MIP; in alcuni pazienti l'AR e la MIP insorgono contemporaneamente e più raramente, la MIP precede la comparsa dell'AR può inoltre essere documentata anche in pazienti con AR di recente insorgenza. La MIP è riportata più frequentemente in pazienti di sesso maschile con abitudine al fumo di sigaretta affetti da AR con noduli sottocutanei od altre manifestazioni extra-articolari. Il rilievo di opacità nodulari polmonari in corso di AR, documentato nello 0,2-1 % dei casi all' esame radiologico del torace, è andato aumentando con l'avvento delle nuove tecniche di imaging quali la tomografia computerizzata ad alta risoluzione e la TC spirale.
In pazienti con AR senza sintomi respiratori, le opacità nodulari polmonari, a prevalente localizzazione subpleurica e del diametro compreso fra 0,5 e 2 centimetri, sono state osservate nell' 8,3% dei casi.6 I fattori associati ad un maggiore rischio di sviluppare noduli polmonari
sono rappresentati dal sesso maschile, dall'abitudine al fumo di sigaretta, dalla presenza del fattore reumatoide (FR) ad alto titolo e dalla coesistenza di noduli sottocutanei.
Il coinvolgimento dell' apparato cardiovascolare, ed in particolare la cardiopatia ischemica (CI), è frequente e rappresenta una delle più principali cause di morte, essendo da sola responsabile del 30-50% dei decessi, con un rischio triplicato nei pazienti con AR rispetto alla popolazione generale. In particolare, un maggiore tasso di mortalità per malattie cardiovascolari, è stato documentato su pazienti con AR erosiva, di lunga durata, sieropositivi per il FR, con elevata attività di malattia e marcata compromissione funzionale e con associate manifestazioni extra-articolari. Si ritiene, quindi, che nell'AR, oltre ai classici fattori di rischio di CI (età e sesso maschile, elevati livelli di colesterolo LDL, ridotto colesterolo HDL, fumo, ipertensione, diabete ecc.), esistano fattori di rischio "AR-specifici" (iper-omocisteinemia, ridotta attività fisica, fenomeni vasculitici, patologia iatrogenica e fenomeni legati al processo immunoflogistico), che giocherebbero un ruolo di rilievo nell' aterogenesi precoce e nella trombosi vascolare. Recenti evidenze inducono a ritenere che la flogosi cronica svolga un ruolo fondamentale nel danno endoteliale e nell'aterogenesi precoce osservata nei pazienti con AR. Tali evidenze sono supportate dalla stretta correlazione osser-vata fra la malattia aterosclerotica e le proteine della fase acuta e dall'importante ruolo svolto dalle citochine proinfiammatorie, quali il TNF -alfa e l'IL6, nella patogenesi del processo aterosclerotico. Fra le altre manifestazioni cardiovascolari, rinvenibili in corso di AR, la pericardite è quella di più frequente riscontro. La prevalenza della pericardite è stata stimata nell' ordine del 50% circa in studi autoptici e variabile tra il 10% ed il 57% con l'utilizzo di metodiche quali l'ecocardiografìa transesofagea o transtoracica; il coinvolgimento pericardico può manifestarsi sotto forma di ispessimento dei foglietti viscerali, versamento intracavitario o formazione di noduli reumatoidi. Nella maggior parte dei casi il decorso della pericardite è subclinico,
risultando sintomatico solo nel 2% dei pazienti, e l'evoluzione verso il tamponamento cardiaco è rara, essendo stata descritta in pazienti con artrite cronica giovanile ed in casi isolati di AR dell'adulto. L'inte-ressamento valvolare in corso di AR è stato recentemente stimato nell' ordine del 39% circa; tale coinvolgimento è in genere singolo e per lo più associato con insufficienza valvolare, pur essendo stati descritti casi di valvulopatie multiple e di stenosi. Dal punto di vista clinico le lesioni valvolari sono sintomatiche in meno del 10% dei casi e la loro localizzazione è per lo più a carico delle valvole aortiche e mitraliche, con una frequenza stimata, con ecocardiogramma transtoracico, rispettivamente del 514% e del 5-35% dei casi.
Le manifestazioni neurologiche rilevabili in corso di AR sono rappresentate dalla neuropatia periferica, dall'interessamento del sistema nervoso centrale (SNC), dalla mielopatia cervicale, dalle neuropatie compressive e dalla neuropatia autonomica. La neuropatia periferica può complicare il decorso dell'AR in una percentuale variabile dall'l% al 18% dei pazienti e quando clinicamente manifesta può presentare i caratteri della neuropatia sensitiva simmetrica distale o della neuropatia sensitivo-motoria. Le manifestazioni di interessamento del SNC derivano preva-lentemente dalla vasculite, dai noduli reumatoici e dalla meningite. La vasculite del SNC in corso di AR è rara ed è per lo più riportata in letteratura come arterite intracraniale; è altrettanto rara anche nei pazienti con vascu1ite reumatoide sistemica. Le manifestazioni cliniche sono rappresentate da: epilessia, demenza, paralisi dei nervi cranici, stroke, emorragia intracerebrale o subaracnoidea e mielopatia. Noduli reumatoidi localizzati nel SNC con caratteristiche istologiche identiche a quelle dei noduli sottocutanei sono di raro riscontro. La meningite complica in genere l'AR di lunga durata e sul piano clinico è ca-ratterizzata da febbre, alterazioni dello stato mentale, cefalea, epilessia, neuropatia dei nervi cranici, emiparesi o paraparesi. La mielopatia cervicale è, di norma, causata dalla sublussazione atlanto-assiale, derivante dalle lesioni delle strutture ossee, legamentose e cartilaginee
del tratto cervicale superiore, Cl-C2, provocate dalla invasività locale del tessuto sinoviale reumatoide. La sublussazione C17 C2 può avvenire in diverse direzioni, anteriore, posteriore, verticale (invaginazione pseudobasilare), laterale e rotazionale. La sublussazione può interessare i segmenti cervicali al di sotto di C2 a un singolo o più spesso a multipli livelli. La sublussazione adanto-assiale può essere un reperto radiologico occasionale, in assenza di sintomi neurologici, anche se ad un esame obiettivo accurato nel 25% dei pazienti con AR si possono rilevare segni di interessamento piramidale od alterazioni della sensibilità. I sintomi più precoci e frequenti sono il dolore e la rigidità del collo. Nei pazienti con sublussazione adanto-assiale anteriore e posteriore, la compressione della seconda radice cervicale provoca dolore irradiato dal collo alla regione occipitale. La sublussazione laterale provoca dolore al collo ed al cingolo scapolare e il collasso della massa laterale dell' adante, severo dolore al collo, alla regione occipitale ed al cingolo scapolare, associato a flessione laterale e rotazione non riducibile del capo verso il lato opposto. La sublussazione verticale del processo odontoideo può causare la paralisi di alcuni nervi cranici, quali il glossofaringeo (IX), il vago (X) e l'ipoglosso (XII), con conseguenti disfagia, diartria e disfonia, in assenza di perdita della sensibilità della lingua. La sublussazione verticale del processo odontoideo può causare, inoltre, apnea notturna di origine centrale, per compressione del tronco encefalico e conseguente disfunzione del centro del respiro. Le neuropatie da compressione sono le più comuni manifestazioni neurologiche dell'AR, non correlano con la durata della malattia, il sesso dei pazienti, la positività del FR, la classe funzionale, la presenza di altre manifestazioni extra-articolari o con i livelli delle proteine della fase acuta, ma riflettono la presenza e la severità della sinovite nelle aree interessate. La sindrome del tunnel carpale è la più comune neuropatia compressiva associata all'AR, con una frequenza compresa fra il 23% e il 69% dei pazienti ed è dovuta alla compressione del nervo mediano nel tunnel carpale, delimitato posteriormente dalle ossa del carpo ed anteriormente dal legamento traverso del carpo, da
parte della tenosinovite dei flessori delle dita. Essa può rappresentare una manifestazione iniziale dell' AR, anche se può comparire in qualunque momento della malattia, con un esordio dei sintomi sia insidioso che ra-pidamente ingravescente. Il quadro clinico è nelle fasi iniziali dominato dai sintomi sensitivi (parestesie, sensazione di addormentamento e dolori che possono irradiarsi in senso retrogrado all'avambraccio e talvolta anche alla spalla ed al collo), spesso più intensi nel corso della notte, nel territorio di innervazione sensitiva del nervo mediano (prime tre dita e metà radiale del 4° dito), mentre più tardive sono le manifestazioni del coinvolgimento motorio (deficit del movimento di opposizione del pollice, ipo-atrofia dell' eminenza tenar).
Il coinvolgimento renale nell' AR non è così frequente come in altre malattie a patogenesi autoimmune, quali il Lupus Eritematoso Sistemico ed alcune vasculiti sistemiche, tuttavia non è di scarsa rilevanza, se si considera che la patologia renale çostituisce una importante causa di morte nell' AR, essendo responsabile del 10-34% dei decessi. Poiché circa la metà di questi è attribuita alla nefropatia connessa con l'amiloidosi secondaria, ne consegue che altre manifestazioni renali siano presenti nell'AR. Alcune di queste sembrano specificamente correlate al processo reumatoide, altre sono conseguenza diretta o indiretta della tossicità dei farmaci impiegati per il trattamento della malattia. La glomerulonefrite mesangiale è un frequente reperto nefrobioptico nei pazienti affetti da AR con proteinuria e/o microematuria. In casistiche di pazienti con AR sottoposti a biopsia renale per la presenza di segni clinici compatibili con patologia renale la glomerulonefrite mesangiale è risultata l'alterazione istologica prevalente (40% dei casi), seguita dal-l'amiloidosi (33% dei casi).
Diagnosi
La diagnosi di AR è agevole nelle fasi più avanzate di malattia, mentre può risultare problematica in fase precoce.
In generale si dovrebbe parlare di "early arthritis" per le forme con esordio di malattia non superiore a 3 mesi. Nel 19871'American College of Rheumatology7 ha pubblicato il set di criteri per la classificazione dell'AR (Tabella 1). Benché proposti come criteri classificativi, i criteri ACR vengono abitualmente utilizzati come criteri diagnostici al fine di selezionare le casistiche per gli studi sull'AR. Si tratta di un set di criteri elaborati su pazienti con AR stabilizzate, con una elevata durata di malattia (media di 7.7 anni). La presenza di almeno 4 dei 7 criteri comporta una sensibilità del 91,2% ed una specificità del 89,3%. Quando tale set di criteri viene utilizzato per differenziare le forme iniziali, sensibilità e specificità risultano alquanto ridotte (57% e 47%, rispettiva-mente).
Tabella 1
CRITERI DEFINIZIONE
1- RIGIDITÀ MATTUTINA (presente almeno per 6 settimane)
1. -Rigidità mattutina articolare, persistente almeno 1 ora prima del massimo miglioramento
2- ARTRITE di 3 o PIÙ AREE ARTICOLARI
(presente almeno per 6 settimane)
2. -Contemporaneo coinvolgimento articolare rilevato da un medico (rigonfiamento dei tessuti molli e/o versamento) di 3 o più distretti articolari, dei 14 distretti possibili (interfalangee prossimali, metacarpofalangee, polso, gomito, ginocchio, tibiotarsica, metatarsofalangee di destra e sinistra) 3- ARTRITE ALLE ARTICOLAZIONI
delle MANI (presente almeno per 6 settimane)
3. -Almeno un distretto articolare interessato deve essere rappresentato da polso, o metacarpofalangee, o interfalangee prossimali
4- ARTRITE SIMMETRICA (presente almeno per 6 settimane)
4. -Presente almeno per 6 settimane, Interessamento contemporaneo degli stessi distretti articolari di entrambi i lati del corpo. È ammessa una simmetria non assoluta per interfalangee prossimali, metacarpofalangee e metatarsofalangee
5- NODULI REUMATOIDI 5. -Noduli sottocutanei a livello di prominenze ossee o su superfici estensorie o in regioni iuxta-articolari, osservati da un medico
6- FATTORE REUMATOIDE SIERICO 6. -Dimostrazione di fattore
reumatoide a titolo significativo, con qualsiasi metodica che rilevi tale attività in <5% di soggetti normali di controllo
7- SEGNI RADIOGRAFICI 7. -Segni radiografici tipici dell'AR su una radiografia postero-anterio di mani e polsi, che devono includere erosioni o sicura osteoporosi localizzata, o più marcata, in sede prossima alle articolazioni interessate (le lesioni artrosiche non sono qualificanti).
La necessità emergente è, dunque, quella di dotarsi di criteri che tengano conto di indicatori prognostici identificabili in fase precoce di malattia, primariamente mirati a prevedere la persistenza delle manifestazioni e la loro severità. La diagnosi precoce dell'AR è oggi di importanza fondamentale ai fini della prevenzione dell'instaurarsi di lesioni anatomiche irreversibili a carico delle aitico1azioni e dei tendini me-diante 1'attuazione di una efficace strategia di trattamento capace di modificare l'evoluzione naturale della malattia.8 La collaborazione tra medico di medicina generale e specialista reumato1ogo è determinante a questo scopo: i pazienti con artrite all' esordio vanno prontamente individuati dal medico di medicina generale ed inviati al reumato1ogo, al quale spetta il compito dell' inquadramento diagnostico, della valutazione della potenziale aggressività della malattia e della messa a punto di una strategia terapeutica adeguatamente personalizzata. Elemento critico in questo percorso è l'individuazione da parte del medico di medicina generale degli elementi sui quali si basa il riconoscimento dei pazienti con "early arthritis". Le "red flags" consentono l'individuazione da parte del medico di medicina generale dei segni precoci di malattia. Esse si basano sul rilievo di 3 o più articolazioni tumefatte, sulla dolorabilità di metacarpofalangee e di metatarsofalangee alla pressione latero-laterale
(manovra della ‘gronda’ o squeeze test) e su una rigidità mattutina della durata superiore a 30 minuti.9 La “manovra della gronda” è una manovra semplice ed utile per valutare il coinvolgimento delle piccole articola-zioni metacarpofalangee e metatarsofalangee, il cui interesse clinico è stato validato proprio nella "early arthritis". Le tecniche di imaging attualmente disponibili consentono di cogliere con estrema precocità e dettaglio elementi utili a identificare l'artrite all'esordio.
Le erosioni corticali costituiscono l'espressione radiografica più caratteristica (anche se non patognomonica) dell'AR. Essa si identifica in una interruzione focale della corticale ossea che nella "early arthrltis" può apparire, inizialmente, come aspetto “a punto e linea”. Sebbene la radiologia convenzionale possa anche essere negativa nei primi 6-12 mesi dall' esordio clinico, il 75% dei pazienti sviluppa erosioni ra-diologicamente rilevabili entro i primi due anni dall' esordio.
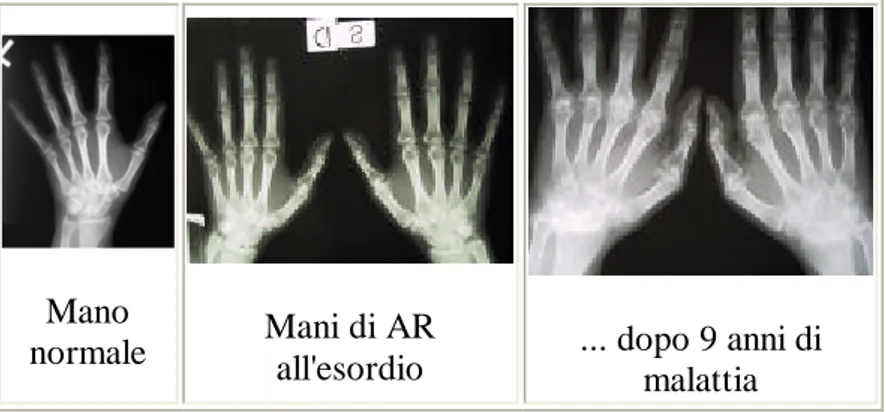
Figura 5: evoluzione delle lesioni articolari in pazienti con AR
Mano
normale Mani di AR all'esordio ... dopo 9 anni di malattia
lesioni multiple, espressione di malattia di lunga durata con coinvolgimento articolare aggiuntivo erosioni subcondrali multiple, fusione (in anchilosi) delle ossa del carpo e di alcune interfalangee prossimali. erosioni articolari marginali delle articolazioni metacarpo-falangee e al carpo, con peculiare coinvolgimento dello stiloide ulnare. ampia lesione erosiva che interessa la testa dell'omero (spalla).
La radiologia convenzionale resta, pertanto, il metodo di scelta per lo studio dell'evoluzione del danno radiologico dell'AR10, in quanto tecnica diffusa, economica e sufficientemente standardizzata. Esistono al riguardo numerosi metodi di valutazione del danno radiologico dell'AR: tra i più usati c’è quello di Larsen.
Metodo di valutazione radiologica della progressione delle lesioni osteo-articolari nell'AR secondo Larsen-Dale, modificato.
Iniziali lesioni erosive metatarso-falangee Alterazioni evolute metatarso-falangee Scomparsa della rima articolare, osteoporosi ed erosioni del ginocchio Piede: alterazioni evolute con lussazioni metatarso-falangee
ARTICOLAZIONI ESAMINATE (32) - 10 metacarpofalangee (MCP)
- 8 interfalangee prossimali (PIP)
- 4 interfalangee, 1° dito, mani e piedi (IP) - 8 metatarsofalangee (MTP)
- 2 polsi (WRIST) Figura 6
A. SCORE DI DANNO (SD)
Ad ogni articolazione viene assegnato il seguente punteggio da 0 a 5, quando confrontata con una Rx standard.
grado 0 : condizione normale
- assenza di alterazioni da A.R. grado 1: lievi alterazioni
- tumefazione dei tessuti molli periarticolari
- osteoporosi periarticolare e lieve assottigliamento dello spazio articolare (se possibile, confrontare con l'articolazione
controlaterale normale o con una Rx precedente della stessa articolazione)
- presenza di piccole erosioni nelle articolazioni delle dita (l'assottigliamento dello spazio articolare può essere presente).
grado 3: alterazioni marcate
- erosioni e assottigliamento dello sazio articolare grado 4: alterazioni gravi
- conservazione parziale della superficie articolare originaria grado 5: mutilazioni
- scomparsa delle superfici articolari originarie - presenza di deformità maggiori
Il polso considerato come unica grossa articolazione, viene "pesato" moltiplicando lo score assegnato x 5.
Lo score di danno (SD) è dato dalla somma dei singoli punteggi di tutte le articolazioni considerate e può essere compreso fra 0 e 200.
B. SCORE DI EROSIONE (SE)
Viene valutato il numero, delle articolazioni considerate, che presentino erosioni juxta-articolari.
Si definisce erosione una soluzione di continuo della corteccia articolare con un diametro minimo di 1 mm.
Lo score erosivo (SE) è dato dalla somma del numero di articolazioni con erosioni e può essere compreso fra 0 e 32.
Questi metodi vengono comunemente utilizzati per valutare la capacità dei farmaci di rallentare la progressione radiologica dell'AR. La radiologia convenzionale presenta tuttavia alcuni svantaggi quali la scarsa sensibilità nel rilevare precocemente le lesioni elementari. Per tale
ragione si sono andate affermando altre tecniche come l'ecografia articolare e la risonanza magnetica (RM). L’ecografia con l'impiego di sonde ad alta frequenza consente lo studio dettagliato dei tessuti molli. L’integrazione con la tecnica power Doppler e con mezzi di contrasto ecografici, fornisce utili informazioni sulla vascolarizzazione del panno sinoviale e, quindi, sull' entità e l'evoluzione del processo flogistico. La RM, grazie al suo contrasto naturale ed alla multiplaniarietà dei piani di studio, fornisce immagini ad elevata risoluzione e sensibilità di tutte le strutture articolari e periarticolari. La tecnica rileva precocemente la presenza di sinovite ed è in grado di fornire indicazioni sull' attività del panno sinoviale grazie all'utilizzo del mezzo di contrasto paramagnetico e dello studio del "contrast enhancement". La RM non espone alle radiazioni ionizzanti e consente di individuare precocemente la presenza di erosioni, con una sensibilità comparabile a quella dell' ecografia articolare e superiore a quella della radiologia convenzionale. I limiti principali sono rappresentati dai costi; dalla scarsa standardizzazione e dalla limitata accettabilità dell' esame in sistemi chiusi ad alto campo da parte del paziente. Recentemente sono stati introdotti apparecchi a basso campo dedicati allo studio delle estremità che rappresentano una inte-ressante alternativa per la valutazione delle articolazioni periferiche nell'AR.
Un pronto ed approfondito inquadramento diagnostico nei pazienti con early arthritis" consente l'identificazione precoce delle forme per le quali è indicato un trattamento più "aggressivo" o che si dimostrano resistenti al trattamento con DMARDs tradizionali. Un'elevata attività di malattia (espressa da più di 6 articolazioni tumefatte e dolenti, da una marcata compromissione della funzione articolare e dello stato generale di salute e da un incremento dei test specifici di flogosi), la positività per il FR ed il numero di articolazioni tumefatte appaiono indicatori prognostici sfavorevoli per tutti i tipi di outcome considerati, mentre lo score
radiologico (valutato mediante il metodo di Larsen o di Sharp modificato) è predittivo per la progressione del danno articolare.11
Benché il FR sia un marcatore dotato di elevata sensibilità per la diagnosi di AR e come marcatore prognostico sfavorevole, è bene tener presente che tale autoanticorpo può essere riscontrato in una varietà di altre condizioni cliniche, reumatiche e non, e in soggetti apparentemente sani, specie in età avanzata.
Anche gli indici di flogosi (VES e PCR) e la positività degli anticorpi an-ti-peptidi citrullinati ciclici (AntiCCP) risultano parametri utili alla de-finizione prognostica nei pazienti con AR. Gli Anti-CCP, in particolare, sono quelli dotati di un profilo di sensibilità/specificità per la diagnosi del1'AR. La comparsa degli Anti-CCP prima dell'esordio della malattia ed il titolo molto elevato nel liquido sinoviale suggeriscono un possibile ruolo patogenetico nel determinismo della malattia. È ancora oggetto di discussione se il dosaggio degli Anti-CCP sia più sensibile di quello del FR nelle early arthritis e se la sua determinazione offra elementi addizionali nella valutazione prognostica ottenuta sulla base dei parametri comunemente impiegati. Non risulta ancora ben definito il grado di suscettibilità per forme di artrite erosiva in pazienti portatori di allele HLA-DR4. In effetti, l'omozigosi per HLA-DRBl 0404 sembrerebbe correlare con lo sviluppo di una artrite infiammatoria sieropositiva per il FR, la concomitante presenza di allele HLA-DRB101 conferirebbe maggiore severità erosiva al quadro.
Una sintesi delle esperienze maturate nelle "Early Arthritis Clinics" ha condotto alla proposta di un modello predittivo dell'artrite reumatoide persistente erosiva. Questo modello è attuabile alla prima valutazione clinica del paziente con "early arthritis" e consiste nella registrazione di 7 variabili: la durata dei sintomi (da 6 settimane a 6 mesi), la rigidità mattutina uguale o superiore ad 1 ora, la conta articolare (articolazioni dolenti e tumefatte) con artrite in 3 o più articolazioni, il "segno della gronda" positivo alle articolazioni metatarsofalangee, la positività del FR, la positività degli anticorpi Anti CCP, la presenza di erosioni alla
radiografia convenzionale di mani e/o piedi. Ad ogni singolo criterio viene attribuito un punteggio con peso variabile. L'applicazione di questo modello consentirebbe di calcolare la probabilità che il paziente possa avere una differente evoluzione secondo una stratifìcazione di "outcome" in artrite autolimitante, artrite persistente non erosiva, artrite persistente erosiva, condizionante l'atteggiamento terapeutico.12
Core-set delle misure per la valutazione dell’ AR
Il numero minimo di variabili essenziali per la valutazione dello stato di attività di malattia è definito “core-set”. Vengono prese in considerazione 6 variabili di processo (che valutano lo stato della malattia in un momento preciso) ed una variabile di esito (misura del risultato del processo di malattia). Il core set proposto dall’ ACR13 comprende: il numero di articolazioni dolenti, il numero di articolazioni tumefatte, la valutazione del dolore da parte del paziente, la valutazione globale dell'attività di malattia, sia da parte del paziente che del medico, la valutazione della funzione fisica da parte del paziente ed, infine, i reattanti della fase acuta (VES o PCR). A queste è stata aggiunta la valu-tazione radiologica delle mani e dei piedi.
Indici articolari
La diffusione dell'utilizzo degli indici articolari, sia nei trial clinici che per la gestione routinaria del paziente con AR, ha reso evidente la necessità di standardizzare le manovre semeiologiche proprie dell'esame obiettivo articolare. I parametri valutati sono essenzialmente la dolorabilità articolare e la tumefazione.
La dolorabilità articolare può essere evocata mediante: . Digitopressione
. Movimento dell'articolazione entro i limiti del range of motion fisiologico
Un ulteriore parametro valutabile è il dolore riferito dal paziente su esplicita richiesta del medico. Alcuni indici articolari, quali l'indice di Ritchie, prevedono che la dolorabilità non solo venga rilevata, ma anche quantificata in base al tipo di reazione (es. risposta verbale, smorfia di dolore, retrazione dell'arto, reazione di fuga). La forza da esercitare con la digitopressione dovrebbe essere all'incirca 3-5 Kg per centimetro quadrato.
La tumefazione articolare può essere conseguenza di una sinovite essudativa o di una proliferazione sinoviale. Bisogna, tuttavia, ricordare che anche l'ipertrofia ossea, le deformità dei capi articolari e l'edema dei tessuti molli peri-articolari possono mimare una tumefazione articolare. Per tumefazione articolare, quindi, si dovrà esclusivamente considerare quella rilevabile lungo i margini articolari. La presenza di un cospicuo versamento articolare determina una tumefazione visibile, ed alla palpazione può dar luogo ad una sensazione di "pastosità" o di massa fluttuante in risposta alle sollecitazioni dell'esaminatore.
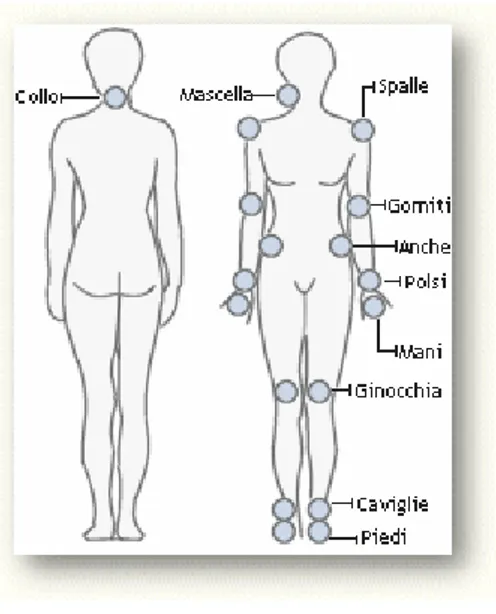
Figura 7:indici articolari
Esistono diversi sistemi di conta delle articolazioni dolenti e/o tumefatte, che si differenziano fra loro per numerosi aspetti. Il fattore distintivo più importante è il numero di articolazioni considerate. Il core set dell'ACR
valuta 68 articolazioni, mentre l'EULAR ha approvato un sistema di valutazione che ne comprende solo 2814.
Indici compositi di attività di malattia
Gli indici compositi di attività di malattia sono espressi non da una singola variabile, ma da un "core set" di misure cliniche, funzionali e di laboratorio. L’adozione di un "pool" di misure, sebbene possa talora comportare difficoltà di interpretazione e di computazione dei dati, offre innumerevoli vantaggi, fra cui figurano la non conflittualità (o non collinearità), la migliore comparabilità fra pazienti o gruppi di pazienti e la maggiore potenza e sensibilità nel monitorare le variazioni cliniche nel tempo. Fra i numerosi indici compositi proposti dalla letteratura, il Disease Activity Score (DAS) è indubbiamente il più utilizzato dai reumatologi, essendo raccomandato dall'EULAR, come criterio di risposta al trattamento15. Si tratta di un indice composito di attività che comprende il numero di articolazioni dolenti, il numero di articolazioni tumefatte, la VES e l' autovalutazione dello stato generale di salute. Nella versione originale il DAS comprende la valutazione di 44 articolazioni tumefatte, mentre per la valutazione delle articolazioni dolenti viene richiesto l'indice di Ritchie.
Più recentemente è stata proposta e validata una versione ridotta del DAS, denominata DAS28 in virtù della semplificazione del conteggio delle articolazioni a 28 sedi. Il DAS originale (con una più completa valutazione articolare) ed il DAS28 non sono intercambiabili. Il DAS28 fornisce valori più elevati rispetto al DAS originale. Qualora non siano disponibili né lo stato generale di salute né la valutazione globale dell'attività di malattia da parte del paziente, può essere calcolato un DAS a 3 variabili, utilizzando le formule specifiche.
Indici di miglioramento o di risposta al trattamento (criteri ACR ed
EULAR)
L’American College of Rheumatology ha proposto nel 1995 una definizione di miglioramento basata sulla modifica di almeno il 20% di 5 delle 7 variabili del core set, dove il miglioramento sia delle articolazioni dolenti che di quelle tumefatte è obbligatorio. Tuttavia, alcuni pazienti classificati come "responder" secondo i criteri ACR 20%, in realtà presentano una risposta clinica superiore, con un minor "rate" di progressione radiologica rispetto ai "non responder" e ciò è stato osser-vato, in particolar modo, in pazienti trattati con i nuovi farmaci biologici. Tale osservazione ha condotto alla ricerca di criteri capaci di esprimere in modo più adeguato un miglioramento di grado più elevato. Da qui l'utilizzo dei criteri di miglioramento ACR 50%, 70% ed anche 90%, definiti utilizzando gli stessi parametri, con un miglioramento rispettivamente del 50%, 70% e 90%. In realtà, la capacità discriminante di tali criteri è risultata inferiore rispetto a quella del1'ACR 20%. La possibilità, infatti, di raggiungere percentuali di risposta elevata dipende in larga parte dal grado di attività al momento dell'inclusione. In tutti i casi questo tipo di valutazione fornisce risposte dicotomiche: miglioramento SÌ / NO.
I criteri di risposta clinica del1'EULAR15 si basano, invece, sui valori. assoluti e sulle variazioni del DAS; utilizzano pertanto solo 3 o 4 variabili del core set.
Tali criteri permettono di classificare la risposta al trattamento come buona, moderata o assente, in relazione a cut off di miglioramento.
Entrambi i metodi sono ritenuti validi nelle sperimentazioni cliniche. Come criterio per definire l'AR, l'EULAR considera un DAS >2,4 (DAS28 2=3,2), mentre l'ACR richiede che tutte e sette le variabili del core set dall'inizio risultino maggiori di 0. La performance dei criteri di miglioramento dell'ACR e di quelli di risposta dell'EULAR è stata confrontata in diversi studi e si è dimostrato che è sostanzialmente
sovrapponibile con una discrepanza nel valutare la condizione di responder <5%. La scelta di quale dei criteri utilizzare deve neces-sariamente essere fatta all'inizio dello studio.
Criteri di remissione
I criteri di remissione definiscono l'assenza o la presenza di un livello molto basso di attività di malattia. Tali criteri devono obbligatoriamente considerare il fattore tempo. L'ARA (American Rheumatism Asso-ciation, attualmente denominata ACR), ha proposto nel 198116 una defìnizione di remissione basata su 6 variabili di attività di malattia, 4 delle quali comprese nel "core set".
L’ EULAR utilizza invece un valore soglia del DAS. Si considera la malattia in fase di remissione se il valore del DAS si mantiene sotto la soglia stabilita per almeno 2 mesi. Tali valori sono stati fissati a <1,6 per il DAS e < 2,6 per il DAS28. La stessa Food and Drug Administration statunitense ha recentemente proposto una serie di criteri di remissione che dovrebbero trovare impiego, soprattutto nei trias clinici.
Criteri di remissione ARA:
5 o più di dei seguenti criteri devono essere soddisfatti per almeno 2 mesi consecutivi:
1. rigidità mattutina 15 minuti
2. assenza di astenia
3. assenza anamnestica di dolore articolare
4. assenza di dolorabilità articolare o dolore al movimento
6. VES (con metodo Westergreen) ? <30 mm/h, ? <20 mm/h
Valutazione della progressione radiologica
La quantifìcazione del danno anatomico nell'AR, ed in particolare lo studio della progressione radiologica, forniscono elementi importanti non solo per conoscere la storia naturale della malattia, ma anche e so-prattutto per monitorare gli effetti a lungo termine dei DMARDs e dei nuovi agenti biologici. Le mani ed i polsi rappresentano le aree più sensibili nella valutazione della progressione radiologica nell'AR. Queste aree vengono precocemente interessate dalla malattia e sono abbastanza numerose da consentire lo sviluppo di indici radiologici con punteggi elevati. Oltre a mani e polsi dovrebbero essere considerate anche le articolazioni metatarsofalangee (MTF). Fra i parametri radiologici da valutare, le erosioni e la riduzione della rima articolare sono quelli più idonei per lo studio della progressione radiologica nell' AR. Il metodo di Larsen ed il metodo di Sharp modificato da van der Heijde rappresentano i sistemi più utillizzati per la valutazione quantitativa del danno anatomico, soprattutto nelle fasi precoci della malattia.
Trattamento farmacologico dell’ AR
La remissione della sintomatologia, l’arresto dell’evoluzione del danno anatomico ed il recupero funzionale sono i principali obiettivi della terapia dell'AR. Il trattamento "sintomatico" si basa sull'impiego isolato o combinato degli antalgici puri (paracetamolo, tramadolo) e degli anti-infiammatori non steroidei (FANS) e steroidei, anche se questi ultimi hanno rivelato interessanti potenzialità nel ridurre la progressione del danno anatomico. Il trattamento ''di fondo" dell'AR ha come finalità principale quella di indurre la remissione della flogosi e di arrestare l'
evoluzione del danno anatomico: i farmaci utilizzati a tale scopo rientrano nel gruppo dei Disease Modifying Anti-Rheumatic Drug (DMARD) e comprendono un'ampia ed eterogenea gamma di molecole (idrossiclorochina, sulfasalazina, Sali d'oro, mtx, lfn, ciclosporina A, farmaci biologici).
Antalgici
Gli antalgici "puri" (paracetamolo, paracetamolocodeina, tramadolo) possono essere utilmente impiegati nel trattamento del dolore, anche in associazione con i FANS. Il profilo di tollerabilità è generalmente ottimo.
Anti-infiammatori non-steroidei (FANS)
I FANS sono efficaci nel ridurre sia la flogosi che il dolore, ma non hanno effetti sulla progressione della malattia né sono in grado di prevenire il danno articolare. Il meccanismo d'azione si basa principalmente sulla inibizione della sintesi prostaglandinico mediata e dalla inibizione dell'enzima ciclo-ossigenasi (nelle sue isoforme Cox1 e Cox2). La scelta più appropriata nel singolo paziente deve basarsi sull' analisi delle peculiari caratteristiche delle diverse molecole in termini di farmacodinamica, farmacocinetica, costi, potenziale interattivo. La tossicità dei FANS, correlata al dosaggio ed alla durata della terapia, rappresenta il fattore che maggiormente ne limita l'impiego. Tra gli effetti collaterali più comuni, riscontrabili specialmente negli anziani, vanno attentamente considerati quelli gastrointestinali, la ritenzione idrica e l'ipertensione arteriosa. Meno comuni, ma non meno importanti sono quelli a carico della funzionalità renale ed i fenomeni di ipersensibilità.
Tutti i FANS seppure in misura e con frequenza diverse possono provocare effetti collaterali indesiderati a carico del tratto gastroenterico.
Il rischio relativo annuale di mortalità, correlata agli effetti collaterali gastrointestinali indotti dall'utilizzo di FANS, è di circa 4 volte rispetto a coloro che non assumono FANS. Nei casi più i complessi va istituita una adeguata gastroprotezione, tenendo in considerazione che i farmaci più efficaci al riguardo sono gli inibitori di pompa protonica (PPI) e gli analoghi delle prostaglandine (anche se meno tollerati ai dosaggi terapeutici consigliati). Meno efficaci dei PPI sono gli antagonisti dei recettori istaminici H2 ed ancor meno i cosìdetti protettori della mucosa (es. sucralfato). L’inibizione della sintesi prostaglandinica, indotta dai FANS, può tradursi in una ridotta perfusione renale che può risultare critica sino alla comparsa di insufficienza renale acuta, specie in presenza di disidratazione, insufficienza cardiaca, insufficienza renale cronica, uso concomitante di diuretici ed ipertensione. Gli inibitori selettivi della Cox2 hanno affiancato i FANS con un ruolo non ancora del tutto definito, anche sulla base delle recenti segnalazioni di eventi cardiovascolari a genesi polifattoriale (effetto ipertensivo, sbilanciamento tra fattori pro- e anti-trombotici).
Corticosteroidi
I corticosteroidi sono spesso utilizzati nei pazienti con AR. Essi andrebbero impiegati alla dose minima efficace, in pazienti nei quali non vi siano significative controindicazioni al loro impiego. La dose minima efficace deve essere accuratamente personalizzata e dovrebbe non superare i 5-7.5 mg/die di prednisone. La terapia protratta con corticosteroidi comporta nell'AR svariati effetti collaterali, tra i quali la perdita di densità minerale ossea che conduce ad una osteoporosi secondaria e ad un aumento del rischio di frattura, questa complicanza rappresenta probabilmente la conseguenza clinica più importante del trattamento corticosteroideo protratto. Le fratture da fragilità rappresentano un onere clinico supplementare di grande rilevanza e
condizionano in misura significativa la qualità di vita, già severamente compromessa, di questi pazienti.
Disease-Modifyng Antirheumatic Drug (DMARD)
La monoterapia con DMARDs, sulla base dei dati disponibili, si è dimostrata efficace in una elevata percentuale dei casi se la malattia viene trattata entro i primi 4 mesi dall'inizio dei sintomi17.
I criteri di scelta del farmaco più idoneo sono basati soprattutto sulla sicurezza di impiego, sulla tollerabilità (ognuno dei DMARDs ha un profilo peculiare di tossicità) e sulla compliance a quel particolare DMARD. Il mtx resta il DMARD di riferimento nella strategia te-rapeutica dell'AR per la sua maggiore efficacia rispetto ai DMARDs tradizionali (idrossiclorochina, sulfasalazina). Anche la lnf, di più recente introduzione, ha rivelato un'efficacia superiore ai DMARDs tradizionali. Se il trattamento si dimostra inefficace nel controllare l'attività di malattia (la valutazione va effettuata entro 3 mesi dall'inizio del trattamento) si potrà ricorrere all'associazione di due o tre DMARDs combinati in successione. Tale scelta dovrà tenere conto dei meccanismi d'azione delle singole molecole capaci di offrire una copertura biologica di tipo additivo (se non sinergico) sui diversi aspetti della flogosi autoimmune. Le scelte più razionali sono quelle che nella letteratura si sono dimostrate le più efficaci nei trial clinici, vale a dire la combina-zione mtx + ciclosporina A + sulfasalazina, quella mtx + sulfasalazina + idrossiclorochina, quella mtx + ciclosporina A + idrossiclorochina. Queste combinazioni offrono garanzie di efficacia e tollerabilità nel medio termine, per cui dovrebbero essere utilizzate in rapida successione, qualora la monoterapia non raggiunga i risultati attesi. I tempi di intervento con la terapia combinata sono condizionati dalla durata di malattia e dalla sua impronta evolutiva: i pazienti con AR rapidamente aggressiva o progressiva sono candidati ad una terapia adeguata già dall’ esordio dei sintomi (entro i primi 4 mesi). Nei pazienti
refrattari o non responsivi al trattamento combinato è indicato il ricorso ai farmaci biologici da soli o in combinazione.
Sulfasalazina
? Dose: via orale 500 mg/die incrementando di 500 mg a sett fino alla dose max di 2-3g/ die.
? Effetti collaterali: nausea, rash, neutropenia, oligospermia, alterazioni epatiche, fotosensibilità.
? Monitoraggio: SGOT, SGPT, emocromo. Controindicato in
pazienti con deficit della G6PDH.
Mtx
? Dose: via orale 7,5 mg/sett eventualmente incrementando di 2,5 mg ogni 6 sett fino alla dose max di 15-20mg/ sett. Per ridurre la tossicità è utile l’ impiego di acido folico nei tre gg successivi alla somministrazione.
? Effetti collaterali: alopecia, nausea, rash, diarrea, fibrosi epatica, alveolite, ulcere orali, noduli reumatoidi.
? Monitoraggio: SGOT, SGPT, emocromo, azotemia, elettroliti, rx torace, sierologia per epatite B e C.
Lnf
? Dose: via orale 100 mg/die per tre giorni consecutivi; mantenimento con 10-20 mg/die.
? Effetti collaterali: diarrea, rash, alopecia, ipertensione, nausea.
? Monitoraggio: SGOT, SGPT, emocromo, pressione arteriosa.
Idrossiclorochina
? Dose:Via orale, 400 mp; die per 3-4 mesi, quindi 200 ml al giorno.
? Effetti collaterali: rash, effetti gastrointestinali; tossicità retinica.
? Monitoraggio: visita ocu1istica al basale. Controllo oculistico nell'eventuale insorgenza di disturbi della visione.
Sali d'oro (aurotiomalato di sodio)
? Dose:Test iniziale con 19 mp; per passare a 50 ml;/settimana. Valutare l'intervallo tra le somministrazioni e la posologia del farmaco in base alla risposta clinica, fino alla dose massima di 19 mp.
? Effetti collaterali: rash, ulcere orali, proteinuria, pancitopenia, nefrotossicità.
? Monitoraggio: emocromo, esame delle urine.
Ciclosporina
? Dose: meno di 5 mg/Kg scalando poi fino alla dose minima efficace. Controindica in pazienti con ipertensione non controllata.
? Effetti collaterali: ipretensione arteriosa, disturbi renali, tremori, parestesie, cefalea, ipertricosi, iperplasia gengivale, nausea.
Farmaci Biologici
Tre sono i prodotti che si sono dimostrati capaci di migliorare segni e sintomi di malattia, nonché di inibire la progressione del danno strutturale, nei pazienti affetti da AR attiva e da spondiloartropatie. I preparati oggi in uso,due anticorpi monoclinali anti-TNF? ?ed una proteina di fusione costituita dal recettore p75 del TNF? , hanno trovato applicazione clinica in virtù della loro dimostrata efficacia e sicurezza di impiego.19
La citochina pleiotropica cachettina, nota precedentemente come Tumor Necrosis Factor alfa (TNF? ), e la molecola ad essa correlata Linfotossina alfa (LFT? ), nota in precedenza come Tumor Necrosis Factor beta (TNF?), sono ormoni polipeptidici membri della superfamiglia dei TNF composta da circa 30 molecole correlate, codificate nella regione MHC di Classe III. Il proTNF? ?sintetizzato ex novo viene posto sulla membrana plasmatica e clivato nella forma solubile di 17 KDa (TNFs) dall’enzima convertente il TNF? ?(TACE or ADAM-17).20 Il TNF, prodotto prevalentemente da monociti/macrofagi attivati e da cellule T, è coinvolto nello sviluppo del sistema immune, nella difesa dell’ospite e nella sorveglianza immunitaria.21 Il TNF? ?e l’LFT? ?condividono gli stessi due recettori monomerici sulla superficie cellulare, il 55 kDa (p55 TNFR) e il 75 kDa (p75 TNFR), che funzionano come elementi di traduzione del segnale.22 Questa risulta principalmente mediata dal p55TNFR, mentre l’azione principale del p75 consiste nella presentazione della molecola del TNF al p55, con funzione di “ligand passing” sulla membrana cellulare. Entrambi i TNFR esistono nelle forme solubili (sTNFR) prodotte dal clivaggio enzimatico una volta che si è verificata l’attivazione cellulare.23 Il TNFR p75 origina dalle cellule T e B attivate, dai neutrofili e dalle cellule endoteliali, mentre il TNFR p55 origina dalle cellule epiteliali. La loro vita media in circolo è di circa 4 ore. I TNFR mediano numerose funzioni biologiche e la loro
espressione e liberazione in circolo sono modulate da numerosi ormoni e citochine.24 Il TNFs, nella forma circolante trimerica stabile di 51 kDa, ha una emivita sierica di circa 6 min e mostra una bassa affinità di legame per i TNFRs.
A concentrazioni fisiologiche, la molecola bioattiva del TNFs si dissocia in modo irreversibile nella forma monomerica inattiva. L’aggiunta dei TNFRs ai trimeri del TNF, induce la formazione di complessi, preservando la forma attiva e permettendo la sostituzione del TNFs inattivato, attraverso la dissociazione nella forma trimerica libera.
La funzione dei TNFRs può essere quella di regolare la biodisponibilità del TNF nell’organismo.
I TNFRs possono agire in diversi modi: come antagonisti del TNF, quando sono presenti in quantità eccessiva; come proteina carrier del TNF e come riserva per il rilascio di TNF, prolungandone l’emivita. Il TNF è una citochina che riveste una funzione chiave nel processo infiammatorio e il suo ruolo critico è stato dimostrato in numerose patologie su base infiammatoria tra cui l’AR, l’AR dell’Infanzia, il morbo di Still, la malattia di Crohn (MC), l’Artrite Psoriasica e la Psoriasi, la Spondilite Anchilosante e altre Spondiloartriti.25, 26
Il TNF è importante anche nello sviluppo e nel mantenimento dei granulomi in corso di risposta dell’ospite in una varietà di infezioni, compresa la tubercolosi, l’istoplasmosi e la coccidiomicosi e ciò giustifica come malattie infettive come la tubercolosi o, meno comunemente, altre malattie infettive di natura fungina, rappresentino tra le reazioni avverse più temibili in corso di terapia con antagonisti del TNF accanto ad altre forme di tossicità meno comuni (linfomi, malattie demielinizzanti, lupus-like sindrome, scompenso cardiaco).27
Gli inibitori del TNF disponibili in commercio sono costituiti da due classi di molecole: i recettori solubili (Etanercept) e gli anticorpi monoclonali (Adalimumab e Ifx). Essi agiscono sequestrando, mediante la formazione di complessi, il TNF in forma attiva e bloccandone di conseguenza l’interazione con i TNFRs della superficie cellulare. Le
differenze potenziali tra questi agenti vanno oltre le caratteristiche strutturali e farmacocinetiche (PK) distintive e riguardano i meccanismi, non ancora completamente chiariti, della risposta farmacodinamica, che concorrono a delinearne il rapporto efficacia/tossicità. Una accurata distinzione farmacologica tra gli inibitori del TNF è molto importante dal momento che queste molecole presentano un impatto clinico estremamente divergente in diverse condizioni patologiche; ne deriva che è giustificato un eventuale switch terapeutico da una molecola all’altra nel caso di un fallimento terapeutico iniziale.28
STRUTTURA MOLECOLARE
Etanercept
L’Etanercept è una proteina di fusione ricombinante costituita dalle sequenze aminoacidiche umane di 2 domini extracellulari del TNFR p75, legati alla porzione Fc della immunoglobulina umana di tipo 1 (IgG1) (TNFR:Fc). Ha un peso molecolare di circa 150 kDa.29
Adalimumab
L’Adalimumab è un anticorpo monoclonale ricombinante IgG1 specifico per il TNF? ?umano. L’anticorpo monoclonale comprende regioni variabili di catene pesanti e leggere di derivazione umana e regioni IgG1.K umane costanti. È costituito da 1330 aminoacidi ed ha un peso molecolare di circa 148 kDa.30
Infliximab
L’Ifx è un anticorpo monoclonale chimerico umano-murino IgG1K con un peso molecolare approssimativo di 149 kDa. Viene prodotto mediante una linea cellulare ricombinante, in base al prototipo dell’anticorpo monoclonale murino geneticamente modificato A2, ed è composto da regioni variabili umane e murine.31
MECCANISMO D’AZIONE
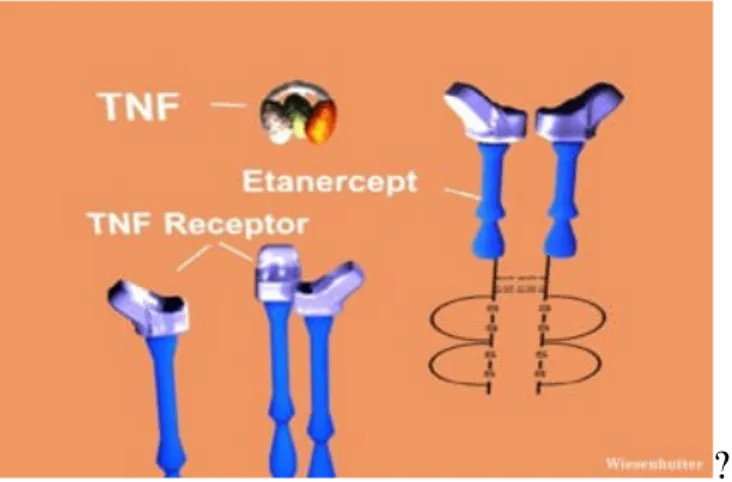
Etanercept
L’Etanercept inibisce l’attività del TNF legandosi con elevata affinità sia alla forma solubile che a quella transmembrana del TNF (tmTNF); esso inattiva sia il TNF? ?che l’LFT? ??
Figura 8 meccanismo d’azione Etanercep
?
Adalimumab
L’Adalimumab si lega specificamente al TNF? ?e blocca la sua interazione con i recettori di superficie p55 e p75. Il rapporto di binding è di 1:1. È stato dimostrato che il complesso che si forma più comunemente è quello costituito da 3 molecole di Adalimumab e 3 di TNF. La costante di affinità era 1x10-10M. L’Adalimumab non si lega né inattiva l’LFT? . L’Adalimumab lisa in vitro le cellule che esprimono in superficie il TNF? ?in presenza del complemento.32
Figura 9: meccanismo d’ azione Adaliumubab
Ifx
L’Ifx neutralizza l’attività biologica del TNF legandosi con elevata affinità alle forme sTNF? ?e tmTNF? ?e inibisce il legame del TNF con i suoi recettori.
L’Ifx si lega sia alla forma monomerica che a quella trimerica del sTNF, con una costante di associazione di 10x10 M-1 e forma complessi stabili sia con il sTNF che con il tmTNF. Ogni molecola di Ifx è in grado di legarsi a 1 o 2 molecole del tmTNF trimerico/ monomerico e di collegare a ponte due molecole di tmTNF. Si ritiene che fino a tre molecole di Ifx possano legare un trimero tmTNF, in modo 4 volte maggiore rispetto all’Etanercept, lasciando liberi pochissimi siti recettoriali.
L’avidità di legame dell’Ifx per il tmTNF, più elevata rispetto a quella dell’Etanercept, è stata dimostrata sia tramite una inibizione dell’attivazione tmTNF-mediata delle cellule umane endoteliali, sia tramite l’espressione della selectina E tmTNF-mediata che è risultata significativamente più efficace.33
L’Ifx non neutralizza l’LFT? . Le cellule che esprimono
TNF? ?transmembrana legato dall’Ifx possono essere lisate in vitro mediante precipitazione del C1q e croSpS-linking e multimerizzazione dei recettori Fc??ed induzione di citotossicità cellulo- ed anticorpo-dipendente; nei monociti circolanti e sinoviali e nei linfociti della lamina propria, il legame con l’Ifx può indurre l’apoptosi.
FARMACOCINETICA
Etanercept
L’Etanercept viene assorbito lentamente dalla sede di iniezione sotto cute, raggiungendo la massima concentrazione circa 48 ore dopo una singola dose. La biodisponibilità assoluta è del 76%.
Figura 11: Figura 12
Il volume di distribuzione allo steady-state (Vss) è 10,4L. L’emivita terminale (T1/2) è di circa 70 ore(2.9 giorni). La clearance osservata è di circa 0.11 L/hr e di circa 0.066 L/hr nei pazienti con AR.
Il complesso Etanercept-TNF viene metabolizzato tramite le vie di riciclaggio degli amminoacidi o eliminato nella bile e nelle urine.34
Non esiste differenza apparente nella farmacocinetica tra uomini e donne. L’influenza dell’età avanzata è stata esaminata nelle analisi farmacocinetiche di popolazione. Le stime di clearance e di volume nei pazienti di età compresa tra 65 e 87 anni erano simili a quelle dei pazienti di età inferiore ai 65 anni. Nei pazienti con insufficienza renale o epatica acuta non sono state osservate concentrazioni aumentate di Etanercept.
Adalimumab
La biodisponibilità assoluta media dell’Adalimumab, stimata dopo una singola dose per via sottocutanea di 40 mg è del 64%. L’emivita terminale media è di 2 settimane, variando da 10 a 20 giorni nei diversi studi.35 Le concentrazioni di Adalimumab nel liquido sinoviale di pazienti con AR variano dal 31 al 96% rispetto a quelle presenti nel siero. Sono state osservate concentrazioni medie allo steady-state di circa 5 µg/mL. I livelli sierici allo steady-state aumentano in modo all’incirca proporzionale alla dose dopo 20, 40 e 80 mg a settimane alterne e ogni settimana per via sottocutanea.
Figura 13 Figura 14 Figura 15
Ifx
Infusioni endovenose singole di dosi da 1 a 20 mg/kg hanno mostrato un rapporto prevedibile e lineare tra la dose somministrata e la
concentrazione sierica e la AUC. A dosi singole di 3, 5 o 10 mg/kg, i valori mediani di Cmax sono rispettivamente di 77, 118 e 277 µg/mL. Il T1/2 mediano a queste dosi variava da 8 a 9.5 giorni.
Figura 16 Figura 17
Nella maggior parte dei pazienti, è stato possibile rilevare l’Ifx nel siero per almeno 8 settimane dopo la dose singola raccomandata di 5 mg/kg nel MC e la dose di mantenimento nell’AR di 3 mg/kg ogni 8 settimane. Risultati mediani di farmacocinetica per le dosi raccomandate di 3 mg/kg nell’AR e 5 mg/kg nel MC indicano che l’emivita terminale dell’Ifx varia da 8 a 9.5 giorni, considerevolmente più breve rispetto alla IgG1 umana (circa 23 giorni).
Nei sottogruppi di pazienti definiti per età o peso non sono state osservate differenze importanti. Non è noto se esistono differenze nella clearance o nel volume di distribuzione nei pazienti con marcata alterazione della funzione epatica o renale. La risposta alla terapia con l’Ifx è legata ai livelli sierici del farmaco e mostra una ampia variazione inter-individuale.
Fattori metabolici spiegano probabilmente la sua rapida eliminazione in alcuni pazienti.36
INTERAZIONI FARMACOLOGICHE
Etanercept
Il Mtx non esercita effetti rilevanti sulla farmacocinetica
dell’Etanercept.37 Non sono state osservate interazioni farmacologiche clinicamente rilevanti in pazienti sani sottoposti a trattamento simultaneo con Etanercept e Diossina o Etanercept e Warfarin.
Adalimumab
Concentrazioni medie di Adalimumab allo steadystate rispettivamente di circa 5 µg/mL e da 8 a 9 µg/mL sono state osservate senza e con MTX. Quest’ultimo ha ridotto la clearance apparente dell’Adalimumab, dopo dosaggio singolo e multiplo, rispettivamente del 29% e del 44%.
Ifx
Le concentrazioni sieriche in terapia combinata con MTX (7.5 mg una volta a settimana) sono risultate leggermente più elevate rispetto alla somministrazione di solo Ifx. I pazienti ai quali veniva somministrato 1 mg/kg di Ifx senza MTX dimostravano una riduzione nella concentrazione sierica di Ifx più rapida, presentando una riduzione dell’Ifx sierico fino a 0.1 ? g/ml 4 settimane dopo la seconda infusione e a 2 settimane dopo le infusioni seguenti. Lo sviluppo di anticorpi umani antichimerici (HACA) verso l’Ifx rappresenta una possibile spiegazione dell’aumento della clearance e della conseguente riduzione nella concentrazione sierica. Il grado di risposta agli HACA era inversamente proporzionale alla dose di Ifx. Il 57% dei soggetti ai quali era stato somministrato Ifx 1 mg/kg senza MTX è divenuto HACA positivo in confronto, rispettivamente, al solo 25% e 10%, nei gruppi dei 3 e 10 mg/kg. La terapia concomitante con MTX a basse dosi ha diminuito lo sviluppo degli HACA, anche se veniva mantenuto il trend di una risposta anticorpale inversamnete proporzionale alla dose.
Conclusioni:
Le differenze di farmacodinamica (PD) e delle risposte cliniche osservate quando gli inibitori del TNF vengono utilizzati, possono riguardare le diversità di struttura molecolare, il meccanismo d’azione e le proprietà
farmacocinetiche (PK) (Cmax; emivita), via e schema di
somministrazione (sottocute vs infusione), tipo e durata del legame col TNF (legame alla forma trimerica vs entrambe le forme, monomerica e trimerica del TNF), le differenze del dosaggio, dello schema di somministrazione, delle concentrazioni del farmaco, e le interazioni farmacologiche. L’efficacia e la tossicità di un particolare antagonista del TNF, per ogni specifica forma patologica, risente delle peculiarità del meccanismo d’azione e delle modificazioni selettive ottenute sulla risposta immunitaria (inibizione della LFT? , induzione di apoptosi a carico di diversi tipi cellulari, immunoprecipitazione del TNF, legame del C1q e croSpS-linking Fc??con induzione di CDC ed ADCC). Grande importanza riveste anche la dinamica delle interazioni delle due classi di antagonisti biologici del TNF.
Le importanti diversità nell’efficacia e tossicità dimostrate dagli anticorpi monoclonali (ifx; adalimubab) rispetto al TNFR:Fc (etanercept) possono essere comprese esaminando il rapporto fra i rispettivi effetti clinici e l’esposizione al farmaco.
L’esposizione dipende dalle caratteristiche PK ed in particolare dal profilo della concentrazione-tempo, delle diverse molecole neutralizzanti il TNF. Alcuni principali parametri di esposizione al farmaco comprendono la concentrazione minima, media e massima allo steady-state ed il volume di distribuzione.38
Effetti su sistema immunitario e neuroendocrino
Uno degli aspetti più importanti nella valutazione dell’efficacia di un farmaco nel trattamento dell’AR è rappresentato dalla capacità di inibire il danno articolare interferendo sul metabolismo osseo.39 I pazienti affetti da AR trattati con etanercept hanno mostrato livelli significativamente ridotti delle metalloproteinasi di matrice (MMP)-1 e MMP-3 (i cui livelli correlano con i marker di attività di malattia come VES e PCR), senza alcun effetto consistente sul loro inibitore tissutale naturale TIMP-1,40 con conseguente rallentamento o inibizione dello sviluppo di danno anatomico osteo-articolare.
La terapia anti-TNF? , sia con monoclinali sia con recettore solubile, induce una ridotta attivazione osteoclastica che rallenta il metabolismo osseo catabolico, sia iuxta-articolare che sistemico, nonché la distruzione cartilaginea.41
Gli anticorpi (Ab) monoclonali ifx ed adalimumab sono in grado di determinare la lisi cellulare attraverso meccanismi Ab-mediati e complemento-mediati.42
Un effetto positivo della lisi cellulare potrebbe essere la riduzione di cellule che producono TNF; tuttavia, contemporaneamente si verifica una riduzione anche delle cellule immunocompetenti. Il trattamento con adalimumab induce, inoltre, un minimo incremento in cellule CD4+ e CD8+, mentre quello con l’ifx determina un incremento nel compartimento cellulare B, specialmente delle plasmacellule. Tale fenomeno è stato però dimostrato nel microambiente articolare di pazienti con spondiloartriti, ma non in pazienti con AR.
Recentemente si è osservato, anche, che l’ifx è in grado di incrementare il numero di linfociti CD20+ e CD27+ nel sangue periferico di pazienti AR, nei quali in effetti tali cellule risultano patologicamente ridotte.43 Il trattamento con adalimumab induce modesti effetti sulle cellule B e T senza peraltro modificare la riposta immune. Lo studio della funzione immunitaria di pazienti trattati per 52 settimane con adalimumab ha
permesso di evidenziare solo un modesto aumento dei linfociti periferici (già dopo 24 settimane di terapia), con aumento dei linfociti T CD4+ e CD8+ memory e dei B CD19+.44 Non è stata riscontrata, invece, alcuna differenza nella funzione fagocitica dei neutrofili e dei macrofagi tra i pazienti trattati con il farmaco e quelli trattati con il placebo.
Non sono state riscontrate alterazioni della risposta proliferativa linfocitaria B e T dopo stimolo con mitogeni e vaccino pneumococcico, né alterazioni nelle risposte di ipersensibilità ritardata e livelli di Ig totali circolanti.
È noto d’altra parte che il TNF? ?possiede un’attività inibitoria sulle funzioni T cellulari e che tali funzioni potrebbero essere normalizzate dal suo blocco.45 La diversità dei farmaci appartenenti a questo nuovo gruppo è testimoniata anche dai differenti effetti da essi dimostrati sulla risposta immune.
È noto che sia ifx che etanercept sono in grado di effettuare una “down-regulation” in vitro della produzione di citochine proinfiammatorie, ifx forma dei complessi molto stabili con il TNF (solubile e di membrana), etanercept presenta invece un’elevata costante di associazione e dissociazione, con conseguente neutralizzazione solo transitoria del TNF.46
L’ utilizzando TNF marcato con 125 I, è stato dimostrato che etanercept, a causa della sua struttura, non è in grado di legare le subunità monomeriche di TNF. Quindi, anche in ciò etanercept si distingue da ifx che invece, legando sia la struttura trimerica che quella monomerica, potrebbe rallentare o addirittura impedire la formazione dei complessi trimolecolari biologicamente attivi.47
Ad oggi non esiste evidenza che etanercept possa indurre apoptosi o lisi cellulare; la sua struttura molecolare, del resto, è tale da consentire soltanto la formazione di dimeri o monomeri con il TNF (che impediscono il legame del C1q),48 mentre gli anticorpimonoclonali si assemblano in complessi oligomerici, più propensi all’attivazione complementaremediata dal frammento Fc.
I trial clinici condotti nei soggetti affetti da malattie reumatiche infiammatorie croniche hanno dimostrato come i farmaci antagonisti del TNF? ?inducano, nella maggior parte dei pazienti, un sostanziale miglioramento nel controllo dei segni e sintomi infiammatori e della qualità della vita. Alla base di questi effetti potrebbero esserci, almeno in parte, le ripercussioni dell’uso di questi composti sul network delle citochine.
Si sono osservate interessanti modulazioni della terapia con ifx e adalimumab sulla funzione dell’asse ipotalamo-ipofisi-surrene (HPA).49 In particolare, la somministrazione di anti-TNF? ?induce una ridotta attivazione dell’asse HPA con normalizzazione della produzione di cortisolo endogeno e di androgeni surrenalici. In altri termini, il paziente sotto trattamento con anti-TNF? ?dimostra di richiedere una riduzione della terapia giornaliera con corticosteroidi.
Recentemente, la migliore risposta clinica alla terapia biologica osservata nei maschi rispetto alle femmine affette da AR (comunicazione Montecucco studio ANTARES) ha introdotto nuove prospettive sugli effetti indiretti degli anti-TNF? ?sul metabolismo degli ormoni gonadici. Un ultimo aspetto da considerare è la immunogenicità delle tre molecole. Trattandosi infatti di strutture di dimensioni e peso molecolare notevoli, è possibile che il sistema immunitario del paziente reagisca alle somministrazioni sviluppando Ab anti-farmaco.50
Sicurezza dei farmaci biologici
L’analisi del profilo degli effetti collaterali registrati in pazienti in terapia con i 3 antagonisti del TNF-? ?attualmente disponibili mette in evidenza, analogamente a quanto è rilevabile per altri aspetti, molti punti in comune insieme con alcune non trascurabili differenze.51,52
La tabella 2 elenca i principali effetti collaterali finora segnalati. Tabella 2
È stata suggerita una possibile associazione tra l’impiego degli agenti anti-TNF-? ?ed un maggior rischio di infezioni anche severe. Tuttavia, poiché il rischio di infezioni severe è di per sé aumentato in corso di AR, la valutazione di un’eventuale relazione causale è piuttosto difficile.53 Infatti, studi randomizzati controllati (condotti, pertanto, in pazienti accuratamente seguiti) ed alcuni studi osservazionali non hanno messo in evidenza un aumento del rischio di infezioni severe con l’impiego degli anti-TNF-? .54, 55 Un solo studio retrospettivo ha mostrato un aumento di circa 20 volte in tale rischio.56 Al riguardo anche la gravità della sottostante malattia infiammatoria articolare può avere un ruolo.57
Nei pazienti che assumono anti-TNF-? , la sensibilità alla tubercolosi primaria può risultare aumentata ed una tubercolosi pregressa può essere riattivata.
- Più comuni effetti collaterali insorti in pazienti in terapia con
antagonisti del TNF-? ?
• Malattie infettive, incluso TBC e sepsi • Sindromi demielinizzanti/neuropatie
• Comparsa di autoanticorpi e malattie autoimmuni • Linfomi e altre anomalie ematologiche (anemia, pancitopenia)
• Aggravamento dello scompenso cardiaco congestizio • Reazioni da infusione e reazioni nel sito di iniezione.