UNIVERSITÀ DI PISA
SCUOLA DI DOTTORATO IN SCIENZE AGRARIE E VETERINARIE
Programma in Medicina Veterinaria
Settore Clinica Medica e Farmacologia Veterinaria (07/H4)
Clinica Medica Veterinaria (VET/08)
I SARTANI NEL TRATTAMENTO
DELLE PATOLOGIE
CARDIOVASCOLARI DEL CANE
Candidato: Dott.ssa Lucia Carlucci Tutor: Prof. Marco Bizzeti
INDICE
ABSTRACT ... 4
INTRODUZIONE ... 7
1
PARTE INTRODUTTIVA ... 10
1.1
SARTANI... 11
1.1.1
Introduzione ... 11
1.1.2
Sistema Renina Angiostensina Aldosterone (RAAS) ... 11
1.1.3
Meccanismo d’azione dei Sartani ... 14
1.2
DEGENERAZIONE
MIXOMATOSA
DELLE
VALVOLE
ATRIOVENTRICOLARI (MMVD) ... 17
1.2.1
Cenni di anatomia del complesso valvolare mitralico... 17
1.2.2
Funzione della valvola mitralica... 18
1.2.3
Diffusione, eziologia e genesi dell’endocardiosi mitralica... 20
1.2.4
Fisiopatologia... 24
1.2.5
Sintomatologia e diagnosi... 29
1.2.6
Classificazione dei soggetti ... 34
1.2.7
Terapia... 35
1.3
INSUFFICIENZA RENALE CRONICA ... 37
1.3.1
Definizione e caratteristiche insufficienza renale cronica ... 37
1.3.2
Eziologia ... 37
1.3.3
Fisiopatologia... 38
1.3.4
Diagnosi di insufficienza renale cronica... 39
1.3.5
Creatinina ... 40
1.3.6
Proteinuria ... 41
1.3.7
Pressione sistemica ... 43
1.3.8
Gli ACE inibitori in nefrologia ... 43
1.3.9
Ipertensione sistemica e del capillare glomerulare... 44
1.3.10
La sindrome cardio renale in medicina umana ... 45
1.3.11
La sindrome cardio renale in medicina veterinaria ... 47
1.4
TROPONINA... 50
1.4.1
Introduzione ... 50
1.4.2
La cTnI come Marker di danno cardiaca ... 52
1.4.3
La troponina in corso di insufficienza mitralica ... 55
1.4.4
La TNI come Marker di patologie di origine non
cardiovascolare ... 57
SCOPO DEL PROGETTO DI RICERCA ... 58
2
RICERCHE PRELIMINARI ALLO STUDIO CLINICO... 61
2.1
STUDIO PK E PD DELL’IRBESARTAN NEL CANE ... 62
2.1.1
Introduzione ... 62
2.1.2
Materiali e metodi ... 62
2.1.3
Risultati ... 65
2.1.4
Discussione ... 68
2.2
DOSAGGIO DELLA TROPONINA IN CANI SANI E CON
ENDOCARDIOSI MITRALICA ... 70
2.2.1
Introduzione ... 70
2.2.3
Risultati ... 72
2.2.4
Discussione ... 74
2.3
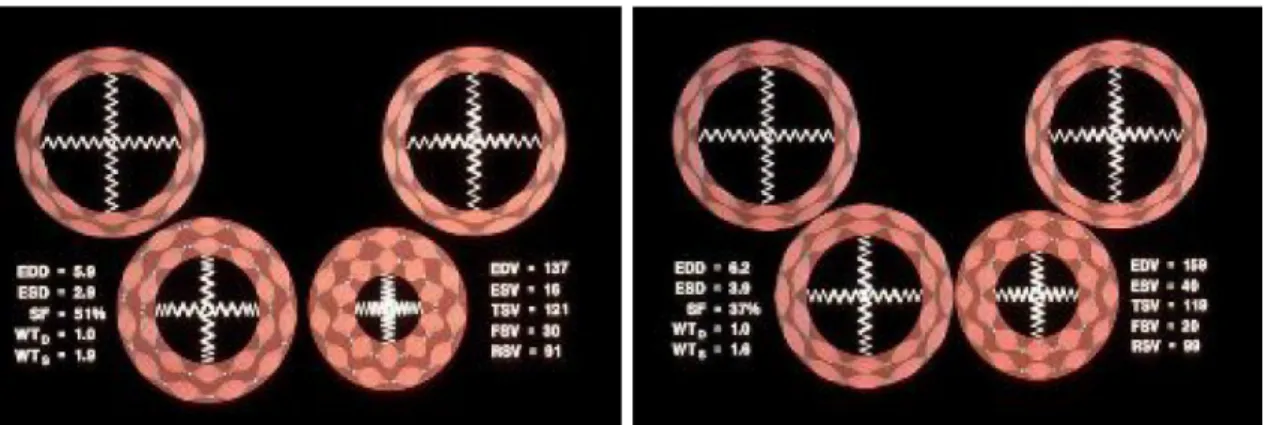
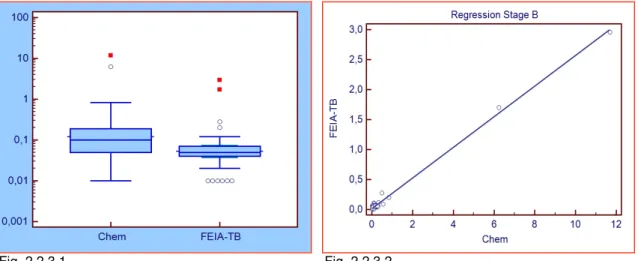
VARIABILITÀ DELLE MISURE ECOCARDIOGRAFICHE ... 76
2.3.1
Introduzione ... 76
2.3.2
Materiali e metodi ... 77
2.3.3
Risultati ... 78
2.3.4
Discussione ... 82
3
STUDIO CLINICO ... 83
3.1
INTRODUZIONE... 84
3.2
MATERIALI E METODI... 85
3.2.1
Criteri di inclusione e di esclusione... 87
3.2.2
Analisi Statistica... 87
3.3
RISULTATI... 88
3.3.1
Parametri Clinici... 91
3.3.2
ECG ... 92
3.3.3
Ecocardiografia ... 93
3.3.4
Parametri Analitici ... 95
3.3.5
La pressione sistolica ... 100
3.4
DISCUSSIONE ... 103
3.4.1
Segnalamento... 103
3.4.2
Parametri Clinici... 103
3.4.3
ECG ... 104
3.4.4
Ecocardiografia ... 105
3.4.5
Parametri Analitici ... 106
3.4.6
Troponina... 107
3.4.7
Esame delle urine con PU/CU ... 108
3.4.8
Pressione ... 109
4
CONCLUSIONI ... 110
I SARTANI NEL TRATTAMENTO DELLE PATOLOGIE CARDIOVASCOLARI DEL CANE
Parole Chiave: Sartani, Endocardiosi Mitralica (MMVD), Insufficienza renale (CKD), Pressione sistolica (SBP), ACE-I, Troponina (cTnI), Ecocardiografia, cani.
Introduzione: I sartani (ARB) sono antagonisti del recettore dell’angiotensina II (Ang II), modulano il sistema renina angiotensina aldosterone (RAAS) prevenendo gli effetti di vasocostrizione e di ritenzione di sodio. Gli ARB rappresentano, in umana, una valida alternativa agli ACE Inibitori (ACE-I) per il trattamento dell’ipertensione, di patologie a carico dell’apparato cardiovascolare e renale.
Obiettivo: Gli ARB non sono, a oggi, impiegati come farmaci nel cane. L’obiettivo di questo lavoro è valutare l’utilizzo di un molecola di questo gruppo, l’Irbesartan (Irb) nei pazienti con endocardiosi mitralica (MMVD) e insufficienza renale (CKD). Inoltre, è stata confrontata la progressione della MMVD e CKD nei soggetti trattati con ARB rispetto a quelli trattati con ACE-I.
Materiali e Metodi: Il nostro progetto di ricerca si è articolato in due fasi: la prima composta dagli studi preliminari (Studio PK e PD dell’irbesartan nel cane, dosaggio della Troponina in cani sani e con Endocardiosi mitralica, validazione delle Misure ecocardiografiche) su cui si è basata la seconda fase costituita dallo studio clinico Irb nel cane con MMVD e CKD. Allo studio clinico hanno preso parte 72 cani che sono risultati affetti da MMVD e/o CKD. In base ai rilievi clinici e strumentali, il grado d’insufficienza cardiaca dei pazienti è stato classificato secondo ACVIM Consensus Statement e il grado di insufficienza renale secondo la classificazione IRIS. I cani sono stati divisi in tre gruppi (cardiopatici C, nefropatici R, cardiopatici e nefropatici CR) e ciascun gruppo a sua volta è stato diviso in 2 sottogruppi: il primo ha ricevuto Irb 2mg/kg BID, il secondo benazepril 0.25mg/kg SID. Le visite di controllo si sono svolte ai tempi: 7, 90, 180, 270 e 365 giorni.
Risultati: Dallo studio si evince una differenza significativa (p<0.05) tra i valori della SBP e della proteinuria tra i pazienti trattati con Irb e quelli trattati con Benazepril. Gli altri parametri clinici e strumentali non hanno mostrato differenze significative a seguito dei due trattamenti.
Conclusioni: I risultati del nostro studio mostrano che l’Irb è risultato più efficace rispetto al benazepril nel determinare una riduzione della SBP e della proteinuria nel cane.
ABSTRACT: SARTAN IN THE THERAPY OF HEART DISEASE OF DOG
Key words: Sartan (ARB), Myxomatous mitral valve disease (MMVD), Chronic Kidney Disease (CKD), systolic blood pressure (SBP), ACE-I, Troponin (cTnI), Echocardiography, dogs.
Introduction: Sartans (angiotensin receptor blockers [ARBs]) are angiotensin II (Ang II) type 1 receptor antagonists. They prevent the effects of angiotensin II, such as vasoconstriction and aldosterone-mediated Na+ retention, through a selective bond to
angiotensin II type 1 receptors (AT1). In human medicine, As treatment of hypertension,
cardiovascular and renal disease ARBs are considered a valid alternative to ACE-inhibitors (ACE-I).
Objective: To date, ARBs are not administered in dogs. The aim of this study is to consider the use of a molecule belonging to this group, Irbesartan (IRB), in patients with Myxomatous Mitral Valve Disease (MMVD) and Chronic Kidney Disease (CKD). Furthermore the progression of CKD and MMVD in dogs treated with ARBs was compared with that of patients treated with ACE-I.
Materials & methods: Our project was divided into two phases: the first one included the preliminary studies (PK and PD of irbesartan in dogs, evaluation of troponin concentration both in MMVD and healthy dogs and the validation of echocardiographic
measurements). The second phase was based on the above mentioned results and It consisted of the clinical examination of dogs affected by Irb MMVD and CKD. For this study 72 dogs affected by MMVD and/or CKD were submitted to evaluation. Based on the clinical and instrumental findings, a grade was established for heart failure and renal failure. The former was classified according to ACVIM Consensus Statement, the latter according to IRIS classification. Patients were divided into three classes (C cardiac, R renal, CR cardiac and renal) divided, in turn, into two subclasses: the first included dogs to whom was administered Irb (2mg/kg BID), while the second benazepril (0.25 mg / kg SID). Checks were performed at days 7, 90, 180, 270 and 365.
Results: The study shows an important gap (p <0.05) between SBP values and proteinuria in patients treated with IRB and those of patients treated with benazepril. While other clinical and instrumental parameters showed no significant differences. The study shows that an important difference (p<0.05) between patients treated with IRB and those treated with benazepril exists. The gap is related to SBP values and proteinuria, while other clinical and instrumental parameters are not affected.
Conclusions: This work proved that the IRB was more effective in determining a reduction in SBP and proteinuria in dogs than benazepril.
INTRODUZIONE
I cani con malattie cardiache su base degenerativa sono in aumento perché è migliorata la qualità di vita e quindi l’aspettativa di vita degli animali domestici. Questo ha determinato un incremento delle patologie geriatriche veterinarie in particolare: cardiovascolari, renali, endocrine, ortopediche, oncologiche. La medicina veterinaria, comunque, ha raggiunto progressi impensabili, fino a pochi anni fa, per gestire queste problematiche e affrontarle nel modo più adeguato.
L'esigenza di un controllo cardiologico approfondito da parte del veterinario è determinata dall'insorgenza di piccoli o gravi disturbi che pregiudicano la qualità di vita del cane e talvolta del proprietario. Al termine della visita cardiologica il medico veterinario, attualmente, è in grado di stadiare in modo accurato il grado della patologia e di decidere se il paziente necessiti o meno di terapie specifiche. Nelle prime fasi della malattia cardiaca i meccanismi di compenso del paziente riescono a garantire una corretta emodinamica e quindi non è necessaria la somministrazione di farmaci. La diagnosi precoce di alcune patologie cardiologiche permette, grazie al monitoraggio attento del paziente, di iniziare la terapia al momento più appropriato consentendo così al cane di avere una buona qualità di vita il più a lungo possibile. Alcuni soggetti hanno problematiche talmente lievi da non necessitare di alcun intervento terapeutico per lunghi periodi, mentre altri hanno una tipologia di danno per il quale è necessario intervenire repentinamente con una terapia cardiologica appropriata in modo da preservare per quanto possibile la funzionalità corretta dell’organo.
La patologia mitralica rappresenta la malattia cardiaca più diffusa nel cane e ha un andamento diverso da soggetto a soggetto: in alcuni cani peggiora lentamente, in altri in modo più repentino. I controlli seriali servono a stabilire quando iniziare una terapia farmacologica appropriata per il singolo cane e ad applicare piccole variazioni farmacologiche appena si presentano i primi sintomi di peggioramento.
I progressi della medicina hanno consentito di migliorare considerevolmente l’intervento terapeutico su pazienti con problemi cardiocircolatori, utilizzando nuove acquisizioni fisiopatologiche. Questi studi sulla fisiopatologia cardiaca hanno aperto numerose e complesse ricerche terapeutiche. In particolare, tra i meccanismi di compenso neuroendocrini, il sistema renina angiotensina aldosterone (RAAS) è stato ampiamente studiato e questo ha permesso di sviluppare molecole che ne bloccano la cascata d’azione a vari livelli: ACE Inibitori e Sartani.
Queste molecole associate con diuretici, beta-bloccanti, inibitori delle endopeptidasi neutre, inibitori selettivi e non selettivi dei recettori dell’endotelina, inibitori misti dell’endopeptidasi neutra, hanno permesso associazioni e politerapie innovative nella farmacoterapia umana, volte a garantire un controllo globale dei meccanismi neuro-ormonali in pazienti cardiopatici.
In medicina veterinaria alcune di queste classi di farmaci non sono presenti e proprio la volontà di indagare l’azione dei sartani nel cane è alla base di questo lavoro.
Il nostro studio andrà a valutare, in particolare, l’utilizzo dell’Irbesartan nei cani con endocardiosi mitralica.
Il nostro progetto ha lo scopo di:
- acquisire informazioni di base in merito all’utilizzo dei sartani, in particolare l’Irbesartan in cani sani;
- creare un protocollo clinico per valutare le capacità terapeutiche dell’Irbesartan in soggetti cardiopatici.
1.1 SARTANI
1.1.1
Introduzione
Gli antagonisti del recettore dell'angiotensina II, conosciuti anche come bloccanti del recettore per l'angiotensina (ARB, dall'inglese angiotensin receptor blockers) antagonisti del recettore AT1 o sartani, sono un gruppo di farmaci che modulano il
sistema renina angiotensina aldosterone (RAAS). Vengono impiegati in medicina umana principalmente in caso di ipertensione44, di nefropatia diabetica122 e di
insufficienza cardiaca177.
In Italia sono in commercio i seguenti sartani:
- candesartan (Blopress®, Ratacand®); - eprosartan (Tevetenz®);
- irbesartan (Aprovel®, Karvea®);
- losartan (Lortaan®, Losaprex®, Neo Lotan®); - telmisartan (Micardis®, Pritor®);
valsartan (Tareg®, Valpression®).
1.1.2
Sistema Renina Angiostensina Aldosterone (RAAS)
I sartani agiscono sul RAAS; questo è uno dei sistemi regolatori ormonali dell’apparato cardiovascolare e renale. La cascata ormonale del RAAS inizia con la biosintesi della renina. La renina presente in circolo ha origine a livello renale, dove è sintetizzata e depositata nell’apparato iuxtaglomerulare del nefrone. Le cellule granulari specializzate, chiamate iuxtaglomerulari, sono i siti di sintesi, deposito e liberazione della renina. La macula densa è un segmento del nefrone strettamente legato alla componente vascolare dell’apparato iuxtaglomerulare. Le componenti vascolare e tubulare dell’apparato iuxtaglomerulare, comprese le cellule iuxtaglomerulari, sono innervate da neuroni noradrenergici. La velocità con cui la renina viene secreta dal rene è un fattore determinante sull’attività del RAAS. La renina in forma attiva viene secreta per esocitosi, rispondendo immediatamente alla stimolazione dell’apparato iuxtaglomerulare47.
La secrezione della renina in forma attiva è controllata da diversi fattori che comprendono:
- i recettori vascolari renali; l’ipotensione sistemica rilevata dalle cellule iuxtaglomerulari dell’arteriola afferente porta a un aumento della liberazione di renina;
- la macula densa; una diminuzione delle quantità di sodio e cloro che giungono al tubulo distale portano alla stimolazione della secrezione di renina;
- il sistema nervoso simpatico; l’ipotensione sistemica stimola i barocettori cardiaci e arteriosi determinando l’aumento del tono del sistema nervoso autonomo. In tal modo si ha un incremento delle catecolamine circolanti che stimolano la secrezione di renina attraverso un’azione mediata dai recettori β1-adrenergici sulle cellule iuxtaglomerulari47;
- l’angiotensina; Ang II inibisce la secrezione di renina. Tale inibizione si ritiene sia il risultato di un’azione diretta di feedback negativo del peptide sulle cellule iuxtaglomerulari4;
- le via intracellulari di trasmissione del segnale; la secrezione di renina dalle cellule iuxtaglomerulari sembra essere controllata dall’interazione tra tre secondi messaggeri intracellulari, cAMP, cGMP e le concentrazioni di Ca libero citoplasmatico. Gli stimoli che determinano un aumento del cAMP inducono la secrezione di renina. Il cGMP e il Ca alterano la secrezione di renina in maniera indiretta, modificando i livelli di cAMP47;
- le alterazioni indotte da alcuni farmaci; la liberazione di renina può essere modificata da numerosi agenti farmacologici. Essa è stimolata dai vasodilatatori, agonisti recettoriali β-adrenergici, antagosnisti α-adrenergici, inibitori delle fosfodiesterasi e dalla maggior parte di diuretici e anestetici. Il rilascio di renina dal rene, quindi, è stimolato dalla riduzione della pressione arteriosa renale, dalla stimolazione nervosa simpatica e da una ridotta concentrazione ematica di sodio oppure da un aumento della sua concentrazione nel tubulo distale47.
La renina è un’aspartilproteasi che catalizza il rilascio idrolitico del decapeptide inattivo angiotensina I dall’angiotensinogeno10. L’angiotensinogeno è una glicoproteina
prodotta dal fegato la cui concentrazione può essere aumentata da corticosteroidi, estrogeni, ormoni tiroidei e Ang II. L’angiotensina I, poi, viene convertita principalmente dall’enzima che converte l’angiotensina (ACE), in angiotensina II, un octapeptide ad attività vasocostrittrice sulle arterie137.
L’ACE è presente soprattutto nell’endotelio vascolare polmonare, nei reni, nel cuore e nel sistema nervoso47.
L’angiotensina II ha un’attività sulla muscolatura liscia vascolare, la corteccia surrenalica, il rene e il cervello. Attraverso queste azioni il RAAS ha un ruolo importante nella regolazione dell’equilibrio idro-elettrolitico e della pressione arteriosa
L’angiotensina II può anche aumentare la pressione arteriosa agendo:
- sul sistema nervoso: stimolando l’assunzione di liquidi ed aumentando la secrezione di vasopressina (ADH) e di ormone adrenocorticotropo (ACTH);
- sul sistema nervoso autonomo: l’Ang II interagisce con il sistema nervoso autonomo periferico stimolando i gangli autonomi, aumenta la liberazione di adrenalina e noradrenalina dalla midollare del surrene e facilita la trasmissione simpatica con un’azione a livello delle terminazioni nervose adrenergiche. Tutto questo determina sia un’aumentata liberazione, sia una ridotta ricaptazione di noradrenalina;
- sulla zona glomerulare della corteccia surrenalica: stimolando la biosintesi e la secrezione di aldosterone;
- sul rene: determinando vasocostrizione renale e aumentando il riassorbimento di sodio a livello del tubulo prossimale e inibendo la secrezione di renina;
- sulle cellule muscolari cardiache: Ang II ha un’azione mitogenica, stimolando il rilascio di citochine e fattori di crescita. La produzione del TGF-β, dell’inibitore dell’attivatore del plasminogeno di tipo 1, del fattore di crescita di derivazione piastrinica e del fattore nucleare-Kβ, portano alla produzione di fibre collagene, alla stimolazione di fibroblasti e all’induzione di processi infiammatori localizzati. L’inibizione delle proteasi specifiche favorisce la deposizione di fibre collagene e può contribuire allo sviluppo di processi di rimodellamento dell’apparato cardiovascolare49
L’angiotensina II esercita la sua azione su due tipi di recettori localizzati sulla membrana plasmatica delle cellule bersaglio largamente distribuite nell’organismo. Due distinti recettori dell’Ang II denominati AT1 (con due sottotipi AT1A e AT1B) e AT2 sono
stati identificati sulla base della diversa affinità di legame101. I recettori AT 1
predominano sulla muscolatura liscia vascolare, renale, polmonare, cardiaca, epatica, surrenalica e nel sistema nervoso centrale. I recettori AT2 sono presenti in elevata
densità in tutti i tessuti durante lo sviluppo fetale; nell’adulto sono espressi solo a livello della midollare del surrene, nei tessuti dell’apparato riproduttivo, nell’endotelio vascolare, nel cuore e in alcune regioni encefaliche28.
La stimolazione dei recettori AT1176:
- regola la pressione arteriosa tramite il rilascio di noradrenalina e
- incrementa il volume plasmatico, tramite il riassorbimento tubulare di sodio e
determina l'ipertensione;
- esplica azioni a livello del sistema nervoso centrale tramite lo stimolo della sete; - interviene in risposte di adattamento come il rimodellamento miocardico con
proliferazione cellulare.
La stimolazione dei recettori AT2 determina: - vasodilatazione;
- effetto antiproliferativo e apoptotico.
Le principali attività fisiologiche dell’Ang II si hanno grazie al suo legame con gli AT1 e consistono in vasocostrizione e aumento del riassorbimento di ioni sodio e acqua
a livello del tubulo renale49.
L’attivazione del RAAS contribuisce attivamente alla vasocostrizione e alla ritenzione idro-sodica, anche se recenti studi dimostrano che l'angiotensina II può essere prodotta anche con sistemi non ACE-dipendenti per mezzo di una serina proteasi, detta chinasi, di cui sono particolarmente ricchi i tessuti cardiaco e vascolare58.
1.1.3
Meccanismo d’azione dei Sartani
Gli antagonisti non peptidici dell’angiotensina II costituiscono il gruppo dei sartani. I sartani sono antagonisti competitivi potenti e specifici dei recettori AT1: abbassano la
pressione arteriosa riducendo le resistenze vascolari periferiche senza modificare significativamente la gittata e la frequenza cardiaca77.
I sartani in medicina umana vengono utilizzati soprattutto nel controllo dell'ipertensione sistemica in alternativa agli ACE inibitori168.
L'enzima di conversione dell'angiotensina (ACE) è responsabile anche dell’inattivazione per idrolisi della bradichinina, che aumenta durante la terapia con ACE inibitori provocando edema e tosse stizzosa. I sartani, agendo direttamente sul recettore per l'angiotensina II non hanno alcun effetto sul metabolismo della bradichinina, quindi valicano questo effetto avverso innescando comunque una risposta ipotensiva 102.
I sartani, Inoltre, bloccano le azioni dell’angiotensina in modo più completo rispetto agli ACE inibitori in quanto agiscono direttamente sui recettori AT1 dell’Ang II.
Nel rene, cuore, sistema nervoso e ghiandole surrenali, infatti, oltre al RAAS sistemico sono presenti i RAAS tissutali. La presenza di questi ultimi porta alla formazione locale
di Ang II, indipendentemente dai livelli di Ang I circolanti, con effetti endocrini e paracrini a livello locale160.
I sartani hanno effetti benefici sia in pazienti asintomatici sia in quelli con ICC seria39. Il RAAS sistemico è implicato nella regolazione della volemia, quindi i farmaci
che agiscono sul RAAS riducono le resistenze periferiche e conseguentemente il postcarico; la ritenzione di acqua e sali, diminuendo la secrezione di aldosterone, riduce il precarico. Riducendo il precarico e il postcarico gli inibitori del RAAS rallentano l’entità della dilatazione ventricolare e l’inizio dell’insufficienza cardiaca con manifestazioni cliniche18.
Il RAAS tissutale ha effetti sulla proliferazione cellulare e la sintesi proteica del rene, del cuore, del sistema nervoso, degli organi riproduttivi e del pancreas. La minor concentrazione di angiotensina a livello tissutale riduce anche l’attività simpatica, attraverso la diminuzione degli effetti presinaptici dell’angiotensina sulla liberazione di adrenalina. Grazie a questi meccanismi i sartani riducono il modellamento a lungo termine del cuore e dei grossi vasi18.
I farmaci che agiscono sul RAAS sono utili, inoltre, in pazienti con affezioni renali croniche, in quanto diminuiscono la proteinuria stabilizzando la funzione renale. Questi effetti benefici derivano da una migliorata emodinamica renale determinata dalla riduzione delle resistenze a carico delle arteriole renali efferenti glomerulari, con conseguente riduzione della pressione capillare intraglomerulare46.
Gli effetti sfavorevoli sono simili a quelli descritti per gli ACE inibitori, ivi compresa la controindicazione in gravidanza. Tosse e angioedema possono verificarsi anche con gli antagonisti ai recettori per l’angiotensina, sebbene siano meno comuni che con gli ACE inibitori168.
Riassumendo: utilizzare antagonisti specifici AT1 permette di limitare gli effetti
nefasti dell’angiotensina II sui recettori AT1 e consente di conservare gli effetti benefici
di questo ormone sui recettori AT2.
Gli effetti anti-ipertensivi e cardiovascolari degli ACE inibitori sono dovuti non solo alla diminuita produzione di angiotensina II ma anche a un aumento, in particolare a livello dell'endotelio luminale, di bradichinina18.
I risultati ottenuti nell’uomo con l’uso di antagonisti AT1 dell’angiotensina II sono
positivi nella terapia dell’ipertensione arteriosa e dell’insufficienza cardiaca. I vantaggi osservati consistono nella maggior tollerabilità di questi rispetto agli ACE inibitori e nella possibilità di associare sartani e ACE inibitori per ottenere un blocco persistente dell’attivazione del RAAS, senza accumulo di bradichinine176
L’applicabilità nel cane dei farmaci in questione, sebbene rivelatasi efficace su modelli di insufficienza cardiaca acuta con miglioramento del pre e del post-carico,
rimane al momento ancora ipotetica101. La dose efficace sembra essere superiore a
quella usata nell’uomo. Questa classe farmacologica, benché promettente e interessante per il suo meccanismo d’azione, deve ancora vedere confermata la maggior efficacia rispetto agli ACE Inibitori nel trattamento dell’insufficienza cardiaca negli animali da compagnia.
1.2 DEGENERAZIONE MIXOMATOSA DELLE VALVOLE
ATRIOVENTRICOLARI (MMVD)
La degenerazione mixomatosa della valvole atrioventricolari, conosciuta più comunemente come endocardiosi mitralica, è una patologia degenerativa cronica delle valvole cardiache caratterizzata da una degenerazione mixomatosa dello strato spongioso e fibroso di una o entrambe le valvole atrioventricolari e delle relative corde tendinee, che esita in insufficienza e prolasso della mitrale e/o della tricuspide. Solo raramente sono coinvolte anche la valvola aortica e polmonare 32.
1.2.1
Cenni di anatomia del complesso valvolare mitralico
La valvola mitrale è la valvola che separa la camera cardiaca atriale sinistra dalla camera ventricolare sinistra.
L’apparato mitralico è una struttura complessa che include: • lembi valvolari;
• corde tendinee; • muscoli papillari 7, 23.
Fig. 1.2.1.1 Immagine anatomica del complesso valvolare mitralico del cane. Le corde tendinee originano dai muscoli papillari (MP) e si distribuiscono a entrambi i lembi mitralici. Notare come il lembo anteriore (LA) presenti una lunghezza minore ma un’altezza maggiore del lembo posteriore (LP). Immagine tratta da Santilli et al, 2012.143
L’apparato mitralico è una struttura che, anche in ambito fisiologico, può variare da soggetto a soggetto con un ampio spettro anatomico da una forma ellittica a una pressoché circolare19.
La mitrale è una valvola bicuspide, in quanto è composta da due lembi valvolari: un lembo anteriore o “settale” e un lembo posteriore o “murale” 7.
La superficie dei due lembi valvolari è superiore a quello dell’orifizio atrio-ventricolare in modo che sia garantita una tenuta stagna all’atto della chiusura e impedito il reflusso di sangue dalla cavità ventricolare a quella atriale1.
I lembi della valvola sono composti da quattro strati che, seguendo una direzione atrio-ventricolare, sono:
• endocardio atriale;
• strato spongioso, costituito da una sottile struttura di fibre collagene, fibre elastiche e fibroblasti, in una matrice mucopolisaccaridica;
• strato fibroso, formato da uno strato denso di fibre collagene; • endocardio ventricolare23.
La superficie endocardica atriale dei lembi valvolari appare liscia in tutta la sua interezza, mentre la superficie endocardica ventricolare si presenta liscia in corrispondenza della base e rugosa verso l’apice del lembo. Le zone ruvide dei lembi fungono da base di attacco per le corde tendinee che collegano i muscoli papillari con i lembi valvolari. Il lembo settale riceve un numero medio di corde superiore a quello murale. Nel cane il numero delle corde tendinee varia in maniera significativa da soggetto a soggetto, in un range compreso tra 48 a 741.
I muscoli papillari del ventricolo sinistro sono molto più spessi di quelli presenti nel ventricolo destro, e vengono identificati come craniale e caudale7, 23.
1.2.2
Funzione della valvola mitralica
In passato si riteneva che i meccanismi di chiusura e apertura della valvola mitralica fossero da attribuire alle differenze di pressione fra il compartimento atriale e quello ventricolare durante il normale ciclo cardiaco (diastole-sistole). Secondo questo modello, la valvola si aprirebbe nel momento in cui la pressione atriale supera quella ventricolare all’inizio della diastole, e si chiuderebbe quando la pressione ventricolare supera quella atriale al momento della sistole143.
La teoria attuale prevede un meccanismo molto più complesso di chiusura della valvola mitrale, che vede coinvolti:
a) cambiamenti di flusso transmitralico; b) movimenti dell’anulus mitralico;
d) movimenti di corde tendinee e muscoli papillari; e) correnti di Eddy;
f) controllo nervoso-muscolare a livello mitralico.
a) Il cambiamento di flusso transmitralico prevede l’azione del gradiente pressorio atrioventricolare come input per far aprire passivamente i lembi mitralici 7, 23;
b) per quanto riguarda l’anulus mitralico nel cane può esserci una varietà di forme, che spaziano dall’ellissi alla forma più circolare. La morfologia è determinante per la normale attività della valvola e quindi un’alterazione a questo livello ne può compromettere la funzione. Inoltre, durante la sistole, l’anulus si muove verso l’apice cardiaco, e in questo modo, senza alterare l’equilibrio pressorio delle camere cardiache, favorisce il riempimento dell’atrio sinistro. In fase diastolica invece, l’anulus si muove nella direzione opposta, cioè verso la base del cuore, così da permettere al sangue, che a fine sistole è in atrio sinistro, di trovarsi già in ventricolo sinistro facilitando il riempimento diastolico ventricolare23;
c) i movimenti dell’anulus sono garantiti dalla funzione contrattile ventricolare. In soggetti con funzione sistolica depressa o compromessa la struttura mitralica ne risente, dato che il contraccolpo elastico della muscolatura ventricolare risulta diminuito. In questo senso quindi la funzione ventricolare è molto importante per il normale funzionamento della valvola;
d) i muscoli papillari e le corde tendinee svolgono un’azione combinata nel mantenere le estremità dei lembi valvolari sempre alla stessa distanza rispetto all’apice valvolare. I muscoli papillari si contraggono su due piani: in un primo momento si ha una contrazione sul piano longitudinale, subito dopo la contrazione procede sul piano trasversale. Tale contrazione consente ai lembi di acquisire una posizione favorevole alla chiusura quando inizia la sistole. L’azione fondamentale dei muscoli papillari è dimostrata dal fatto che quando si ha un rimodellamento ventricolare (quale a esempio un'ipertrofia), questi muscoli vengono spostati in posizione più trasversale, con conseguente alterata trazione delle corde tendinee sui lembi valvolari;
e) sono definite “correnti di Eddy” i movimenti in senso circolare del sangue che si dirige dalla superficie atriale verso quella ventricolare dei lembi valvolari. Queste correnti coadiuvano i lembi mitralici a raggiungere la posizione ottimale per la chiusura quando inizia della sistole;
f) infine, ancora oggetto di studio, è il ruolo svolto dalla presenza di una fitta serie di terminazioni nervose e fibre muscolari a livello della valvola mitralica, che sembrano avere un ruolo importante nell’autoregolazione del movimento valvolare stesso43.
1.2.3
Diffusione, eziologia e genesi dell’endocardiosi mitralica
L’endocardiosi mitralica è il risultato della degenerazione mixomatosa; rappresenta la più comune patologia cardiaca acquisita del cane adulto e il 75% di tutti i disturbi cardiovascolari in questa specie22,180.
La manifestazione del disturbo, secondo alcuni studi, è stata correlata con l’età e la razza del soggetto in esame. Una grande prevalenza di casi si ha in cani di età superiore ai 10 anni. Nei Cavalier King Charles Spaniel (CKCS)127 la prevalenza
dell’endocardiosi mitralica aumenta linearmente con il progredire dell’età a cominciare già dai 5-6 anni65,69,70,71 ,162.
Di solito l’endocardiosi mitralica è diagnosticata nei cani di piccola taglia, non è raro, però, che anche cani di taglia media e grossa ne risultino affetti66.
È stato inoltre riscontrato che i soggetti maschi sono molto più predisposti a sviluppare la patologia rispetto alle femmine, anche a un’età più giovane rispetto a quella dei 10 anni. Questo è in accordo con l’osservazione più frequente della patologia in pazienti di sesso maschile in età medio-avanzata, rispetto a pazienti coetanei di sesso femminile22.
Nell’endocardiosi mitralica, la valvola appare accorciata e inspessita sia in forma diffusa, fino all’interessamento di gran parte dei lembi valvolari, sia in forma nodulare56,155.
Fig. 1.2.3.1 A sinistra: lembi valvolari mitralici degenerati e Fig. 1.2.3.2 A destra: visione dorsale dell’ostio atrio-ventricolare di sinistra, da cui si intravedono le corde tendinee e i muscoli papillari; i margini dei lembi valvolari appaiono molto ispessiti e raccorciati.Immagine tratta da Hamlin, 200569.
Da un punto di vista macroscopico, le lesioni valvolari furono classificate per la prima volta da Whitney nel 1970173; secondo questa classificazione, le lesioni associate ad endocardiosi mitralica possono essere di quattro tipi:
• Tipo 1 e Tipo 2: sono lesioni caratterizzate dalla presenza di piccoli inspessimenti nodulari più o meno estesi sui lembi valvolari, senza interessamento delle corde tendinee.
• Tipo 3: comprende la formazione di lesioni più estese sui lembi valvolari associate a valvole ridondanti.
• Tipo 4: le lesioni si estendono anche alle corde tendinee, e frequentemente comportano rottura delle stesse 143, 164
Fig. 1.2.3.3 Classificazione di Whitney e Pomerance delle lesioni valvolari mitraliche del cane. Immagine tratta da Santilli et al, 2012 143.
In sezione la lesione ha aspetto edematoso, poichè le molecole di glicosaminoglicani idrofili con eccesso di iarulonato, si accumulano a livello della matrice extracellulare, in quantità maggiore rispetto ai glicosaminoglicani normalmente presenti nella costituzione della valvola4.
Aspetto normale valvola mitrale Aspetto alterato valvola mitrale Fig. 1.2.3.4 Immagini tratte da Bigg et al, 2013.16
Per quanto riguarda l’eziologia del disturbo, non è stato ancora ben chiarito quale sia l’evento scatenante la patologia. Infatti, poiché l’endocardiosi mitralica colpisce prevalentemente cani anziani e questi ultimi in genere hanno una pletora di altri disturbi, spesso non è facile capire se tali disturbi sono semplicemente concomitanti oppure costituiscono una vera e propria condizione di genesi della patologia valvolare69.
Vista l’elevata prevalenza della malattia in alcune razze, è stato ipotizzato che essa abbia una componente ereditaria di tipo poligenico. L’ipotesi della natura poligenica della malattia è stata formulata per la prima volta da Swenson nel 1996, in base all’osservazione che i CKCS con malattia più grave davano origine a una prole affetta da soffi cardiaci più intensi rispetto ad altri CKCS affetti da una malattia più lieve92,162.
Questa natura poligenica della malattia è stata in seguito dimostrata anche nel Bassotto tedesco115, 116, 126.
Al momento non sono stati ancora classificati i geni che sono coinvolti nella trasmissione della malattia21. Un'ipotesi abbastanza recente è quella che vede come
incipit del processo degenerativo una turba primaria del metabolismo del collageno e della matrice extracellulare con accumulo di materiali di cui questa è costituita (ovvero i proteoglicani), tramite una attivazione delle cellule valvolari interstiziali (VIC). Le VIC sono il tipo cellulare più rappresentato nelle valvole cardiache. I ruoli principali di tali cellule sono: sintesi della matrice extracellulare, riparazione e rimodellamento valvolare. Normalmente queste cellule sono presenti in uno stato di quiescenza, ma in seguito a un danno endoteliale e allo stress che quest’ultimo comporta, possono attivarsi143. Le VIC attivate hanno la capacità di sintetizzare sostanze diverse, tra cui
rimodellamento della matrice extracellulare attraverso il rilascio di metallo-proteinasi e di inibitori della metallo-proteinasi16,113.
La continua attivazione delle VIC quando si instaura un circolo vizioso (danno endoteliale-stress-riparazione) porterebbe a una diminuzione di collagene e alla deposizione di proteoglicani in eccesso nel suo spessore97.
Le VIC possono, inoltre, subire un'alterazione del fenotipo tramutandosi in miofibroblasti o cellule muscolari lisce16.
Sulla base di queste nuove e vecchie osservazioni è stato proposto un nuovo schema per spiegare la patogenesi della degenerazione mixomatosa della valvola mitralica.
In accordo a quest’ultimo modello elaborato, nei cani geneticamente predisposti alla malattia, una lesione endocardica che porta a uno stress meccanico ripetuto, determina l’attivazione delle VIC con produzione di metallo proteinasi-3 (MMP-3) e di fattore di crescita trasformante β (TGF-β-3). L’aumento dell’espressione del TGF-β-3 determina un aumento dell’espressione dell’α-actina muscolare liscia (αSMA) e dei proteoglicani con attivazione delle cellule interstiziali valvolari113. Il risultato finale è
rappresentato dalla degenerazione mixomatosa della valvola16.
1.2.4
Fisiopatologia
L’insufficienza cardiaca in corso di endocardiosi delle valvole atrioventricolari inizia con un ispessimento dei lembi valvolari, un allungamento e lassità delle corde tendinee, che determinano insufficienza e prolasso valvolare82
Da un punto di vista fisiopatologico, l’insufficienza mitralica è causata da una condizione emodinamica in cui a un aumentato precarico corrisponde un diminuito postcarico ventricolare14. La diminuzione del postcarico si verifica perché una parte del
volume ventricolare è espulsa nelle prime fasi della sistole nell’atrio sinistro, sia a causa della ridotta pressione atriale rispetto a quella ventricolare sia perchè la valvola mitrale non riesce più a far combaciare i propri lembi e a isolare i due compartimenti167.
In genere, un'insufficienza valvolare lieve appare ben tollerata dai cani colpiti, e non determina nessuna risposta compensatoria da parte del sistema cardiovascolare174; la gittata cardiaca è mantenuta e la minima quota di sangue che
rigurgita in atrio è ben tollerata da quest’ultimo51.
La quantità di rigurgito dipende dalla differenza di pressione che si viene a creare fra l’atrio e il ventricolo sinistri, e dal lasso di tempo durante il quale la pressione ventricolare eccede quella atriale68,167.
L’atrio sinistro è in grado, dilatandosi, di compensare per un certo periodo il volume in surplus impostogli dal rigurgito trans-valvolare, e anche il ventricolo sinistro conserva in tale periodo una gittata sistolica quasi normale97.
Quando insorge un’insufficienza mitralica acuta di grado medio, si verifica una perdita in atrio di una certa quantità di sangue non disponibile per l’espulsione nel circolo sistemico e quindi, una riduzione acuta della gittata e della portata cardiaca con un aumento repentino delle pressioni atriali, che si riflette nelle vene e nei capillari polmonari fino, nei casi più gravi, a procurare edema polmonare82.
La rapida riduzione della massa ematica circolante determina una riduzione della pressione sistemica e del flusso renale. Questa ipoperfusione viene percepita dai barocettori del seno carotideo, del glomo aortico e cardiaci, che, insieme alla riduzione del flusso renale, stimolano una risposta β-adrenergica del sistema simpatico.
La stimolazione dei recettori adrenergici esita in:
- aumento della frequenza del nodo del seno (effetto cronotropo positivo); - aumento della forza contrattile (effetto inotropo positivo);
- vasocostrizione periferica82
.
Si ottiene, così, un più rapido e completo svuotamento ventricolare che, insieme all’aumento della frequenza di contrazioni per minuto, migliorano sensibilmente la gittata e portata cardiaca. Queste variazioni, associate alla vasocostrizione periferica
determinano una normalizzazione della pressione sistemica e il ritorno a uno stato di normoperfusione82.
In breve tempo (qualche giorno), tuttavia, lo stimolo adrenergico continuo provoca una down-regulation dei β1-recettori (circa il 50%): la forza contrattile e la frequenza, pur rimanendo elevate rispetto a una condizione di normalità, risultano invece ridotte rispetto alla fase iniziale di compensazione82. Si osserva, quindi, nuovamente una
riduzione della portata cardiaca e dello stato perfusionale. In questa patologia, la risposta β-adrenergica, da sola, non fornisce una soluzione adeguata e sufficiente per un adattamento cronico della portata cardiaca82. Quest’ultima a sua volta causa
l’attivazione dei meccanismi di compenso quali: • l’attivazione neuroendocrina;
• la risposta ipertrofica a carico del muscolo cardiaco; • la dilatazione atriale sinistra.
L’attivazione neuroendocrina include l’attivazione del sistema nervoso simpatico, del sistema renina-angiotensina-aldosterone (RAAS) e dei peptidi natriuretici125.
È ormai stato appurato che questi sistemi sono senza dubbio coinvolti nel progredire della degenerazione valvolare, ma quello che ancora non è stato compreso fino in fondo è il momento in cui essi sono chiamati in causa per cercare di tamponare la condizione patologica25. La riduzione della gittata cardiaca conseguente
all’insufficienza mitralica è associata a un aumento dell’attività del sistema nervoso simpatico124. Alcuni studi hanno, infatti, dimostrato che i cani affetti da endocardiosi
mitralica presentano livelli di noradrenalina circolanti più elevati rispetto ai soggetti normali; inoltre è stato visto che i livelli circolanti di catecolamine sono direttamente proporzionali al grado di insufficienza mitralica124. Mentre nell’uomo quest'attivazione è
in pratica concomitante all’inizio dell’insufficienza valvolare, nel cane una più intensa attivazione simpatica avviene solo negli stadi più avanzati della malattia; solo i soggetti nello stadio tardivo della patologia dimostrano un aumento importante della frequenza cardiaca. I livelli di noradrenalina in cani asintomatici, ma comunque affetti da endocardiosi, non differiscono da quelli riscontrati in soggetti normali. L’attivazione cronica del sistema nervoso simpatico se da una parte nel breve periodo aumenta la frequenza cardiaca e grazie all’azione inotropa positiva consente di ristabilire la gittata cardiaca, in una condizione cronica si dimostra sfavorevole: si ha infatti un aumento del consumo di ossigeno, una vasocostrizione periferica e un aumento del lavoro cardiaco. A questo punto entra in gioco il rene che, avvertendo la riduzione del flusso e della pressione, attiva il sistema renina-angiotensina-aldosterone (RAAS)140. Come per
momento di ripristinare la normale portata cardiaca e soprattutto una normale pressione di perfusione renale. Col lungo andare, però, anche il RAAS contribuisce al peggioramento della patologia, poiché determina un aumento del precarico e del postcarico ventricolare e favorisce il rimodellamento cardiaco127. Sono stati compiuti
studi in passato che hanno mostrato un certo grado di correlazione fra l’attivazione più o meno precoce del RAAS e la razza; il CKCS è risultata essere la razza più suscettibile a tale attivazione125. Ancora non è stato possibile stimare con certezza
quando e in che misura il RAAS sia attivato nelle fasi precliniche della malattia, e questo spiega il perché una terapia preventiva a base di ACE Inibitori non riesca a rallentare il progredire della patologia degenerativa129. Il rilascio del peptide natriuretico
atriale (ANP) è causato dalla dilatazione atriale dovuta all’aumento della quota di rigurgito mitralico, mentre il rilascio del peptide natriuretico cerebrale (BNP) è causato dall’ipertrofia eccentrica ventricolare sinistra associata al progressivo sovraccarico di volume. L’azione dei due peptidi è quella di promuovere la diuresi tramite l’aumento dell’escrezione di sodio (Na+). A differenza del sistema nervoso simpatico e del RAAS,
i livelli di ANP e BNP sono elevati soprattutto nelle prime fasi della patologia, mentre tendono man mano a diminuire con l’aumento della dilatazione della camera atriale, quindi in modo inversamente proporzionale. L’aumentata produzione dei peptidi (ANP e BNP) nelle fasi precliniche della patologia svolge un ruolo importante nel bilanciare l’iniziale aumentata attività del sistema nervoso simpatico e del RAAS; con il progredire della patologia i livelli dei peptidi si abbassano poiché non più in grado di bilanciare efficacemente l’attivazione dei meccanismi neurormonali, che infine prevalgono e scompensano il sistema120.
Il riassorbimento del sodio e la ritenzione di acqua, ottenuto con l’attivazione del RAAS, determina un incremento del volume ematico e del ritorno venoso al cuore (aumento del precarico) cui fa seguito un sovraccarico volumetrico del ventricolo sinistro che genera aumento della tensione parietale; questa rappresenta il principale input per l’ipertrofia eccentrica compensatoria82. La risposta ipertrofica di tipo
eccentrico della parete del ventricolo sinistro è causata dall’aumento del precarico, tale ipertrofia è associata a un aumento della forza di contrazione. La diminuzione del post-carico e l’ipertrofia eccentrica, insieme al già menzionato aumento della stimolazione catecolaminica, sono i responsabili dei quadri di ipercinesia ventricolare sinistra che si osservano nei pazienti affetti da endocardiosi mitralica con significativo rigurgito38. La
degenerazione mitralica è una malattia cronicamente evolutiva e l’attivazione cronica del RAAS conduce gradualmente a un incremento del precarico che causa aumento delle dimensioni del ventricolo e dell’atrio sinistro, e rimodellamento miocardico. Questo determina anche un aumento della frazione di rigurgito. L’insufficienza
valvolare è considerata moderata quando la frazione di rigurgito è compresa tra il 45% e il 75% e la contrattilità rimane normale; quando, la frazione di rigurgito mitralico è maggiore del 75% allora l’insufficienza valvolare è severa. In questa fase dell’evoluzione della degenerazione mixomatosa sono presenti i segni clinici dell’insufficienza cardiaca82.
Fig. 1.2.4.1 Fase finale della patologia mitralica82 Fig. 1.2.4.2 Fase finale della patologia mitralica82
Quando inizia l’ICC il volume di sangue espulso nel circolo sistemico (FSV) comincia a ridursi e, per compensare l’ipoperfusione, la frequenza ventricolare rimane elevata (spesso anche a riposo): scompare l’aritmia sinusale respiratoria per assenza del tono vagale. Il diametro e il volume telediastolico sono ulteriormente aumentati, mentre, il diametro e il volume telesistolico rimangono invariati; di conseguenza la frazione di accorciamento (SF) diviene ancora più elevata con spiccata ipercinesia setto-parietale (Fig. 1.2.4.1).
Il RAAS continua infaticabile il suo lavoro di trattenere sodio e acqua, ma la compliance ventricolare ha raggiunto il suo massimo contributo per consentire un ulteriore adattamento cardiaco a questa nuova condizione di lavoro. La rigidità camerale aumenta e, con essa, le pressioni ventricolari di riempimento diastolico (in figura: spirali notevolmente ispessite in telediastole). Le pressioni diastoliche e sistoliche atriali aumentano e, di conseguenza, si ripercuotono sulle pressioni delle vene e dei capillari polmonari determinando la fuoriuscita di liquido trasudatizio dagli spazi capillari nell’interstizio con conseguente edema interstiziale.
Lo stadio finale della patologia mitralica (figura 1.2.4.2) è caratterizzato da un ulteriore notevole dilatazione del ventricolo e dell’atrio sinistro; l’ipertrofia eccentrica compensatoria e l’attivazione del sistema simpatico non sono più in grado di mantenere una sufficiente perfusione; la gittata sistolica in aorta (FSV) si riduce drasticamente e il RAAS aggrava ulteriormente il sovraccarico volumetrico.
“Entro limiti fisiologici, quanto maggiore sarà la distensione degli elementi contrattili alla fine della diastole (lunghezza precontrattile o precarico), tanto maggiore sarà la forza e
la velocità di contrazione cardiaca, ottenendo, così, un migliore svuotamento ventricolare” (Legge di Maestrini). Il limite fisiologico della legge di Starling-Maestrini sulla capacità intrinseca di contrazione del muscolo cardiaco è ormai superato. La contrattibilità, quindi, si riduce, il diametro e il volume telesistolico aumentano e la frazione di accorciamento si “normalizza” (SF<40%)
La progressiva dilatazione che consegue al rigurgito mitralico è un adattamento che consente di mantenere, fino a un certo periodo, le pressioni di riempimento nell’ambito della norma. La compliance atriale sinistra e la rapidità d'insorgenza del rigurgito mitralico sono i due aspetti su cui si basa l’eventuale insorgenza di una complicazione della malattia mitralica cronica, ovvero l’edema polmonare3, 80. Se il
rigurgito mitralico progredisce in maniera cronica, l’atrio sinistro ha il tempo necessario per cercare di adattarsi alla condizione patologica e quindi aumentare in maniera graduale il proprio volume per cercare di mantenere per quanto possibile un equilibrio pressorio compatibile con il funzionamento cardiaco17.
Se invece il rigurgito peggiora in maniera molto veloce o addirittura immediata (come nel caso della rottura di una o più corde tendinee), l’atrio non avrà il tempo necessario per l’adattamento e quindi l’improvviso e non bilanciato aumento di pressione scaturirà nell’edema polmonare.
La dilatazione atriale non consiste però in un semplice aumento di volume camerale; infatti, nei soggetti cronici l’atrio subisce un rimodellamento che col tempo conduce a una riduzione della compliance atriale che comporta, con tempistica diversa nei pazienti cronici, lo sviluppo progressivo di edema polmonare. L’aumento delle pressioni atriali e del circolo di ritorno all’atrio sinistro aggravano il pattern del polmone che frequentemente evolve da interstiziale a alveolare; invece, la notevole dilatazione atriale predispone a patologie del ritmo come battiti ectopici o, molto frequentemente, fibrillazione atriale.
1.2.5
Sintomatologia e diagnosi
Nella maggior parte dei casi, in ambito clinico il sospetto di endocardiosi mitralica è fornito al momento dell’auscultazione cardiaca8.
Soprattutto a livello dell’apice cardiaco sinistro, è spesso possibile percepire in questi pazienti (a seconda del grado di degenerazione) un soffio sistolico; se la degenerazione è grave, il soffio diviene udibile anche auscultando l’emitorace destro; caso limite è quello in cui si ha sia un soffio mitralico che un soffio tricuspidale, dati dalla degenerazione mixomatosa di entrambi gli apparati valvolari.
Il soffio non sempre è strettamente correlato all’entità della patologia mitralica, esiste una percentuale di soggetti che versano in condizioni di scompenso cardiaco in cui, tuttavia, non è possibile udire il soffio. Il riscontro di questa casistica può essere spiegato dal fatto che questi pazienti sono spesso affetti da disturbi di tipo aritmico quali la fibrillazione atriale che possono mascherare il sottostante soffio8. Di solito non
è facile identificare il soffio nei pazienti con MMVD iniziale che non mostrano segni clinici apprezzabili; in questi cani spesso è percepibile un rumore assimilabile a un “click”. Questo “click” è spesso intermittente e la sua origine è attribuita alla tensione delle corde tendinee e alla decelerazione del flusso sanguigno contro i lembi mitralici ridondanti nell’atrio sinistro. Un modo per rendere maggiormente udibile questo rumore patologico è indurre nel cane un aumento della frequenza cardiaca; infatti, l’aumento delle contrazioni cardiache è correlato ad un peggioramento del prolasso valvolare, e in definitiva aumenta la probabilità di generare il “click”.
La presenza di tosse rappresenta, in realtà, un problema di non facile interpretazione alla visita clinica.
La tosse come conseguenza di edema polmonare è, in effetti, un possibile indizio di insufficienza cardiaca nel cane. Spesso, con troppa facilità, si tende a correlare la tosse in un cane anziano con problemi di entità cardiaca, ma non bisogna dimenticare che nel cane anziano (di piccola taglia soprattutto) il rilievo di tosse è un reperto più che frequente a causa di disturbi delle prime vie respiratorie54.
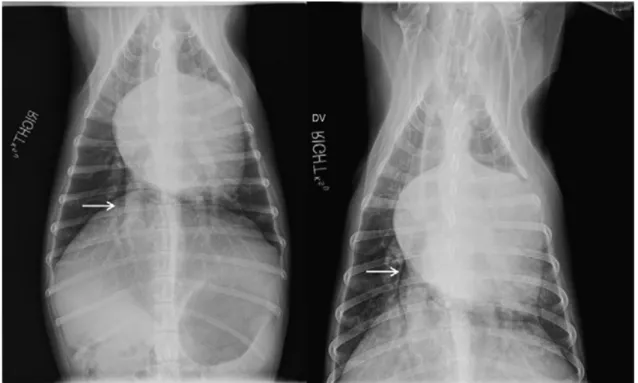
Un esame radiografico toracico può essere molto utile ai fini di discernere se la tosse è data da un problema respiratorio primario oppure è secondario al rimodellamento cardiaco66.
Nel secondo caso, la tosse (che viene definita “cardiogena”) è di solito causata dalla compressione dei bronchi principali a opera dell’atrio sinistro dilatato. Recenti studi hanno dimostrato che la tosse è correlata esclusivamente alla bronco-malacia primaria54.
Fig. 1.2.5.1 Radiografie toraciche in proiezione dorso-ventrale di un cane con grave endocardiosi mitralica. La radiografia di sinistra mostra il normale percorso del bronco principale destro (freccia). La radiografia di destra mostra lo stesso cane a distanza di un mese: la radiografia è stata ripetuta perché il proprietario riportava che il cane mostrava tosse intensa; la freccia mostra come la parte terminale del bronco di destra appaia collabita. Non si evidenziano segni di edema o congestione polmonare. Immagine tratta da Boragrelli & Haggstrom, 2010.
Fig. 1.2.5.2 Scansione parasternale sinistra quattro camere: normale anatomia delle camere cardiache e dell’apparato valvolare atrio-ventricolare. AD=atrio destro; VD=ventricolo destro; AS=atrio sinistro;
Al giorno d’oggi la conferma diagnostica di endocardiosi mitrlica è senza dubbio fornita dall’esame ecocardiografico del soggetto165. L’American College of Veterinary
Internal Medicine (ACVIM)8 raccomanda l’esame ecocardiografico in tutti i soggetti sospettati di essere affetti da endocardiosi mitralica.
L’ecocardiografia permette di confermare la diagnosi, escludere la presenza di malattie concomitanti, valutare la severità dell’ingrandimento atrioventricolare sinistro e riconoscere la presenza di complicanze quali la rottura delle corde tendinee, la rottura dell’atrio sinistro e la presenza dell’ipertensione polmonare.
Le caratteristiche ecocardiografiche a carico della valvola in corso di endocardiosi mitralica sono rappresentate dalla presenza di lembi mitralici inspessiti e dal prolasso di uno o entrambi i lembi20.
Per prolasso mitralico si intende uno spostamento sistolico anomalo superiore e posteriore dei lembi mitralici dal ventricolo sinistro nell’atrio sinistro.
Fig. 1.2.5.3 Scansione parasternale sinistra quattro camere: le frecce evidenziano l’aspetto alterato dei lembi valvolari mitralici, che appaiono inspessiti
Fig. 1.2.5.4 Scansione parasternale destra quattro camere: notare l’alterazione dei lembi mitralici; in particolare, il lembo settale appare dislocato verso la cavità atriale sinistra Nel cane, come anche nell’uomo, il prolasso mitralico è più facilmente individuabile utilizzando la proiezione parasternale destra a quattro camere.
L’ anatomia dell’anulus mitralico nel cane ha un'elevata variabilità da soggetto a soggetto; di conseguenza talvolta è possibile che questa proiezione possa sovrastimare la presenza o il grado di prolasso.
Mentre in medicina umana sono ormai state fissate le misure “gold standard” dell’anulus per cui un paziente è predisposto a sviluppare l’insufficienza mitralica135, in
medicina veterinaria non sono ancora stati stabiliti precisi criteri ecocardiografici per tale valutazione.
Nella realtà clinica, la stima dell’endocardiosi mitralica e dei suoi effetti secondari deve essere sempre valutata e confermata da almeno due scansioni ecocardiografiche.
In linea di massima, la presenza di una dilatazione atriale sinistra e l’ipertrofia eccentrica ventricolare sinistra indicano la presenza di un significativo sovraccarico volumetrico81. Un’altra misurazione ecocardiografica, importante nello stimare il grado
di endocardiosi mitralica, è il rapporto atrio sinistro-aorta (LA/Ao). Esso consente di confrontare il diametro atriale (che in numerose patologie può aumentare) col diametro dell’anulus aortico (che è invece relativamente stabile)8.
Il riscontro di ingrandimento atriale sinistro tramite questa misurazione è stato recentemente associato a un aumento del rischio di mortalità o di progressione della malattia.
Fisiologicamente, tale rapporto (secondo la razza e della taglia del cane) deve essere contenuto in un intervallo che va da 1.0 a 1.2-1.3.
Secondo uno studio recente, un rapporto Asx/Ao superiore a 1.4 in soggetti asintomatici è stato associato a un aumento pari a 2.6 volte del rischio di morte per cause cardiache, mentre un rapporto superiore a 1.7 è associato a un aumento del rischio di mortalità in un gruppo di cani affetti da endocardiosi mitralica preclinica e con scompenso cardiaco21.
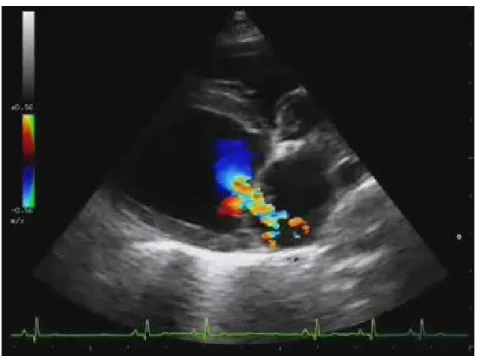
Infine, un fondamentale ausilio alla diagnosi della patologia è dato dall’utilizzo della funzione “color-doppler”. Il color-doppler è un termine che si riferisce ai sistemi settoriali a ultrasuoni che prevedono la sovrapposizione alla classica immagine in scala di grigi di un’area in cui è eseguita un’analisi dei flussi sanguigni con codifica di colore. Il flusso ematico è rappresentato con colori standard rappresentativi della velocità, della direzione e del tipo di flusso.
L’attribuzione del colore avviene tramite algoritmi o mappe di colori che fanno corrispondere una specifica sfumatura al valore numerico assegnato a ogni pixel coinvolto in base alla direzione e alla velocità di flusso registrato: il colore rosso è attribuito ai flussi in avvicinamento, il blu a quelli in allontanamento, secondo il codice BART (red-toward, blue-away).
I pixel con velocità non misurabile sono convenzionalmente colorati di nero, in modo da renderli indistinguibili dallo sfondo sottostante.
In genere sono ormai diffuse le mappe nelle quali il contrasto fra le sfumature di colore non è ridotto al solo rosso e blu, ma è più variegato grazie all’introduzione del colore giallo o verde, che corrisponde alla sovrapposizione dei due tipi di flussi (in definitiva, se presente, mostra il rigurgito)83.
Fig. 1.2.5.5. Scansione parasternale destra asse corto atrio sinistro/aorta; AS=atrio sinistro; Ao=aorta
Fig. 1.2.5.6 Scansione parasternale destra quattro camere: presenza di rigurgito mitralico. Immagine tratta da Hamlin et al, 2005.
Il risultato di uno studio doppler però, sebbene sia in un certo senso diagnostico di alcune patologie, può essere influenzato in maniera sensibile dalla qualità dell’esame: perciò deve essere attentamente ponderato prima di trarre deduzioni semiquantitative.
Sta quindi all’operatore che conduce l’analisi stimare quanto le immagini visualizzate possano più o meno corrispondere alla realtà patologica del soggetto.
In ogni caso, secondo uno studio quali-quantitativo, la classificazione della gravità dell’endocardiosi mitralica sulla base della correlazione fra il rapporto LA/Ao e dell’area del jet di insufficienza mitralica riscontrata con il color doppler risulterebbe la più affidabile e veritiera delle altre metodiche diagnostiche87.
1.2.6
Classificazione dei soggetti
Da quanto detto finora, è facile intuire che l’endocardiosi mitralica è una patologia la cui presentazione clinica è molto variabile: da pazienti asintomatici fino ai casi estremi di morte improvvisa per edema polmonare fulminante.
La commissione della ACVIM ha proposto nel 2009 una nuova classificazione atta a inquadrare al meglio la condizione in cui versa il paziente8.
I cani sono inseriti in una scala graduata con le lettere dell’alfabeto (dalla A alla D) a seconda della gravità dell’endocardiosi.
Classe A Cani a rischio di sviluppo della MMVD che non presentano segni clinici o ecocardiografici di malattia cardiaca (per esempio, CKCS, Bassotto, Barboncino Nano)
Classe B1 Cani con diagnosi clinica ed ecocardiografica di MMVD che non hanno mai presentato segni clinici e senza segni radiografici o ecocardiografici di rimodellamento cardiaco
Classe B2 Cani con diagnosi clinica ed ecocardiografica di MMVD che non hanno mai presentato segni clinici, ma che hanno segni radiografici e/o ecocardiografici di rimodellamento cardiaco (per esempio ingrandimento atriali o ventricolare sinistro)
Classe C Cani con diagnosi clinica ed ecocardiografica di MMVD e con segni clinici di scompenso cardiaco presenti (ad esempio dispnea o intolleranza all’esercizio) o con episodi di scompenso cardiaco pregressi documentati (esempio esame radiografico).
I cani che presentano segni di scompenso per la prima volta possono essere in condizioni cliniche critiche e necessitare l’ospedalizzazione
Classe D Cani con MMVD e scompenso cardiaco refrattario definitio come persistente stato di scompenso cardiaco, sebbene in terapia ottimale con diuretici, ACE Inibitori e farmaci inotropo positivi
(Da: ACVIM Consensus Statement. Guidelines for the diagnostic and treatment of canine chronic valvular heart disease. J Vet Intern Med 2009; 23:1142-50; modificata.)
1.2.7
Terapia
La MMVD è una malattia frequente nei cani anziani, caratterizzata da una lunga fase asintomatica. Il cardiologo, utilizzando la radiologia e l’ecocardiografia per stadiare la malattia cardiaca, deve individuare il momento opportuno per iniziare la terapia in modo da ritardare o prevenire lo sviluppo dello scompenso cardiaco e dell’edema polmonare143.
Nei pazienti in stadio B1 ACVIM l’attivazione neuro-ormonale sistemica sembra silente; si ritiene che l’Ang II e l’Aldosterone si modifichino solo con la comparsa della sintomatologia clinica rendendo inutile un intervento terapeutico nelle fasi pre-cliniche della malattia. Lo studio di Kvart85 ha valutato inefficace l’utilizzo degli ACE inibitori
(Enalapril al dosaggio 0.25 mg/kg) nel rallentare la comparsa dello scompenso cardiaco. Atkins9 utilizzando Enalapril nei soggetti asintomatici giungeva alla stessa
conclusione pur mostrando un modesto incremento della sopravvivenza nei cani trattati con ACE inibitore. Un risultato analogo è stato ottenuto da Pouchelon134 valutando
retrospettivamente la sopravvivenza in un gruppo di cani con endocardiosi mitralica trattati con Benazepril al dosaggio 0.3 mg/kg.
L’efficacia degli ACE inibitori, in monoterapia, nel ritardare la comparsa della sintomatologia in soggetti con MMVD in stadio asintomatico risulta da modesta Atkins9
a nulla Kvart85. Attualmente l’uso degli ACE inibitori risulta, invece, indispensabile
quando si intraprende una terapia diuretica che determina l’attivazione del RAAS con un aumento delle resistenze periferiche e del post carico Suzuki161. L’uso di una terapia
diuretica necessita, dunque, dell’associazione di farmaci che siano in grado di bloccare la liberazione di Ang II e dell’aldosterone Sisson155 e Haggstrom76. Gli ACE inibitori in
associazione con i diuretici consentono un miglioramento della qualità di vita e un prolungamento dei tempi di sopravvivenza dei pazienti COVE, IMPROVE1, BENCH2,
Martin99, Lefebvre91. Gli ACE inibitori dovrebbero essere utilizzati ai massimi dosaggi
efficaci; il riscontro di livelli elevati di Ang II e aldosterone, in soggetti trattati cronicamente con ACE inibitori, ha evidenziato come l’ACE inibizione a 24 ore dalla somministrazione di 5 ACE inibitori diversi, sia modesta suggerendo la necessità di somministrare questi farmaci 2 volte al giorno2.
La terapia medica attuale per il trattamento dei cani con MMVD e segni clinici di insufficienza cardiaca, comprende un’associazione di Furosemide, ACE inibitori, Pimobendan e Spironolattone; quale sia l’associazione con cui iniziare il trattamento è una scelta che dipende dalla gravità dello scompenso cardiaco, dalla presenza di malattie concomitanti e dalla disponibilità del proprietario.
Il Pimobendan esplica la sua attività attraverso l’inibizione della fosfodiesterasi III e favorisce la vasodilatazione periferica; determina, inoltre, una riduzione della
concentrazione di catecolamine in circolo nei soggetti con MMVD121. La sua
associazione alla terapia diuretica, però, non sembra essere in grado nelle fasi iniziali della MMVD, di impedire l’attivazione del RAAS. Attualmente si ritiene che l’associazione di ACE inibitori, Pimobendan e diuretici possa garantire, almeno nelle fasi iniziali dello scompenso, un equilibrio emodinamico nel paziente in classe C ACVIM Consensus.
La terapia con ACE inibitori in umana viene associata agli inibitori dell’Aldosterone. Il trattamento con Spironolattone in aggiunta alla terapia con Furosemide e ACE inibitori ha evidenziato una riduzione della progressione della malattia e della mortalità.
Lo Spironolattone, oltre a essere un risparmiatore di potassio agendo sui recettori dei mineralcorticoidi170, consente di bloccare l’attività aldosteronica derivante
dall’escape conseguente all’azione delle chimasi (proteasi in grado di trasformare l’Ang I in Ang II). Le evidenze in medicina umana130 e in medicina veterinaria15, sostengono
l’utilizzo dell’aldosterone come potenziatore degli ACE inibitori in quanto insieme controllano i meccanismi pro-fibrotici e la risposta all’ossido nitrico in modo più efficace aumentando la sopravvivenza dei pazienti. L’uso degli ACE inibitori è consigliato quando si utilizza l’Amlodipina per contrastare l’effetto di attivazione del RAAS9.