INTRODUZIONE
Il tumore del polmone è, ad oggi, la principale causa di morte per neoplasia negli USA sia per gli uomini che per le donne (Jemal et al , 2004; Travis et al, 1996). É stato stimato che nel 2004 l'incidenza di questa neoplasia negli Stati Uniti abbia raggiunto i 173.700 casi rappresentando il 13% di tutte le nuove diagnosi di tumori e il 29% delle morti per cancro (Ahmedin et al, 2004).
Mentre l'incidenza di tumore polmonare tra gli uomini è in diminuzione dopo il picco raggiunto negli anni '80, l'incidenza nel sesso femminile è in aumento e ciò ha significativamente alterato il rapporto maschi/femmine in questa patologia (Patel, 2004). Gran parte di queste differenze possono essere attribuite ai cambiamenti nell'uso di tabacco ma sembra che il rischio relativo di specifici tipi di tumore polmonare, la relazione tra fumo e tumore così come la risposta alla terapia, siano diversi nei due sessi.
I carcinomi polmonari non a piccole cellule (NSCLC) rappresentano circa l’80% di tutti i casi di neoplasie polmonari (Weir H, 2003; Chuman Y, 1999; Lynch T, 2004). Ampi studi epidemiologici (Osann et al, 1993; Thun et al, 1997; Muscat et al, 1995; Jennifer et al, 2005) hanno dimostrato che il tipo istologico di tumore polmonare più frequente tra gli uomini è il carcinoma a cellule squamose mentre tra le donne è l'adenocarcinoma, in particolare per le donne non fumatrici.
Secondo l’ultima edizione della classificazione delle neoplasie polmonari della World Health Organization (WHO) i tipi istologici più frequenti sono: il carcinoma a cellule squamose (SCC), l’adenocarcinoma (ADC), il carcinoma a piccole cellule (SCLC) ed il carcinoma a grandi cellule (LCC) (Travis W, 2004). Questa classificazione anatomopatolgica si basa sull’osservazione delle sezioni colorate con Ematossilina-Eosina dei preparati istologici ottenuti dai campioni chirurgici. Nella pratica clinica solo il 10-15% dei pazienti con tumore polmonare viene sottoposto ad
intervento chirurgico. L’applicazione della classificazione WHO sul tumore polmonare primitivo è quindi possibile solo in un numero limitato di casi. Per la maggior parte dei pazienti la diagnosi definitiva viene effettuata solo sulla base dei campioni citologici o bioptici e su tale diagnosi viene impostato il trattamento (Travis W, 1999).
Negli ultimi anni sono stati effettuati notevoli progressi nella ricerca farmacologica ed oncologica applicata ai tumori polmonari. Questo ha portato allo sviluppo di nuove chemioterapie personalizzate, la cui scelta si basa, in primis, sulla diagnosi istologica che deve essere più dettagliata possibile (Hirsh FR, 2008). La semplice distinzione dicotomica tra carcinoma polmonare a piccole cellule e carcinoma polmonare non a piccole cellule è quindi divenuta riduttiva. Per i carcinomi non a piccole cellule studi prospettici randomizzati hanno dimostrato una maggiore efficacia di nuovi farmaci chemioterapici e farmaci a bersaglio molecolare rispetto alle precedenti opzioni terapeutiche standard (Scagliotti GV, 2008). Inoltre una scelta di trattamento che prescinda dalle caratteristiche istologiche della neoplasia può determinare sia inefficacia che tossicità del trattamento stesso.
Per queste ragioni viene richiesta al patologo una accuratezza sempre maggiore nella tipizzazione e sottotipizzazione istologica delle neoplasie polmonari. Ad esempio tra i carcinomi non a piccole cellule è raccomandato al patologo di specificare se si tratti di un adenocarcinoma o di un carcinoma a cellule squamose, limitando il più possibile (al di sotto del 5%) il numero di casi diagnosticati come “carcinoma non a piccole cellule non ulteriormente specificabili (NSCLC-NOS)”. Tale diagnosi spesso si basa solo su materiale citologico e/o bioptico nei quali frequentemente, data l’esiguità delle cellule neoplastiche, mancano gli elementi morfologici specifici di ciascun istotipo. Data la sempre maggiore necessità, da parte del clinico, di diagnosi dettagliate è opportuno che nelle procedure non invasive si ottenga quanto più materiale possibile, così da evitare di sottoporre il paziente ad ulteriori procedure più invasive (Thomas JS, 1993; Edwards SL, 2000; Travis WD,
Disaccordo tra esperti nella diagnosi differenziale tra carcinoma non a piccole cellule e carcinoma a piccole cellule può interessare fino al 5-7% dei casi. Tra i numerosi fattori che sembrano determinare tale variabilità vi sono: campioni bioptici piccoli e lacerati, modificazioni ischemiche, difetti di fissazione e sezioni istologiche subottimali per spessore o colorazione eccessivi.
Tra i carcinomi non a piccole cellule la distinzione tra adenocarcinomi e carcinomi a cellule squamose può risultare ancora più difficoltosa per la scarsa cellularità dei campioni, la dispersione tra le cellule e gli artefatti da “crush” (Rekhtman N, 2011). Numerosi studi hanno analizzato l’utilità integrare i dati morfologici con quelli dell’analisi immunoistochimica. A tal proposito sono stati confrontati diversi pannelli di anticorpi, comprendenti da 4 a 6 anticorpi, applicati ai campioni citologici, alle piccole biopsie ed ai microarray tissutali.
La maggior parte degli studi sono stati condotti sui carcinomi non a piccole cellule ed hanno dimostrato che i due marker più specifici per gli adenocarcinomi ed i carcinomi a cellule squamose sono rispettivamente il fattore di trascrizione tiroideo (TTF-1) e la p63, i quali non sembrano quasi mai essere coespressi. Gli studi di validazione di altri marker non hanno ancora portato a conclusioni univoche. Data la scarsa cellularità dei campioni citologici e bioptici è necessario che il pannello di anticorpi sia il più possibile limitato considerando inoltre che è opportuno conservare parte del materiale per le analisi molecolari (Rekhtman N, 2011; Mukhopadhyay S, 2011; Pelosi G, 2011; Terry J, 2010; Righi L, 2011; Tsuta K, 2011; Ocque R, 2011).
In questo studio abbiamo valutato la concordanza e l’accuratezza nella sottotipizzazione dei carcinomi a piccole cellule e dei carcinomi non a piccole cellule, adenocarcinomi e carcinomi a cellule squamose, tra la diagnosi citologica e quella bioptica su campioni ottenuti durante la stessa procedura. L’accuratezza diagnostica della diagnosi preoperatoria è stata confrontata anche con la successiva diagnosi sul campione chirurgico, nei casi sottoposti ad intervento chirurgico. Abbiamo analizzato la frequenza di utilizzo delle indagini immunoistochimiche confrontando la specificità e l’accuratezza dei singoli marker all’interno di un selezionato pannello
anticorpale. Infine abbiamo valutato l’adeguatezza e l’affidabilità dell’applicazione delle indagini molecolari, per l’analisi dello stato mutazionale di EGFR e KRAS, ai campioni citologici e bioptici.
ALTERAZIONI GENICHE NELLE NEOPLASIE POLMONARI
Numerose alterazioni geniche sono state evidenziate nel tumore polmonare. La trasformazione della cellula normale a cellula neoplastica dipende da mutazioni di geni normalmente coinvolti nel ciclo cellulare, con conseguente perdita del controllo della proliferazione. Tra i geni coinvolti sicuramente p53 gioca un ruolo fondamentale, in quanto è stato dimostrato che mutazioni di tale gene possono determinare il perpetuarsi del danno al DNA.
Negli ultimi anni l’attenzione si è rivolta verso lo studio dei geni EGFR e K-RAS che sembrano coinvolti nell’insorgenza e nella progressione del tumore polmonare.
EGFR
EGFR, gioca un ruolo importante nello sviluppo, controllo, proliferazione, differenziazione e sopravvivenza cellulare. Un’aberrante attivazione del recettore è associata con la trasformazione neoplastica in molti tipi cellulari. EGFR è un membro della famiglia dei recettori di fattori di crescita tirosin chinasici quali: EGFr/ErbB-1, HER2/Erb-2, HER3/Erb-3 e HER4/ErbB-4, attivati da vari fattori di crescita; tale recettore è specifico per sei ligandi: il fattore di crescita epidermico (EGF), il fattore di crescita trasformante a (TGF-a), l’amfiregulina, l’epiregulina, la betacellulina e il fattore di crescita legante l’eparina. Questi recettori, insieme ai loro ligandi, sono considerati importanti nello sviluppo e progressione di molti tumori umani (Fig.).
Fig
EGFR è una glicoproteina transmembrana di 170 KDa e consiste di 3 domini: un dominio extracellulare, uno intracellulare e uno transmembrana. Il dominio extracellulare è composto da 621 aa e comprende a sua volta 4 regioni: la regione 1 che è importante nella dimerizzazione indotta dal ligando; la regione 2 e 4 che sono ricche in residui di cisteina e la regione 3 che rappresenta il sito di legame per EGF.
dall’estremità carbossi-terminale con 5 siti di autofosforilazione; il dominio tirosinchinasico del gene è codificato dagli esoni 18-21: dai dati presenti in letteratura, la maggior parte delle mutazioni sono state evidenziate a carico degli esoni 19 e 21. Il dominio transmembrana è infine formato da 24 aa e ha la funzione di connettere il dominio extra con quello intracellulare (Fickova; 2002) (Fig. ).
M
ECCANISMO D’
AZIONEDIEGFR
Il legame di EGFR al suo ligando, permette la trasmissione del segnale attraverso la membrana quindi l’attivazione dell’espressione genica e la risposta cellulare, come ad esempio la proliferazione (Fig.10). In seguito a questo legame si ha la formazione di omodimeri e eterodimeri con successiva cross-fosforilazione del recettore al livello dei residui di cisteina; in un secondo momento avviene l’attivazione di proteine citoplasmatiche che stimolano differenti cascate di trasduzione del segnale, come la via delle MAP chinasi (MAPK), la fosfoinositol chinasi, la chinasi antiapoptotica Akt
e molti tipi di proteine regolatorie Infine il segnale viene inattivato attraverso l’endocitosi del complesso ligando/recettore che viene poi degradato o riciclato sulla superficie cellulare (Yarden 2001) (Fig.11).
M
UTAZIONI DIEGFR
E RISPOSTAALLATERAPIAIl gene EGFR risulta essere normalmente espresso in molti tipi di cellule, come ad esempio le cellule epiteliali e mesenchimali; diversi studi riportano una iperespressione di EGFR in differenti neoplasie, quali tumori testa-collo, utero, ovaio, colon, mammella, pancreas, e il tumore polmonare non a piccole cellule (Herbst R.S. et al., 2002; Mendelsohn et al., 2003; Nicholson R.I. et al., 2001; Mok T.S. et al., 2009). Il coinvolgimento di EGFR nello sviluppo tumorale ha portato alla messa a punto di farmaci che inibiscono l'EGFR stesso tra cui Cetuximab (anticorpo monoclonale) e Gefitinib (inibitore del dominio tirosino chinasico del recettore). Né l’espressione né lo stato di fosforilazione del recettore sembrano influenzare la risposta al trattamento con Gefitinib in pazienti NSCLC. Numerosi studi hanno invece evidenziato che la presenza di specifiche mutazioni dell’EGFR potrebbe conferire una maggiore sensibilità al farmaco. In particolare le mutazioni specifiche del dominio tirosinochinasico di EGFR (esoni 18, 19, 20 e 21) sembrano predire una risposta positiva alla terapia con i farmaci inibitori (Mitsudomi et al, 2010; Maemondo et al, 2010). Tra gli altri due studi condotti in Giappone e Taiwan (l'incidenza di mutazioni di EGFR è maggiore in Asia rispetto ai paesi occidentali)
suggeriscono che le mutazioni dell'esone 19 di EGFR conferiscano una maggiore sensibilità alla terapia rispetto alle mutazioni degli esoni 20 e 21 (Chou et al, 2005; Mitsudomi et al, 2005). Queste mutazioni sono più frequenti in una sottopopolazione di pazienti con carcinoma polmonare non a piccole cellule (NSCLC): donne, non fumatrici, portatrici di adenocarcinomi ed in particolare di sottotipo bronchioloalveolare (Giaccone, 2005; Janne et al, 2005). Tuttavia una piccola percentuale di pazienti con NSCLC portatori delle mutazioni di EGFR non rispondono alla terapia con inibitori tirosin-chinasici mentre alcuni pazienti che rispondono alla terapia con Gefitinib presentano un EGFR wild-type (Fukuoka et al, 2003; Kris et al, 2003). Queste osservazioni inducono ad ottimizzare le procedure di valutazione dello stato mutazionale di EGFR ma anche a cercare ulteriori markers per l'identificazione dei pazienti potenzialmente sensibili alle terapie anti-EGFR (Fig).
K-RAS
Dati recenti suggeriscono l’esistenza di due vie distinte coinvolte nella patogenesi del tumore polmonare; da una parte mutazioni del dominio tirosin-chinasico del gene EGFR, dall’altra mutazioni del gene K-RAS.
La famiglia degli oncogeni Ras (N-Ras, H-Ras, K-Ras) codifica per una proteina di 21-Kd con attività GTPasica. Le proteine Ras svolgono un importante ruolo nella via di trasduzione del segnale cellulare, stimolando la crescita e la differenziazione.
Mutazioni nei codoni 12, 13 e 61 prevengono l’inattivazione di p21 portando ad una proteina costantemente attiva e ad una continua trasmissione del segnale, che determina una proliferazione cellulare impropria. (Rodenhuis 1992; Huncharek et al.,1999; Hatzachi et al 2001). Numerosi lavori evidenziano che mutazioni a livello dell’esone 2 del gene, sono frequenti nel tumore polmonare, pancreatico e del colon e sembrano avere un impatto prognostico (Hatzachi et al 2001).
Mutazioni di K-RAS sembrano essere associate al fumo di sigaretta ed essere comuni nel sesso femminile e nell’adenocarcinoma e sono state trovate in pazienti ch presentano progressione del tumore nonostante la terapia con Gefitinib ed Erlotinib.
Numerosi studi hanno dimostrato che le mutazioni dei due geni K-RAS ed EGFR sono mutualmente esclusive nell’adenocarcinoma del tumore polmonare; questi risultati suggeriscono che la presenza di mutazioni del gene K-RAS potrebbe essere un potenziale meccanismo della resistenza agli inibitori di EGFR (Janne et al., 2005).
ASPETTI ISTOLOGICI
La classificazione istologica del tumore del polmone fu per la prima volta pubblicata dall'Organizzazione Mondiale della Sanità nel 1968 e successivamente rivista nel 1981. Quella che segue è l’ultima classificazione pubblicata ufficialmente, proposta da Travis et al. (2004) e pubblicata su “ Pathology and Genetics of Tumours of the Lung, Pleura, Thymus and Heart”.
Questa classificazione è il punto di partenza del lavoro concluso nel 2011 dall’International Association for the Study of Lung Cancer insieme all’American Thoracic Society ed all’European Respiratory Society di revisione della classificazione degli adenocarcinomi polmonari.
LESIONI PRE-INVASIVE
Il tumore del polmone sembra essere il risultato di un processo di carcinogenesi multisteps in cui i cambiamenti molecolari accompagnano o precedono i cambiamenti istologici. Questo supporta il concetto di “field cancerization” che riflette il fatto che l'intero epitelio broncoalveolare è il bersaglio per l'azione dei cancerogeni. I cambiamenti genetici, per la loro specificità e sensibilità, si prestano ad essere markers di premalignità, purchè vengano mantenuti nelle lesioni francamente maligne.
Lo studio istologico delle lesioni preinvasive è essenziale per la diagnosi precoce nello screening dei pazienti ad alto rischio. L’utilizzo di moderne tecniche quali la broncoscopia a fluorescenza e la TAC spirale, in virtù della loro grande sensibilità, può essere di notevole ausilio nell’identificazione di tali lesioni, da sottoporre, in seguito, a caratterizzazione istologica grazie ad esami quali: l’esame citologico dell’espettorato, la broncoscopia (con prelievi bioptici, lavaggio o brushing bronchiale ed agoaspirazione transbronchiale) ed agobiopsia polmonare transparietale eco/TC-guidata.
Figura 1 – Immagini di broncoscopia a fluorescenza di tumori polmonari.
D
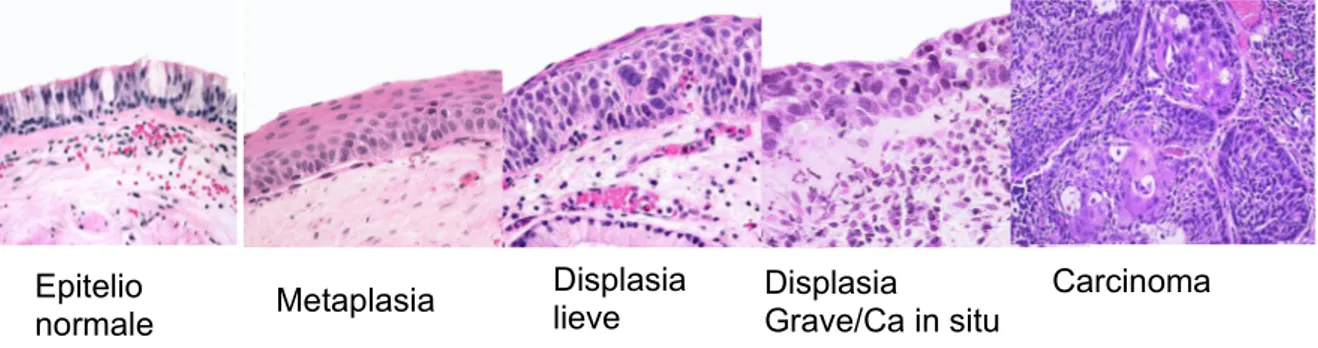
ISPLASIASQUAMOSAE CARCINOMAIN SITULa trasformazione morfologica della mucosa bronchiale normale avviene attraverso uno spettro continuo di lesioni che include: metaplasia squamosa, displasia lieve moderata e severa, carcinoma in situ. La displasia squamosa è distinta in lieve, moderata e severa a seconda che interessi rispettivamente il terzo basale, i due terzi basali o l'intero spessore del rivestimento epiteliale. Il carcinoma in situ interessa tutto lo spessore epiteliale, presenta spiccate atipie citologiche e si differenzia dalla displasia severa per l'assenza di visibile maturazione ed orientamento baso-apicale delle cellule.
Figura 2 – Sequenza istologica di sviluppo del carcinoma a cellule squamose.
I
PERPLASIAALVEOLAREATIPICAQuesta è una lesione millimetrica (spesso è minore di 5 mm e multifocale) considerata essere uno stato preinvasivo del carcinoma bronchioloalveolare. Consiste in una proliferazione focale di cellule epiteliali lievemente atipiche, cubiche o colonnari basse, lungo le pareti alveolari e i bronchioli respiratori. I setti alveolari possono essere assottigliati e presentare infiltrazione linfoide.
Epitelio normale Metaplasia Displasia Grave/Ca in situ Carcinoma Displasia lieve
Figura 3 –Iperplasia alveolare atipica.
I
PERPLASIAIDIOPATICA DIFFUSADICELLULE NEUROENDOCRINE POLMONARISi pensa che questa rara condizione sia il precursore delle neoplasie polmonari di natura neuroendocrina. Interessa le vie aeree periferiche a livello dei bronchioli terminali e respiratori ed è caratterizzata da un'iperplasia lineare di cellule neuroendocrine presenti normalmente nel rivestimento epiteliale delle vie aeree.
LESIONI INVASIVE
-Carcinoma a cellule squamosepapillare a cellule chiare a piccole cellule basaloide -Adenocarcinoma acinare papillare
bronchioloalveolare (mucinoso/ non mucinoso/ combinato o indeterminato)
solido con produzione di mucina (fetale/ mucinoso colloidale/ ad anello con castone/ a cellule chiare/ cistoadenocarcinoma colloidale)
-Carcinoma a piccole cellule (SCLC) a piccole cellule
-Carcinoma a grandi cellule
carcinoma neuroendocrino a grandi cellule (LCNEC) carcinoma basaloide
carcinoma linfoepitelioma simile carcinoma a cellule chiare
carcinoma a grandi cellule con fenotipo a bastoncello -Carcinoma adenosquamoso
-Carcinoma sarcomatoide
carcinoma pleomorfo carcinoma a cellule fusate carcinoma a cellule giganti carcinosarcoma blastoma polmonare -Carcinoide tipico atipico
C
ARCINOMAACELLULE SQUAMOSEI sottotipi sono: papillare, a cellule chiare, a piccole cellule e basaloide.
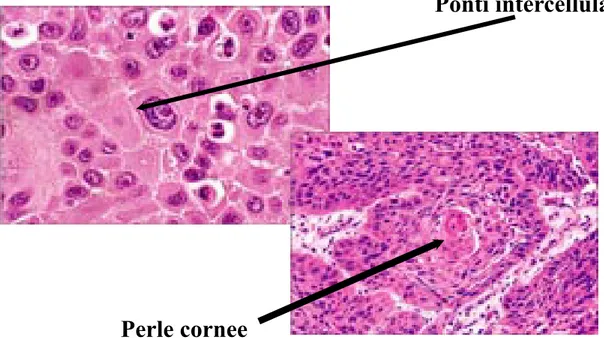
Il carcinoma a cellule squamose rappresenta globalmente circa il 30% dei tumori del polmone negli USA e il 45% in Europa, dove la sua incidenza si è progressivamente ridotta parallelamente all'aumento di incidenza dell' adenocarcinoma. Due terzi dei casi sono tumori centrali ad insorgenza dai bronchi principali o lobari, mentre solo un terzo origina perifericamente dai bronchi segmentali. Rispetto alle altre neoplasie polmonari il carcinoma squamoso presenta un accrescimento più lento e la tendenza più tardiva all'invasione metastatica. Le caratteristiche morfologiche della differenziazione squamosa, ben evidenti quindi nei tumori altamente differenziati, sono i ponti intercellulari e la cheratinizzazione (di
non sembra correlare con la prognosi.
La maggior parte dei carcinomi squamosi esprime citocheratine ad alto peso molecolare (riconosciute dagli anticorpi AE1/AE3, KL1, 34bE12, anti-citocheratine 5-6), pochi esprimono la citocheratina 7 e nessuno esprime il fattore di trascrizione tiroideo 1 (TTF-1)
Figura 4 – Carcinoma a cellule squamose.
A
DENOCARCINOMAI sottotipi sono: acinare, papillare, bronchioalveolare (mucinoso, non mucinoso e misto o indeterminato), solido, con sottotipi misti e altre varianti (fetale ben differenziato, mucinoso colloidale, cistoadenocarcinoma colloidale, ad anello con castone, a cellule chiare).
L'adenocarcinoma rappresenta globalmente circa il 40% dei tumori del polmone in Europa ed USA.
La maggior parte degli adenocarcinomi sono istologicamente eterogenei, contengono cioè due o più sottotipi: infatti l'80% di essi è classificabile come
Perle cornee
sottotipo misto. Questo istotipo insorge più frequentemente in sede periferica, a partire dalle cellule epiteliali e, meno frequentemente, dalle cellule ghiandolari; la sua patogenesi è legata al fumo di sigaretta o a reliquati cicatriziali di pregressi processi patologici parenchimali.
Il carcinoma bronchioloalveolare (BAC), secondo la classificazione del WHO/International Association for the Study of Lung Cancer (1999), è definito come un tumore caratterizzato da una crescita prevalente lungo i setti alveolari conservati, con contorni intatti delle lamine elastica e basale, senza crescita invasiva e senza infiltrazione pleurica. Secondo questa definizione questo tumore può essere condsiderato un carcinoma in situ in sede alveolare. E' frequente osservare cicatrici centrali nell'adenocarcinoma polmonare che contiene componenti invasive e un pattern focale di tipo BAC alla periferia del tumore. Più del 50% dei tumori precedentemente chiamati BAC presentano tessuto cicatriziale desmoplastico centrale o una crescita papillare complessa intraalveolare mentre la crescita endoalveolare è presente al bordo della cicatrice. Per i tumori che mostrano nidi di cellule tumorali maligne in una reazione desmoplastica stromale centrale la diagnosi è di adenocarcinoma a sottotipo misto (questi non possono più essere considerati BAC). Secondo la classificazione del WHO/ IASLC (1999), una diagnosi definitiva di BAC può essere formulata solo dallo studio di un campione da resezione chirurgica. Piccole biopsie ottenute con broncoscopia o prelievi con ago sottile possono mostrare un pattern di crescita endoalveolare che suggerirebbe la possibilità di un BAC, ma non sono sufficienti per escludere la presenza di una crescita invasiva. Clinicamente il BAC insorge con relativa frequenza in giovani, donne e non fumatrici.
Le caratteristiche immunoistochimiche dell'adenocarcinoma possono variare in base al loro sottotipo istologico. Tutti gli adenocarcinomi esprimono i markers epiteliali: citocheratine, antigene epiteliale di membrana (EMA), antigene carcinoembrionario (CEA). Fra le citocreatine, la Ck 7 è quasi sempre espressa, mentre la Ck 20 lo è raramente eccetto per il tipo BAC mucinoso che è spesso Ck 20
TTF/1 è espresso nell'85% degli adenocarcinomi; i carcinomi mucinosi sono quasi sempre negativi.
La deregolazione di oncogeni e geni oncosoppressori è simile a quella osservata negli altri tumori del polmone non a piccole cellule ad eccezione della mutazione di Ras che è pressochè limitata all'adenocarcinoma e più caratteristica del suo tipo periferico. La diagnosi differenziale tra l'adenocarcinoma polmonare primitivo e l'adenocarcinoma colico metastatico non può basarsi sulla positività del Ck20 e sull'espressione del gruppo genico CdX2 perchè entrambi sono espressi nei due tumori. Una distinzione fra l'adenocarcinoma polmonare e il mesotelioma epiteliomorfo maligno come tumore periferico si basa su differenze fenotipiche; anche se il primo esprime il TTF-1 ed il secondo non lo esprime. Il mesotelioma, a differenza dell'adenocarcinoma, esprime la calretinina e la citocheratina 5-6; per la distinzione sono utili anche i markers generali dell'adenocarcinoma (CEA, CD15, BerEP-4).
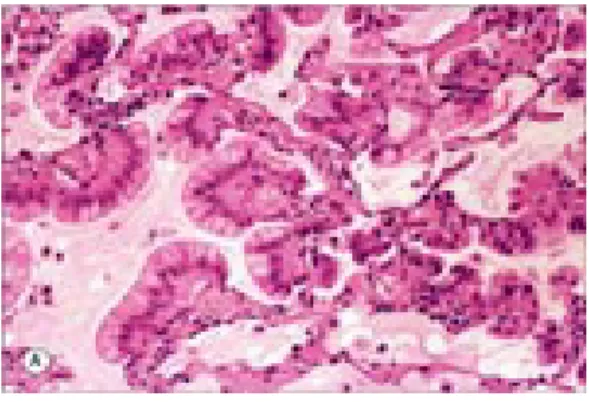
Figura 6 – Esempi di adenocarcinoma papillare
C
ARCINOMAAPICCOLE CELLULE(SCLC)
I sottotipi, secondo la classificazione del WHO/IASLC(1999), sono due: carcinoma a piccole cellule e carcinoma a piccole cellule combinato (se presenti istotipi non a piccole cellule).
Il carcinoma a piccole cellule rappresenta il 25% dei tumori polmonari in Europa e USA; due terzi di essi sono prossimali e si presentano come tumori periilari. Il microcitoma è in assoluto l'istotipo di tumore polmonare dotato di maggior tendenza alla diffusione a distanza, sia per via linfatica che per via ematica.
Il carcinoma polmonare a piccole cellule ha un aspetto istologico distintivo. Le cellule tumorali sono piccole, di forma tonda o fusiforme, con scarso citoplasma (rapporto nucleo\citoplasma di 9\10), cromatina nucleare finemente granulare e nucleoli assenti o poco evidenti. Per la scarsità di citoplasma è frequente la rottura del nucleo e la dispersione della cromatina causate da un artefatto da schiacciamento. Spesso ci sono necrosi estese ed un tasso mitotico oltre le 20 e fino a 100 mitosi per 2 mm². Il pattern di crescita più frequente è in nidi diffusi anche se possono esserci differenziazioni endocrine con rosette, nastri, cellule a palizzata e nidi a crescita organoide.
Le caratteristiche immunoistochimiche dell'SCLC sono fondamentali per la sua diagnosi. La distinzione più importante, per le sue implicazioni terapeutiche, è tra carcinoma polmonare a piccole cellule e non a piccole cellule. I markers neuroendocrini più specifici ed utili per l’SCLC sono la cromogranina A, la sinaptofisina e le molecole di adesione delle cellule neurali (NCAM). Il 95% degli SCLC sono reattivi con gli anticorpi NCAM presentando un tipico pattern di membrana: questo sembra essere il marker più specifico per distinguere l’SCLC dal NSCLC. Le cheratine (AE-1\AE-3) e l' EMA colorano rispettivamente l'85% degli
SCLC, mentre un set specifico di citocheratine (CK1,5,10,14), riconosciute dall'anticorpo 34βE12, non è mai espresso dall'SCLC puro. La reattività con tale anticorpo può quindi essere utilizzata per differenziare il sottotipo combinato da quello puro di SCLC. Il TTF-1 è espresso nell'85% degli SCLC; numerosi casi inoltre esprimono l'antigene Mic2/CD99 ed il C-kit/CD117.
Il carcinoma a piccole cellule combinato è per definizione un SCLC associato con almeno il 10% di componente NSLC, in ordine di frequenza con carcinoma a grandi cellule, adenocarcinoma ed infine carcinoma a cellule squamose. Sembra che l’SCLC combinato sia circa il 28% di tutti i casi di SCLC. L'immunoistochimica può esser utile nel riconoscere le possibili componenti associate, ad esempio l'anticorpo 34βE12 (specifico per le citocheratine CK1, 5, 10, 14) è in grado di marcare le componenti di NSCLC. Ad oggi non sembrano,comunque, esserci differenze in termini di prognosi e risposta alla terapia tra i due sottotipi di SCLC.
Figura 7 Carcinoma a piccole cellule
C
ARCINOMAAGRANDI CELLULEIl carcinoma a grandi cellule è un tumore poco differenziato che non mostra nessun pattern tra quelli del carcinoma a cellule squamose, dell’ adenocarcinoma o del carcinoma a piccole cellule. Questo vale per l'osservazione al microscopio ottico, mentre alla microscopia elettronica possono essere trovati aspetti eterogenei. Il carcinoma a grandi cellule è un tumore spesso periferico, grande e necrotico. Istologicamente è costituito da strati o nidi di grandi cellule poligonali con nuclei vescicolari e nucleoli prominenti.
carcinoma a grandi cellule che sembra essere associato ad una peggior prognosi. I criteri istologici per la sua diagnosi includono: 1)- morfologia neuroendocrina (pattern di crescita a rosette, trabecolare, organoide o con cellule a palizzata) 2)- caratteri citologici a cellule non piccole (cellule grandi, poligonali, con basso rapporto nucleo\citoplasma, cromatina nucleare vescicolare o grossolana, nucleoli evidenti) 3)- elevato indice mitotico (> 11 per 2 mm², con una media di 60 per 2 mm²) 4)- necrosi frequenti 5)- almeno un marker immunoistochimico neuroendocrino specifico positivo o granuli neuroendocrini alla microscopia elettronica. Il 90% dei LCNEC esprime NCAM oltre al pattern morfologico neuroendocrino tipico, e molti di essi esprimono cromograninaA e\o sinaptofisina. Metà dei LCNEC esprimono il TTF-1, mentre CK1- 5- 10- 14 (34βE12) non è mai espresso nel LCNEC puro ma lo è nei suoi tipi combinati. È difficile diagnosticare un LCNEC con campioni bioptici piccoli, cioè senza un campionamento esteso del tumore, per la frequente assenza della morfologia neuroendocrina.
Il carcinoma basaloide è il secondo sottotipo in ordine di frequenza dopo il LCNEC. Questo rappresenta il 3-4% dei carcinomi polmonari non a piccole cellule e colpisce tipicamente i maschi fumatori. Cresce spesso nei bronchi prossimali con una componente endobronchiale ed origina da ampie aree di mucosa bronchiale con carcinoma in situ. Il pattern di crescita è lobulare, trabecolare o a palizzata; le cellule sono piccole, monomorfe, cubiche o fusiformi, con nuclei moderatamente ipercromatici, cromatina finemente dispersa e nucleoli assenti o solo focalmente evidenti, scarso citoplasma e con un rapporto nucleo\citoplasma minore rispetto al carcinoma pomonare a piccole cellule; l’indice mitotico è elevato (da 20 a 100 mitosi per 2 mm²). Il carcinoma basaloide ha una prognosi peggiore rispetto al carcinoma a cellule squamose scarsamente differenziato e può esser da esso distinto per l'assenza di ponti intercellulari e di cheratinizzazione cellulare. L'immunoistochimica consente la diagnosi differenziale tra il carcinoma neuroendocrino a grandi cellule ed il carcinoma basaloide : specifica del primo è l'espressione di TTF-1 (sempre assente nel secondo), specifica del secondo quella di CK1, 5, 10, 14 (34bE12) (sempre
assente nel primo).
C
ARCINOMAADENOSQUAMOSOIl carcinoma adenosquamoso rappresenta lo 0,6- 2,3% dei carcinomi polmonari e per la sua definizione è necessaria la presenza di almeno il 10% di componenti a cellule squamose o di adenocarcinoma. Importante è non confondere questo tumore con il carcinoma mucoepidermoide che è caratterizzato dalla presenza di cellule squamose, cellule mucosecernenti e cellule di tipo intermedio (in analogia agli stessi tumori delle ghiandole salivari). Il carcinoma mucoepidermoide ad alto grado di malignità si distingue dall'adenocarcinoma per varie caratteristiche fra cui una mescolanza di cellule a contenuto mucoso e cellule squamose, aree di transizione dal carcinoma mucoepidermoide classico a basso grado e l'assenza di cheratinizzazione.
C
ARCINOMASARCOMATOIDEI sottotipi sono: carcinoma con cellule fusate e\o giganti (carcinoma pleomorfo, carcinoma a cellule fusate, carcinoma a cellule giganti), ca rcinosarcoma, blastoma polmonare ed altri.
Questi tumori sono scarsamente differenziati ed esprimono le caratteristiche ed il comportamento biologico di cellule epiteliali che possono assumere un atteggiamento evolutivo tipico dei sarcomi.
I carcinomi pleomorfi sono spesso grandi tumori periferici con invasione bronchiale e crescita endobronchiale, possono arrivare ad invadere la parete toracica con pessima prognosi. Per la loro diagnosi istologica , che richiede un ampio campionamento (almeno una sezione per centimetro del diametro tumorale), è necessaria la presenza di almeno un 10% di componente a cellule fusate o giganti associata con altri tipi istologici, come il carcinoma a cellule squamose o l'adenocarcinoma. Caratteristica comune ai carcinomi sarcomatoide e pleomorfo è una pessima prognosi già allo stadio 1.
dalle cellule epiteliali polmonari: il TTF-1 è espresso nel 40% di essi, il Ck7 è positivo, mentre il Ck20 è negativo.
C
ARCINOIDII sottotipi sono: carcinoide tipico ed atipico; globalmente rappresentano l'1-2% dei tumori maligni polmonari. Istologicamente sono caratterizzati da un pattern di crescita endocrino di tipo organoide e da aspetti citologici uniformi: moderata eosinofilia, citoplasma finemente granulare, cromatina nucleare finemente granulare e nucleoli poco evidenti o discretamente evidenti nei carcinoidi atipici. Una varietà di patterns istologici può presentarsi nei carcinoidi tipici ed atipici, tale varietà include: pattern trebecolare, a palizzata periferica, a rosette, papillare, papillare sclerosante, ghiandolare, paragangliomatoso, a cellule fusate e follicolare.
Le caratteristiche maggiormente distintive tra i carcinoidi tipici e quelli atipici sono relative all'indice mitotico ed alla presenza o assenza di necrosi. I carciniodi tipici mostrano meno di 2 mitosi per mm² e non hanno necrosi; quelli atipici mostrano tra 2 e 10 mitosi per mm² e\o possono avere aree di necrosi (solitamente piccoli foci centrali all'interno di nidi organoidi di cellule tumorali).
I markers neuroendocrini necessari per la diagnosi dei carcinoidi sono: cromogranina, sinaptofisina, NCAM etc. I carcinodi non esprimono il TTF-1 a differenza dei tumori neuroendocrini di alto grado, LCNEC ed SCLC.
NUOVA CLASSIFICAZIONE DEGLI ADENOCARCINOMI
L’adenocarcinoma è l’istotipo più frequente tra le neoplasie primitive del polmone. Nel 2011 si è concluso uno studio multidisciplinare condotto dall’International Association for the Study of Lung Cancer insieme con l’American Thoracic Society e l’European Respiratory Society. Questo studio è terminato con la stesura di una nuova classificazione degli adenocarcinomi polmonari.
Lo scopo del lavoro è stato quello di fornire un nuovo approccio integrato clinico, radiologico, molecolare e anatomo-patologico alla classificazione degli adenocarcinomi polmonari che possa definire nuove categorie con distinte caratteristiche cliniche, radiologiche, molecolari e anatomo-patologiche. Ciascuna categoria è associata a specifici fattori prognostici e costituisce uno specifico target terapeutico.
La necessità di un approccio multidisciplinare alla classificazione dell’adenocarcinoma polmonare deriva dall’esistenza di due vaste aree di interazione tra specialisti (anatomopatologo, oncologo, radiologo e biologo molecolare):
Nei pazienti con carcinomi non a piccole cellule avanzati i recenti progressi
nella biologia molecolare e nell’oncologia hanno portato a:
o La scoperta delle mutazioni di epidermal growth factor receptor (EGFR)
ed il loro ruolo predittivo della risposta alla terapia con inibitori tirosino-chinasici (TKIs) di EGFR nei pazienti con adenocarcinoma
o La necessità di escludere la diagnosi di carcinoma a cellule squamose per
valutare l’eligibilità al trattamento con pemetrexed (per la miglior efficacia nell’adenocarcinoma) o bevacizumab (per la tossicità nel carcinoma a cellule squamose)
La scoperta di una correlazione tra aspetti radiologici ed anatomopatologici tra
invasiva all’esame istologico
La nuova classificazione riguarda sia i pezzi operatori che le piccole biopsie ed i campioni citologici.
CLASSIFICAZIONE DEI CAMPIONI CHIRURGICI
LESIONI PREINVASIVE
I
PERPLASIAADENOMATOSAATIPICA(AAH)
L’iperplasia adenomatosa atipica era già riconosciuta nella classificazione WHO, sia del 1999 che del 2004, come una lesione preinvasiva dell’adenocarcinoma polmonare. Numerosi studi hanno dimostrato la presenza di questa lesione nel parenchima polmonare adiacente in una percentuale di adenocarcinomi polmonari tra il 5 ed il 23% e la condivisione delle caratteristiche molecolari tra AAH ed adenocarcinoma (ad es: mutazioni di EGFR e K-ras, espressione di p53 etc).
L’iperplasia adenomatosa atipica è una proliferazione localizzata, piccola (dimensione massima solitamente inferiore o uguale a 0,5 cm), di pneumociti di II tipo e/o cellule di Clara lievemente o moderatamente atipiche che rivestono le pareti alveolari e talvolta i bronchioli respiratori. Tra le cellule si vedono degli spazi, le cellule sono tonde, cubiche, colonnari basse con nuclei tondi o ovali. Frequenti sono le inclusioni intranucleari. Sebbene nei casi di AAH sia presente uno spettro di cellularità ed atipie non è raccomandato l’uso di un grading di queste lesioni (Figura 1).
Figura 1
A
DENOCARCINOMAIN SITU(AIS)
Questa entità non era presente nelle precedenti classificazioni. I pazienti con questa lesione hanno una percentuale di sopravvivenza libera da malattia del 100% se la lesione viene escissa completamente. Facendo un parallelo tra le lesioni preinvasive dell’adenocarcinoma e quelle del carcinoma a cellule squamose l’iperplasia adenomatosa atipica corrisponde alla displasia squamosa e l’adenocarcinoma in situ al carcinoma a cellule squamose in situ. Per entrambi i tipi di neoplasie esiste un continuum morfologico e molecolare tra le due lesioni preinvasive e tra il carcinoma in situ ed il carcinoma invasivo.
L’adenocarcinoma in situ è un adenocarcinoma localizzato, piccolo (dimensione massima inferiore o uguale a 3 cm) con crescita delle cellule neoplastiche esclusivamente lungo le strutture alveolari preesistenti (crescita lepidica), senza invasione stromale, vascolare o pleurica. Non presenta mai pattern papillare o micro papillare né cellule tumorali intraalveolari. Le atipie nucleari sono assenti o lievi.
Esistono due sottotipi di AIS:
Non mucinoso: è il sottotipo prevalente; è composto da pneumociti di II tipo o
cellule di Clara (Figura 2)
Mucinoso: molto raro; è compsto da cellule colonnari alte con nucleo basale ed
Figura 2
Figura 3
LESIONI INVASIVE
A
DENOCARCINOMAMINIMAMENTE INVASIVO(MIA)
Anche questa è un’entità che non era presente nelle classificazioni precedenti. Le caratteristiche prognostiche del MIA sono sovrapponibili a quelle dell’AIS: sopravvivenza libera da malattia circa del 100% se la lesione viene escissa completamente.
(dimensione massima inferiore o uguale a 3 cm), con un pattern di crescita prevalentemente lepidico ed una profondità di invasione inferiore o uguale a 5 mm in ciascun campo. La componente invasiva del MIA è definita come: sottotipi istologici diversi dal pattern lepidico (ad es: acinare, papillare, micro papillare o solido) o cellule tumorali singole infiltranti lo stroma miofibroblastico. Se sono presenti multiple aree di microinvasione la dimensione massima dell’area più grande deve essere inferiore o uguale a 5 mm (non và eseguita la somma delle dimensioni delle diverse aree). L’adenocarcinoma minimamente invasivo è per definizione solitario, una diagnosi di MIA può essere fatta in presenza di lesioni multiple solo se gli altri tumori sono considerati essere sincroni e non metastasi intrapolmonari.
La diagnosi di MIA è esclusa se il tumore:
Infiltra vasi ematici e/o linfatici o la pleura Contiene foci di necrosi
Anche di MIA esistono due sottotipi:
Non mucinoso: è il più frequente (Figura 4) Mucinoso: raro
Figura 4
A
DENOCARCINOMAINVASIVOGli adenocarcinomi invasivi rappresentano tra il 70 ed il 90% dei tumori polmonari asportati chirurgicamente. La maggior parte degli adenocarcinomi polmonari sono costituiti da un insieme complesso ed eterogeneo di sottotipi istologici. Questa nuova classificazione prevede di descrivere per ciascuna neoplasia quali siano i pattern di crescita presenti, registrando in modo semiquantitativo la percentuale per ciascun pattern se la differenza tra di esse è di almeno il 5%, e tra questi quale sia quello prevalente. Ciascun tumore viene quindi classificato in base al pattern di crescita prevalente, per il suo importante significato prognostico, ed ai diversi pattern presenti specificando le relative percentuali. In questa classificazione non compare più la dicitura “adenocarcinoma sottotipo misto”. Nei pazienti con adenocarcinomi polmonari multipli questa sottotipizzazione istologica può facilitare il confronto tra le diverse neoplasie, ciascuna con il proprio insieme eterogeneo di pattern istologici, per stabilire se queste siano metastasi o neoplasie primitive sincrone o metacrone.
Adenocarcinoma con pattern predominante di crescita lepidico
Questa neoplasia è costituita da pneumociti di II tipo e/o cellule di Clara che crescono lungo le pareti alveolari con morfologia simile a quella descritta per AIS e MIA. L’adenocarcinoma con pattern predominante di crescita lepidico è un adenocarcinoma non mucinoso che abbia come componente predomiante quella lepidica.Per definizione deve essere presente almeno un’area di adenocarcinoma infiltrante che misuri nella sua dimensione massima più di 5 mm. Questa componente invasiva è definita come: sottotipi istologici diversi dal pattern lepidico (ad es: acinare, papillare, micropapillare o solido) o cellule tumorali singole infiltranti lo stroma miofibroblastico. Questa diagnosi viene fatta anche se il tumore: infiltra i vasi ematici e/o linfatici o la pleura o se contiene foci di necrosi (Figura 5).
Questo sottotipo sembra essere associato ad una prognosi migliore.
Figura 5
Adenocarcinoma con pattern predominante di crescita acinare
La componente più rappresentata è formata da ghiandole di forma rotonda o ovale con lume centrale cirondato da cellule tumorali (acini). Sia le cellule neoplastiche che i lumi ghiandolari possono contenere mucina. Le strutture acinari possono anche essere composte da aggregati rotondi di cellule tumorali con polarizzazione nuclearepossibili aspetti del pattern acinare (Figura 6).
Figura 6
Adenocarcinoma con pattern predominante di crescita papillare
La componente prevalente è formata da cellule ghiandolari che crescono intorno ad un asse centrale fibrovascolare. Se il tumore ha una crescita lepidica ma gli spazi alveolari contengono strutture papillari viene classificato come adenocarcinoma papillare (Figura 7, riquadro a destra).Adenocarcinoma con pattern predominante di crescita micro papillare
La componente prevalente è formata da cellule tumorali che crescono in strutture simil-papillari in cui manca un asse fibrovascolare. Queste pseudo-papille possono essere o meno ancorate alle pareti alveolari. Le cellule tumorali sono piccole, cubiche, con atipie nucleari lievi. È possibile trovare strutture ghiandolari ad anello immerse negli spazi alveolari. Frequentemente mostra invasione vascolare e stromale; possono inoltre essere presenti corpi psammomatosi (Figura 7, riquadro a sinistra).Figura 7
Adenocarcinoma con pattern predominante di crescita solido con
produzione di mucina
La componente prevalente è formata da cellule tumorali poligonali che formano strati in cui mancano i pattern tipici dell’adenocarcinoma, ad es: acini, papille, micro papille o crescita lepidica. Se il tumore è solido per il 100% la mucina intracellulare deve essere presente in almeno cinque cellule tumorali in ciascun campo valutando due campi ad alto ingrandimento. Nella diagnosi differenziale vanno considerati il carcinoma a cellule squamose ed il carcinoma a grandi cellule, entrambi con crescita solida e con possibile mucina intracellulare (Figura 8).
Anche il pattern di crescita solido sembra essere associato ad una prognosi peggiore.
Figura 8
V
ARIANTIDELL’
ADENOCARCINOMAINVASIVOAdenocarcinoma invasivo mucinoso
Questa neoplasia è composta da cellule tumorali colonnari o goblet con abbondante mucina intracitoplasmatica. Le atipie citologiche sono assenti o lievi. Gli spazi alveolari contengono spesso mucina. Questa neoplasia può presentare gli stessi pattern eterogenei di crescita dell’adenocarcinoma non mucinoso: lepidico, acinare, papillare, micropapillare e solido. Non viene raccomandato di specificare quale sia il pattern prevalente e quali siano le percentuali degli altri pattern presenti, in quanto non è ancora chiaro quale sia il significato clinico di questa descrizione. Spesso questa neoplasia si presenta multifocale, multilobare o bilaterale (Figura 9).
Nella classificazione precedente esisteva il “carcinoma bronchiolo alveolare (BAC)” mucinoso e non mucinoso, questa entità è stata eliminata nella nuova classificazione. Il concetto di BAC si ritrova, nella nuova classificazione, nel concetto di crescita lepidica: a seconda dei criteri suddetti l’ex BAC diventa AIS (mucinoso e non mucinoso), MIA (mucinoso e non mucinoso), adenocarcinoma invasivo mucinoso ed adenocarcinoma con pattern predominante di crescita lepidico.
La distinzione tra adenocarcinoma invasivo mucinoso e gli adenocarcinomi non mucinosi si basa sull’evidenza che “l’adenocarcinoma invasivo mucinoso” sia un’entità a se stante. Questa distinzione si basa su differenze cliniche, radiologiche, patologiche e genetiche. All’analisi immunoistochimica questa neoplasia mostra positività per CK20 (nel 54% dei casi) e negatività per TTF-1 (nell’83% dei casi). Alle analisi mutazionali mostra frequentemente mutazioni di K-ras (nel 76% dei casi) e raramente mutazioni di EGFR (wild type nel 97% dei casi).
“L’adenocarcinoma misto mucinoso e non mucinoso”, per definizione costituito da almeno un 10% di entrambe le componenti, è un’entità rara.
Depone per una diagnosi di adenocarcinoma invasivo mucinoso rispetto a quella di AIS o MIA mucinosi la presenza di uno o più tra i seguenti elementi:
Dimensione superiore a 3 cm Invasione superiore a 5 mm Noduli multipli
Assenza di bordi circoscritti con diffusione miliare nel parenchima polmonare
adiacente
Figura 9
Adenocarcinoma colloidale
Questa neoplasia contiene mucina extracellulare in ampi laghi che distendono gli spazi alveolari con distruzioni delle pareti alveolari. Tali laghi di mucina contengono gruppi di cellule tumorali secernenti mucina che possono costituire anche una piccola percentuale delle cellule neoplastiche ed essere poco evidenti. Le cellule tumorali possono essere cellule goblet o altri tipi di cellule secernenti mucina (Figura 10, riquadri A e B).
L’adenocarcinoma colloidale raramente si presenta come pattern puro, più frequentemente è mescolato ad altri sottotipi istologici di adenocarcinoma. Un adenocarcinoma misto viene definito “adenocarcinoma colloidale” se la componente colloidale costituisce la maggior parte della neoplasia, nella diagnosi dovranno essere
indicate le percentuali delle altre componenti.
“L’adenocarcinoma colloidale con modificazioni cistiche” è un adenocarcinoma colloidale con presenza di cisti, uni o multilculate, contenenti mucina e rivestite da cellule goblet o altre cellule secernenti mucina, la componente cistica è solitamente focale. L’epitelio delle cisti può essere discontinuo e parzialmente sostituito da cellule infiammatorie, ad esempio da reazione granulomatosa o tessuto di granulazione. Questa neoplasia era denominata, nella classificazione precedente, “cistoadenocarcinoma mucinoso” mentre viene attualmente considerata uno spettro dell’adenocarcinoma colloidale.
Adenocarcinoma fetale
“L’adenocarcinoma fetale” è costituito da elementi ghiandolari tubulari composti da cellule non ciliate, ricche di glicogeno, che somigliano ai tubuli dei polmoni fetali. Le cellule neoplastiche hanno citoplasma chiaro abbondante con caratteristici vacuoli sottonucleari. Nei lumi dei tubuli sono visibili morule squamoidi. La maggior parte di queste neoplasie è di basso grado con prognosi favorevole; sono tuttavia possibili casi di alto grado. L’età di insorgenza di questa neoplasia è caratteristicamente più bassa rispetto agli altri adenocarcinomi polmonari (Figura 10, riquadro C).
Una neoplasia che presenti caratteri dell’”adenocarcinoma fetale” misti a caratteri di altri sottotipi istologici deve essere classificata in base alla componente prevalente.
Questa variante di adenocarcinoma è caratterizzata dalla presenza di mutazioni del gene della beta-catenina, all’analisi immunoistochimica con l’anticorpo specifico le cellule tumorali mostrano un’aberrante espressione nucleare e citoplasmatica di tale proteina.
Adenocarcinoma con differenziazione enterica
oltre il 50% della neoplasia viene definito “adenocarcinoma con differenziazione enterica”. Il pattern enterico presenta caratteristiche morfologiche ed immunoistochimiche sovrapponibili all’adenocarcinoma colico. Tale pattern è costituito da strutture ghiandolari e/o papillari, talora cribiriformi, contenenti necrosi endoluminale e detriti nucleari, con cellule tumorali colonnari alte con pseudostratificazione nucleare. Se il tumore è scarsamente differenziato può avere una crescita solida (Figura 10, riquadro D).
A differenza delle metastasi polmonari da adenocarcinoma del colon questa neoplasia è istologicamente eterogenea con componenti tipiche dell’adenocarcinoma polmonare, ad esempio la crescita lepidica.
All’analisi immunoistochimica questa neoplasia presenta, per definizione, positività per almeno un marker di differenziazione enterica (CDX-2, CK20 o MUC2) e nel 50% dei casi si associa anche una positività per CK7 e TTF-1, ulteriore elemento a favore di una primitività polmonare.
Figura 10
CLASSIFICAZIONE DELLE BIOPSIE E DEI CAMPIONI
CITOLOGICI
Per le biopsie ed i campioni citologici, la nuova classificazione raccomanda, quando possibile, di fare una diagnosi il più accurata possibile. Fino a pochi anni fa nella diagnosi di tali campioni ci si limitava a distinguere tra carcinomi a piccole cellule e carcinomi non a piccole cellule e questa distinzione era sufficiente ai clinici per impostare il percorso terapeutico successivo. Oggi grazie ai progressi, sia in termini di opzioni terapeutiche, sia di conoscenze per la valutazione prognostica, questa distinzione è divenuta riduttiva. Il patologo ed il citologo debbono, quando possibile, evitare la dicitura “carcinoma non a piccole cellule” e specificare se si tratti di un adenocarcinoma o di un carcinoma a cellule squamose.
I pazienti con adenocarcinoma, a differenza di quelli con carcinoma a cellule squamose, possono essere sottoposti a terapia con pemetrexed (migliore efficacia nell’istotipo adenocarcinoma) o bevacizumab, farmaco controindicato nei pazienti con carcinoma a cellule squamose per il rischio di emorragie anche mortali.
Inoltre nei pazienti con adenocarcinoma o con carcinoma non a piccole cellule non ulteriormente specificabile (NSCLC-NOS) deve essere studiato lo stato mutazionale di EGFR: la presenza di specifiche mutazioni di tale gene sono predittive di una sensibilità al trattamento con inibitori tirosino-chinasici di EGFR (gefitinib ed erlotinib).
Si raccomanda di limitare, per quanto possibile, l’uso della dicitura “carcinoma non a piccole cellule non altrimenti specificabile” (NSCLC-NOS). Se un preparato non mostra aspetti morfologici di differenziazione ghiandolare, squamosa o neuroendocrina è necessario applicare un pannello di indagini immunoistochimiche. Tale pannello deve contenere uno o più markers per l’adenocarcinoma (TTF-1, Napsina-A, CK7, surfactante A e B) ed uno o più markers per il carcinoma a cellule squamose (p63, p40, CK5/6, CK34bE12).
Tra i marcatori immunoistochimici il TTF-1 sembra essere il più specifico per l’adenocarcinoma: in presenza di positività nucleare (solo nucleare e non
citoplasmatica) per TTF-1 è corretto formulare una diagnosi di adenocarcinoma, anche in presenza di positività per i marcatori tipici del carcinoma a cellule squamose. Esistono difatti adenocarcinomi che esprimono p63, CK5/6 e CK34bE12. La negatività del TTF-1 non esclude comunque una diagnosi di adenocarcinoma, “l’adenocarcinoma mucinoso” difatti risulta negativo per tale marcatore nell’83% dei casi. Inoltre il TTF-1 ha il vantaggio di confermare la primitività polmonare della lesione, essendo un marker tipico dei pneumociti, e di escludere una metastasi di adenocarcinoma di altra origine (ad es colica o mammaria).
In base alle caratteristiche morfologiche ed immunoistochimiche i campioni bioptici e citologici vengono classificati in:
Carcinoma a piccole cellule (SCLC) , in presenza di morfologia
neuroendocrina, cellule piccole, nucleoli assenti, markers neuroendocrini positivi (cromogranina, sinaptofisina e CD56), TTF-1 positivo (90% dei casi)
Carcinoma non a piccole cellule, con probabilità a grandi cellule, in
presenza di morfologia neuroendocrina, cellule grandi, markers neuroendocrini positivi
Carcinoma a cellule squamose (SCC), in presenza di caratteri
morfologici di differenziazione squamosa (perle cornee e/o ponti intercellulari)
Adenocarcinoma (ADC), in presenza di caratteri morfologici di
differenziazione ghiandolare (architettura ghiandolare nelle biopsie; organizzazione in strutture ghiandolari, citoplasma vacuolato o schiumoso, nuclei eccentrici con cromatina fine e nucleoli spesso evidenti nei campioni citologici)
Carcinoma non a piccole cellule, con probabilità a cellule squamose, in
assenza di chiari caratteri morfologici ed in presenza di positività (diffusa, moderata/intensa) per i markers squamosi e negatività per quelli tipici
Carcinoma non a piccole cellule, con probabilità adenocarcinoma, in
assenza di chiari caratteri morfologici ed in presenza di positività per i markers dell’adenocarcinoma e negatività per quelli squamosi (la positività per il TTF-1 depone per una diagnosi di adenocarcinoma anche in presenza di positività per i markers squamosi)
Carcinoma non a piccole cellule, con probabilità adenosquamoso, in
presenza di positività intensa per i markers dell’adenocarcinoma e di quelli squamosi in due popolazioni distinte di cellule neoplastiche
Carcinoma non a piccole cellule non altrimenti specificabile
(NSCLC-NOS), in presenza di negatività per tutti i markers o in presenza di
positività solo debole o focale per i markers squamosi e negatività per quelli dell’adenocarcinoma
Le biopsie ed i campioni citologici possono non essere rappresentativi dell’intera neoplasia per l’eterogeneità istologica che caratterizza l’adenocarcinoma polmonare.
Questo comporta una possibile discrepanza tra la diagnosi pre-operatoria e la diagnosi istologica definitiva sul pezzo operatorio.
Per la scarsa rappresentatività del materiale in esame viene raccomandato di evitare, con tali preparati, la diagnosi di:
adenocarcinoma in situ ed adenocarcinoma minimamente invasivo
(diagnosi possibili solo dopo completo campionamento); se in una biopsia è presente un pattern non invasivo si raccomanda la dicitura “crescita lepidica”
carcinoma a grandi cellule (diagnosi possibile solo dopo accurato
campionamento che permetta di escludere la presenza di componenti differenziate)
carcinoma pleomorfo ; se sono presenti caratteri sarcomatoidi quali marcato
raccomanda di classificare come adenocarcinoma o carcinoma a cellule squamose in presenza rispettivamente di elementi di differenziazione ghiandolare o squamosa o come “carcinoma non a piccole cellule scarsamente differenziato con aspetti a cellule giganti o a cellule fusate” in assenza di tali elementi
Se il patologo ha a disposizione sia campioni citologici che bioptici di uno stesso paziente è opportuno che la diagnosi venga fatta analizzando contemporaneamente tutto il materiale a disposizione. Se il tumore è costituto da un’abbondante reazione stromale è possibile che le piccole biopsie siano scarsamente cellulate e che, rispetto ad esse, i campioni citologici contengano un numero maggiore di cellule tumorali. Per questo è raccomandato ricavare sempre citoinclusi dai campioni citologici positivi per ottenere materiale su cui poter eseguire indagini molecolari ed immunoistochimiche.
CLASSIFICAZIONE TNM
La stadiazione secondo il sistema TNM ha un ruolo importante soprattutto nei carcinomi polmonari non a piccole cellule (NSCLC) sia a fini prognostici che di programmazione terapeutica. Il sistema si basa sui caratteri della neoplasia primitiva (T), dei linfonodi locoregionali (N) e delle eventuali metastasi a distanza (M). Dalla valutazione di questi tre parametri si arriva a classificare le singole neoplasie in stadi, ognuno di questi presenta una specifica prognosi e delle specifiche indicazioni terapeutiche. La classificazione in uso è la settima edizione del 2009.
T-TUMORE PRIMITIVO
Tx- Il tumore primitivo non può essere definito o ne è provata l'esistenza per la
presenza di cellule atipiche nell'escreato o nel liquido di lavaggio bronchiale ma non è visualizzabile con la broncoscopia o con le tecniche per immagini.
T0- Nessuna evidenza di tumore primitivo Tis- Carcinoma in situ
T1- Tumore con dimensione massima minore o uguale a 3 cm, circondato da
tessuto polmonare o da pleura viscerale, in assenza di segni endoscopici di invasione più prossimale di un bronco lobare.
T1a- Tumore con dimensione massima minore o uguale a 2 cm T1b- Tumore con dimensione massima tra 2 cm e 3 cm
T2- Tumore con dimensione massima tra 3 cm e 7 cm o con una qualsiasi delle
seguenti caratteristiche:
- interessamento del bronco principale ad almeno 2 cm dalla carena - invasione della pleura viscerale
- associato ad atelectasia o polmonite ostruttiva che si estende alla regione ilare ma non interessa l'intero polmone.
T2a- Tumore con dimensione massima maggiore di 3 cm ma non superiore a 5 cm
T2b- Tumore con dimensione massima maggiore di 5 cm ma non
superiore a 7 cm
T3- Tumore con dimensione massima maggiore di 7 cm o che invade
direttamente una delle seguenti strutture: parete toracica (inclusi i tumori dell'apice), diaframma, nervo frenico, pleura mediastinica, pericardio parietale; o tumore di un bronco principale che disti meno di 2 cm dalla carena ma senza interessamento della carena stessa; o associato ad atelectasia o polmonite ostruttiva dell'intero polmone; o nodulo/i tumorale/i separato/i nello stesso lobo
T4- Tumore di qualunque dimensione che invade una delle seguenti strutture:
mediastino, cuore, grossi vasi, trachea, nervo laringeo ricorrente, esofago, corpi vertebrali, carena; nodulo/i tumorale/i separato/i in altro lobo ipsilaterale
N-LINFONODI REGIONALI
Nx- Linfonodi regionali non valutabili N0- Linfonodi regionali liberi da metastasi
N1- Metastasi ai linfonodi peribronchiali omolaterali e/o ilari omolaterali ed
intrapolmonari, incluso l'interessamento per estensione diretta
N2- Metastasi ai linfonodi mediastinici omolaterali e/o sottocarenali
N3- Metastasi ai linfonodi mediastinici controlaterali, ilari controlaterali,
scalenici omo o controlaterali o sovraclaveari omo o controlaterali
M-METASTASI A DISTANZA
Mx- Metastasi a distanza non dimostrabili M0- Metastasi a distanza assenti
M1- Metastasi a distanza presenti
M1a- Nodulo/i tumorale/i separato/i in lobo controlaterale; tumore con noduli pleurici o versamento pleurico o pericardico maligno
STADI: - Carcinoma occulto ( Tx/ N0/ M0 ) - Stadio 0 ( Tis/ N0/ M0 ) - Stadio IA ( T1/ N0/ M0 ) - Stadio IB ( T2/ N0/ M0 ) - Stadio IIA ( T1/ N1/ M0 ) - Stadio IIB ( T2/ N1/ M0 o T3/ N0/ M0 ) - Stadio IIIA ( T1-2/ N2/ M0 o T3/ N1-2/ M0 ) - Stadio IIIB ( ogni T/ N3/ M0 o T4/ ogni N/ M0 ) - Stadio IV ( ogni T/ ogni N/ M1 )
Il primo stadio comprende pazienti con malattia confinata al polmone senza alcun
segno di estensione a livello linfonodale o mediastinico. La terapia d'elezione è quella chirurgica e consente la guarigione nella maggioranza dei casi: la sopravvivenza a 5 anni sembra essere del 65% per i T1 clinici e del 42% per i T2 clinici, del 76% per i T1 patologici e del 57% per i T2 patologici (dopo stadiazione chirurgico-patologica).
Il secondo stadio comprende pazienti con tumore con interessamento dei lifonodi
peribronchiali e/o ilari omolaterali ed intrapolmonari. Il trattamento di scelta è quello chirurgico ma l'aspettativa di soprvvivenza a 5 anni scende al 30% circa per il secondo stadio clinico ed al 40% circa per il secondo stadio patologico.
Lo stadio IIIA identifica casi di malattia con una limitata estensione extrapolmonare
(parete toracica, diaframma, pleura mediastinica, pericardio parietale) e/o coinvolgimento dei linfonodi mediastinici omolaterali e/o sottocarenali. La terapia chirurgica è anche qui indicata con l'ausilio di chemioterapia neoadiuvante allo scopo di ridurre le dimensioni della massa primitiva facilitandone l'exeresi completa, nonchè di eliminare eventuali micrometastasi. La radioterapia ha un essenziale ruolo curativo per i pazienti in stadio I, II e IIIA non operabili.
Lo stadio IIIB identifica casi di malattia con esteso interessamento extrapolmonare
(mediastino, cuore, grossi vasi, esofago, corpi vertebrali etc) e/o coinvolgimento dei linfonodi mediastinici controlaterali, ilari controlaterali, scaleni o sovraclaveari.
Lo stadio IV comprende i casi di malattia con metastasi a distanza. Sia per lo stadio
IIIB che per lo stadio IV la terapia di scelta è la chemioterapia associata a radioterapia palliativa. Purtroppo, nella maggior parte dei casi, la prognosi è infausta.
STADIAZIONE DEI MICROCITOMI
La stadiazione TNM non è generalmente utilizzata per i microcitomi polmonari in quanto non sembra predirre altrettanto bene la sopravvivenza. L' International Association for the Study of Lung Cancer ha proposto per i microcitomi una classificazione in due stadi:
– Malattia limitata: tumore primitivo limitato ad un emitorace con metastasi ai
linfonodi regionali (ilari omo e controlaterali, mediastinici omo e controlaterali, sovraclaveari omo e controlaterali) e/o versamento pleurico omolaterale. Per questo stadio il trattamento di scelta è una polichemioterapia associata a radioterapia curativa.
– Malattia estesa: tumore primitivo con estensione maggiore rispetto a quella della
malattia limitata ovvero con metastasi a distanza. Il trattamento di scelta è la polichemioterapia; la radioterapia può avere un ruolo palliativo a livello toracico o profilattico sull'encefalo.
CITOLOGIA
Lo sviluppo della citologia nella diagnostica dell’apparato respiratorio è iniziato con gli studi condotti negli anni 50 da Papanicolau. Nel suo studio egli analizza il ruolo delle metodiche citologiche nella diagnosi delle lesioni dell’apparato respiratorio sottolineando l’accuratezza diagnostica di tali metodiche non solo nella diagnosi di malignità ma anche nella tipizzazione delle neoplasie. Negli anni 50 e 60 vengono condotti numerosi studi sulla citologia polmonare e contemporaneamente si sviluppano le metodiche di biopsie aspirative con ago sottile trans-toraciche.
Oggi, dopo oltre mezzo secolo di distanza dai primi lavori di Papanicolau, lo studio dei preparati citologici dell’apparato respiratorio è entrato nella pratica clinica come procedura diagnostica necessaria nella valutazione dei pazienti con sospetta neoplasia polmonare primitiva o secondaria, nel follow-up di pazienti con storia di neoplasia polmonare e nei pazienti con lesione polmonare sospetta che necessiti di conferma morfologica. La citopatologia ha un ruolo essenziale nella diagnosi delle neoplasie polmonari come tecnica diagnostica non invasiva o minimamente invasiva su cui si basa il successivo iter diagnostico-terapeutico.
L’accuratezza diagnostica delle tecniche citologiche si basa sull’adeguatezza del campione citologico dell’apparato respiratorio. Valutare l’adeguatezza del campione riduce l’incidenza di falsi risultati, in particolare di falsi negativi. Tale campione, in linea generale, deve contenere un numero adeguato di cellule ben conservate e deve essere preparato velocemente. I criteri più specifici per stabilire l’adeguatezza dipendono dal tipo di campione in esame.
I campioni più frequentemente utilizzati sono:
Sputo: prodotto altamente specializzato dell’apparato respiratorio che risulta
dall’interazione tra l’apparato mucociliare, il sistema immunitario dell’ospite e le sostanze inalate. Questo è composto prevalentemente da muco frammisto a materiale cellulato ed acellulato prodotto dall’ospite e alle sostanze inalate.
alcune cellule colonnari ciliate. Le spirali di Curschmann (spirali “a cavatappi” con asse centrale da cui si irradiano strutture filamentose perpendicolari all’asse, sono calchi di muco dei bronchioli medio-piccoli), quando presenti, sono indicative di un’origine polmonare profonda. Campioni con abbondanti cellule squamose benigne sono solitamente indicativi di una contaminazione dall’epitelio orale e quindi non sono da considerarsi adeguati.
o Lo sputo fresco è il campione raccolto la mattina per tre giorni consecutivi da tosse profonda ed inviato immediatamente al laboratorio senza fissativi. Questo viene macroscopicamente esaminato per evidenziare la presenza di frammenti tissutali ed aree emorragiche. Campioni sia da queste aree che random da altre aree vengono fissati in alcool etilico al 95% e colorati con il metodo di Papanicolau.
o Lo sputo può essere prefissato con la metodica di Saccomanno: viene raccolto in un contenitore con alcool etilico al 50% e polietilene glicole al 2% (Carbowax). In laboratorio tale campione viene centrifugato ed il deposito cellulare ottenuto viene colorato, con il vantaggio di un’alta concentrazione cellulare.
o Lo sputo indotto viene usato in pazienti che non sono in grado di produrlo con la tosse. A tal fine viene effettuato un aerosol con appropriate soluzioni, quella di comune utilizzo è costituita da cloruro di sodio al 15% e propilene glicole al 20%.
Broncoaspirato e broncolavaggio: tramite introduzione del broncoscopio
nelle basse vie respiratorie vengono aspirate le secrezioni e viene effettuato un lavaggio con soluzione salina bilanciata (immissione e successiva aspirazione). Il materiale ottenuto può essere centrifugato ed il campione ottenuti dal deposito cellulare, può essere filtrato tramite membrana o può essere centrifugato ed il deposito cellulare incluso in paraffina.
Un broncolavaggio ed un “brushing” bronchiale per essere adeguati devono contenere abbondanti cellule colonnari ciliate.
Lavaggio broncoalveolare: si ottiene per infusione e riaspirazione di
soluzione salina sterile nei segmenti polmonari distali con broncoscopio. Questa tecnica si utilizza per le lesioni polmonari sospette ed anche per diagnosticare