Dipartimento di Biologia
Corso di Laurea in Scienze e Tecnologie Biomolecolari
TESI DI LAUREA
Nanoparticelle di biossido di titanio: effetti citogenetici in
pneumociti umani in vitro
RELATORI: CANDIDATA:
Prof.ssa Lucia Migliore Valentina Dell’Acqua
Dott.ssa Chiara Uboldi
Questa è l'essenza della Scienza: fai una domanda sconveniente e sei sulla strada giusta per ricevere una risposta pertinente. Jacob Bronowski
INDICE
Riassunto
1
1.
Introduzione
3
1.1 Nanotecnologie, nanoparticelle e le loro applicazioni 3
1.2 Nanoparticelle di biossido di titanio 5
1.3 Interazione nanoparticelle – cellule 7
1.4 Effetti delle proprietà chimico-fisiche delle nanoparticelle sulla loro tossicità 10
1.4.1 Dimensione e area di superficie 11
1.4.2 Forma e aspect ratio 13
1.4.3 Chimica e carica di superficie 14
1.5 Modelli in vitro per lo studio della tossicità delle nanoparticelle 16 1.6 Citotossicità basale: test colorimetrici e non colorimetrici 17
1.7 Genotossicità 18
1.7.1 Cytome-test del micronucleo con blocco della citodieresi (CBMN-cyt) 19
1.7.2 Ibridazione fluorescente in situ (FISH) 22
1.7.3 Test della cometa 24
2.
Scopo della tesi
26
3.
Materiali e metodi
28
3.1 Nanoparticelle di biossido di titanio: sintesi e caratterizzazione 28 3.2 Coltura in vitro di pneumociti umani di tipo-II: linea cellulare A549 31 3.3 Trattamento delle colture di A549 con TiO2 NP e relativi controlli 32
3.4 Test di Efficienza di Formazione Colonie (CFE) 32
3.5 Cytome-test del micronucleo con blocco della citodieresi (CBMN-cyt) 33 3.5.1 Criteri di conteggio delle cellule vitali e citostasi 34 3.5.2 Criteri di conteggio delle cellule non vitali e citotossicità 35
3.5.3 Criteri di valutazione del danno genotossico 36
3.6 Fluorescence in situ hybridization (FISH) 37
3.7 Test della cometa: danno primario e danno ossidativo al DNA 38
4.
Risultati
41
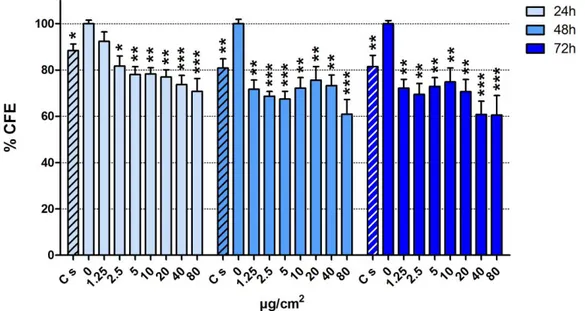
4.1 Test di Efficienza di Formazione delle Colonie (CFE) 41
4.1.1 TiO2 NP pristino 41
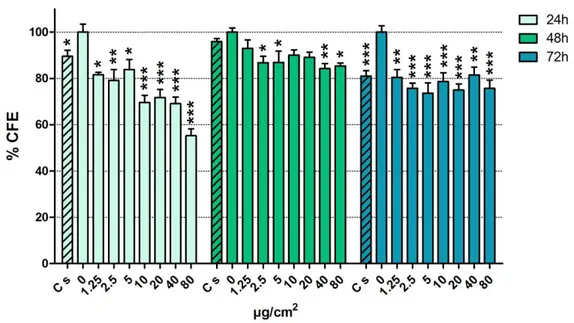
4.1.2 TiO2 NP rivestite con sodio citrato 43
4.1.3 TiO2 NP rivestite con biossido di silicio 43
4.1.4 TiO2 NP Aeroxide P25 44
4.1.5 Confronto tra i dati di CFE dopo esposizione alle diverse TiO2 NP 46
4.2 Cytome-test del micronucleo con blocco della citodieresi (CBMN-cyt) 47 4.2.1 Citostasi: indice di proliferazione (CBPI) e indice di replicazione (RI) 47 4.2.2 Citotossicità: indice apoptotico e indice necrotico 49 4.2.3 Genotossicità: frequenza dei micronuclei (MN), ponti nucleoplasmatici (NPB)
ed evaginazioni nucleari (NBUD) 51
4.2.4 Confronto dei valori di citostasi, citotossicità e genotossicità dopo
esposizione a TiO2 NP diversamente rivestite 54
4.3 Ibridazione fluorescente in situ (FISH) 55
4.4 Test della cometa 56
4.4.1 Danno primario al DNA 56
4.4.2 Danno ossidativo alle basi pirimidiniche e puriniche 57 4.4.3 Confronto dei valori di danno primario ed ossidativo del DNA dopo
esposizione a TiO2 NP diversamente rivestite 60
5.
Discussione
62
6.
Bibliografia
66
RIASSUNTO
Le nanoparticelle (NP) sono definite come materiali con almeno una delle tre dimensioni minore di 100 nm e, rispetto alle loro controparti macromolecolari, si distinguono per via delle loro peculiari caratteristiche chimico-fisiche che possono renderle più resistenti, migliorarne le attività catalitiche e le proprietà ottiche.
In conseguenza di tali proprietà, negli anni recenti lo sviluppo dell’industria nanotecnologica è aumentato notevolmente e, di conseguenza, anche l’esposizione umana e ambientale a tali materiali nanostrutturati. I nanomateriali, infatti, sono già utilizzati in molteplici applicazioni quali cosmetici, creme solari, protesi dentali, impianti ortopedici, ed il loro impiego è destinato ad aumentare sia in ambito industriale che biomedico. Studiare quali siano i rischi associati all’esposizione alle NP, come interagiscono con i sistemi biologici e quali siano gli effetti sull’uomo e sull’ambiente è di fondamentale importanza.
Questo lavoro di tesi si pone l’obiettivo di indagare, in colture cellulari umane, le relazioni esistenti tra nanoparticelle di biossido di titanio (TiO2 NP), sia non rivestite che differentemente rivestite con ossido di silicio o citrato, ed un materiale di riferimento (P25 Aeroxide), e la loro potenziale citotossicità e genotossicità, enfatizzando il ruolo svolto dalla diversa chimica di superficie. Nell’ambito del progetto di ricerca europeo Sanowork sono stati condotti esperimenti in vitro utilizzando cellule epiteliali polmonari di tipo-II (linea cellulare A549), riconosciute come modello per lo studio dell’esposizione inalatoria ai nanomateriali. Lo studio è stato condotto attraverso i seguenti saggi:
• Colony forming efficiency assay (CFE)
• Citokinesis-block micronucleus cytome assay (CBMN Cyt) • Fluorescence in situ hybridization (FISH)
• Comet assay (con e senza l’utilizzo di enzimi di restrizione EndoIII e Fpg)
Il saggio di efficienza di formazione di colonie (CFE) ci ha permesso di valutare la vitalità cellulare attraverso la capacità clonogenica cellulare.
Il test del micronucleo, nella sua versione con blocco della citodieresi (CBMN Cyt), ha consentito l’analisi del danno cromosomico indotto a carico di cellule binucleate che, grazie all’azione della Citocalasina-B, non possono completare il processo di divisione cellulare. I biomarcatori di danno cromosomico analizzati sono:
micronuclei, piccoli nuclei accessori persi durante la divisione cellulare, ponti nucleoplasmatici come indicatori della formazione di cromosomi dicentrici e/o fusioni telomeriche, ed evaginazioni nucleari generate dall’eliminazione di DNA amplificato o di complessi di riparazione. Tramite il CBMN Cyt, inoltre, è stato possibile valutare anche la citostasi e la citotossicità indotta dalle TiO2 NP mediante l’analisi della proliferazione cellulare, dell’apoptosi e della necrosi.
La genotossicità indotta è stata risolta ulteriormente differenziando meccanismi clastogeni ed aneuploidogeni attraverso l’ibridazione fluorescente in situ (FISH) con l’uso di sonde pancentromeriche.
Con il test della cometa (comet assay) è stata verificata la presenza di rotture del DNA a singolo o doppio filamento e, attraverso l’utilizzo di enzimi di restrizione quali EndoIII e Fpg, è stato possibile discriminare i danni ossidativi a carico delle basi pirimidiniche e puriniche.
I risultati ottenuti evidenziano come la chimica di superficie influenzi le diverse proprietà chimico-fisiche delle TiO2 NP, ed in particolare la loro dimensione, determinando differenti risposte citogenetiche nelle cellule A549.
1. INTRODUZIONE
1.1 Nanotecnologie, nanoparticelle e le loro applicazioni
La nanotecnologia è una disciplina che applica le proprietà della materia in scala nanometrica (1 nm = 10-9 m) all’industria e alla biomedicina. Il crescente sviluppo della nanotecnologia ha portato ad un incremento della progettazione, della sintesi e della produzione di nanomateriali, ossia materiali che abbiano componenti strutturati con almeno una delle dimensioni inferiore a 100 nm e che includono nanoparticelle (NP), ossia particelle le cui dimensioni siano comprese nell’intervallo 1-100 nm (EU, 2011). Tuttavia le NP possono anche essere generate naturalmente in seguito ad incendi, attività vulcaniche e fonti d’inquinamento, oppure possono essere antropogeniche, ossia prodotte da motori a combustione e usura di pneumatici.
Le NP possono avere varia composizione chimica (metalliche, polimeriche, lipidiche), struttura (nanotubi, fullereni, dendrimeri), forma (sferica, bastoncellare, fusiforme, cilindrica, discoidale, a guscio), e la loro dimensione può essere paragonata a quella di virus e proteine.
Figura 1: Esempi di forme diverse in nanoparticelle (ossido di rame, CuO). Immagini ottenute
mediante microscopia elettronica a trasmissione di (a) CuO granulare, (b) con forma sferica, (c) con forma conica e (d) con forma fusiforme. (Di Bucchianico et al., 2013).
Poiché le NP hanno caratteristiche chimico-fisiche che, rispetto alle loro controparti macromolecolari, possono modificarle rendendole, ad esempio, più resistenti o migliorandone le attività catalitiche e le proprietà ottiche, l’interesse delle industrie nel produrre e utilizzare le NP è esponenzialmente aumentato nell’ultimo decennio (Singh et al., 2009).
I nanomateriali e le nanoparticelle sono utilizzati in ambito industriale e tecnologico per la progettazione di marmitte catalitiche delle automobili, chip di computer e monitor ad alta risoluzione, produzione di articoli sportivi, tessuti e cosmetici. Per esempio, nanomateriali quali i nanotubi di carbonio sono molto resistenti alla trazione ed al contempo molto leggeri, per cui risultano più vantaggiosi in applicazioni aerospaziali e automobilistiche rispetto ai materiali tradizionali (Presting et al., 2003). NP di biossido di titanio vengono utilizzate nella produzione di vetri, vernici e materiali cartacei grazie alla loro capacità di conferire opacità e alle loro proprietà sbiancanti, ma sono anche usati nell’industria cosmetica per la produzione di creme solari in quanto tali NP hanno la capacità di bloccare e fornire una barriera protettiva contro le radiazioni solari UV-A (Doak et al., 2009; Skocaj
et al., 2011). In campo biomedico nanomateriali quali titanio, silicio ed i nanotubi di
carbonio sono utilizzati per protesi dentali e impianti ortopedici (Choi et al., 2013; Polyzois et al., 2012), e numerosi sforzi sono attualmente in corso per poter utilizzare le NP di silicio come veicoli per la somministrazione di farmaci (Shohdy e Alfaar, 2013). Le NP, infatti, grazie alle loro piccole dimensioni, possono penetrare nelle cellule ed essere trasferite nel circolo ematico per raggiungere i siti bersaglio quali le cellule neuronali in terapie farmacologiche del sistema nervoso centrale come il morbo di Alzheimer (Wilson, 2011) o di Parkinson (Brynskikh et al., 2010). Benché per via delle loro peculiari caratteristiche chimico-fisiche i nanomateriali costituiscano un enorme potenziale, essi al contempo suscitano domande e perplessità relativamente alle loro interazioni con gli organismi e l’ambiente. L’ampio utilizzo delle NP rende quindi necessaria una maggiore comprensione dei meccanismi di interazione con i sistemi biologici, ed una valutazione più accurata dei potenziali rischi e pericoli associati all’uso delle NP e dei prodotti che le contengono. Numerosi studi sono stati ad oggi condotti per comprendere quali caratteristiche delle NP risultino influenzare la loro potenziale tossicità, ossia se questa dipenda dalla dose somministrata o dalla forma del materiale, dal tempo di esposizione o dalle proprietà di superficie delle NP, dalla via di esposizione o dalla
loro composizione chimica. Ad esempio, uno studio sugli effetti tossici di NP di argento (Ag NP) condotto su cellule epiteliali di carcinoma polmonare umano (linea cellulare A549) ha dimostrato che Ag NP possono indurre stress ossidativo, arresto del ciclo cellulare, reazioni infiammatorie, aberrazioni cromosomiche e rotture del filamento di DNA (Foldbjerg et al., 2011). Un altro studio ha invece dimostrato che i nanotubi di carbonio provocano significativa citotossicità, danni al DNA e induzione di micronuclei in cellule PC12 derivate da feocromocitoma neurale (Zhang et al., 2010b).
Tuttavia, i risultati ottenuti dallo studio dei nanomateriali risultano ancora controversi. Per esempio, uno studio sulle interazioni tra NP di oro (Au NP) con macrofagi murini ha evidenziato che Au NP sono biocompatibili e hanno una tossicità trascurabile (Zhang et al., 2011), invece Gerber e colleghi hanno dimostrato che Au NP inducono tossicità, risposte infiammatorie e morte cellulare per apoptosi oltre che inibizione della crescita e dello sviluppo di embrioni di
Zebrafish (Gerber et al., 2013), e Di Bucchianico e coautori hanno osservato come Au NP inducano effetti aneuploidogeni e danno ossidativo al DNA in macrofagi murini e linfociti umani (Di Bucchianico et al., 2014). Ancora, nanoparticelle di biossido di silicio amorfo non hanno indotto alcun effetto citotossico e genotossico in fibroblasti murini Balb/3T3 (Uboldi et al., 2012), mentre in macrofagi murini è stata osservata attività infiammatoria e citotossicità (Kusaka et al., 2014).
Risulta quindi evidente come lo studio delle NP e delle loro interazioni con gli organismi e l’ambiente sia ancora attuale, e il presente lavoro di tesi si colloca in questo contesto assumendo un ruolo importante nello studio delle NP e del biossido di titanio.
1.2 Nanoparticelle di biossido di titanio
Le nanoparticelle di biossido di titanio (TiO2 NP), grazie al loro alto indice di
rifrazione e alla loro elevata attività catalitica, vengono utilizzate in un’ampia gamma di prodotti industriali e sono tra le prime cinque nanoparticelle più utilizzate al mondo (Shukla et al., 2011). Tra le varie applicazioni, TiO2 NP possono essere
utilizzate nell’industria delle materie plastiche, come additivi farmaceutici e alimentari, in vernici, prodotti per la casa e cosmetici (Skocaj et al., 2011;
Magdolenova et al., 2012; Valdiglesias et al., 2013). Le TiO2 NP trovano ampia
applicazione anche nelle creme solari grazie alla protezione che offrono contro i raggi UV e al loro aspetto trasparente, rispetto invece alle stesse particelle in scala micrometrica che lasciano un residuo bianco sulla pelle (Kiss et al., 2008; Barnard, 2010).
Essendo così largamente utilizzate e potendosi presentare sotto forma di polvere, aerosol, sospensione o emulsione, l’esposizione a TiO2 NP può verificarsi sia
durante la loro produzione (esposizione occupazionale) sia durante il loro utilizzo (esposizione intenzionale). L’uso sempre più crescente di TiO2 NP ha determinato
quindi lo svolgimento di progetti volti a comprenderne gli effetti sulla salute umana e sull’ambiente. Numerosi studi hanno dimostrato che TiO2 NP inducono danno
ossidativo, genotossicità e citotossicità in diverse linee cellulari umane (Ghosh et
al., 2010; Jin et al., 2011; Jugan et al., 2012; Shukla et al., 2011). Jugan e
collaboratori hanno condotto uno studio su cellule A549 esposte a TiO2 NP di
forma sferica (12-140 nm di diametro) dimostrando che possono indurre singole rotture dei filamenti e lesioni ossidative al DNA, ma anche stress ossidativo (Jugan
et al., 2012). Ulteriori studi sulle stesse cellule esposte a TiO2 NP hanno evidenziato danni alla membrana e alterazioni dell’attività mitocondriale (Hsiao e Huang, 2011; Aueviriyavit et al., 2012); inoltre, TiO2 NP sono risultate citotossiche
in cellule Syrian Hamster Embryo (SHE) come conseguenza della produzione di specie reattive dell’ossigeno (ROS) (Guichard et al., 2012). Analogamente, TiO2
NP hanno indotto citotossicità in vitro in cellule epiteliali amniotiche (Saquib et al., 2012), in pneumociti umani di tipo-II (Aueviriyavit et al., 2012) e in cellule polmonari di criceto (Hamzeh e Sunahara, 2013).
L’incremento della produzione di ROS è stato suggerito essere l’effetto determinante per l’induzione della genotossicità di TiO2 NP, con formazione di
micronuclei (Osman et al., 2010; Jaeger et al., 2012) e rottura del singolo e doppio filamento di DNA (Bernier et al., 2012; Guichard et al., 2012; Saquib et al., 2012; Hamzeh e Sunahara, 2013). Uno studio condotto da Huang e colleghi su fibroblasti murini NIH-373 ha dimostrato che esposizioni a lungo termine (12 settimane) a 15 nm TiO2 NP possono influenzare la proliferazione cellulare
facilitando così la trasformazione cellulare e la crescita incontrollata, e possono interagire con proteine che partecipano alla corretta progressione delle fasi mitotiche, dall’ingresso in mitosi alla citodieresi, portando alla formazione di fusi
multipolari aberranti, all’allineamento e/o segregazione scorretta dei cromosomi, all’aumento del numero di cellule multinucleate e della frequenza di micronuclei (Huang et al., 2009). Poiché meccanismi come l’alterazione delle vie di segnalazione cellulare e il danno al DNA svolgono un ruolo fondamentale nell’induzione delle neoplasie, TiO2 NP recentemente sono state classificate come
possibili cancerogeni dall’Agenzia Internazionale per la Ricerca sul Cancro (IARC, 2010).
Studi sulla neurotossicità hanno inoltre evidenziato che TiO2 NP inducono effetti a
livello cellulare e tissutale in cellule murine in vitro (Liu et al., 2010; Wu et al., 2010) e in roditori in vivo (Ramsden et al., 2009; Shimizu et al., 2009; Ma et al., 2010). È stato dimostrato che, dopo somministrazione endovenosa o inalazione, TiO2 NP riescono ad attraversare il tessuto placentare dei topi raggiungendo gli
organi fetali, incluso il cervello, e causando complicazioni della gravidanza ed effetti negativi sulla prole (Hougaard et al., 2010; Yamashita et al., 2011).
1.3 Interazione nanoparticelle - cellule
Per comprendere la potenziale tossicità indotta da NP, è indispensabile analizzare come queste interagiscano con le cellule.
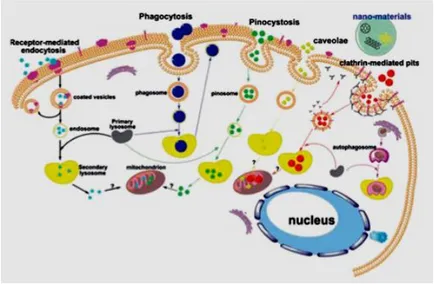
A seguito dell’esposizione, le NP possono danneggiare le cellule con la loro presenza provocando anossia cellulare, oppure possono penetrare nelle cellule secondo meccanismi (Figura 2) quali fagocitosi, macropinocitosi, endocitosi mediata da recettori (clatrina, caveolina, zolle lipidiche), endocitosi indipendente da recettori, pinocitosi o penetrazione diretta della membrana cellulare (Zhu et al., 2013). Dopo essere state internalizzate le NP possono essere intrappolate dapprima in endosomi e poi trasferite ai lisosomi, per mezzo dei quali possono eventualmente essere estruse dalle cellule. Tuttavia, grazie alle loro peculiari caratteristiche chimico-fisiche e alle loro ridotte dimensioni le NP possono sfuggire agli endosomi ed entrare in altri comparti cellulari come mitocondri, reticolo endoplasmatico e nucleo, dove possono quindi interagire con componenti intracellulari come proteine, lipidi o acidi nucleici (Cheng et al., 2013b).
Figura 2: Assorbimento intracellulare delle NP. Rappresentazione schematica dei principali
meccanismi di assorbimento delle nanoparticelle all’interno delle cellule (Cheng et al., 2013b).
Chithrani e collaboratori hanno studiato l’internalizzazione e il traffico intracellulare di Au NP in cellule MCF-7 di carcinoma mammario, dimostrando che le nanoparticelle vengono internalizzate attraverso endocitosi mediata da recettori e intrappolate in endolisosomi (Chithrani et al., 2009). Altri studi condotti su macrofagi murini attraverso tecniche di microscopia elettronica a trasmissione (TEM) accoppiata a spettroscopia EDX (Energy Dispersive X-ray spectroscopy) hanno mostrato che Au NP, aventi dimensione di 60 nm, possono essere internalizzate anche attraverso fagocitosi (Zhang et al., 2011).
Studi in vitro con cellule staminali mesenchimali umane (hMSCs) hanno evidenziato, mediante TEM, che Ag NP possono penetrare nelle cellule attraverso endocitosi e poi traslocare in endosomi (con successiva fusione con i lisosomi), nei mitocodri e nei nuclei (Hackenberg et al., 2011). Ulteriori sudi condotti da Wei e collaboratori, invece, hanno evidenziato che Ag NP vengono fagocitate nei fibroblasti murini, andando poi a localizzarsi nei mitocondri e nel reticolo endoplasmatico (Wei et al., 2010).
Per quanto concerne i nanotubi di carbonio (CNT), questi sono assorbiti dalle cellule tramite endocitosi mediata da clatrina. Riguardo la loro localizzazione all’interno delle cellule i dati, però, sono discordanti: secondo Kang e colleghi i CNT possono entrare nella cellula ma non nel nucleo (Kang et al., 2008), altri studi invece mostrano che CNT a parete singola (SWCNT) entrano nel nucleo delle cellule ma che tale internalizzazione può essere reversibile (Cheng et al., 2008).
Mu e colleghi hanno condotto uno studio su cellule embrionali epiteliali renali umane (HEK293) e, mediante tecniche di citometria a flusso, microscopia a fluorescenza e TEM, hanno dimostrato che singoli CNT a parete multipla (MWCNT), aventi diametro di circa 20-30 nm e lunghezza di circa 1000 nm, entrano nelle cellule attraverso penetrazione diretta, mentre fasci di MWCNT vengono internalizzati tramite endocitosi. Tuttavia, una volta all’interno degli endosomi e prima di essere reclutati dai lisosomi ed esclusi dalle cellule, i fasci di MWCNT possono rilasciare singoli nanotubi che penetrano la membrana endosomiale e si localizzano nel citoplasma. Inoltre MWCNT di circa 200 nm di lunghezza penetrano più facilmente le membrane plasmatiche e possono anche entrare nel nucleo delle cellule attraversando i pori nucleari (Mu et al., 2009). Nonostante gli studi effettuati per comprendere appieno le interazioni tra le NP e i componenti cellulari siano numerosi, non sono ancora stati del tutto chiariti i meccanismi secondo cui le NP interagiscono con le cellule causando citogenotossicità. É tuttavia chiaro che le nanoparticelle non assumono direttamente il controllo dei processi cellulari, ma possono interferire con la proliferazione, il metabolismo e l’espressione genica. Numerosi studi hanno proposto l’induzione di specie reattive dell’ossigeno come meccanismo di cito- e genotossicità mediata da NP: alti livelli di ROS possono danneggiare le cellule attraverso perossidazione lipidica, inducendo il rilascio di citochine proinfiammatorie, alterando proteine e DNA (Eom e Choi, 2009; Singh et al., 2009; Bernard, 2010; Shukla et al., 2011; Cheng et al., 2013b). I radicali liberi, come le specie reattive dell’ossigeno, sono in grado di interagire, danneggiandola, con qualsiasi molecola di cui è costituita una cellula, con conseguenze quali alterazioni funzionali, alterazioni strutturali, morte cellulare. La loro “avidità di elettroni” rende i radicali liberi molto reattivi e trovano stabilità ossidando le molecole con cui entrano in contatto, generando così squilibrio nello stato ossidativo e antiossidativo della cellula e stress ossidativo dannoso per le cellule.
Lo stress ossidativo indotto dalle NP può determinare l’attivazione di specifiche vie metaboliche come la proteina chinasi attivata da mitogeni (MAPK) e il fattore di trascrizione nucleare NF-κB i quali, associati alla riduzione delle difese antiossidanti delle cellule, determinano il rilascio di citochine pro-infiammatorie (Zhou et al., 2012; Hirano et al., 2010).
Lo stress ossidativo, inoltre, determina danno al DNA attraverso il radicale idrossilico OH-, il quale grazie al suo elettrone spaiato riesce ad attirare o cedere elettroni alle basi azotate e, soprattutto, allo scheletro carbonioso del doppio filamento del DNA, determinando rotture dell’elica o inducendo mutazioni. OH-, inoltre, è responsabile della perossidazione lipidica e, conseguentemente, dell’attivazione della risposta infiammatoria che se da una parte rappresenta una reazione di difesa dell’organismo, dall’altra determina un ulteriore incremento nella produzione di ROS da parte di cellule infiammatorie come i neutrofili.
Uno studio su TiO2 NP ha dimostrato, per esempio, come queste NP possano
provocare perossidazione lipidica e riduzione di antiossidanti come il glutatione (GSH) all’interno di cellule epidermiche umane, con conseguente aumento dei livelli di ROS e induzione di espressione dei relativi geni (Shukla et al., 2011). L’aumento di ROS mediato da TiO2 NP è considerato un fattore scatenante la
citogenotossicità indotta dal titanio ed è associato anche al danno al DNA, all’apoptosi e alla necrosi (Falck et al., 2009; Wang et al., 2009; Bernard, 2010; Shukla et al., 2011).
1.4 Effetti delle proprietà chimico-fisiche delle nanoparticelle sulla loro tossicità
Le proprietà chimico-fisiche dei nanomateriali alterano fortemente le proprietà biochimiche delle cellule e pertanto rivestono un ruolo essenziale nell’interazione NP-cellule, regolando l’internalizzazione (uptake) e la cinetica (distribuzione, metabolismo, escrezione) delle NP ed influendo quindi sulla loro potenziale tossicità. Tali caratteristiche chimico-fisiche includono fattori fisici (dimensione, forma, area superficiale e composizione di superficie), chimica di superficie (carica superficiale, funzionalizzazione, proprietà idrofobiche o idrofiliche) e stabilità (stato di aggregazione, biodegradabilità e solubilità).
È noto che NP con diverse proprietà chimico-fisiche hanno impatti diversi su proliferazione, funzioni del citoscheletro, apoptosi, migrazione e adesione (Di Bucchianico et al., 2013; Huang et al., 2010). L’efficienza dell’uptake cellulare e della fuga endosomiale, per esempio, dipendono fortemente dalle dimensioni delle nanoparticelle (Gan et al., 2012) e quindi dal loro aspect ratio (il rapporto fra due
dimensioni caratteristiche di una figura solida tridimensionale) e dal loro stato di aggregazione. Lo stato di aggregazione a sua volta è influenzato dalla carica superficiale e dalla composizione delle NP (Soares et al., 2014); così anche l’internalizzazione e la localizzazione cellulare delle NP sono influenzate dalla loro dimensione che ne limita l’accesso ai vari organelli cellulari. La chimica di superficie delle NP, inoltre, è un fattore chiave nel determinare le possibili interazioni che possono verificarsi tra le NP e le molecole intracellulari, influenzando così il panorama ossidativo all’interno della cellula ed i possibili fenomeni di apoptosi o instabilità cellulare.
1.4.1 Dimensione e area di superficie
La dimensione delle NP regola aspetti della loro interazione con le cellule quali la capacità di internalizzazione, la modalità con cui avviene l’assorbimento e la loro potenziale citotossicità.
La maggior parte dei nanomateriali con dimensioni inferiori a 500 nm sono internalizzati per endocitosi; per penetrare direttamente la membrana cellulare, invece, la dimensione delle NP dovrebbe essere inferiore allo spessore del doppio-strato della membrana, che va da 4 nm a 10 nm (Lux et al., 2011; Zhou et
al., 2011). La fagocitosi, invece, è un processo più permissivo che permette la
traslocazione di NP con dimensioni che vanno da 10 nm a 500 nm (Mitragotri et
al., 2009),
Secondo quanto dimostrato da Shukla, TiO2 NP vengono internalizzate in cellule
epidermiche umane o aderiscono alla membrana cellulare a seconda delle loro dimensioni: NP di 30-100 nm sono localizzate nel citoplasma, in vescicole e nel nucleo; NP più grandi (> 500 nm) sono invece rimaste all’esterno delle cellule (Shukla et al., 2011).
Le NP solitamente tendono ad associarsi e formare aggregati più o meno stabili che possono eventualmente essere disciolti in una sostanza liquida. La loro dispersione all’interno di un liquido dipende fortemente dal potenziale elettrocinetico o potenziale Z, caratteristica intrinseca delle NP che può variare significativamente secondo il pH della soluzione (Skocaj et al., 2011). Il potenziale Z rappresenta la carica superficiale delle NP e indica il potenziale che si genera in
seguito alla formazione di un doppio strato elettrico all’interfaccia solido-liquido e che è responsabile dei fenomeni elettrocinetici e della stabilità delle NP: un valore elevato di potenziale Z (< -30 mV e > 30mV) conferisce maggiore stabilità in quanto si originano repulsioni elettrostatiche che impediscono l’aggregazione delle particelle disperse, mentre quando il potenziale Z è basso (-30 mV < Z-pot < 30 mV) le forze attrattive prevalgono sulle repulsioni consentendo la formazione di aggregati.
In conseguenza dello stato di aggregazione delle NP la loro dimensione può cambiare notevolmente, influenzando così il loro comportamento nell’interazione con le cellule, in termini sia di uptake sia di risposte citotossiche. Magdolenova e collaboratori hanno esposto tre diversi tipi cellulari (linfoblasti umani TK6; cellule epiteliali embrionali umane EUE e fibroblasti di rene di scimmia Cos-1) a TiO2 NP
con due diversi gradi di dispersione (aggregati inferiori a 200 nm e aggregati più grandi di 200 nm), ottenuti trattando la sospensione di nanoparticelle con diversi tempi di sonicazione e in presenza/assenza di siero, e hanno dimostrato come lo stato di aggregazione influenzi la citogenotossicità delle TiO2 NP, osservando
effetti più significativi in presenza di aggregati maggiori di 200 nm (Magdolenova
et al., 2012).
É inoltre di grande attualità il problema della dimensione “ideale” delle NP impiegate in applicazioni biomediche quali il rilascio mirato di farmaci (drug
delivery) o terapie contro il cancro, e nel confronto dei risultati di studi effettuati
con NP di argento (Park et al., 2011), idrossiapatite (Yuan et al., 2010), oro (Ma et
al., 2011) e polipirrolo (Kim et al., 2011), Cheng e colleghi hanno approssimato
che la migliore dimensione per le NP ad uso biomedico è di 50 nm (Cheng et al., 2013a).
La dimensione, inoltre, influisce sull’area di superficie delle NP e sul loro potenziale citotossico: più piccola è la dimensione maggiore è il numero di particelle per unità di massa, quindi maggiore sarà la superficie globale delle NP, caratteristica questa che fornisce loro una reattività particolarmente elevata. Conseguentemente, maggiore è il loro potenziale reattivo maggiore potrà quindi essere la loro interazione con le cellule ed i loro compartimenti, inducendo un elevato danno cellulare e stress ossidativo. A tal proposito Park e colleghi hanno dimostrato come Ag NP con diametro di 20 nm siano più tossiche di Ag NP più grandi (Park et al., 2011).
1.4.2 Forma e aspect ratio
La forma dei nanomateriali è un altro fattore importante per l’interazione tra NP e cellule poiché, contribuendo alla grandezza dell’area superficiale disponibile, essa influenza la reattività e la tossicità delle NP. Per lo stesso principio, una superficie porosa contribuirà ad aumentare l’area superficiale e quindi la reattività delle NP rispetto ad una superficie liscia.
Studi di Huang e collaboratori su una linea cellulare di melanoma umano (A375) condotti utilizzando NP di silicio (SiO2 NP) con diverso aspect ratio hanno
dimostrato come quest’ultimo influisca su varie funzioni cellulari come la velocità di assorbimento, la formazione del citoscheletro, adesione, migrazione, vitalità e proliferazione: SiO2 NP lunghe (aspect ratio = 4) erano internalizzate più
facilmente rispetto a SiO2 NP corte (aspect ratio = 2) o sferiche (aspect ratio = 1) e
la citotossicità di tali NP diminuiva al decrescere di tale parametro (Huang et al., 2010; Huang et al., 2011).
Tuttavia, Florez et al. in uno studio condotto su cellule HeLa e cellule staminali mesenchimali (MSC) esposte a NP polimeriche non sferiche e con aspect ratio differenti tra loro (191 nm x 84 nm, aspect ratio = 2; 279 nm x 70 nm, aspect ratio = 4 e 381 nm x 65 nm, aspect ratio = 6) ha osservato un’efficienza di assorbimento più bassa nelle NP non sferiche rispetto alle loro controparti sferiche e ha dimostrato inoltre come il tasso di assorbimento decresce all’aumentare dell’aspect ratio (Florez et al., 2012). Questi stessi risultati sono stati ottenuti da Qiu e colleghi confrontando Au NP sferiche (30 nm x 33 nm, aspect ratio = 1) con tre tipi di Au NP bastoncellari differenti tra loro per aspect ratio (40 nm x 21 nm,
aspect ratio = 2; 50 nm x 17 nm, aspect ratio = 3 e 55 nm x 14 nm, aspect ratio =
4): Au NP bastoncellari ad alto aspect ratio erano internalizzate più lentamente, sia rispetto a quelle sferiche sia rispetto a quelle con aspect ratio basso (Qiu et al., 2010).
L’interazione tra forma e dimensione sembra quindi essere determinante per l’uptake e per la reattività cellulare.
1.4.3 Chimica e carica di superficie
La chimica di superficie rappresenta un altro fattore critico per determinare la tossicità delle NP. Tale caratteristica chimico-fisica, infatti, è rilevante dal punto di vista della chimica molecolare della cellula e dello stress ossidativo, in quanto può indurre un diverso assorbimento cellulare, localizzazione subcellulare e capacità di catalizzare la produzione di ROS.
A causa delle forze adesive in superficie le NP possono essere monodisperse oppure formare agglomerati e aggregati. La formazione di tali aggregati, tuttavia, oltre che dalla carica e dalla chimica di superficie dipende anche dal pH dell’ambiente in cui si trovano e dai compartimenti cellulari in cui si concentrano le NP. La carica di superficie, inoltre, è importante per l’assorbimento: la membrana e l’ambiente intracellulare sono carichi negativamente, quindi le NP anioniche vengono assorbite in quantità minore rispetto alle NP cationiche che infatti sono associate a risposte citotossiche più severe (Nan et al., 2008). A tal fine Cho et al. hanno condotto un esperimento su cellule SK-BR-3 di adenocarcinoma mammario utilizzando Au NP (17.7 1.6 nm in diametro) con carica neutra rivestite con citrato, cariche negativamente funzionalizzate con polivinilalcool (PVA) e con poliallamineidrocloride (PAA) che conferisce carica positiva: attraverso la spettrometria di massa (ICP-MS) è stato dimostrato come Au NP neutre e anioniche mostrino un tasso di assorbimento minore rispetto a quelle cationiche (Cho et al., 2009).
La chimica superficiale delle NP è responsabile delle loro proprietà idrofobiche e/o idrofiliche: NP idrofobiche hanno una minore dispersione nei liquidi biologici e nei mezzi di coltura (Ge et al., 2011) rispetto a quelle idrofiliche, tuttavia tale idrofobicità migliora la capacità di penetrazione delle NP nelle membrane cellulari e nei pori nucleari (Naim et al., 2009). Spesso per migliorare l’idrofilicità delle NP vengono utilizzati dei tensioattivi o vengono apportate delle modifiche chimiche (funzionalizzazione) alle loro superfici, tuttavia ciò può comportare anche un’alterazione delle risposte genotossiche (Cheng et al., 2013b; Jain et al., 2011; Coccini et al., 2010). Inoltre, modificando la chimica superficiale viene modificata anche la capacità delle NP di formare aggregati e la loro biocompatibilità.
In alcuni casi gli stessi rivestimenti apportati alle NP per alterarne la chimica di superficie possono scatenare risposte tossiche o migliorare l’assorbimento delle
NP, sovraccaricando i sistemi cellulari e provocando effetti dannosi; in alternativa tali funzionalizzazioni possono schermare le NP riducendone il potenziale tossico (Singh et al., 2009). Rossi e colleghi hanno studiato gli effetti di TiO2 NP non
rivestite e rivestite con biossido di silicio (SiO2) in vivo in topi e in vitro su
macrofagi murini (RAW 264.7) e fibroblasti polmonari umani (MRC-9). I risultati hanno mostrato che TiO2 NP rivestite inducono infiammazione polmonare nei topi
e aumentano il rilascio di citochine pro-infiammatorie in vitro. Il materiale di rivestimento è stato dimostrato non essere la causa diretta dell’infiammazione poiché la sola esposizione a SiO2 non ha indotto alcuna attività infiammatoria,
dimostrando così che alterazioni nelle proprietà di superficie delle TiO2 NP
possono influenzarne il potenziale infiammatorio (Rossi et al., 2010).
Un altro aspetto da considerare quando si studia la superficie delle NP sono le cosiddette “proteine della corona”. Per studiare le interazioni che intercorrono in
vitro tra NP e cellule, le NP vengono introdotte in ambiente fisiologico in cui sono
contenuti grandi quantità di amminoacidi, peptidi e proteine che vengono prontamente assorbite sulla superficie delle NP formando un rivestimento detto corona (Huang et al., 2013). La densità e la composizione di questo strato di proteine dipende dalla composizione dell’ambiente acquoso o fisiologico, in combinazione con le caratteristiche chimico-fisiche delle NP stesse, così che la corona sarà formata da una miscela complessa e dinamica di proteine. La corona di proteine che si forma sulla superficie delle NP ne altera la dimensione e la composizione superficiale, determinando così risposte fisiologiche tra cui l’internalizzazione, la cinetica, il trasporto, l’accumulo, l’estrusione e non da ultimo la tossicità dei nanomateriali.
Saggi di citotossicità cellulare hanno rivelato che il legame competitivo di proteine del sangue sulla superficie di SWCNT può modificare notevolmente i loro percorsi di interazione cellulare e risultare in una tossicità molto ridotta (Lynch et al., 2009). Inoltre, la corona di proteine influenza l’internalizzazione cellulare: l’assorbimento del complesso NP-proteine dipende dalla presenza, sulla membrana cellulare, di recettori in grado di riconoscere le proteine legate alle NP, le proteine inoltre devono essere presentate a tali recettori nel giusto orientamento e devono poter competere efficacemente per il recettore con le proteine libere (Lynch et al., 2009). Per identificare le proteine plasmatiche che si associano con le nanoparticelle e per correlare il loro legame con le proprietà chimico-fisiche delle particelle stesse
sono stati condotti numerosi studi (Walczyk et al., 2010; Lundqvist et al., 2008; Lynch et al., 2009), ma sono ancora necessarie ulteriori indagini per chiarire le interazioni tra le nanoparticelle e le proteine del mezzo biologico in cui sono disperse.
Possiamo concludere dunque che le proteine corona sono un elemento fondamentale da prendere in considerazione per definire l’identità biologica delle nanoparticelle (Walkey et al., 2012).
1.5 Modelli in vitro per lo studio della tossicità delle nanoparticelle
Per valutare gli effetti tossicologici delle nanoparticelle numerosi studi sono stati ad oggi condotti e a tal fine negli ultimi anni è emersa una nuova disciplina, la nanotossicologia, che appunto si occupa di investigare gli effetti che nanomateriali e nanoparticelle hanno sulla salute umana e sull’ambiente. L’obiettivo della nanotossicologia è comprendere appieno le caratteristiche chimico-fisiche delle nanoparticelle e le conseguenti proprietà tossicologiche (Suh et al., 2009).
Mediante i test in vivo è possibile determinare la tossicità delle NP considerando diversi parametri quali dose, via di esposizione, metabolismo, escrezione e risposta immunitaria (Zhang et al., 2010a). Tuttavia, a causa della loro complessità e delle loro peculiari caratteristiche che le rendono ognuna differente dalle altre, non è semplice determinare la tossicità delle NP in vivo (Aillon et al., 2009). I modelli in vivo sollevano problematiche non solo di natura etica legata alla sperimentazione sugli animali, ma anche riguardanti i costi elevati e le tempistiche relativamente lunghe per poter valutare la citogenotossicità delle NP e il loro potenziale cancerogeno.
I test in vitro sono più immediati e meno costosi rispetto a quelli in vivo (Hillegass
et al., 2010) e, pertanto, risultano più vantaggiosi nonostante non siano in grado di
replicare la complessità di un sistema in vivo o di fornire dati significativi sulla risposta fisiologica di un sistema vivente rispetto ad un agente tossico (Zhang et
al., 2010a).
I saggi in vitro che sono comunemente utilizzati per lo studio della potenziale citotossicità e genotossicità delle NP possono essere colorimetrici (MTT, Neutral
red uptake, alamar blue) oppure non colorimetrici (CFE, CBMN-cyt, FISH, test
della cometa, trasformazione morfologica).
1.6 Citotossicità basale: test colorimetrici e non colorimetrici
Per determinare la vitalità cellulare e la citotossicità di un composto i test di tipo colorimetrico, quali ad esempio l’MTT, sono largamente utilizzati in quanto relativamente semplici da svolgere.
Mentre per le sostanze chimiche tali saggi risultano accurati nel valutare la vitalità cellulare, per i nanomateriali presentano alcune limitazioni. A causa delle loro proprietà chimico-fisiche le NP possono interferire con i reagenti utilizzati nei saggi colorimetrici producendo risultati falsati da tali interferenze (Doak et al., 2009; Baer
et al., 2010; Dhawan e Sharma, 2010). Nel caso di TiO2 NP, ad esempio, sia MTT sia XTT sono stati dimostrati sovrastimare la vitalità cellulare e, di conseguenza, sottostimare il danno cellulare indotto dalle NP: il danno osservato è stato dimostrato originare dalla presenza di radicali liberi rilasciati dalle stesse TiO2 NP,
i quali radicali hanno convertito essi stessi i sali di formazano generando una non corretta interpretazione del segnale e dei risultati (Wang et al., 2011). In aggiunta, anche test condotti su TiO2 NP in assenza di cellule (test acellulari) hanno
evidenziato come si verifichi una interazione tra le NP ed i sali di formazano che sono precipitati in maniera proporzionale alla concentrazione di TiO2 NP presente
in soluzione (Lupu e Popescu, 2013).
L’utilizzo di test non colorimetrici quali il saggio di Efficienza di Formazione di Colonie (CFE) può essere una valida alternativa in quanto permette, senza l’utilizzo di sostanze coloranti o fluorescenti, di valutare la vitalità cellulare misurando la capacità di una singola cellula di formare una colonia. Il test CFE è inoltre risultato essere più sensibile rispetto ai metodi biochimici convenzionali poiché non misura un effetto biologico specifico, bensì la morte cellulare in generale (Ponti et al., 2006; Herzog et al., 2007).
Il saggio di Efficienza di Formazione di Colonie, che è attualmente in fase di approvazione come test alternativo per lo studio dei nanomateriali da parte dell’Organizzazione per la Cooperazione e lo Sviluppo Economico (OECD), è già stato utilizzato per studiare la citotossicità basale di vari tipi di NP. Per esempio,
Au NP hanno causato una diminuzione dimensione-dipendente della capacità di formare colonie da parte di fibroblasti murini (Coradeghini et al., 2013), così come i nanotubi di carbonio multistrato (Ponti et al., 2013). In cellule epiteliali colonrettali umane le NP di ossido di zinco, ma non quelle di biossido di titanio, hanno causato riduzione di CFE e quindi citotossicità (De Angelis et al., 2012), ed infine il test di efficienza di formazione di colonie ha evidenziato che SiO2 NP (15-80 nm
diametro medio) non sono tossiche in fibroblasti murini immortalizzati, e che il loro effetto è indipendente dalla loro dimensione (Uboldi et al., 2012).
Tuttavia, lo studio della tossicità basale non può essere sufficiente per spiegare le complesse interazioni tra NP e cellule: le nanoparticelle, infatti, una volta internalizzate nelle cellule, possono innescare meccanismi di tossicità quali infiammazione, stress ossidativo, genotossicità e cancerogenesi (Donaldson et al., 2010; Singh et al., 2009; Donaldson e Poland, 2012; Roy et al., 2014), ed è pertanto necessario svolgere parallelamente anche altri tipi di test che prendano in considerazione meccanismi d’azione alternativi.
1.7 Genotossicità
Nella nanotossicologia lo studio del potenziale genotossico delle NP riveste un ruolo fondamentale. È infatti di grande importanza comprendere se le NP inducono danno a livello del DNA e come questo danno avvenga. In funzione del meccanismo in seguito al quale si sviluppa danno genotossico la genotossicità indotta dalle NP può essere di tipo diretto o indiretto, primario o secondario.
Con genotossicità primaria si intende il danno genetico causato in assenza di infiammazione (Schins e Knaapen, 2007) ed in seguito all’interazione tra le NP con il DNA o con componenti ad esso associati che ne determinano l’integrità. Nel caso in cui si abbia interazione fisica diretta tra le NP e il DNA si parla di genotossicità primaria diretta: le NP entrano nel nucleo ed agiscono direttamente sul DNA oppure si accumulano all’interno della cellula e durante la mitosi interagiscono fisicamente o chimicamente con processi di divisione cellulare come la segregazione dei cromosomi (Gonzalez et al., 2008). Le NP possono anche interagire con i costituenti cellulari che guidano la segregazione cromosomica, come ad esempio il fuso mitotico (Donaldson et al., 2010).
Si parla invece di genotossicità primaria indiretta quando il danno al DNA è causato dalla produzione di specie reattive dell’ossigeno in risposta all’interazione con le NP con, contemporaneamente, una diminuzione di antiossidanti. La genotossicità indiretta può essere causata anche attraverso l’inibizione della riparazione del DNA inattivando, ad esempio, specifiche proteine coinvolte nei processi di riparazione (Beyersmann e Hartwing, 2008) o, ancora, si possono avere effetti tossici mediati dalla produzione, da parte delle NP, di specie ossidanti che possono diffondere nel nucleo e causare danno ossidativo.
La genotossicità secondaria, invece, è guidata da una risposta infiammatoria: l’attivazione, in presenza delle NP, di cellule infiammatorie da parte della risposta immunitaria innata porta all’aumento del consumo dell’ossigeno cellulare che causa il rilascio di radicali liberi ossidanti come superossido (O2-) e perossido
d'idrogeno (H2O2). Questi, reagendo con altri composti come l’ossido nitrico,
portano alla produzione di ulteriori specie reattive e al danno delle cellule circostanti e del DNA.
Diversi test in vitro possono essere impiegati per studiare quali siano gli effetti genotossici delle NP e attraverso quale meccanismo agiscano a livello del DNA. Tra questi test certamente il test del micronuelo con blocco della citodieresi, l’ibridazione in situ con sonde fluorescenti e il test della cometa sono utili strumenti.
1.7.1 Cytome - test del micronucleo con blocco della citodieresi (CBMN-cyt)
Aberrazioni cromosomiche quali i micronuclei (MN), i ponti nucleoplasmatici (NPB) e le evaginazioni nucleari (NBUD) sono biomarcatori di eventi genotossici e instabilità cromosomica che possono essere causati da eventi di vario tipo quali anche le NP.
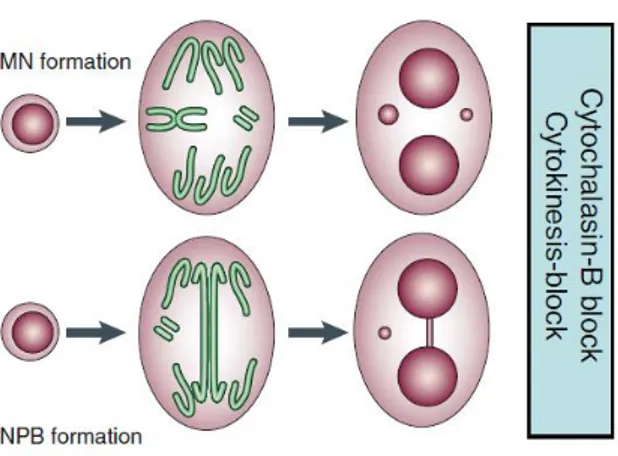
I MN (Figura 3) derivano principalmente da frammenti di cromosomi, cromatidi acentrici o interi cromosomi che non riescono ad essere inclusi nei nuclei figli al completamento della mitosi perché non si attaccano correttamente al fuso mitotico durante il processo di segregazione in anafase, e che vengono circondati da membrana nucleare (Fenech et al., 2011).
I frammenti acentrici possono derivare da vari meccanismi quali una rottura dell’elica del DNA che non viene riparata o che risulta malriparata a causa di difetti a carico di geni coinvolti nei meccanismi di riparazione; i frammenti acentrici possono formarsi anche in seguito a frammentazione cromosomica derivante dalla formazione di ponti nucleoplasmatici che, durante la telofase, vengono allungati e infine rotti (Hoffelder et al., 2004)
Figura 3. Formazione di MN e NPB in cellule in divisione. Micronuclei e ponti nucleoplasmatici
sono osservabili in cellule binucleate la cui attività di citocinesi sia stata inibita mediante l’uso di citocalasina-B (immagine tratta da Fenech, 2007).
MN costituiti da interi cromosomi possono invece derivare da ipometilazione delle citosine a livello delle sequenze ripetute centromeriche (DNA satellite) e paracentromeriche (Pironon et al., 2010). In condizioni normali il DNA satellite è fortemente metilato ai livello dei residui di citosina, ed in caso di ipometilazione causa malsegregazione dei cromosomi e/o la loro perdita, con conseguente formazione di MN imputabili a difetti nell’assemblaggio del cinetocore (Gieni et al., 2008; Heit et al., 2009).
I ponti nucleoplasmatici (NPB) originano, invece, da cromosomi dicentrici (Fenech
et al., 2011): durante l’anafase i centromeri vengono attirati ai poli opposti del fuso
mitotico e, se il ponte creatosi non si rompe, la membrana nucleare circonda i nuclei figli e il ponte formando così un NPB (Figura 3). I cromosomi dicentrici possono derivare da rotture malriparate della doppia elica di DNA o da fusione di estremità telomeriche (Fenech, 2010); queste ultime, a loro volta, possono essere causate da assemblaggi inappropriati delle strutture proteiche dei telosomi che
proteggono i telomeri oppure da un eccessivo accorciamento dei telomeri (Pampalona et al., 2010a). Infine, poiché all’inizio dell’anafase i cromatidi fratelli sono ancora uniti tra loro, difetti ereditari o acquisiti a livello dei complessi proteici coinvolti nella separazione dei cromatidi fratelli in anafase possono aumentare la formazione di NPB (Chan et al., 2007; Naim e Rosselli, 2009; Nasmyth e Haering, 2005).
Le evaginazioni nucleari (NBUD) rappresentano processi di eliminazione dei complessi di riparazione del DNA o di DNA amplificato che viene localizzato selettivamente a livello di siti specifici della periferia nucleare ed eliminato tramite “gemmazione” nucleare durante la fase S del ciclo cellulare (Fenech et al., 2011). Le NBUD possono formarsi anche in seguito a rottura di un NPB, con le due metà del ponte che si ritraggono verso i nuclei (Pampalona et al., 2010b; Utani et al., 2010). Tuttavia, la comprensione dei meccanismi che portano alla formazione di NBUD ma anche di MN e NPB non è ancora completa. Per esempio non si è compreso ancora totalmente come i polimorfismi relativi ai geni del mantenimento del genoma possano influenzare le frequenza di tali biomarcatori di genotossicità (Kirsch-Volders et al., 2010).
Per valutare questi tipi di aberrazioni cromosomiche in seguito ad esposizione a nanomateriali il test del micronucleo (OECD test guideline 487) rappresenta un valido strumento. Il test del micronucleo con blocco della citodieresi (CBMN-cyt) può essere effettuato applicando diverse strategie in base all’assenza o presenza di citocalasina-B durante il test. La citocalasina-B, infatti, riveste un ruolo fondamentale in quanto agisce sui filamenti di actina inibendo la citodieresi e favorendo la formazione di cellule binucleate nelle quali viene valutata la formazione di MN, NPB ed NBUD. Pertanto, il test del micronucleo può essere svolto applicando diverse varianti del protocollo (Gonzalez et al., 2011):
Nessun trattamento: non si aggiunge citocalasina-B alle cellule in coltura; Post trattamento: la citocalasina-B viene aggiunta alle colture cellulari dopo
il trattamento con le NP e dopo che queste sono state rimosse dal mezzo di coltura;
Co-trattamento: l’incubazione con citocalasina-B avviene simultaneamente al trattamento con le NP;
Co-trattamento ritardato: le cellule in coltura vengono supplementare con citocalasina-B successivamente al trattamento con NP che permangono nel mezzo di coltura.
Poiché la citocalasina-B, oltre ad inibire la citodieresi, inibisce anche l’endocitosi delle NP, al fine di permettere l’internalizzazione delle NP è importante quindi che sia aggiunta solo dopo l’inizio del trattamento con le NP secondo la strategia di co-trattamento ritardato (Doak et al., 2009; Gonzalez et al., 2011). Pertanto, proprio per permettere alle NP di essere internalizzate e per facilitare l’eventuale necessità di un’interazione fisica tra NP e DNA, i nostri esperimenti sono stati eseguiti con la strategia del co-trattamento ritardato, che prevede l’aggiunta della citocalasina-B alla 44ma ora dalla messa in coltura e 20 ore dopo la somministrazione di NP alle cellule. Tale strategia sperimentale consente di bloccare il ciclo cellulare dopo che sia avvenuta almeno una divisione nucleare ma prima che avvenga la citodieresi, permettendo così la formazione di cellule binucleate.
Il CBMN-cyt, però, è un test completo in quanto non consente solo di valutare il danno genotossico indotto dalla presenza di NP, ma permette anche di valutarne la citostasi e la citotossicità mediante la determinazione di parametri come l’indice di replicazione, l’apoptosi e la necrosi.
1.7.2 Ibridazione fluorescente in situ (FISH)
Come il CBMN-cyt consente di identificare aberrazioni cromosomiche quali i micronuclei, l’ibridazione fluorescente in situ (FISH) è una tecnica citogenetica che può essere utilizzata per rilevare e localizzare la presenza o l'assenza di specifiche sequenze di DNA su preparati citologici di cellule in metafase o interfase (Garimberti et al., 2010). La FISH utilizza delle sonde a fluorescenza, ossia sequenze di DNA coniugate con molecole reporter (fluorofori) che si legano in modo estremamente selettivo a specifiche regioni dei cromosomi e che permettono di discriminare se l’origine dei MN sia di tipo aneuploidogeno oppure clastogeno.
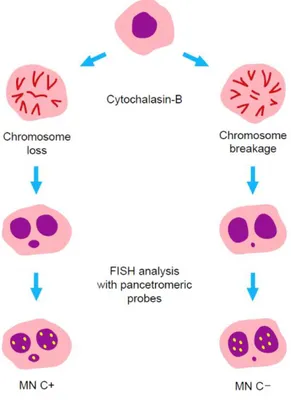
La FISH può dunque essere combinata con il test del micronucleo per valutare simultaneamente i vari tipi di danno cromosomico e la presenza di specifiche regioni genomiche all’interno dei micronuclei (Figura 4): può essere utilizzata per determinare se i MN derivino da un danno di tipo aneuploidogeno, che comporta una variazione nel numero dei cromosomi e quindi i MN contengono un cromosoma o la maggior parte di esso (micronuclei centromero-positivi), o se l’origine dei MN sia clastogena e quindi dovuta a frammentazione cromosomica in seguito alla quale i MN contengono frammenti di cromosomici acentrici (micronuclei centromero-negativi). A tale scopo si utilizzano sonde pancentromeriche omologhe al DNA alfoide, che è una porzione di DNA costituita da sequenze altamente ripetute, dette satelliti, che si ritrova nel centromero di tutti i cromosomi umani (Decordier et al., 2011).
Figura 4. Valutazione del danno cromosomico mediante FISH. MN centromero-positivi (MNC+)
derivano da un danno di tipo aneuploidogeno che comporta una variazione nel numero dei cromosomi; MN centromero-negativi (MNC-) originano invece da eventi clastogeni e quindi dovuti a frammentazione cromosomica (immagine tratta da Migliore et al., 2014).
Attraverso l’uso di sonde telomeriche, invece, è possibile differenziare i meccanismi di formazione dei ponti nucleoplasmatici: se un NPB origina dall’unione di estremità telomeriche all’interno del ponte sarà presente il segnale
relativo all’appaiamento della sonda, mentre quando un NPB origina da eventi di malriparazione del DNA non avremo segnale all’interno del ponte ma all’interno di eventuali micronuclei derivati da frammenti acentrici.
1.7.3 Test della cometa
Il test della cometa (comet assay), noto anche come elettroforesi su singola cellula (SCGE), è un test di mutagenesi per l'identificazione di rotture del filamento di DNA. La finalità del test della cometa è quella di verificare la capacità clastogena di una NP, ovvero di saggiare se questa sia in grado di generare nei cromosomi danni strutturali con conseguenti mutazioni cromosomiche. I danni possono essere rotture del singolo filamento o del doppio filamento di DNA che portano, in entrambi i casi, alla formazione di frammenti cromosomici (Figura 5).
Il test della cometa ha trovato applicazione in settori quali il biomonitoraggio delle popolazioni umane in seguito ad esposizione occupazionale o ambientale ad agenti genotossici, ma è anche impiegato nella valutazione dei danni ossidativi al DNA (Dusinska et al., 2008).
Figura 5: Immagini di nuclei visualizzati al microscopio a fluorescenza effettuando il comet
assay. Nucleo intatto (sinistra) e nucleo danneggiato (destra) dal quale è generata una “cometa” di
DNA frammentato visibile dopo corsa elettroforetica. Ingrandimento 400x.
Un aspetto fondamentale nella determinazione dei parametri applicativi del test della cometa e nell’interpretazione dei risultati è dato dal ruolo dei meccanismi di riparazione del DNA. Infatti, i parametri rilevati dal test della cometa possono essere fortemente influenzati dalla presenza e dall’efficienza dei differenti meccanismi di riparazione del DNA. Al riguardo, una variabile fondamentale negli studi in vitro è data dal tempo che intercorre tra la fine del trattamento con la
sostanza in esame e la visualizzazione dei risultati: tanto più il tempo viene ridotto tanto maggiore è l’efficienza del test nel rilevare la quota reale di danno dovuta all’azione della sostanza in esame. Questo aspetto non rappresenta però che solo una delle criticità in gioco. Comprendere l’influenza dei meccanismi di riparazione richiede infatti di considerare il tipo di lesione indotta, così come la sensibilità e la specificità del test migliorano notevolmente attraverso l’utilizzo di enzimi di restrizione che riconoscono specifici tipi di danni nel DNA (ad esempio danni di tipo ossidativo) e convertono le lesioni in rotture, aumentando la quantità di DNA nella coda della cometa e di conseguenza la sua intensità di fluorescenza (Collins, 2004). Nello specifico, l’enzima endonucleasi III (Endo-III) converte in rotture del filamento di DNA i siti in cui sono presenti pirimidine ossidate (Collins et al., 1993), mentre l’enzima formamidopirimidina glicosilasi (Fpg) riconosce specificamente le basi puriniche ossidate (Dusinska et Collins, 1996).
Il numero di frammenti prodotti dal trattamento enzimatico risulta direttamente proporzionale al danno ossidativo al DNA, mentre le loro dimensioni sono inversamente proporzionali a quest’ultimo. Di conseguenza, poiché la lunghezza e l’intensità di fluorescenza della coda (tail moment) sono direttamente proporzionali al livello di frammentazione del DNA ed inversamente proporzionali alle dimensioni dei frammenti, il tail moment ottenuto dopo trattamento con gli enzimi di restrizione consente una determinazione semiquantitativa del danno ossidativo al DNA. Tale stima può essere ricavata dal confronto tra il tail moment medio di lisati cellulari trattati con gli enzimi ed il tail moment medio di cellule non trattate con gli enzimi, che è rappresentativo della frammentazione diretta al DNA (Karlsson, 2010). Una possibile interazione che potrebbe portare a una quantità inferiore di DNA nella coda della cometa è la presenza di NP all’interno del nucleoide: le NP potrebbero ostacolare la migrazione del DNA e nello stesso tempo potrebbero inficiare l’azione degli enzimi, diminuendone così la possibilità di rilevare i danni ossidativi (Karlsson, 2010).
A tal proposito, nel presente studio è stato valutato il danno primario ed ossidativo indotto al DNA da TiO2 NP in concentrazioni sub-tossiche e che non abbiano
2. SCOPO DELLA TESI
Il presente lavoro di tesi si colloca all’interno di un progetto di ricerca europeo, SanoWork, che ha come obiettivo quello di saggiare vari tipi di nanoparticelle al fine di determinarne i potenziali effetti tossici nei sistemi biologici e garantire ambienti di lavoro sicuri a coloro che lavorano a contatto con i nanomateriali. Questo studio ha quindi lo scopo di valutare le risposte biologiche, in termini di citotossicità e genotossicità, in colture cellulari in vitro in seguito all’esposizione a nanoparticelle di biossido di titanio (TiO2 NP) nude e con diversi rivestimenti
superficiali (rivestite con sodio citrato e con biossido di silicio).
Il sistema in vitro da noi utilizzato è costituito da pneumociti umani di tipo II derivati da adenocarcinoma polmonare (linea cellulare A549) che rappresentano un modello in vitro di una delle principali vie d’ingresso delle nanoparticelle, il sistema respiratorio. Lo scopo di questo lavoro è verificare se la funzionalizzazione delle TiO2 NP con sodio citrato e biossido di silicio induca
una diversa bioreattività, valutata mediante analisi del potenziale citogenotossico, rispetto allo stesso materiale non rivestito.
L’analisi delle tre differenti nanoparticelle di TiO2 e del materiale di riferimento
Aeroxide P25 consentirà di eseguire uno studio comparativo evidenziando, qualora fossero presenti, analogie e/o differenze nelle risposte biologiche delle colture di A549, e che possono variare in funzione della dimensione, della forma e del rivestimento delle NP.
La valutazione del potenziale citotossico e genotossico è stata eseguita a tempi di esposizione crescenti (24-48-72 ore) e a concentrazioni di massa comprese nell’ intervallo tra 1.25 e 80 µg/cm2. L’effetto citotossico di TiO
2 NP è stato
valutato mediante la capacità cellulare di formare colonie (CFE), mentre la genotossicità tramite il test della cometa, compresa la sua variante che utilizza enzimi di restrizione sensibili all’ossidazione delle basi puriniche e pirimidiniche, e il test del micronucleo con blocco della citodieresi nella sua versione “cytome” (CBMN-cyt), che consente una contestuale valutazione della citostasi e citotossicità indotta. Per verificare se la genotossicità osservata derivasse da meccanismi clastogeni o aneuploidogeni è stato effettuato il test di ibridazione
in situ (FISH) sfruttando la capacità delle sonde pancentromeriche di ibridarsi al
3. MATERIALI E METODI
3.1 Nanoparticelle di biossido di titanio: sintesi e caratterizzazione
Le nanoparticelle di biossido di titanio (TiO2 NP) utilizzate in questo lavoro
sperimentale sono state sintetizzate dal Consiglio Nazionale delle Ricerche (CNR), Istituto di Scienza e Tecnologia dei Materiali Ceramici (ISTEC) con sede a Faenza, Italia.
Poiché le TiO2 NP vengono utilizzate come additivi fotocatalitici nelle ceramiche lo
studio del loro possibile effetto cito- e genotossico rientra nell’ambito del progetto
Sanowork (Safe nano worker exposure scenarios, contratto numero 280716),
finanziato dal 7° programma quadro dell’Unione Europea, il cui fine è sviluppare ed identificare scenari non tossici di esposizione occupazionale a nanomateriali. TiO2 NP commerciali (Colorobbia; Firenze, Italia) sono state trattate in modo da
riprodurre le condizioni alle quali sono esposti coloro che utilizzano tali nanomateriali in ambiente lavorativo. Questo tipo di TiO2 NP, definite come
“materiale pristino”, sono state successivamente trattate chimicamente in modo da potenziarne l’adesione ai substrati ceramici: mediante metodo colloidale le TiO2
NP pristine sono state rivestite con nanoparticelle inorganiche di biossido di silicio (SiO2 NP; W. R. Grace Italiana S.p.A.; Milano, Italia) o con trisodio citrato diidrato
(Sigma Aldrich; Milano, Italia). Le TiO2 NP rivestite con silicio sono state
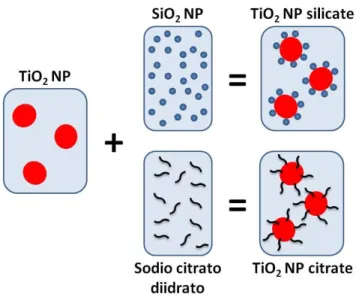
sintetizzate mediante etero-coagulazione (Figura 6): SiO2 NP e TiO2 NP aventi
carica superficiale opposta sono state miscelate in modo da ottenere un rapporto SiO2:TiO2 pari a 1:3 e un peso solido finale del 3% (w/w). Al termine della reazione
le TiO2 NP silicate sono state macinate per 24 h con sfere di zirconio (5 mm
diametro) fino ad ottenere una soluzione lievemente opaca.
Per modificare la superficie di TiO2 NP con sodio citrato è stato invece applicato
un protocollo di auto-assemblaggio (Figura 6): una soluzione di trisodio citrato diidrato è stata aggiunta ad una sospensione di TiO2 NP pristine in modo da
ottenere un rapporto citrato:TiO2 NP pari a 1:0,83 e un peso solido finale del 3%
(w/w). La reazione è stata quindi portata a compimento lasciando la soluzione in agitazione per 12 ore fino ad ottenere una sospensione stabile e cristallina.
Figura 6: Schema esemplificativo della funzionalizzazione di TiO2 NP con biossido di silicio e con sodio citrato diidrato. Mediante interazioni elettrostatiche, SiO2 NP cariche negativamente (-23
mV a pH 3.0) si distribuiscono attorno a TiO2 NP che posseggono, invece, carica positiva (+149 mV a
pH 1.5). La funzionalizzazione di TiO2 NP con sodio citrato è invece avvenuta mediante
auto-assemblaggio.
Nanoparticelle di biossido di titatnio Aeroxide® P25, con un rapporto anatase:rutile pari a 70:30, sono state acquistate da Evonik (Essen, Germania) e utilizzate come materiale di riferimento.
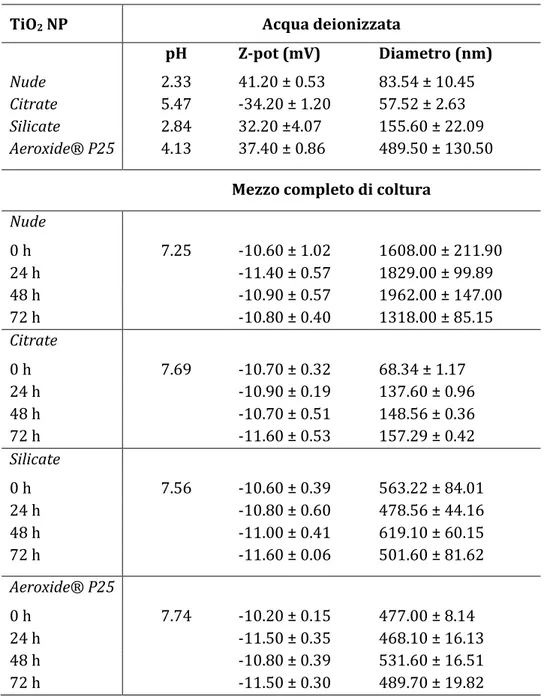
La caratterizzazione chimico-fisica delle TiO2 NP (Tabella 1) è stata eseguita
misurando, mediante la tecnica DLS (dynamic light scattering), il diametro idrodinamico e il potenziale Z delle NP disperse in acqua deionizzata (soluzione nativa) e in mezzo completo di coltura (Ham’s F12 supplementato con 10% siero bovino fetale e 1% antibiotico). Le misurazioni sono state eseguite utilizzando uno Zetasizer nano (ZSP model ZEN5600; Malvern Instruments, UK). A t = 0 ore ogni soluzione madre di TiO2 NP è stata sonicata per 15 min e aliquote di NP sono
state aggiunte a soluzioni 0.05% di albumina di siero bovino (BSA; Sigma-Aldrich, Italia) in phospate buffered solution (PBS; Invitrogen, Italia) in modo da ottenere degli intermedi che, messi in mezzo completo di coltura, risultassero avere una concentrazione di 1.25 μg/cm3. In modo da valutare la stabilità colloidale delle TiO2 NP, le analisi in mezzo di coltura sono state eseguite anche a tempi crescenti
di esposizione (t = 24-48-72 ore), ed a tal fine le sospensioni di TiO2 NP sono
Utilizzando una tecnica elettroacustica (AcoustoSizer II equippaggiato con un sistema automatico di calibrazione, Colloidal Dynamics, Australia) che ha permesso di identificare il punto di zero Z-potential (punto isolelettrico) delle sospensioni di TiO2 NP, le misure di potenziale Z in funzione del pH sono state
eseguite in acqua deionizzata ed alla concentrazione finale di 100 µg/cm3 (Tabella 1).
Tabella 1. Determinazione del potenziale Z e della dimensione media di TiO2 NP (1.25 µg/cm3)
in acqua deionizzata ed in mezzo complete di coltura.
TiO2 NP Acqua deionizzata
pH Z-pot (mV) Diametro (nm)
Nude 2.33 41.20 ± 0.53 83.54 ± 10.45
Citrate 5.47 -34.20 ± 1.20 57.52 ± 2.63
Silicate 2.84 32.20 ±4.07 155.60 ± 22.09
Aeroxide® P25 4.13 37.40 ± 0.86 489.50 ± 130.50
Mezzo completo di coltura
Nude 0 h 7.25 -10.60 ± 1.02 1608.00 ± 211.90 24 h -11.40 ± 0.57 1829.00 ± 99.89 48 h -10.90 ± 0.57 1962.00 ± 147.00 72 h -10.80 ± 0.40 1318.00 ± 85.15 Citrate 0 h 7.69 -10.70 ± 0.32 68.34 ± 1.17 24 h -10.90 ± 0.19 137.60 ± 0.96 48 h -10.70 ± 0.51 148.56 ± 0.36 72 h -11.60 ± 0.53 157.29 ± 0.42 Silicate 0 h 7.56 -10.60 ± 0.39 563.22 ± 84.01 24 h -10.80 ± 0.60 478.56 ± 44.16 48 h -11.00 ± 0.41 619.10 ± 60.15 72 h -11.60 ± 0.06 501.60 ± 81.62 Aeroxide® P25 0 h 7.74 -10.20 ± 0.15 477.00 ± 8.14 24 h -11.50 ± 0.35 468.10 ± 16.13 48 h -10.80 ± 0.39 531.60 ± 16.51 72 h -11.50 ± 0.30 489.70 ± 19.82