INDICE
1. LE INFEZIONI CORRELATE ALL’ASSISTENZA ...2
1.1. Introduzione ...2
1.2. Storia e normativa ...3
1.3. Hai: definizione ed epidemiologia ...11
1.4. Fattori associati ...13
1.5. Impatto sulla salute ...16
1.6. Impatto economico...17
2. MISURE DI SORVEGLIANZA E PREVENZIONE DELLE INFEZIONI CORRELATE ALL’ASSISTENZA...20
2.1. Introduzione ...20
2.2. Il Comitato delle infezioni ospedaliere(CIO)...21
2.3. La sorveglianza ...25
2.4. Misure a livello nazionale ed internazionale...27
2.5. Misure di controllo e prevenzione...31
2.5.1. Linee guida e protocolli ...31
2.5.2. Best practice...36
2.5.3. Pulizia, disinfezione e sterilizzazione degli ambienti e dei dispositivi medici e chirurgici...38
2.6. Valutazione: indicatori e audit ...42
3. L’ESPERIENZA DEI PRESIDI OSPEDALIERI DELLA FONDAZIONE TOSCANA “GABRIELE MONASTERIO” DI PISA E MASSA CARRARA...44
3.1. La Fondazione “G. Monasterio” ...44
3.2. Il CIO ...46
3.3. Obiettivi della tesi ...48
3.4. Materiali e metodi ...49
3.5. Risultati ...50
3.6. Presentazione di un progetto aziendale ...52
3.7. Valutazioni di base e criticità...69
3.8. Azioni intraprese ...71
3.8.1. Sorveglianza microrganismi multiresistenti (MDRO)...72
3.8.2. Monitoraggio infezioni del sito chirurgico ...76
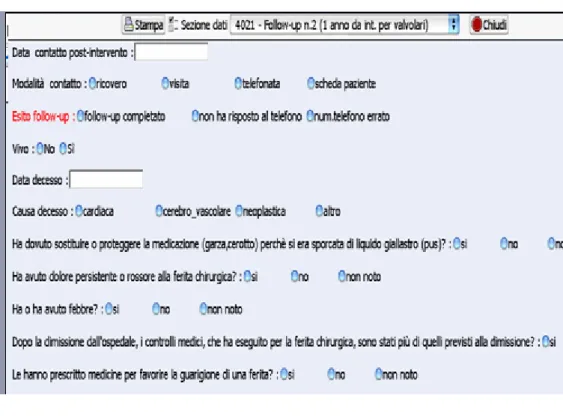
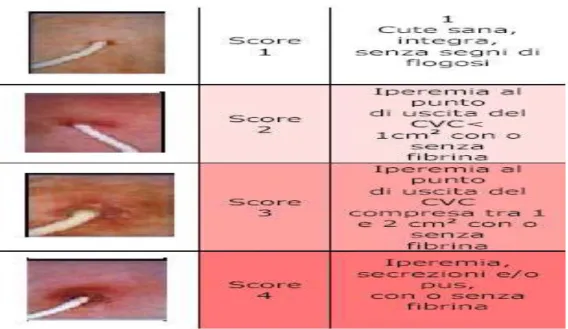
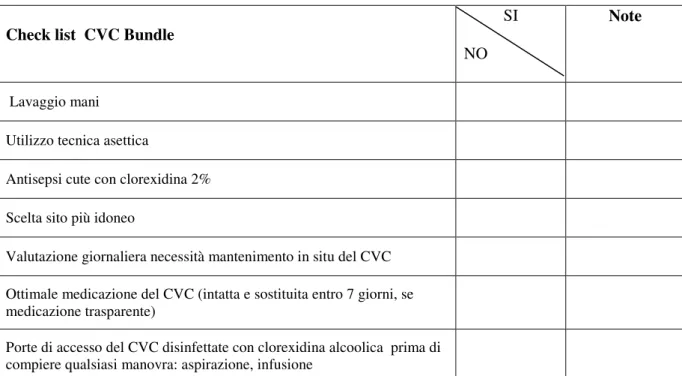
3.8.3. Monitoraggio del Catetere Venoso Centrale...81
3.8.4. Monitoraggio del catetere vescicale...89
3.9. Conclusioni ...90 Bibliografia
1. LE INFEZIONI CORRELATE ALL’ASSISTENZA 1.1. Introduzione
Il tema della sicurezza del paziente, cioè l’insieme delle azioni mirate a prevenire i rischi evitabili dovuti dall’assistenza sanitaria, negli ultimi anni ha assunto un ruolo centrale per i servizi sanitari. Tra i più frequenti rischi evitabili le infezioni correlate all’assistenza (ICA), legate alle pratiche sanitarie, causano un prolungamento dell’ospedalizzazione con un incremento della disabilità, dei costi per le famiglie e la sanità e delle morti evitabili rappresentando uno dei fenomeni più rilevanti in questo ambito.
Negli ultimi anni nella pratica clinica si è affermato sempre più tra gli operatori il tema delle infezioni correlate all’assistenza, che risultano manifestarsi più frequentemente a causa dell’introduzione di nuove tecnologie e procedure sanitarie invasive, dell’aumento di ceppi batterici resistenti dovuti all’inappropriato e smodato utilizzo di antibiotici, dell’incremento di pazienti con patologie concomitanti complesse.
Nonostante gli elevati costi che gravano sulla spesa sanitaria, con il conseguente impatto sociale ed economico, i sistemi di sorveglianza e controllo sono assai disomogenei sia a livello nazionale che internazionale.
Nell’ultimo decennio si stanno facendo passi in avanti nella conoscenza delle ICA e si sono implementati programmi di prevenzione per mano di importanti organi di sanità pubblica in molti paesi.
Tra gli obiettivi (PSR Toscana 2008-2010) troviamo che deve esserci il miglioramento della qualità della pratica assistenziale e della sicurezza di pazienti e operatori, da conseguire attraverso la produzione, l’implementazione e la verifica di impatto di protocolli e linee guida condivisi.
E’ comunque auspicabile riuscire a sensibilizzare nei prossimi anni il maggior numero possibile di operatori per arrivare a compiere una prevenzione mirata e riuscire ad abbattere le infezioni correlate all’assistenza.
1.2. Storia e normativa
Sin da I sec. a.C. con Terenzio Marrone si intuì l’esistenza di entità vive in grado di provocare malattie infettive.
Però solo nel XVI secolo fu preso di nuovo in considerazione dell’esistenza di malattie trasmissibili con Girolamo Fracastoro: per questo medico e poeta veronese, gli agenti etiologici delle malattie contagiose erano sostanze vive che lui denominava “virus” o “seminaria” che avevano per l’organismo contagiato una particolare “antipatia” materiale e spirituale.
Tra la fine dell’800 e l’inizio del 900, la scoperta dei microrganismi permise di orientare gli studi principalmente sui germi e quindi di puntualizzare misure preventive, atte a ridurre la trasmissione di germi verso il paziente.
Gli studi effettuati dal medico ungherese Ignàc Fülöp Semmelweiss specialista in ostetricia e ginecologia, permisero di scoprire la prima forma d’infezione a trasmissione ospedaliera.
Egli mise a confronto le puerpere che partorivano nel I padiglione del suo ospedale, gestito dai medici, con quelle che partorivano nel II padiglione, gestito solamente dalle ostetriche: vide che nel I padiglione l’incidenza di febbre puerperale era dell’11%, mentre nel II era dell’1%.
La sua intuizione uscì fuori quando un suo collega morì dopo essersi accidentalmente tagliato durante un’autopsia effettuata su una donna morta per febbre puerperale, a sua volta l’autopsia sul corpo del medico rivelò reperti anatomopatologici sovrapponibili a quelli della puerpera. A questo punto Semmelweiss trasse la conclusione che le donne morivano perché contagiate dalle mani dei medici che le visitavano dopo aver eseguito autopsie.
Egli impose ai medici di lavarsi le mani e di cambiare le lenzuola quando le donne arrivavano in ospedale: in questo modo in due anni riuscì a ridurre drasticamente l’incidenza dall’11% all’1%.
Anche l’infermiera Florence Nightingale nel 1860 definì l’ospedale come fonte di contagio, nello specifico evidenziò come il sovraffollamento e la conseguente riduzione del livello di igiene, portasse ad un aumento della mortalità di alcuni gruppi di pazienti.
Si deve arrivare al XX secolo per l’introduzione di misure di prevenzione delle infezioni soprattutto in campo chirurgico con l’introduzione dei dispositivi di protezione individuale quali guanti, mascherine e camici per limitare la contaminazione batterica.
L’applicazione di tecniche asettiche, inoltre, permise di porre sotto controllo la diffusione delle infezioni in ospedale.
L’introduzione sul mercato degli antibiotici dopo la 2° Guerra Mondiale portò alla falsa credenza che questi farmaci potessero portare alla eradicazione delle infezioni. Purtroppo negli anni ’50 in Inghilterra e negli Stati Uniti si verificò una pandemia di infezioni dovute a stafilococco meticillino resistente e quindi cadde il mito della distruzione dei microrganismi con gli antibiotici.
Questo evento portò alla nascita di gruppi multidisciplinari all’interno degli ospedali per monitorare fenomeni di infezione diffuse su larga scala e alla formulazione di nuovi studi.
E’ in questi anni che si ha la nascita dei Comitati per il controllo delle infezioni ospedaliere (CIO) e l’introduzione di una nuova figura quale è la infermiera addetta al controllo delle infezioni (infection control nurse).
Intorno agli anni ’70, negli Stati Uniti, nasce il NNIS (National Nosocomial Infection Study), coordinato dai Center for Disease Control di Atlanta e al quale aderirono su base volontaria delle strutture ospedaliere.
Con questo studio si è arrivati a fare un’analisi quantitativa del fenomeno infezioni ospedaliere, inoltre è servito come spunto per altri studi e altre indagini epidemiologiche tese ad indagare fattori di rischio più importanti.
Andando avanti con gli anni gli epidemiologi hanno sviluppato maggiormente l’attenzione nella valutazione dell’efficacia delle misure di prevenzione. Riguardo a questo dobbiamo considerare lo studio SENIC (Study of Efficacy of Nosocomial
Infection Control) che come obiettivo ha avuto quello di verificare quanto era stato fatto negli Stati Uniti in materia di diffusione delle misure preventive e di valutare i risultati delle misure stesse. Da tale studio originarono le prime raccomandazioni atte ad evidenziare misure di prevenzione improntate alla riduzione di infezioni da parte dei germi nei confronti del paziente.
Per quanto riguarda la situazione europea il Consiglio d’Europa emanò sin dal 1971 numerose raccomandazioni ai singoli governi in merito al problema delle infezioni ospedaliere. In Italia il Ministero della Sanità, per uniformarsi sia all’Europa che agli Stati Uniti, ha emanato la circolare n. 52 del 20/12/85 e successivamente la circolare n. 8 del 30/01/88 in materia di “lotta alle infezioni ospedaliere”: con queste ha completamente recepito le raccomandazioni europee ed ha indicato quali figure devono far parte del Comitato delle infezioni ospedaliere (CIO), oltre a dare suggerimenti di tipo organizzativo da attuare in ciascun presidio ospedaliero.
Il CIO era stato previsto anche dal Decreto del Ministero della Sanità 13 Settembre 1988 sulla determinazione degli standard del personale ospedaliero e anche dall’art. 135 del DPR n. 384 del 28/11/90 che disciplinava le “commissioni per la verifica e la revisione della qualità dei servizi e delle prestazioni sanitarie”. Nel Decreto legge n. 502 del 30/12/92 viene inoltre introdotto il concetto di accreditamento delle istituzioni e dell’adozione del sistema di verifica e revisione della qualità delle attività svolte e delle prestazioni erogate.
Questo concetto lo ritroviamo nella legislatura successiva e nella stesura dei piani sanitari nazionali a partire dal triennio 1994-1996. In questo troviamo tutte le misure che devono essere considerate per attuare la prevenzione della trasmissione delle infezioni ospedaliere.
Il DPR del 14/01/07 definisce linee guida in materia di requisiti strutturali, tecnologici ed organizzativi minimi per l’esercizio delle attività sanitarie da parte delle strutture pubbliche e private in particolare viene stabilito che “…devono essere predisposti una raccolta di regolamenti interni, linee guida, aggiornati per lo svolgimento delle procedure tecniche più rilevanti…, in particolare:
modalità di prelievo (es. emoculture), conservazione, trasporto dei materiali organici da sottoporre ad accertamento;
modalità di pulizia, lavaggio, disinfezione e sterilizzazione di tutti gli strumenti ed accessori;
pulizia e sanificazione degli ambienti;
modalità di compilazione, conservazione, archiviazione dei documenti comprovanti un’attività sanitaria (notifica di infezioni ospedaliere, trascrizione in cartella dell’indicazione alla cateterizzazione..).
Con il decreto ministeriale 13/09/1998 “al fine di accertare la qualità dell’assistenza sanitaria” il Ministero della sanità ha di nuovo evidenziato l’importanza e la necessità dell’istituzione della Commissione di controllo all’interno di ogni azienda ospedaliera, definendo anche i compiti che spettano al Direttore Sanitario, quale responsabile del governo clinico aziendale.
Nel Piano Sanitario Nazionale 1998-2000 venne confermata l’importanza delle infezioni ospedaliere come indicatore della qualità dell’assistenza prestata ai pazienti ricoverati, ponendo, fra gli obiettivi per il triennio di riferimento, la riduzione di almeno il 25% dell’incidenza delle infezioni e l’attivazione di un programma per la sorveglianza.
L’importanza del controllo delle infezioni correlate all’assistenza è stata ribadita anche nei PSN 2003-2005, 2006-2008.
Nel piano 2008-2010 venne proposta l’introduzione di protocolli per garantire l’appropriatezza della terapia antibiotica e una campagna di diffusione sull’importanza dell’igiene delle mani.
La Toscana sino ad oggi è stata una regione molto attiva in questo campo, sia sul piano legislativo che progettuale. La normativa prodotta in ambito regionale a partire dal 2004 che comprende misure di prevenzione delle infezioni è molto ricca:
Piano Sanitario Regionale 2002-2004, prevede interventi mirati di
prevenzione e tutela della salute all’interno delle strutture sanitarie, inserendo tra gli obiettivi prioritari la riduzione dell’incidenza delle infezioni correlate all’assistenza di almeno il 25%
Deliberazione Giunta Regionale 27 dicembre 2004 n. 1387 - Linee di indirizzo per la gestione del rischio clinico e la sicurezza del paziente nelle Aziende sanitarie + Allegato Linee di indirizzo per le Aziende Pubblicata nel B.U.R.T 19 gennaio 2005, n. 3
Deliberazione Giunta Regionale 21 febbraio 2005, n. 302 Gestione del Rischio Clinico e Sicurezza del Paziente. Collaborazione con le professioni mediche e azioni di supporto. Pubblicata nel B.U.R.T 16 MARZO 2005, n.11 Deliberazione Consiglio Regionale 16 febbraio 2005, n. 22 Piano sanitario
regionale 2005-2007. In particolare: 3.4.9.1 “Il Governo clinico” e 6.3 "Gli indicatori delle azioni di Piano e dei progetti speciali") Pubblicata nel B.U.R.T 23 marzo 2005, n. 12 Supplemento n. 5
Deliberazione Giunta Regionale 3 aprile 2006, n. 225 Piano sanitario regionale 2005-2007. Azioni di coordinamento e sviluppo delle attività di gestione del rischio clinico, B.U.R.T 26 aprile 2006, n. 17
Deliberazione Consiglio Regionale 4 ottobre 2006, n. 109 Requisiti accreditamento rischio clinico, B.U.R.T 25 ottobre 2006, n. 43
Deliberazione Giunta Regionale 5 maggio 2008, n. 341 Legge regionale n.40/2005, art. 43. Costituzione del Comitato di Coordinamento Regionale e del Comitato Tecnico Scientifico per la prevenzione e la lotta delle infezioni correlate ai processi assistenziali (ICPA)
Decreto Giunta Regionale 1 dicembre 2008, n. 5737 Nomina componenti del Comitato di Coordinamento regionale per la prevenzione e la lotta delle infezioni correlate alle pratiche assistenziali Pubblicato integralmente sulla Banca Dati degli Atti amministrativi della Giunta regionale
Legge regionale 05 agosto 2009, n. 51 Norme in materia di qualità e sicurezza delle strutture sanitarie: procedure e requisiti autorizzativi di esercizio e
sistemi di accreditamento.
Decreto del Presidente della Giunta Regionale 24 dicembre 2010, n. 61/R Regolamento di attuazione della legge regionale 5 agosto 2009, n. 51
(Norme in materia di qualità e sicurezza delle strutture sanitarie: procedure e requisiti autorizzativi di esercizio e sistemi di accreditamento) in materia di autorizzazione ed accreditamento delle strutture sanitarie.
Piano Sanitario Regionale 2008-2010, prevede il mantenimento e lo sviluppo di iniziative di sorveglianza e il monitoraggio di dati correnti in associazione ad un miglioramento della qualità della pratica assistenziale e della sicurezza dei pazienti e degli operatori, da conseguire attraverso la produzione,
l’implementazione e la verifica di impatto di protocolli e linee guida condivisi.
In parallelo allo sviluppo della normativa sono stati avviati una serie di progetti e studi atti a valutare l’entità del fenomeno e l’efficacia delle attività di prevenzione messe in atto. Uno dei progetti più importanti è il CORIST (Controllo Rischio Infettivo in Sanità in Toscana), dedicato alla prevenzione e al controllo delle Infezioni Correlate a Pratiche Assistenziali (ICPA) e condotto dall’ARS.
1.3. Hai: definizione ed epidemiologia
Le infezioni ospedaliere (IO) sono infezioni che insorgono durante il ricovero in ospedale, o in alcuni casi, dopo che il paziente è stato dimesso, e che non erano manifeste clinicamente né in incubazione al momento dell’ammissione in ospedale. Tali infezioni interessano prevalentemente i pazienti ospedalizzati ma possono anche essere acquisite dal personale sanitario coinvolto nell’assistenza.
L’evoluzione dei sistemi sanitari ha reso con il tempo inadeguata questa definizione: l’ospedale essendo sempre più una struttura ad alta concentrazione tecnologica, destinata ad affrontare problemi sanitari acuti in tempi relativamente ristretti ha delegato l’erogazione di molte prestazioni, anche ad alto contenuto tecnologico ed alta complessità, a strutture ambulatoriali o in regime di day hospital, a strutture per lungo degenza, RSA o a servizi di assistenza domiciliare, nei quali l’incidenza delle infezioni rappresenta un problema comparabile a quello osservato all’interno delle strutture ospedaliere.
Le infezioni ospedaliere vengono così ora propriamente definite Infezioni correlate all’Assistenza (ICA, HAI health care-associated infection) definizione che comprende tutte le infezioni contratte durante l’assistenza e comprendendo anche le infezioni che possono essere contratte dagli operatori che lavorano a contatto con i pazienti.
I CDC definiscono un HAI come “una condizione sistemica o localizzata dovuta ad una reazione avversa legata alla presenza di un agente/i patogeno/i o della sua
tossina/e. Non devono esserci evidenze che l’infezione fosse presente o in incubazione al momento dell’ammissione”.
Le ICA sono un importante problema di sanità pubblica sia per le gravi ripercussioni sul paziente con un aumento (5 giorni) della degenza media, sia per quel che riguarda il controllo e la valutazione della qualità delle prestazioni erogate dai professionisti sanitari.
Importante è anche evidenziare che per ogni tipo di infezione vengono definiti dei criteri per fare diagnosi.
- Il paziente presenta almeno uno fra i seguenti segni: A) Drenaggio purulento dall’incisione
B) Isolamento di microrganismi da una coltura di materiale prelevato asetticamente C) Uno dei seguenti segni e sintomi di infezione: dolore o sensibilità, gonfiore localizzato, arrossamento o calore e l’incisione superficiale è volutamente aperta dai chirurghi e la sua coltura è risultata positiva
- Diagnosi di infezione del sito chirurgico effettuata dai chirurghi o altri medici che si occupano del paziente
Con la presenza di questi segni possiamo fare diagnosi di infezione del sito chirurgico (ISC) come una HAI. In questo modo i dati sono ben omologati e si riduce il fenomeno di sottostimare gli stessi.
1.4. Fattori associati
L’insorgenza di una infezione, sia essa ospedaliera o comunitaria, è determinata da una serie di fattori correlati all’agente infettante, alle modalità di trasmissione e all’ospite.
Il primo anello della catena epidemiologica dell’infezione è rappresentato dall’agente infettante, la cui patogenicità, virulenza, invasività e dose infettante variano a seconda del microrganismo. Le sorgenti di infezione possono essere endogene (flora batterica dello stesso paziente) o esogene (altri pazienti, personale, attrezzature mediche, ambiente). L’ecosistema rappresentato dall’ospedale può incidere anche sui microrganismi provenienti da fonte endogena, allorquando essi vengano modificati dalla pressione selettiva antibiotica, o dei disinfettanti utilizzati in ambito ospedaliero, o semplicemente da una troppo lunga degenza prima di una manovra invasiva. La fonte di infezione però nella maggior parte dei casi è costituita da una persona sana che fa parte del personale di assistenza o da altri pazienti infetti. La trasmissione rappresenta il secondo anello della catena. il contatto diretto e indiretto, la via aerea, la trasmissione mediata da veicoli e vettori rappresentano le modalità attraverso le quali un agente infettante penetra nell’ospite, terzo e
definitivo anello della catena epidemiologica. I veicoli dell’infezione possono essere molteplici: le mani, lo strumentario, le infusioni di sostanze e farmaci, l’ambiente, gli effetti letterecci, gli umidificatori, i nebulizzatori , gli impianti di ventilazione, il cibo, gli arredi, i mobili e i pavimenti. L’importanza degli arredi e dei mobili è costituita dal fatto che il personale può toccare queste superfici contaminate e
trasferire i microrganismi, tramite le mani, al paziente, mentre per quanto riguarda i pavimenti la loro importanza è relativa al sollevamento di polveri con microrganismi spesso multiresistenti. Nel determinismo dell’insorgenza di un’infezione
intervengono i vari fattori specifici dell’ospite, compresi i suoi meccanismi di difesa. Spesso il paziente ricoverato ha un’alterazione o una scarsa efficienza dei sistemi difensivi, se non addirittura un vero e proprio stato di immunodeficienza. In questo caso anche agenti a bassa patogenicità e virulenza possono essere causa di infezioni gravi e, talora letali.
I fattori che concorrono all’insorgenza di una infezione ospedaliera quindi sono molti e possono essere classificati in tre tipi:
- correlati all’ospite
- correlati al profilo dell’assistenza - correlati alla qualità dell’assistenza
Per quanto riguarda i fattori correlati all’ospite quelli più critici sono:
- l’età, con un rischio maggiore per i pazienti che hanno più di 65 anni o meno di 1 anno soprattutto nei paesi a basso reddito;
-le patologie di base del paziente, in particolare le forme sistemiche come diabete insufficienza epatica, renale, neoplasie, emolinfopatie sistemiche e collagenopatie; -lo stato del sistema immunitario
Secondo studi recenti nei bambini più che l’età, influirebbe sull’aumentato rischio di contrarre un HAI, il basso peso alla nascita, soprattutto se inferiore a 1500 g. Questi studi condotti in Canada e in Germania hanno infatti riportato percentuali di
infezioni di HAI in neonati sotto i 1500 g rispettivamente di 23.5 (5) e 12.3 % (27), valori nettamente superiori a quelli registrati nelle terapie intensive pediatriche (5.7% circa)1
Per quanto riguarda i fattori correlati al profilo di assistenza, essi riguardano innanzitutto il tipo di reparto in cui il paziente viene ricoverato, l’essere ammessi in un reparto ad elevata criticità come una terapia intensiva o un’unità ustionati, infatti rappresenta di per sé un aumento del rischio di contrarre un HAI. Comprendono poi i giorni di degenza e tutte le procedure invasive attuate, gli eventuali interventi chirurgici e le terapie. Secondo quanto riportato dal sistema NNIS americano infatti l’83% delle polmoniti acquisite in ospedale sono associate a ventilazione meccanica, il 97% delle infezioni del tratto urinario sono associate all’utilizzo del catetere e l’87% delle infezioni del sangue si associano all’uso del CVC.2
Infine i fattori correlati alla qualità dell’assistenza sono quelli su cui principalmente si può agire per ridurre la diffusione delle HAI. Essi riguardano la modalità di gestione del paziente esposto a procedure invasive, l’applicazione corretta dei protocolli d’uso di disinfettanti e antibiotici, i criteri di utilizzo di farmaci e procedure invasive conformi agli standard. Ma riguardano anche il management dell’ospedale, la gestione delle degenze e delle pulizie. Il National
1 Richards MJ, Edwards JR, Culver DH, et al. Nosocomial infections in pediatric intensive care
units in the United States. National Nosocomial Infections Surveillance system. Pediatrics, 1999, 103: 39
2 Richards MJ, Edwards JR, Culver DH, et al. Nosocomial infections in combined
Institute for Occupational Safety and Health (55) ha identificato i fattori che favoriscono la trasmissione dei microrganismi nelle 5 C:
-Crowding -Contact
-Compromised skin
-Contaminated items and surfaces -lack of Cleanliness
Quindi sovraffollamento, contatto, alterazioni cutanee, ma anche superfici contaminate e scarsa pulizia, sottolineando l’importanza della qualità ambientale nella diffusione delle HAI. Molti patogeni e in particolare gli MDRO (multi drug resistent organism) sono in grado infatti di resistere nell’ambiente anche per periodi prolungati, come l’Acinetobacter che è in grado di sopravvivere 30 giorni sulle superfici plastiche e fino a 3 anni sul pavimento o l’MRSA (Staphylococcus aureus meticillino resistente) che si riscontra nella quota respirabile della polvere e nei bagni anche di degenti non colonizzati. (24-31) L’epidemiologia ambientale locale quindi gioca senza dubbio un ruolo rilevante per quanto riguarda la trasmissione dei patogeni costituendo un importante fonte di contagio.
1.5. Impatto sulla salute
L’impatto che le HAI hanno sulla salute dei pazienti che le contraggono è molto pesante. L’UK Health Protection Agency riporta che i pazienti che contraggono un HAI hanno un rischio di morte 7 volte maggiore rispetto agli altri. Nei Paesi ad alto
reddito il tasso grezzo di mortalità associato alle HAI varia dal 12 all’ 80% in base alle caratteristiche dei pazienti3. In Europa si è calcolato che ogni anno le HAI sono responsabili di 37.000 morti attribuibili e che contribuiscono ad altre 110.000. le forme di HAI che hanno un esito maggiormente infausto sono le polmoniti associate a ventilazione meccanica (VAP) e le infezioni del sangue. La contrazione di un’infezione durante la degenza ospedaliera in genere determina un’importante peggioramento della qualità di vita dei pazienti e un prolungamento della loro degenza.
In Europa è stato stimato che le HAI da sole sono responsabili di circa 16 milioni di giorni di degenza extra ogni anno4. Ad esempio un’infezione del sangue può comportare un aumento dei giorni di degenza da 4 a 14.5
1.6. Impatto economico
In Europa il progetto HELICS (Hospital in Europe Link for Infection Control
through Surveillance) ha dimostrato che l’incidenza delle infezioni ospedaliere varia
dal 9% della Gran Bretagna all’11% della Svizzera e dal 6,7% della Francia al 4% della Germania. Anche in Italia a partire dall’inizio degli anni ’80, sono stati condotti numerosi studi per quantificare l’entità del fenomeno e descriverne le principali caratteristiche. Il Ministero della Sanità ha emanato due Circolari
3 Vincent JL Nosocomial Infections in adult intensive-care units. Lancet 2003, 361: 2068-2077
4 WHO Report on the burden of Endemic Health Care-associated Infection Worldwide,2011
5 E Tacconelli, G Smith, K Hieke et al Epidemiology, medical outcomes and costs of
Ministeriali (n.52/1985 e n.8/1988) nelle quali sono stati definiti i requisiti di base dei programmi di controllo ed in particolare, la costituzione di un Comitato di Controllo per la lotta alle infezioni ospedaliere (CIO) in ciascuna struttura ospedaliera e la disponibilità di un’infermiere dedicato preminentemente ad attività di sorveglianza e controllo. Nel 1988 l’Istituto Superiore di Sanità ha condotto un’indagine sulla diffusione dei programmi di sorveglianza e controllo delle infezioni ospedaliere, con bassa rispondenza (34%). Dalle indagini è emerso che: • il 14,2% degli ospedali campionati aveva attivato il CIO, (di questi più di un terzo non si era mai riunito nel corso dell’anno); la diffusione dei Comitati di Controllo aumenta all’aumentare delle dimensioni dell’ospedale;
• l’11,5% dei CIO si era dotato di un proprio referente medico;
• l’8% dei CIO disponeva di una figura infermieristica dedicata; di questi solo il 20% aveva una risorsa impiegata a tempo pieno nei programmi di controllo; • l’8,7% degli ospedali aveva definito uno o più protocolli.
A distanza di più di 10 anni, l’ISS ha effettuato un’analoga indagine conoscitiva, con alta rispondenza (80%), che ha dato i seguenti risultati:
• il 73,8% degli ospedali hanno attivato il CIO, ma solo il 50% di essi è in attività; i comitati sono costituiti in media da 12,2 componenti;
• il 59% ha dichiarato di disporre di un medico referente, ma solo nel 43% dei casi tale figura è effettivamente operativa;
• il 51% ha dichiarato di disporre di un infermiere addetto al controllo, di cui solo il 33% impiegato nel programma di controllo.
L’analisi dei dati mette in evidenza una disomogeneità territoriale con svantaggio globale del sud d’Italia e delle isole rispetto al nord-centro nell’istituzione e organizzazione dei programmi e una differenza, talora sostanziale, tra le proporzioni dei presidi.
Sulla base delle indicazioni della letteratura relativa ai numerosi studi multicentrici effettuati, si può stimare che nel nostro Paese dal 5% all’8 % dei pazienti contrae una infezione ospedaliera che in circa l’80% dei casi si localizza, con probabilità decrescente, presso l’apparato urinario, la ferita chirurgica, l’apparato respiratorio, o determina una infezione sistemica (sepsi/batteriemia). Ogni anno, quindi, si verificano dalle 450.000 alle 700.000 infezioni in pazienti ricoverati in ospedale e queste sono direttamente causa del decesso nell’1% dei casi. In riferimento a questa stima, il costo delle infezioni ospedaliere è stato calcolato intorno all’1% della spesa sanitaria nazionale. I costi aggiuntivi legati alla gestione delle HAI sono determinati dal prolungamento della degenza, dall’uso degli antibiotici, dall’attuazione di altre procedure e interventi ma anche ai costi dovuti alla riammissione in ospedale o ai costi sanitari post-dimissione. I costi post-dimissione oltre a comprendere quelli dovuti alla riammissione precoce in ospedale riguardano anche le spese associate ad un numero maggiore di visite richieste, alla necessità di assistenza infermieristica, alle visite del medico di famiglia e al maggiore accesso ai servizi di emergenza.6 Ulteriori costi sono determinati dai rimborsi dovuti ai pazienti infettati che muovono azioni legali.
2. MISURE DI SORVEGLIANZA E PREVENZIONE DELLE INFEZIONI CORRELATE ALL’ASSISTENZA
2.1. Introduzione
Le infezioni che colpiscono i pazienti ricoverati presso presidi ospedalieri o che sono stati sottoposti a procedure in ambiente sanitario non sono tutte prevenibili in quanto spesso sono dovute a fenomeni endogeni cioè intrinseci al paziente che ha magari più patologie concomitanti e quindi maggiori fattori di rischio di contrarre una infezione. Tuttavia è stato rilevato che circa il 30% di esse, di origine esogena può essere prevenuta o abbassata applicando delle semplici misure di prevenzione e controllo. Come si evince anche dalla letteratura scientifica in tutti i paesi occidentali le HAI continuano a costituire un’importante causa di morbilità, mortalità e costi prevenibili, nonostante siano abbattuti i tempi di degenza e le tecniche diagnostico terapeutiche siano avanzate, questo dovuto al fatto che vi è una mancanza di un congruo adeguamento “di sistema” delle organizzazioni sanitarie. Questo fenomeno complesso che è un importante obiettivo di salute pubblica nazionale nei paesi industrializzati, deve essere affrontato a tutto tondo da ogni singolo operatore che si trova nel rispettivo comparto dell’ospedale, inoltre necessita della collaborazione sia dei degenti, sia dei visitatori sia del personale sanitario e non. Ne consegue che il programma di gestione del controllo delle HAI è gradualmente cambiato nel tempo: da un approccio puramente clinico ad uno multidisciplinare, che comprende più figure professionali e i pazienti stessi: il
successo dei risultati ottenuti è dovuto all’azione di questo approccio multidisciplinare che si avvale dell’uso di tecniche statistiche ed informatiche.
Fortunatamente sempre più le organizzazioni sanitarie si stanno sensibilizzando sull’importanza della prevenzione delle HAI e quindi nella gestione ospedaliera si stanno mettendo a frutto le evidenze scientifiche sviluppatesi negli anni in modo da poterle applicare in ambito ospedaliero.
2.2. Il Comitato delle infezioni ospedaliere(CIO)
Tutte le nazioni che hanno dato inizio a programmi di controllo delle infezioni ospedaliere, hanno optato come soluzione organizzativa capace di produrre omogeneità e qualità di interventi, la formazione di un Comitato multidisciplinare a livello ospedaliero.
La costituzione del Comitato è considerata tra le misure “fortemente raccomandate” dai Center for Disease Control and Prevention (CDC) per la prevenzione delle infezioni ospedaliere. Secondo i CDC le attività del Comitato Infezioni Ospedaliere (CIO) devono focalizzarsi su quattro funzioni: formazione, coordinamento, collaborazione e progettazione.
Per quanto concerne la formazione il CIO deve diffondere le conoscenze delle problematiche e della pratica inerente alle infezioni ospedaliere con specifici corsi di formazione rivolti a tutti gli operatori sanitari.
Il coordinamento del CIO si svolge sui gruppi di lavoro al fine di uniformare gli interventi su stessi temi, modalità operative, metodologie e strumenti di valutazione. Altri compiti del CIO, nell’ambito del coordinamento sono l’invio al direttore
generale e sanitario di azienda di un report trimestrale con rilevazioni riguardanti la sorveglianza, le comunicazioni sui risultati raggiunti ai vari coordinatori di dipartimento e inoltre la redazione di una relazione a cadenza annuale sullo stato di attività del CIO contenente informazioni sul raggiungimento degli obiettivi specifici, sui problemi più importanti da affrontare, da presentare al direttore di presidio che a sua volta invierà al direttore generale.
La collaborazione del CIO deve essere diretta ai gruppi di lavoro e ai progetti delle varie unità operative e dei dipartimenti. Esso inoltre deve avere la funzione di supporto e di indirizzo metodologico alle attività di sorveglianza e controllo delle infezioni ospedaliere nelle varie fasi (definizione problema, scelta delle priorità, definizione e attuazione di metodologie, standard di riferimento e degli strumenti da utilizzare per effettuare rilevazioni; elaborazione statistica dei dati ecc.). Infine per quanto riguarda la progettazione il CIO si deve occupare della valutazione di specifici studi, come ad esempio studi di appropriatezza, valutazione qualità dei dati e dei relativi flussi,qualità della documentazione clinica, qualità dei sistemi di controllo e sorveglianza sulle infezioni ospedaliere.
In Italia il Comitato Infezioni Ospedaliere (CIO) viene introdotto con le circolari del Ministero della Sanità n. 52 del 20/12/85 e n. 8 del 30/1/88. Quali devono essere i membri facenti parte le circolari indicano testualmente: “… il Comitato coadiuvato dal Direttore Sanitario deve comprendere almeno un rappresentante delle altre aree funzionali, ma gli esperti in igiene, in malattie infettive ed in microbiologia debbono
costituire le figure essenziali, così come è fondamentale la presenza del dirigente del personale infermieristico”.
Il CIO viene considerato una “struttura organizzativa” tecnico-consultiva rappresentativo delle diverse aree funzionali ospedaliere, con proprie responsabilità, procedure e risorse utilizzate per il controllo e la sorveglianza delle infezioni ospedaliere a livello aziendale.
L’organigramma del Comitato è costituito da due parti: il Comitato con funzioni di organizzazione, controllo e programmazione, un piccolo gruppo operativo, facente parte del Comitato, che è direttamente responsabile della verifica della messa in atto degli interventi e della messa in pratica dei protocolli condivisi con il Comitato. La composizione del Comitato può essere la seguente:
direttore medico di presidio (con la funzione di presidente) esperto di igiene (responsabile del nucleo operativo)
esperto di malattie infettive esperto di microbiologia
esperto nel campo dell’epidemiologia e statistica esperto dell’assistenza infermieristica
infermiere addetto al controllo delle infezioni esperto in ambito farmaceutico
esperto nella gestione del rischio clinico
medici con nomina da parte dei capi dipartimento I medici nominati dai capi dipartimento hanno il ruolo di :
- riportare nelle proprie realtà le indicazioni e le azioni dettate dall’azienda sull’argomento infezioni ospedaliere
- focalizzarsi sulla ricerca di criticità relative alle infezioni ospedaliere nella propria U.O.
- facilitare nella realizzazione e promozione di azioni e migliorie nelle proprie realtà - favorire la stesura di protocolli e procedure monitorando l’utilizzo in modo costante
Il gruppo operativo generalmente è formato da un numero limitato di componenti in modo da rendere snello e senza ostacoli la frequenza degli incontri e il loro lavoro. Vi può essere varietà nella formazione dei gruppi di lavoro:
gruppi di lavoro permanenti su problemi emergenti (ad es. infezioni sito chirurgico, infezioni degli accessi vascolari, utilizzo antibiotici, uso prodotti per sanificazione e disinfettanti; ecc.)
gruppi di lavoro a tempo formati per affrontare problemi urgenti e importanti gruppi interni all’unità operativa
In Italia la Circolare ministeriale non dà per quanto riguarda il funzionamento del CIO delle direttive, ma evidenzia ampia discrezionalità negli interventi in modo da poterli calare all’interno delle realtà locali e quindi strutturarli in base alle proprie necessità.
Concludendo il compito fondamentale di questo comitato è quello di ricoprire un ruolo di riferimento e guida per tutte le attività di prevenzione e controllo delle infezioni, promuovendo e “pubblicizzando” ogni lavoro svolto dal CIO.
2.3. La sorveglianza
La sorveglianza delle infezioni è la base di ogni programma di prevenzione. Essa consiste in un processo dinamico di raccolta, organizzazione, analisi e comunicazione dei dati e/o degli avvenimenti specifici a una popolazione definita. L’informazione ottenuta dai dati di sorveglianza epidemiologica delle infezioni correlate all’assistenza permette ai membri dei gruppi addetti alla prevenzione di tali infezioni e al personale di cura in generale, di determinare il tasso d’infezione di base o delle complicazioni insorte a causa di queste infezioni, di stabilire variazioni nella frequenza o nella distribuzione degli avvenimenti, di mettere in atto delle investigazioni per spiegare l’aumento dei tassi, d’instaurare delle misure di controllo e di determinarne l’efficacia. La sorveglianza secondo le linee guida fornite dalla WHO, dai CDC e da Consiglio Europeo, rappresenta il fondamento dell’attività per il controllo delle HAI, solo attraverso questa, si può capire la gravità del problema e quindi le soluzioni da mettere in atto nelle varie realtà locali. I dati epidemiologici raccolti permettono anche di identificare i fattori di rischio d’infezione, di misurare l’osservanza delle misure preventive stabilite, di evidenziare le situazioni o i settori nei quali possono essersi verificati dei discostamenti, di valutare i cambiamenti delle metodiche e di identificare i campi da approfondire. Principali elementi della sorveglianza sono innanzitutto la definizione delle infezioni, la raccolta delle informazioni, la organizzazione dei dati, la loro sintesi ed interpretazione ed infine la restituzione dei risultati per poter intraprendere delle azioni preventive. La
“sorveglianza attiva” (studi di prevalenza e di incidenza) è condotta da personale preparato e che si occupa di controllo delle infezioni avvalendosi di studi e di ricerca di evidenze scientifiche.
La “sorveglianza passiva” fornita da partecipanti estranei al gruppo di controllo delle infezioni (sorveglianza basata sui dati di laboratorio, estrazione dalle cartelle cliniche di dimissione, notifica delle infezioni da parte medica o infermieristica sono a bassa sensibilità.
Esiste una grande varietà di metodi applicati alla tecnica di sorveglianza. Quella storicamente e scientificamente usata come referenza consiste in una sorveglianza prospettiva delle infezioni (ogni sito d’infezione) e coinvolge tutti i pazienti ospedalizzati nell’istituto. Praticamente, questo tipo di sorveglianza, chiamata sorveglianza d’incidenza istituzionale (cioè che interessa tutto l’istituto) è estremamente pesante da effettuare e i mezzi per eseguirla non sono in generale disponibili. Comunque la sorveglianza prospettica mirata risulta molto indicata nelle infezioni del sito chirurgico e rappresenta il gold standard in quanto permette di mettere in atto misure preventive in modo tempestivo. La forma retrospettiva invece si basa su dati registrati di routine dopo che i pazienti sono stati dimessi, di conseguenza rappresenta una soluzione meno onerosa e più rapida ma spesso i dati così ottenuti non sono esaurientemente completi. Vi può essere anche una sorveglianza orientata al reparto: gli sforzi possono essere focalizzati a reparti ad alto rischio quali le terapie intensive, i reparti chirurgici, oncologia ed ematologia, centri per ustionati, neonatologie, ecc..
Sorveglianza sulla base delle priorità: sorveglianza intrapresa per specifici problemi della struttura (ad esempio infezioni del tratto urinario in pazienti cateterizzati lungo degenti).
La sorveglianza è un processo circolare si parte da:
1) Progetto di sorveglianza: definizione obiettivi, protocollo di raccolta dati per la sorveglianza
2) Controllo e distribuzione: analisi dei dati, interpretazione, comparazione, discussione
3) Prevenzione: decisioni ed azioni correttive
4) Valutazione dell’impatto sulle infezioni con la sorveglianza (andamenti) ed altri studi
2.4. Misure a livello nazionale ed internazionale
La prevenzione ed il controllo delle infezioni correlate all’assistenza hanno una rilevanza sia a livello internazionale che nazionale in quanto sempre più aumenta la sensibilizzazione da parte di strutture sanitarie a questa criticità che come abbiamo visto ha ripercussioni sia a livello sociale che economico.
Negli Stati Uniti sono presenti molti enti e società attive a livello nazionale con lo scopo di agire sul controllo delle infezioni ospedaliere, per citarne solo alcune delle più autorevoli CMS (Center for Medicare and Medicaid Services), CDC (Center for Disease Control), QIO(Quality Improvement Organization).
Le misure per la prevenzione delle HAI risultano inoltre ampiamente diffuse tra i CoPs, Condition of Partecipation, ossia gli standard di salute e sicurezza che gli ospedali devono garantire per entrare a far parte dei programmi del sistema sanitario governativo.
Ancora negli Stati Uniti si promuove la prevenzione delle HAI tramite il raggiungimento di obiettivi prestabiliti quali ad esempio: migliorare la sicurezza della degenza chirurgica, ridurre la percentuale di infezioni nosocomiali da MRSA, migliorare la sicurezza dei farmaci, ridurre la percentuale delle ulcere da pressione e contenzione fisica. La Healthcare Infection Control Practices Advisory Committee (HICPAC), formata da una commissione di esperti che guidano l’attività dei CDC e dell’ HHS (Dipartment of Health and Human Service) nell’ambito delle HAI ha sviluppato un progetto con diversi gruppi di lavoro con lo scopo di sviluppare concetti fondamentali per la prevenzione e il controllo delle stesse tramite il cosiddetto Action Plan partito nel 2009 con lo scopo di riuscire in 5 anni a raggiungere obiettivi ben precisi quali ad esempio la riduzione del 75% per le infezioni del sangue associate a CVC nelle terapie intensive e negli altri reparti, ottenere il 100% dell’aderenza al protocollo per l’inserzione del CVC, la riduzione del 25 percentile delle infezioni profonde (organi/spazi) del sito chirurgico.
I cinque gruppi di lavoro in cui si è articolato l’Action Plan sono i seguenti: 1- Prevenzione e implementazione
2- Ricerca
3- Sistemi di informazione e tecnologie 4- Incentivi e sorveglianza
5- Diffusione e messaggi
In Europa nel 2009 si è riunito il Consiglio Europeo per elaborare delle raccomandazioni con lo scopo di dare delle linee di indirizzo agli stati membri con lo scopo di realizzare un sistema organizzato per la prevenzione delle infezioni correlate all’assistenza.
Fra le principali raccomandazioni troviamo l’istituzione di sistemi di sorveglianza sia a livello locale che nazionale, standardizzazione dei dati utilizzando un linguaggio ed indicatori comuni, promozione di campagne nazionali sul buon uso degli antimicrobici, individuazione di personale deputato al controllo delle infezioni all’interno di ogni struttura sanitaria, diffusione tramite corsi di formazione e aggiornamento di linee guida e protocolli agli operatori, promozione e coinvolgimento degli operatori nella segnalazione di eventi avversi, infine ma non meno importante il coinvolgimento del paziente e dei suoi familiari nelle misure di controllo informandoli dei comportamenti da tenere per limitare la diffusione delle infezioni.
In Italia le misure per la prevenzione ed il controllo delle HAI sono partite con la promulgazione di leggi e decreti; successivamente un contributo importante allo
sviluppo della prevenzione delle HAI è stato dato dall’Accreditamento: in Italia infatti il controllo delle infezioni rientra tra i requisiti fondamentali per l’accreditamento istituzionale delle strutture. Le prime leggi che introducono il termine di Accreditamento e di qualità in sanità sono la legge 502 del 1992 e la 517 del 1993. Successivamente il DPR 14 gennaio 1997 sancisce il problema dell’accreditamento, inteso di tipo autorizzativo e definisce i requisiti minimi assistenziali. La legge n. 419 del 30 novembre 1998 ribadisce la necessità di definire un modello di accreditamento rispondente agli indirizzi del Piano Sanitario Nazionale 1998-2000, cioè che riduca le HAI del 25%. Anche nelle recenti leggi per l’accreditamento “Legge regionale 05 agosto 2009, n. 51 Norme in materia di qualità e sicurezza delle strutture sanitarie: procedure e requisiti autorizzativi di esercizio e sistemi di accreditamento” e “Decreto del Presidente della Giunta Regionale 24 dicembre 2010, n. 61/R Regolamento di attuazione della legge regionale 5 agosto 2009, n. 51 Norme in materia di qualità e sicurezza delle strutture sanitarie: procedure e requisiti autorizzativi di esercizio e sistemi di accreditamento in materia di autorizzazione ed accreditamento delle strutture sanitarie” il controllo delle HAI ha una notevole importanza fra i requisiti richiesti ad ogni singola unità operativa.
2.5. Misure di controllo e prevenzione 2.5.1. Linee guida e protocolli
Le linee guida sono un insieme di raccomandazioni sviluppate mediante un
processo di revisione sistematica della letteratura e delle opinioni di esperti, con lo scopo di aiutare i medici e i pazienti a decidere le modalità assistenziali più appropriate sulla base di conoscenze e prove scientifiche continuamente aggiornate e, redatte allo scopo di rendere appropriato e con un elevato standard di qualità il modus operandi.
Queste vengono elaborate da istituzioni sanitarie, gruppi di esperti come ad esempio Agenzie Sanitarie governative e non, collegi e ordini professionali, Istituti di ricerca.
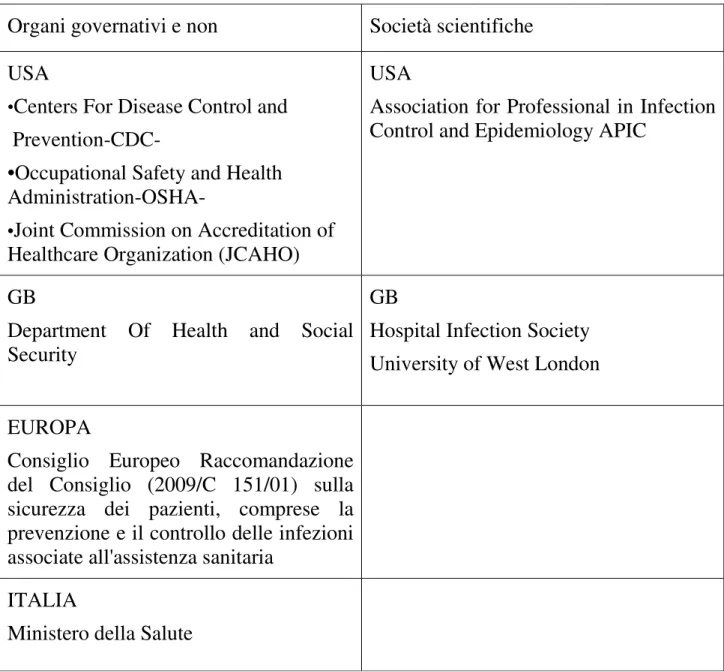
Tra le organizzazioni principali (Tab. 1) che hanno prodotto linee guida riguardanti le infezioni ospedaliere che vengono attualmente seguite in Italia troviamo:
i CDC (Center for disease Control and Prevention) con sede ad Atlanta, un’agenzia federale statunitense deputata a elaborare e fornire linee guida e direttive nella prevenzione e controllo delle malattie acute e croniche.
La prima pubblicazione di linee guida sulle infezioni da parte dei CDC risale al 1981e hanno segnato un cambiamento del modus operandi riguardo ai programmi di controllo delle infezioni ospedaliere, in quanto è stato introdotto un approccio scientifico alla valutazione dell’efficacia delle misure messe in atto per il controllo.
A partire dal 1991 i CDC sono coadiuvati da un gruppo di esperti dell’HICPAC (Hospital Infection Control Practices Advisory Committee) che hanno il ruolo di aggiornare le linee guida e di crearne di nuove. Per ricordare alcune linee guida sviluppate dall’HICPAC elenchiamo quelle relative alla prevenzione delle polmoniti (febbraio 1994), alle misure di isolamento (novembre 1994), alla prevenzione delle infezioni correlate a dispositivi intravascolari in ospedale (aprile 1995, 2011 nuove linee guida), prevenzione delle infezioni del sito chirurgico (gennaio 1999).
Le raccomandazioni dei CDC negli Stati Uniti sono considerate come riferimento a livello nazionale e applicate nei regolamenti e nelle leggi governative.
APIC (Association for Professional in Infection Control and Epidemiology), società scientifica statunitense con sede a Washington DC, formata da un insieme di esperti appartenenti a più figure professionali, che si occupa di controllo delle infezioni. Essa collabora con i CDC per la elaborazione sia di ricerche che di linee guida.
Consiglio europeo tramite Raccomandazioni (giugno 2009) sulla sicurezza dei pazienti compresa la prevenzione e il controllo delle infezioni associate all’assistenza sanitaria.
Ministero della Salute italiano attraverso Commissioni costituite da esperti nei vari settori
Organi governativi e non Società scientifiche USA
•Centers For Disease Control and
Prevention-CDC-
•Occupational Safety and Health Administration-OSHA-
•Joint Commission on Accreditation of Healthcare Organization (JCAHO)
USA
Association for Professional in Infection Control and Epidemiology APIC
GB
Department Of Health and Social Security
GB
Hospital Infection Society University of West London EUROPA
Consiglio Europeo Raccomandazione del Consiglio (2009/C 151/01) sulla sicurezza dei pazienti, comprese la prevenzione e il controllo delle infezioni associate all'assistenza sanitaria
ITALIA
Ministero della Salute
Tabella 1 Principali enti che si occupano della stesura di linee guida in tema di HAI
La stesura delle linee guida prevede una commissione multidisciplinare formata dda più figure professionali (medici, epidemiologi, infermieri, amministratori) che ha lo scopo precipuo di elaborare raccomandazioni sulla gestione di un problema, tenendo in considerazione oltre all’efficacia clinica anche le criticità di carattere economico, etico e psicosociale.
Esistono diversi schemi per graduare la forza delle raccomandazioni cliniche: le raccomandazioni in base alle evidenze che ne scaturiscono sono suddivise in livelli di prova.
I Prove ottenute da più studi clinici controllati randomizzati e/o da revisioni sistematiche di studi randomizzati.
II Prove ottenute da un solo studio randomizzato di disegno adeguato.
III Prove ottenute da studi di coorte non randomizzati con controlli concorrenti o storici o loro metanalisi.
IV Prove ottenute da studi retrospettivi tipo caso-controllo o loro metanalisi. V Prove ottenute da studi di casistica («serie di casi») senza gruppo di controllo. VI Prove basate sull’opinione di esperti autorevoli o di comitati di esperti come indicato in linee guida o consensus conference, o basata su opinioni dei membri del gruppo di lavoro responsabile di queste linee guida.
La forza delle raccomandazioni è così suddivisa:
A L’esecuzione di quella particolare procedura o test diagnostico è fortemente raccomandata. Indica una particolare raccomandazione sostenuta da prove scientifiche di buona qualità, anche se non necessariamente di tipo I o II.
B Si nutrono dei dubbi sul fatto che quella particolare procedura o intervento debba sempre essere raccomandata, ma si ritiene che la sua esecuzione debba essere attentamente considerata.
C Esiste una sostanziale incertezza a favore o contro la raccomandazione di eseguire la procedura o l’intervento.
D L’esecuzione della procedura non è raccomandata. E Si sconsiglia fortemente l’esecuzione della procedura
Il protocollo è uno schema di comportamento predefinito e vincolante utilizzato per definire precisi interventi e comportamenti da mettere in atto in specifici contesti assistenziali. Attraverso tale strumento si può valutare la qualità dell’assistenza erogata in quanto dà indicazioni di come viene erogata (processo) e gli outcome cioè gli esiti nei confronti della salute del paziente La presenza o meno di questi documenti, nello specifico quelli per il controllo delle HAI, è un indicatore importante del livello di attenzione e di coinvolgimento da parte della struttura sanitaria per quanto concerne la prevenzione e il controllo delle infezioni.
Un protocollo per essere usato sia come strumento di prevenzione che di orientamento professionale deve rispondere a precisi criteri quali:
Elaborazione da parte di gruppo di professionisti addetti all’assistenza che dovranno applicarli e verificare la completa aderenza agli stessi
Definiscono il contesto operativo specifico di applicazione
La loro costruzione ha lo scopo di identificare e risolvere problemi reali
Possono essere adattati a specifiche esigenze dell’assistito, quindi sono flessibili
Verifica costante tramite indicatori di risultato
Permettono di apportare miglioramenti sia dal punto di vista professionale che tecnico
Consultando le linee guida nazionali ed internazionali si evince che è fondamentale promuovere la divulgazione di procedure e protocolli riguardanti:
- precauzioni standard con particolare attenzione al lavaggio delle mani e all’uso dei DPI
- controllo delle infezioni dovute a microrganismi MDR
- procedure diagnostiche e terapeutiche che fanno aumentare il rischio di sviluppare un’infezione (CVC , VAP)
- profilassi perioperatoria e corretto uso degli antibiotici - idonea sanificazione ambientale
- disinfezione e sterilizzazione dei presidi medico-chirurgici
2.5.2. Best practice
Il raggiungimento della riduzione della trasmissione delle HAI e della sicurezza deglio operatori e dei pazienti si ottiene senza dubbio attraverso le pratiche assistenziali evidence-based.
Fra i criteri della Joint Commission 2012 troviamo l’adesione alle linee guida dei CDC e della OMS sull’igiene delle mani, sull’implementazione di pratiche evidence-based per la prevenzione delle infezioni catetere correlate all’uso del CVC, dell’infezione della ferita chirurgica, delle infezioni da microrganismi MDR. Nel 2006 il CCM del Ministero della Salute ha promosso e sponsorizzato il progetto INF-OSS “Prevenzione e controllo delle infezioni nelle organizzazioni sanitarie e socio-sanitarie con lo scopo di creare un collegamento fra Regioni che permettesse di fare benchmarking.
Uno degli obiettivi del progetto era la promozione dell’adesione a pratiche evidence-based tramite la diffusione di linee guida specifiche. Per combattere l’insorgenza di HAI si devono adottare misure di carattere generale (sanificazione, disinfezione, sterilizzazione, igiene mani e precauzioni di isolamento)
Per il controllo delle HAI si deve prevedere di limitare il ricorso a procedure invasive ai casi strettamente necessari, cercare di ridurre il tempo di mantenimento di dispositivi invasivi, diminuire la durata della degenza totale e postoperatoria, correggere eventuali comportamenti scorretti e di dubbia efficacia scientifica.
Inoltre è molto importante focalizzare l’attenzione sulla riduzione del rischio di trasmissione da un paziente ad un altro tramite l’adozione di precauzioni standard su tutti i pazienti e specifiche sui pazienti nei quali è accertata una infezione in atto. Fra le precauzioni standard troviamo l’igiene delle mani, l’uso dei guanti, l’uso di barriere protettive, la corretta gestione delle attrezzature, la pulizia dell’ambiente, l’educazione sanitaria e la formazione degli operatori.
Vi sono inoltre precauzioni aggiuntive sia di barriera che relative al paziente in base alla via di trasmissione.
Da non tralasciare l’importanza della corretta gestione dei dispositivi medici che aumentano il rischio di contrarre un’infezione quali ad esempio il catetere urinario, la ventilazione meccanica e il CVC.
2.5.3. Pulizia, disinfezione e sterilizzazione degli ambienti e dei dispositivi medici e chirurgici
E’ importante ricordare che anche lo stesso ambiente rappresenta una fonte di rischio per la trasmissione delle HAI. In letteratura troviamo vari studi che hanno dimostrato la presenza nelle stanze di degenza di germi multiresistenti.
Anche le suppellettili possono fare da veicolo di trasmissione in quanto l’operatore tramite le mani si può contaminare nel toccare oggetti inanimati che si trovano attorno ad un letto del paziente.
Quindi la pulizia e la sanificazione degli ambienti ospedalieri rappresentano un anello importante per spezzare la catena di trasmissione delle infezioni da parte di germi MDR. Questo è stato visto anche tramite studi ad esempio in un ospedale di Toronto (St Michael), il miglioramento delle attività di pulizia ha prodotto una diminuzione delle infezioni da MRSA del 60%.7 Un punto critico da evidenziare è rappresentato dalla modalità di gestione ed esecuzione degli interventi di pulizia. Le procedure di pulizia devono prevedere oltre che l’uso di detergenti anche il successivo utilizzo di disinfettanti. Altri fattori che influiscono sulla qualità della sanificazione dell’ambiente ospedaliero sono una troppo elevata percentuale di occupazione di posti letto ed anche un eccessivo turn over dei pazienti.8 Una criticità importante nell’elaborazione di un valido strumento di controllo è la rilevazione e codificazione del livello di pulizia dell’ambiente. A tutt’oggi quelli più usati anche
7 Salaripour M, McKernan P, Devlin R et Al. A multidisciplinary approach to reducing out breaks
and nosocomial MRSA in a University-Affiliated Hospital. Healthcare Quarterly 2006, 9 Special Issue: 54-60
8 Griffiths P, Renz A, Rafferty AM et al. The impact of Organisation and Management Factors on
in ambito ospedaliero sono quelli visivi, ma diversi studi hanno dimostrato come ciò che visivamente può sembrare pulito, può non risultare a livello microbiologico.9 Lo Scottish Centre for Infection and Enviromental Health suggerisce che gli ospedali adottino degli standard microbiologici sovrapponibili a quelli adottati per le superfici usate per la preparazione dei cibi.10 Importante è anche che il personale che appartiene alla ditta di pulizie sia ben organizzato ed istruito in modo da offrire un’alta qualità del servizio. Tutto questo si ottiene realizzando procedure scritte per gli interventi di pulizia, disinfezione e sterilizzazione¸altro aspetto importante è la loro diffusione a tutto il personale compreso quello della ditta di pulizie.
Nelle linee guida canadesi e anche nei CDC riguardo alla sanificazione, disinfezione e sterilizzazione viene messa in risalto la necessità della definizione di un piano di pulizia che comprenda tutti gli aspetti quali la frequenza, la metodologia ed inoltre che si identifichi un referente tecnico e un programma dettagliato per il controllo e revisione periodica di conduttore e impianti di condizionamento dell’aria.11 Le raccomandazioni di provata efficacia sono:
Le superfici devono essere sanificate con un appropriato detergente e disinfettante nei confronti dei patogeni che rischiano di contaminare le aree dove è assistito il paziente. Importante anche la preparazione del disinfettante (diluizione, prevenzione di contaminazione dello stesso, ripristinando
9 Malik RE, Cooper RA and Griffith CJ. Use of audit tools to evaluate the efficacy of cleaning
systems in hospitals. American Journal of Infection Control 2003. 31(3):181-187.
10 Dancer SJ. How do we assess hospital cleaning? A proposal for microbiological standards for
surface hygiene in hospitals. J Hosp Infect 2004, 56:10-15
frequentemente soluzioni fresche e comunque secondo i protocolli propri aziendali)
Durante le pulizie porre attenzione alle superfici che vengono maggiormente in contatto con il paziente come ad esempio la testata del letto, il comodino, le maniglie e impostare una frequenza idonea di pulizia.
Evitare metodi di pulizia mediante aerosol e nebulizzazioni di prodotti per la pulizia, inoltre non provocare dispersione di polvere nelle stanze di degenza dei pazienti.
Condividere e divulgare protocolli standard per la pulizia e la disinfezione I blocchi operatori devono essere sanificati al termine della seduta operatoria
e deve prevedere prima la detersione delle superfici e poi la disinfezione
Stanze di degenza con pazienti in isolamento devono essere effettuate le pulizie utilizzando prodotti e materiale per la pulizia solo per quella stanza e successivamente smaltire il prodotto e cambiare il materiale utilizzato per lo spolvero ad umido
Nei reparti pediatrici considerare la pulizia e disinfezione periodica dei giochi. In caso di spandimento di sangue pulire immediatamente usando un disinfettante a base di cloro con maggiore concentrazione se lo spandimento è grande.
I dispositivi medici riutilizzabili, prima sia dell’alta disinfezione che della sterilizzazione devono essere decontaminati in acqua assieme a detergenti
enzimatici per rimuovere residui organici, in seguito sciacquare ed asciugare prima di processarli.
Per quanto concerne la sterilizzazione vi sono da rispettare delle disposizioni molto precise quali il monitoraggio ad ogni ciclo utilizzando indicatori fisici e chimici, gli indicatori biologici devono essere utilizzati almeno con frequenza settimanale ed ogni volta che si sterilizzi un carico che contenga presidi protesici. Il metodo di sterilizzazione a vapore deve essere utilizzato per presidi medici che non vengono danneggiati dal calore, dalla pressione e dall’umidità: tutte condizioni che si verificano all’interno della camera dell’autoclave a vapore. La sterilizzazione a bassa temperatura ad esempio a gas plasma deve essere adoperata per materiale sensibile al calore e umidità. Il materiale utilizzato per il confezionamento per il successivo stoccaggio, deve essere compatibile con la procedura di sterilizzazione e deve fare da barriera all’umidità, ai microrganismi e deve essere sufficientemente consistente per resistere a perforazioni e strappi. Il materiale all’interno della sterilizzatrice deve essere disposto in modo che lo sterilizzante penetri agevolmente e quindi non deve essere ammassato. Inoltre vi deve essere una tracciabilità del materiale sterilizzato mediante etichetta che indichi chi ha processato il materiale, il numero di ciclo,data di sterilizzazione e data di scadenza. Importante è anche lo stoccaggio del materiale sterilizzato: questo deve essere riposto in armadi chiusi e in modo da non danneggiare le buste con i dispositivi all’interno, inoltre deve essere maneggiato con molta cura onde evitare di danneggiare la confezione.
2.6. Valutazione: indicatori e audit
Il ruolo della prevenzione e del controllo delle ICA, nell’ambito del governo clinico e del risk management, si concretizza nell’attività di promozione delle buone pratiche, intese come appropriatezza e qualità del processo, e nell’elaborazione di strumenti di supporto ai professionisti per l’operato quotidiano (protocolli, procedure) ma soprattutto interventi di formazione continua, preferibilmente sul campo, che permettano un costante aggiornamento delle conoscenze e delle abilità richieste per l’assistenza ai pazienti. Tuttavia la prevenzione ed il controllo non si esauriscono con l’elaborazione di strumenti e di interventi formativi sugli operatori sanitari; occorre promuovere attività di sorveglianza delle infezioni e audit clinico-assistenziali per valutare l’adesione agli standard prefissati e per individuare spazi di miglioramento. Per definire cosa si vuole misurare si deve definire un criterio, un indicatore, uno standard.
Il criterio specifica la caratteristica del fenomeno che si vuole valutare, cioè ciò che si vuole misurare per prendere delle decisioni in merito. Per quanto riguarda le infezioni del sito chirurgico i principali studi a livello internazionale utilizzano i criteri proposti nel 1992 dai CDC e già citati in precedenza. L’indicatore ha come obiettivo di misurare la qualità, in termini di appropriatezza e sicurezza, delle prestazioni assistenziali che vengono e identificare le non conformità, l’inadeguatezza e le possibili cause connesse. Lo standard è un valore di riferimento intrinseco all’indicatore che mi indica il livello accettabile che mi porta a lavorare con qualità. Può essere considerato il valore atteso con il quale mettere a confronto
quello osservato. Caratteristica fondamentale degli indicatori è che devono essere semplici, essenziali e in numero limitato.
Per monitorare e valutare il processo e l’applicazione delle buone pratiche per prevenire e controllare le ICA, ci si può avvalere di uno strumento rigoroso e di grandi potenzialità: l’audit clinico. Può essere definito come un processo di miglioramento della qualità che ha l’obiettivo di migliorare l’assistenza e gli esiti al paziente tramite la revisione sistematica dell’assistenza, con criteri predefiniti e l’implementazione di cambiamenti. Esistono vari tipi di audit: audit di struttura (orientato ai locali, all’architettura); audit di risorse (materiali, attrezzature ecc.)audit di procedure, che può indagare sulle conoscenze (per esempio, la conoscenza dei contenuti del protocollo sull’igiene delle mani), le attitudini, le pratiche, audit dei risultati (per esempio la percentuale di operatori che osserva una corretta igiene delle mani in una determinata Unità Operativa. I principali obiettivi dell’audit nel caso delle ICA, sono:
Misurare l’applicazione delle buone pratiche assistenziali
Promuovere, migliorare e garantire la qualità delle cure (appropriatezza e qualità del processo
Prevenire e controllare il rischio infettivo
Gli obiettivi secondari sono sensibilizzare gli operatori sanitari e valorizzare la loro attività professionale.
3. L’ESPERIENZA DEI PRESIDI OSPEDALIERI DELLA FONDAZIONE TOSCANA “GABRIELE MONASTERIO” DI PISA E MASSA CARRARA
3.1. La Fondazione “G. Monasterio”
La Fondazione “G. Monasterio” opera su un territorio di 1.156 Kmq di superficie con una popolazione di circa 200000 abitanti, distribuita nei 17 comuni della provincia di Massa Carrara per quanto riguarda il Presidio di Massa.
Per quanto riguarda il Presidio di Pisa la Fondazione opera su un territorio di 2444 Kmq di superficie con una popolazione al 31 luglio 2013 di 415203 abitanti, distribuita nei 37 comuni della provincia di Pisa.
Lo stabilimento ospedaliero di Massa è quello che presenta un maggior numero di posti letto 64 ordinari e 14 di terapia intensiva.
Le unità operative presenti sono:
Cardiologia e cardiologia interventistica dell’adulto e pediatrica Cardiochirurgia dell’adulto e pediatrica
Sono inoltre presenti un’unità operativa di cardiologia ambulatoriale e un unità operativa di radiodiagnostica per immagini.
Strutturalmente è costituito da un monoblocco di 2 piani, collegato in corrispondenza del 2° piano con l’area materno infantile dell’Asl 1 di Massa Carrara.
Nel monoblocco la dislocazione è la seguente:
Al piano terra l’ingresso principale con l’accettazione, il bar, l’unità operativa di radiodiagnostica per immagini, l’area ambulatoriale cardiologia e il laboratorio di analisi
Al primo piano Dirigenza amministrativa e Medica, Ufficio tecnico, Dirigenza infermieristica e aree di accesso ai reparti per i visitatori
Al secondo piano diviso strutturalmente in due ali collegate da corridoi vi sono le aree di degenza ordinaria dell’adulto, la sala emodinamica e la terapia intensiva pediatrica, la degenza pediatrica, la terapia intensiva adulti e il blocco operatorio di cardiochirurgia con annessa la sterilizzazione.
Figura 1 Presidio Ospedaliero “Ospedale del cuore G. Pasquinucci” Massa
Lo stabilimento ospedaliero di Pisa ha 47 posti letto 39 ordinari 6 di terapia intensiva e 2 di Day Hospital.
Le unità operative presenti sono:
Cardiologia e cardiologia interventistica Pneumologia
Radiodiagnostica per immagini Medicina nucleare