UNIVERSITA’ DI PISA
FACOLTA’ DI MEDICINA E CHIRURGIA
SCUOLA DI SPECIALIZZAZIONE IN CHIRURGIA TORACICA
TESI DI LAUREA
RUOLO E PROSPETTIVE DELLA CHIRURGIA ROBOT
ASSISTITA NELLA PATOLOGIA DEL MEDIASTINO
Candidato
Giovanni Belcari
Relatore
Chiar.mo Prof. Alfredo Mussi
INDICE
INTRODUZIONE PAG 3
LA CHIRURGIA ROBOTICA : NOTE STORICHE PAG 6
CENNI D’ANATOMIA TOPOGRAFICA PAG 8
PATOLOGIA E FISIOPATOLOGIA MEDIASTINICA PAG 11
CLINICA E DIAGNOSI PAG 13
MATERIALI E METODI PAG 16
RISULTATI PAG 19
COMMENTI E CONTROVERSIE PAG 20
BIBLIOGRAFIA PAG 22
TABELLE PAG 27
INTRODUZIONE
La patologia del mediastino di interesse chirurgico e’ quanto mai varia, in relazione alle diverse componenti comprese in questo spazio anatomico. Spesso e’ sede di tumori, sia benigni che maligni, non sempre facilmente differenziabili con la clinica, sebbene la loro localizzazione sia importante fattore di indirizzo diagnostico come possibile origine, dalle strutture anatomiche ivi residenti. Nel 40% dei casi si tratta di lesioni asintomatiche, diagnosticate con una occasionale radiografia del torace; in un terzo, di masse mediastiniche maligne primitive, comprendenti vari tipi di neoplasie [1] .Tra i tumori primitivi del mediastino, le forme di piu’ frequente riscontro sono [2] .T.neurogeni (25%), Timomi (23%), lesioni cistiche (18%), Linfomi (15%), Tumori endocrini e mesenchimali (8%) carcinomi primitivi (6%) fino a forme sempre piu’rare [3] . Il trattamento chirurgico delle masse primitive del mediastino, ha da sempre privilegiato ampie vie di accesso, data la complessita’ dell’area anatomica da trattare. La sternotomia e la toracotomia, nelle sue varianti, dalla antero-laterale, alla postero-laterale, fino alla piu’ traumatica toracotomia bilaterale anteriore con sternotomia traversa, sono, classicamente, gli accessi chirurgici utilizzati dalla chirurgia convenzionale “a cielo aperto”.
Nelle ultime due decadi, la chirurgia, ha subito una profonda trasformazione. Grazie all’evoluzione tecnologica che ha favorito lo sviluppo e l’ applicazione di tecniche mini-invasive, si e’ assistito ad una vera rivoluzione nella pratica chirurgica quotidiana, anche in campo toracico. Dalla classica toracoscopia di H.C. Jacobaeus, con finalita’ per lo piu’ diagnostiche, si e’ arrivati ad una
patologie toraco-polmonari tra cui quella mediastinica. Il perfezionamento della tecnica, parallelamente allo sviluppo della strumentazione, ha reso possibile l’ampliamento delle indicazioni, con applicazione della VATS (Video-Thoracoscopic-Surgery) nel 25-35% dell’attivita’ chirurgica toracica, secondo indicazioni ormai ben codificate [4, 5] In particolare, nel piu’ ristretto ambito della patologia mediastinica, la VATS rappresenta una nuova opzione tra le tante metodiche convenzionali, diagnostico-terapeutiche, di approccio alle masse mediastiniche (dalle tecniche diagnostiche come biopsia transtoracica, mediastinoscopia, mediastinotomia fino alle ampie incisioni chirurgiche come sternotomia e toracotomia). La scelta della la tecnica piu’ appropriata dipende dalle finalita’ dell’intervento (diagnostico e/o terapeutico) ed a tal proposito, la videotoracoscopia risulta essere la tecnica che piu’ di tutte e’ in grado di soddisfare entrambe le esigenze.
Sebbene gli innumerevoli vantaggi della VATS, peraltro ben conosciuti (minor trauma, riduzione del dolore post-operatorio ecc…), alcuni limiti di ordine tecnico sono tuttavia da considerare con particolare riferimento alla visione bidimensionale, al ridotto numero dei gradi di movimento della strumentazione. Tutto questo si concretizza in una difficolta’ di valutazione visiva, che risulta piana e priva di profondita’ ed in una scarsa “ergonomicita’” delle manovre chirurgiche in corso di intervento.
Alla fine degli anni “90, gli ulteriori progressi tecnologici, hanno portato allo sviluppo di sistemi robotici ed alla loro applicazione in campo chirurgico, costituendo quello che molti definiscono “lo stadio tecnologico piu’ avanzato della chirurgia mini-invasiva”. Da allora molti modelli sono stati progettati tra
cui ZeusTM, Computer Motion Inc., Goleta, CA, USA; da Vinci ™ Robotic System, Intuitive Surgical, Inc, CA-USA considerati Sistemi Robotici completi.
Nel 1999 e’ stato descritto il primo intervento chirurgico con tecnica robotica, da Loumlet e Reichnspurner ( by-pass aorto-coronarico) [6-7] .In seguito procedure di chirurgia robotica sono state effettuate in altre specialita’ chirurgiche, e nel 2001 , Yoshino [8] descrisse la prima procedura di chirurgia robotica in ambito mediastinico, per il trattamento di un piccolo timoma. Dal Febbraio 2002, la Chirurgia Robotica Videoassistita e’ stata applicata in Chirurgia Toracica, presso il Dipartimento Cardio-Toracico, diretto dal Prof A Mussi, per il trattamento di molte patologie pleuro-polmonari, secondo criteri di selezione ben codificati. Obiettivo di questa tesi e’ la descrizione della tecnica, e delle attuali indicazioni per il trattamento chirurgico delle masse mediastiniche
CHIRURGIA ROBOTICA
note storiche
La chirurgia robotica inizia alla fine degli anni Cinquanta, negli USA. Il Pentagono mette a punto il primo sistema robotico con l’intento di eseguire interventi chirurgici a distanza. Si tratta tuttavia di un modello sperimentale e tale rimane per molti anni.
Alla fine degli anni ’90, l’evoluzione tecnologica consente ulteriori progressi nel campo della ingegneria biomedica. Il primo sistema robotico impiegato in chirurgia era relativamente semplice, programmato per mantenere l’ottica od uno strumento endoscopico, in una posizione fissa, durante l’intervento chirurgico [9] Questi sistemi elementari hanno dato il via, negli anni, a modelli piu’ complessi e sempre piu’ sofisticati. La chirurgia robotica intesa come nuova tecnica chirurgica, e’ stata introdotta per la prima volta da Cadiere nel marzo 1997 [10]. In ambito toracico, il primo intervento chirurgico, e’ stato un by-pass aorto coronario, effettuato con un sistema robotico a controllo vocale (ZeusTM, Computer Motion Inc., Goleta, CA, USA) [11-12]. Nello stesso periodo altri differenti sistemi robotici sono stati utilizzati da altri teams chirurgici [6,13-14]. Attualmente esistono diversi sistemi robotici ciascuno con peculiarita’specifiche che vengono impiegati nelle diverse specialita’. ( Tab. 1 ) [7, 15,16]
Tra i modelli robotici, il da Vinci™ Robotic System (Intuitive Surgical, Inc, CA, USA). rappresenta un sistema completo, inizialmente utilizzato per interventi di cardiochirurgia ed in seguito anche per interventi di chirurgia toracica. Negli ultimi anni un numero sempre maggiore di patologie toraciche sono trattate con
tecnica robotica con parallelo incremento delle indicazioni tra cui alcune patologie mediastiniche [18-30]
CENNI DI ANATOMIA DEL MEDIASTINO
Il mediastino è una entità topografica virtuale, mediana, contenuta nella cavità toracica. E’ uno spazio tridimensionale a forma di piramide quadrangolare irregolare definito come ‘ terzo spazio’ del torace [31].
E’circondato bilateralmente dalle pleure mediastiniche la cui superficie e’ regolare ad eccezione del punto di riflessione ilare; a parte questo non ci sono altri punti di continuità mediastino-pleurici. Superiormente è in comunicazione con il collo attraverso i piani fasciali, la sua apertura superiore, detto ‘spazio critico di Grawitz’, ha una disposizione obliqua, dall’alto in basso e postero-anteriormente, secondo un piano inclinato, corrispondente al decorso della I costa. Non esistono precise linee strutturali di demarcazione tra collo e mediastino.
E’ consuetudine per gli anatomisti ed i chirurghi, suddividere il mediastino in compartimenti per la localizzazione degli organi e delle strutture in esso contenute ( Tab .2 ).
Sin dal 1889, il mediastino e’ stato suddiviso in 3 compartimenti : anteriore medio e posteriore. Da allora numerose suddivisioni sono state proposte, da quella “non-anatomica” proposta da Felson (Fig 1) a quelle a 6 compartimenti descritto dal Heitzman [32] (Fig 2) fino al modello cosiddetto “tri-compartimentale”, proposto da Shields.
MODELLO ANATOMICO A QUATTRO COMPARTIMENTI
Si tratta di una suddivisione anatomica del mediastino in quattro compartimenti (Figg 3-4): superiore ed inferiore, quest’ultimo suddiviso a sua volta in anteriore, medio e posteriore.
Il mediastino superiore è l’area situata sopra un piano immaginario che si estende dalla giunzione manubrio-sternale (angolo di Louis) al bordo inferiore della IV vertebra toracica. Questo piano corrisponde alla localizzazione dell’arco aortico e della biforcazione tracheale. Contiene tutte le strutture che attraversano l’ingresso superiore del torace (grossi vasi, trachea, esofago,vene,linfatici, dotto toracico e parte del timo). Il mediastino inferiore è secondo questo modello,diviso in altri tre compartimenti : anteriore, medio e posteriore. Il mediastino anteriore è localizzato tre il corpo dello sterno (anteriormente) e la superficie anteriore del pericardio (posteriormente). Contiene il corpo del timo ed i linfonodi preaortici nel contesto del tessuto cellulo-adiposo. Il mediastino medio è occupato dal pericardio e contiene la carena, i bronchi principali ed i linfonodi tracheo-bronchiali; il mediastino posteriore, tra il mediastino medio e il legamento spinale anteriore, contiene l’esofago, l’aorta, la catena del simpatico ed il dotto toracico.
MODELLO TRICOMPARTIMENTALE TRADIZIONALE
Questa suddivisione raggruppa nel mediastino anteriore, i due terzi anteriori del mediastino superiore ed il mediastino anteriore nella sua totalità,già descritti . Il mediastino medio include il cuore ed il pericardio, il posteriore si estende per l’intera lunghezza della colonna vertebrale (Fig 5).
MODELLO TRICOMPARTIMENTALE ( SHIELDS)
La suddivisione del mediastino “secondo Shields” (Fig 6) corrispondenti a zone di dissezione anatomica reali, individua 3 compartimenti, anteriore, medio (viscerale) e posteriore, ciascuno esteso dall’ingresso superiore del torace al diaframma. Il compartimento anteriore situato tra la superficie posteriore dello sterno e la superficie anteriore dei grossi vasi, viene detto “prevascolare”. Il medio o viscerale situato dietro i grossi vasi, tra essi e la trachea, viene detto retrovascolare. E’ identificato anche come ‘strato pre-tracheale’ raggiungibile mediante una via verso la fascia cervicale. Posteriormente a queste due zone c’è l’area retroviscerale, cui Shields associa i solchi paravertebrali. Questa è la zona più profonda dei 3 compartimenti. E’ l’area che molti autori identificano come “mediastino-posteriore”.
PATOLOGIA MEDIASTINICA
I tumori del mediastino sono una patologia relativamente rara, ma con frequenza e prevalenza di lesioni maligne in netto incremento [2,33] .Quest’ultime colpiscono frequentemente individui tra la terza e quinta decade di vita, ma possono interessare tutte le eta’ e tutti i compartimenti mediastinici. [2]. L’eta’ del paziente e la localizzazione della neoplasia e’ spesso elemento importante come orientamento diagnostico [2-34] (Fig 7-8). Nella popolazione adulta, il 54% delle neoplasie interessa il mediastino antero-superiore , il 20% il mediastino medio ed il 26% il mediastino posteriore [2] in eta’ pediatrica rispettivamente il 43%, il 18% ed il 40% [33, 35] (Tab 3 ) .
La diversa distribuzione tra la popolazione adulta e pediatrica mostra un’ incrementata incidenza dei tumori timici e dei linfomi negli adulti vs i tumori neurogeni nei bambini. (Tab 4) . Nella pratica clinica e chirurgica , i tumori solidi o cistici del mediastino (Tab 5 ) si sviluppano entro zone specifiche (Figg 7-8 ). In particolare le lesioni timiche ( Figg 9- 10 ),predominano nel mediastino antero-superiore , seguiti dai linfomi (Fig 11) , germinomi ,dai carcinomi,dai lipomi ( Fig 18). Le lesioni cistiche ( pericardiche, enteriche e broncogene) sono rare ed interessano sono per lo piu’ il mediastino medio (Figg 14-17 ) seguite dai linfomi , dai tumori mesenchimali e dai carcinomi. Nel mediastino posteriore sono comuni i tumori neurogeni ( Figg 12-13 ) seguiti dalle cisti ,dai tumori mesenchimali e da lesioni endocrine [2, 36] , ( Tab 3, 6 ).
Fisiopatologia del mediastino
Gli organi contenuti nel mediastino, sono separati da tessuto cellulo-adiposo. Esso facilita i movimenti degli organi dotati di motilità ritmica e continua come il cuore e i grossi vasi, o di una motilità volontaria e saltuaria come l’ esofago. Il mediastino, per la elasticità delle sue pareti e per i punti di minor resistenza tra i visceri, grazie al cellulare lasso ivi contenuto, tende a lasciarsi spostare, piuttosto che ad opporsi alle forze compressive. Quando per eventi patologici (neoplasie, processi infiammatori/infettivi) il cellulare mediastinico viene alterato, a seconda degli organi interessati, possono manifestarsi le classiche “sindromi mediastiniche” .
CLINICA E DIAGNOSI
Circa il 40% dei pazienti con masse mediastiniche sono asintomatici. [2,36] (Tab 7 ). Le lesioni sono evidenziate accidentalmente, spesso in occasione di una radiografia routinaria del torace. Nel rimanente 60% dei pazienti possono essere presenti: sintomi direttamente correlati alla compressione/invasione od allo stretto rapporto delle lesioni con le strutture mediastiniche; sindromi sistemiche associate a neoplasie primitive del mediastino, in alcuni casi causate da produzione di ormoni. (Tab 8-9 ). I sintomi e segni piu’ comunemente descritti sono : il dolore toracico, la tosse e la dispnea [2,36-37] .Astenia, disfagia, calo ponderale e sudorazione notturna sono anch’essi frequentemente riscontrabili (Tab 10) . Frequentemente i pazienti asintomatici sono affetti da lesioni benigne ( Tab 7) [2, 33,36-38 ).Circa il 40% dei pazienti con timoma sono affetti da miastenia gravis; la red cell aplasia e l’ipogammaglobulinemia possono essere anch’esse associate ( Tab 8), [2,37,39] .
Diagnosi strumentale
La radiografia standard del torace in 2 proiezioni costituisce il metodo piu’ semplice per una iniziale diagnosi delle masse mediastiniche ( Figg 11-13,15-17 ).
Permette di rilevare la localizzazione,la grandezza, la densita’e la presenza di eventuali calcificazioni all’interno delle lesioni [40 ].
tra le diverse lesioni : cistiche, solide o adipose. La grandezza , la sede ed il rapporto con le strutture mediastiniche, possono essere accuratamente definite. Nel sospetto di infiltrazione neoplastica, la risonanza magnetica (RM) (Fig 14 )costituisce un utile mezzo diagnostico per lo studio dei rapporti con le strutture vascolari [43,44] .
Diagnostica invasiva
La diagnosi istologica e’essenziale per un trattamento appropriato. Tra le procedure chirurgiche per la diagnosi e/o il loro trattamento delle lesioni mediastiniche, la mediastinoscopia costituisce una metodica relativamente semplice che permette un adeguato approccio al mediastino superiore e medio con una accuratezza dell’80%-90% [ 45,46] .La mediastinotomia anteriore permette una biopsia diretta con una accuratezza diagnostica del 95%-100% [45, 46]. La VATS di piu’ recente acquisizione, e’ la procedura che consente l’accesso a tutte le aree del mediastino con una accuratezza diagnostica del 100% [46] ,(Tab 11).
Markers biologici
In molti tumori mediastinici i markers sierici simili a quelli tissutali [47,48] possono essere di ausilio per la diagnosi. Markers significativi per il mediastino sono: l’ Alfafetoproteina(AFP), la Gonadotropina corionica umana (beta- HCG)le catecolanine con i loro prodotti di degradazione, l’ormone paratiroideo(PTH), la lattico deidrogenasi (LDH) e la ferritina(nel blastoma ganglioneuroblastoma). Il pattern di incremento dei livelli sierici di queste proteine dimostra una
correlazione con la diagnosi di alcune forme tumorali, particolarmente nei casi dei tumori mediastinici a cellule germinali [49,50] (Tab 12)
MATERIALE E METODI
Dal Febbraio 2001, 95 pazienti (eta media 60aa.) con varie lesioni pleuro-polmonari sono stati sottoposti a Videochirurgia Robotica, presso la Chirurgia Toracica dell’Università di Pisa diretta dal Prof . Alfredo Mussi.
Ventinove (28.5%) di essi erano affetti da patologia mediastinica di cui 16 maschi e 13 femmine con eta’ media di 52 anni (range 19- 81 aa). Tutti erano in ottime condizioni cliniche, selezionati sulla base di indagini clinico/radiologiche (Rx torace 2p/TAC Torace) e funzionali (valutazione cardio/respiratoria) con FEV1 >1.5 L (forced expiratory volume in 1 second).
Sono stati considerati criteri di selezione : la benignita’ della lesioni; le dimensioni <3 cm di diametro, l’ assenza di sintomi/segni neurologici e di miastenia gravis- con AbACH negativi, in pazienti con iperplasia timica o con piccoli timomi.
Obesita’, insufficienza respiratoria medio-grave (valutata con Es spirometrico), patologie cardio-vascolari, obliterazione della cavita’ pleurica sono stati considerati criteri di esclusione.
Uno specifico consenso e’ stato richiesto per tutti gli interventi. Tutte le procedure sono state effettuate in anestesia generale con intubazione selettiva (tubo a doppio lume) e paziente in decubito laterale per le lesioni localizzate nel mediastino posteriore e nei seni costo-frenici, in decubito supino con esposizione del triangolo ascellare sx, per le lesioni del mediastino anteriore ( Figura 19 ). Le incisioni chirurgiche sono state effettuate nel triangolo ascellare, in posizioni variabili in rapporto alla sede della lesione ed alle caratteristiche anatomiche del torace.
Per il mediastino antero-superiore e posteriore i bracci robotici sono stati disposti secondo una triangolazione convenzionale con una incisione al VII spazio intercostale per il posizionamento dell’ottica e altre 2 incisioni, rispettivamente al V-VI spazio intercostale sulla linea ascellare anteriore ed al IV-V spazio sulla linea ascellare posteriore. Per l’approccio alla loggia timica i tre bracci robotici sono stati posizionati in una differente disposizione: al V spazio sulla linea acellare media per il posizionamento dell’ottica, ed al III e VI sulla linea ascellare anteriore per gli strumenti robotica ( Fig 20) .L’esplorazione della cavita’ pleurica e’ stato effettuata in tutti i casi prima della chirurgia per valutare la fattibilita’ dell’intervento chirurgico e per il corretto posizionamento dei bracci robotici.
Il sistema robotico utilizzato per il trattamento chirurgico delle masse mediastiniche e’ stato il da Vinci™ Robotic System (Intuitive Surgical, Inc, CA, USA). Si tratta di una sistema robotico “completo” costituito da tre componenti principali:
1. Consolle Chirurgo (Surgical Console)
E’ posta al di fuori del campo sterile, a pochi metri dal tavolo operatorio; dispone di un sistema di display 3D ad alta risoluzione visualizzato attraverso il Visore Stereo.
2. Carrello Chirurgico (Surgical Cart)
Il Carrello Chirurgico, posto vicino al tavolo operatorio, e’ costituito da 3 bracci cui sono connessi gli strumenti robotici. Questa è la parte del sistema attraverso cui viene effettuato l’intervento chirurgico vero e proprio grazie al trasferimento dei movimenti del chirurgo ai bracci robotici e quindi alla
strumentazione in modo assolutamente affidabile. 3. Carrello Visione (Vision Cart)
Comprende una Telecamera, Endoscopi ed un Carrello Visione composto da componenti di elaborazione ed ottimizzazione dell’immagine, integrato nella Consolle Chirurgo.
In tutti gli interventi e’ stata utilizzata CO2 tra 6 e 12 mmHg insufflata in cavita’ toracica, attraverso uno dei trocar (solitamente il trocar attraverso cui viene posizionata l’ottica) , per aumentarne i diametri ed agevolare le manovre chirurgiche. ECG, NIBP, SpO2 ed EtCO2 sono stati monitorizzati durante tutti gli interventi .
Le caratteristiche dei pazienti ed il tipo di lesione trattate con Videochirurgia Robotica sono descritte in Tab 13 . Si e’ trattato prevalentemente di lesioni benigne. In particolare le masse mediastiniche come lipomi, leiomiomi, neurinomi e lesioni cistiche sono state asportate utilizzando 2 soli strumenti “robotici” tra cui una pinza (Endograsp di Cadiere) ed una spatola collegata all’elettrobisturi per la coagulazione e la dissezione dei tessuti (Endo-Dissector ). Gli interventi di timectomia hanno richiesto una maggiore accuratezza soprattutto nell’area periaortica ed del tronco anonimo per l’individuazione e la dissezione dei vasi timici. In questi casi sono stati utilizzati per la coagulazione, strumenti bipolari ( pinza di Meryland) o ad ultrasuoni che consentono la coagulazione tra le branche senza ledere le strutture circostanti. La chiusura delle vene timiche e’ stata effettuata con clips metalliche al titanio.
Al termine dell’intervento, in tutti i casi e’ stato utilizzato un sacchetto sterile per la rimozione del pezzo operatorio e posizionati 2 drenaggi toracici di 24 F.
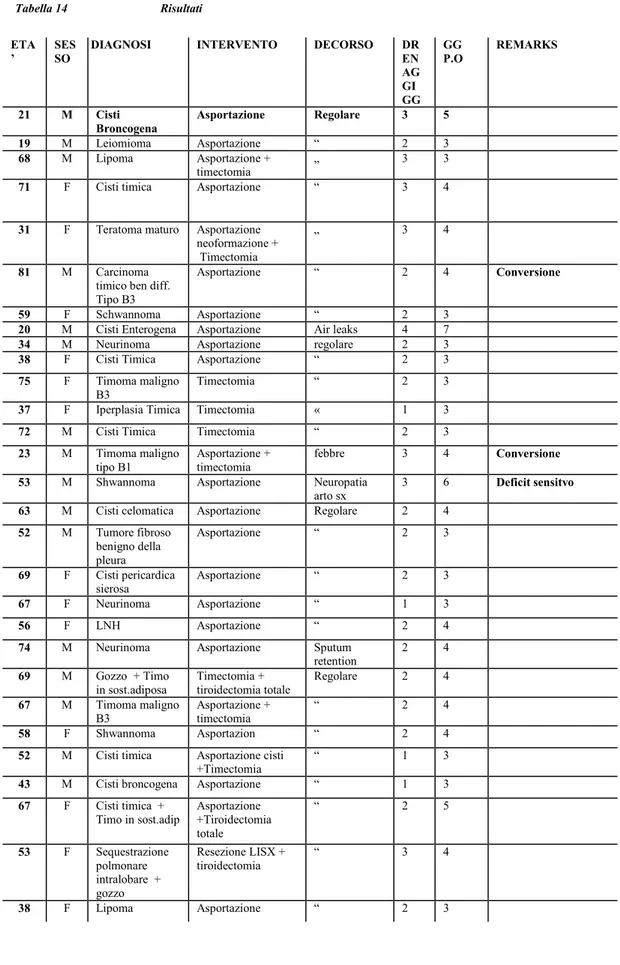
RISULTATI
In tutti gli interventi di asportazione e/o timectomia effettuati in Videochirurgia robotica non vi e’ stata alcuna complicanza intraoperatorie,. I risultati, in dettaglio, sono riportati in in Tab.14 .In questo gruppo di pazienti, accuratamente selezionati, non sono stati registrati complicanze relative alla tecnica ne’ alle manovre chirurgiche della strumentazione “robotica” Tutti hanno ben tollerato la procedura ed il decorso post-operatorio e’ risultato soddisfacente richiedendo dosi di analgesici in quantita’ inferiori, rispetto alla chirurgia convenzionale. In 2 pazienti (timoma maligno; carcinoma timico) e’ stata necessaria una conversione in mini-toracotomia antero-laterale per tenaci aderenze con il pericardio. In un paziente con neurinoma il decorso post-operatorio e’ stato caratterizzato da neuropatia dell’arto superiore sx sul versamte ulnare, residuata in una riduzione della sensibilità nei successivi 3 mesi.
La durata degli interventi ha avuto tempi variabili, da un minimo di 2.40 h ad un massimo di 4 ore, di cui 1 per il self-test del sistema robotico e per il set-up degli strumenti. La durata media dei drenaggi e’ stata di 2.3 giorni e la degenza media di 3.9 gg
Tutti i pazienti sono stati dimessi in ottime condizioni e ritornati ai livelli pre-operatori di attivita’ fisica entro 10 gg dall’intervento.
COMMENTI E CONTROVERSIE
Fino agli anni “80 in epoca pre-VATS, l’approccio chirurgico alle masse mediastiniche era esclusivamente “cielo aperto”, con incisioni chirurgiche ampie, talvolta sproporzionate in caso di patologia benigna o di procedure diagnostiche. Con l’evoluzione tecnologia e la miniaturizzazione delle telecamere e’ stato possibile ridurre il trauma. Le tecniche mini-invasive e la VATS in particolare, hanno in tal senso rivoluzionato l’approccio chirurgico allo spazio mediastinico, sebbene limiti, quali la visione bidimensionale, il ridotto numero di gradi di “liberta’”, la scarsa “ergonomicita’ di alcune manovre chirurgiche, costituiscono importanti fattori limitanti per il trattamento di masse mediastiniche voluminose e/o neoplastiche. L’introduzione della chirurgia robotica [23-30,51,] ha in parte superato queste difficolta’, grazie alle caratteristiche proprie del sistema robotico : visione stereoscopica 3D [54-56], 7 gradi di libertà della strumentazione (che permette di riprodurre i fisiologici movimenti della mano) azione di filtro sul fisiologico tremore della mano [52-53], ergonomicita’ per il chirurgo.
L’applicazione della chirurgia robotica in campo toracico e’ iniziata nel 2001 , presso la Chirurgia toracica di Pisa, con l’intento di valutare l’applicabilita’ di questa tecnica per il trattamento di alcune patologie toraciche.. L’esperienza maturata in questi anni ha mostrato come il sistema robotico sia particolarmente adatto per il trattamento di lesioni mediastiniche in cui, manovre chirurgiche accurate, sono richieste in un ristretto campo chirurgico. L’approccio alla loggia timica cosi’ come il trattamento di neoformazioni del mediastino posteriore (es neurinomi ), in aree remote della cavita’ toracica, risulta estremamente agevole se
confrontata con la VATS ed anche con la chirurgia convenzionale. Sebbene gli innumerevoli vantaggi tuttavia questa tecnica e’ ancora in una fase di “validazione”per molti interventi, soprattutto in campo oncologico. Ancora oggi pochissimi sono i centri in grado di eseguire questo tipo chirurgia e, di conseguenza , pochi sono i chirurghi che hanno esperienza in questo campo [19-22].
Attualmente molte delle limitazioni della chirurgia robotica sono dovute all’imperfezione del sistema: l’assenza di feedback tattile [ 6,15,57 ], la grandezza della macchina robotica, la carenza di strumentazione, costituiscono ancora difficolta’ importanti per l’ampia applicazione di questo tipo di chirurgia.
Considerando questi limiti, le “procedure robotiche” in ambito mediastinico possono essere tecnicamente eseguite solo in casi accuratamente selezionati. Cosi’ come per la VATS, questa nuova tecnica chirurgia puo’ essere applicata solo in centri specialistici qualificati dove l’alta tecnologia puo’ avvalersi dell’esperienza “stratificata “ della chirurgia convenzionale in campo toracico [58].
BIBLIOGRAFIA
[1] Clinical Oncology 3nd edition. Excerpta Medica (Elsevier Italia) 004. 1762-1786).
[2] Davis RD, Oldham HN, Sbiston DC. Primari cysts and neoplasm of the mediastinum: recent changes in clinical presentation, methods of diagnosis, management, and results. Ann Thoracic Surgery 1987 ;44:229
[3] Strollo DC,Rosaldo De ChristensenMl,Jett JR,Primary mediastinal tumors part 1. Chest,112:511;1997
[4] Wihlm JM.”La vidèochirurgie thoracique:aspects chirurgicaux”.In Fischler M. (ed.) Anestesie en chirurgie pulmonaire. Vol.53,Masson,Paris,1998;pp. 68-82. [5] Mack MJ,Scruggs GR Kelly KM et al,Video assisted thoracic surgery: has technology found his place? ,Ann Thoracic Surg,1997 64:211-215.
[6] Loulmet D, Carpentier A, D'Atelis N, Berrebi A, Cardon C, Ponzio O. Endoscopic coronary artery bypass grafting with the aid of robotic assisted instruments. J Thorac Cardiovasc Surg 1999;118:4–10
[7] Reichenspurner H, Damiano RJ, Mack M, Boehm DH, Gulbins H, Detter C, Meiser B, Ellgass R, Reichart B. Use of the voice-controlled and computer-assisted surgical system Zeus for endoscopic coronary artery bypass grafting. J Thorac Cardiovasc Surg 1999;118:11–16
[8] Yoshino I, Hashizume M, Shimada M, Tomikawa M, Tomiyasu M, Suemitsu R, Sugimachi K. Thoracoscopic thymomectomy with the Da Vinci computer-enhanced surgical system. J Thorac Cardiovasc Surg 2001;122:783–785
[9] Osmote K,Feussner H, Ungeheurer A,Arbter K, Wey GQ Siewet JR. Self guided robotic camera control. Am J Surg 1999;177:321-4
[ 10] Cadiere GB, Himpens J, Vertruyen M, Favretti F. The world’s first obesity surgery performed by a surgeon at a distance. Obes Surg 1999;9:206-9
[11] Vassiliades TA Jr, Nielsen JL. Alternative approaches in off-pump redo coronary artery bypass grafting. Heart Surg Forum 2000;3:203-206.)
[12] Stephenson ER, Sankholkar S, Ducko CT, Damiano RJ. Robotically assisted microsurgery for endoscopic coronary artery bypass grafting. Ann Thorac Surg 1998;66:1064-7.)
[ 13 ] Falk V, Diegeler A, Walther T, Bannusch J, Autschbach R, Mohr FW. Total endoscopic coronary artery bypass grafting. Eur J Cardiothoracic Surg 2000;17:38-45.),
[ 14 ] Schurr MO, Arezzo A, Buess GF. Robotics and systems technology for advanced endoscopic procedures: experiences in general surgery. Eur J Cardiothorac Surg 1999;16 Suppl 2:S97-105) .
[15] LaPietra A, Grossi EA, Derivaux CC, Applebaum RM, Hanjis CD, Ribakove GH, Galloway AC, Buttenheim PM, Steinberg BM, Culliford AT, Colvin SB. Robotic-assisted instruments enhance minimally invasive mitral valve. Ann Thorac Surg 2000;70:835-838.)
[16] Rininsland HH. Basics of robotics and manipulators in endoscopic surgery. Endosc Surg Allied Technol 1993;1:154-159.
[17] Marius Berman , Alon Stamler , Bernardo A. Vidne and Milton Saute Computer-enhanced thoracoscopic thymectomy with the Zeus telemanipulation surgical system. http://www.icvts.org/elan/100/thymectomy.
[18] (Okada S, Tanaba Y, Yamauchi H, Sato S. Single-surgeon thoracoscopic surgery with a voice-controlled robot. Lancet 1998;351:1249 .
[19] Melfi FM, Menconi GF, Mariani AM, Angeletti CA. Early experience with robotic technology for thoracoscopic surgery. Eur J Cardiothorac Surg 2002;21:864-868.
[20] Okada S, Tanaba Y, Sugawara H, Yamauchi H, Ishimori S, Satoh S. Thoracoscopic major lung resection for primary lung cancer by a single surgeon with a voice-controlled robot and an instrument retraction system. J Thorac Cardiovasc Surg 2000;120:414-5.
[21] Morgan Jeffrey A, Ginsburg Mark E., Sonett J R, Morales D LS, Kohmoto T, Gorenstein LA, Smith CR, Argenziano M. Advanced thoracoscopic procedures are facilited by computer-aided robotic technology. Eur J Cardiothorac Surg 2003;23:883-887.
[22] J. Bodner, H. Wykypiel, G. Wetscher, and T. Schmid .First experiences with the da VinciTM operating robot in thoracic surgery. Eur. J. Cardiothorac. Surg., May 2004; 25: 844-851.
[23] Michael A. Savitt, Guangquiang Gao, Anthony P. Furnary, Jeffrey Swanson, Hugh L. Gately, and John R. Handy Application of Robotic-Assisted Techniques to the Surgical Evaluation and Treatment of the Anterior Mediastinum Ann. Thorac. Surg., Feb 2005; 79: 450 - 455.
[24] Johannes C. Bodner, Matthias Zitt, Harald Ott, Gerold J. Wetscher, Heinz Wykypiel, Paolo Lucciarini, and Thomas Schmid Robotic-Assisted Thoracoscopic Surgery (RATS) for Benign and Malignant Esophageal Tumors Ann. Thorac. Surg., Oct 2005; 80: 1202 – 1206
[25] Bacchetta MD, Korst RJ, Altorki NK, Port JL, Isom OW, Mack CA. Resection of a symptomatic pericardial cyst using the computer-enhanced da VinciSurgicalSystem. Ann Thorac Surg. 2003 Jun;75(6):1953-5.
[26] Profanter C, Schmid T, Prommegger R, Bale R, Sauper T, Bodner J. Robot-assisted mediastinal.parathyroidectomy.Surg Endosc. 2004 May;18(5):868-70 [27] Bakker PF, Budde RP, Grundeman PF. Endoscopic robot-assisted extended thymectomy by subxiphoid approach with sternal lifting: feasibility in the pig. Surg Endosc. 2004 Jun;18(6):986-9.
[28] Morgan JA, Kohmoto T, Smith CR, Oz MC, Argenziano M.[]Endoscopic computer-enhanced mediastinal mass resection using robotic technology. Heart Surg Forum. 2003;6(6):E164-6.
[29] Bodner J, Profanter C, Prommegger R, Greiner A, Margreiter R, Schmid T. Mediastinal parathyroidectomy with the da Vinci robot: presentation of a new technique.J Thorac Cardiovasc Surg. 2004 Jun;127(6):1831-2
[30] Joseph J. DeRose, Jr, Daniel G. Swistel, Ali Safavi, Cliff P. Connery, and Robert C. Ashton, JrMediastinal mass evaluation using advanced robotic techniquesAnn. Thorac. Surg., Feb 2003; 75: 571 – 573
[31] Wilson JC:On the diagnosis of tumors of the anterior mediastinum. JAMA 3:113,1884
[32] Heitzman ER:The mediastinum;radiologic correlation with anatomy and pathology;St Louis CV Mosby 1977
[33] Bariety M., Coury CH.: Les Tumeurs du Mèdiastin. Masson Edit. Paris,1958 [34] Simpson I,Campbell PE. Mediastinal masses in childhood:a review from a pediatric pathologist’s point of view. Prog in pediatric surgery 1991;27:93
[35] Grosfeld JL.Primary tumors of the chest wall and mediastinum in children.Semin. Thorac Cardiovascular Surgery 1994;6:235
[36] Angeletti C. A.,Janni A,Mussi A. ,Stefani P.:Classification and distribution of mediastinal tumors and cysts: 135 observation. Surgery in Italy,9,248,1979 [37] Angeletti C. A.,Janni A.:Les tumeurs du mèdiastin. Analyse de 98 cas. Ann Chir.,31,255-259,1977
[38] Adkins RB,Maples MD,Heinswort JD. Primary malignant mediastinal tumors. Ann Thoracic Surgery 1984;38:648
[39] Davis RD,Oldham HN,Sabiston DC. The mediastinum. In: Sabiston DC,Spencer FC,eds.Surgery of the chest,ed 5. Philadelphia:WB Saunders,1989
[40] Harris GJ,Harmon PK,Trinkle JK,Grover FL. Standard biplane roentgenography is higly sensitive in documenting mediastinal masses. Ann thoracic Surgery 1987;44:238
[41] Weisbrod GL,Herman SJ.Mediastinal masses:diagnosis with non invasive techniques. Semin. Thoracic Surgery 1992;4:3.
[42] Stark P.Imaging Mediastinal Tumors.CA 1987 ;37:211.
[43] Ikezoe J,Takeuchi N,Johokoh T,et al. MRI of anterior mediastinal tumors. Radat Med 1992;10:176
[44] Mayo JR. Magnetic resonance imaging of the chest:where we stand. Radiol Clin North. Ann 1994;32:795
[45] Elia S,Cecera C,Giampaglia F, Ferrante G .Mediastinoscopy Vs anterior mediastinostomy in dignosis of mediastinal linphoma. Eur. J of Cardiothoracic Surg 1992;6:361.
[46] Rendina EA, Venuta F et al, Comparative merits of thoracoscopy,mediastinoscopy,mediastinostomy for mediastinal biopsy. Ann Thor surg 1994;57:992.[47] Rosemberg JC,Neoplasm of the mediastinum. In De Vita VT ,Hellman S, Rosenberg SA ,eds. Cancer:Principles and practice of Oncology,ed 4. Philadelphia: JB Lippincott1993
[48] Salathe M, Soler M, bolliger CT, et al: Transbronchial needle apiration in routine fiberoptic bronchoscopy. Respiration 59: 5-8, 1992
[49] Hainsworth JD,Greco FA,Poorly differentiated carcinoma and germ cell tumors.Hematol Oncol Clin North Am5:1223,1991,b.
[50] Van Herle AJ,Uller RP,Elevated serum thyroglobulin,a marker of metastases. J Clin Invest 56:272;1975
[51] Geis WP, McAfee PC, Kim HC, Brennan EJ. Robotic arm enhancement to accomodate improved efficiency and decreased resource utilitation in complex minimally invasive surgical procedures. Presented at the Fourth International Symposium: Medicine Meets Virtual Reality San Diego, California. January 17-20, 1996
[52]. Falk V, Fann JI, Grunenfelder J, Daunt D, Burdon TA : Endoscopic Computer-Enhanced beanting hearth coronary bypass grafting. Ann Thorac Surg 2000; 70:2029-33
[53] Douglas A. Murphy, MD , Jeffrey S. Miller, MD , David A. Langford, MD, obot-assisted endoscopic excision of left atrial myxomas; Jtcs.ctsnetjournals.org/cgi/content/extract/130/2/596
[54] T.A.D'Amico, Robotics in thoracic surgery: Applications and outcomes J. Thorac. Cardiovasc. Surg., January 1, 2006; 131(1): 19 - 20
[55]Galloway AC, Shemin RJ, Glower DD: First report of the port access Intenational Registryuff TE. Ann Thorac Surg 1999; 67:51-56[56] Shinchiro O, Yoshiaki T, Hideyuki Y, Shoichi S. The Lancet 1998; 351:124
[57] Autschbach R, Onnasch JF, Falk V, Walther T, Kruger M, Schilling LO, MohrFW.TheLeipzig-experience,with,robotic,valve,surgery.eally MF, Lewis RJ, Anderson RJ, Fosburg RG,Gay WA Jr,Jones RH,Orringer MB.Steatement of the AATS/STS Joint Committee on Thoracoscopy and Video Assisted Thoracic Surgery. J Thoracic Cardiovascular Surg 1992;104:1
TABELLE
Tabella 1
Robot di uso chirurgico
Modello
Utilizzo
Aesop EndoAssist Zeus Da Vinci CyberKnife Novac 7 Robodoc Neuromate Endoscopia Endoscopia Chirurgia cardiotoracica Chirurgia Cardiotoracica Radiochirurgia Radiochirurgia Chirurgia ortopedica NeurochirurgiaTabella 2
Strutture Anatomiche del Mediastino Mediastino Anterosuperiore
Timo
Arteria anonima,vena cava superiore Arco aortico,grandi vasi
Linfonodi,vasi linfatici Tessuto cellulo-adiposo
Tiroide-Paratiroidi (se ectopiche) Vene ed arterie mammarie Mediastino Medio
Pericardio e cuore Nervi frenici
Trachea, bronchi principali,ili polmonari Linfonodi
Tessuto cellulo adiposo Mediastino Posteriore
Strutture nervose(nervi vago, catena del simpatico) Dotto toracico
Aorta toracica discendente Esofago
Vene Azygos ed Emiazygos Linfonodi
Tab 3
Localizzazione ed incidenza delle masse mediastiniche più frequenti(escluse le lesioni vascolari) Anteriori Adulti Bambini (54%) (43%) Mediane Adulti Bambini (20%) (18%) Posteriori Adulti Bambini (26%) (40%) Tumori timici
Tumori a cellule germinali Linfomi Carcinomi Gozzi retrosternali Tumori mesenchimali Cisti Tumori endocrini Linfomi Cisti Broncogeniche Cisti Pericardiche Tumori mesenchimali Ernia iatale Sarcoidosi Tumori Neurogenici Meningocele Cisti Enteriche Tumori mesenchimali Tumori endocrini Masse esofagee
Tab 4
Incidenza dei tumori primitivi mediastinici in adulti e bambini
Tumori Incidenza (%) Adulti Bambini Timici 31 28 Neurogenici 15 47 Linfomi 26 9
Tumori a cellule germinali 15 9
Vascolari 1 6
Altri 13 2
(Adapted from Azarow,Pearl,Zurcher,et al. Primary mediastinal masses a comparison of adult andpediatric population. J Thoracic Cardiovascular Surg 1993;106:67)
Tab 5
Classificazione delle masse mediastiniche
NEUROGENICHE Tumori originatisi dai nervi periferici
Neurofibroma Shwannoma Neurosarcoma
Tumori originatisi dalla catena del simpatico Ganglineuroma Ganglioneuroblastoma Neuroblastoma Altri Feocromocitoma Paraganglioma TUMORI A CELLULE GERMINALI Seminomi Non seminomi Tumore a cellule embrionali
Teratomi Altri ERNIE Iatali Ernie di Morgagni CISTI Pericardiche Broncogene Enteriche Timiche Meningocele TUMORI TIMICI Timomi Carcinoidi Timolipoma Carcinomi timici ANEURISMI Dell’aorta ascendente Dell’arco dell’aorta Dell’aorta discendente
Dei grossi vasi
TUMORI MESENCHIMALI Fibromi,fibrosarcomi Lipoma,liposarcoma Mixoma Mesotelioma Leiomioma.leiomiosarcoma Rabdomiosarcoma Xantogranuloma Mesenchimoma Emangioma Emangioendotelioma Emangiopericitoma Linfangioma Linfangiopericitoma Linfangiomioma LINFOADENOPATIE Infiammatorie / Granulomatose Sarcoidosi LINFOMI Linfomi di Hodgkin Linfomi non Hodgkin
ENDOCRINI Neoformazioni Tiroidee Neoformazioni paratiroidee
Tab 6
Incidenza delle masse tumorali mediastiniche primitive
Tumori Incidenza (%)
Neurogenici Timomi Linfomi
Tumori a cellule germinali Tumori endocrini Tumori mesenchimali Carcinomi primitivi Altri 25,3% 23,3% 15,3% 12,2% 7,8% 7,3% 5,7% 2,9%
TAB 7
Segni e sintomi in pazienti con patologia mediastinica Benigna o Maligna
Sintomi Benigni (n=146) Maligni (n=84) Totale (n=230) Asintomatici 82 19 101 Sintomi respiratori 23 17 40 Dolore toracico 23 20 43 Disfagia 4 0 4
Sindrome della vena cava superiore 0 4 4 Segni Nessun segno 122 57 179 Calo ponderale 3 3 6 Segni di SVC 0 8 8 Neurologici 5 2 7
SVC, Sindrome della vena cava superiore.
From Cohen AJ,Thompson L,Edwards FF et al:Primary cysts and tumors of the mediastinum. Ann thoracic surgery 51:378,1991
TAB 8
Sindromi sistemiche associate a masse mediastiniche
Neoplasia Timoma Malattia di Hodgkin Neurofibroma Carcinoidi timici Neuroblastoma Shwannoma Sindrome
Miastenia gravis, red cell aplasia, ipoγglobulinemia ,malattie autoimmuni
Prurito,febbre
Osteoartrosi,malattia di Von Recklinghausen
Neoplasie endocrine multiple
Anomalie ematologiche,mioclonie
Tabella 9
Manifestazioni sistemiche da produzione ectopica di ormoni di masse mediastiniche
Sintomi Ormoni Tumori
Ipertensione Catecolamine Feocromocitoma,neuroblastoma,ganglineuroma Ipercalcemia PTH Adenoma paratiroideo
Tireotossicosi Tiroxina Tireotossicosi Sindrome di
Cushing
ACTH Carcinoidi
Ginecomastia HCG Tumori a cellule germinali Ipoglicemia Insulina,Fattori
insulino simili
Tumori mesenchimali
Diarrea VIP Ganglineuroma,neuroblastoma ,neurofibroma
PTH, paratormone
ACTH,ormone adrenocorticotropo HCG,gonadotropina corionicaumana VIP,peptide vasoattivo intestinale
Tab 10
Sintomi e segni delle masse mediastiniche
SINTOMI Dolore toracico Dispnea Tosse Astenia Disfagia Sudorazioni notturne Emottisi Palpitazioni SEGNI Calo ponderale Febbre Adenopatie Stridori,sibili
Sindrome della vena cava superiore Paralisi delle corde vocali
Neurofibromatosi Segni neurologici
Segni di tamponamento cardiaco Aritmie cardiache
Tab 11
Valutazioni diagnostiche delle masse mediastiniche
ANAMNESI ED ESAME OBIETTIVO
DIAGNOSTICA PER IMMAGINI Radiografia standard del torace
TC Pasto Maritato Medicina Nucleare Angiografia Mielografia Ecografia MRI ENDOSCOPIA ESAMI EMATOCHIMICI AGOBIOPSIA TC-guidata Eco-guidata PROCEDURE CHIRURGICHE Mediastinoscopia Mediastinostomia Toracotomia(VATS)
Tabella 12
Markers tumorali od ormonali di uso routinario nella diagnosi di masse mediastiniche
Neoplasie
Tumori a cellule germinali Seminoma
Tumori del sacco vitellino Coriocarcinoma
Carcinoma embrionale, teratocarcinoma Timomi
Tumori neuroendocrini del timo
Paratiroidi
Tumori neurogenici
Ormoni – Markers tumorali
Basso titolo di β-HCG AFP β -HCG AFP, β -HCG
Ab-antiAChR , AB –anti muscolo
CRH
Calcitonina
Insulina
AFP,α-feto proteina; Ab-antiAChR, anticorpo anti recettore dell’acetilcolina; β –HCG, gonadotropina corionica umana ; CRH,ormone di rilascio delle corticotropine.
Tabella 13
PAZIENTI CON MASSE MEDIASTINICHE SOTTOPOSTI A CHIRURGIA ROBOTICA
ETA’ SESSO SINTOMI DIAGNOSI INTERVENTO
21 M Tosse Cisti Broncogena Asportazione 19 M Asintomatico Leiomioma Asportazione
68 M “ Lipoma Asportazione
71 F “ Cisti timica Asportazione +
timectomia
31 F “ Teratoma maturo Asportazione
81 M Tosse/dispnea Carcinoma timico ben diff. Tipo B3
Asportazione neoformazione + Timectomia 59 F Asintomatico Schwannoma Asportazione
20 M “ Cisti Enterogena Asportazione
34 M “ Neurinoma Enucleazione
38 F “ Cisti Timica Asportazione
75 F “ Timoma maligno Timectomia
37 F “ Iperplasia Timica Timectomia
72 M “ Cisti Timica Timectomia
23 M “ Timoma maligno tipo B1 Timectomia (conversione)
53 M “ Shwannoma Asportazione
63 M “ Cisti celomatica Asportazione
52 M “ Tumore fibroso benigno
della pleura
Asportazione 69 F “ Cisti pericardica sierosa Asportazione
67 F “ Neurinoma Asportazione
56 F Tosse LNH Asportazione
74 M Asintomatico Neurinoma Asportazione 69 M Dispnea lieve Nodulo microfollicolare
tiroideo in gozzo multinodulare, Timo in sost.adiposa
Timectomia
+tiroidectomia totale
67 M Dispnea Timoma maligno B3 Asportazione (conversione) 58 F Asintomatico Shwannoma Asportazione
52 M “ Cisti timica Asportazione +
timectomia 43 M Tosse Cisti broncogena Asportazione cisti
67 F Cisti timica + Timo in
sost.adiposa
Timectomia
53 F Broncorrea ,Tosse Sequestrazione
polmonare intralobare + gozzo multinodulare
Asportazione neoformazione LISX +Tiroidectomia totale
38 F Asintomatico Lipoma Asportazione massa
mediastinica anteroinferiore
Tabella 14 Risultati ETA
’
SES SO
DIAGNOSI INTERVENTO DECORSO DR EN AG GI GG GG P.O REMARKS 21 M Cisti Broncogena Asportazione Regolare 3 5 19 M Leiomioma Asportazione “ 2 3 68 M Lipoma Asportazione + timectomia „ 3 3
71 F Cisti timica Asportazione “ 3 4
31 F Teratoma maturo Asportazione neoformazione + Timectomia
„ 3 4
81 M Carcinoma timico ben diff. Tipo B3
Asportazione “ 2 4 Conversione
59 F Schwannoma Asportazione “ 2 3 20 M Cisti Enterogena Asportazione Air leaks 4 7 34 M Neurinoma Asportazione regolare 2 3 38 F Cisti Timica Asportazione “ 2 3 75 F Timoma maligno
B3
Timectomia “ 2 3 37 F Iperplasia Timica Timectomia « 1 3 72 M Cisti Timica Timectomia “ 2 3 23 M Timoma maligno
tipo B1
Asportazione + timectomia
febbre 3 4 Conversione 53 M Shwannoma Asportazione Neuropatia
arto sx
3 6 Deficit sensitvo 63 M Cisti celomatica Asportazione Regolare 2 4
52 M Tumore fibroso benigno della pleura Asportazione “ 2 3 69 F Cisti pericardica sierosa Asportazione “ 2 3 67 F Neurinoma Asportazione “ 1 3 56 F LNH Asportazione “ 2 4 74 M Neurinoma Asportazione Sputum
retention 2 4 69 M Gozzo + Timo in sost.adiposa Timectomia + tiroidectomia totale Regolare 2 4 67 M Timoma maligno B3 Asportazione + timectomia “ 2 4 58 F Shwannoma Asportazion “ 2 4 52 M Cisti timica Asportazione cisti
+Timectomia
“ 1 3
43 M Cisti broncogena Asportazione “ 1 3 67 F Cisti timica + Timo in sost.adip Asportazione +Tiroidectomia totale “ 2 5 53 F Sequestrazione polmonare intralobare + gozzo Resezione LISX + tiroidectomia “ 3 4 38 F Lipoma Asportazione “ 2 3
FIGURE
Figura 1
Figura 2
Figura 3
Fig 4
Fig 5
Fig 6
Fig 7
Anatomia topografica dei tumori del mediastino
1) Timoma,Tumore a cellule Germinali,adenopatie linfomi,gozzi 2) Adenopatie,gozzi,linfomi ,tumore a cellule germinali
3) Cisti pleuropericardiche,timoma ectopico,fibroma pleurico,timoma,tumorea cellule germinali,lipomi 4) Gozzi posteriori,cisti paraesofagee,tumori neurogeni 5) Cisti broncogene
Fig 8
Anatomia topografica dei tumori del mediastino
1)Timoma,Tumore a cellule Germinali,adenopatie linfomi,gozzi 2)Adenopatie,gozzi,linfomi ,tumore a cellule germinali
3)Cisti pleuropericardiche,timoma ectopico,fibroma pleurico,timoma,tumorea cellule germinali,lipomi
4)Gozzi posteriori,cisti paraesofagee,tumori neurogeni 5)Cisti broncogene
Fig 9
Fig 10
Fig 11
Fig 12
Fig 13
Fig 14
Fig 15
Fig 16
Fig 17
Fig 18
Figura 19
Figura 20