Conservazione del meccanismo in tre enzimi utilizzanti il corismato
Il corismato è il prodotto finale della via dello scichimato per la biosintesi dei composti aromatici carbociclici nelle piante, nei batteri, nei funghi e in alcuni parassiti. L’antranilato sintasi (AS), la 4-amino-4-deossicorismato sintasi (ADCS), e l’isocorismato sintasi (IS) sono enzimi omologhi che avviano la trasformazione iniziale sul corismato nella biosintesi del triptofano, del p-aminobenzoato, e della enterobactina, rispettivamente, e ci si aspetta che dividano un meccanismo comune. Un legame debole all’ADCS dei due potenziali stati di transizione analoghi per l’addizione di un nucleofilo al C6 del corismato implica che questo, come l’AS e l’IS, inizi la reazione di addizione di un nucleofilo al C2. Il modello molecolare basato sulle strutture a raggi X di AS e ADCS suggerisce che il residuo K274 del sito attivo è il nucleofilo impiegato dall’ADCS per iniziare la reazione, formando un intermedio covalente. I mutanti K274A e K274R hanno dimostrato di avere valori di kcat ridotti di 265 e 640
volte quando il PabA (l’affine amidotransferasi) + glutammina sono usati come fonte di azoto. In condizioni di corismato saturante e NH4+, ADCS e il mutante
K274A hanno i medesimi valori di kcat, suggerendo la partecipazione di NH4+
come agente di salvataggio. Un simile ruolo è stato confermato dall’accumulo di 2-ammino-2-deossicorismato nella reazione del mutante K274A ma non nell’ADCS, quando sia l’NH4+ sia il PabA + glutammina vengono usati come
fonte di azoto. Inoltre, l’inclusione dell’etilammina nelle reazioni del 274A produce il derivato N-etilico del 2-ammino-2deossicorismato. È stato quindi proposto un meccanismo unificante per AS, ADCS e IS che comporta l’addizione nucleofila al C2 di corismato in un processo SN2 [11].
La via biosintetica dello scichimato si trova nelle piante, nei batteri, nei funghi, e nei parassiti apicomplessi [12]. Essa assume un ruolo centrale per la biosintesi di una varietà di composti aromatici carbociclici. Il prodotto finale della via dello scichimato, il corismato, è il punto di partenza per la produzione di folato, aminoacidi aromatici, vitamine K e E, coenzima Q, enterobactina, cloramfenicolo, plastochinoni, fenoazinoni e altri metaboliti. Alcuni intermedi in queste vie hanno pure dei ruoli fisiologici importanti. Per esempio, il salicilato è coinvolto nella difesa delle piante contro i patogeni [13], e l’antranilato è il precursore al segnale del chinolone dello Pseudomonas, che è coinvolto nella regolazione del fattore di virulenza nello Pseudomonas aeruginosa [14]. L’importanza centrale delle vie corismato-dipendenti e la loro assenza nei mammiferi le rendono obiettivi molto interessanti per lo sviluppo sia di antimicrobici che di erbicidi.
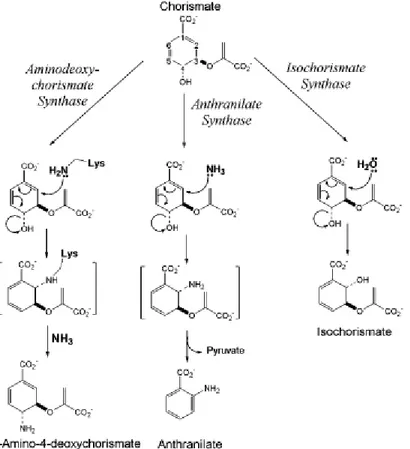
Sono stati caratterizzati cinque enzimi utilizzanti il corismato. Questi includono l’antranilato-sintasi (AS), la 4-ammino4-deossicorismato sintasi (ADCS), l’isocorismato sintasi (IS), la corismato mutasi, e la corismato liasi. I primi tre di questi enzimi posseggono un’ elevata omologia di sequenza e le strutture ai raggi-X di due di essi, AS e ADCS, sono molto simili. Questa correlazione non è sorprendente, date le similarità delle reazioni che essi catalizzano. Comunque, essi mostrano anche differenze interessanti. Per esempio, l’AS forma 2-ammino-2-deossicorismato (ADIC) come intermedio legato all’enzima e, di conseguenza, catalizza l’eliminazione di piruvato per formare antranilato in un singolo sito attivo. L’ADCS e l’IS, d’altro canto, non eliminano piruvato dai prodotti del corismato sostituito. Questo è interessante dal momento che l’eliminazione è il passo successivo nella biosintesi dell’acido p-amminobenzoico (PABA), catalizzato dalla 4-ammino-4-deossicorismato liasi (ADCL).
L’AS, l’IS e l’ADCS catalizzano la sostituzione dell’ossidrile sul C4 del corismato con azoto (AS e ADCS) o ossigeno (IS) nucleofili. Le reazioni catalizzate dall’AS e dall’IS implicano l’addizione nucleofilica al C2 del corismato, rimpiazzando l’originale gruppo idrossilico sul C4. La reazione di sostituzione dell’ADCS è più complessa. Nel prodotto finale, il 4-ammino-4 deossicorismato (ADC), il gruppo idrossilico presente sul C4 del corismato è sostituito da un amminogruppo con ritenzione della stereochimica originale [15]. Le reazioni dell’AS e dell’IS possono avvenire attraverso una singola reazione di sostituzione nucleofila del tipo SN2. Di contro, la reazione ADCS non può avere
luogo attraverso una singola sostituzione SN2, dal momento che questo
meccanismo condurrebbe all’inversione della stereochimica. Sono stati proposti e testati una varietà di meccanismi alternativi per l’ADCS, ma le prove disponibili non hanno portato a delle precise conclusioni [16].
Sono stati considerati inizialmente quattro meccanismi per l’AS, l’IS e l’ADCS: (1) una sequenza addizione/eliminazione di Michael con la formazione di un intermedio aci-carbossilato; (2) addizione nel sito attivo dell’enzima sul C6 del corismato di un nucleofilo; (3) una catalisi covalente effettuata dal substrato stesso nel quale il carbossilato della catena laterale enolpiruvato si aggiunge al C6 per formare un lattone biciclico; (4) un’addizione 1,5 SN2 di nucleofili al C2
mediante uno stato di transizione che coinvolge uno ione Mg2+ [16]. E’ possibile concludere che l’ADCS impiega un sito attivo nucleofilo, il K274, che interagisce con C2 mediante una reazione SN2. È proposto un unico meccanismo
in cui AS, l’ADCS e l’IS, iniziano le proprie reazioni mediante l’addizione di nucleofili azotati o ossigenati al C2 del corismato. Ciò porta conseguentemente alla formazione di diversi prodotti, con l’AS che elimina il piruvato, l’ADCS catalizza una seconda reazione SN2, e l’IS rilascia il prodotto.
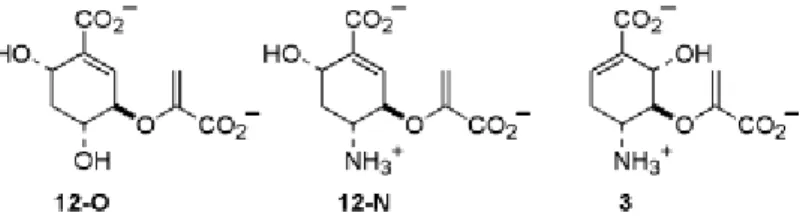
Inibizione da parte di 3, 12-O, e 12-N. I composti 12-O e 12-N (Figura 6) erano
testati come inibitori dell’ADCS e i risultati sono presentati nella Tabella 3.
Figura 6: Strutture di tre potenziali stati di transizione analoghi per la reazione catalizzata da
ADCS.
Tabella 3: Dati di inibizione per ADCS e per il mutante K274A.
Entrambi i composti sono inibitori deboli, apparentemente competitivi dell’ADCS con valori Ki nel range millimolare. Il composto 3 era stato
precedentemente indicato inibitore (Ki ≈ 40 µM) dell’ADCS [17]. Per cui tale
capacità è stata ulteriormente rivalutata con l’ADCS estentendola all’enzima mutante K274A.
Le similitudini nelle reazioni catalizzate dall’AS, ADCS e IS, come pure le loro omologie di sequenza, hanno stimolato lo sviluppo di uno studio del meccanismo comune per questi tre enzimi. Walsh et al. [16] hanno proposto tre meccanismi possibili: (1) l’addizione di un nucleofilo enzimatico al C6 del corismato mediante una modalità SN2, seguita da una seconda sostituzione SN2 dell’enzima
nucleofilo, (2) l’addizione come substrato della catena laterale carbossilata dell’enolpiruvato al C6 per formare un lattone biciclico, seguita da una seconda sostituzione SN2, (3) la sostituzione concertata SN2 caratterizzata da un’addizione
C2 seguita da sostituzione C4 attraverso uno stato di transizione Mg2+-diretto. Una quarta possibilità, l’addizione di Michael al C2, seguita dall’eliminazione al C4 era stata ipotizzata per l’AS e l’IS, ma non era stata presa in considerazione come un meccanismo per introdurre l’ammino gruppo C4 all’ADCS.
Walsh et al. [18] hanno sintetizzato tre analoghi del corismato con gruppi elettrofili al C6, ma nessuno di questi era in grado di catturare l’enzima come nucleofilo e ciò va contro la prima possibilità di meccanismo esposta precedentemente. Kozlowski et al. [17] sintetizzarono tre analoghi potenziali per lo stato di transizione concertato Mg2+-legato e tali composti erano buoni inibitori dell’ADCS. In questo modo, era dimostrato che l’ADCS poteva impiegare uno stato di transizione concertato Mg2+-legato, coinvolgente
un’addizione SN2 di un nucleofilo esogeno (ad es., H2O) al C6 invece del C2 nel
primo passaggio, seguito da un secondo passaggio SN2 nel quale NH3 si aggiunge
al C4. Pertanto furono sintetizzati i composti 12-O e 12-N (Figura 6) per confermare questa ipotesi [19]. I dati riassunti in Tabella 3 mostrano che entrambi questi composti sono deboli inibitori dell’ADCS. Questi risultati, e quelli tratti dagli studi precedenti di Walsh, indicano che non vi sia un meccanismo per l’ADCS nel quale un nucleofilo viene aggiunto al C6.
Pertanto sulla base di questa conclusione furono nuovamente valutati i meccanismi per l’ADCS erano valutati di nuovo sotto questa luce. Il quarto meccanismo, ovvero l’addizione di Michael al C2 con una sostituzione SN2´´ al
C4, potrebbe, in linea generale, essere seguito da tutti e tre gli enzimi se l’ADCS impiega un sito attivo nucleofilo al C2, invece di NH3 oppure H2O come l’AS e
l’IS. La reazione dell’ADCS sarebbe allora completata da una seconda sostituzione SN2´´ del nucleofilo enzimatico al C2 attraverso l’addizione
dell’NH3 al C4. Questo meccanismo spiegherebbe anche l’inibizione
relativamente bassa dell’ADCS osservata per gli analoghi dello stato di transizione per la sostituzione concertata C2/C4, dal momento che il nucleofilo enzimatico interferirebbe stericamente con il sostituente sul C2 dell’inibitore. Le strutture dell’AS e dell’ADCS sono state risolte cristallo graficamente [9, 8] La struttura [9] dell’AS benzoato-legata era impiegata come stampo per modellare l’interazione del corismato nel sito attivo.
La Figura 7 mostra un meccanismo centrale comune per l’AS, l’ADCS e l’IS.
Figura 7: Conservazione del meccanismo fra i tre enzimi omologhi utilizzanti corismato AS, ADCS e IS.
In tutti e tre gli enzimi, le reazioni iniziano con l’addizione di un nucleofilo al C2 del corismato con un meccanismo SN2´´, perdita concomitante del gruppo
idrossilico al C4. La reazione AS forma l’ADIC come un intermedio legato strettamente, che reagisce ulteriormente tramite l’eliminazione della porzione enolpiruvato per dare antranilato. IS aggiunge semplicemente H2O (o OH-) al C2
e rilascia il prodotto. L’ADCS addiziona l’ε-ammino gruppo di K274 al C2 per formare un intermedio covalente. Una seconda addizione SN2´´ dell’NH3 al C4
con perdita concomitante di K274 al C2 procura il prodotto finale, ADC.
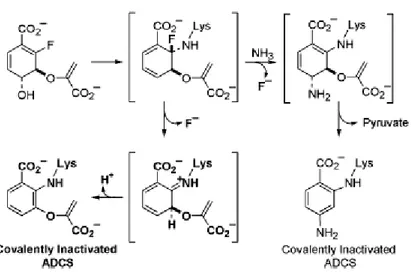
Il meccanismo ADCS che coinvolge il legame covalente del substrato attraverso K274 fornisce indicazioni chiare per il disegno di opportuni inibitori, come pure una valida spiegazione per le proprietà antibatteriche del (6S)-6-fluoroscichimato [20, 21]. Il processo sequenziale di questo derivato che parte dalla chinasi dello scichimato, ESP sintasi, e dalla sintasi del corismato procura 2-fluorocorismato, che subisce la sostituzione veloce SN2´´ da parte del K274 nel sito attivo
dell’ADCS (Figura 8).
Figura 8: Meccanismo-base di inibizione dell’ADCS dal 2-fluorocorismato. La via mostrata in grassetto sembra essere favorita.
L’intermedio covalente formato può reagire attraverso due vie possibili: (1) la perdita diretta del fluoride per formare un’immina che aromatizza e inattiva covalentemente l’ADCS, (2) l’addizione di ammoniaca al C4 con perdita del fluoride e conseguente eliminazione del piruvato. Il primo meccanismo (evidenziato in grassetto nella Figura 8 sembra essere preferibile poiché la perdita di fluoride geminale dall’intermedio covalente iniziale e la seguente aromatizzazione sono favorite chimicamente, mentre lo step di eliminazione del piruvato richiesto nel meccanismo alternativo non è catalizzato dall’ADCS. Così, mentre il (6S)-6-fluoroscichimato di per sè non è una molecola reattiva o un inibitore dell’enzima, essa si avvale della via biosintetica dallo scichimato al corismato, per liberare un potente inibitore all’ADCS.