3
Introduzione
3.1 Herpes simplex
I virus dell’herpes simplex (HSV) sono responsabili di un elevato numero di infezioni, compreso l’herpes genitale.
Nonostante la terapia antivirale si sia dimostrata efficiente, le infezioni da HSV sono tutt’oggi un grave problema di salute pubblica. A tal proposito i vaccini sembrano rappresentare la strada migliore sia per limitare la diffusione che per controllare le patologie da HSV (Stanberry, Cunningham et al. 2000).
A seconda della via di ingresso, dello stato immunologico dell’ospite e a seconda che si tratti di un infezione primaria o di una riattivazione, i virus dell’herpes simplex di tipo 1 (HSV-1) e di tipo 2 (HSV-2) possono provocare numerose malattie. Sebbene HSV-1 e HSV-2 differiscano per struttura genetica ed antigenica, tuttavia condividono le stesse proprietà patogene e sono responsabili di patologie simili.
3.1.1 Classificazione
Degli oltre 100 virus erpetici animali descritti ad oggi, almeno 8 di questi sono virus che infettano l’uomo, occupando in esso compartimenti tissutali diversi. Questi virus fanno parte della famiglia Herpesviridae che a sua volta è stata suddivisa in 3 sottofamiglie:
Alphaherpesvirinae, sottofamiglia di cui fanno parte HSV-1, HSV-2 e il virus varicella zoster (VZV), agente eziologico della varicella e dell’herpes zoster. Questi virus infettano le cellule mucoepiteliali ed instaurano la latenza a livello dei gangli sensitivi, in vitro hanno un ciclo riproduttivo di 8-14 ore e presentano un ampio spettro d’ospite.
Betaherpesvirinae, a questa sottofamiglia appartengono il citomegalovirus umano (HCMV) e gli herpes virus umani 6 e 7 (HHV-6 e HHV-7). Questi virus latentizzano negli endoteli, epiteli e negli organi linfoidi, ed in vitro hanno un ciclo riproduttivo più lento (48-96 ore).
Gammaherpesvirinae, questa è una sottofamiglia che comprende le specie Epstein-Barr virus (EBV), agente eziologico della mononucleosi infettiva, e l’herpes virus umano 8 (HHV-8), che è risultato essere associato al sarcoma di Kaposi. Questi virus instaurano latenza
negli organi linfoidi ed infettano i linfociti in vitro, il loro ciclo replicativo ha durata intermedia (36-60 ore).
3.1.2 Morfologia
Gli herpes virus sono tra i più grandi e complessi virus animali (Fig 3.1).
Figura 3.1 - Morfologia di una particella virale matura di herpes virus (http://www.expasy.org/viralzone/all_by_species/176.html)
Nella regione più interna della particella si ritrova il genoma virale che fa parte di una struttura più complessa, costituita da nucleoproteine e DNA, chiamata nucleoide.
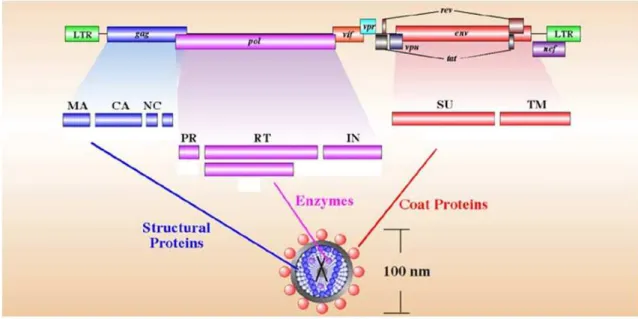
Il genoma degli herpes virus è costituito da una molecola di DNA lineare a doppio filamento che differisce, sia per dimensioni che per orientamento dei geni, tra i diversi virus.
Il capside proteico, a simmetria icosaedrica, è costituito da 162 capsomeri cavi che determinano una struttura dal diametro di circa 100 nm. All’esterno del nucleocapside si trova uno zona amorfa ed asimmetrica costituita da materiale proteico (20-40 nm di spessore) che prende il nome di tegumento.
La particella virale matura, di dimensioni comprese tra 150 e 200 nm, è circondata da un involucro virale (envelope) costituito da lipidi, poliammine e da diverse proteine, di cui
almeno 10 glicosilate. L’envelope deriva dalla membrana nucleare interna della cellula ospite che risulta essere, quindi, notevolmente modificata dall’inserzione delle glicoproteine virali (Simpson-Holley, Colgrove et al. 2005). L’envelope è una struttura abbastanza fragile ma fondamentale per l’infettività del virus in quanto le glicoproteine esposte sulla sua superficie sono responsabili dell’ingresso dello stesso all’interno della cellula ospite.
3.1.3 Organizzazione Genomica
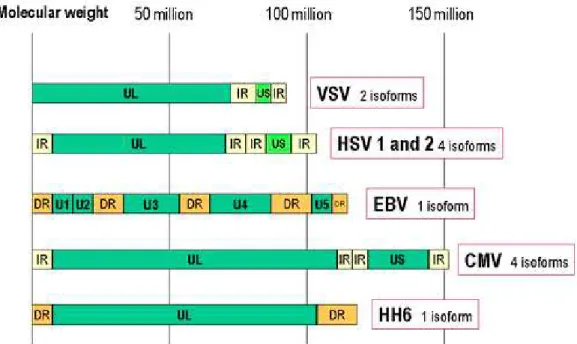
Il genoma degli herpes virus ha dimensioni molto variabili, infatti si va dalle 120 kilobasi (kb) di alcuni Alphherpesavirinae alle 240 kb dell’HCMV. Indipendentemente dalle dimensioni, la cui variabilità è dovuta principalmente alla presenza di sequenze interne e terminali ripetute, il genoma codifica per un numero abbastanza costante di proteine. L’organizzazione genomica differisce tra i vari membri della famiglia (Fig 3.2): HSV, VZV e HCMV possiedono sequenze ripetute invertite (IR) e questo porta alla formazione, mediante ricombinazione, di più di un isomero del genoma. Possedendo solo 2 IR, VZV può dare luogo a solo 2 forme isomeriche, mentre HSV ed HCMV, possedendone 4, possono dare luogo a 4 diverse forme isomeriche. Le ripetizioni dirette (DR), invece, non danno luogo a ricombinazione, per cui EBV, HHV-6 ed HHV-7 possiedono solo un’isoforma.
Figura 3.2 - Organizzazione genomica dei principali membri della famiglia Herpesviridae (http://pathmicro.med.sc.edu/virol/genomes1.jpg)
HSV-1 ed HSV-2 rappresentano la coppia di herpes virus filogeneticamente più vicina, è stato stimato infatti che i due virus si siano separati circa 8 milioni di anni fa (Wu, Jun et al. 2009). I genomi di entrambi i virus sono costituiti da due sequenze unite covalentemente e chiamate L (long) e S (short). Ciascuna componente è costituita da sequenze uniche (UL e
US, rispettivamente) fiancheggiate da ripetizioni invertite. I geni che si trovano nelle regioni
uniche sono presenti nel genoma in singola copia, al contrario, i geni codificati nelle regioni ripetute, come ICP0 e ICP4, sono presenti nel genoma in 2 copie. La maggiore differenza in lunghezza tra i genomi dei due virus è localizzata nella regione US, che in HSV-2 risulta
essere più lunga di circa 1,5 kb, mentre UL in HSV-2 è più lunga di circa 1 kb (Dolan,
Jamieson et al. 1998). Anche il contenuto in G+C risulta essere maggiore in HSV-2 (70% contro 68% di HSV-1) (Brown 2007).
Il genoma di HSV (Fig 3.3) codifica per 84 polipeptidi, di questi almeno 47 non sono strettamente necessari per la replicazione virale in colture cellulari, tuttavia non risultano essere nemmeno superflui, alcuni infatti complementano geni cellulari che non vengono espressi in cellule differenziate, altri invece alterano il metabolismo cellulare in modo da assicurare un elevato titolo virale (Whitley and Roizman 2001). Virus mutanti difettivi per questi geni non possono sopravvivere in natura.
Sono presenti tre diverse origini di replicazione che prendono il nome a seconda che si trovino nella regione L (oriL) o S (oriS), quest’ultima, trovandosi all’interno di una regione ripetuta, è presente in 2 copie. Per la replicazione virale è sufficiente anche una sola di queste sequenze (Taylor, Brockman et al. 2002).
3.1.4 Ciclo Replicativo
Il ciclo replicativo di HSV-1 ed HSV-2 (Fig 3.4) inizia con l’adsorbimento del virus alla cellula ospite, questo è un processo a più fasi che coinvolge numerose proteine virali (Teuton and Brandt 2007).
L’infezione ha inizio quando le glicoproteine virali C (gC) e B (gB) si legano ai proteoglicani eparan-solfati della cellula (Spear and Longnecker 2003).
Il recettore d’ingresso con cui interagisce gB, responsabile dell’ampio tropismo in vitro e dell’infezione di target clinici in vivo, è stato recentemente identificato essere la catena pesante della miosina IIA (Arii, Goto et al. 2010), un polipeptide di 224 kDalton che è espresso nelle piastrine , nei monociti, nei granulociti, nei fibroblasti e nelle cellule endoteliali.
Dopo questo step iniziale, gD può legare numerosi altri recettori cellulari, quali ad esempio le molecole HVE (herpes virus entry mediators), la nectina-1, la nectina-2 e il 3-O-eparan-solfato, portando in questo modo ad un suo cambiamento conformazionale (Krummenacher, Supekar et al. 2005). Questo cambiamento, sembra essere necessario per l’assemblaggio del complesso di ingresso e fusione costituito da gD, gB e dall’eterodimero formato dalle glicoproteine H (gH) ed L (gL).
Recenti studi hanno dimostrato come la prima proteina ad essere arruolata nel complesso di ingresso sia gB, seguita poi da gH-gL (Gianni, Amasio et al. 2009).
La funzione di gB si esplica sotto forma di trimero, e sembra che anche questa proteina sia sottoposta ad un cambiamento conformazionale durante la fase di ingresso, tuttavia
essa manca di alcune delle caratteristiche rappresentative di numerose proteine di fusione virali (Heldwein, Lou et al. 2006).
Figura 3.4 - Ciclo di replicazione di HSV
La gH, invece, contenendo sequenze del tutto simili ad alcune proteine di fusione note, sembra svolgere effettivamente questo ruolo (Gianni, Martelli et al. 2005), inoltre gH lega il recettore cellulare integrina αVβ3 ma il significato di questo legame è ancora poco chiaro
(Parry, Bell et al. 2005).
Infine, alcuni tipi cellulari possono anche venire produttivamente infettati mediante un processo di endocitosi indipendente dal complesso di ingresso.
Dopo la fusione dell’envelope con la membrana plasmatica si ha dunque la penetrazione del nucleocapside virale all’interno del citoplasma della cellula ospite, qui il nucleocapside, servendosi dei microtubuli del citoscheletro (Sodeik 2000), raggiunge la mambrana nucleare a livello della quale si lega, per poi introdurre il DNA virale all’interno attraverso i pori nucleari. Il processo di scapsidamento del DNA richiede la partecipazione
di proteine cellulari e virali, quali ad esempio l’importina β e Ran-GTP (Newcomb, Booy et al. 2007).
All’interno del nucleo della cellula infettata, il DNA lineare viene rapidamente circolarizzato, probabilmente per favorire la replicazione delle regioni terminali del genoma (Fatahzadeh and Schwartz 2007).
La trascrizione di tutti i geni virali viene effettuata ad opera della RNA polimerasi II dell’ospite; mentre le proteine cellulari sono sufficienti per la sintesi dei trascritti virali, per l’inizio e l’avanzamento della trascrizione di alcuni geni virali sono necessarie le proteine virali stesse.
La replicazione di HSV avviene mediante tre successive fasi di trascrizione (Taylor, Brockman et al. 2002): per prima si ha la trascrizione delle proteine immediate precoci (IE) a livello dei geni immediati precoci (α), queste proteine sono responsabili della replicazione virale ed includono numerose proteine multifunzionali (ICP0, ICP4, ICP22 ed ICP27) che giocano un ruolo essenziale nell’espressione genica virale tardiva così come nel controllo del metabolismo della cellula ospite.
La seconda fase prevede la trascrizione dei geni precoci (β), che codificano per le proteine precoci (E), queste comprendono enzimi che sintetizzano ed impacchettano il DNA virale come la DNA polimerasi virale e la timidina chinasi.
Infine, a seguito della replicazione del DNA virale, si ha la trascrizione delle proteine tardive (L) da parte dei geni tardivi (γ), molte di queste proteine sono componenti del virione.
La replicazione del DNA di HSV avviene in strutture specializzate all’interno del nucleo della cellula infetta, chiamate compartimenti di replicazione. La replicazione inizia a livello di una delle tre origini di replicazione e inizialmente procede secondo un meccanismo theta. Una volta che la sintesi del DNA è iniziata, questo meccanismo viene sostituito da un meccanismo di replicazione a circolo rotante che è responsabile della produzione della maggior parte della progenie virale. Il virus codifica per numerose proteine necessarie per la sintesi del DNA virale, tuttavia diversi fattori cellulari, quali DNA ligasi e topoisomerasi, possono contribuire allo svolgimento di questo processo.
L’assemblaggio dei capsidi virali avviene a livello del nucleo e richiede numerose proteine L. Queste proteine, una volta tradotte nel citoplasma, si complessano a proteine virali dotate di segnale di localizzazione nucleare (NLS) ed entrano nel nucleo.
L’assemblaggio del capside non richiede fattori cellulari e può essere anche riprodotto in vitro utilizzando proteine virali purificate (Mettenleiter, Klupp et al. 2009).
I capsidi vuoti sono caricati con il DNA virale mediante un processo che simultaneamente svolge i concatameri e impacchetta monomeri di dimensione genomica a formare il nucleocapside.
Una volta assemblato il nucleocapside, si ha la fuoriuscita del virus dalla cellula, con conseguente acquisizione dell’envelope. Prima di tutto il nucleocapside fuoriesce dalla membrana nucleare interna (INM) mediante un processo di esocitosi, durante questo passaggio si ha l’acquisizione di parte del tegumento e di un envelope primario. A questo punto si ha la fusione dell’envelope primario con la membrana nucleare esterna (ONM) con conseguente traslocamento del nucleocapside nel citosol dove esso completa la formazione del tegumento. L’acquisizione dell’envelope secondario avviene a livello dell’apparato del Golgi, si ha quindi il rilascio all’esterno delle particelle virali complete in seguito alla esocitosi delle stesse. Recenti studi (Mettenleiter, Klupp et al. 2006) hanno dimostrato come esista una sola via di maturazione delle particelle virali, che è appunto quella che prevede l’acquisizione successiva di due diversi envelope; fino a poco tempo fa, invece, erano considerate coesistere due vie parallele, di cui la seconda prevedeva l’acquisizione dell’envelope solo a livello della INM ed il traslocamento di vescicole esocitate dalla ONM, contenenti le particelle virali mature, nel Golgi o nel reticolo endoplasmatico, dal quale poi venivano rilasciati i virioni mediante la normale via secretoria.
3.1.5 Trasmissione
HSV-1 ed HSV-2 si trasmettono principalmente attraverso il contatto diretto di mucose o di pelle che presenta lesioni o abrasioni con le secrezioni mucose di un individuo con un infezione primaria o ricorrente in atto. La trasmissione può risultare anche dalle secrezioni mucose un individuo asintomatico che, nonostante l’apparenza, libera ugualmente il virus senza alcun segno clinico di malattia.
HSV-1 è principalmente associato ad infezioni orali, faringee, facciali, oculari e del sistema nervoso, ed è trasmesso, nella maggior parte dei casi, attraverso secrezioni orali e contatti non genitali. È stato riportato che nel 67% delle persone affette da herpes simplex labiale, è possibile isolare HSV-1 dalle mani, indicando così una via di trasmissione
principalmente orizzontale (Turner, Shehab et al. 1982). HSV-1 infatti, può persistere per un breve periodo di tempo sulla pelle, i vestiti e gli oggetti di plastica, facilitando in questo modo una via di trasmissione anche attraverso un contatto diretto di tipo non sessuale.
HSV-2 si ritrova frequentemente nelle infezioni anali e genitali e viene trasmesso principalmente mediante un contatto diretto sessuale attraverso le secrezioni genitali.
Nonostante questa suddivisione generale, i cambiamenti nei costumi e nelle abitudini sessuali, che hanno interessato la nostra società negli ultimi decenni, hanno portato questa generalizzazione ad essere sempre meno calzante. Oggigiorno, infatti, la differenza tra le frequenze di localizzazione dei due virus non è più così netta (Gupta, Warren et al. 2007) al punto tale che in numerosi paesi industrializzati almeno la metà degli episodi di herpes genitale è dovuta ad un’infezione da HSV-1 (Buxbaum, Geers et al. 2003; Manavi, McMillan et al. 2004; Xu, Sternberg et al. 2006).
Nel caso di infezione da HSV, sono possibili 2 diverse manifestazioni sintomatiche iniziali. Con infezione primaria ci si riferisce al primo episodio di herpes in un individuo sieronegativo per HSV-1 o HSV-2. Un infezione secondaria, invece, si ha in individui sieropositivi per uno dei due virus, che acquisiscono l’altro. Le infezioni primarie hanno manifestazioni solitamente più gravi e sono spesso associate a sintomi evidenti e ad una liberazione del virus prolungata nel tempo. La ricerca di anticorpi anti-HSV può aiutare nella distinzione tra infezione primaria e secondaria, in particolare, elevati livelli di IgM saranno predittivi di un’infezione primaria, mentre livelli molto elevati di IgG suggeriranno la possibilità di un’infezione secondaria.
3.1.6 Patologia e Patogenesi
3.1.6.1 Gengivostomatite erpetica primaria
L’infezione da HSV colpisce principalmente la pelle e le mucose. La più comune manifestazione erpetica a livello oro-facciale è la gengivostomatite primaria (Arduino and Porter 2008), questa è caratterizzata dalla comparsa di lesioni vesciculo-ulcerative a livello orale e periorale. La gengivostomatite si sviluppa in individui sieronegativi che sono entrati in contatto per la prima volta col virus, o in individui che sono già stati infettati da uno dei due virus, ma non hanno sviluppato un titolo di anticorpi sufficiente. La maggior parte delle infezioni trascorrono in maniera sub-clinica ed il più alto numero di casi si riscontra nei bambini di età compresa tra 1 e 5 anni (Simmons 2002). I neonati, essendo protetti in
modo passivo dagli anticorpi materni fino a circa il sesto mese di vita, solo raramente acquisiscono l’infezione (Muller, Jones et al. 2010). Le manifestazioni sintomatiche sono tipicamente precedute o accompagnate da una sensazione di bruciore o parestesia a livello del sito di inoculo, da linfadenopatia cervicale e submandibolare, febbre, malessere, mialgia, perdita di appetito, disfagia e mal di testa. Uno o 2 giorni più tardi, un numero elevato di vescicole transienti compare sulla mucosa orale, successivamente queste si rompono provocando, all’interno e nei dintorni della cavità orale, ulcerazioni superficiali e dolorose. Le gengive appaiono da subito infiammate ed edematose. Negli individui sani la prognosi dell’infezione primaria è eccellente, con un tempo di guarigione atteso tra i 10 ed i 14 giorni. La liberazione del virus all’interno del cavo orale, tuttavia, persiste per numerose settimane dopo la risoluzione della malattia.
3.1.6.2 Herpes oro-facciale ricorrente
In seguito ad infezione primaria, HSV latentizza e periodicamente può andare incontro a riattivazione, migrando dal ganglio sensorio, provocando così l’herpes orale ricorrente. Nonostante HSV-2 possa provocare l’infezione orale primaria, la sua riattivazione in questo caso è rara (Esmann 2001). La frequenza delle riattivazioni riguarda solo il 15-40% dei pazienti sieropositivi e sembra essere influenzata da vari fattori quali ad esempio una certa suscettibilità genetica, dallo stato immunitario, dall’età, dal sito anatomico di infezione, dalla dose iniziale di inoculo e dal ceppo virale, inoltre la riattivazione sembra divenire meno frequente dopo i 35 anni di età (Fatahzadeh and Schwartz 2007). Se comparato all’entità dell’infezione primaria, l’episodio ricorrente è solitamente più lieve e di durata più breve, con un minimo coinvolgimento a livello sistemico. Nel paziente sano, le lesioni ricorrenti rimangono localizzate a livello dello stesso sito dell’infezione primaria.
La forma di herpes oro-facciale ricorrente più frequente è sicuramente l’herpes labiale, conosciuto anche col nome di febbre sorda. Nella maggiorparte dei pazienti questa forma ricorre periodicamente con 2 o meno episodi l’anno, tuttavia nel 5-10% dei pazienti le riattivazioni possono essere anche più frequenti ed arrivare ai 6 episodi l’anno. I segni prodromici, come bruciore e dolore localizzato, durano per circa 6 ore e sono dovuti alla replicazione del virus a livello delle terminazioni dei nervi sensori che innrevano i dermatomeri mucocutanei. Solitamente, entro le 24 ore compaiono le vescicole che poi si risolvono in meno di 2 settimane senza lasciare cicatrici.
3.1.6.3 Herpes genitale
Le ulcerazioni a livello genitale posso essere causate sia da HSV-1 che da HSV-2. Le manifestazioni cliniche sono molteplici e possono variare da una forma prettamente asintomatica, a forme severe che possono portare anche a complicazioni quali ritenzione urinaria, meningite e morbidità psicologica. La maggior parte delle infezioni da HSV risultano essere sub-cliniche e non vengono percepite dalla persona infettata, questo fatto rappresenta un grosso problema di salute pubblica in quanto questi soggetti, anche se asintomatici, posso ugualmente liberare il virus nelle loro secrezioni, rischiando così di infettare il partner. Così come nell’herpes labiale, anche nell’herpes genitale, l’infezione primaria è preceduta da una fase prodromica che in questo caso può dare anche segni sistemici quali mal di testa, febbre, malessere e linfoadenopatia inguinale. Nel giro di pochi giorni dal contatto sessuale si ha la comparsa di vescicole di varie dimensioni a livello degli organi genitali maschili o femminili; nella donna durante l’infezione primaria è comune la comparsa di vescicole anche a livello della cervice uterina. Le vescicole gradualmente si rompono e formano ulcerazioni irregolari che poi formano una crosta e guariscono senza lasciare cicatrici nel giro di 2-6 settimane.
Per la loro anatomia, i genitali femminili si prestano molto bene alla diffusione del virus e questo può predisporre la donna a manifestazioni cliniche più severe. Inoltre, le donne vanno incontro a sintomi sistemici più evidenti ed a complicazioni più frequenti quali ad esempio meningite asettica e disuria. La meningite è una complicazione grave che affligge l’11% degli uomini ed il 36% delle donne con un’infezione primaria da HSV (Tyler 2004).
In segiuto all’infezione primaria, il virus permane in forma latente a livello dei gangli sensori o autonomici, fino alle successive riattivazioni. Queste possono portare sia a ricorrenze sub-cliniche che a manifestazioni mucocutanee sintomatiche. Gli episodi ricorrenti sono solitamente di entità minore e più localizzati rispetto all’infezione primaria e questo porta ad una fase di liberazione del virus meno intensa e più breve in durata (Beauman 2005). La frequenza delle riattivazioni e la liberazione del virus durante la fase asintomatica di può variare molto sia tra soggetti diversi, sia nello stesso soggetto in momenti diversi (Ashley and Wald 1999). Le ricorrenze sintomatiche risultano essere più frequenti negli uomini e questo spiega, almeno in parte, la grande efficienza di trasmissione di HSV-2 dall’uomo alla donna (Beauman 2005).
3.1.6.4 Herpes neonatale
L’herpes neonatale, risultato della trasmissione verticale al neonato di HSV, ha conseguenze spesso possono essere devastanti o fatali. L’acquisizione può avvenire in utero, durante o dopo il parto. Nel caso della trasmissione perinatale, questa può avvenire per esposizione diretta del neonato o alle lesioni materne o alle secrezioni che risultano infette a causa della liberazione del virus durante la fase asintomatica.
L’infezione congenita da HSV è rara (Whitley and Roizman 2001) e può portare a microcefalia, idrocefalo, retinite ed eruzioni vescicolari cutanee. Le infezioni acquisite alla nascita sono spesso sintomatiche e ricoprono uno spettro di manifestazioni che possono portare a prognosi diverse (Corey and Wald 2009): patologie neonatali limitate alla pelle, occhi e bocca, encefalite neonatale, malattie disseminate che coinvolgono il fegato, i polmoni ed altri organi vitali.
Anche con il supporto della terapia, nei neonati con encefalite da HSV o infezione disseminata, i tassi di mortalità sono elevati (Rudnick and Hoekzema 2002), i neonati che superano l’infezione, inoltre, hanno spesso problemi di sviluppo del sistema nervoso. Non risulta di particolare gravità se l’infezione è acquisita nel primo o secondo trimestre di gravidanza. Se l’infezione genitale primaria viene invece acquisita tardi durante la gravidanza, le probabilità di trasmissione dell’infezione al feto sono maggiori rispetto alle donne soggette ad infezioni ricorrenti. Il parto cesareo viene suggerito nel caso in cui la madre contragga l’herpes genitale primario o nel caso di una riattivazione sintomatica nei giorni immediatamente precedenti al parto naturale. Nel caso di una riattivazione, se non si hanno lesioni o siamo in presenza di un titolo sufficiente di anticorpi trans-placentari protettivi, il parto cesareo non viene consigliato, visto il rischio minimo di trasmissione al neonato.
3.1.6.5 Altre forme di infezione erpetica
La disseminazione dell’infezione erpetica orale o periorale può complicare delle bruciature cutanee, una dermatite atopica pre-esistente o delle procedure cosmetiche a livello della zona della testa e del collo, questo può portare ad una seria e progressiva condizione conosciuta col nome di eczema herpeticum o eruzione varicelliforme di Kaposi (KVE) (Esmann 2001). KVE porta alla fusione delle vescicole in larghe zone erosive che sono suscettibili a superinfezione da parte di batteri cutanei. Le lesioni erpetiche si diffondono
direttamente alla regione cutanea irritata, evitando in tal modo il passaggio dalla terminazione nervosa e dai gangli; per questo motivo, non essendo la disseminazione un vero e proprio inoculo, le fasi successive quali la latenza virale e le riattivazioni non sono attese (Marcus, Lipozencic et al. 2005).
L’herpes gladiatorum è una forma che viene acquisita in seguito ad inoculo di HSV attraverso abrasioni della pelle, solitamente in atleti che praticano spot ad elevato contatto fisico quali wrestling, rugby e calcio. Le lesioni possono comparire a livello del collo, faccia ed orecchie, entro le 2 settimane dal contatto diretto (Anderson 2008). La comparsa delle lesioni porta alla esclusione dell’atleta dagli eventi sportivi, che dovrà poi ricorrere alla terapia antivirale per la durata della stagione sportiva (Brady and Bernstein 2004).
L’herpes whitlow è una forma cutanea che interessa le falangi distali della mano, questa forma può presentarsi soprattutto in operatori sanitari, bambini con herpes orale ed adulti con herpes genitale. L’infezione viene trasmessa in seguito all’inoculo diretto a livello della cute abrasa del dito con uno dei due virus. L’inoculo esogeno di HSV-1 negli operatori sanitari era la causa predominante fino all’introduzione routinaria dei guanti, oggigiorno la causa predominante è l’esposizione ad HSV-2 attrverso il contatto genitale (Wu and Schwartz 2007)
L’herpes oculare è la prima causa di cecità corneale negli Stati Uniti e nei paesi ad alto reddito (Fillet 2002) ed è la prima causa di cecità corneale unilaterale al mondo (Barker 2008). L’inoculo del virus a livello oculare può portare a cheratocongiuntivite unilaterale o bilaterale, ulcerazioni oculari ricorrenti, perdita della vista e necessita un’immediato intervento con terapia antivirale. Nel bambino, l’infezione primaria oculare può essere anche molto grave e solitamente è bilaterale (Pepose, Keadle et al. 2006).
3.1.6.6 Infezione erpetica nell’ospite immuno-compromesso
L’infezione erpetica ricorrente è una delle principali cause di morbidità e mortalità nel paziente immunocompromesso. Le ricorrenze mucocutanee risultano essere protratte nel tempo, con sintomatologia più grave, poco responsive alle terapie ed associate ad una liberazione del virus di durata maggiore; inoltre spesso coinvolgono più siti contemporaneamente ed esiste il rischio concreto di una disseminazione del virus. Pur trattandosi di episodi ricorrenti, le lesioni intra-orali si presentano in una forma estesa coinvolgendo sia la mucosa cheratinizzata che quella non cheratinizzata, allo stesso modo di come avviene nelle lesioni primarie.
HSV-2 è un agente coinfettivo molto frequente nella popolazione positiva al virus dell’immunodeficienza umana (HIV), in parte a causa della via di trasmissione, ovvero quella sessuale, comune ai due virus (Weiss 2004). In questi pazienti l’infezione da HSV-2 è solitamente asintomatica, anche se la liberazione del virus a livello vaginale è molto più alta rispetto agli individui che presentano un’infezione solo da HSV-2. Nei pazienti con un’infezione da HIV allo stadio avanzato, le ulcerazioni ano-genitali si fanno sempre più frequenti e persistenti, progredendo successivamente fino a divenire necrotiche (Strick, Wald et al. 2006).
L’herpes ano-genitale è una delle infezioni opportunistiche che si ritrovano più frequentemente nei pazienti con sindrome da immunodeficienza acquisita (AIDS) e le ulcerazioni erpetiche sono una delle patologie che definiscono l’AIDS.
Nei pazienti con patologia genitale ulcerativa sintomatica, di cui HSV-2 è una delle principali cause, il rischio di trasmissione di HIV risulta significativamente aumentato sia a causa del danneggiamento ed infiammazione a livello degli epiteli, sia a causa di HSV-2 stesso. È stato visto, infatti, che la riattivazione di HSV-2 porta ad un aumento dei livelli di HIV nelle secrezioni genitali, aumentando così il rischio di trasmissione, il titolo di HIV è incrementato anche nel sangue e secrezioni vaginali di pazienti con una riattivazione asintomatica di HSV-2 in corso.
Nonostante il trattamento di HSV-2 con la terapia antivirale riduca la frequenza delle riattivazioni e diminuisca il titolo di HIV, questa non sembra tuttavia ridurre la trasmissione di HIV (Celum, Wald et al. 2010)
3.1.7 Epidemiologia
HSV-1 è responsabile, a livello mondiale, della maggior parte dei casi di infezione da HSV di tipo non genitale, i livelli di sieropositività mondiale, infatti, variano dal 45% al 98%, mentre, negli Stati Uniti, una percentuale che va dal 40% al 63% della popolazione risulta sieropositiva (Fatahzadeh and Schwartz 2007). La sieroprevalenza di HSV-1 varia con l’età, la razza, la posizione geografica e con lo stato socio-economico, il valore più elevato viene registrato nei paesi meno industrializzati (Whitley and Roizman 2001).
Negli Stati Uniti il 35% dei bambini di colore all’età di 5 anni presentano anticorpi anti-HSV, contro il 18% dei bambini bianchi, dimostrando in questo modo che l’acquisizione dell’infezione è fortemente influenzata dalla razza (Whitley and Roizman 2001). Per quanto
riguarda l’aspetto socio-economico, nelle popolazioni a basso status negli Stati Uniti la prevalenza di anticorpi anti-HSV è del 33% nei bambini di 5 anni, per aumentare al 70%-80% nella tarda pubertà (Xu, Sternberg et al. 2006). Al contrario, negli Stati Uniti i bambini che vivono in uno stato socio-economico più alto acquisiscono l’infezione più tardi con una sieroprevalenza solo del 20% prima dei 5 anni di età e del 40%-60% tra i giovani adulti (Glick 2002).
L’infezione da HSV, in particolare quella da HSV-2, è la causa principale di ulcerazioni genitali di naura sessuale al mondo (Lafferty 2002). In particolare, negli Stati Uniti, si stima che più di 50 milioni di individui abbiamo l’herpes genitale, e che annualmente vengano segnalati mezzo milione di nuovi casi (Steben 2005).
Negli ultimi 30 anni la sieroprevalenza di HSV-2 è aumentata drasticamente tanto che oggigiorno negli Stati Uniti il 20%-25% degli adulti presenta anticorpi anti-HSV-2 prima dei 40 anni di età (Ohana, Lipson et al. 2000).
I fattori di rischio per l’infezione genitale da HSV risultano essere: età avanzata, genere femminile, razza nera, basso stato socio-economico, basso livello di educazione, acquisizione pregressa di altre malattie sessualmente trasmesse, età precoce del primo rapporto sessuale ed numero elevato di partner sessuali.
La sieroprevalenza di HSV-2 è maggiore nelle donne. Le donne HSV-1 positive hanno una possibilità minore del 5%-20% di andare incontro ad una sieroconversione per HSV-2 rispetto alle donne HSV-1 sieronegative (Wald 2004).
3.1.8 Terapia
In generale, il trattamento delle infezioni da HSV inizia con la prevenzione. Le strategie preventive più appropriate sono quelle che si basano sull’educazione pubblica riguardo ad argomenti quali la natura contagiosa dell’infezione, la possibilità di auto-inoculo, l’efficacia delle barriere protettive, quali ad esempio il condom, nel prevenire la trasmissione virale, la liberazione del virus anche durante la fase asintomatica e la terapia antivirale.
L’intervento con una terapia deve essere effettuato non prima di una valutazione generale dei segni clinici, dei sintomi e della salute del paziente, e deve tenere conto del sito di infezione e della natura primaria o ricorrente.
Gli agenti antivirali disponibili non curano l’infezione da HSV, ma piuttosto modificano il decorso della malattia andando ad inibire la replicazione virale e, conseguentemente, il
danno agli epiteli. Dato il decorso naturale dell’infezione erpetica, e la presenza di replicazione virale nelle prime 48 ore dall’inizio dell’episodio ricorrente, un intervento rapido a livello del sito di replicazione virale è di importanza critica per un esito positivo della terapia e nel prevenire la possibilità di una ricorrenza clinica (Simmons 2002).
Per il trattamento delle infezioni da HSV possono essere somministrati antivirali in forma topica, orale o intravenosa. L’efficacia degli agenti per via topica è determinata dalla loro permeabilità attraverso l’epitelio e dalla loro disponibilità a livello delle terminazioni dei nervi sensori, dove avviene la replicazione virale. In generale, la terapia topica è meno efficace delle altre terapie, prevalentemente a causa della difficoltà nel raggiungere le lesioni più inaccessibili (Esmann 2001). Nel caso di lesioni a livello del setto nasale, orecchio interno o genitali interni, vengono raccomandati farmaci per via sistemica.
Rispetto agli agenti topici, i farmaci antivirali orali permettono una esposizione sistemica al farmaco, un più rapido accesso ai siti di replicazione virale, una più elevata biodisponibilità, la possibilità di somministrazioni ridotte ed una compliance maggiore da parte dei pazienti. Questi permettono anche una via pratica ed appropriata per la terapia soppressiva a lungo termine nei pazienti con riattivazioni frequenti e severe (Simmons 2002).
Infine, l’intervento con gli antivirali per via sistemica è raccomandato nei casi di eczema herpeticum, herpes neonatale, encefalite da HSV, herpes oculare ed infezioni da HSV nell’ospite immunocompromesso.
Numerosi sono i farmaci che vengono correntemente utilizzati nel trattamento delle infezioni erpetiche da herpes simplex (Fig 3.5).
Acyclovir, famciclovir e valacyclovir sono agenti farmacologici sicuri ed efficaci per il trattamento dell’herpes genitale primario; tutti e 3 i farmaci permettono una riduzione della severità dei sintomi, della durata del periodo di liberazione del virus e promuovono una più rapida guarigione delle lesioni.
Il trattamento con questi farmaci durante il primo episodio non influisce sulla frequenza e severità delle ricorrenze future (Emmert 2000).
Acyclovir, valacyclovir e penciclovir sono tutti analoghi aciclici della guanosina ed agiscono interferendo con la polimerasi virale e con la replicazione del DNA virale. Il farmaco si trova in una forma non biologicamente attiva che viene raggiunta in seguito a fosforilazioni successive da parte della timidina chinasi (TK) virale e delle chinasi cellulari.
Dal momento che il primo
gli effetti collaterali degli analoghi dell
Il meccanismo di azione principale dell’acyclovir e del valacyclovir trifosfato è una inibizione selettiva della DNA polimerasi e la successiva incorporazione del composto nella catena di DNA virale in allungamento con conseguen
Rispetto all’acyclovir, il penciclovir ha una emivita maggiore, raggiunge una concentrazione più elevata
meno potente nell’inibire la DNA polimerasi virale
arresta la sintesi del DNA virale attraverso un meccanismo di azione irreversibile che si basa più sulla inibizione competitiva della DNA polimerasi, piuttosto che sul
catena di DNA (Chakrabarty, Pang et al. 2004)
Il valacyclovir, è un agente antivirale sistemico appr
simplex labiale ricorrente. Si tratta dell’estere valinico dell’acyclovir, e per questo viene assorbito più rapidamente e metabolizzato completamente ad acyclovir ed L
del fegato e dell’intestino. Il va
rispetto a quella dell’acyclovir e questo permette di ridurre il numero di somministrazioni orali ed aumenta la compliace
3.5 - Principali agenti farmacologici utilizzati nella cura delle infezioni erpetiche
Dal momento che il primo step di fosforilazione richiede l’enzima virale, a livello cellulare gli effetti collaterali degli analoghi della guanosina sono attenuati.
Il meccanismo di azione principale dell’acyclovir e del valacyclovir trifosfato è una inibizione selettiva della DNA polimerasi e la successiva incorporazione del composto nella catena di DNA virale in allungamento con conseguente terminazione della stessa.
Rispetto all’acyclovir, il penciclovir ha una emivita maggiore, raggiunge una più elevata all’interno delle cellule infettate, ma è dalle 100 alle 160 volte meno potente nell’inibire la DNA polimerasi virale (Zhu, Guo et al. 2009)
arresta la sintesi del DNA virale attraverso un meccanismo di azione irreversibile che si basa più sulla inibizione competitiva della DNA polimerasi, piuttosto che sul
(Chakrabarty, Pang et al. 2004).
Il valacyclovir, è un agente antivirale sistemico approvato per il trattamento dell’herpes simplex labiale ricorrente. Si tratta dell’estere valinico dell’acyclovir, e per questo viene assorbito più rapidamente e metabolizzato completamente ad acyclovir ed L
del fegato e dell’intestino. Il valacyclovir possiede una biodisponibilità 5 volte maggiore rispetto a quella dell’acyclovir e questo permette di ridurre il numero di somministrazioni
compliace del paziente (Rajalakshmi, Kumari et al.
Principali agenti farmacologici utilizzati nella cura delle infezioni erpetiche
di fosforilazione richiede l’enzima virale, a livello cellulare
Il meccanismo di azione principale dell’acyclovir e del valacyclovir trifosfato è una inibizione selettiva della DNA polimerasi e la successiva incorporazione del composto nella
te terminazione della stessa.
Rispetto all’acyclovir, il penciclovir ha una emivita maggiore, raggiunge una all’interno delle cellule infettate, ma è dalle 100 alle 160 volte (Zhu, Guo et al. 2009). Il penciclovir arresta la sintesi del DNA virale attraverso un meccanismo di azione irreversibile che si basa più sulla inibizione competitiva della DNA polimerasi, piuttosto che sulla terminazione della
ovato per il trattamento dell’herpes simplex labiale ricorrente. Si tratta dell’estere valinico dell’acyclovir, e per questo viene assorbito più rapidamente e metabolizzato completamente ad acyclovir ed L-valina a livello lacyclovir possiede una biodisponibilità 5 volte maggiore rispetto a quella dell’acyclovir e questo permette di ridurre il numero di somministrazioni
(Rajalakshmi, Kumari et al. 2010).
Il valacyclovir è approvato dalla Food and Drug Administration per il trattamento delle infezioni da HSV nei pazienti con infezione da HIV, tuttavia in questi pazienti devono essere costantemente monitorati i segni ed i sintomi di microangiopatia trombotica, un grave effetto collaterale che si può osservare in questi casi.
Il famciclovir è un antivirale sistemico che è stato approvato per il trattamento dell’herpes oro labiale nel paziente immunocompromesso; si tratta di un profarmaco del penciclovir con un gruppo diacetil estere, questo viene rapidamente assorbito nel tratto gastro intestinale e convertito in penciclovir in seguito all’ingestione. Il famciclovir presenta un migliore assorbimento a livello orale, una discreta biodisponibilità e sono sufficienti somministrazioni ad intervalli maggiori rispetto al penciclovir. Il farmaco presenta lo stesso meccanismo di azione dell’acyclovir, inibendo la DNA polimerasi, ma non causa anche la terminazione della catena di DNA.
Foscarnet è un agente antivirale da assumersi per via intravenosa ed è stato approvato per il trattamento delle infezioni da HSV resistenti all’acyclovir nel paziente immunocompromesso, in quanto la presenza di mutanti resistenti all’acyclovir è un evento alquanto raro nel paziente sano. La resistenza all’acyclovir può essere attribuita sia mutazioni a livello della DNA polimerasi che a mutazioni nel gene della TK.
Foscarnet è un analogo del pirofosfato con un meccanismo di azione indipendente dalla fosforilazione da parte delle chinasi virali o cellulari. Questo agisce bloccando selettivamente i siti di legame del pirofosfato a livello della DNA polimerasi virale che in questo modo risulta completamente inattiva. Tra gli effetti collaterali del farmaco vanno sottolineati la tossicità a livello renale, che può essere ridotta in parte attraverso una sufficiente idratazione prima e durante le infusioni. Gli episodi di resistenza al foscarnet sono rari e possono essere dovuti a mutazioni puntiformi a livello della DNA polimerasi virale.
Cidofovir è un nucleoside aciclico 5-monofosfato che inibisce selettivamente la DNA polimerasi virale in seguito a fosforilazione da parte delle chinasi dell’ospite (Zabawski 2000). È fortemente nefrotossico ed è riservato esclusivamente al trattamento delle infezioni da virus resistente all’acyclovir ed al foscarnet; dal momento che questo farmaco non richiede la TK per essere attivato, è efficace anche in presenza di HSV TK-deficiente. Cidofovir ha una emivita molto prolungata e per questo motivo può essere somministrato
una volta alla settimana per via endovenosa. Gli episodi di resistenza al farmaco sono principalmente dovuti a mutazioni a livello della DNA polimerasi virale.
3.2 Sistema Immunitario
La funzione fisiologica del sistema immunitario è quella di difendere l’organismo da sostanze estranee all’organismo, sia che siano microbi o macromolecole quali proteine o polisaccaridi, indipendentemente dalle conseguenze fisiologiche o patologiche di tale risposta.
La difesa nei confronti dei microrganismi poggia su risposte precoci mediate dall’immunità innata e su risposte più tardive mediate dall’immunità specifica (Fig 3.6).
3.6 – Componenti cellulari e proteiche coinvolte nell’immunità innata e specifica (da www.people.eku.edu)
3.2.1 Immunità Innata
Gli effettori dell’immunità innata, quali peptidi antimicrobici, fagociti ed il sistema del complemento, si attivano immediatamente dopo l’inizio dell’invasione dell’ospite e sono in grado di controllare rapidamente la replicazione dell’agente infettivo. Per questo motivo, la funzione principale dell’immunità innata è sempre stata ritenuta essere il contenimento
dell’infezione fino all’attivazione dell’immunità specifica. Tuttavia, oggi si è sempre di più messa in evidenza l’importanza dell’immunità innata in tutte le fasi della difesa dell’ospite da parte del sistema immunitario (Takeuchi and Akira 2009).
Durante l’evoluzione, il sistema immunitario innato si è sviluppato prima del sistema adattativo, ed alcune forme di immunità innata erano probabilmente già presenti in tutti gli organismi multicellulari. A differenza dell’immunità adattativa, il riconoscimento da parte dell’immunità innata, essendo mediato da recettori codificati dalla linea germinale, è determinato geneticamente. Un vantaggio di questi recettori è che si sono evoluti per selezione naturale secondo la loro specificità verso i patogeni. Nonostante i microbi siano estremamente eterogenei e possano mutare con un tasso molto più elevato rispetto all’ospite, tuttavia la strategia dell’immunità innata non è quella di riconoscere ogni possibile antigene, ma piuttosto focalizzarsi nel riconoscimento di poche strutture molto conservate e presenti in un gran numero di microrganismi.
Questi recettori, chiamati recettori di riconoscimento del profilo (PRR), sono espressi su numerose cellule effettrici del sistema immunitario innato quali ad esempio macrofagi, neutrofili, cellule natural killer (NK) e cellule dendritiche; una volta che il recettore ha riconosciuto un profilo associato ad un patogeno, la cellula effettrice è indotta ad iniziare la sua risposta immediatamente, piuttosto che dopo avere proliferato.
I PRR possono essere sia esposti sulla membrana citoplasmatica (Toll-like receptors e il recettore per il mannosio) che intracellularmente (Toll-like receptors, NOD-like receptors e RIG-I-like receptors), possono indurre un segnale all’interno della cellula che porta alla secrezione di fattori quali citochine e chemochine, oppure promuovere l’endocitosi del microrganismo.
A loro volta, i segnali indotti dal sistema innato controllano l’attivazione del sistema adattativo, che si trova così a rispondere ai patogeni solo in seguito al riconoscimento di questi da parte dell’immunità innata (Fig 3.7).
3.2.2 Immunità Specifica
L’immunità acquisita è anche chiamata immunità specifica in quanto è diretta contro specifici antigeni incontrati in precedenza dal sistema immunitario. I punti chiave di questa risposta sono la sua capacità di imparare, di adattarsi e di ricordare. Nonostante questo tipo di risposta necessiti, per svilupparsi, di un tempo maggiore in seguito all’esposizione ai nuovi antigeni, tuttavia, una volta che la memoria si è formata, le successive risposte allo stesso antigene risultano essere più veloci ed efficaci di quelle generate dall’immunità innata (Fig 3.8).
3.8 – Specificità, memoria ed auto-limitazione delle risposte immunitarie (www.virology.ws)
Le cellule responsabili dell’immunità acquisita sono i linfociti. Solitamente questa risposta ha inizio quando gli anticorpi, prodotti dalle cellule B, legano un antigene. In
questo processo vengono coinvolte anche le cellule dendritiche, le citochine ed il sistema del complemento che incrementa, con la sua attivazione, l’efficacia degli anticorpi.
I progenitori linfocitari si originano nel midollo osseo ed, una volta maturati, si ritrovano nel circolo sanguigno e nel sistema linfatico e si spostano all’interno dei tessuti nel caso in cui si abbia un focolaio d’infezione.
Le principali componenti della risposta specifica sono i linfociti T ed i linfociti B.
Le cellule T sono chiamate così in quanto prodotte nel timo, qui si ha la maturazione di quei precursori che non riconoscono gli antigeni self, questo ultimo tipo di cellula infatti potrebbe attaccare le cellule e i tessuti dell’organismo portando ad episodi di autoimmunità.
Le cellule T mature si ritrovano principalmente negli organi linfoidi secondari quali linfonodi, milza, tonsille, appendice e nell’intestino a livello delle placche di Peyer.
I linfociti T citotossici (CTL) sono una tipologia di linfociti la cui principale funzione è il riconoscimento e l’uccisione delle cellule dell’ospite infettate da virus o da altri microbi intracellulari. I CTL solitamente esprimono il recettore di adesione e trasduzione del segnale CD8 e riconoscono peptidi di derivazione microbica presentati da molecole del complesso maggiore di istocompatibilità (MHC) di classe I. L’uccisione delle cellule infettate da parte dei CTL presuppone la liberazione di granuli citoplasmatici, che contengono proteine in grado di indurre la formazione di pori sulla membrana delle cellule bersaglio ed enzimi, chiamati granzimi, che scindono le caspasi cellulari ed attivando così la morte apoptotica della cellula. Un altro meccanismo utilizzato dai CTL per indurre apoptosi nelle cellule infettate è mediante l’interazione tra il ligando di Fas (espresso dai CTL in seguito ad attivazione) ed il recettore Fas espresso sulle cellule target.
Un'altra sottopopolazione di linfociti T sono le cellule T helper, la cui principale funzione effettrice è l’attivazione dei macrofagi e dei CTL, nelle risposte cellulo-mediate, e la promozione della produzione di anticorpi da parte dei linfociti B, nelle risposte umorali. Queste funzioni effettrici sono mediate da citochine e dall’interazione del ligando di CD40 con le molecole CD40 espresse dai macrofagi e linfociti B. I linfociti T helper si distinguono per l’espressione del recettore CD4.
Una sottopopolazione di linfociti di alquanto recente scoperta è quella dei linfociti T regolatori (T-reg), questi sono specializzati nel sopprimere l’attivazione del sistema immunitario e quindi nel mantenere la sua omeostasi e la tolleranza agli antigeni self
(Basten and Fazekas de St Groth 2008). Il ruolo critico svolto da questa sottopopolazione si può facilmente evincere da alcune severe sindromi autoimmuni che sono il risultato di mutazioni genetiche che si possono ritrovare a livello di queste cellule.
Un'altra recente scoperta è quella delle cellule T helper 17 (Th17). Queste cellule secernono preferenzialmente interleuchina (IL)-17, IL-21 e IL-22. Il loro ruolo è quello di mediare la risposta dell’ospite contro vari agenti infettivi , specialmente contro i batteri extracellulari, e sono anche coinvolte nella patogenesi di numerose malattie autoimmuni tra le quali ricordiamo la psoriasi, il diabete mellito di tipo 1, l’artrite reumatoide e la malattia di Crohn (Ouyang, Kolls et al. 2008).
Le cellule B sono l’unico tipo cellulare capace di produrre anticorpi e rappresentano quindi la componente cellulare principale delle risposte umorali. Queste si sviluppano a livello del midollo osseo e si ritrovano, una volta mature, principalmente nei tessuti linfatici secondari, nel midollo osseo ed in piccolo numero anche nel sangue periferico.
Nella risposta all’antigene da parte dei linfociti B si distinguono 2 fasi: nella risposta immunitaria primaria, quando la cellula B incontra l’antigene per la prima volta, questo si lega al recettore, stimolando così la cellula a diventare cellula B della memoria o plasmacellula. I linfociti T helper aiutano le cellule B in questo processo. Le plasmacellule producono anticorpi che sono specifici per l’antigene che ha indotto la loro produzione. Durante la risposta immunitaria secondaria invece, quando la cellula B incontra nuovamente l’antigene specifico, le cellule B della memoria si attivano rapidamente, si moltiplicano e diventano plasmacellule, durante queste fasi si ha anche la maturazione dell’affinità, questo è un processo che porta all’aumento dell’affinità degli anticorpi rivolti verso un determinato antigene man mano che la risposta umorale procede e si esplica con la selettiva sopravvivenza dei linfociti B che producono anticorpi ad affinità maggiore.
Gli anticorpi, chiamati anche immunoglobuline o Ig, proteggono l’organismo secondo diversi meccanismi: innanzitutto possono neutralizzare le tossine, i batteri o i virus, impedendo il loro legame alla cellule che presentano il recettore specifico, inoltre le Ig possono aiutare i fagociti ad ingerire gli antigeni, attivare il complemento e favorire la citotossicità cellulare mediata da anticorpi.
Ciascun anticorpo è costituito da due parti: una parte è variabile ed è specializzata per l’attacco ai diversi antigeni, l’altra parte (Fc) può essere 1 di 5 diverse strutture, che determina la classe dell’Ig ed è costante.
Molte delle funzioni effettrici svolte dalle Ig sono mediate dalle regioni Fc della catena pesante: isotipi Ig diversi assolvono quindi a funzioni effettrici diverse.
3.3 Immunità ai Virus
In molte infezioni virali, il sistema immunitario ha la possibilità di attaccare le particelle virali durante varie fasi dell’infezione ad esempio prima che il virus penetri nelle cellule o quando questi sono liberati dopo la replicazione. L’attacco può anche avvenire a livello delle cellule infette durante le fasi di produzione delle proteine virali o durante la fase di assemblaggio, in questo caso sono gli antigeni che compaiono sulla membrana delle cellule infette ad attivare una risposta immunitaria (Fig 3.9). In alcuni casi, come per gli herpesvirus, l’infezione può persistere per un tempo indeterminato senza che alcuna particella virale od antigene di superficie siano rilevabili sulla membrana delle cellule infette. Quando questo avviene, il sistema immunitario non è in grado di combattere l’infezione, perché non ci sono peptidi virali che indichino la presenza del virus.
3.9 – Principali meccanismi adottati dal sistema immunitario nella difesa contro i virus (da http://biohorizons.oxfordjournals.org)
3.3.1 Immunità Innata ai Virus
Il principale sistema adottato dalla risposta innata contro le infezioni virali è quello mediato dall’interferone (IFN) e dall’attivazione delle cellule NK che sono rivolti principalmente contro le cellule infette.
L’IFN è una citochina presente in 3 diversi tipi: α, β e γ. I primi 2 sono prodotti prevalentemente dai monociti-macrofagi e in misura minore dai fibroblasti. L’IFN-γ è prodotto dai linfociti CD4 e CD8 e dalle cellule NK.
L’IFN esercita una forte azione antivirale e promuove diversi meccanismi quali l’induzione di uno stato di resistenza nelle cellule adiacenti alla cellula infetta, l’induzione di molecole ad attività antivirale e l’espressione di geni che codificano per proteine antivirali (Kawai and Akira 2006).
Le cellule NK, una sottopopolazione di linfociti di derivazione midollare, si attivano in seguito al contatto con una cellula infettata da virus che viene così attaccata mediante lisi diretta e secrezione di IFN-γ (Lanier 2008).
Un terzo meccanismo implicato nella difesa innata contro i virus è l’attivazione del sistema del complemento, sia dipendente che indipendente dalla presenza di anticorpi, questo meccanismo risulta essere ancora poco chiaro e necessita di ulteriori studi (Brockman and Knipe 2008).
3.3.2 Immunità Acquisita ai Virus
L’immunità adattativa è diretta sia contro le particelle virali che contro le cellule infettate da virus. Il più importante meccanismo diretto verso le particelle virali sono gli Ab, mentre la citotossicità cellulo-mediata è più efficace nella risposta contro le cellule infettate, quest’ultima può essere mediata da cellule (CD8+
), da cellule ed Ig (citotossicità cellulare mediata da anticorpi) o da Ig e sistema del complemento.
Nel caso in cui la risposta adattativa sia rivolta contro le particelle virali, il bersaglio principale risultano essere le strutture esterne del virione che essendo molto antigeniche, inducono un elevato numero di Ig.
Questo tipo di risposta prevede la neutralizzazione delle particelle infettive, l’agglutinazione virale e l’attivazione della fagocitosi nel momento in cui i complessi antigene-anticorpo vanno a stimolare il recettore Fc situato sui macrofagi.
Nel caso in cui, invece, la risposta adattativa sia diretta contro la cellule infettate, che risultano visibili in quanto esprimono sulle loro membrane antigeni virali, queste vengono distrutte per prevenire la produzione di progenie virale. La risposta adattativa attacca le cellule infette sia attraverso il legame mediato dagli anticorpi sia in seguito a meccanismi di citotossicità da parte dei linfociti CD8+
, meccanismo che risulta tra i più efficaci contro le infezioni virali.
3.3.3 Risposte innate ed adattative contro HSV
La risposta immunitaria contro HSV coinvolge sia meccanismi della risposta innata che di quella adattativa. Si ritiene che la risposta innata giochi un ruolo fondamentale nel determinare l’esito di una infezione da HSV, ad esempio, la produzione di IFN-α e β è stata relazionata alla protezione contro la malattia sia in modelli animali che in studi sull’uomo (Vollstedt, Arnold et al. 2004).
Inoltre, in vivo numerosi tipi cellulari contribuiscono alla risposta innata contro HSV. Tra questi i più rilevanti sono le cellule NK, la cui secrezione di citochine, il riconoscimento e l’uccisione delle cellule infettate da HSV, giocano un ruolo importante nella risposta contro il virus (Nandakumar, Woolard et al. 2008); inoltre vanno anche ricordate le cellule dendritiche plasmacitoidi, la cui azione fondamentale è la secrezione di IFN di tipo I (Lund, Sato et al. 2003).
Oltre a questa risposta, quella adattativa ha dimostrato giocare un ruolo fondamentale nella progressione della malattia, nella latenza e nel controllo della liberazione del virus.
Il livello di anticorpi neutralizzanti è stato correlato negativamente con la severità della malattia (Seppanen, Meri et al. 2006), tuttavia il ruolo della risposta umorale nel controllo della patogenesi e della diffusione è ancora controversa (Mossman et al. 2009).
La risposta cellulare è fortemente implicata nella difesa contro HSV attraverso la secrezione di IFN-γ da parte dei linfociti CD8+
(Milligan, Dudley-McClain et al. 2004; Iijima, Linehan et al. 2008).
È stato dimostrato come le cellule CD8+
siano richiamate da HSV-2 a livello delle lesioni durante le prime fasi dell’infezione e che queste contribuiscano notevolmente al controllo immunitario ed alla citolisi. In un modello murino d’infezione cutanea da HSV-1, la proliferazione delle cellule T CD8+
gB specifiche avviene in meno di 48 ore dall’infezione e correla con l’attività citolitica (Mueller, Jones et al. 2002).
La gB è un epitopo immunodominante contro il quale vengono prodotti numerosi linfociti T CD8+
specifici, tuttavia, sono stati anche recentemente individuati linfociti T CD8+
non gB-specifici che però possiedono un fenotipo del tutto simile a quelli specifici per quanto riguarda i marker di superficie, la produzione di citochine e la lisi (Sheridan, Cherpes et al. 2009). Questa osservazione suggerisce la presenza di epitopi sub-dominanti che contribuiscono ugualmente alla risposta delle cellule T CD8+
. Gli effetti antivirali esercitati dalle cellule T CD8+
sono stati largamente descritti, e tra questi l’azione dell’IFN-γ risulta tra le più importanti. Ad esempio è stato dimostrato che in un modello animale di infezione intravaginale, la risposta cellulare contro un ceppo TK-negativo di HSV-2 permette il controllo dell’infezione secondo una modalità IFN-γ dipendente (Dobbs, Strasser et al. 2005).
Visto il ruolo cruciale svolto da questo tipo cellulare nella difesa contro HSV, è stata valutata anche la possibile implicazione di una risposta immediata da parte dei linfociti CD8+
nel prevenire lo stabilirsi di uno stato di latenza, tuttavia, questa strategia terapeutica non si è dimostrata altrettanto promettente nel modello animale, nel quale si è osservata latenza anche in presenza di un basso titolo virale sia nei siti neurali che nel sito d’infezione (Wakim, Jones et al. 2008). Numerosi studi, infatti, hanno evidenziato come, durante la latenza neuronale, le cellule T CD8+
secernenti IFN-γ persistano in aree d’infiltrazione di cellule T (Sheridan, Cherpes et al. 2009), suggerendo così una stimolazione antigenica costante di questi linfociti che così, pur non riuscendo a cancellare l’infezione, persistono in uno stato attivo.
È stato anche descritto un ruolo minoritario per i linfociti T CD4+
, queste cellule sono in grado di conferire un certo livello di protezione in assenza di altri effettori della risposta immunitaria (Johnson, Chu et al. 2008).
3.4 Vaccini
Uno dei più grandi trionfi della medicina è stato il controllo di numerose infezioni grazie all’utilizzo di vaccini profilattici. Il successo delle formulazioni è stato confermato dall’eradicazione del vaiolo, annunciata nel 1977, e dalla ormai prossima eradicazione della poliomielite.
Altri vaccini che si sono dimostrati altamente efficaci sono quelli per la rosolia, orecchioni, varicella, febbre gialla ed epatite A e B (HAV e HBV), anche se sfortunatamente, a causa dei costi elevati, spesso queste formulazioni non sono accessibili alla maggioranza
delle persone nei paesi in via di sviluppo. Questo, ad esempio, crea una situazione particolarmente drammatica nel caso della rosolia, contro la quale sarebbe disponibile un vaccino estremamente efficace quando usato durante l’infanzia. Dato l’elevato numero di persone non vaccinate, la rosolia è tutt’oggi causa di elevata mortalità e complicazioni.
Nonostante l’elevatissimo sforzo intellettuale ed economico, numerosi sono ancora i virus contro i quali non è stato ancora sviluppato un vaccino efficace, tra questi ricordiamo HIV, il virus dell’epatite C (HCV) e tutti gli herpes virus, fatta eccezione per il varicella-zoster virus.
Molteplici fattori contribuiscono al fallimento di un vaccino e questi fattori possono essere anche comuni a più patogeni: nel caso dei virus ad RNA la chiave fondamentale sembra essere la plasticità, inoltre questi virus hanno evoluto numerosi strumenti efficaci per evadere la risposta immunitaria dell’ospite (Alcami and Koszinowski 2000).
I virus possono nascondersi in cellule inaccessibili al sistema immunitario o, idealmente, nelle stesse cellule che lo costituiscono. Questi patogeni possono causare infezioni croniche, persistenti o latenti. Gli esempi migliori sono HIV, HCV ed HSV. Questi patogeni sono solitamente resistenti alla neutralizzazione da parte delle Ig e per questo l’immunità nei loro confronti è dipendente quasi esclusivamente dalle cellule T.
Per questi virus sono richieste nuove strategie vaccinali che possano indurre sia una forte avidità da parte delle cellule T CD8+
effettrici e della memoria, sia una risposta centrale che possa rimuovere il focolaio iniziale di cellule infettate a livello delle superfici mucosali per prevenire la trasmissione e ridurre notevolmente lo sviluppo della malattia.
3.4.1 Vaccini attenuati ed inattivati
La storia dei vaccini risale agli studi condotti da Edward Jenner ed in seguito da Louis Pasteur i quali per primi introdussero il concetto di vaccinazione con microrganismi attenuati o inattivati.
I vaccini attenuati prevedono l’utilizzo di uno o più agenti infettanti vivi, che risultano simili all’agente che induce la malattia, ma la cui virulenza è attenuata. In questo modo il vaccino può indurre un’immunità a lungo termine contro l’omologo virulento senza però risultare in una patologia per il soggetto vaccinato. Solitamente questi vaccini vengono ottenuti da ceppi omologhi naturalmente attenuati (come nel caso dell’utilizzo del virus del vaiolo vaccino per l’immunizzazione contro il virus del vaiolo umano), oppure da ceppi
virulenti che vengono attenuati in maniera stabile utilizzando diverse tecniche. Il metodo più utilizzato prevede la crescita in coltura del virus fino alla perdita completa della virulenza, più di recente, sono stati generati con lo stesso intento ceppi virali mutanti o temperatura sensibili.
Questa tipologia di vaccini induce spesso un’immunità specifica duratura e la vaccinazione in età pediatrica è sufficiente a garantire una protezione per tutta la vita. Tra gli esempi di vaccini virali attenuati più efficaci sono da ricordare i vaccini contro la poliomielite, il morbillo e la febbre gialla.
Il limite maggiore di questa tipologia di vaccini sta nella loro sicurezza: l’attenuazione del patogeno, infatti, potrebbe risultare non completa o questo potrebbe revertire alla forma virulenta. Per esempio, ogni anno un piccolo numero di bambini contrae la poliomielite dopo la somministrazione del vaccino antipolio.
3.4.2 Vaccini con antigeni purificati (a subunità)
I vaccini a subunità sono costituiti da antigeni purificati dal microrganismo o dalle sue tossine inattivate, essi sono generalmente somministrati in combinazione con adiuvanti.
Nel caso in cui si utilizzino antigeni polisaccaridici, risposte anticorpali ad affinità elevata possono essere indotte coniugando i polisaccaridi ad opportune proteine, andando a costituire i cosiddetti “vaccini coniugati” che risultano efficaci grazie alla cooperazione tra cellule B e T.
Nel caso di antigeni proteici, questi stimolano sia una risposta T che anticorpale, ma non sono in grado di indurre una risposta CTL, perché i peptidi esogeni non entrano nella via di presentazione dell’antigene e non vengono quindi riconosciuti dai linfociti T CD8+
. Questo tipo di vaccini è impiegato con grande successo nella prevenzione delle malattie provocate da tossine batteriche ma non viene generalmente applicato nello sviluppo di vaccini contro i virus.
3.4.3 Vaccini Sintetici
Una delle applicazioni più promettenti della tecnologia del DNA ricombinante è l’identificazione degli antigeni maggiormente immunogenici e la loro riproduzione in laboratorio per essere utilizzati come vaccini. Non essendo presente il virus intero, non esiste il rischio di una possibile infezione.
La prima subunità vaccinica con cui si è avuto successo (approvata nel 1986) è quella prodotta contro HBV, virus che infetta il fegato producendo alterazioni che, in qualche caso, possono evolvere in cancro. La particella virale è ricoperta di un antigene di superficie, l’HBsAg, che si ritrova in forma polimerica nel sangue dei pazienti infetti.
Gli aggregati di questa proteina sono stati sfruttati come vaccini dapprima purificandoli direttamente dal sangue di soggetti malati, tuttavia questo comportava grossi rischi di infezione e una limitata disponibilità di plasma umano infetto.
Successivamente il gene codificante per l’HBsAg è stato clonato ed espresso in vari sistemi, tra i quali E. Coli, Saccharomyces cerevisiae e linee cellulari di mammifero.
3.4.4 Vaccini a DNA
L’immunizzazione con DNA purificato è un recente ed efficace metodo per indurre una risposta immunitaria protettiva. Il gene codificante per l’antigene di interesse viene clonato in un plasmide che viene poi introdotto nell’ospite, qui il plasmide viene espresso ed è quindi in grado di indurre sia una risposta umorale che cellulo-mediata (Kutzler and Weiner 2008). Questa tecnologia permette di ottenere una risposta contro tutti quegli antigeni che sono codificati da DNA, quindi tutte le proteine, ma non contro i carboidrati. L’immunizzazione con il DNA permette la presentazione dell’antigene al sistema immunitario dell’ospite in una forma naturale, simile a quella ottenibile con i vaccini vivi attenuati.
La via di somministrazione più efficace è il bombardamento con particelle rivestite con il DNA, altre vie sono quella intramuscolare ed intradermica. In seguito all’introduzione del DNA, l’efficacia di trasfezione delle cellule dell’ospite è bassa, ma è solitamente sufficiente ad indurre una risposta immunitaria.
Il DNA permane nelle cellule trasfettate in una forma episomiale, in questa conformazione questo può essere eliminato, ma i plasmidi che permangono permettono una espressione residua che può essere rilevata anche per un lungo periodo.
Nei modelli animali, la vaccinazione a DNA ha mostrato indurre buoni livelli di protezione contro il virus influenzale (Drape, Macklin et al. 2006), herpes (Cattamanchi, Posavad et al. 2008), virus dell’epatite B (Mancini-Bourgine, Fontaine et al. 2006) e virus West Nile (Martin, Pierson et al. 2007).
I vaccini a DNA permettono anche una modulazione della risposta immunitaria a seconda della via di somministrazione, dell’aggiunta al plasmide di sequenze immunostimulatorie e della co-somministrazione di geni per le citochine.
Questa tipologia di vaccini, essendo alquanto innovativa, necessita di ulteriori approfondimenti anche per quanto riguarda la tematica della sicurezza (Liu, Wahren et al. 2006).
3.4.5 Vettori Virali
I virus, grazie alla loro co-evoluzione con l’ospite, hanno evoluto delle strutture e dei meccanismi altamente efficienti per infettare le cellule ed utilizzare il macchinario cellulare per la produzione di proteine virali necessarie per la sua replicazione e diffusione. Proprio per questo motivo i virus sono veicoli naturali per il trasporto di geni eterologhi che possono essere riconosciuti dal sistema immunitario e possono efficacemente attivarlo. Sebbene non tutti i virus si leghino e infettino le cellule presentanti l’antigene (APC), questo non è un prerequisito fondamentale per lo sviluppo di un vettore efficace per la immunoterapia, infatti la risposta umorale può essere indotta anche senza la necessità della presentazione dell’antigene da parte di una APC, inoltre un ruolo fondamentale è giocato dal meccanismo di cross-presentazione dell’antigene; questo meccanismo si attua quando un antigene viene trasferito da una cellula che lo esprime ad una APC professionale per generare una risposta MHC-I ristretta da parte dei CTL.
Negli ultimi anni sono stati sviluppati numerosi vettori che trasferiscono ed esprimono efficacemente il transgene per l’immunizzazione.
La costruzione del vettore risulta di fondamentale importanza per l’immunogenicità del vaccino risultante, tra i fattori modulabili per incrementare ulteriormente l’efficienza sono importanti da menzionare la via di somministrazione, la dose ed il numero e la tempistica delle immunizzazioni.
Per generare un vettore, le sequenze dei geni codificanti e le sequenze cis-agenti sono separate in vettori distinti in modo da prevenire il ricostituirsi di particelle virali produttive in seguito a ricombinazione. I geni virali possono essere espressi da plasmidi eterologhi, o, addirittura, essere incorporati nella cromatina di cellule produttrici in modo da stabilizzare la produttività e allo stesso tempo limitare la mobilitazione. Le sequenze virali cis-agenti connesse all’immunogeno possono essere introdotte nelle stesse cellule portando così alla