Alcoli e Fenoli
H H H
m
= 1.7 Dm
= 1.9 D H H C O H H C Cl d+ d– d+ d– d+Momenti Dipolari
m
= 1.7 Dm
= 1.9 Dd + d –
d – d +
d + d – d + d – d + d –
Forze di attrazione
dipolo-dipolo
d + d –
d – d +
d + d – d + d – d + d –
Forze di attrazione
dipolo-dipolo
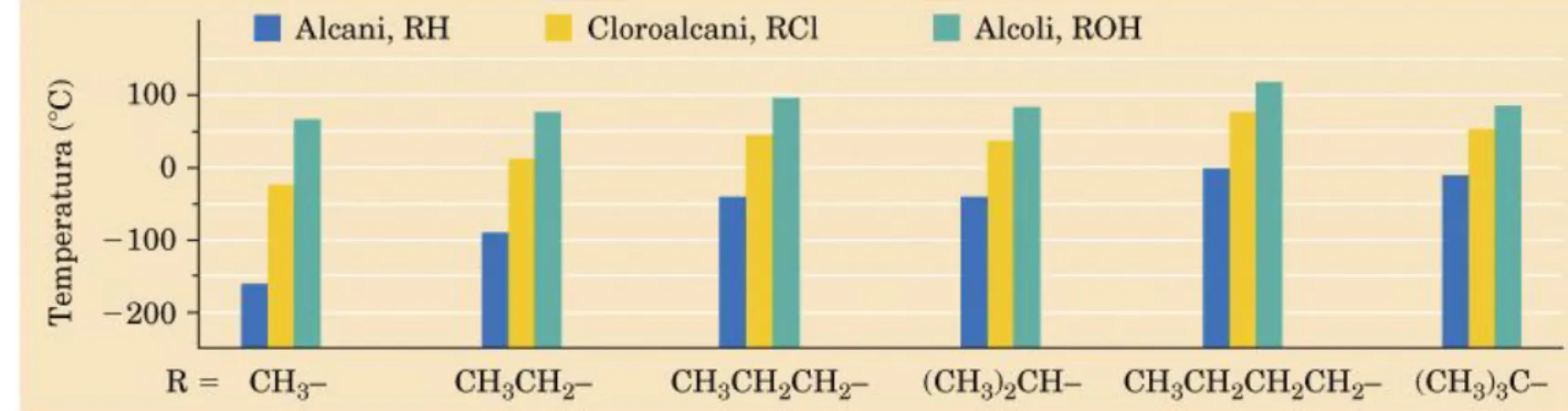
Figura 17.1 Confronto dei punti di ebollizione di alcuni alcani, cloroalcani ed alcoli. Gli alcoli mostrano generalmente i punti di ebollizione più alti.
•
Punti di ebollizione
•
Solubilità in acqua
•
Densità
d+ d–
d–
d+
Figura 17.2 Il legame a idrogeno negli alcoli e nei fenoli. Le molecole sono tenute unite da una debole attrazione che si instaura tra un idrogeno polarizzato positivamente di un gruppo OH e l’ossigeno polarizzato negativamente di un altro gruppo OH.
La mappa di potenziale elettrostatico del metanolo mostra
chiaramente l’idrogeno del legame OXH polarizzato positivamente (zona blu) e l’ossigeno polarizzato negativamente (zona rossa).
•
44
48
46
•
-42
-32
+78
•
0
1.9
1.7
CH3CH2CH3 CH3CH2F CH3CH2OH Peso Molecolare Punto di ebollizione, °C Momento dipolare, D
Effetto della Struttura sul
Punto di Ebollizione
•
44
•
-42
•
0
CH3CH2CH3 Peso Molecolare Punto di ebollizione, °C Momento dipolare, D Le forze intermolecolari sono deboli Le uniche forze intermolecolari derivano dalle attrazioni dipoloindotto-dipolo indotto (Van der Walls)
Effetto della Struttura sul
Punto di Ebollizione
•
48
•
-32
•
1.9
CH3CH2F Peso Molecolare Punto di ebollizione, °C Momento dipolare, DUna molecola polare:
sia le forze dipolo-dipolo sia quelle dipolo-dipolo indotto contribuiscono alle attrazioni
intermolecolari
Effetto della Struttura sul
Punto di Ebollizione
•
46
•
+78
•
1.7
CH3CH2OH Peso Molecolare Punto di ebollizione, °C Momento dipolare, D
Il punto di ebollizione più elevato indica forze di
attrazione intermolecolare più intense: legame
d’idrogeno
Il legamo d’idrogeno è più intenso di qualunque
attrazione dipolo-dipolo
Effetto della Struttura sul
Punto di Ebollizione
Acidità degli Alcoli ROH ka = 10-18 ROH + OH- RO- + H 2O Ka 10-18 Ka 10-16 ROH + NH2- RO- + NH 3 Ka 10-18 Ka 10-33
Effetti elettronici che stabilizzano la base coniugata dell’alcol
(CH3)3COH (CF3)3COH
Metodi di sintesi degli alcoli
CH2 CH2 H+
Altri metodi di sintesi degli alcoli: riduzione dei carbonili
Altri metodi di sintesi degli alcoli: riduzione dei carbonili
Altri metodi di sintesi degli alcoli: riduzione dei composti acilici
Sintesi degli alcoli mediante l’impiego dei reattivi di Grignard
Figura 17.5 MECCANISMO:
Disidratazione acido-catalizzata di un alcol per formare un alchene. Il processo coinvolto è una reazione di tipo E1 e prevede l’intervento di un carbocatione intermedio.
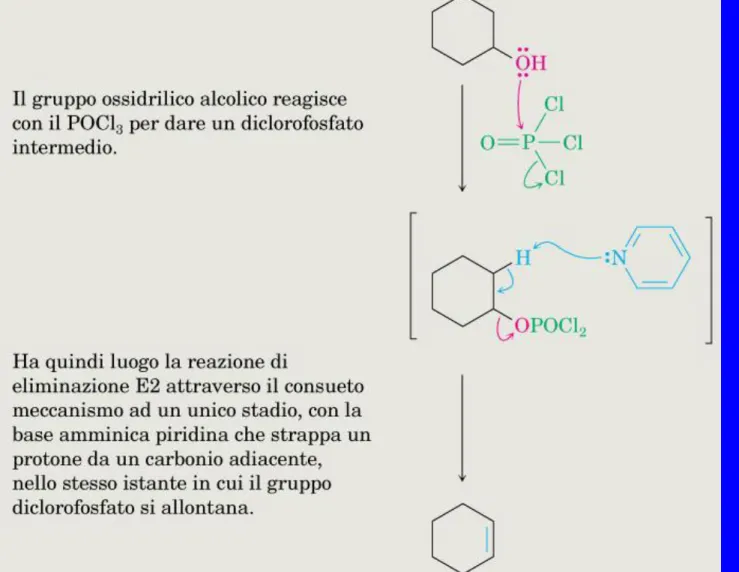
Figura 17.6 MECCANISMO:
La reazione di disidratazione di alcoli secondari e terziari con POCl3 in piridina. La reazione procede secondo un processo E2.
R-CH2OH H-Cl
SOCl2
Sintesi degli alogenuri alchilici dagli alcoli
R-CH2-Cl
Figura 17.7 MECCANISMO:
La reazione di un alcol terziario con HCl per dare un cloruro alchilico terziario. Inizialmente l’alcol viene protonato a dare uno ione ossonio che dà luogo ad una reazione di tipo SN1.
Trasformazioni di alcoli in alogenuri alchilici (alcoli primari e secondari) Meccanismo SN2
Metodi di sintesi dei fenoli
Reazioni di sostituzione nucleofila aromatica
Metodi di sintesi dei fenoli Reazioni di sostituzione nucleofila aromatica
Metodi di sintesi dei fenoli
Acidità dei Fenoli
•
La proprietà più caratteristica dei
fenoli è la loro acidità
Acidità dei fenoli: paragone con alcooli alifatici
O H • • •• Ka = 10-10 + H + O • • •• • • – CH3CH2O •• H •• Ka = 10-18 + H + CH3CH2O •• •• – • •
O
•
• •• • •
–
CH3CH2O-
Per spiegare la diversa acidità è opportuno riportare il discorso sulle basi coniugate
lo ione alcossido non presenta alcun tipo di stabilizzazione
Delocalizzazione della carica negativa nello ione fenossido
• • O •• H H H H H • • –
• • O •• H H H H H • • – • • O •• H H H H H – ••
Delocalizzazione della carica negativa nello ione fenossido
Delocalizzazione della carica negativa nello ione fenossido
• • O •• H H H H H – ••
• • O •• H H H H H – •• • • O •• H H H H H – ••
Delocalizzazione della carica negativa nello ione fenossido
• • O •• H H H H H – ••
Delocalizzazione della carica negativa nello ione fenossido
• • O •• H H H H H – •• • • O •• H H H H H – ••
Delocalizzazione della carica negativa nello ione fenossido
I Fenoli sono convertiti in ioni fenossidi in ambiente acquoso basico
O H
•
• •• • • O •• • • –
+ HO – + H2O
Acido più forte Acido più
Effetti dei Sostituenti
sull’ Acidità dei Fenoli
I gruppi a rilascio elettronico hanno l’effetto di deprimere l’acidità
OH
CH3
OH OH
OCH3
I gruppi ad attrazione elettronica aumentano l’acidità OH Cl OH OH NO2 Ka: 1 x 10-10 4 x 10-9 7 x 10-8
L’effetto dei gruppi ad attrazione elettronica è più pronunciato nelle posizioni orto e para
OH NO2 OH NO2 OH NO2 Ka: 6 x 10-8 4 x 10-9 7 x 10-8
L’effetto dei gruppi a forte attrazione elettronica è cumulativo OH NO2 OH NO2 NO2 OH NO2 NO2 O2N Ka: 7 x 10-8 1 x 10-4 4 x 10-1
Strutture di Risonanza • • O •• N H H H H • • O O • • •• •• •• • • •• + – – • • O •• N H H H H • • – O O • • •• •• •• • • + –
Effetto dei sostituenti sull’acidità del fenolo
Struttura dovuta alla
presenza del gruppo nitro Struttura di kekule
Ossidazione dei fenoli a chinoni e reazioni redox
Gli esempi più comuni di ossidazioni dei fenoli sono le ossidazioni degli 1,2- e 1,4-benzenedioli che danno i chinoni.
(76-81%)
Chinoni OH OH O O Na2Cr2O7, H2SO4 H2OAlizarina
(pigmento rosso)
Alcuni chinoni sono coloranti
O
O
OH OH
Ubichinone (Coenzima Q)
n = 6-10
è coinvolto nel trasporto elettronico nei sistemi biologici
Alcuni chinoni sono importanti biomolecole
CH3O CH3O O O CH3 n
Vitamina K
(fattore di coagulazione del sangue)
Alcuni chinoni sono importanti biomolcole
O
CH3
O CH3 CH3 CH3 CH3
Ossidoriduzioni biologiche
Nel processo respiratorio gli elettroni vengono trasportati dall’NADH all’ossigeno molecolare, con riduzione dell’ossigeno ad acqua e Liberazione di energia