Dottorato di Ricerca
Malattie Infettive, Microbiologia e Sanità Pubblica
Curriculum: Scienze della salute e Medicina Sociale
Dipartimento di Sanità Pubblica e Malattie Infettive (Coordinatore: Prof. Stefano D’Amelio)
Tesi
”Studio della prevalenza della sensibilizzazione
ad Anisakis in soggetti professionalmente esposti”
Tutor: Candidato: Prof. Stefano D’Amelio Dott.ssa Antonella Costa
Anno Accademico 2018/2019 XXXII CICLO
1
SOMMARIO
1. INTRODUZIONE………2
1.1 L’ agente biologico………5
1.2 Ciclo vitale e specie ittiche coinvolte………7
1.3 Anisakis nell’uomo ... 10
1.4 Patogenicità ... 12
1.5 Risposta allergica nell’uomo ... 13
1.6 Allergeni di Anisakis ... 16
1.7 Diagnostica... 18
1.8 Prevenzione………...20
2. SCOPO DELLA TESI ... 23
3. MATERIALI E METODI ... 24
3.1 Soggetti ... 24
3.2 Allergeni ... 25
3.3 Fasi di preparazione degli allergeni ... 26
3.3.1 Ricerca delle larve della famiglia Anisakidae ... 26
3.3.2 Identificazione morfologica ... 26
3.3.3 Identificazione molecolare ... 27
3.3.4 Estrazione allergeni ... 28
3.4 Skin Prick Test (SPT) ... 29
3.5 ImmunoCAP ... 29
3.6 Immunoblotting ... 31
3.6.1 Elettroforesi su gel di poliacrilammide..………...31
3.6.2 Trasferimento delle proteine dal gel alla membrana di nitrocellulosa ...32
3.6.3 Incubazione con i sieri e rivelazione degli anticorpi ………...32
3.6.4 Raccolta ed elaborazione dei risultati ………...33
3.7 Test di attivazione dei basofili (BAT) ... 33
3.8 Analisi statistica ... 35 4. RISULTATI ... 36 5. DISCUSSIONE E CONCLUSIONI ... 45 6. BIBLIOGRAFIA ... 50 7. RINGRAZIAMENTI ... 60 ALLEGATO 1 ... 61
2 1. INTRODUZIONE
L’anisakiasi è una malattia parassitaria trasmessa da prodotti ittici marini infestati da forme larvali di nematodi del genere Anisakis. L’uomo rappresenta un ospite accidentale nel ciclo del parassita, in seguito al consumo di prodotti ittici (pesci, molluschi cefalopodi) crudi o poco cotti, infestati da larve vive al 3° stadio (L3). Oltre alle alterazioni che le L3 possono causare nell’apparato gastroenterico, le larve di Anisakis sono state negli ultimi anni ritenute responsabili di forme allergiche, di frequente associate ad alti livelli di IgE (IgE As) (Audicana e Kennedy, 2008).
Sulla problematica “allergie e Anisakis” è aumentato notevolmente l’interesse della comunità scientifica con la pubblicazione di numerosi lavori, reperibili in bibliografia, indicando come l’ipersensibilità ad Anisakis (As) rappresenti un problema sanitario diffuso a livello mondiale.
L’ EFSA riconosce il nematode Anisakis simplex come l’unico parassita dei prodotti ittici in grado di provocare reazioni allergiche e l'infezione da larve vive e vitali viene indicata come il prerequisito per lo sviluppo, dopo un secondo contatto con il parassita o con i suoi prodotti, delle varie forme di allergia; l’EFSA nel contempo raccomanda di procedere a studi coordinati in questo settore (EFSA Journal, 2010). Recenti evidenze suggeriscono infatti che le forme larvali, anche non vitali, appartenenti al genere Anisakis, svolgano un ruolo emergente in termini di rischio e sicurezza alimentare, in particolare essendo fonte di allergeni di elevato potere biologico. Reazioni allergiche di tipo I (ipersensibilità) agli antigeni di Anisakis sono riportate in un crescente numero di soggetti, in seguito a consumo di prodotti ittici cotti o congelati o, anche, in seguito a contatto o inalazione (Baird et al., 2014; Daschner et al., 2012; Heffler et al., 2016). Lavori da vari Paesi descrivono pazienti con malattia acuta o cronica dovuta ad Anisakis simplex (Buendia 1997; Akbar e Ghosh, 2005). I sintomi allergici, che vanno dall'orticaria lieve allo shock anafilattico, sono dovuti alla presenza di anticorpi specifici, immunoglobuline E (IgE), che costituiscono un componente importante della risposta immunitaria al parassita (Del Pozo et al., 1999; Daschner et al., 2000).
La diagnosi corrente di anisakiasi allergica si basa sulla storia clinica (anamnesi suggestiva di reazione allergica dopo il consumo di pesce crudo, escludendo l’allergia al pesce), sulla positività al skin prick test (SPT) in vivo e sulla presenza di IgE specifiche nel siero del paziente IgE As mediante ELISA, o ImmunoCAP fluorimetrico. Inoltre, è possibile l’identificazione degli allergeni del parassita utilizzando l’immunoblotting (o western blot), metodo considerato più specifico (Lorenzo et al., 2000; Garcia et al., 1997;
3 Del Pozo et al., 1996). SPT e dosaggio di IgE As vengono considerati test di primo livello o di screening, e ritenuti altamente sensibili (Lorenzo et al., 2000). Diversi allergeni di Anisakis sono stati caratterizzati e, tra questi, l'uso di allergeni presenti nei prodotti di escrezione/secrezione per la diagnosi clinica permette di aumentare la sensibilità e la specificità diagnostica (Baeza et al., 2001; Moneo e Caballero, 2002). L’interpretazione dei test di screening è però complicata dalla cross reattività degli allergeni di Anisakis con numerosi panallergeni parassitari, in particolare la tropomiosina (Anis s 3), che è simile a quella presente nei nematodi ascaridi, nel gambero e negli acari della polvere (specie appartenenti al genere Dermatophagoides), la paramiosina (Ani s 2) presente in altri invertebrati, compresi i crostacei e gli acari della polvere (specie appartenenti al genere Blomia (Audicana et al., 2002) e le proteine della famiglia SXP/RAL, che sono simili a quelle presenti in altri nematodi: per queste motivazioni l’interpretazione dei test sierologici può risultare spesso difficoltosa dovuta alla presenza di fasi positivi (Garcia et al., 1997; Lorenzo et al., 2000).
Spesso, questa diagnosi errata può portare ad un susseguirsi di inutili test diagnostici con costi sanitari significativi (Miles et al., 2005).
Reazioni allergiche agli anisakidi sono state scambiate in passato per altre patologie quali l'orticaria acuta o l' “allergia al pesce” (Kasuja et al., 1990).
È interessante notare che alti livelli di IgE specifiche per gli allergeni di Anisakis sono stati rilevati anche in soggetti sani senza sintomi allergici (Abattouy et al., 2012). Alcuni studi riportano IgE specifiche per Anisakis nel 16 - 22% dei donatori di sangue (Del Rey Moreno et al., 2006; Del Pozo et al., 1996) e positività al SPT e/o IgE As specifiche nel 24% circa di soggetti con orticaria acuta, sebbene Anisakis fosse la vera causa scatenante solo nel 33% dei casi (Del Pozo et al., 1997).
Il gold standard per le allergie alimentari è il challenge test con gli allergeni alimentari, ma per ragioni etiche non è possibile consentire l'esecuzione di questo test in caso di sospetto di allergia ad Anisakis (Sastre et al., 2000; Lluch-Bernal et al., 2002).
Il Basophil Activation Test (BAT) mediante citofluorimetria a flusso, è stato proposto come strumento affidabile per l'allergia ad Anisakis, come test di terzo livello ad integrazione di procedure standardizzate di screening (Frezzolini et al., 2010; Gonzalez-Muñoz et al., 2005; Brusca et al., 2015). L’alta specificità clinica del BAT per la diagnosi di allergia ad Anisakis è stata recentemente studiata, suggerendo l’implementazione di un algoritmo diagnostico in pazienti con anamnesi suggestiva di reazione allergica al parassita (Brusca et al., 2019).
4 Il fenomeno allergico richiede in genere contatti frequenti e ripetuti per cui si ritiene che l’esposizione professionale, in particolari categorie di soggetti, possa costituire un rischio per lo sviluppo di ipersensibilità ad Anisakis. In generale, l’importanza della malattia infatti non è soltanto dovuta all’iniziale manifestazione ma alla sensibilizzazione agli allergeni Anisakis con il rischio di una esacerbazione allergica a seguito successiva esposizione (Nieuwenhuizen et al., 2006).
Con la globalizzazione dell’industria dei prodotti ittici, il rischio di acquisire anisakiasi in determinati contesti, caratterizzati da una forte vocazione per la pesca, un elevato consumo di pesce, una diffusa presenza di industrie dedite alla conservazione, allevamento e distribuzione del prodotti ittici o derivati, può essere sottostimato.
L'impatto significativo della sensibilizzazione ad Anisakis nella popolazione generale e in specifiche categorie professionali è stato sottolineato da numerosi studi, in particolare quelli con maggiore dimensione del campione, tenuti in Giappone, Spagna e Italia, documentando come Anisakis si configuri come una delle principali cause di allergie alimentari più frequentemente del pesce stesso (Mazzucco et al., 2012; Kimura et al., 1999; AAITO-IFIACI 2011).
Una recente review sulla sensibilizzazione ad Anisakis, che valuta 41 studi da diversi Paesi in differenti categorie di soggetti, documenta, nella popolazione asintomatica generale, lo 0,4-27,4% dei casi mediante rilevazione indiretta di IgE ELISA o ImmunoCAP e tra il 6,6% e il 19,6% dei campioni mediante SPT mentre pazienti allergici sintomatici con qualsiasi tipo di allergene vengono riportati positivi alla rilevazione di IgE specifiche di Anisakis tra lo 0,0% e l'81,3% tra gli adulti con allergia ai crostacei (Mazzucco et al., 2018). Uno studio effettuato in Sicilia, l'isola più grande del Mar Mediterraneo, riporta, in pazienti ambulatoriali con sintomi allergici, una prevalenza della sensibilizzazione ad A. simplex con SPT del 15,4% (Heffler et al., 2016).
Alcuni lavori riportano ipersensibilità verso As in soggetti professionalmente esposti, con episodi di asma e orticaria, quali addetti alla manipolazione, lavorazione ed alla vendita del pesce o derivati, pescatori, potendosi configurare una vera e propria “patologia occupazionale” (Armentia et al., 1998; Mazzucco et al., 2012). La sensibilizzazione ad Anisakis è stata infatti correlata non solo con ingestione di pesce parassitato, ma anche tra i lavoratori la cui occupazione consisteva nella manipolazione frequente di pesce crudo o farina di pesce (Mazzucco et al., 2012), compresi anche cuochi e addetti alla ristorazione (Armentia et al., 1998; Scala et al, 2001; Barbuzza et al., 2009).
5 nelle tecniche diagnostiche (lavori basati soltanto su SPT e/o su dosaggio IgE) e nelle caratteristiche delle popolazioni arruolate che hanno portato a risultati contrastanti tra le varie aree geografiche.
In particolare, tre lavori riportano dati di prevalenza sulla sensibilizzazione ad Anisakis su soggetti professionalmente esposti: solo con SPT (Nieuwenhuizen et al., 2006), con SPT e RAST (Purello-D’Ambrosio et al., 2000) e con UniCAP (Mazzucco et al.,2012) (Fig 1).
Figura 1. Riferimento bibliografico, caratteristiche, numero dei campioni ed esiti in soggetti professionalmente esposti (Mazzucco et al, 2018)
L'accurata valutazione della prevalenza di sensibilizzazione ad Anisakis svolge un ruolo fondamentale per sviluppare servizi sanitari e iniziative pubbliche in base alle esigenze della popolazione, in particolare al fine di pianificare la sorveglianza delle malattie, garantire risorse sufficienti per far fronte all'onere della malattia e valutare le tendenze nel tempo (Nieuwenhuizen et al., 2014).
1.1 L’agente biologico
Anisakis spp appartiene alla sottofamiglia Anisakinae, famiglia Anisakidae, superfamiglia Ascaridoidea, ordine Ascarida (Smith e Wootten, 1987). Alla sottofamiglia Anisakinae, appartengono anche i generi Pseudoterranova, Contracaecum e Phocascaris.
La tassonomia dei nematodi appartenenti alla famiglia Anisakidae è basata principalmente sui caratteri morfologici degli esemplari adulti maschi (sistema escretore, tratto alimentare, numero e distribuzione delle papille caudali, lunghezza delle spicole)
6 (Mattiucci e Nascetti, 2008; Mattiucci e D’Amelio, 2014); gli stadi larvali possono essere identificati al microscopio ottico solo a livello di genere, principalmente sulla base della morfologia del tratto digestivo.
L’ identificazione a livello di genere delle larve di Anisakis spp. si basa sulle caratteristiche morfologiche, osservabili al microscopio ottico, quali la lunghezza del ventricolo e la presenza/assenza del mucrone all’estremità caudale: in base a queste differenze sono state descritte larve di Tipo I e di Tipo II (sensu Berland 1961).
L’applicazione della multilocus allozyme electrophoresis (MAE) e l’introduzione successiva delle metodiche biomolecolari (PCR) hanno permesso l’identificazione di specie sia degli adulti che delle forme larvali: la PCR-RFLP del rDNA (D’Amelio et al., 2000; Pontes et al., 2005), il sequenziamento genico della regione ITS del rDNA (Nadler et al., 2005) e mitocondriale (mtDNA cox2) (Nadler et al., 2005; Valentini et al., 2006) hanno dimostrato che il genere Anisakis comprende nove distinte specie, Anisakis simplex s.s. (sensu stricto), A. pegreffii e A. berlandi (=A. simplex C) incluse nel complesso A. simplex s.l. (sensu lato), A. ziphidarum, A. nascettii (= Anisakis sp); A. physeteris, A. brevispiculata, e A. paggiae ed infine A. typica (Mattiucci e D’Amelio, 2014). Studi genetici hanno dimostrato l’esistenza di due clades principali (Clade I e Clade II) nel genere Anisakis: il primo Clade comprende un subclade formato dalle specie A. simplex s.s., A. pegreffii, A. berlandi e un secondo da A. ziphidarum e A. nascettii, Clade morfologicamente riferibile allo stadio larvale indicato come Anisakis Tipo I (sensu Berland, 1961); il Clade II comprende le specie A. physeteris, A. brevispiculata e A. paggiae che condivide la morfologia larvale Anisakis Tipo II (sensu Berland, 1961); la specie A. typica formerebbe una distinta linea filogenetica rispetto alle altre specie (Cavallero et al., 2011; Mattiucci e D’Amelio, 2014).
Delle 9 specie geneticamente caratterizzate, solo 2- A. simplex s.s. e A. pegreffii- sono state identificate come causa di infezioni umane, riconoscendole il ruolo zoonotico (D’Amelio et al., 2000; Mattiucci et al., 2013; Umehara et al., 2007).
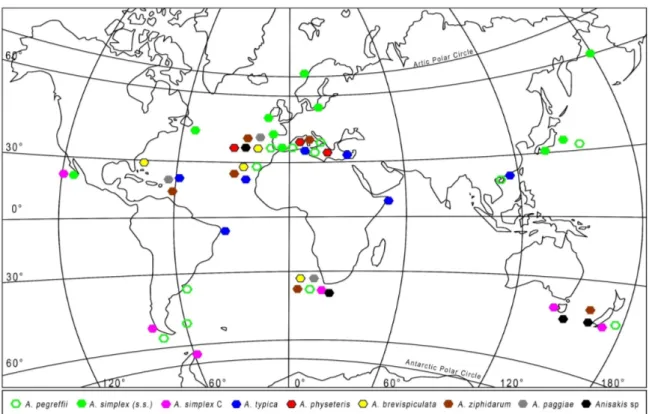
Il genere Anisakis è stato trovato in tutto il mondo, e le 9 specie conosciute si distribuiscono diversamente a livello geografico (Mattiucci e Nascetti, 2008) (Fig 2). Riguardo le due specie di Anisakis riportate in casi umani, A. simplex s.s è presente principalmente nel Nord dell’ Atlantico e del Pacifico fra il 35°N ed il circolo Artico, mentre A. pegreffii è prevalentemente presente nel Mar Mediterraneo (Mattiucci e Nascetti, 2008).
7
Figura 2 : Distribuzione geografica di Anisakis spp. (Mattiucci e Nascetti, 2008 modificata)
1.2 Ciclo vitale e specie ittiche coinvolte
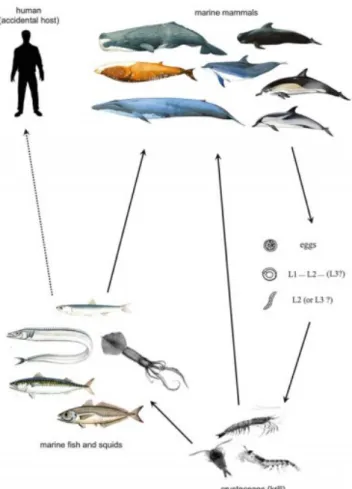
Le forme adulte del genere Anisakis vivono nello stomaco di mammiferi marini (ospiti definitivi), principalmente cetacei (balene, delfini) per il genere Anisakis. Le uova vengono rilasciate in mare attraverso le feci. La prima muta da L1 a L2 avviene dentro l'uovo, le larve allo stadio L2 o L3 vengono ingerite da piccoli crostacei come il krill, che rappresentano i primi ospiti intermedi (Smith e Wootten, 1987; Audicana et al., 2002). I crostacei a loro volta sono mangiati da pesci o cefalopodi che rappresentano ospiti paratenici. All'interno di questi ospiti le larve si trovano allo stadio larvale L3 libere o incapsulate nella cavità viscerale e/o sulle superfici di organi o muscoli. I pesci e i cefalopodi parassitati dalle larve L3 possono causare l’anisakiasi quando consumati dall’uomo crudi o sottoposti a trattamenti non in grado di devitalizzare le larve (Sakanari e McKerrow, 1989). Gli esseri umani rappresentano pertanto un ''ospite accidentale '' nel quale le larve non possono completare il loro ciclo vitale (Davey, 1971; Sohn e Chai 2005; Torres et al., 2007). Nel ciclo naturale, i nematodi che allo stadio L3 si trovano nei pesci o nei cefalopodi, sono ingeriti dai cetacei dove mutano nello stadio L4 e poi in adulti. Nello stomaco dei cetacei i nematodi anisakidi adulti sono fecondati e depongono le uova, completando il ciclo (Fig 3).
8
Figura 3. Ciclo vitale di Anisakis spp. (Mattiucci e D’Amelio, 2014)
L’infestazione nei mammiferi marini per il genere Anisakis è nota da tempo. Il primo studioso ad interessarsi di questi nematodi fu l’elmintologo francese Felix Dujardin che nel 1845 ne coniò il nome Anisakis dal greco anisos=diseguale e akis=punta (Dujardin, 1845).
Le larve L3 di Anisakis spp possono albergare nella cavità viscerale di diverse specie di pesci a livello mondiale: sono state rilevate in Gadiformi, Perciformi, Clupeiformi, Pleuronectiformi, Scorpaeniformi, Zeiformi, Bericiformi, Lophiiformi, Anguilliformi e Atheriniformi e in molluschi cefalopodi in particolare in Ommastrephidae; raramente in Elasmobranchi (Mattiucci e D’Amelio, 2014). Diverse specie ittiche pelagiche e demersali mostrano un aumento nella prevalenza e abbondanza di larve di Anisakis con l’età e la taglia (Mattiucci e Nascetti, 2008; Levsen and Lunestand, 2010). Nel pesce parassitato, le larve si presentano libere o incapsulate in forma di spirali appiattite, circa 4-5 mm situate sopra o all’interno degli organi viscerali, nel mesentere e nel peritoneo. Alcune specie di pesce possono accumulare centinaia di larve durante la loro vita (Fig 4).
9
Figura 4. Visceri di pesce sciabola manifestatamente infestato da Anisakis
Studi condotti sulla presenza di larve di Anisakis in diverse specie ittiche del Mediterraneo, hanno riportato alte prevalenze di infestazione in pesce sciabola (Lepidopus caudatus) (100%), nel suro (Trachurus trachurus) (95%), nel melù (Micromesistius poutassou (95%), nel lanzardo (Scomber japonicus) (75%), nello sgombro (Scomber scombrus) (71%), nel nasello (Merluccius merluccius) (40%); nelle alici e nelle sardina rispettivamente il 17% ed l’1% ; sono state osservate in 31 specie prevalenze dal 1.3 al 100% e un’intensità di infestazione da 1 a oltre 300 larve per esemplare (Pozio, 2005). Cammilleri et al , 2019 riportano in Lepidopus caudatus una prevalenza di infestazione da Anisakis del 100%, seguita da Trachurus trachurus (83.3%) e da Scomber scombrus (68.8%); in Engraulis encrasicolus (alici) e in Sardina pilchardus (sardine) rispettivamente il 12.4% ed il 4.5%. La specie con maggior numero di larve è risultata Lepidopus caudatus con un’intensità media (mI)di 157 (Fig 5).
Figura 5. Prevalenza di infestazione (P%) e intensità media (mI) in specie ittiche (Cammilleri et al, 2019)
10 Nel pesce, come anche nei cefalopodi, la localizzazione viscerale delle larve di Anisakis è nettamente prevalente rispetto a quella muscolare: tuttavia è possibile che un numero limitato di larve possa migrare intra-vitam dalla cavità addominale e penetrare nella muscolatura dorsale del pesce ospite; tale migrazione in generale inizia già dopo le prime ore di morte del pesce e viene facilitata da ritardata, insufficiente o discontinua refrigerazione (EFSA, 2010; Pozio, 2005)
1.3 Anisakis nell’uomo
L’anisakidosi è una parassitosi alimentare causata dall’ ingestione accidentale di larve vive di nematodi anisakidi, in particolare del genere Anisakis, meno frequentemente del genere Pseudoterranova, ancor più raramente dal genere Contracaecum. Con il termine anisakiasi si intende l’infestazione causata da larve anisakidi appartenenti al genere Anisakis, per pseudoterranoviasi si intende l’infestazione da specie appartenenti al genere Pseudoterranova.
Il primo caso d’infezione da parte di un membro della famiglia Anisakidae fu segnalato più di 50 anni fa in Olanda. Van Thiel notò infatti la presenza del nematode marino nelle feci di un paziente affetto da dolori addominali acuti. Successivamente il nematode venne identificato come Anisakis e associato alla parassitosi umana (Van Thiel, 1962).
Il paese con la più alta prevalenza di casi di anisakiasi è il Giappone. Sushi e sashimi infestati sono una fonte significativa di infezione umana, annualmente sono riportati dai 2000 ai 3000 casi (Yorimitsu et al., 2013). In Italia, in particolare in alcune regioni il pesce marinato o crudo è una tradizione culinaria, l'incidenza effettiva di anisakiasi nell’uomo è probabilmente sottostimata considerando l’elevata prevalenza di pesci parassitati nel Mediterraneo (Pasolini et al., 2004). La globalizzazione della cucina, lo sviluppo di migliori strumenti diagnostici e una maggiore consapevolezza ha portato negli ultimi anni ad una più frequente segnalazione di anisakiasi in diversi paesi come Corea, Australia, Cina, Croazia e Stati Uniti d'America (Arizono et al., 2012; Kliks 1983). Segnalato per la prima volta nei Paesi Bassi (Van Thiel et al., 1960), l'anisakiasi è rilevante per la salute pubblica non solo nei paesi orientali come il Giappone, dove il pesce crudo è ampiamente consumato, ma ha attirato una crescente attenzione anche in altri paesi occidentali: in Europa, nel Regno Unito, Francia, Spagna e in Italia sono stati segnalati vari casi umani (Mattiucci e D’Amelio, 2014; Mladineo et al., 2016; Cavallero
11 et al., 2018). Tuttavia, la Spagna sembra avere l'incidenza più elevata di anisakiasi in Europa, e i "boquerones en vinagre" (acciughe marinate) sono riconosciuti come il principale veicolo alimentare (Bao et al., 2017). Diverse preparazioni di pesce tradizionali locali sono considerate ad alto rischio per l'anisakiasi: sushi e sashimi giapponesi, acciughe marinate spagnole e italiane, gravlax scandinavo, aringhe salate e marinate olandesi, ceviche sudamericane. Vale la pena sottolineare che la maggior parte dei casi segnalati in Sud America sono causati da Pseudoterranova spp. (Torres et al., 2007), che è stato osservato anche in Italia (Cavallero et al., 2016) e in Francia (Brunet et al., 2017). L’uomo rappresenta un ospite accidentale non permissivo del parassita Anisakis a seguito del consumo di pesci crudi o poco cotti contenenti larve vive al terzo stadio (Audicana e Kennedy, 2008). Le larve sono molto resistenti: possono resistere ai succhi gastrici per giorni. In genere la sintomatologia è provocata da una sola larva, raramente da un numero maggiore (Kagei e Isogaki, 1992).
Di solito nel giro di poche ore dopo l'ingestione, il parassita attraversa la parete intestinale e successivamente muore provocando una reazione infiammatoria acuta e transitoria con sintomi come dolori addominali, nausea, vomito e/o diarrea. La condizione a volte può mimare altri disturbi gastrointestinali come ulcera gastrica, appendicite acuta o tumori (Pozio, 2005). Poiché i sintomi dell’anisakiasi non sono specifici, la patologia è spesso erroneamente diagnosticata. La diagnosi clinica è di solito effettuata tramite endoscopia o esame radiologico; diversi saggi immunologici sono stati utilizzati per la diagnosi indiretta, compreso lo skin prick test (SPT), test di immunofluorescenza (IFI), test di immunodiffusione (IDT), saggi ELISA.
L'interpretazione dei test sierologici può essere difficile perché i sieri dei pazienti con anisakiasi condividono antigeni con altri nematodi, come detto in precedenza, e perché i sieri di individui sani possono contenere anticorpi non specifici che possono dare risultati falsi-positivi verso gli antigeni di Anisakis (EFSA 2010).
L'anisakiasi può essere classificata in gastrica (GA) e intestinale (IA) o ectopica / extra-gastrointestinale a seconda della posizione della larva; in acuto / cronico e grave / moderato dall'entità dei sintomi e in invasivo e non invasivo a seconda del comportamento larvale (Audicana et al., 2002). Alcuni pazienti possono presentare un quadro clinico, denominato anisakiasi gastroallergica (GAA), con sintomi digestivi (epigastralgia e vomito) e nel contempo reazioni allergiche IgE-mediate (Mattiucci et al., 2013). Dopo manifestazioni iniziali, l'anisakiasi può diventare cronica se la risposta immunitaria non elimina il verme e le successive sensibilizzazioni agli allergeni derivati
12 da Anisakis possono innescare un'esacerbazione allergica in seguito ad esposizione secondaria (Baird et al., 2014).
1.4 Patogenicità
Le infezioni da parassiti elmintici sono caratterizzate sia dallo sviluppo di una risposta di tipo allergica che immunomodulatoria (Falcone et al., 2006; Paterson et al., 2002). La risposta di protezione verso i nematodi intestinali è associata alla produzione di citochine di tipo Th2, conseguente aumento dei mastociti, risposta di tipo IgE ed eosinofilia, quadro tipico della reazione allergica e della risposta immune ai parassiti elmintici nei tessuti (Urban et al., 1992).
Anisakis spp. induce una forte risposta umorale e dopo un mese dall’infestazione possono essere individuate le IgG, IgM e IgA specifiche. In certi pazienti si sviluppa una risposta immune mediata da IgE specifica, responsabile dei sintomi allergici. La risposta cellulare è caratterizzata da un coinvolgimento di mastociti, basofili e linfociti, con un pattern di citochine di tipo Th2. Oltre al loro ruolo nella immunità innata, i basofili sono una fonte cellulare importante per la produzione precoce di IL-4 che influenza l’induzione della risposta Th2 (Audicana e Kennedy, 2008).
L’anisakiasi umana è peculiare in quanto questo parassita non è adattato a vivere nell’uomo e l’infezione è transitoria: più del 90% dei casi descritti sono stati causati da una singola larva (Daschner et al., 2000; Kagei e Isogaki, 1992).
Diversi studi hanno indicato che l’alterazione patologica all'interno del tratto gastrointestinale durante l'infezione da Anisakis è il risultato combinato dell'azione diretta della larva durante l'invasione del tessuto e della complessa interazione tra il sistema immunitario ospite e le sostanze contenute o rilasciate dal parassita. Al fine di invadere la mucosa gastrointestinale, il nematode allo stadio larvale L3 utilizza la distruzione meccanica dei tessuti combinata con il rilascio di potenti enzimi proteolitici che sono in grado di degradare la matrice extracellulare (Kennedy, 2000; Sakanari et al., 1990). La capacità invasiva delle larve, unitamente alla presenza di sostanze anticoagulanti nei prodotti di escrezione-secrezione (ES), spiega l'esistenza delle lesioni erosive e/o emorragiche solitamente rilevati in prossimità della lesione principale all'interno della mucosa gastrica di pazienti con anisakiasi (Namiki e Yazaki, 1989; Perteguer et al., 1996).
I prodotti metabolici rilasciati dalle larve sono importanti dal punto di vista immunologico. È stato dimostrato che taluni antigeni di ES, di superficie o componenti
13 somatiche dei parassiti non solo possono indurre risposte immunitarie, ma provocare anche altri effetti, come la degranulazione diretta dei mastociti IgE-indipendente (Kobayashi et al., 1972). Altri effetti riportati includono immunosoppressione (Raybourne et al., 1986), proprietà mutagene (Chung et al., 1996, Petithory et al., 1991), attività anticoagulante (Perteguer et al., 1996), e chemiotassi di eosinofili (Del Pozo et al., 1999, Tanaka et al., 1978) che sono in parte responsabili del danno tissutale indotto nell'ospite. Una delle caratteristiche principali delle lesioni infiammatorie locali causate dalle larve di Anisakis è la presenza di una cospicua infiltrazione eosinofila nei tessuti circostanti il parassita. Queste cellule aderiscono al nematode in presenza di anticorpi rilasciando fattori citotossici che, se apparentemente non sono in grado di danneggiare la cuticole del nematode (Deardorff et al., 1991), sono probabilmente responsabili del danno nel tessuto che circonda il parassita sia nelle infezioni acute che croniche.
1.5 Risposta allergica nell’uomo
L’allergia ad A. simplex è stata descritta per la prima volta in Giappone nel 1990 (Kasuya et al., 1990). In seguito nel 1995 fu segnalato in Spagna un caso di allergia ad A. simplex che aveva causato anafilassi (Audicana et al., 1995). I pazienti con sintomi allergici acuti dopo il consumo di pesce parassitato presentavano IgE specifiche contro questo nematode, da allora questo parassita è considerato un potenziale allergene alimentare. I segni clinici includono orticaria, rinite, bronco-costrizione, tosse e/o disturbi gastrointestinali e in alcuni casi anche severe anafilassi (Audicana e Kennedy, 2008; Hochberg e Hamer, 2010).
In generale, attualmente, si ritiene che possano essere osservate due tipologie di manifestazioni allergiche causate dalle larve anisakidi: la cosiddetta forma gastroallergica e la reazione anafilattica.
Forma gastroallergica: anisakidosi gastrica o duodenale associata a Sindrome Orticaria Angiodema (SOA): si presenta nell’11% delle forme di anisakidosi gastrica. E’ causata da antigeni ES prodotti dalle larve vive.
Reazione anafilattica: ampio spettro di manifestazioni: shock anafilattico, SOA, asma, congiuntivite, dermatite allergica da contatto. Si tratta di manifestazioni IgE mediate causate da antigeni proteici termostabili di 30-50 kDa, resistenti al calore ed al congelamento.
14 giovani e ambedue sono associate nel 30% dei casi. L'anafilassi è una sindrome pericolosa e a rapida insorgenza, caratterizzata da orticaria, angioedema, gravi sintomi respiratori e gastrointestinali, collasso e shock. E' stato rilevato che l'orticaria acuta e lo shock anafilattico sono spesso associati all’ipersensibilità IgE-mediata ad Anisakis, con la comparsa dei sintomi da pochi minuti a qualche ora dopo l’ingestione di pesce fresco crudo o poco cotto (Falcao et al., 2008; Del Pozo et al., 1997).
I primi segni di una reazione allergica di solito appaiono entro 60-120 minuti dopo l'ingestione di pesci parassitati, ma possono essere necessarie fino a sei ore (Audicana et al., 2002). E’stato inoltre riscontrato che i soggetti sensibili possono avere reazione allergiche non solo ingerendo il pesce infestato ma anche manipolandolo o respirando allergeni diffusi nell’aria. In questo caso si tratta di un rischio prevalentemente legato alla lavorazione del pesce, quindi di una malattia professionale che riguarda i lavoratori nel settore della trasformazione dei prodotti ittici (Tan et al., 2001; Scala et al., 2001). Le manifestazioni più frequenti di questa malattia professionale sono congiuntivite (Anibarro e Seoane, 1998), asma (Pulido- Marrero et al., 2000) e dermatite da contatto (Conde-Salazar et al., 2002). E’ stata rilevata un’elevata prevalenza di sensibilizzazione per A. simplex associata a dermatiti e ad iperattività bronchiale in lavoratori addetti alla trasformazione dei prodotti ittici (Nieuwenhuizen et al., 2006).
Vari stimoli attivano la risposta allergica ad Anisakis: lo stesso parassita, i prodotti ES e gli antigeni somatici rilasciati durante la morte del nematode. Una varietà di moduli effettori costituiscono la risposta allergica di difesa dell’ ospite (Fig 6).
I cheratinociti e l’iperplasia delle cellule calice (produzione di muco) migliorano le funzioni di barriera per limitare l'ingresso dei nematodi, l'alimentazione e la crescita. I macrofagi attivati possono limitare la diffusione dei parassiti e indurre la riparazione dei tessuti attraverso la deposizione di matrice extracellulare e il ripristino della barriera. Gli eosinofili possono mediare l’uccisione diretta dei nematodi, mentre eparina e proteasi rilasciate da mastociti attivati e dai basofili possono disattivare varie proteine. L'attivazione dei mastociti e dei basofili induce una restrizione vascolare per ridurre la diffusione del parassita, mentre starnuti, tosse, vomito e diarrea sono mezzi diretti di espulsione del parassita.
Centrale per l'attivazione di questi meccanismi di difesa verso Anisakis e i suoi diversi antigeni è l'attivazione di cellule linfoidi innate e Th2, che portano alla secrezione di citochine specifiche, tra cui IL-4, IL-5, IL-9 e IL-13. Queste citochine promuovono iperplasia delle cellule e la secrezione di muco, mentre IL-5 induce il reclutamento degli
15 eosinofili per la soppressione di Anisakis (Daschner et al., 2000).
L’interessante cross-talk tra questi due moduli, le cellule innate linfoidi/Th2 e i mastociti/ basofili, viene generato tramite specifiche citochine. I Th2 producono l’IL-3 che stimola la produzione di mastociti / basofili, mentre IL-9 recluta i mastociti. A sua volta i mastociti producono IL-33, e i basofili IL-4, che inducono le cellule Th2 (Nieuwenhuizen e Lopata, 2013).
Figura 6. Risposta allergica dell'ospite in seguito all’esposizione agli antigeni di Anisakis (Nieuwenhuizen e Lopata, 2013)
La risposta predominante verso gli allergeni di Anisakis è quindi Th2-mediata, con la conseguente espulsione del parassita. Le risposte immunitarie guidate dai Th2 includono la produzione di anticorpi IgE, il reclutamento di eosinofili, mastociti e dei basofili, iperplasia delle cellule calice, contrazione della muscolatura liscia e rilascio di fluido dai vasi, che favoriscono la rimozione del parassita (Audicana e Kennedy, 2008; Roongruangchai et al., 2012; Pulendran et al., 2012).
Gli individui sensibilizzati sviluppano anticorpi IgE specifici per una serie di proteine allergeniche. Questi anticorpi si legano ai recettori (FcεRI) presenti sulla superficie di una varietà di cellule, compresi mastociti nel tratto gastrointestinale e nella pelle, e basofili circolanti nel sangue. Dopo contatto con gli allergeni, l'interazione dell'anticorpo IgE con l’allergene innesca nelle cellule il rilascio di una serie di mediatori dell’infiammazione, con conseguenti segni clinici legati alla secrezione di muco, accumulo di eosinofili e rilascio di citochine e istamina.
16 1.6 Allergeni di Anisakis
I nematodi anisakidi presentano numerose strutture biologiche dotate di attività antigenica, importanti nella patologie umane. Ad oggi sono stati descritti 14 antigeni/allergeni (Mattiucci et al., 2017), ad Anisakis simplex (s.l.)- che include il complesso di specie gemelle A. simplex s.s., A. pegreffii e A. berlandi: la maggior parte di questi sono stati caratterizzati a livello molecolare e si possono dividere in tre gruppi di molecole antigeniche (Ubeira et al., 2000):
Antigeni somatici: sono gli antigeni più numerosi. Nell’elettroforesi di omogenati di Anisakis spp su gel di poliacrilammide si possono distinguere tra 30 e 40 bande con un peso molecolare compreso tra 13 e 150 kDa. Essi includono proteine coinvolte nella neoglucogenesi e nella sintesi degli acidi grassi. Alcune di queste proteine, quali l’enzima biotol-carbossilasi, mostrano cross-reattività con antigeni di Ascaris spp. (Sugane et al., 1982). Sperimentalmente è stato evidenziato un picco di anticorpi anti-antigeni somatici a 42 giorni.
Antigeni di escrezione-secrezione (ES): sono molecole proteiche di basso peso molecolare sintetizzate da due strutture del parassita, la ghiandola esofagea dorsale e le cellule secretive del tratto digestivo, che sono la più grande fonte di enzimi digestivi ad azione istolitica (con attività di proteolisi e di ialuronidasi). Queste molecole aiutano il parassita a penetrare la mucosa gastrica e ad indurre la degranulazione dei mastociti e ad esplicare attività anticoagulante. Gli anticorpi anti- Ag ES sono i primi ad essere evidenziati dopo pochi giorni dall’inizio dei sintomi (Iglesias et al., 1993). Sperimentalmente si è osservato un picco di anticorpi anti- Ag ES a 21 giorni dall’infestazione.
Questo complesso antigenico può essere ottenuto incubando le larve L3 vive in un mezzo di cultura adeguato per un periodo di tempo, nel quale gli antigeni sono secreti dalle larve (Raybourne et al., 1986; Sakanari e McKerrow, 1990). Alcuni studi hanno dimostrato che le larve di A. simplex allo stadio L3 incubate a 37°C in un mezzo acido diluito (molto simile al succo gastrico) rilasciano una notevole quantità di proteine (Moneo et al., 2002).
Antigeni di superfice: corrispondono alle molecole espresse nella cuticola del parassita, sono condivisi con altri nematodi. Questi antigeni vengono espressi quando la larva evolve dallo stadio L3 a L4. Rispetto agli antigeni somatici e Ag
17 ES, posseggono potere antigenico inferiore e possono svolgere un ruolo importante nello sviluppo di uno stimolo cronico, come nel caso della formazione dei granulomi (Baeza et al., 2001).
I pazienti possono essere esposti in primo luogo agli antigeni somatici provenienti da larve vive o morte nei prodotti ittici, molti allergeni di Anisakis infatti sono resistenti al calore e alla pepsina (Caballero e Moneo, 2004; Moneo et al., 2005, Caballero et al., 2008) e la maggior parte di loro sono stati rilevati nei prodotti di escrezione -secrezione (ES) (Shimakura et al., 2004).
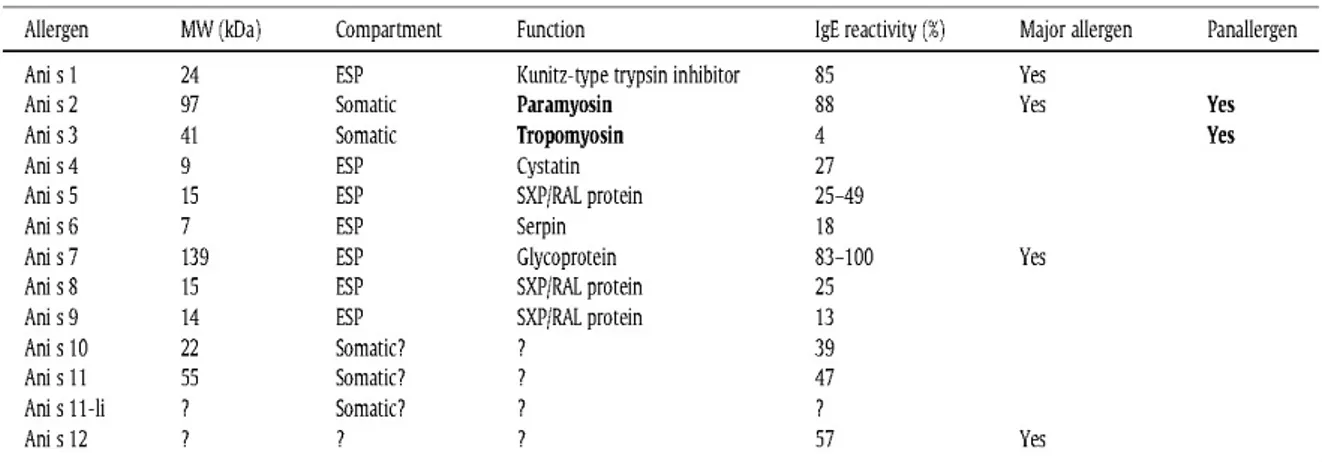
Gli allergeni Ani s 1 e Ani s 7 sono considerati i più importanti allergeni ES o allergeni maggiori di Anisakis, riportati da circa l’85% e 100% dei pazienti infetti, rispettivamente (Daschner et al., 2012). Ani s 1 di circa 24 kDa, secreto dal parassita, mostra omologia con gli inibitori delle serine proteasi di Caenorhabditis elegans. Ani s 1 è termostabile e può agire da allergene alimentare, causando reazioni cliniche a seguito di una seconda esposizione, immediatamente dopo l’ingestione di pesce anche cotto (Moneo et al., 2000). L’altro allergene maggiore Ani s 7 è anch’esso un antigene ES di circa 139 kDa ed è una glicoproteina (Anadon et al., 2009). Un altro allergene Ani s 4, una cistatina stabile al calore, che è riconosciuta dal 27% dei pazienti allergici all’Anisakis, sembra essere centrale nel provocare l’anafilassi (Rodriguez-Mahillo et al., 2007). Gli allergeni resistenti al calore, come Ani s 4, sono importanti, anche se classificati come “allergeni minori” (per la bassa frequenza di riconoscimento da parte dei sieri dei pazienti), perché questi allergeni sono correlati alle reazioni allergiche verso i prodotti ittici cotti o in scatola infestati da Anisakis (Rodriguez- Mahillo et al., 2007). Altri allergeni minori sono rappresentati da Ani s 5 (15 kDa), Ani s 8 (15 kDa), e Ani s 9 (14 kDa), appartenenti alla famiglia SXP/RAL specifica per i nematodi. Tutti questi allergeni sono prodotti ES e stabili al calore. L’allergene minore Ani s 6 (7 kDa), è omologo agli inibitori delle serine proteasi dell’Apis mellifera Api m 6. Gli allergeni descritti come Ani s 2 (100 kDa) e Ani s 3 (41 kDa), sono omologhi alle proteine del muscolo paramiosina e tropomiosina rispettivamente, e sono i maggiori responsabili di cross-reattività tra Anisakis e gli altri invertebrati, come i crostacei e gli acari della polvere (Bernardini et al., 2005) (Fig 7). Inoltre, Gonzalez-Fernandez et al., 2015, hanno descritto una globina in A. simplex s.l., che è "emoglobina" (di seguito anche "nemoglobina" per distinguerla dall'emoglobina vertebrata), come un nuovo maggiore allergene importante (Ani s 13) riconosciuto nel 64% di pazienti sensibilizzati e nell’81% di soggetti con GAA. Infine, Ani s 14 è stato recentemente descritto (Kobayashi et al., 2015).
18
Figura 7. Allergeni caratterizzati di Anisakis simplex (Nieuwenhuizen et al. 2013)
La maggior parte degli studi sulle capacità allergeniche degli anisakidi riguardano il genere Anisakis. In un recente studio sulla capacità allergenica di Pseudoterranova in BALB/c (Ludovisi et al., 2017), e’ stato rilevato che l'infezione da P. decipiens può sensibilizzare i topi a reagire al challenge orale con proteine di anisakidi, come descritto nelle infezioni da A. simplex s.s. e A. pegreffii. I risultati del lavoro mostrano che le proteine anisakidi inducono una risposta Th2 dominante, sebbene P. decipiens potrebbe anche indurre un pattern misto di tipo 1/tipo 2.
1.7 Diagnostica
Le larve anisakidi sono estremamente immunogene, l’avvenuto contatto si può facilmente evidenziare mediante la ricerca di diverse classi di anticorpi in particolare di tipo IgE. La ricerca delle IgE totali (policlonali) rappresenta il primo step; in parallelo vanno testati gli anticorpi specifici anti- Anisakis, ricerca che può essere effettuata con diverse metodiche: ELISA, Ag- capture ELISA, mAb UA3 (metodica con anticorpi monoclonali), immunoblotting, RAST, Ouchterlony, elettrosineresi, deviazione del complemento, immunofluorescenza. Con le metodiche convenzionali (ELISA, RAST) con l’uso di antigeni somatici e/o ottenuti da larva intera, si osservano fenomeni di cross-reazione che confondono la diagnosi. L’attivazione della risposta immunitaria in seguito all’esposizione con il parassita è indicata dal fatto che, nel siero dei pazienti, si riscontrano concentrazioni crescenti di IgE durante i primi giorni successivi al contatto con gli allergeni (Daschner et al., 2000), che rimangono elevati per mesi o anni
19 (Audicana et al., 2002). L’ipersensibilità è di solito diagnosticata e confermata sia con test cutanei in vivo che con test in vitro. Nel 1995 fu utilizzato per la prima volta il prick test cutaneo (SPT) per Anisakis (Audicana et al., 1995). Da allora il suo utilizzo si è diffuso e viene impiegato come test di screening nei casi di orticaria e anafilassi di natura non nota (Audicana et al., 2002).
In assenza di un gold standard la diagnosi di allergia ad Anisakis si basa attualmente sull’anamnesi (ingestione di pesce fresco nelle ore precedenti alla reazione), sull'esclusione di altre possibili cause di anafilassi e SPT in vivo, confermato dalla rilevazione in vitro di IgE specifiche mediante immunodosaggio su siero e/o immunoblotting (Falcao et al., 2008; Moneo et al., 2007). Tuttavia, l'utilità di queste tecniche nella diagnosi di una vera risposta allergica ad Anisakis è oggetto di dibattito, a causa dell’esistenza di cross-reattività tra antigeni di Anisakis e quelli di altri nematodi ascaridi, microrganismi o parassiti responsabili di risultati falsi positivi (Lozano et al., 2004; Guarneri et al., 2007).
La cross-reattività è determinata dalla presenza di allergeni ubiquitari, denominati“panallergeni” come ad esempio la tropomiosina che può causare cross-reattività in pazienti sensibilizzati agli artropodi, oppure gli allergeni appartenenti alla famiglia SxP Ral-2 (Ani s 5, Ani s 8 e Ani s 9) che mostrano un’alta similitudine nel phylum dei nematodi , ne costituisce un esempio l’Ani s 9 appartenente agli allergeni di Anisakis che mostra il 60% di identità di sequenza con As-14 di Ascaris (Carballeda-Sangiao et al., 2014).
Di conseguenza la bassa specificità dei test cutanei e del dosaggio in vitro delle immunoglobuline (IgE) specifiche può portare ad una diagnosi errata.
Limite comune nella diagnostica allergologica è la presenza di positività ai test sia in vivo che in vitro in assenza di sintomatologia clinica.
I pazienti con orticaria cronica spontanea presentano una positività dei test per Anisakis senza una chiara manifestazione clinica (Frezzolini et al., 2010; Ventura et al., 2013) Per la diagnosi dell’allergia alimentare il gold standard attualmente riconosciuto è il comunemente definito challenge con l’alimento nelle sue varie forme di esecuzione; tale metodo comporta tuttavia l’esposizione del paziente ad un rischio considerevolmente elevato (Brusca et al., 2015).
Nel caso dell’ipersensibilità ad Anisakis a tale limite si aggiunge la problematica bioetica determinando l’impossibilità di effettuare un test di challenge orale con il parassita vivo, dal momento che è stata verificata l’assenza di sintomi allergici in seguito all’ingestione
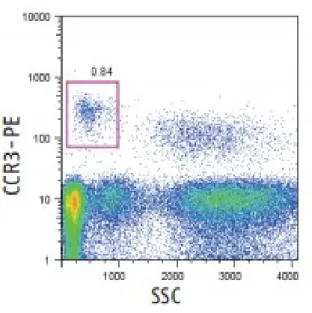
20 di estratti del parassita liofilizzato (Sastre et al., 2000), probabilmente per la mancanza in quest’ultimo delle proteine secretorie legate a condizioni intra-vitam del parassita . Diversi dati sperimentali supportano l'utilizzo in vitro di allergeni per il test di attivazione dei basofili (BAT) sostenendo la possibilità che possa sostituire il test di challenge in vivo (Santos et al., 2014; Rubio et al., 2011). Il BAT è stato proposto come metodo diagnostico molto più fedele alla clinica rispetto ai test precedentemente elencati (Ebo et al., 2005), è stato dimostrato infatti come questo test possa aiutare a distinguere con elevata specificità tra pazienti allergici e pazienti sensibilizzati (positività ai prick test e alle IgE specifiche) in assenza di manifestazioni cliniche (Tokuda et al., 2009; Santos et al., 2014). Il BAT, in pratica, consente di simulare in vitro un test di scatenamento allergenico in vivo, attraverso la valutazione citofluorimetrica di marcatori di attivazione dei basofili (Brusca et al., 2015). Il metodo si basa sulla determinazione di cambiamenti fenotipici a livello della superficie cellulare dei basofili attivati. Durante il periodo di incubazione con gli allergeni, questi ultimi sono riconosciuti dalle IgE specifiche legate al recettore di membrana FcεRI sulla superficie cellulare; di conseguenza si innesca una cascata di segnali intracellulari che inducono l’attivazione dei basofili, questi una volta attivati rilasciano mediatori bioattivi e subiscono un’up-regolazione dell’espressione di alcuni marcatori sulla membrana. L’indicatore più comunemente usato nei test di attivazione dei basofili è CD63, una proteina presente nei granuli che si esprime sulla membrana plasmatica dei basofili in seguito alla loro attivazione e la cui espressione è correlata al rilascio di istamina (Sainte-Laudy et al., 2000; Lambert et al., 2003). Nel campo delle allergie alimentari la sensibilità e la specificità del BAT variano, rispettivamente, tra il 65% e il 100% e tra il 62,5% e il 100% (DeWeck et al., 2008). Il BAT è stato proposto inoltre come strumento innovativo e affidabile nella diagnostica allergologica di Anisakis, integrando procedure standardizzate (SPT e dosaggio di IgE specifiche) sia in diagnosi che durante il follow-up (Gonzalez-Munoz et al., 2005; Frezzolini et al, 2010).
1.8 Prevenzione
Dalle conclusioni del Rapporto EFSA 2010, nessuna area adibita alla pesca può ritenersi indenne dalla presenza di larve di Anisakis; la presenza di larve di parassiti in generale nei prodotti ittici pescati non è quindi legata a stati di alterazione, ma rappresenta un fenomeno naturale legato all’ecosistema. Il rischio per l’uomo è legato al consumo di
21 parti di pesce crudo o quasi crudo, o sottoposto a trattamenti non del tutto in grado di devitalizzare le larve di larve di parassiti vivi e vitali potenzialmente presenti.
Il consumo di pesci infestati dalle larve di Anisakis è un rischio biologico che può essere impedito da misure di controllo sotto la supervisione delle autorità sanitarie e dall’uso di metodi di conservazione e di preparazione adeguati che ne consentano l'inattivazione. Le larve di Anisakis sono sensibili al calore e, in generale, un trattamento di 60 °C al cuore del prodotto per 1 min è sufficiente ad uccidere le larve, che possono essere responsabili di patologie nell’uomo, ma è consigliabile raggiungere una temperatura di almeno 70°C (International Commission on Microbiological Specifications for Foods 1996). Questo trattamento è in grado di prevenire l’insorgenza dell’anisakiasi ma non impedisce la comparsa di un eventuale reazione allergica poiché alcuni allergeni trattati a 100 °C possono mostrare ancora capacità di legare le IgE. Gli allergeni a basso peso molecolare sono quelli più resistenti alle alte temperature (San Martin, 2000). Ad esempio Ani s 1, Ani s 4 e Ani s 9 hanno dimostrato di essere termostabili, e gli allergeni rilasciati dalle larve nel tessuto circostante hanno conservato la loro allergenicità anche dopo che le larve sono state uccise dal trattamento termico (Vidaček et al., 2011). E’ stata dimostrata anche la loro resistenza al forno a microonde (Vidaček et al., 2009).
Per la prevenzione della salute del consumatore, sono state adottate normative sia a livello comunitario che nazionale, inerenti in particolare le temperature da applicare per l’uccisione dei parassiti nei prodotti della pesca. A livello comunitario, il Regolamento (UE) n. 1276/2011 della Commissione dell'8 dicembre 2011, che modifica l'allegato III del Regolamento (CE) n.853/2004, relativamente al trattamento per l'uccisione di parassiti vitali in prodotti della pesca destinati al consumo umano, prevede che gli OSA che immettono sul mercato i prodotti della pesca derivati da pesci pinnati o molluschi cefalopodi che vanno consumati crudi o praticamente crudi oppure marinati, salati e qualunque altro prodotto della pesca trattato, se il trattamento praticato non garantisce l'uccisione del parassita vivo, devono assicurarsi che il materiale crudo o il prodotto finito siano sottoposti ad un trattamento di congelamento che uccide i parassiti vivi potenzialmente rischiosi per la salute dei consumatori. Per i parassiti diversi dai trematodi, il congelamento deve consistere in un abbassamento della temperatura in ogni parte della massa del prodotto fino ad almeno -20°C per almeno 24 ore oppure - 35°C per almeno 15 ore. Gli OSA non sono tenuti a praticare i trattamenti di congelamento che uccidano i parassiti vivi potenzialmente rischiosi per il consumatore qualora i prodotti della pesca, in particolare: siano sottoposti o destinati ad essere sottoposti ad un
22 trattamento termico che uccida il parassita vivo prima del consumo; nel caso di parassiti diversi dai trematodi, il prodotto è riscaldato ad una temperatura al centro del prodotto superiore o uguale a 60°C per almeno un minuto.
A livello nazionale, il Ministero della Salute, con il decreto 17 luglio 2013 "Informazioni obbligatorie a tutela del consumatore di pesce e cefalopodi freschi e di prodotti di acqua dolce” ha fornito indicazioni sulle informazioni obbligatorie che i punti vendita di prodotti ittici devono rendere disponibili ai consumatori, al fine di prevenire i rischi collegati al consumo di prodotti ittici crudi o poco cotti per la possibile presenza di larve di Anisakidi, nel caso tale preparazione venga effettuato a livello domestico.
Il decreto stabilisce che nei punti vendita sia esposto un cartello in posizione ben visibile riportante le seguenti indicazioni: "INFORMAZIONI AL CONSUMATORE PER UN CORRETTO IMPIEGO DI PESCE E CEFALOPODI FRESCHI: In caso di consumo crudo, marinato o non completamente cotto il prodotto deve essere preventivamente congelato per almeno 96 ore a – 18 °C in congelatore domestico contrassegnato con tre o più stelle". Il congelamento del pesce, se effettuato con le prescritte temperature, uccide le larve di A. simplex.
Molti autori hanno eseguito test di challenge con pesce congelato su pazienti allergici ad A. simplex, e tutti hanno mostrato una buona tolleranza (García et al., 2001). Tuttavia, altri autori hanno riportato nel 10% dei pazienti la manifestazione di sintomi dopo aver mangiato pesce congelato. Baeza et al. 2001, hanno studiato l'evoluzione in un periodo di 10 mesi di 58 pazienti allergici ad A. simplex, dividendoli in tre gruppi: un gruppo con una dieta priva di pesce, un altro mangiava solo pesce congelato, e un terzo gruppo consumava pesce fresco. Il 60% e il 5% dei pazienti che mangiavano pesce fresco e pesce congelato rispettivamente hanno sviluppato sintomi di orticaria. I livelli IgE totali non sono cambiati nel gruppo che mangiava pesce fresco e sono invece diminuiti rispettivamente del 57% e del 45% nei pazienti la cui dieta includeva pesce congelato e in quelli con una dieta priva di pesce.
Altra importante modalità in grado di prevenire l’insorgenza dell’anisakiasi è effettuare l’eviscerazione del pesce, di dimensioni medio-grandi, nel più breve tempo possibile dopo la cattura: poiché è noto che le larve permangono nella cavità celomatica nel pesce vivo tendendo a passare nel tessuto muscolare dopo la morte del pesce stesso, una pronta eviscerazione può rappresentare un importante intervento di prevenzione della parassitosi umana (Circolare 11/03/1992, n.10).
23 2. SCOPO DELLA TESI
Lo scopo dello studio è stato quello di determinare la prevalenza di sensibilizzazione agli allergeni di Anisakis in soggetti potenzialmente a rischio per esposizione professionale (dipendenti addetti alla lavorazione di prodotti ittici, addetti alla vendita etc.). Inoltre sono stati testati pazienti ambulatoriali con anamnesi positiva di reazioni allergiche, in particolare di orticaria cronica, ai prodotti ittici.
Lo studio è stato effettuato testando i soggetti in vivo con lo SPT e in vitro con il dosaggio delle IgE specifiche per Anisakis (metodica ImmunoCap).
I soggetti positivi al dosaggio delle IgE specifiche ad Anisakis sono stati successivamente saggiati con la metodica di western-blot.
I soggetti positivi al dosaggio delle IgE specifiche o con anamnesi suggestiva di sensibilizzazione ad Anisakis e che hanno acconsentito, sono stati successivamente richiamati e saggiati con il test di attivazione dei basofili (BAT), al fine di raggiungere il massimo di specificità diagnostica.
Lo studio è stato svolto in collaborazione con il Reparto di Patologia Clinica, ambulatorio di Immunoallergologia, Ospedale Buccheri La Ferla di Palermo, per la parte inerente il reclutamento dei soggetti, i test allergologici (SPT, dosaggio IgE) e BAT. Presso il laboratorio del Centro di Referenza Nazionale Anisakiasi, presso il Dipartimento Alimenti, dell’IZS di Palermo, dove svolgo la mia attività, è stata messa a punto la metodica di preparazione dell’ estratto crudo e delle frazioni arricchite degli allergeni di Anisakis utilizzata per il BAT ed è stata standardizzata la procedura di Western blotting.
24 3. MATERIALI E METODI
3.1 Soggetti
Sono stati inclusi nello studio pazienti afferenti all’ambulatorio di allergologia dell’Ospedale Buccheri La Ferla Fatebenefratelli di Palermo nel biennio 2016-2018. Lo studio è stato condotto in particolare su n. 123 soggetti, di cui n. 98 maschi (79,7%) e n. 25 femmine (20.3%) (range di età: 20-74 anni), lavoratori del settore ittico della Sicilia Occidentale con potenziale esposizione professionale/sensibilizzazione ad AS dei quali: n. 50 addetti o dipendenti industrie ittiche (Mazara del Vallo e provincia di Palermo); n. 30 pescatori o marinai (Sciacca); n. 27 addetti alla preparazione di alimenti/cuochi (Palermo); n. 16 addetti alla vendita (Palermo) (Tabella 1).
Numero soggetti e prevalenza % sul totale
degli esaminati
Provenienza
Genere
Maschio 98
(79.7)
Palermo e prov; Mazara del Vallo; Sciacca
Femmina 25
(20.3)
Palermo e prov; Mazara del Vallo 123 Lavoratori del settore ittico Addetti/dipendenti industria ittica 50 (40.7)
Mazara del Vallo (TP); Aspra (PA); Bagheria (PA)
Pescatori/marinai 30 (24.4) Sciacca (AG) Addetti preparazione alimenti/cuochi 27 (21.9) Palermo
Addetti alla vendita di prodotti ittici
16
(13) Palermo
123
Tabella 1: Caratteristiche (genere, professione, provenienza) dei 123 soggetti con potenziale esposizione professionale
Durante il periodo di studio sono pervenuti inoltre all’attenzione del reparto di Allergologia, 613 pazienti (età media 38,6 anni con un range tra 1-86) dei quali n.75 con anamnesi suggestiva per AS (pazienti che avevano manifestato reazioni allergiche
25 nell’ultimo mese -orticaria-angioedema, asma, diarrea acuta o anafilassi- dopo aver mangiato pesce fresco), n. 515 pazienti affetti da documentata orticaria cronica (CU) con o senza angioedema e n. 23 con sintomi riferibili ad infestazione parassitaria (n.23). E’ stato progettato un questionario per raccogliere le caratteristiche dei pazienti ambulatoriali (età, sesso, area di residenza, tipo di occupazione, uso eventuale di dispositivi di protezione individuale (DPI) e contatto con pesce crudo) insieme alle informazioni sull'anamnesi, questionario che è stato fornito a tutti i soggetti che si sono presentati all’ambulatorio durante il biennio di studio (Allegato 1).
Seguendo l'attuale approccio diagnostico, tutti i soggetti, inclusi nello studio in base all'anamnesi, sono stati testati in vivo con lo SPT ed in vitro con l’ immunoCap (prima linea) per AS, Ascaris e tropomiosina (per reazioni allergiche ad altri parassiti), merluzzo, tonno e parvoalbumina della carpa (per l’allergia al pesce).
Sono stati esclusi dallo studio i soggetti con sensibilizzazione “al pesce”, documentata da test diagnostici.
La presenza di anticorpi IgE verso uno o più allergeni di Anisakis è stata altresì ricercata tramite Western blotting.
I pazienti ambulatoriali che sono risultati positivi alla prima linea (positivi IgE specifiche e Western blotting) sono stati invitati a essere ulteriormente testati con BAT, come analisi sperimentale di conferma. Nonostante sia risultato negativo alle analisi in prima linea, è stato testato con il BAT un soggetto (pescatore) che documentava una presentazione clinica molto suggestiva per l'allergia all'Anisakis.
Tutti i pazienti ambulatoriali hanno letto e firmato un consenso informato prima del prelievo di sangue e della somministrazione del questionario.
3.2 Allergeni
Per il SPT e per l’ immunoCap sono stati utilizzati degli estratti di Anisakis reperibili in commercio (ALK-Abellò, Madrid Spagna e Phadia S.r.l. Uppsala, Svezia). Il test di attivazione dei basofili (BAT) invece è stato eseguito oltre che con l’estratto in commercio (BÜHLMANN fCAL®, Svizzera), con delle frazioni arricchite in allergeni ottenute dagli estratti di Anisakis simplex sensu stricto (A. simplex s. s.) e di Anisakis pegreffii (A. pegreffii), preparate presso il laboratorio del Centro di Referenza Nazionale per le Anisakiasi (C.Re.N.A) dell’Istituto Zooprofilattico Sperimentale della Sicilia, Palermo, secondo la metodica descritta di seguito.
26 3.3 Fasi di preparazione degli allergeni
3.3.1 Ricerca delle larve della famiglia Anisakidae
20 campioni di pesce, di cui 10 appartenenti alla specie Lepidopus caudatus (pesce sciabola) provenienti dalla zona FAO 37 e 10 appartenenti alla specie Clupea harengus (aringa) provenienti dalla zona FAO 27, sono stati esaminati per la ricerca di larve di nematodi anisakidi (specie ittiche scelte per la maggiore probabilità di trovare rispettivamente A. pegreffii e A. simplex s.s.). E’ stata eseguita una prima ispezione del campione attraverso il taglio in senso caudo-craniale, quindi il controllo dei visceri e dei muscoli, con il metodo visivo e con l’ausilio di uno stereomiscroscopio (Stemi 2000 Zeiss, Oberkochen). Le larve rilevate sono state lavate in soluzione fisiologica e fissate in 70% di etanolo. Nei casi di assenza di larve il campione è stato sottoposto a digestione cloropeptica con 16 ml di HCl al 25% e 10 g di pepsina (1:10000 NF) in soluzione acquosa (Regolamento CE 2075/2005). É stato prelevato e pesato 100 g di campione, pressato allo stomacher (omogeneizzatore AES) e sottoposto a digestione in un becher di vetro contenente la soluzione acquosa con HCl e pepsina preriscaldata a 44±2°C. La digestione procede in agitazione per un tempo di 30 minuti. Il prodotto di digestione è stato filtrato con un filtro da 180 µm ed ispezionato allo stereomicroscopio.
Dai campioni analizzati sono state prelevate, per specie ittica, circa 100 larve di Anisakidae per l’identificazione morfologica e successiva identificazione di specie utili per l’implementazione di un metodo d’estrazione degli allergeni che si riporta poi di seguito.
3.3.2 Identificazione morfologica
Le larve ritrovate dalle due specie ittiche utilizzate, procedendo separatamente, sono state lavate in soluzione fisiologica e fissate in etanolo al 70% per una notte, quindi chiarificate in glicerolo al 87% e visualizzate al microscopio ottico (Leica DM 2000); ciò allo scopo di procedere all’identificazione morfologica di genere (morfologia del tratto digerente, posizione del poro escretore, presenza del dente o delle labbra nell’estremità anteriore, presenza o assenza del ventricolo e del mucrone nell’estremità posteriore) (Berland 1961; 1989), secondo procedura accreditata presso il C.Re.N.A. (POS CRENA 03 Ricerca ed identificazione nematodi appartenenti alla famiglia Anisakidae).
Le larve ritrovate nei campioni delle due specie ittiche sono state sottoposte in parte ad identificazione di specie e la restante parte utilizzata per l’estrazione degli allergeni.
27 3.3.3 Identificazione molecolare
Una volta effettuata l’identificazione morfologica, per ogni larva appartenente al genere Anisakis è stato prelevato un frammento per l’identificazione di specie eseguita mediante PCR-RFLP (D’Amelio et al., 2000; Pontes et al., 2005) secondo procedura accreditata presso il C.Re.N.A. (POS CRENA 02 Identificazione a livello di specie di larve di Anisakis in PCR-RFLP).
I frammenti larvali sono stati reidratati in acqua sterile quindi posti all’interno di un eppendorf con 200 µl di acqua nucleasi free e congelati a -20°C per una notte. L’estrazione del DNA dei campioni è stata effettuata tramite l’utilizzo di appositi kit basati sulle colonnine ad affinità (GenElute®Mammalian Genomic DNA Miniprep Kit Sigma Aldrich, Amsterdam). Il DNA così estratto è stato quantificato mediante spettrofotometro a 260 nm e sottoposto a reazione di amplificazione (PCR). I primers utilizzati (NC5: 5’-GTA GGT GAA CCT GCG GAA GGA TCA TT-3’ e NC2: 5’-TTA GTT TCT TTT CCT CCG CT-3’) (Zhu et al., 1998), amplificano per la regione genomica nucleare che contiene gli spaziatori ribosomali ITS1 e ITS2, più la regione codificante per la subunità 5.8S. La Master Mix per la reazione di amplificazione è stata preparata come segue: 2 mM MgCl2, 0,2 mM di ciascun dNTP, 20 pmol / ml di ciascun primer, tampone AmpliTaq Gold 1 ×, 3 U AmpliTaq Gold DNA polimerasi (AB) e 20-25 ng di DNA genomico in un volume finale di 50 microlitri. I campioni hanno subito le seguenti condizioni di PCR: 10 min a 95°C; 35 cicli di 30 s a 95°C, 30 s a 58°C e 1 min e 30 s a 72°C; polimerizzazione finale a 72°C per 15 min. I prodotti di amplificazione sono stati rivelati tramite elettroforesi su gel di agarosio all’1% e successivamente sottoposti a restrizione enzimatica. La restrizione enzimatica è stata eseguita tramite l’utilizzo di due diversi enzimi di restrizione (HhaI e HinfI). Le sequenze riconosciute sono le seguenti: HhaI: GCG C – CGC G; HinfI: GANTC – CTNA G. La digestione degli ampliconi è stata effettuata incubando a 37°C o.n. La rivelazione dei prodotti di digestione è stata realizzata tramite elettroforesi su gel di agarosio al 2%.
I dati di RFLP, analizzati mediante elettroforesi, hanno mostrato i pattern di restrizione riferibili alle varie specie appartenenti al genere Anisakis, secondo la chiave di lettura riportata in bibliografia (D’Amelio et al., 2000; Pontes et al., 2005).
Le larve isolate dalla specie ittica Lepidopus caudatus (pesce sciabola), sono state identificate come A. pegreffii (specie prevalente nel Mar Mediterraneo), mentre le larve isolate dalla specie Clupea harengus (aringa), come A. simplex s.s.
28 3.3.4 Estrazione allergeni
Per l’estrazione delle proteine allergeniche di Anisakis sono stati utilizzati i frammenti larvali residui. È stata messa a punto una metodica per l’estrazione delle proteine di Anisakis sulla base di fonti bibliografiche (Moneo et al., 2007; Del Pozo et al., 1996). La procedura si divide in più fasi, la prima riguarda la preparazione dell’estratto crudo seguita dalla preparazione delle frazioni antigeniche.
La metodica d’estrazione degli allergeni ha previsto un processo di ottimizzazione del numero di larve da utilizzare, secondo i risultati scaturiti dalla quantificazione delle proteine. Per ogni estrazione sono state utilizzate un numero di 50 larve per specie di Anisakis, identificate in precedenza, inserite in un eppendorf con acqua bidistillata e congelate a – 80°C over night (o.n.). Successivamente si è proceduto alla rottura meccanica dei tessuti, mantenendo il campione di larve sempre in ghiaccio, in un potter di vetro con l’aggiunta di 1 ml di PBS (pH 7). Il campione cosi frammentato è stato sottoposto a 3 cicli di sonicazione di 30 secondi (sonicatore SonoPlus Chemic ALS srl). Il campione omogeneizzato e sonicato è stato posto in un rotore verticale a 4°C o.n., centrifugato a 16.000 giri per 15 minuti ed è stato prelevato il surnatante contenente l'estratto crudo.
Per la preparazione delle frazioni antigeniche si è diluito una parte dell’estratto crudo con un rapporto 1/2 in etanolo assoluto, il composto è stato miscelato fino ad ottenere una soluzione biancastra e incubato a temperatura ambiente (T.A.) dai 30 ai 60 minuti. Al termine dell’incubazione i campioni sono stati centrifugati a 5000 giri per 15 minuti a 4°C, il surnatante è stato raccolto e trasferito in un nuovo tubo, è stato aggiunto etanolo assoluto con un rapporto 1/3, i campioni sono stati vortexati e incubati a T.A. per 30 minuti. Dopo l’incubazione i campioni sono stati centrifugati a 5000 giri per 15 minuti a 4°C, il surnatante ottenuto è stato raccolto e trasferito in nuovo tubo, mentre il pellet è stato conservato per lasciare evaporare l'etanolo almeno una notte e infine risospeso in 0,5 ml di PBS per ottenere la frazione con etanolo al 50-66%.
Al surnatante della fase precedente è stata aggiunta una quantità di etanolo assoluto fino ad ottenere 10 volte il volume iniziale ed è stato incubato 30 min. a T.A. e centrifugato a 5000 giri per 15 minuti a 4°C. Il surnatante ottenuto è stato scartato e il pellet è stato lasciato evaporare almeno una notte. Infine il pellet è stato risospeso in PBS con un rapporto 1/10 per ottenere la frazione con etanolo al 66-99%.
Si ottengono pertanto diverse frazioni (Moneo et al., 2007):
29 visibili
- frazione con etanolo al 50-66%: contiene l'allergene Ani s 1 (20-22 kDa) e Ani s 4 (9-10 kDa)
- frazione con etanolo al 66-99% contiene gli allergeni appartenenti alla famiglia SxP Ral-2 (Ani s 5, Ani s 8 e Ani s 9 15-18 kDa).
La concentrazione proteica è stata determinata con il fluorimetro Qubit (Qubit 3.0 Fluorometer Life Technologies) e i campioni aliquotati sono stati conservati a -80°C. 3.4 Skin Prick Test (SPT)
Lo SPT è stato eseguito con un estratto commerciale di Anisakis simplex (ALK-Abellò, Madrid Spagna) concentrato 2 mg/ml. Sono stati utilizzati istamina (1 mg/ml) e glicerolo diluiti in buffer rispettivamente come controllo positivo e negativo. La reazione è stata valutata dopo 15 minuti dall’inoculazione e valutata come positiva nei casi di formazione di un pomfo ≥ a 3 mm di diametro.
3.5 ImmunoCAP
Tutti i soggetti reclutati nello studio sono stati sottoposti al dosaggio delle IgE specifiche (Immunocap250, Immunodiagnostics Uppsala, Sweden) per Anisakis (p4), tropomiosina (Der p10-d205), Ascaris (p1) per rilevare la positività ad Anisakis e per merluzzo (f3), tonno (f40) e parvoalbumina della carpa (Cyp c1-f355) per la diagnosi di allergia al pesce. Un valore di IgE specifiche >0.35 kIU/L è stato considerato positivo.
Metodica ImmunoCap: Per l’esecuzione del test si sfrutta un sistema diagnostico in vitro che utilizza particolari pozzetti, contenenti l’estratto allergenico in studio, denominati immunoCap. L’immunoCap è formato da una fase solida costituita da un derivato della cellulosa contenuto in una capsula, che presenta una struttura porosa con elevata capacità legante, circa 150 volte più elevata della superficie interna tradizionale coated tube, questo, insieme ad altre peculiari caratteristiche dell’immunoCAP, conferisce al sistema elevata velocità, precisione, riproducibilità che contribuiscono ad una superiore sensibilità e specificità del dosaggio. Il test è strutturato come un immunodosaggio ELISA (Enzyme-Linked Immuno Sorbent Assay) eterogeneo a “sandwich”, per la ricerca degli anticorpi.
L’analizzatore utilizzato in questo studio per il dosaggio delle IgE specifiche (Phadia 250, Thermoscientific) è un’apparecchiatura ad accesso continuo e random, completamente automatizzata che gestisce tutte le fasi dell’analisi, dalla dispensazione dei campioni alla misurazione della fluorescenza. Il siero del campione in esame è stato
30 dispensato nel pozzetto contenente l’allergene di interesse, il quale si lega in maniera specifica alle IgE del campione eventualmente presenti.
Dopo un’incubazione a 37°C è stato effettuato un primo lavaggio per rimuovere tutto quello che non si è legato alla fase solida. Successivamente è stato aggiunto il coniugato, costituito da anticorpi monoclonali di topo anti-IgE coniugati con un enzima, la b-galattosidasi (che permette di catalizzare la reazione). Dopo una seconda incubazione a 37°C è stato effettuato un lavaggio per eliminare gli anticorpi marcati non legati, mentre il complesso legato è stato incubato a 37°C con un reagente di sviluppo (4-metilubelliferim-b-D-galattosidase allo 0,01%) che reagisce con l’enzima sviluppando una reazione fluorescente. La reazione è stato arrestata mediante l’utilizzo di una soluzione stoppante (soluzione acida). Successivamente a questa fase, è stata misurata la fluorescenza dell’eluato automaticamente dallo strumento.
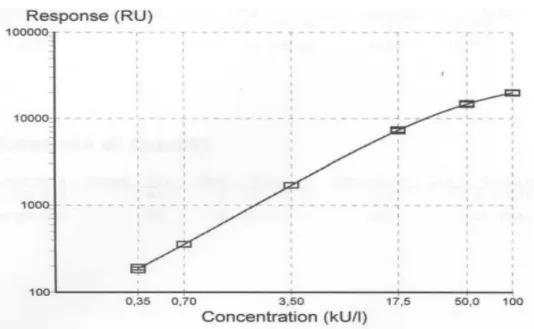
Tanto più elevata è la concentrazione di IgE specifiche presenti nel campione in esame, tanto maggiore sarà la fluorescenza misurata. Per la valutazione dei risultati, le fluorescenze misurate nei campioni sono state trasformate in concentrazioni mediante l’uso di una curva di calibrazione (Fig 8). Quest’ultima è stata costituita con alcuni standard a concentrazione nota che vanno a costituire un grafico, dove sull’asse delle ascisse sono riportate le concentrazioni dei diversi standard dosati, mentre sull’asse delle ordinate è riportata la fluorescenza rilevata. La fluorescenza dei campioni in esame è stata riportata su un grafico e per confronto sono state ottenute le relative concentrazioni. Nel test sono stati inoltre utilizzati un controllo positivo ed uno negativo. I risultati sono stati espressi in unità anticorpali allergene-specifiche (KU/l).
Figura 8. Curva di calibrazione, riportante in ascissa le concentrazioni degli standard ed in ordinata la fluorescenza rilevata.