1
Indice
1. Introduzione pag. 2
2. Caso Clinico pag. 3
2.1 Note anamnestiche 2.2 Decorso clinico 2.3 Indagini strumentali 2.4 Management 3. Discussione pag. 8 4. Conclusioni pag. 10 5. Ringraziamenti pag. 11 6. Bibliografia pag. 12
2
1. Introduzione
Il trapianto renale rappresenta senza dubbio il trattamento di scelta nei pazienti con malattia renale cronica terminale rispetto alla dialisi peritoneale e all’emodialisi, sia in termini di durata che di qualità di vita. I progressi della tecnica chirurgica e della terapia immunosoppressiva hanno aumentato la sopravvivenza del graft a circa 20 anni nel trapianto da cadavere e a circa 30 anni in quello da vivente.
L’ecografia è ampiamente usata sia nell’iter diagnostico del ricevente e del donatore sia nel follow-up a breve e lungo termine del trapianto, poiché non è una tecnica invasiva né nefrotossica, è poco costosa e ben tollerata dal paziente. Inoltre, consente l’esecuzione di procedure interventistiche, quali la biopsia del graft, il drenaggio percutaneo di raccolte, la pielostomia e il posizionamento di stent pielo-vescicale. L’ecografia riveste un ruolo fondamentale nella diagnosi delle complicanze del periodo post-operatorio, che sono spesso correlate ad errori della tecnica chirurgica. Tra queste, le raccolte perirenali sono relativamente frequenti, interessando l’11% dei pazienti trapiantati di rene. L’ematoma, il linfocele, l’urinoma e l’ascesso rappresentano le forme più comuni di raccolta peri-renale post-chirurgica. Una raccolta anecogena, non strutturata e senza echi in sospensione, con o senza setti divisori, è indicativa di urinoma o di linfocele. Una raccolta extraperitoneale complessa con lacune ipo-anecogene con tralci spessi, irregolari e privi di segnale color Doppler, che impronta il graft, è generalmente espressione di ematoma in fase di organizzazione. Infine, una raccolta complessa, con echi in sospensione centrali e ricca vascolarizzazione marginale, depone per un ascesso.
Le metodiche di imaging pesante, quali la tomografia computerizzata e la risonanza magnetica, integrano le informazioni fornite dall’indagine ecografica, qualora quest’ultima non risulti risolutiva nella diagnosi. La natura della raccolta peri-renale deve comunque essere confermata dall’analisi del materiale della stessa.
3
2. Caso Clinico
Paziente di sesso maschile di anni 72 giungeva al pronto soccorso per febbre e tumefazione testicolare destra. In regime di urgenza, veniva avviata terapia antibiotica con amoxicillina.
2.1 Note anamnestiche
Nel 1993, diagnosi di malattia renale cronica secondaria a nefropatia a depositi mesangiali di IgA. Nel 2000, per il progressivo peggioramento della funzione renale, avvio al trattamento sostitutivo extracorporeo. Nel 2001, primo trapianto di rene da donatore cadavere ed inizio della terapia immunosoppressiva con daclizumab, steroide, micofenolato mofetile e tacrolimus. Nel 2004, ricovero per angina instabile, tuttavia non è stata eseguita nessuna indagine angiografica. Nello stesso anno, diagnosi di ipertrofia prostatica benigna. Nel gennaio 2015, ricovero in terapia intensiva per insufficienza respiratoria acuta che ha richiesto un supporto di ventilazione meccanica. Durante la degenza, effettuato trattamento extracorporeo continuo con mancata ripresa della funzione renale. Lavaggio bronco-alveolare positivo per Citomegalovirus, virus Epstein-Barr e per Candida; tampone nasale positivo per il virus dell’Influenza A. Ad aprile 2015, ripresa della terapia sostitutiva extracorporea intermittente.
A maggio 2017, trapianto di rene singolo da donatore cadavere. Compatibilità 1Ag; ischemia fredda 18 ore; tempo anastomotico 30 minuti; rene sinistro score 5. Delayed graft function di 30 giorni; terapia immunosoppressiva con siero anti linfociti T, steroide, micofenolato mofetile e tacrolimus. In quindicesima giornata, effettuata biopsia renale con evidenza di persistente necrosi tubulare acuta e significativa vasculopatia. Sostituzione del micofenolato mofetile con everolimus. A giugno 2017, urosepsi da Escherichia Coli, trattata con meropemen. Per la comparsa di diabete secondario alla terapia steroidea, inizio della terapia insulinica. Creatinina alla dimissione 5 mg/dl.
4
2.2 Decorso clinico
Il paziente veniva trasferito dal pronto soccorso presso l’U.O.C. di Nefrologia e Dialisi dell’Ospedale di Treviso-Oderzo per febbre, tumefazione testicolare destra e dolore addominale diffuso con quadro di addome acuto. Gli esami di laboratorio evidenziavano: creatinina 3.9 mg/dl, azotemia 86 mg/dl, sodio 141 mEq/l, potassio 3.4 mEq/l, calcio 8.5 mg/dl, fosforo 5.3 mg/dl, bicarbonati standard 20 mmol/l, globuli bianchi 2.820/mm3, piastrine 90.000/mm3, emoglobina 11.9 gr/dl, proteina C reattiva 32 mg/dl, proteinuria delle 24 ore 150 mg, Citomegalovirus DNA non rilevabile. L’emocoltura risultava positiva per Escherichia Coli sensibile al meropenem. L’urinocoltura era negativa. Considerato il quadro laboratoristico, veniva sospesa la terapia immunosoppressiva ed avviata la terapia antibiotica, inizialmente con tazobactam e successivamente con meropenem.
2.3 Indagini strumentali
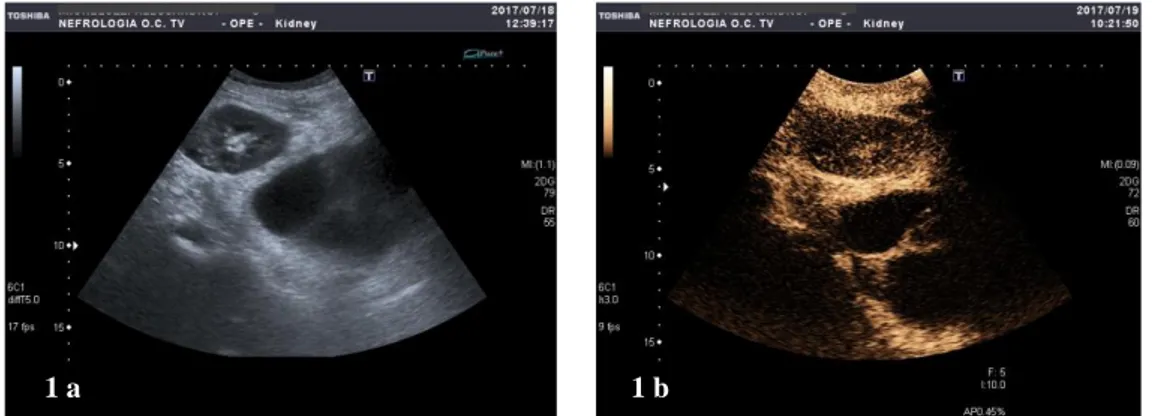
L’ecografia in B-Mode evidenziava una raccolta complessa al di sotto del rene trapiantato, dislocante la vescica e con scarso enhancement dopo somministrazione del mezzo di contrasto (Figura 1 a,b).
Figura 1. (A) Immagine in B-Mode, raccolta complessa al di sotto del rene trapiantato, dislocante la vescica. (B) Dopo la somministrazione del mezzo di contrasto, raccolta con scarso enhancement.
5
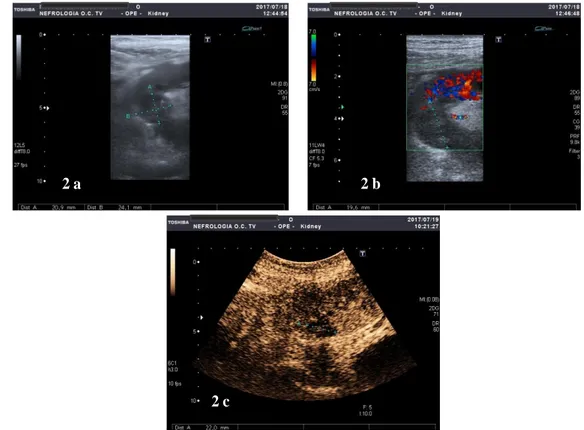
Inoltre, nel rene trapiantato era evidente un’area ipoecogena dal diametro di 19.6 mm, non vascolarizzata al colorDoppler e con scarso enhancement dopo somministrazione del mezzo di contrasto (Figura 2 a,b,c).
Figura 2. (A). Immagine in B-Mode, area iopecogena. (B) Area con scarsa vascolarizzazione al colorDoppler. (C) Dopo somministrazione del mezzo di contrasto, scarso enhancement.
2 a
2 c
6
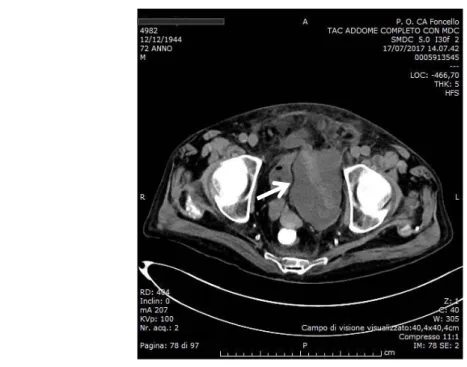
La tomografia computerizzata con mezzo di contrasto dell’addome rilevava una raccolta pelvica, al di sotto del rene trapiantato, con componente iperdensa dislocante lievemente la vescica ed interessante per un breve tratto il profilo anteriore del muscolo iliaco di sinistra (diametri assiali massimi 9,5 x 5,5 cm). La raccolta sembrava in continuità con un’altra raccolta nella parete addominale anteriore-inferiore, posteriormente ai muscoli retti, anch’essa con regioni dense sul versante sinistro (diametri assiali massimi 5 x 3 cm). Non era evidente sanguinamento attivo (Figura 3).
Figura 3. Raccolta pelvica con componente iperdensa dislocante lievemente la vescica ed interessante per un breve tratto il profilo anteriore del muscolo iliaco di sinistra, in continuità con un’altra raccolta nella parete addominale anteriore-inferiore, posteriormente ai muscoli retti.
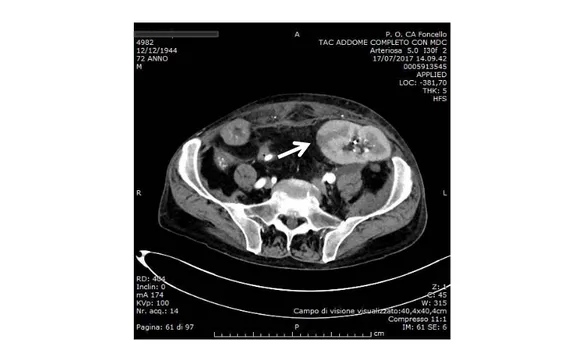
Il rene trapiantato in fossa iliaca sinistra presentava limitata area costantemente ipodensa nelle fasi contrastografiche, con forma approssimativamente a cuneo (Figura 4). In sede il pigtail. Non vi era evidenza di spandimenti di urina iodata in addome.
7
Figura 4. Rene trapiantato in fossa iliaca sinistra con limitata area ipodensa nelle fasi contrastografiche, con forma approssimativamente a cuneo.
La radiografia del torace non evidenziava addensamenti polmonari, ma una accentuazione diffusa del disegno vascolare.
2.4 Management
Dato il quadro clinico-laboratoristico, il paziente è stato sottoposto ad intervento chirurgico laparoscopico con creazione di una finestra peritoneale e drenaggio della raccolta retroperitonelae (liquido sieroso-torbido). La coltura del liquido peritoneale è risultata positiva per Escherichia Coli sensibile al meropenem. L’intervento chirurgico e la terapia antibiotica hanno determinato la remissione della febbre, un progressivo miglioramento delle condizioni cliniche ed una riduzione degli indici di flogosi. E’ stato successivamente rimosso lo stent ureterale senza evidenza di dilatazione delle cavità escretrici al controllo ecografico. Alla dimissione gli esami di laboratorio mostravano: creatinina 3.2 mg/dl, azotemia 85 mg/dl, sodio 144 mEq/l, potassio 4.7 mEq/l, calcio 8.8 mg/dl, fosforo 6.2 mg/dl, bicarbonati standard 19 mmol/l, piastrine 101.000/mm3, globuli bianchi 4.650/mm3 emoglobina 12.5 gr/dl,
proteina C reattiva 0.1 mg/dl, FK 5.6, Citomegalovirus DNA non rilevabile, urinocoltura negativa.
8
3. Discussione
Quello descritto è un caso di sepsi da Escherichia Coli associata a linfocele infetto in un quadro di addome acuto in paziente trapiantato di rene.
Dal 1970 il linfocele è una nota complicanza post-chirurgica del trapianto di rene costituita da una raccolta linfatica derivante generalmente dalla dissezione dei vasi linfatici satelliti dei vasi iliaci del ricevente o del donatore. Tuttavia, negli ultimi decenni altri fattori sono stati correlati alla sua patogenesi, quali i farmaci immunosoppressori, il diabete mellito, l’obesità, gli episodi di rigetto, la delayed graft function e le alterazioni della coagulazione (1). Il linfocele può formarsi da due settimane a sei mesi dall’intervento chirurgico (2,3) e tende a localizzarsi in prossimità dei vasi iliaci, ma può estendersi alla loggia peri-renale, alla pelvi e allo spazio peri-vescicale. L’introduzione dell’ecografia nel follow-up del rene trapiantato ha determinato un aumento della incidenza del linfocele, che varia dallo 0.6% al 33.9% (2,4-8). L’incidenza delle forme sintomatiche varia invece dallo 0.03% al 26% (5,9-11).
Da un punto di vista patogenetico, la formazione del linfocele sembra favorita dalla presenza di diabete mellito in pazienti in trattamento con inibitori della calcineurina. La microangiopatia diabetica potrebbe, infatti, essere responsabile degli alterati processi di riparazione della ferita chirurgica, facilitando la formazione della raccolta linfatica (8). Anche la malattia renale policistica autosomica dominante è associata ad un maggiore incidenza di linfocele, a causa dell’effetto compressivo dei reni nativi sulla vena cava e la conseguente riduzione del flusso linfatico (12). Alterazioni della coagulazione e la terapia anticoagulante con eparina a basso peso molecolare ritardano la guarigione della ferita, favorendo la formazione del linfocele (13,14). Alcuni autori hanno dimostrato che il rigetto acuto è un fattore di rischio indipendente di linfocele (OR 1.34, p<0.03) (15). Altri fattori che aumentano il rischio di linfocele sono l’obesità (6,15,16) e l’età del ricevente (17), la necrosi tubulare acuta con delayed graft function (18), il tempo di ischemia calda (17), la durata del trattamento dialitico (19) ed i farmaci immunosoppressori, quali il micofenolato mofetile, gli inibitori di mTOR (mammalian target of rapamicin) ed
9
alte dosi di steroidi (17,18, 20-22). La tabella 1 riassume i fattori coinvolti nella patogenesi del linfocele.
Fattori Autori Anno
Diabete Mellito Ulrich F et al. 2010
Malattia renale policistica autosomica dominante
Martínez-Ocaña JC et al. 1995 Alterazioni della coagulazione e terapia
anticoagulante
Ziętek Z et al. Lundin C et al.
2011 2002
Rigetto acuto Tiong HY et al. 2009
Obesità del ricevente Goel M et al. Tiong HY et al. Dean PG et al.
2004 2009 2004
Età del ricevente Zagdoun E et al. 2010
Delayed graft function Khauli RB et al. 1993
Tempo di ischemia calda Zagdoun E et al. 2010 Durata del trattamento dialitico Mokos I et al. 2010
Farmaci immunosoppressori Zagdoun E et al. Khauli RB et al. Rogers CC et al. Woodle ES et al. Sandrini S et al. 2010 1993 2005 2005 2009
Tabella 1. Fattori favorenti la formazione del linfocele
Il linfocele è generalmente asintomatico. Se di grandi dimensioni, può determinare idronefrosi, tenesmo vescicale, dolore addominale, edema della regione ingunale, febbre e sindrome da compressione della vena cava inferiore. Raramente il linfocele può infettarsi, trasformandosi in una raccolta ascessuale complessa. Da un punto di vista ecografico, il linfocele assume l’aspetto di una formazione similcistica rotondeggiante o lobulata, situata a ridosso del graft o dei vasi iliaci, che spesso la attraversano senza interrompersi. Quando la raccolta si forma in sede pelvica, può essere confusa con la vescica, per cui l’esame ecografico deve essere effettuato a vescica piena e dopo minzione comandata. La natura della raccolta va confermata con l’analisi del liquido della stessa.
10
Il linfocele non richiede generalmente nessun trattamento. Krol et al. hanno dimostrato che il posizionamento di un drenaggio durante l’intervento si associa ad una riduzione dell’incidenza di raccolte fluide e della necessità di trattamento soprattutto in pazienti in trattamento con sirolimus (23). Altre opzioni terapeutiche comprendono la sospensione della terapia immunosoppressiva, l’aspirazione percutanea ecoguidata della raccolta, la scleroterapia con iodopovidone, alcool etilico o tetracicline. Dal 1992, il linfocele sintomatico è trattato chirurgicamente in laparoscopia o a cielo aperto con la creazione di una finestra peritoneale e drenaggio della raccolta. La percentuale di recidiva varia dal 4% all’8%, nettamente inferiore a quella riportata in caso di aspirazione della raccolta, che varia dal 16% al 51% (1). Nel caso descritto, la presenza di diabete, la terapia immunosoppressiva con micofenolato mofetile ed everolimus e la delayed graft function secondaria a necrosi tubulare acuta, hanno indubbiamente favorito la formazione del linfocele. La raccolta si è successivamente infettata con verosimile coinvolgimento del peritoneo parietale e conseguente quadro di addome acuto. L’area ipoecogena del graft potrebbe essere espressione di pielonefrite acuta focale. Le dimensioni della raccolta hanno reso necessario l’intervento chirurgico con l’aspirazione della stessa. La sospensione della terapia immunosoppressiva ed il trattamento antibiotico hanno contribuito alla risoluzione del quadro clinico.
4. Conclusioni
Il linfocele rappresenta una complicanza post-chirurgica relativamente frequente nel trapianto di rene, talvolta responsabile di quadri clinici severi. Il suo trattamento, e soprattutto la sua prevenzione con il posizionamento di un drenaggio durante l’intervento, rivestono un ruolo fondamentale per la sopravvivenza del graft.
11
Ringraziamenti
Si ringraziano il Professore Mario Meola e la Dott.ssa Ilaria Petrucci per i loro preziosi insegnamenti e la cordiale disponibilità.
Si ringrazia il Dott. Mauro Dugo per la sua gentile collaborazione nella stesura di questa tesi e per aver fornito i dati e le immagini.
12
Bibliografia
1. Ranghino A, Segoloni GP, Lasaponara F et al. Lymphatic disorders after renal transplantation: new insights for an old complication. Clin Kidney J. 2015 Oct;8(5):615-22.
2. Ebadzadeh MR, Tavakkoli M. Lymphocele after kidney transplantation. Where are we standing now? Urol J 2008; 5: 144–148.
3. Samhan M, Al-Mousawi M. Lymphocele following renal transplantation. Saudi J Kidney Dis Transpl 2006; 17: 34–37.
4. Dubeaux VT, Oliveira RM, Moura VJ et al. Assessment of lymphocele incidence following 450 renal transplantations. Int Braz J Urol 2004; 30: 18– 21.
5. Zietek Z, Sulikowski T, Tejchman K et al. Lymphocele after kidney transplantation. Transplant Proc 2007; 39: 2744–2747.
6. Goel M, Flechner SM, Zhou L et al. The influence of various maintenance immunosuppressive drugs on lymphocele formation and treatment after kidney transplantation. J Urol 2004; 171: 1788–1792.
7. Adani GL, Baccarani U, Bresadola V et al. Graft loss due to percutaneous sclerotherapy of a lymphocele using acetic acid after renal transplantation. Cardiovasc Intervent Radiol 2005;28: 836–838.
8. Ulrich F, Niedzwiecki S, Fikatas P et al. Symptomatic lymphoceles after kidney transplantation - multivariate analysis of risk factors and outcome after laparoscopic fenestration. Clin Transplant 2010; 24: 273–280.
9. Lucewicz A, Wong G, Lam VW et al. Management of primary symptomatic lymphocele after kidney transplantation: a systematic review. Transplantation 2011; 92: 663–673.
10. Shum CF, Lau KO, Sy JL et al. Urological complications in renal transplantation. Singapore Med J 2006; 47: 388–391.
11. Minetti EE. Lymphocele after renal transplantation, a medical complication? J Nephrol 2011; 24: 707–716.
13
12. Martínez-Ocaña JC, Lauzurica R, Castellote E et al. Adult polycystic kidney disease: a risk factor for lymphocele formation after renal transplantation? Transplant Proc 1995; 27:2246–2247.
13. Ziętek Z, Iwan-Ziętek I, Sulikowski T et al. The outcomes of treatment and the etiology of lymphoceles with a focus on hemostasis in kidney recipients: a preliminary report. Transplant Proc 2011; 43: 3008–3012.
14. Lundin C, Bersztel A, Wahlberg J et al. Low molecular weight heparin prophylaxis increases the incidence of lymphocele after kidney transplantation. Ups J Med Sci 2002; 107: 9–15.
15. Tiong HY, Flechner SM, Zhou L et al. A systematic approach to minimizing wound problems for de novo sirolimus treated kidney transplant recipients. Transplantation 2009; 87: 296–302.
16. Dean PG, Lund WJ, Larson TS et al. Wound-healing complications after kidney transplantation: a prospective, randomized comparison of SRL and tacrolimus. Transplantation 2004; 77: 1555–1561.
17. Zagdoun E, Ficheux M, Lobbedez Tet al. Complicated lymphoceles after kidney transplantation. Transplant Proc 2010; 42: 4322–4325.
18. Khauli RB, Stoff JS, Lovewell T et al. Post-transplant lymphoceles: a critical look into the risk factors, pathophysiology and management. J Urol 1993; 150: 22–26.
19. Mokos I, Basic-Jukic N, Kastelan Z et al. Influence of long-term dialysis treatment on operative complications after renal transplantation. Transplant Proc 2010; 42: 2531–2533.
20. Rogers CC, HanawayM, Alloway RR et al. Corticosteroid avoidance ameliorates lymphocele formation and wound healing complications associated with sirolimus therapy. Transplant Proc 2005; 37: 795–797.
21. Woodle ES, Vincenti F, Lorber MI et al. A multicenter pilot study of early (4-day) steroid cessation in renal transplant recipients under simulect, tacrolimus and sirolimus. Am J Transplant 2005; 5: 157–166.
22. Sandrini S, Setti G, Bossini N et al. Steroid withdrawal five days after renal transplantation allows for the prevention of wound-healing complications associated with sirolimus therapy. Clin Transplant 2009; 23: 16–22.
14
23. Król R, Kolonko A, Chudek J et al. Did volume of lymphocele after kidney transplantation determine the choice of treatment modality? Transplant Proc 2007; 39:2740–2743.