Sintesi dei peptidi
2.SINTESI DEI PEPTIDI
2.1 Approccio per la protezione e la formazione del legame peptidico
Il primo step nella sintesi dei peptidi è la soppressione della reattività dei gruppi funzionali degli amminoacidi che non sono implicati nel legame peptidico. E’ necessario che siano liberi due gruppi funzionali: il gruppo carbossilico di un amminoacido e il gruppo amminico dell’altro amminoacido impiegati nella formazione del legame peptidico. Gli altri gruppi funzionali non devono reagire e per questo devono essere derivatizzati, legati, cioè, a molecole chiamate gruppi protettori. E’ inoltre importante che, alla fine della sintesi, i gruppi protettori possano essere rimossi senza danneggiare il peptide ottenuto.
La formazione del legame peptidico11 avviene mediante la rimozione di una molecola d’acqua fra i gruppi amminico e carbossilico dei due amminoacidi derivatizzati (Schema 2.1). Il successivo step è la liberazione del gruppo funzionale implicato nella formazione del secondo legame peptidico. La selettiva deprotezione di un gruppo funzionale è uno dei punti critici nella sintesi dei peptidi, in quanto è necessario che questa operazione avvenga senza incidere sugli altri gruppi protettori. Le operazioni di selettiva deprotezione e di coupling vengono ripetute fino a che la sequenza amminoacidica desiderata viene ottenuta. Infine tutti i gruppi protettori vengono rimossi in uno o due step per dare il prodotto desiderato.
La sequenza appena descritta si riferisce all’allungamento graduale della catena che consiste nell’incorporare nel peptide un amminoacido alla volta. Una via alternativa riguarda, invece, la realizzazione di piccoli peptidi che sono condensati tra loro per ottenere la sequenza peptidica finale.
La catena peptidica può essere costruita a partire dall’amminoacido carbossi terminale, con selettiva deprotezione del gruppo amminico, o a partire dall’amminoacido ammino terminale, con selettiva deprotezione del gruppo carbossilico della crescente catena.
Sintesi dei peptidi
Quando due gruppi protettori richiedono un meccanismo diverso per la loro rimozione vengono detti ortogonali. Un set di gruppi protettori indipendenti, ognuno rimovibile in presenza dell’altro, è definito un sistema ortogonale.
NH2-AA 3 -CO2H NH2-AA 2 -CO2H NH2-AA 1 -CO2H AA1 Pg1 CO2Pg4 H2N Pg5HN AA2 CO2H Pg2 AA1 Pg1 CO2Pg 4 HN Pg5HN AA2 CO Pg2 AA1 Pg1 CO2Pg4 HN H2N AA2 CO Pg2 Pg6HN AA3 CO2H Pg3 AA1 Pg1 CO2Pg4 HN HN AA2 CO Pg2 Pg6HN AA3 CO Pg3 AA1 COOH HN HN AA2 CO H2N AA3 CO Deprotezione selettiva Coupling Protezione Coupling Deprotezione finale
Schema 2.1 Schema generale per la formazione del legame peptidico.Pg1, Pg2, Pg3, Pg4, Pg5, Pg6 sono gruppi protettori. Pg5 deve essere differente da Pg1, Pg2
Pg4 e deve essere rimosso selettivamente.
2.2 Protezione dell’ammino gruppo
La natura del gruppo protettore sull’ammino gruppo gioca un ruolo fondamentale sul decorso della reazione di coupling. E’ necessario che un gruppo protettore possa essere introdotto e successivamente rimosso con elevate rese ed in modo selettivo. Inoltre un buon gruppo protettore deve essere stabile nelle condizioni della sintesi peptidica e della purificazione. Le due principali categorie di gruppi protettori sono il gruppo acilico e il gruppo alcossicarbonilico.
I sostituenti acilici 2.1 (Schema 2.2), in cui l’atomo di azoto è incorporato in un legame ammidico, sono usati raramente, in quanto la loro rimozione può avere
Sintesi dei peptidi
Fra i sostituenti acilici è da menzionare il gruppo trifluoroacetile 2.2 (Schema 2.2) che è introdotto mediante acilazione con l’anidride trifluoroacetica in acido trifluoroacetico o utilizzando gli esteri attivi fenil trifluoroacetato e etil trifluoraacetato (Schema 2.3). La rimozione del gruppo trifluoroacetile può essere effettuata in condizioni blande, in presenza di alcali o con basi organiche, senza influenzare gli altri legami ammidici della catena peptidica.
NH C O AA COOH R1 R
gruppo acilico trifluoroacetile NH C O AA COOH R1 F3C R=alchile R1=catena amminoacidica 2.1 2.2
Schema 2.2 Gruppo acilico e trifluoroacetile.
+ CH O O Pg 1 H2N CH O O Pg 1 HN O F3C + Pg1=gruppo protettore R=catena amminoacidica CF3 O C H2 + CH O O Pg 1 H2N O H3C CH O O Pg 1 HN O F3C + CH3CH2OH CF3 O F3C + CH O O Pg 1 H2N CH O O Pg 1 HN O F3C + O O OH F3C O
Protezione dell'amminoacido impiegando il fenil trifluoroacetato
Protezione dell'amminoacido impiegando l'etil trifluoroacetato
Protezione dell'amminoacido impiegando l'anidride tritrifluoroacetica
O O CF3 OH R R R R R R
Sintesi dei peptidi
Nella sintesi dei peptidi i gruppi protettori più utilizzati sono quelli di tipo uretanico o alcossicarbonile 2.3 (Schema 2.4), in cui è presente un atomo di ossigeno fra la porzione alchilica e il carbonile del sostituente acilico.
I più comuni gruppi alcossicarbonili sono il t-butossicarbonile 2.4 (Boc) benzilossicarbonile 2.5 (Cbz o Z), e il 9-fluorenilmetossicarbonile 2.6 (Fmoc) (Schema 2.4). NH C O O C CH3 H3C CH3 AA COOH R1 NH C O O H2 C AA COOH R1 NH C O O H2C AA COOH R1 2.5Z o Cbz=benzilossicarbonile NH C O O AA COOH R1 R uretano 2.3alchilossicarbonile 2.4Boc=tertbutossicarbonile 2.6 Fmoc=9-fluorenilmetossicarbonile R=alchile R1=catena amminoacidica
Schema 2.4 Gruppi di tipo uretanico.
I gruppi benzilossicarbonilico e il gruppo 9-fluorenilmetossicarbonile vengono introdotti mediante i loro derivati cloroformiati (Schema 2.5).
Sintesi dei peptidi C O O H2 C Cl + NaOH CH O O Pg 1 H2N CH HN C O O H2 C O O Pg1 NH C O O H2 C C H R C O O H2 C Cl + CH O O Pg1 H2N 2.6Fmoc NaOH 2.5 Z o Cbz O O Pg1 Pg1=gruppo protettore R=catena amminoacidica R R R H
Schema 2.5 Introduzione gruppi Fmoc e Z.
I derivati cloformiati vengono preparati facendo reagire i corrispondenti alcoli benzilico e 9-fluorenilmetilico con il fosgene.
Il gruppo Boc viene introdotto come diterbutildicarbonato (Schema 2.6), in quanto il corrispondente cloroformiato è instabile.
C O O C O O O + C O CH H2N OH R C O O C O O O C O CH OH R NH2 C O tBuO C tBuO O C O CH OH R N H O H C tBuO C O CH OH H N R=catena amminoacidica tBu tBu R tBu tBu O
Schema 2.6 Introduzione del gruppo Boc.
Il gruppo benzilossicarbonile viene rimosso mediante idrogenolisi con Pd/C o
Sintesi dei peptidi H2/ Pd + CO2 + + CH3 CH3
I drogenilisi d el carbammato benzilico H2 C O N H AA OH O R1 O HO NH AA OH O R1 O H2N AA OH R1 O H+ + CO2 + + Br -CH2+ CH2Br
Acidolisi del carbammato benzilico H2 C O N H A A OH O R1 O H2 C O N H AA OH OH R1 O HO N H AA OH O R 1 O H3N AA OH R1 O (HBr ) R1=catena amminoacidica Pg1=gruppo protettore
Schema 2.7 Rimozione gruppo Z.
Il gruppo Boc è labile in ambiente acido e viene rimosso mediante l’utilizzo dell’acido trifluoroacetico in CH2Cl2. L’acido protona l’ossigeno e si forma lo ione
ossonio. Successivamente si ha la scissione dei legami sigma con conseguente formazione del catione t-butilico, stabile in ambiente acido, e dell’anidride carbonica. Il catione t-butilico può dare, in un secondo momento, una reazione di eliminazione E1 con formazione del 2-metilpropene oppure reagire con l’acido trifluoroacetico con formazione del t-butil trifluoroacetato, mediante una sostituzione nucleofila SN1 (Schema 2.8)
Sintesi dei peptidi CF3COOH CH2Cl2 H + CH3 C H3C CH3 + CO2 + CH3 C H3C CH2 H CF3COO -CH3 C H3C CH2 + CF3COOH CH3 C H3C CH3 CF3COO -O C F3C O CH3 C H2C CH3 E1 SN1 R1=catena amminoacidica Pg1=gruppo protettore CH O Pg 1 H N R1 O C H3C H3C H3C C O CH O O Pg 1 H N R1 O C H3C H3C H3C C O CH O O Pg 1 H N R1 O C H3C H3C H3C C OH + CH O O Pg 1 H2N R1 O
Schema 2.8 Rimozione del gruppo Boc.
Il gruppo 9-fluorenilmetossicarbonile 2.6 viene invece rimosso in condizioni basiche blande (Schema 2.9). In presenza di un eccesso di piperidina il dibenzofulvene forma un addotto stabile con la base stessa. La driving force della reazione è l’eliminazione di CO2 dall’acido carbammico.
CO2 + + + R=catena amminoacidica NH C O O H2 C C H COOH R + NH C O O H2 C C H COOH R H CH2 + C NH O O CH COOH R N H2 C H H2N C H COOH R H N H2+ N
Sintesi dei peptidi
2.3 Protezione del gruppo carbossilico
Il gruppo carbossilico che non è implicato nel legame peptidico deve essere protetto per mascherare l’acidità del protone che interferisce nelle reazioni catalizzate dalle basi e per prevenire reazioni di addizione nucleofila al carbonile.
I principali gruppi protettori utilizzati sono: 1) benzilestere e suoi derivati 2) metilestere e suoi derivati 3) etilestere e suoi derivati 4) tert-butil estere e analoghi.
L’estere benzilico viene scisso mediante acidolisi in ambiente anidro, in cui il legame peptidico è stabile. L’estere benzilico viene rimosso anche mediante idrogenazione con Pd/C, che può risultare lenta per peptidi molto grandi. Quindi,
in alternativa , si può effettuare l’idrogenazione con Pd/C e HCOOH in MeOH: la rimozione è veloce a temperatura ambiente ed in queste condizioni avviene anche la rimozione del gruppo Cbz. L’acido formico, inoltre, è un buon solvente per la maggior parte dei peptidi.
L’estere metilico viene rimosso mediante saponificazione acquosa utilizzando alcali in presenza di solventi organici quali MeOH, diossano e acetone. Anche se si lavora con quantità stechiometriche e a basse temperature, si può avere il fenomeno della racemizzazione. L’estere metilico è un ottimo gruppo protettore se non deve essere rimosso al completamento della sequenza.
Gli etil esteri sono molto simili agli esteri metilici anche se sono più resistenti alla saponificazione.
Il gruppo t-butilico è rimovibile per acidolisi. Viene generalmente rimosso con HCl in solventi organici, TFA in CH2Cl2 in presenza di Et3SiH.
Questi gruppi protettori possono essere impiegati anche per la protezione del gruppo carbossilico della catena laterale.
2.4 Formazione del legame peptidico e dell’ossazolone
Il gruppo ammonio dell’amminoacido implicato nel legame peptidico deve essere convertito in un nucleofilo mediante l’aggiunta di un ammina terziaria in situ disciolta nel solvente di reazione. Invece, il gruppo carbossilico,
Sintesi dei peptidi
separatamente o in presenza dell’altro componente mediante l’addizione di un reagente che trasforma il gruppo carbossilico in un centro elettrofilo; ciò è reso possibile legando all’atomo di carbonio del gruppo carbonilico un gruppo elettron-attrattore Y. L’attacco dell’ammina nucleofila all’atomo di carbonio elettrofilo, con conseguente formazione del legame peptidico, determina la rimozione del gruppo attivante come anione (Schema 2.10).
R3NH+ R3N CH O O Pg 1 CH R1 O Y HN Ο R +H 3N CH R1 O HN Ο R HN CH O O Pg 1 Peptide Y H+ R = alchile, alcossi Pg1=gruppo protettore R1,R2=catena amminoacidica R2 CH O O Pg 1 H2N R2 R2
Schema 2.10 Formazione del legame peptidico.
In molti casi la reazione di coupling non è così lineare, ma può avvenire una reazione secondaria che dipende dalla natura del componente attivato. L’atomo di ossigeno del carbonile, adiacente all’atomo di azoto sostituito, può agire da nucleofilo e competere, per l’attacco al centro elettrofilo, con il gruppo amminico nucleofilo, generando un composto ciclico, l’ossazolone. La reazione intermolecolare (via A) genera il legame peptidico, mentre la reazione intramolecolare (via B) da origine all’ossazolone (Schema 2.11).
La formazione dell’ossazolone inizia con la rimozione di un protone, da parte di una base, dall’atomo di azoto, del componente con il gruppo carbossilico attivato, che inizia la ciclizzazione a cui segue un riarrangiamento di elettroni con lo shift del doppio legame da C═O a C═N con l’attacco simultaneo dell’ossigeno nucleofilo all’atomo di carbonio elettrofilo.
L’atomo di azoto nucleofilo nella reazione di coupling è una base così debole che il gruppo amminico promuove la formazione dell’ossazolone allo stesso tempo di come l’azoto nucleofilo partecipa alla formazione del legame peptidico.
Sintesi dei peptidi CH O Y HN Ο R1 R C O Y C C N R1 O R H H Base O C N C C R1 R H O B CH O HN Ο R1 HN CH O O Pg 1 Peptide CH NH2 O O Pg 1 A A Amminoacido attivato R R2 R2 Ossazolone R1=gruppo protettore R=catena amminoacidica Y=gruppo attivante Ammina Y H+
Schema 2.11 Formazione del legame peptidico e dell’ossazolone.
La formazione dell’ossazolone è inoltre favorita dal fatto che i gruppi implicati nella ciclizzazione sono separati da un numero di atomi tali da portare alla formazione di un anello a cinque termini. Gli ossazoloni sono numerati a partire dall’atomo di ossigeno dell’anello a cinque termini. Da ciò deriva il nome 2,4-Dialchil-5(4H)-ossazolone con i sostituenti alchilici in posizione 2 e 4, se il gruppo protettore dell’ammino gruppo è di tipo acilico (tra parantesi viene indicato la posizione dell’atomo di idrogeno). Se, invece, il gruppo protettore dell’ammino gruppo è un gruppo di tipo uretanico si ha il 2-alcossi-5(4H)-ossazolone Si può ottenere, anche se raramente, il 2,4-Dialchil-5(2H)-2-alcossi-5(4H)-ossazolone con il doppio legame in posizione 3. I 2,4-Dialchil-5(2H)-ossazoloni possono essere ottenuti quando gli N-trifluoroacetilammino acidi attivati ciclizzano o quando i 2,4-Dialchil-5(4H)-ossazoloni derivati dagli N-formilammino acidi si trovano in presenza di un’ammina terziara (Schema 2.12).
Sintesi dei peptidi O C N C C C R H O R1 R2 R3 O C N C C O R5 H O R4 O C N C C O R R6 H 2,4-Dialchil-5(4H)-Ossazolone 2,4-Dialchil-5(2H)-Ossazolone 2-alcossi-5-(4H)-Ossazolone 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5
Schema 2.12 Nomenclatura ossazoloni.
2.5 Racemizzazione dell’amminoacido
La racemizzazione degli amminoacidi costituisce un grave problema nella sintesi dei peptidi, in quanto la presenza di uno o più amminoacidi racemizzati determina la formazione di epimeri. Se la molecola presenta uno o più amminoacidi racemizzati e se questi si trovano in un punto critico, la struttura tridimensionale del peptide può essere così diversa da comportare una perdita dell’attività biologica.
I meccanismi che stanno alla base della racemizzazione sono 1) l’enolizzazione diretta e 2) la formazione dell’ossazolone.
1) L’enolizzazione diretta, attraverso la tautomeria cheto-enolica, spiega la racemizzazione molto lenta degli amminoacidi non attivati al carbossile. La tautomeria cheto-enolica può avvenire mediante catalisi basica o acida (Schema 2.13). L’enolato che si forma è planare dove l’amminocido con configurazione L ha perso il proprio centro chirale. Sulla specie enolato, quando si riforma il carbonile, l’atomo di idrogeno può attaccare da sopra o da sotto il piano molecolare, generando un miscela di enantiomeri con configurazione L e D. Questa reazione dipende fortemente dalla basicità e dalla temperatura della soluzione ed è influenzata dal carattere elettron-attrattore dei sostituenti X, Pg1 e R. Nelle condizioni normali di reazione, richieste per la sintesi degli amminoacidi, la racemizzazione, mediante enolizzazione diretta, è così lenta che può essere trascurata; diventa, invece, molto importante quando il peptide viene sottoposto a condizioni molto basiche o ad alte temperature.
Sintesi dei peptidi C R1HN C O Pg1 H+ R C 1HN C OH+ Pg1 C R1HN C+ OH Pg1 C R1HN C OH Pg1 C R1HN C OH+ Pg1 H R C R1HN C OH+ Pg1 R H C R1HN C O Pg1 H R C R1HN C O Pg1 R H H R R H R H R C R1HN C O Pg1 H R OH -- C R1HN C O Pg1 R C R1HN C O -Pg1 R C R1HN C O Pg1 R C R1HN C O Pg1 H R C R1HN C O Pg1 R H H+ -H+ L-Amminoacido D-Amminoacido L-Amminoacido -H+
Tautomeria cheto-enolica mediante catalisi acida
L-Amminoacido
+
D-Amminoacido L-Amminoacido
Tautomeria cheto-enolica mediante catalisi basica
+ +
H+
H OH
R1, Pg1=gruppo protettore R=catena amminoacidica
Schema 2.13 Tautomeria cheto-enolica mediante catalisi acida e basica.
2) Il secondo meccanismo, che determina la racemizzazione, riguarda la formazione dell’intermedio ciclico ossazolone degli amminoacidi attivati al carbossile. Poiché è un processo più veloce dell’enolizzazione diretta, questo meccanismo è quello che sta alla base della racemizzazione degli amminoacidi durante la sintesi peptidica.
L’ossazolone costituisce un substrato attivato che possiede la stessa chiralità dell’amminoacido di partenza. L’ossazolone formato può dare due tipi di reazioni: 1) amminolisi e 2) racemizzazione.
1) L’amminolisi porta alla formazione del peptide con la stereochimica desiderata. L’ossazolone, infatti, si comporta da acilante e reagisce con nucleofili come il gruppo amminico di un amminoacido . (Schema 2.14).
Sintesi dei peptidi C O Y C C N R1 O R H H O C N C C R1 H R O O C N C C R1 R H O O C N C C R1 H R N H O -C C H R N H O N H peptide C O R1 N H N L-ossazolone L-ossazolone NH2-peptide R1-CO-NH-L-AA-peptide N Y -N H + peptide : R1=alchile, alcossi R=catena amminoacidica Y=gruppo attivante - H+ R1-CO-NH-L-AA attivato
Schema 2.14 Amminolisi dell’ossazolone.
La racemizzazione dell’ossazolone avviene attraverso l’enolizzazione che è un processo molto più veloce rispetto alla semplice enolizzazione di un amminoacido, in quanto il protone su carbonio chirale è più acido (Schema 2.15).
O C N C C R1 R H O N O C N C C R1 R O L-ossazolone enolato O C N C C R1 R O -O C N C C R1 R O O C N C C R1 R H O L-ossazolone O C N C C R1 R H O D-ossazolone N H NH2-peptide C C H R N H O N H peptide C O R1 R1-CO-NH-L-AA-peptide C C H R N H O N H peptide C O R1 R1-CO-NH-D-AA-peptide + + : R1=gruppo protettore R=catena amminoacidica
Sintesi dei peptidi
L’idrogeno legato al carbonio chirale è più acido, in quanto gode, oltre che dell’effetto di risonanza tipico di una specie enolato, anche dell’effetto induttivo –I esercitato dall’adiacente atomo di azoto e dalla possibilità di delocalizzare la carica negativa anche su un atomo di carbonio adiacente all’ossigeno del sistema ossazolonico e quindi godere dell’effetto induttivo –I di questo. La rimozione del protone, ad opera di una base, dell’ ossazolone porta alla formazione dell’anione enolato, che ha perso il proprio centro chirale. Si forma un sistema coniugato che determina un aumento dell’acidità di quel protone rispetto all’amminoacido di partenza. Sulla specie enolato, la protonazione può avvenire sia dalla faccia di sopra che dalla faccia di sotto a generare due ossazoloni enantiomeri in eguale quantità con configurazione L e D. L’amminolisi dei due ossazoloni porta alla formazione di due peptidi diasteroisomeri.
Le velocità delle reazioni di amminolisi e di racemizzazione sono quasi uguali ed è quindi opportuno, durante la sintesi dei peptidi, impedire la formazione dell’ossazolone, per non danneggiare la molecola che si sta sintetizzando che può perdere la propria chiralità.
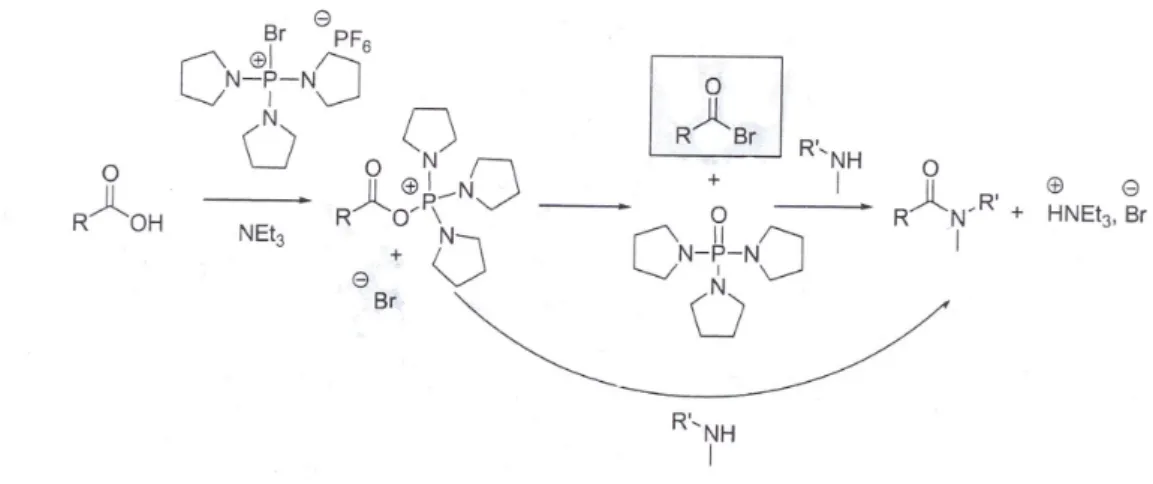
2.6 Attivazione del gruppo carbossilico
Il gruppo carbossilico di un amminoacido può essere attivato mediante la preparazione di cloruri acilici, azidi aciliche, imidazoli acilici, anidridi simmetriche, esteri attivi12.
Ci sono differenti modi per effettuare la reazione di coupling fra l’amminoacido attivato al carbossile e l’amminogruppo dell’altro amminoacido impiegato nel legame peptidico:
● l’agente acilante intermedio viene prima formato e isolato e poi sottoposto ad amminolisi
● l’agente acilante reattivo viene formato dalla derivatizzazione del gruppo carbossilico in uno step separato e poi fatto immediatamente reagire con l’ammina
● l’agente acilante viene generato in situ mediante derivatizzazione del gruppo carbossilico in presenza dell’ammina, con l’aggiunta di un agente attivante o di
Sintesi dei peptidi
Come descritto nel paragrafo precedente, la formazione del legame peptidico può presentare come difficoltà il fenomeno della racemizzazione. Per evitare questo inconveniente, sono stati introdotti numerosi reagenti di coupling e sono stati sviluppati nuovi metodi in grado di prevenire la racemizzazione dei centri chirali. Il principale meccanismo di racemizzazione avviene mediante la formazione dell’ossazolone quando il gruppo carbossilico è attivato.
La catena peptidica viene, quindi, fatta crescere dalla parte N-terminale e l’attivazione deve avvenire in condizioni blande. In questo approccio l’attivazione viene effettuata su un α-amminoacido protetto all’amminogruppo, evitando la formazione dell’ossazolone.
2.6.1 Cloruri acilici
Il metodo più immediato per la formazione del legame peptidico è quello di trasformare il gruppo carbossilico di un amminoacido in un cloruro acilico e farlo poi reagire con l’ammino gruppo del secondo amminoacido, coinvolto nel legame peptidico.
I reagenti più utilizzati per la formazione dei cloruri acilici sono: il cloruro di tionile SOCl2 4, cloruro di ossalile (COCl)2 5, tricloruro di fosforo PCl3,
ossicloruro di fosforo POCl3 e pentacloruro di fosforo PCl5. Il pentacloruro di
fosforo è generalmente usato per gli acidi aromatici che contengono sostituenti elettron-attrattori e che non reagiscono facilmente con il cloruro di tionile 4. Il meccanismo per la formazione del cloruro acido usando cloruro di tionile o cloruro di ossalile è illustrato nello schema 2.16.
Sintesi dei peptidi R O OH Cl S O Cl 4 R O OSCl O + R O Cl Cl O O Cl 5 R O O O O Cl + R O Cl H Cl H Cl + SO2+ HCl +CO2+ CO + HCl
Schema 2.16 Formazione del cloruro acilico mediante l’utilizzo del cloruro di
tionile e del cloruro di ossalile.
Queste reazioni sono spesso promosse dall’addizione di DMF. Il ruolo catalitico della DMF è descritto nello schema 2.17.
Schema 2.17 Ruolo catalitico della DMF.
Uno dei maggiori svantaggi nella formazione dei cloruri acilici è lo sviluppo di HCl. Alcuni substrati, come gli amminoacidi che hanno il gruppo amminico
Sintesi dei peptidi
protetto con il gruppo Boc, sono sensibili agli acidi e non richiedono, quindi, condizioni acide.
I cloruri acilici possono anche essere formati in condizioni neutre, mediante l’utilizzo della trifenilfosfina, PPh3, e il tetracloruro di carbonio CCl4.
Inizialmente avviene la formazione del trifeniltriclorometilfosfonio cloruro
seguita dall’attacco dell’acido carbossilico con formazione del
trifenilalcossifosfonio cloruro e del cloroformio. Infine, dopo l’attacco dello ione cloruro al carbonio carbonilico si ha la formazione del cloruro acilico e l’ossido della trifenilfosfina (Schema 2.18).
Schema 2.18 Formazione dei cloruri acilici usando TPP e CCl4.
Il legame peptidico si forma in seguito alla reazione fra il cloruro acilico e la corrispondente ammina. Generalmente viene aggiunta una base per neutralizzare l’acido cloridrico che si forma. La reazione di coupling avviene in solventi inerti anidri in presenza di un’ammina terziaria non nucleofila (NEt3, iPr2NEt). I cloruri
acilici sono abbastanza stabili per effettuare il coupling in condizioni acquose, per esempio, in presenza di NaOH.
Questa reazione può essere accelerata in presenza di quantità catalitiche di piridina o N,N-dimetilamminopiridina (DMAP). In questi casi la piridina è utilizzata come solvente. Si ha la formazione del sale acilpiridinio come intermedio che reagisce con l’ammina per dare il prodotto di coupling (Schema 2.19). L’uso dello zinco metallico può accelerare il coupling a temperatura ambiente. Questo metodo è applicabile ad alchili, arili, eterocicli, carboidrati e amminoacidi, con elevate rese.
Sintesi dei peptidi R O Cl + N + RNH2 N O R Cl + RNH2 R O NHR + N
Schema 2.19 Ruolo catalitico della piridina.
Nella sintesi peptidica l’uso dei cloruri acilici è stato limitato, in quanto possono dare idrolisi, racemizzazione e determinare la rimozione dei gruppi protettori sensibili agli acidi. Il cloruro acilico può dare racemizzazione in presenza di basi, in quanto, mediante la rimozione del protone in α al carbonile, si forma il chetene, che ha perso la configurazione del centro chirale. Il chetene reagisce con l’ammina per dare una miscela di prodotti racemi (Schema 2.20).
Inoltre il cloruro acilico degli amminoacidi è troppo attivo e, in presenza di basi, può ciclizzare spontaneamente formando l’ossazolone che può racemizzare e portare alla formazione di una miscela di enantiomeri.
Schema 2.20 Racemizzazione attraverso la formazione del chetene.
2.6.2 Azidi aciliche
Le azidi aciliche sono state uno dei primi reagenti ad essere impiegati nella sintesi dei peptidi, con il metodo Curtius. Le azidi aciliche possono essere preparate dai corrispondenti metil esteri in due step di sintesi. L’iniziale reazione dell’estere con l’idrazina genera l’acil idrazide, che poi subisce una reazione di nitrosazione per dare l’acile azide finale (Schema 2.21).
Sintesi dei peptidi
Schema 2.21 Formazione del legame peptidico via azidi aciliche.
Questo è di solito un efficiente metodo di coupling che non porta a nessuna racemizzazione e che garantisce l’integrità stereochimica del peptide, in quanto non da luogo al corrispondente ossazolone. La non formazione dell’ossazolone potrebbe essere dovuta al fatto che la ciclizzazione è impedita dalla presenza del legame a idrogeno formato tra l’atomo di azoto dell’azido gruppo ed il protone – NH del residuo attivato (Schema 2.22).
CH R2 N C O N R N N H legame a idrogeno
Schema 2.22 Formazione del legame a idrogeno azidi aciliche.
E’ un metodo laborioso che può portare ad una reazione secondaria, il riarrangiamento di Curtius, che porta alla formazione dei corrispondenti isocianati indesiderati (Schema 2.23).
Sintesi dei peptidi
2.6.3 Acilimidazoli con l’impiego di CDI
Il carbonil diimidazolo (CDI) è un reagente di coupling che permette la formazione del legame ammidico one-pot. L’acil carbossi imidazolo e l’imidazolo vengono inizialmente formati e poi fatti reagire insieme per dare la corrispondente specie attivata l’acilimidazolo (Schema 2.24). L’ acilimidazolo si forma dopo un’ora e poi viene aggiunta l’ammina. Questa reazione che genera imidazolo in situ, non necessita di una base addizionale ed è quindi compatibile con i sali clorurati dell’ammine. Questo reagente è comunemente usato su larga scala nella sintesi dei peptidi e il suo uso può essere esteso alla formazione di esteri e tioesteri.
Schema 2.24 Formazione del legame ammidico usando CDI.
Con uno step di attivazione simile a quello dell’utilizzo del CDI 1’ N-N’-carbonilbis(3-metilimidazolio) triflato (CBMIT) è stato descritto come un efficiente reagente amminoacilante per la sintesi dei peptidi (Figura 2.25).
Sintesi dei peptidi
2.6.4 Anidridi
Le anidridi sono composti che reagiscono con una vasta gamma di nucleofili come alcoli, tioli e naturalmente ammine. Questa strategia utilizza sia delle semplici anidridi simmetriche sia le più raffinate anidridi miste che includono, per esempio, le isouree o le specie derivate dell’acido fosforico.
2.6.4.a Anidridi simmetriche
La diversità delle anidridi disponibili commercialmente è abbastanza limitata ed quindi è necessario preparare la desiderata anidride.
Le anidridi simmetriche vengono preparate o riscaldando il corrispondente acido o, in condizioni blande, facendo reagire due molecole di acido in presenza di due equivalenti di dicloesilcarbodiimmide (DCC) (Schema 2.26). Come sottoprodotto di reazione si forma l’urea.
L’anidride è poi fatta reagire in un secondo step con un’ammina. In teoria, non è richiesta l’addizione di una base per generare l’anione carbossilato in situ. Questo metodo di coupling blando ed efficiente è compatibile con la formazione del legame peptidico.
Sintesi dei peptidi
La principale limitazione è che soltanto la metà dell’acido reagisce in maniera efficace mentre l’altra metà non reagisce. Questo potrebbe essere un problema se l’acido è costoso.
2.6.4.b Anidridi carbossiliche miste
Per risolvere il problema della perdita di una molecola di acido, sono stati sviluppati vari metodi che utilizzano anidridi miste. Questi metodi prevedono l’impiego di un secondo gruppo carbossilico economico e che si leghi facilmente all’acido. La difficoltà consiste nella regioselettività dell’addizione nucleofila per la posizione a o per la posizione b (Schema 2.27). L’anidride mista pivalica è uno dei rari composti di questa serie. Infatti, l’amminolisi selettiva verso una delle due posizioni è dovuta all’ingombro sterico del gruppo t-butilico.
Schema 2.27 Reazione di coupling attraverso due step, via anidride pivalica.
2.6.4.2.c Anidridi carboniche miste
Una strategia per differenziare i due centri reattivi prevede l’utilizzo delle anidridi carboniche miste. L’introduzione di un ulteriore atomo di ossigeno riduce l’elettrofilicità del carbonile in b stabilizzato dalla risonanza e rende il carbonio carbonilico del centro a più reattivo.(Schema 2.28).
C H C O O H N R C O OR2 HC C O O H N R C O OR2 a b a b R1 R1
Sintesi dei peptidi
Le anidridi si formano per reazione fra l’alchil cloro formiato e il gruppo carbossilico dell’amminoacido. Una ammina terziaria è necessaria per deprotonare l’acido carbossilico e reagire con il cloroformiato. Un eccesso di cloroformiato reagirebbe con l’ammina a dare l’uretano ed è quindi necessario utilizzare tempi brevi di attivazione a basse temperature (-5/-10° C). E’ stato osservato che l’ammina, come la N-metilmorfolina, non sia un semplice catturante di protoni, ma che funzioni da trasportatore di un acile sottoforma di acilmorfolino catione. Infatti la DIPEA non è efficace in questa reazione. Si usa l’etil o l’isobutil cloroformiato ed anche l’isopropil cloroformiato.
Le anidridi etossicarboniliche possono essere generate mediante l’utilizzo dell’etilcloroformiato (Schema 2.29) o del 2-etossi-1-etossicarbonil-1,2- diidrochinolina (EDDQ) (Schema 2.30).
In condizioni acide l’etanolo è eliminato dall’EDDQ, generando il sale reattivo etil formiato di chinolina. Questo intermedio ha una reattività simile al sale di piridinio descritto per i cloruri acilici e reagisce col desiderato carbossilato per formare l’anidride etossicarbonilica desiderata. Questa reazione genera come prodotto indesiderato la chinolina aromatica.
C H C O OH H N R NMM HC C O O H N R C Cl O OEt C H C O O H N R C O OEt R2NH2 C H C O H N R N H + C HO O OEt R1 R1 R1 R1 R2
Schema 2.29 Reazione di coupling attraverso due step, via etil anidride
carbonica.
Sintesi dei peptidi
2.6.4.d N-Carbossi anidridi o anidridi di Leuch’s
Le N-carbossi anidridi sono state ampiamente studiate e utilizzate da Leuch. Le anidridi cicliche possono essere preparate dalla reazione fra un amminoacido non protetto e il fosgene. In alternativa la procedura consiste nella reazione fra un amminoacido N-protetto con cloruro di tionile e DMF (Schema 2.31). In questo caso l’acido cloridrico reagisce con il carbonile del vicino carbammato per dare la corrispondente N-carbossi anidride (NCA).
Schema 2.31 Preparazione NCA.
2.6.4.e) O-Acilisouree
Il concetto di anidride mista può essere esteso ai derivati O-acilisourea che si formano per reazione tra l’acido carbossilico e una carbodiimmide.
La dicloesilcarbodiimmide (DCC), la diisopropilcarbodiimmide (DIC) e il sale cloruro dell’1-etil-3(3’-dimetilammino) carbodiimmide (EDC o WSC · HCl) (Schema 2.32) sono frequentemente usati per la formazione del legame peptidico. In questa procedura one-pot non è prevista l’aggiunta di un’ammina.
Sintesi dei peptidi
La carbodiimiide reagisce con l’acido carbossilico per formare l’anidride mista O-acilisourea (Schema 2.33). Questo intermedio può direttamente reagire con l’ammina per dare la desiderata ammide e l’urea come sottoprodotto.
Schema 2.33 Reazione one-pot con le carbodiimmidi.
Spesso sono state osservate reazioni di racemizzazione e formazione di un composto non reattivo l’N-acilurea per trasferimento dell’acetile (Schema 2.34). Questa reazione secondaria può essere considerevolmente diminuita facendo reagire l’acido e il reagente di coupling a 0 °C prima dell’aggiunta dell’ammina. La formazione dell’ N-acilurea può essere inoltre soppressa con l’addizione di un nucleofilo selettivo come l’HOBt (Schema 2.34) o l’HOSu (Schema 2.35), che reagisce con l’ O-acilisourea a formare un intermedio ancora più reattivo per il coupling. In questo modo viene inoltre ridotta la formazione dell’ossazolone e se questo si forma il nucleofilo reagisce prima che questo possa epimerizzare.
Schema 2.34 Utilizzo dell’HOBt per ridurre la formazione della non reattiva
Sintesi dei peptidi C H C O H N R O C N NH N O OH O + H C C O -H N R C N NH O O H N O O C C H O R' H N R C N NH O O H N O O C C H O R' H N R O N O O + C NH H N O DCU R1 R1
Schema 2.35 Utilizzo dell’HOSu per ridurre la formazione della non reattiva
N-acilurea.
La formazione dell’ N-acilurea può essere inoltre soppressa per addizione di HOBt in quanto la O-acilisourea viene ad essere protonata. In aggiunta all’effetto protonante che impedisce l’isomerizzazione a N-acilurea, lo stesso effetto protonante fa della O-acilurea una specie più elettrofila che quindi si consuma facilmente e più velocemente. Allo stesso tempo l’azione protonante dell’HOBt genera la base coniugata –OBt che è un nucleofilo forte che consuma anche più velocemente la O-acilurea (Schema 2.36).
Sintesi dei peptidi C CH O H N R O C N NH HOBt C CH O H N R O C N H NH C CH O H N R O C N H NH R=gruppo protettore R1=catena amminoacidica R1 R1 R1
Schema 2.36 Effetto protonante dell’HOBt.
La differenza di solubilità dell’uree, generate da ciascun reagente come sottoprodotto, può essere un vantaggio da sfruttare durante i processi di purificazione. Ad esempio, la dicicloesil urea DCU è insolubile e può essere eliminata mediante filtrazione. Al contrario, la dimetilammino-3-etilurea è estremamente solubile in acqua e può essere eliminata mediante lavaggi acquosi.
2.6.5 Alchil esteri
Gli alchil esteri (metil, etil, benzil esteri) non possono essere considerati specie attive e sono comunemente usati come gruppi protettori nella sintesi dei peptidi. Gli alchil esteri possono, a volte, essere attaccati dalle ammine in condizioni non blande che prevedono l’impiego di alte temperature o l’addizione di acidi di Lewis.
Sintesi dei peptidi
2.6.6 Esteri attivi
Gli esteri attivi così come gli esteri aromatici danno più facilmente idrolisi rispetto agli esteri alchilici e reagiscono con una larga quantità di nucleofili. Inoltre reagiscono con le ammine in condizioni blande, riducendo la racemizzazione. Nello schema 2.37 sono rappresentati gli alcoli più comunemente utilizzati. L’aumento dell’elettrofilicità del centro carbonilico, rispetto agli alchil esteri, dipende dal carattere elettron-attrattore degli alcoli utilizzati.
R O O R'' R'NH2 NR3 R O NHR' + R''OH R''OH: HO NO2 F HO F F F F Cl HO Cl Cl N O O HO N N N HO N N N N HO HO N O O
PNP pentafluorufenolo 2,4,5-triclorofenolo HONB
HOSu HOAt
HOBt
Schema 2.37 Gli alcoli più utilizzati nella formazione degli esteri attivi.
I primi esteri di questo tipo sono stati i p-nitrofenil derivati. L’effetto induttivo –I del gruppo nitro e l’effetto di risonanza, rendono l’estere meno stabile (risonanza) ed il carbonio carbonilico più elettrofilo (effetto –I) e quindi più reattivo. L’inconveniente era dovuto al fatto che il p-nitrofenolo liberato nel processo di amminolisi non era facilmente allontanabile (non solubile in acqua) (Schema 2.38).
Sintesi dei peptidi C H C O OH H N R NO2 HO C H C O O H N R NO2 C H C O O H N R N O O R=gruppo protettore R1=catena amminoacidica R1 R 1 R1
Schema 2.38 Impiego del paranitrofenolo.
Più efficaci sono gli esteri attivati derivati da acidi idrossammici. Tra questi dobbiamo ricordare il più versatile: l’estere succinimmidico. Questo si prepara facendo uso della N-idrossisuccinimmide. Un altro esempio è dato dall’ 1-idrossibenzotriazolo (HOBt).
Il derivato succinimmidico, dopo reazione di amminolisi, libera la N-idrossisuccinimmide che è solubile in acqua e può essere allontanata facilmente (Schema 2.39).
Nel caso degli esteri attivati, ottenuti mediante l’N-idrossisuccinimmide e l’1-idrossibenzotriazolo, l’effetto attivante non è riconducibile al solo effetto –I del sostituente, ma anche ad un processo di assistenza che rende più veloce la reazione di amminolisi (Schema 2.39 e Schema 2.40).
L’ammina viene trasportata nelle vicinanze del carbonio carbonilico da un efficace processo di coordinazione con il vicino ossigeno del gruppo carbonilico e quindi, in questo modo, per fattori entropici, il processo viene ad essere velocizzato.
Sintesi dei peptidi C H C O R1 H N R O N O O N H H R2 legame a idrogeno C H C O R1 H N R O N O O NH2 R2 C H C OH R1 H N R O N O O HN R2 : C H C O R1 H N R N H R2 + HO N O O R=gruppo protettore R1,R2=catena amminoacidica
Schema 2.39 Impiego dell’idrossisuccinimmide.
C H C O R1 H N R O N N N N H H R2 NH2R2 C H C O R1 H N R O N N N NH2 R2 C H C OH R1 H N R O N N N HN R2 : N N N C H C O R1 H N R N H R2 + R=gruppo protettore R1,R2=catena amminoacidica HO
Schema 2.40 Impiego dell’idrossibenzotriazolo.
Un altro reagente comunemente utilizzato è il pentafluorofenolo (PFP). Gli esteri derivati dal pentafluorofenolo vengono preparati dagli acidi eterociclici, dove la DCC e la DCI si sono rilevate inefficaci.
Sintesi dei peptidi
dicarbossiimmide HONB. Gli esteri 2,4,5-triclorofenilici, inoltre, sopprimono il fenomeno della racemizzazione più efficacemente degli esteri derivati dall’N-idrossisuccinimmide.
L’idrossi-7-azabenzotriazolo (HOAt) è stato riportato essere più efficientie rispetto all’HOBt in alcuni casi di coupling con basi ingombrate. L’aumento dell’efficienza è dovuto alla chelazione da parte dell’azoto della piridina durante lo step di amminolisi (Schema 2.41).
Schema 2.41 Chelazione con HOAt.
Gli esteri possono essere preparati, purificati e conservati per molto tempo. Alcuni amminoacidi si trovano disponibili in commercio come i loro benzotriazolo esteri. Gli esteri attivi sono generalmente preparati utilizzando i metodi standard di formazione degli esteri citati nei paragrafi precedenti.
2.6.7 Procedura one-pot
Le reazioni di coupling possono essere effettuate secondo una procedura one-pot, dove l’acido carbossilico è attivato in situ come estere e fatto reagire con l’ammina. Questo può essere ottenuto semplicemente aggiungendo quantità catalitiche o stechiometriche di HOBt nelle condizioni standard di coupling con DCC. Più recentemente sono stati sviluppati reagenti di coupling che incorporano il fenolo e sono disponibili in commercio. Essi possono essere raggruppati secondo la loro natura come sali di uronio, fosfonio e immonio. Tra questi reagenti sono stati sviluppati sali derivati di HOBt e HOAt.
Sintesi dei peptidi
2.6.7.a Sali di fosfonio
Il Benzotriazolo-1-il-ossi-tris-(dimetilammino)-fosfonio esafluorofosfato (BOP) è anche chiamato reagente di Castro ed è stato il primo esempio, descritto in letteratura, di questi reagenti. La reazione di coupling one-pot avviene mescolando l’acido desiderato con l’ammina in presenza di BOP e trietilammina. L’acido deprotonato reagisce con il BOP per generare l’acilfosfonio, un intermedio reattivo, e l’HOBt. L’idrossibenzotriazolo reagisce con l’acido attivato per produrre l’estere reattivo benzotriazolo, il quale reagisce con l’ammina. Questa reazione genera come uno dei sottoprodotti il corrispondente ossido (Schema 2.42).
Schema 2.42 Procedura di coupling utilizzando BOP.
Il reagente di Castro è molto efficace, ma genera la triammide esametilfosforica, che è estremamente tossica. Per questo scopo è stato sviluppato l’analogo Benzotriazolo-1-il-ossi-tris-pirrolidino-fosfonio esafluorato fosfato (PyBop) che genera una triammide meno tossica.
Alcuni N-metil-α-ammino acidi danno reazioni di coupling molto lente, con basse rese e tendono a racemizzare, anche utilizzando reagenti come PyBop o BOP. Una spiegazione è data dal fatto che l’estere intermedio attivo benzotriazolo è troppo ingombrante per reagire facilmente con un’ammina secondaria, dando origine alla racemizzazione. Sono stati, quindi, sviluppati altri reagenti di coupling che non includessero la struttura del benzotriazolo. Per esempio, il bromotri(pirrolidino)fosfonio esafluorofosfato (PyBrop) (Schema 2.43) è un efficace reagente di coupling per gli N-metilati ammino esteri. L’effetto deterrente
Sintesi dei peptidi
dell’HOBt può essere confermato dal fatto che aggiungendolo alla miscela di coupling aumenta la degradazione e la racemizzazione.
Schema 2.43 Procedura di coupling one-pot utilizzando PyBrop.
Un meccanismo d’azione proposto suggerisce la formazione in situ dell’acilbromuro.
La tabella 2.1 mostra altri sali di fosfonio utilizzati come reagenti di coupling.
Sintesi dei peptidi
2.6.7.b Sali di uronio
Un’altra famiglia di reagenti di coupling sviluppati sono i derivati specie
uronio come l’O-(1H-benzotriazolo-1-il)-N,N,N’,N’-tetrametiluronio
esafluorofosfato (HBTU) o il suo tetrafluoroborato equivalente TBTU. Il controione non ha influenza sulla reattività. La reazione di coupling avviene con un meccanismo simile a quello che avviene impiegando i sali di fosfonio. In questi casi il sottoprodotto che si forma è l’urea (Schema 2.44).
Schema 2.44 Procedura di coupling one-pot utilizzando HBTU o TBTU.
In soluzione, la specie uronio benzotriazolo (forma-O) è in equilibrio con la specie guanidinio (forma-N). La specie guanidinio è una forma cristallina (Schema 2.45). L’HATU è un efficace reagente di coupling anche in presenza di composti stericamente ingombrati, dando un basso livello di racemizzazione. Si ha la formazione del 7-azabenzotriazolo-1-il estere, una specie molto reattiva nei confronti delle ammine.
Schema 2.45 Equilibrio fra le specie uronio e guanidinio.
HBTU:X=C HATU:X=N
Sintesi dei peptidi
Le specie uronio sono anche note come agenti di guanidilazione (Schema 2.46).Questa reazione secondaria può essere ridotta mediante l’aggiunta di HOBt alla miscela di reazione.
Schema 2.46 Formazione della guanidina come sottoprodotto usando HBTU.
Come per i sali di fosfonio (PyBrop) una limitazione degli esteri attivi, come l’estere benzoitriazolo, è rappresentato dall’ingombro sterico durante lo step di amminolisi. Sono stati, quindi, sviluppati nuovi reagenti di coupling per risolvere questo problema. Per esempio, l’ O-(etossicarbonil)cianometil ammino)-N,N,N’,N’-tetrametil-uronio tetrafluoroborato (TOTU) genera un’ acil ossima attivata ed è stata osservata una bassa racemizzazione nella sintesi dei peptidi (Schema 2.47).
Schema 2.47 Procedura di coupling one-pot usando TOTU.
Sintesi dei peptidi
Tabella 2.2 Sali di Uronio.
2.7 Strategie per la sintesi di peptidi enantiomericamente puri
Per impedire, quindi, la racemizzazione dell’amminoacido, si può intervenire o 1) evitando la formazione dell’ossazolone o 2) evitando la racemizzazione dell’ossazolone quando questi si forma.
1) La velocità di formazione dell’ossazolone, che si genera in seguito all’attacco del carbonile al carbossile attivato, dipende dall’attivazione del carbossile e dalla nucleofilicità dell’ossigeno carbonilico. Composti troppo attivi, come i cloruri acilici, utilizzati all’inizio della sintesi peptidica, aumentano la velocità di formazione dell’ossazolone, mentre l’impiego di esteri attivi o anidridi simmetriche, ne riducono la formazione.
La nucleofilicità dell’ossigeno carbonilico può essere ridotta impiegando, come gruppi protettori dell’ammino gruppo, gruppi di tipo uretanico.
La presenza, infatti, di un atomo di ossigeno, adiacente al gruppo carbonilico implicato nella ciclizzazione, ne riduce la nucleofilicità, sfavorendo la ciclizzazione che, se in alcuni casi avviene, porta alla formazione del 2-alcossi-5(4H)-ossazolone.
Inoltre, l’amminolisi del 2-alcossi-5(4H)-ossazolone avviene rapidamente, in quanto esso è un elettrofilo migliore rispetto al 2-alchil-5(4H)-ossazolone.
Infine, il 2-alcossi-5(4H)-ossazolone non enolizza, non da l’enantiomero indesiderato ed è, quindi, chiralmente stabile nelle condizioni di reazione.
Sintesi dei peptidi
2) Per evitare la racemizzazione dell’ossazolone può essere aumentata la velocità di apertura dell’anello o ridurne l’acidità. L’ossazolone reagisce con l’amminoacido sia attraverso la reazione di amminolisi, sia attraverso la racemizzazione, reazioni che procedono alla stessa velocità. E’ quindi opportuno aumentare la velocità di apertura dell’anello. Utilizzando derivati della
idrossilammina, come l’N-idrossisuccinimmide (HO-Su) o
l’N-idrossibenzotriazolo (HO-Bt), si ha un aumento della velocità di apertura dell’anello, con il quale essi reagiscono molto più velocemente rispetto ad un’ammina. L’estere attivo che si forma reagisce con il gruppo amminico dell’amminoacido formando il peptide con la stereochimica desiderata. Si può ottenere un basso livello di racemizzazione utilizzando DCC e l’N-idrossisuccinimmide (HO-Su) o l’N-idrossibenzotriazolo (HO-Bt) al posto della sola DCC.
L’acidità dell’ossazolone può essere ridotta impiegando gruppi protettori dell’amminogruppo di tipo uretanico rispetto a quelli di tipo ammidico. Ciò si può spiegare in termini di risonanza degli anioni derivati dai corrispondenti ossazoloni (Schema 2.48). Nell’anione, che si forma dall’ossazolone di un amminoacido protetto, al gruppo amminico con un gruppo uretanico, c’è una risonanza fra gli elettroni del doppio legame C═N e del secondo ossigeno uretanico quindi la carica negativa non può essere delocalizzata sul carbonio in posizione 2. Al contrario, nell’anione che deriva dall’amminoacido protetto al gruppo amminico con un gruppo di tipo ammidico, la carica negativa può essere delocalizzata anche sul carbonio in posizione 2, in questo modo l’anione intermedio risulta maggiormente stabilizzato e quindi il corrispondente ossazolone è più acido.
In conclusione, gli acidi N-alcossicarbonilammino derivati sono migliori rispetto agli N-alchilcarbonilamminoacidi, in quanto sono meno sottoposti ad epimerizzare attraverso l’intermedio ossazolonico, con conseguente formazione dei due peptidi diasteroisomeri.
Sintesi dei peptidi L-ossazolone O C N C C O O O C N C C O R H O R1 R1 N R HN R1=gruppo protettore R=catena amminoacidica O C N C C O O R1 R f orma stabilizzata O C N C C O O R1 R
f orma non stabilizzata 1
2 3
4 5