7. RISULTATI E DISCUSSIONI
7.1. ANALISI DEL COMPOSTO 1
Tale composto corrispondente alla frazione R'7 è stato isolato dopo diverse
cromatografie eseguite sulla riunione R14 proveniente dalla cromatografia di
esclusione molecolare Sephadex LH-20. Si presenta come un solido amorfo brunastro con formula molecolare C10H8O5 determinata tramite ESI-MS.
R'7 presenta una macchia di colore gialla caratterizzata da un valore di ritenzione
di 0.55 calcolato su TLC in fase inversa eluita con MeOH/W 4:6, evidenziata con reattivo spray di NTS-PEG rilevata all'UV a valori di lunghezza d'onda di 254 e 366 nm.
Lo spettro di risonanza magnetica nucleare del protone (1H-NMR, 250 MHz,
CD3OD) mostra dei picchi caratteristici di una porzione aromatica ed olefinica
nella zona spettrale compresa tra 7.50 e 6.15 ppm riconducibili ad una struttura di tipo fenilpropanoidica. Partendo da valori di chemical shift alti, si nota un doppietto integrante per un protone a 7.40 ppm accoppiato con un secondo doppietto presente a 6.11 ppm attraverso una costante di accoppiamento di 16 Hz, attribuibili ad idrogeni di tipo vinilico in conformazione trans. I rimanenti segnali evidenziano protoni di un sistema di tipo ABX appartenenti ad un anello aromatico (6.92, d, J = 1.8 Hz; 6.82, dd, J = 8, 1.8 Hz; 6.66, dd, J = 8, 1.8 Hz). Pertanto al composto in esame viene attribuita la struttura dell'acido caffeico (fig. 7a), comune precursore della via biosintetica dei polichetidi e abbastanza frequente nel regno vegetale. L'ipotesi è stata confermata per confronto con i dati presenti in letteratura riguardo l'acido caffeico. (DÜRÜST N.,
et al
., 2001)Fig. 7a. Struttura del composto 1 (Acido Caffeico)
Table 7.1
.1H-NMR e 13C-NMR (250MHz, CD3OD) del composto 1Posizione δδδδΗΗΗΗ((((ppm) δδδδC((((ppm) 1 123.3 2 6.92 d (J = 1.8Hz, 1 H) 115.3 3 147.1 4 149.2 5 6.82 dd (J = 8, 1.8Hz) 116.6 6 6.65 dd (J = 8, 1.8Hz) 128.2 7 7.41 d (J = 16.1Hz) 146.5 8 6.10 d (J = 16.1 Hz) 115.7 9 169.3
Fig.7.1.1H-NMR (250 Mhz, CD3OD) del composto 1
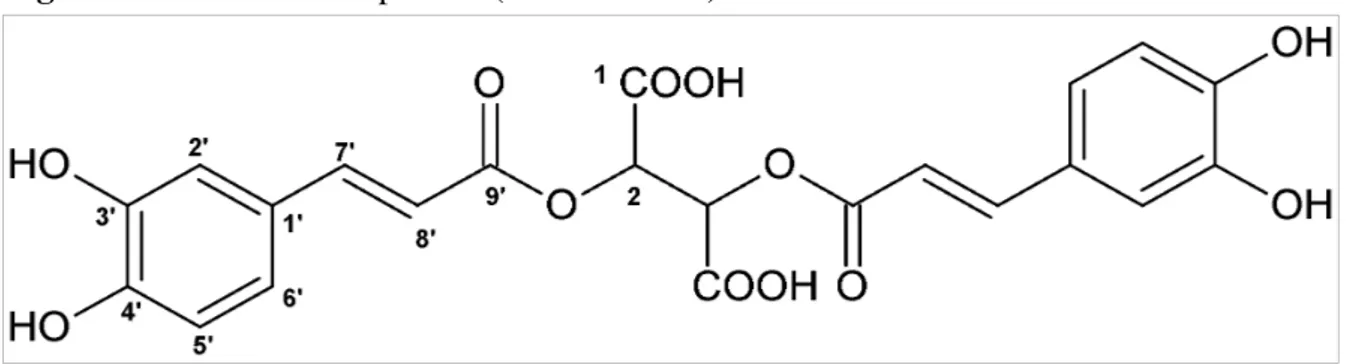
7.2. ANALISI DEL COMPOSTO 2
Il composto M'2C+M'3A+M'3B, proveniente dalle separazioni cromatografiche con
TLC preparativa eluita con Cloroformio/Metanolo/Acqua nel rapporto 6:4:1 della frazione M2 e M3 provenienti dalla Lobar a bassa pressione con MeOH/W 4:6 e 7:3
eseguita sulla riunione R10 proveniente dalla cromatografia di esclusione
molecolare Sephadex LH-20, si presenta come un solido amorfo di colore brunastro con formula molecolare C22H16O12, determinata tramite spettroscopia
ESI-MS. La frazione presenta una singola macchia di colore giallo intenso caratterizzata da un valore di ritenzione di 0.72 calcolato su TLC in fase inversa eluita con cloroformio/metanolo/acqua nel rapporto 6:4:1, evidenziata con reattivo spray di NTS-PEG rilevata con lampada UV a 254 e 366 nm.
Lo spettro di risonanza magnetica al protone (1H-NMR, 250 MHz, CD 3OD)
evidenzia segnali nella zona compresa tra 5.5-7.5 ppm. La presenza di un singoletto slargato a 8.41 ppm denota la presenza di un ossidrile acido nella molecola in esame. Procedendo nell'analisi dello spettro da campi bassi verso campi alti si nota la presenza di un doppietto a 7.63 (J = 16.1Hz) integrante per un idrogeno e accoppiato con il protone a 6.36 ppm che produce un doppietto con medesima costante di accoppiamento (J = 16.1Hz). I segnali sono tipici di un raggruppamento vinilico con conformazione trans. Sono poi inoltre presenti segnali di un nucleo aromatico con la tipica sostituzione ABX: si notano infatti i picchi a 7.06 (d, J = 1.8Hz), 6.95 (dd, J = 7.8 e 1.8Hz) e 6.76 (d, J = 7.8Hz e 1.8Hz), attribuibili rispettivamente agli idrogeni H-2, H-5 e H-6. Il rimanente singoletto a 5.68 ppm, integrante per due idrogeni, denota una simmetria all'interno della struttura del composto in esame e possiede valori di chemical
Fig. 7b. Struttura del composto 2 (acido cicorico)
Posizione δδΗδδΗΗ((((Ηppm) δδδδC((((ppm) 1 8.41 br s (2H) 171.7 2 5.68 br s (2H) 76.4 1' 123.0 2' 7.06 d (J = 1.8Hz, 2H) 116.5 3' 150.1 4' 150.8 5' 6.95 dd ( J = 1.8, 7.8Hz, 2H) 117.6 6' 6.76 dd ( J = 1.8, 7.8Hz, 2H) 127.5 7' 7.63 d ( J = 16.1Hz, 2H) 147.4 8' 6.36 d ( J = 16.1Hz, 2H) 116.6 9' 167.8
Fig.7.4.1H-NMR (250 Mhz, CD3OD) del composto 2
7.3. ANALISI DEL COMPOSTO 3
Il composto 3 (Q6) provieniente da una separazione cromatografica a bassa
pressione (Lobar-Chromatography) di R13 eluita con MeOH/W mostra una macchia
di colore giallo con formula molecolare C20H30O14 (determinata tramite ESI-MS)
evidenziata con reattivo spray di NTS-PEG rilevata con lampada UV a 254 e 366 nm. Tale macchia è caratterizzata da un valore di ritenzione (Rf) di 0.39 ottenuto con TLC in fase inversa eluita con MeOH/W (4:6).
Lo spettro protonico eseguito in CD3OD evidenzia ancora una volta la presenza di
un residuo cinnammico 3'-4' disostituito. E' presente inoltre un singoletto a 3.69 integrante per 3 idrogeni tipico di un raggruppamento metossilico aromatico. Pertanto potremmo essere in presenza di un derivato dell'acido ferulico.
Nella zona compresa tra 5.5-4.0 ppm sono presenti due doppietti a 5.06 e 4.41 ppm con costante di accoppiamento rispettivamente di 3.5 e 7.8 Hz. Detti segnali integrano per un protone ciascuno e sono tipici di idrogeni anomerici confermati nello spettro di risonanza magnetica al 13C dai segnali a 98.21 e 93.96 ppm
rispettivamente. La correlazione diretta tra protoni e carboni anomerici viene confermata dall'analisi dello spettro HMQC. L'insieme dei valori della costante di accoppiamento dei due protoni anomerici, il chemical shift del 13C-NMR e la
correlazione HMQC suggeriscono la presenza di un anomerico in posizione alfa e
uno in posizione beta.
La presenza di due unità zuccherine viene confermata nello spettro 13C-NMR da
dieci segnali nella zona compresa tra 80.0-60.0 ppm. I picchi a 62.87 e 62.72 suggeriscono la presenza di due esosi con la posizione 6 libera presumibilmente glucosio o galattosio.
L'ipotesi strutturale che ne deriva potrebbe fare risalire la natura del composto ad un disaccaride sostituito con un raggruppamento ferulico attraverso un legame estereo (confermato dal chemical shift del carbonio carbonilico a 169.7. Resta da stabilire la natura del legame glicosidico ed il sito di attacco del sostituente aromatico.
Posizione δδδδH(ppm) δδCδδ (ppm) Feruloil derivato 1 127.7 2 6.97 dd (J = 8, 2 Hz) 114.8 3 149.6 4 146.8 5 6.90 dd (J = 8, 2 Hz) 116.5 6 6.71 d (J =2Hz) 122.9 7 7.46 d (J = 16.0Hz, 1H) 149.9 8 6.20 d (J = 16.0Hz, 1H) 115.1 9 169.7
Unità zuccherine
1'β 4.40 d (J = 7.5Hz, 1H) 98.2 2' 3.81-3.56 m (1H) 78.1 3' 3.81-3.56 m (1H) 78.0 4' 3.81-3.56 m (1H) 71.9 5' 3.81-3.56 m (1H) 76.31H-NMR (250 Mhz, CD3OD) del composto 3
7.4. ANALISI DEL COMPOSTO 4
Tale composto corrispondente alla frazione Q7 è stato isolato dopo diverse
cromatografie eseguite sulla riunione R13 proveniente dalla cromatografia di
esclusione molecolare sephadex LH-20. Tale composto si presenta come un solido amorfo di colore brunastro con formula molecolare C15H16O9 determinata tramite
ESI-MS.
Q7 presenta una macchia di colore gialla intensa caratterizzata da un valore di
ritenzione di 0.58 calcolato su TLC in fase inversa eluita con MeOH/W (4:6), evidenziata con reattivo spray di NTS-PEG rilevata all'UV a 254 e 366 nm.
Lo spettro di risonanza magnetica al protone evidenzia segnali nella zona compresa tra 8.0-3.3o ppm. Procedendo nell'analisi dello spettro da campi bassi verso campi alti si nota la presenza di un doppitto a 7.61 (J = 16.1Hz) integrante per un idrogeno e accoppiato con un protone a 6.26 ppm che da origine ad un doppietto con medesima costante di accoppiamento (J =1 6.1). I segnali sono tipici di due raggruppamenti vinilico con conformazione trans su una porzione cinnammoilica.
Sono poi inoltre presenti segnali di un nucleo aromatico con la tipica sostituzione ABX: si notano infatti i picchi a 7.01 (br s), 6.91 (br s) e 6.75 (br s) integranti ciascuno per un idrogeno, attribuibili rispettivamente agli idrogeni H-2, H-5 e H-6 del derivato cinnammoilico suddetto.
Procedendo nell'analisi dello spettro verso campi alti nell'intervallo tra 5.5 e 4.0 ppm è presente un doppietto (4.37, che appare come singoletto slargato) attribuibile ad una unità zuccherina.
L'analisi dello spettro al 13C conferma la presenza dell' unità caffeoilica legata ad
un glucosio attraverso un ponte estereo: si evidenziano infatti un carbonio carbonilico estereo a 169.75 ppm.
La nostra ipotesi strutturale ci conduce ad attribuire al composto in esame la struttura di un monosaccaride sostituito con un raggruppamento caffeoilico in posizione 1'.
Posizione δδδδH(ppm) δδδδC(ppm) 1 127.6 2 7.01 brs (1H) 114.8 3 149.9 4 146.9 5 6.91 brs (1H) 116.5 6 6.54 brs (1H) 122.9 7 7.62 d (J = 16.0Hz, 1H) 149.9 8 6.26d (J = 16.0Hz, 1H) 115.2 9 169.8 1'β 4.43 d (J = 7.8Hz, 1H) 95.8 2' 3.83-3.63 m (1H) 78.8 3' 3.83-3.63 m (1H) 74.0 4' 3.83-3.63 m (1H) 71.1 5' 3.83-3.63 m (1H) 78.0 6' 3.83-3.63 m (1H) 62.3
7.5. ANALISI DEL COMPOSTO 5
Il composto 5 corrispondente alla frazione P2 è stato isolato dopo diverse
cromatografie eseguite sulla riunione R1 proveniente dalla cromatografia di
esclusione molecolare sephadex LH-20. Tale composto si presenta come un solido amorfo di colore brunastro con formula molecolare C30H34O17 determinata tramite
ESI-MS.
P2 si presenta una macchia di colore violaceo con fluorescenza azzurro tenue
caratterizzata da un valore di ritenzione di 0.42 calcolato su TLC in fase inversa eluita con CHCl3/MeOH/W (6:4:1), evidenziata con reattivo spray di NTS-PEG e
analizzata alla lampada UV a 254 e 366 nm.
Lo spettro di risonanza magnetica al protone del composto 5 evidenzia segnali nella zona compresa tra 8.0-3.30 ppm. Procedendo nell'analisi dello spettro da campi bassi verso campi alti si nota la presenza di due doppietti a 7.56 (J=15.6Hz) e 7.53 (J=16.4Hz) integranti per un idrogeno ciascuno e accoppiati con i protoni a 6.40 e 6.24 ppm che danno origine a due doppietti con medesima costante di accoppiamento (J=15.6 e 16.4Hz). I segnali sono tipici di due raggruppamenti vinilici con conformazione trans su porzioni cinnammoiliche indipendenti.
Sono poi inoltre presenti segnali di un nucleo aromatico con la tipica sostituzione ABX: si notano infatti tre singoletti slargati a 7.03, 6.94 e 6.78 integranti ciascuno per due idrogeni, attribuibili rispettivamente agli idrogeni H-2, H-5 e H-6 di due derivati cinnammoilici.
Procedendo nell'analisi dello spettro verso campi alti nell'intervallo tra 5.5 e 4.0 ppm sono presenti: un singoletto slargato (5.05ppm), un doppietto (4.48ppm) e
attribuibili a due esosi con la posizione 6 occupata (64.87 e 64.85) i cui
anomerici risuonano a 98.3 e 94.1.
La nostra ipotesi strutturale ci conduce ad attribuire al composto in esame la struttura di un disaccaride disostituito con raggruppamenti caffeoilici su due unità differenti.
Posizione δδδδH (ppm) δδCδδ (ppm) 1 127,7 2 7,03 brs (1H) 115,1 3 149,6 4 147,0 5 6,94 brs (1H) 116,5 6 6,78 brs (1H) 122,9 7 7,58 d (J=16 Hz, 1H) 146,8 8 6,40 d (J=16 Hz, 1H) 115,1 9 169,1 1' 126,6 2' 7,02 brs (1H) 115,1 3' 147,1 4' 147,0 5' 6,94 brs (1H) 116,5 6' 6,77 brs (1H) 123,0 7' 7,55 d (J=15,8 Hz, 1H) 147,1 8' 6,23 d (J=15,8 Hz, 1H) 115,1 9' 168,5
Unità zuccherine
1'' 5,05 d (J= 3,5 Hz, 1H) 94,1 2'' 3,66-3,81 (m, 1H) 76,3 3'' 3,66-3,81 (m, 1H) 73,8 4'' 3,66-3,81 (m, 1H) 71,87.6. ANALISI DEL COMPOSTO 6
Tale composto corrispondente alla frazione R''3A1 è stato isolato dopo diverse
cromatografie eseguite sulla riunione di R'3 proveniente da Lobar a bassa
pressione seguita sulla riunione R14 proveniente dalla cromatografia di esclusione
molecolare Sephadex LH-20. Si presenta come un solido amorfo arancio-giallastro. R''3A presenta una macchia di colore gialla caratterizzata da un valore di ritenzione
di 0.81 calcolato su TLC in fase inversa eluita con MeOH/W 6:4, evidenziata con reattivo spray di NTS-PEG rilevata all'UV a valori di lunghezza d'onda di 254 e 366 nm.
Lo spettro di risonanza magnetica al protone (1
H-NMR, 250 MHz, CD3OD) mostra
dei picchi caratteristici di una porzione aromatica ed olefinica nella zona spettrale compresa tra 7,50 e 6,00 ppm riconducibili ad una struttura di tipo feruil-propanoidica. Partendo da valori di chemical shift alti, si nota un doppietto integrante per un idrogeno a 7,23 ppm accoppiato con un secondo doppietto a 6,23 sempre integrante per un idrogeno attraverso una costante di accoppiamento di 96,1 Hz.
Tali segnali sono attribuibili a due idrogeni vinilici in conformazione trans. I rimanenti segnali nella porzione di spettro in esame sono caratteristici di un sistema ABX appartenenti ad un anello aromatico (6,94 ,d, 1,8 Hz; 6,81, dd, 1,8 e 8 Hz; 6,70, dd, 1,8 e 8 Hz). Nella porzione dello spettro del protone compresa tra 5,5 e 4,0 ppm si ritrovano quattro segnali tipici di protoni anomerici. Due di questi segnali (5,36 e 5,08 ppm) possiedono valori di chemical shift e costante di
α
accoppiamento caratteristici di protoni anomerici di tipo , mentre i rimanenti due (4,45 e 4,24 ppm) possiedono “chemical shift” e costanti di accoppiamento di