Capitolo 2
Ossigenoterapia
e
Ventilazione
artificiale
A livello cellulare le fonti primarie di energia sono rappresentate da glucosio
ed ossigeno (ciclo di Krebbs).
Mentre per il glucosio esistono fonti di “stoccaggio”, per l’ossigeno questo
non avviene. L’organismo ha la possibilità di attuare in situazioni di
emergenza un meccanismo alternativo per la produzione di energia
(anaerobiosi), ma questo ha capacità molto limitata e può portare alla
presenza nell’organismo di eccessive quantità di acido lattico, responsabile
di uno stato di acidosi, dannoso per le cellule.
Conseguentemente l’ossigeno rappresenta una fonte energetica insostituibile
e non accumulabile, la cui presenza nell’organismo dipende dal buon
funzionamento della dinamica polmonare (ventilazione ed ematosi),
cardiocircolatoria ed ematica (trasporto dell’ossigeno ad organi e tessuti).
Polmoni e sistema emodinamico (cuore, vasi e sangue) lavorano insieme in
modo da assicurare che la quota di liberazione di sangue ossigenato (DO2)
risponda alle esigenze dell’organismo (Clutton, 1999).
La sintomatologia clinica di un’alterazione del sistema di acquisizione e
inadeguata ventilazione, altre dipendono da anomalie della diffusione
attraverso la membrana polmonare, oppure da difetto del trasporto di
ossigeno dai polmoni ai tessuti (Guyton, 1983).
2.1 Indicazioni per ossigenoterapia e ventilazione artificiale
Esistono diverse indicazioni per la ventilazione meccanica che possono
essere riferite a quattro grandi categorie come riportate in tabella 2.1 (Raffe,
2002b).
Ventilazione inadeguata a mantenere il livello di pH ematico • Diminuzione di eliminazione di CO2
1. patologie polmonari primarie 2. danni al torace o al diaframma • Lesioni del sistema nervoso centrale
1. apnea
Inadeguata ossigenazione tissutale
• Patologie polmonari che diminuiscono l’apporto di O2
Aumento dello sforzo respiratorio • Aumento del consumo di O2
• Affaticamento dei muscoli respiratori Patologie cardiovascolari
La discordanza tra ventilazione e perfusione (Va/Q) è probabilmente la più
comune causa di ipossiemia. Le malattie ostruttive croniche del polmone,
come le bronchiti croniche e l’enfisema polmonare alveolare (alveoli
eccessivamente distesi o rottura delle loro pareti), sono causa di alterazione
del rapporto ventilazione/perfusione (Reece, 2002).
Queste patologie sono caratterizzate dall’insorgenza dell’effetto shunt in cui
l’unità funzionale risulta perfusa ma non ventilata con conseguente
diminuzione dell’ossigenazione ematica ed aumento dell’anidride carbonica,
per l’impossibilità di eliminarla (Fig. 2.1).
I disturbi dell’ematosi conseguenti ad alterazioni del circolo polmonare (es.
trombosi, embolia) portano alla comparsa dell’effetto spazio morto in cui è
presente un alveolo ben ventilato ma non perfuso (Fig. 2.1).
Figura 2.1: Effetto shunt ed Effetto spazio morto
Le malattie che modificano la tensione superficiale dell’interfaccia gas-liquido
aumentata, e quindi un minor sforzo necessario per poter dilatare il polmone,
rappresenta un serio problema perché riduce la pressione transpolmonare, la
forza che tiene aperte le piccole vie aeree. La riduzione del calibro delle vie
aeree ne aumenta la resistenza disturbando la distribuzione dell’aria inspirata
nel polmone limitando quindi la velocità del flusso espiratorio.
Viceversa, una diminuzione della compliance comporta una difficoltà
nell’inspirazione: un lavoro respiratorio maggiore è richiesto per avere un
determinato aumento del volume polmonare (Aguggini, 1998).
Le alterazioni sopra indicate sono responsabili di insufficienza respiratoria e
quindi di uno stato di ipossiemia e conseguente ipossia producendo una
sofferenza cellulare.
La somministrazione di ossigeno e la ventilazione meccanica rappresentano
la terapia di elezione per ripristinare un’adeguata funzionalità respiratoria
(Tseng, 2000).
2.2 Ossigenoterapia
Si tratta del primo intervento da prendere in considerazione in caso di
ipossia; deve essere messa in atto sistematicamente perché l’insufficienza
respiratoria è sempre accompagnata da uno stato di ipossiemia; a questo
(FiO2) (tra 21% e 100% = FiO2 0.21-1.0), considerando che in un soggetto
normale ed in buone condizioni fisiche una FiO2 di 0.21 (0.21 =
concentrazione di O2 nell’aria) dovrebbe essere sufficiente a mantenere una
PaO2 > 60 mm Hg.
Se i valori della PaO2 sono inferiori, è necessario aumentare il valore della
FiO2, con la somministrazione di ossigeno; ciò può essere fatto mediante
varie tecniche, ad esempio con maschera e gabbia ad ossigeno
raggiungendo una FiO2 di circa 0.4, con O2 al 100% oppure con un
tracheotubo cuffiato che permette di raggiungere una FiO2 di 1.0 con O2 al
100%. Le modalità di somministrazione possono essere diverse e per alcune
si rende necessaria la sedazione o addirittura l’anestesia dell’animale (Tab.
2.2). Modalità di somministra zione Erogazione Vantaggi Inconvenienti
Maschera 1-3 l/min Strumentazione ad uso immediato a basso costo
Mal tollerata, controllo costante, FIO2 imprecisa
Sonda nasale 100 ml/kg/min
Buona tolleranza, basso costo, buon controllo FIO2,
No nel soggetto agitato, in caso di epistassi, fratture muso, ostruzione prime vie
Sonda tracheale
100 ml/kg/min
Ok per ostruzione prime vie respiratorie, buon controllo FIO2, basso costo
No nel soggetto agitato senza sedazione
Collare elisabettiano
1-3 l/min Basso costo, nessun controllo Ingenti fughe O2, no accesso
rapido alla testa Gabbia 4 l/min Eccellente tollerabilità, buon
controllo FIO2 umidità e
temperatura
Animale isolato, Caduta della FIO2
all’apertura, elevato consumo O2
Maschera
È un metodo di somministrazione semplice, immediato e poco costoso.
Viene utilizzata una maschera con un diaframma in gomma da applicare sul
muso dell’animale; deve essere di una misura tale da permettere all’animale
di respirare a bocca aperta. La maschera viene raccordata ad un circuito di
ossigeno a bassa pressione. Richiede però un controllo costante dell’animale
e la presenza di un aiuto che tenga in posizione la maschera; inoltre ci sono
ingenti fughe di ossigeno nello spazio che si viene a creare tra la maschera e
il muso dell’animale.
Sonda nasale
Richiede un certo grado di manipolazione dell’animale ed è quindi
sconsigliata nei soggetti in stato di shock o molto critici. Si prende la misura
della sonda, che deve arrivare fino al secondo premolare superiore; alcune
gocce di anestetico locale possono essere instillate a livello della narice, per
attenuare il riflesso dello starnuto.
La sonda (catetere urinario, sonda per alimentazione) viene inserita nel
meato nasale ventrale fino al punto preventivamente misurato; nel punto in
cui la sonda esce dalla narice viene fissata con un punto di sutura; la parte
rimanente viene fatta aderire al collo fino al collegamento con l’ossigeno.
L’ossigeno viene umidificato tramite nebulizzatore presente nel circuito,
Sonda trans-tracheale
Consiste nell’inserire un catetere endovenoso di grosso calibro (16-18
Gauge) tra due anelli tracheali, nella porzione cervicale inferiore della
trachea, e collegarlo al circuito dell’ossigeno. È una tecnica indicata in
emergenza, in alternativa alla tracheotomia, in caso di ostruzione delle prime
vie aeree, molto efficace nei soggetti di piccole dimensioni.
Collare elisabettiano
È un metodo semplice e ben tollerato che consiste nell’applicare un collare
elisabettiano, chiuso con della pellicola nella parte rostrale. Il tubo per
l’erogazione dell’ossigeno viene fatto passare tra il collare ed il collo
dell’animale. L’aria espirata e l’ossigeno in eccesso vengono evacuati dagli
interstizi presenti tra il collare ed il collo.
Gabbia ad ossigeno
È un metodo ben tollerato dai soggetti di piccole dimensioni. La FiO2, la
temperatura ed il tasso di umidità possono essere regolati con precisione. Lo
svantaggio è che l’animale risulta meno gestibile in caso di peggioramento.
2.3 Tecniche di ventilazione artificiale
In caso di insufficienza respiratoria grave la semplice somministrazione di
del paziente. In questi casi si rende necessaria la ventilazione artificiale, che
può essere messa in atto mediante diverse tecniche.
Durante la ventilazione artificiale è possibile modificare le caratteristiche della
funzionalità respiratoria del paziente controllando le seguenti variabili:
- frequenza respiratoria
- volume corrente
- rapporto I/E
- flusso inspiratorio
- pressione di picco inspiratorio
- frazione di ossigeno inspirato (FiO2)
La frequenza respiratoria viene impostata in base alle caratteristiche del
paziente con un range variabile da 8 a 20 atti respiratori al minuto.
Il volume corrente viene calcolato in base al volume tidalico ed alla frequenza
respiratoria con un range variabile di 8-15 ml/kg/atto respiratorio.
Il rapporto I/E impiegato è generalmente di 1:2 ma può essere variato fino ad
arrivare in condizioni particolari a 2:1.
Il flusso inspiratorio dipende dal volume tidalico e dalla compliance
polmonare e del circuito.
La pressione di picco inspiratorio (PIP) è la pressione massima raggiunta
La frazione di ossigeno inspirato varia da 0.21 (aria) ad 1 (ossigeno al 100%)
e può essere impostata a seconda della miscela che viene fatta tra aria ed
ossigeno.
Le tecniche di ventilazione possono essere suddivise in due tipologie: a
pressione negativa e pressione positiva.
La ventilazione a pressione negativa (NPV) viene attuata per mezzo di
dispositivi che generano l’instaurarsi di una pressione negativa
intrapolmonare che permette l’ingresso di aria nei polmoni e la conseguente
fase inspiratoria. La ventilazione a pressione negativa aumenta la negatività
pleurica e per tale motivo si ritiene possa aumentare il ritorno venoso al
cuore e la gittata cardiaca durante l’inspirazione. Questo è uno dei motivi che
fanno ritenere la NPV più fisiologica rispetto alla ventilazione a pressione
positiva (Corrado et al., 2004).
Il maggiore vantaggio della NPV è dato dalla possibilità di evitare
l’intubazione e le sue relative complicanze permettendo al paziente le
fisiologiche funzioni di parlare, tossire, inghiottire e mangiare. Inoltre in corso
di ventilazione sono possibili manovre broncoscopiche.
La ventilazione a pressione positiva (PPV) viene realizzata mediante
insufflazione forzata di aria nei polmoni con un aumento della pressione
intrapolmonare durante la fase inspiratoria. L’espirazione è invece passiva e
Questa tecnica non rispecchia l’andamento fisiologico della pressione ma è
quella che viene più comunemente utilizzata nella pratica clinica (Morgan et
al., 2002).
Quando la ventilazione a pressione positiva viene effettuata mediante una
maschera si parla di Ventilazione Meccanica Non Invasiva (NIMV), mentre
se viene attuata per mezzo di un tubo endotracheale viene detta
Ventilazione Meccanica Invasiva (IMV).
Esistono due criteri generali per distinguere i diversi modi di ventilazione
positiva.
Il primo criterio attiene alla scelta dell’attore principale della ventilazione che
può essere:
- il paziente (ventilazione spontanea)
- il ventilatore (ventilazione controllata)
- ambedue (ventilazione assistita).
Nella ventilazione controllata il ruolo del paziente è assolutamente passivo
(Romano et al., 2002).
Il secondo si attiene alla scelta del parametro che viene sottoposto al diretto
essere distinta in ventilazione a controllo di volume, ventilazione a controllo
di pressione, a controllo di tempo ed a controllo di flusso.
La ventilazione a controllo di volume è quella in cui, indipendentemente da
qualsiasi altro evento, l’inspirazione termina quando il volume corrente (o
volume/minuto) prestabilito dall’operatore è stato erogato. Almeno in teoria la
ventilazione a controllo di volume comporta più facilmente il rischio di
barotrauma. Per evitare eccessi di picco inspiratorio in questo tipo di
ventilazione, molti ventilatori sono forniti di un allarme di pressione che può
essere impostato dall’operatore.
Nella ventilazione a controllo di pressione la fase espiratoria ha inizio quando
è stato raggiunto un valore pressorio predeterminato nelle vie aeree
(Romano et al., 2002). Quindi il volume corrente e la durata dell’inspirazione
variano in relazione alla resistenza delle vie aeree e polmonari ed in base
alla compliance del circuito. Una perdita significativa nel sistema può
compromettere il raggiungimento della pressione nel circuito ed il
funzionamento del ventilatore; mentre un aumento improvviso della
resistenza nelle vie respiratorie o una diminuzione della compliance
polmonare e/o del circuito portano ad una diminuzione del ciclo inspiratorio e
del volume corrente con possibilità di ipoventilazione del paziente.
Nei ventilatori a controllo di tempo la fase espiratoria ha inizio quando un
Il volume corrente è quindi il prodotto del tempo di inspirazione presettato e
la frequenza di flusso inspiratorio. Questi tipi di ventilatori sono
comunemente usati in neonatologia umana. (Morgan et al., 2002).
I ventilatori a controllo di flusso presentano dei sensori di pressione e di
flusso che permettono al ventilatore stesso di monitorare il flusso inspiratorio
per una determinata pressione inspiratoria impostata; quanto questo flusso
raggiunge il livello prefissato il ventilatore passa alla fase inspiratoria a quella
espiratoria (Morgan et al., 2002).
Tutte queste tecniche di ventilazione possono essere attuate senza alcuna
collaborazione da parte del paziente o con la totale/parziale collaborazione di
questo (Romano et al., 2002).
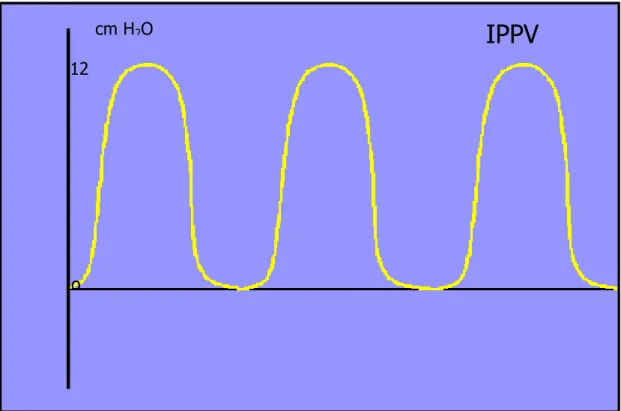
Nella Ventilazione a pressione positiva intermittente (IPPV: Intermittent
Positive Pressure Ventilation) viene esercitata una pressione, variabile da 12
a 20 cm H2O, nelle vie aeree in modo da ottenere un atto inspiratorio, che
termina quando i parametri preselezionati in base alla funzione del
ventilatore (volume, pressione, tempo, flusso) sono raggiunti; l’espirazione ha
inizio quando termina l’insufflazione forzata ed è completamente passiva
Figura 2.2: Rappresentazione grafica IPPV
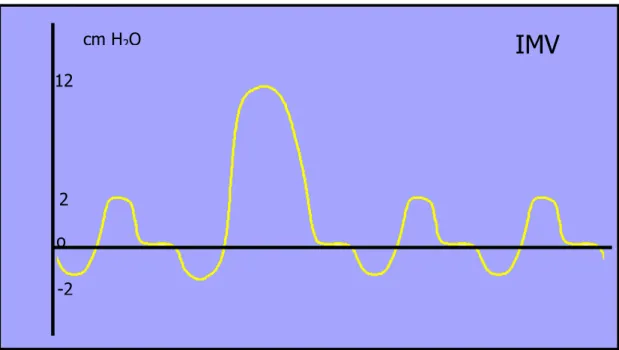
Durante la Ventilazione intermittente obbligatoria (IMV: Intermittent
Mandatory Ventilation) il paziente respira autonomamente e ad intervalli
regolari viene effettuata una inspirazione artificiale a pressione positiva,
dall’operatore (per mezzo del pallone di riserva di un sistema respiratorio) o
dal ventilatore. L’inspirazione forzata può essere indipendente dall’atto
respiratorio del paziente oppure può essere sincronizzata (SIMV), ovvero ha
inizio quando il paziente avvia la fase inspiratoria (Fig. 2.3).
Questa tecnica è impiegata per aumentare il volume minuto respiratorio dei
paziente ed è indicata per svezzare il paziente dal ventilatore (West, 2003b).
cm H2O 12
o
Figura 2.3: Rappresentazione grafica IMV
La Ventilazione ad Alta Frequenza (HFV: High Frequency Ventilation) è un
metodo in cui non si ha una vera e propria espansione polmonare, ma si
sfrutta un’elevata frequenza respiratoria associata ad un basso volume
tidalico; questa tecnica, pur con volumi correnti pari o inferiori allo spazio
morto, può mantenere valori normali di PO2 e PCO2 arteriosa, durante
l’apnea, perché facilita la mescolanza dei gas nelle vie aeree per fenomeni di
diffusione di flusso (Raffe, 2002b).
La HFV può essere applicata con due diverse modalità:
• IPPV ad alta frequenza, fino a 100 apm, tramite tubo endotracheale; il volume corrente è uguale o leggermente superiore allo spazio morto.
• Ventilazione a getto ad alta frequenza (HFJV), con una frequenza di
IMV
cm H2O 12 o -2 2inserito in trachea per via percutanea, oppure attraverso un tubo
tracheale, in cui viene fatta passare una sonda che arrivi fino alla
biforcazione tracheale, per ridurre al minimo lo spazio morto (Fig. 2.4).
Figura 2.4: Rappresentazione grafica HFJV
La Pressione positiva a fine espirazione (PEEP: Positive End Expiratory
Pressure) è una tecnica eseguita in associazione con IPPV, in cui alla fine di
ogni atto respiratorio viene mantenuta una pressione superiore (2-5 cm H2O)
rispetto alla pressione atmosferica (Fig. 2.5).
Questa tecnica viene usata soprattutto in pazienti che hanno una
diminuzione della capacità funzionale residua ed in pazienti con atelectasia cm H2O
2
o
polmonare (Vassilev et al., 2004), poiché incrementa gli scambi respiratori,
aumentando il tempo di contatto tra sangue e aria.
In medicina umana può essere applicata anche in modalità non invasiva,
mediante l’utilizzo di una maschera facciale, mentre in medicina veterinaria può
essere applicata solo su pazienti che sono intubati.
Figura 2.5: Rappresentazione grafica PEEP
La Pressione delle vie aeree positiva continua (CPAP: Continuous
Positive Airway Pressure) mantiene una pressione positiva nelle vie aeree
durante tutte le fasi della ventilazione nei pazienti in respirazione spontanea
(Fig. 2.6) (Raffe, 2002b).
cm H2O
PEEP
2,5
o 15
respiratorio, con oscillazioni di 0,5-1 cm di H2O, tipiche della ventilazione
spontanea.
In questo modo si ottiene un’espansione costante degli alveoli responsabile
del miglioramento nella distribuzione dell’ossigeno, di una più efficace
rimozione dell’anidride carbonica e di un miglior rapporto
ventilazione/perfusione (Raffe, 2002b).
Figura 2.6: Rappresentazione grafica CPAP cm H2O 2,7 2,5 2,2 o
CPAP
2.4 Effetti collaterali e complicazioni della ventilazione
artificiale a pressione positiva
I ventilatori disturbano la normale fisiologia e, se usati in modo inappropriato,
possono causare alcune patologie.
I potenziali problemi sono correlati con il sistema respiratorio,
cardiovascolare, con il SNC, il sistema renale, la funzione degli organi
viscerali (Raffe, 2002b ).
Sistema respiratorio: le complicazioni delle vie aeree superiori
comprendono le sinusiti e le faringiti secondarie ad un’alterazione del
ricambio della flora batterica presente in questi siti. I problemi associati con la
respirazione artificiale includono danni alla laringe, alla mucosa tracheale e
necrosi mucosale secondaria alla pressione della cuffia del tracheotubo.
Le complicazioni più frequenti delle vie aeree inferiori sono più evidenti con la
ventilazione a pressione positiva. L’iperisuffluazione polmonare (barotrauma
e volutrauma) è la complicazione più comune e può causare rottura degli
alveoli e comunicazione con lo spazio pleurico producendo pneumotorace a
valvola, danno bronchiolare ed embolismo gassoso sistemico. Una
superinsufflazione può produrre anche una infiammazione secondaria dei
tessuti successiva alla rottura dell’epitelio alveolare e dell’endotelio capillare
L’infiammazione può produrre edema polmonare, una disfunzione del
surfactante a seguito della alterazione membrana ialina ed un disequilibrio
tra ventilazione e perfusione (Raffe, 2002b).
Le polmoniti da ventilazione artificiale sono dovute all’elusione dei
meccanismi di difesa delle vie aeree superiori, per la presenza del tubo
endotracheale.
In corso di ventilazione non invasiva la normale funzionalità ciliare può
essere alterata da flussi inspiratori elevati, o per gli effetti di tossicità
dell’ossigeno, quando somministrato per periodi prolungati.
Sistema cardiovascolare: la ventilazione meccanica è ben tollerata da
pazienti con una funzione cardiaca regolare, un tono simpatico normale ed
un adeguato volume intravascolare.
Durante la ventilazione artificiale la pressione positiva che si viene a creare
all’interno del torace provoca una diminuzione di ritorno venoso al cuore
destro per compressione dei vasi venosi.
Inoltre per pressioni eccessive si può avere anche un certo grado di
compressione sulle pareti atriali.
Queste alterazioni sono responsabili di una diminuzione del precarico che si
ripercuote sulla dinamica circolatoria con una riduzione della gittata cardiaca.
Pazienti con una funzionalità cardiocircolatoria compromessa possono non
risultando a rischio di ipotensione, ipoperfusione renale e degli organi
splacnici e collasso cardiocircolatorio (Raffe, 2002b).
Sistema Nervoso Centrale: un aumento della pressione intracranica è stato
messo in relazione con elevate pressioni di ventilazione. Un aumento in tal
senso può contribuire ad un edema cerebrale secondario ed a disfunzioni
delle regioni del talamo, ipotalamo, del ponte e della regione midollare
(Raffe, 2002b).
Sistema Renale: la ventilazione meccanica è stata riconosciuta causa di
possibili alterazioni della funzionalità renale dovuti a:
- cambiamenti dell’emodinamica cardiovascolare, risultanti in ipovolemia per
deplezione del volume ematico circolante in fase prerenale;
- attivazione simpatica con conseguente vasocostrizione delle arteriole renali
afferenti diretta o indiretta per attivazione del sistema renina-angiotesina;
- danno polmonare da ventilazione con liberazione sistemica di mediatori
dell’infiammazione promotori di danno cellulare ed apoptosi (Pannu, 2004).
Funzione viscerale: una disfunzione epatica può essere secondaria ad una
ridotta perfusione epatica e alla conseguente diminuzione di rilascio
dell’ossigeno. Questo è dovuto ad una diminuzione del flusso di sangue
questa è reversibile nel momento in cui viene ristabilita una ventilazione
spontanea.
La funzione gastrointestinale è alterata da una ventilazione a pressione
positiva. L’incidenza di emorragie gastrointestinali aumenta del 40% in
pazienti ventilati per più di tre giorni. Questo è dovuto ad una differenza di
pressione di perfusione intestinale secondaria a una diminuzione della
pressione sistemica ed a un incremento della pressione venosa (Raffe,