- 7 -
Capitolo 1
Dolore perioperatorio
1.1 Nocicezone animaleIl dolore è una sensazione spiacevole, sensoriale ed emotiva, che è associata molto spesso, ma non sempre, a un danno tissutale o nervoso. Gli esseri umani possono esprimere e definire le sensazioni che provano e anche localizzare la sede del dolore. Gli animali, invece, hanno una risposta al dolore differente che può essere solo interpretata dall’uomo. La parola antromorfismo è utilizzata quando ad un animale sono attribuite delle caratteristiche e/o degli atteggiamenti, in questo caso interpretabili come dolorosi, propri dell’uomo (Gaynor, 2002).
Un altro termine caratteristico del dolore è neuroplasticità che indica la capacità del sistema nervoso di cambiare o modellare le proprie funzioni biochimiche e fisiologiche in risposta a stimoli interni (biologici) o esterni (incluso l’utilizzo ripetuto di farmaci) che sono responsabili delle sensazioni dolorose. Gli animali che hanno un ricordo doloroso, una condizione dolorosa difficile da trattare, o un dolore che dura da più di 12-24 ore rispondono in maniera meno efficace al trattamento analgesico (Gaynor, 2002).
Il ricordo del dolore dipende da molti fattori: l’aspettativa di dolore, il comportamento animale, l’ambiente, l’intensità dell’evento negativo. Quest’ultimo è l’elemento che più di tutti determina il ricordo doloroso (Gaynor, 2002).
Il dolore può essere classificato in base ai suoi caratteri (fisiologico, infiammatorio, acuto, cronico, persistente e misto) alla sede di provenienza (tissutale, neuropatico, psicogeno, di origine sconosciuta o incerto) e in base all’esperienza topografica ( primario, secondario).
Il dolore fisiologico è un sistema protettivo nei confronti di un evento lesivo o potenzialmente tale che vuole prevenire o evitare un danno tissutale, in questo caso lieve o nullo. Tale dolore attiva il sistema nocicettivo in seguito a uno stimolo del sistema nocicettivo.
- 8 -
Il dolore infiammatorio è una specie di dolore fisiologico perché condivide con il precedente l’origine nocicettiva e la tendenza a voler limitare il danno tissutale (dolore adattativo che ha finalità protettiva). Tuttavia, la risposta a un simile dolore può sviluppare un aumento agli stimoli algici (iperalgesia) o una riduzione della soglia del dolore per cui stimoli innocui diventano dolorosi (allodinia).
Il dolore infiammatorio, se particolarmente severo e di lunga durata, può evolvere in un dolore patologico o maladattativo.
Il dolore acuto è un dolore di breve durata che termina con la fine della stimolazione algica o del processo infiammatorio che accompagna una lesione.
Il dolore postoperatorio, quello successivo a un trauma e quello proveniente da un processo infiammatorio sono tutti esempi di dolore acuto.
Il dolore cronico è un dolore infiammatorio in cui permane una condizione algica anche quando la lesione iniziale risulta riparata, perdendo completamente o parzialmente il rapporto causa/effetto. In questi casi il sistema nocicettivo può essere attivato anche in assenza di nocicezione e si parla quindi di dolore disnocicettivo o non nocicettivo.
Il dolore disnocicettivo non origina da uno stimolo nocicettico periferico, ma è una disfunzione della via nocicettiva stessa. Il dolore neuropatico è un esempio di dolore cronico disnocicettivo: il danno del tessuto nervoso altera la normale via nocicettiva.
Il dolore cronico non nocicettivo è un tipo di dolore più caratteristico dell’uomo che degli animali e alcuni esempi sono il dolore da tensione muscolare e il dolore allucinatorio.
- 9 -
Il dolore persistente è un dolore in cui, diversamente dal dolore neuropatico, permane la nocicezione che sostiene il dolore tissutale (è un dolore nocicettivo) ed è mantenuto il nesso causa/effetto. Esempi di dolore persistente sono il dolore da osteoartrosi e quello neoplastico
Il dolore misto è un dolore persistente infiammatorio associato a dolore cronico neuropatico
Il dolore tissutale prende diversi nomi a seconda della sede dei nocicettori e della provenienza delle fibre nervose afferenti: si parla di superficiale se coinvolge la cute, i denti, l’occhio e le mucose visibili; profondo somatico per il dolore muscoloscheletrico (osteogeno, miogeno, articolare e periarticolare, vasogeno, durale) e il dolore proveniente dalle strutture nervose (nerve tunk pain); profondo viscerale se coinvolge gli organi, i dotti interni del corpo, le connessioni legamentose (trazione sui legamenti viscerali) e patologie (angina pectoris, necrosi ischemiche).
l dolore psicogeno e il dolore di origine sconosciuta sono il dolore da tensione muscolare, quello allucinatorio e le cefalee e il dolore da arto fantasma rispettivamente.
Il dolore primario è quello avvertito nel punto di localizzazione dello stimolo nocicettivo dopo l’attivazione di nocirecettori locali, come per esempio quello di una lesione tissutale visibile, quello da persistente ipereccitabilità dei nocicettori e quello a carico di una struttura nervosa (nerve trunk pain).
Il dolore secondario attiva i recettori nocicettivi locali, ma è avvertito in una zona differente da quella della nocicezione. Esempi di dolore secondario sono il dolore disnocicettivo e il dolore non nocicettivo. Il dolore secondario è differito quando più impulsi provenienti da strutture profonde somatiche o viscerali convergono su una struttura, profonda e più spesso superficiale, che condivide l’innervazione con la sede della nocicezione.
- 10 -
Il dolore è secondario riflesso se un primo stimolo attiva una seconda nocicezione. Per esempio quando una lesione ossea provoca uno spasmo muscolare (dolore da spasmo muscolare) o nocicettori viscerali contraggono delle parti superficiali attivando dei recettori locali (dolore viscerale riflesso)
1.2 Fisiopatologia del dolore
La genesi del dolore è un evento complesso che coinvolge una catena di eventi fisiologici e di risposte comportamentali e sensoriali che non sono separate tra loro, ma costituiscono un processo dinamico e continuo. Al fine di semplificare, il dolore nocicettivo può essere suddiviso in quattro processi:
1) Trasduzione- uno stimolo nocicettivo viene convertito in un segnale elettrico da parte dei nocicettori
2) Trasmissione- del messaggio elettrico dai nocicettori attraverso vie ascendenti al midollo spinale (conduzione) e poi al tronco encefalico, alla sostanza reticolare ascendente, al talamo e infine alla corteccia somatosensitiva (proiezione) e in senso opposto attraverso vie discendenti
3) Modulazione- del messaggio a livello del midollo spinale, del talamo e di alcune aree del midollo allungato e del cervello
- 11 -
Trasduzione
Gli stimoli dolorosi attivano dei recettori specifici detti “nocicettori” che non sono altro che la parte terminale di fibre nervose mieliniche (fibre Aδ) e
amieliniche (fibre C) localizzate in diverse parti del corpo (cute, sottocute, periostio, articolazioni, muscoli e organi interni).
A livello cutaneo, le fibre Aδ rispondono soprattutto a meccanorecettori (recettori pressori) ad alta soglia e a recettori meccanotermici (della pressione e del calore) e sono responsabili del dolore iniziale, pungente e localizzato. Le fibre C, invece, sono dette “polimodali” perché rispondono a stimoli meccanici, termici e chimici (es. mediatori dell’infiammazione) e sono responsabili di un dolore sordo, più diffuso e persistente che fa seguito alla prima risposta.
In profondità, i nocicettori sono sensibili ad altri stimoli come l’attività muscolare e l’estensione articolare esagerata (a livello somatico) o la torsione, la distensione e l’ischemia (a livello viscerale). Questi ultimi creano un dolore intenso e di difficile localizzazione dato che hanno un’ampia area di ricezione e sono sovrapposti.
In entrambi i casi, sia a livello superficiale cutaneo che profondo somatico e viscerale, l’attivazione di tali nocicettori crea delle variazioni (potenziali d’azione o PA) nel potenziale di riposo della membrana neuronale (-70 mV) per cui viene raggiunto un valore soglia (-55 mV) responsabile dell’apertura di proteine-canale sodio/potassio voltaggio-dipendenti che determinano l’entrata nella cellula di ioni positivi. A questo punto, la membrana si depolarizza ulteriormente fino a -35 mV e dà vita alla propagazione dello stimolo nervoso (fase di trasmissione del dolore al SNC).
I nocicettori possono essere attivati da uno stimolo, direttamente (per attivazione dei recettori o per uno stiramento della fibra nervosa), oppure indirettamente da parte di cellule prossime al tessuto lesionato (potassio, serotonina, bradichinina, istamina, ossido nitrico, prostaglandine E2 e
citochine) o dallo stesso nocicettore sensibilizzato (sostanza P, neurochinina A, peptide correlato al gene della calcitonina). L’insieme di tutti i mediatori attivano le fibre sensitive e simpatiche e determinano una vasodilatazione e
- 12 -
uno stravaso di proteine plasmatiche che esitano in un ulteriore rilascio di mediatori chimici da parte delle cellule infiammatorie.
Durante la fase di trasduzione può succedere che la soglia di attivazione sia inferiore al normale per cui stimoli normalmente non dolorosi vengono percepiti come tali (allodinia) con un aumento della risposta dolorifica (iperalgesia primaria). Ancora, nocicettori che normalmente non sono
coinvolti potrebbero partecipare al processo nocicettivo aggravando l’iperalgesia.
Conduzione
La propagazione dei potenziali d’azione continua lungo le fibre sensitive afferenti fino al midollo spinale (conduzione) e successivamente al tronco encefalico, alla sostanza reticolare ascendente, al talamo e infine alla corteccia (proiezione).
Le fibre Aδ mieliniche hanno un diametro di 1-6 mm e una velocità di conduzione di 5-30 m/s, mentre le fibre C, più piccole, misurano meno di 1,5 mm di diametro e hanno una minor volocità di conduzione, di 0,2-0,5 m/s. In condizioni di dolore patologico si può verificare un inversione del senso di progressione dello stimolo, chiamato “riverberazione del PA ” (Bufalari, 2012).
Modulazione
A livello delle corna dorsali del midollo spinale, gli impulsi sensoriali periferici sono modulati (amplificati o soppressi).
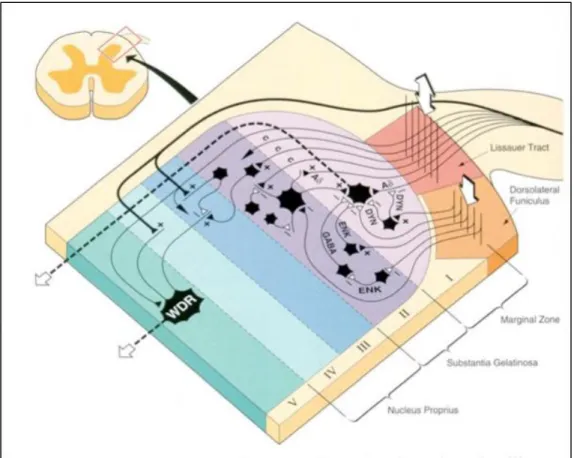
La maggior parte degli stimoli nocicettivi interagiscono con la sostanza grigia delle corna dorsali del midollo spinale e, in particolare, a livello delle lamine I (zona marginale), II (sostanza gelatinosa), V (una parte del nucleo proprio) e X. La lamina II integra le informazioni con la lamina I, e la lamina X riceve informazioni dolorifiche e sulla temperatura simili alle lamine precedenti.
- 13 -
In questi distretti si attivano dei meccanismi che influenzano il percorso dello stimolo doloroso:
Rilascio di mediatori: eccitatori (glutammato, aspartato), inibitori (GABA, glicina), prostaglandine, ATP, peptidi, oppioidi endogeni inibitori (endorfine, encefaline, dinorfine), ammine (serotonina, norepinefrina).
Teoria del cancello di controllo: le fibre sensitive mieliniche Aβ, normalmente responsabili della trasmissione di informazioni sensoriali innocue (es. del tatto), se più numerose, attiverebbero degli interneuroni inibitori del midollo spinale, normalmente inibiti dalle fibre C, riducendo la trasmissione dello stimolo doloroso verso il cervello.
Figura 1.1: Aree di materia grigia delle corna dorsali del midollo spinale implicate nella trasmissione della nocicezione ( DYN= dinorfina, ENK= leu/met-encefaline, GABA= acido gamma-amino butirrico, WDR= wide dynamic range cells - cellule ad ampio campo recettivo, + = stimolo, - = inibizione).
- 14 -
Stimoli nocicettivi ripetitivi, provenienti da un danno tissutale, portano a un cambiamento della risposta dei neuroni delle corna dorsali che diventano, per tutta la durata dello stimolo, maggiormente attivi. Si verifica un abbassamento della soglia dello stimolo per evocare il potenziale d’azione, una più alta sensibilità della cellula una volta superato il valore soglia e un aumento del campo di recezione dei neuroni che nell’insieme definiscono la cosiddetta “sensibilizzazione centrale” o wind-up.
Il fenomeno di wind-up si verifica anche senza una sensibilizzazione periferica, probabilmente, in parte, per l’attivazione, da parte del glutammato, dei recettori NMDA (N-metil-D-aspartato) presenti nel midollo spinale. Il loro innesco è facilitato dalla simultanea stimolazione della sostanza-P sui recettori AMPA (acido α-amino-5-metil-4-isoxazolone propionato) e NK (neurochinina) (Bufalari, 2012).
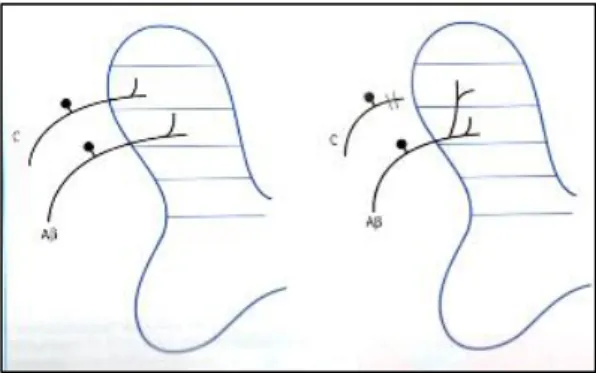
Il meccanismo molecolare dell’iperalgesia spinale si verifica per un potenziamento a lungo termine (LTP), con attivazione dei recettori-canali NMDA, normalmente bloccati dal Mg2+, che incentivano l’entrata di Ca2+. L’LTP, a sua volta, aumenta la liberazione del glutammato presinaptico grazie alla liberazione di ossido nitrico (NO), per attivazione della NO-sintetasi, e la liberazione di prostaglandine (PG) (Bufalari, 2012). L’allodinia si realizza in seguito a una nuova sinapsi dei propriorecettori Aβ che prendono contatto di norma in corrispondenza delle lamine III e IV del midollo spinale e che, in caso di lesione al nocicettore (Aδ o C) provvisto dello stesso campo recettivo, si sdoppia in una nuova fibra collegandosi con un affernte nocicettivo secondario della lamina II (Bufalari, 2012).
Fig. 1.2: processo di allodinia: sdoppiamento della fibra propriocettiva in L2 e sinapsi con un afferente nocicettivo diverso dall’originale (Bufalari e Lachin, 2012).
- 15 -
Proiezione
Le informazioni nocicettive dalle corna dorsali del midollo spinale sono trasmesse al cervello da fasci neuronali (tratti nervosi). A riguardo, esistono pareri contrastanti sul meccanismo d’azione dei vari tratti nervosi. I principali coinvolti sono:
tratto spinotalamico: è la principale via nocicettiva ascendente che origina dalle lamine I e IV alla lamina VII delle corna del midollo spinale. Questo tratto contiene specifici assoni nocicettivi e numerosi neuroni dinamici che terminano nel talamo.
tratto spinoreticolare: ha la stessa origine del tratto spinotalamico, ma termina nella formazione reticolare (RE) e nel talamo
tratto spinomesencefalico: i suoi assoni provengono dalle lamine I e V fino al mesencefalo (regione grigia periacqueduttale, sistema limbico, ipotalamo)
tratto spinoipotalamico: va dalle lamine III e IV proiettando informazioni all’ipotalamo e al prosencefalo
Percezione
La percezione è l’insieme dei processi d’integrazione e riconoscimento dell’informazione sensitiva che avviene in diverse aree del cervello e si traduce con una risposta eccitatoria, somatosensitiva, motoria e autonoma.
Il sistema attivatore reticolare ascendente (ARAS) nel cervello è un centro d’integrazione delle esperienze sensoriali che amplifica e diffonde le informazioni, favorendo l’elaborazione da parte dei centri corticali e subcorticali. Esso è implicato anche nella modulazione di risposte del sistema motorio, autonomo ed endocrino.
La sostanza grigia periacqueduttale (PAG) gioca un ruolo importante nel facilitare il rilascio di sostanze inibitrici (oppioidi endogeni) e modulatrici coinvolte nello stimolo doloroso a livello spinale.
Il talamo manda informazioni alla corteccia somatosensitiva responsabile della percezione cosciente della sensazione dolorosa.
- 16 -
Negli animali non primati, rispetto alla specie umana, si evidenziano un relativo minor sviluppo filogenetico delle vie laterali, in particolare del tratto spinotalamico (componente sensitivo-descriminativa), e una maggiore produzione delle vie mediali (componente motivazionale affettiva), un minor volume corticale delle aree associative rispetto alle aree di proiezione, un minor numero dei neuroni inibitori corticali e la mancanza del solco centrale (Bufalari, 2012).
1.3 Diagnosi di dolore
Non esiste un sistema universalmente riconosciuto per valutare il dolore negli animali. Diverse strategie sono state proposte sia in via sperimentale che nella pratica clinica nel tentativo di trovare misure oggettive in grado di valutare il dolore acuto e cronico negli animali. Tali linee vergono sulla valutazione di diagnosi presuntive, un’accurata valutazione clinica, risposte comportamentali, utilizzo di “pain score” e risposta alle terapie.
Diagnosi presuntiva
La diagnosi presuntiva, cioè la somministrazione di un analgesico prima dell’intervento dello stimolo algico, può ridurre la risposta iniziale acuta al dolore e può prevenire, o quantomeno ridurre, le modificazioni neuronali associate all’ipersensibilizzazione centrale (wind-up) (Della Rocca, http://centri.unipg.it/cesda).
Valutazione clinica
La valutazione clinica considera alcuni parametri degli apparati cardiovascolare, respiratorio, digerente, urinario e muscoloscheletrico. Per esempio, il dolore acuto stimola una risposta simpatica da stress che può alterare le risposte dinamiche funzionali dell’organismo: variazioni dei parametri clinici come la frequenza cardiaca (FC), la frequenza respiratoria (FR) e la pressione sanguigna (BP) possono essere utilizzati come indicatori di dolore (Ledowski, 2011).
- 17 -
La risposta da stress è prodotta dall’asse ipotalamo-ipofisi-surrene che è innescato dalla liberazione di corticotropina analgesica e antinocicettiva che, a sua volta, produce una risposta simpaticomimetica per la liberazione di epinefrina (EPI) e norepinefrina (NEP) (Bufalari, 2012).
Ancora, possono essere valutati la presenza di vomito o di addome contratto, la ritenzione urinaria, il diametro pupillare, la zoppia, la stipsi associata alla riluttanza di movimento, la perdita dell’appetito e la misurazione di alcuni ormoni quali: cortisolo, catecolamine, glucosio, ADH, β-endorfine (Della Rocca, http://centri.unipg.it/cesda).
Comportamento
Caratteristiche comportamentali associate al dolore nel cane e nel gatto possono essere la postura del corpo, le espressioni facciali, le vocalizzazioni, cambi d’umore e i comportamenti evocati.
Continui cambi di posizione, assunzione di posture anomale (cani con dolore addominale possono assumere una posizione “a preghiera”), leccarsi o osservare la zona dolente, gli occhi socchiusi sono esempi di dolore (Gaynor, 2012).
Punteggio scale del dolore
Le scale del dolore rappresentano uno strumento oggettivo e veloce per la valutazione del dolore finalizzato a una corretta terapia.
Le più utilizzate in medicina veterinaria sono le scale per il dolore acuto, inteso soprattutto come dolore chirurgico, ma esistono anche scale per il dolore cronico, come per esempio la Helsinki chronic pain index, la CBPI (Canine Brief Pain Inventory), la CSU (Colorado State University) chronic pain scale e, per la valutazione della qualità della vita dell’animale, la CSU QOL (Quality of Life) Questionnaire (Della Rocca, http://centri.unipg.it/cesda).
L’esame del dolore acuto può essere determinato utilizzando sia scale monoparametriche, che misurano un solo parametro connesso al dolore, ovvero la sua intensità, sia con scale multiparametriche. Queste ultime sono più utilizzate in veterinaria perchè hanno una gradazione numerica associata a un singolo parametro (per es. comfort, movimento, vocalizzazione,
- 18 -
comportamento, reazione al tatto) che dev’essere scelta dall’osservatore e la somma del punteggio di ciascuno di essi fornisce una misura del dolore provato dall’animale (Bufalari, 2012).
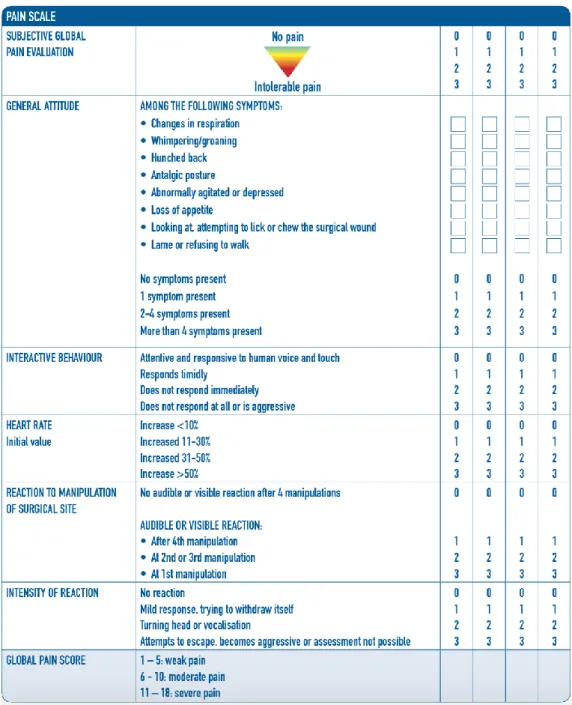
Alcune scale multiparametriche sono la Glasgow Composite Pain Tool, la 4avet, la Hellyer and Gaynor Scale e quella dell’Università di Melbourne. Le scale monoparametriche considerano solo il grado della sensazione algica senza una valutazione qualitativa e mostrano una grande variabilità intersoggettiva a seconda dell’operatore. Tali schemi derivano dalla medicina umana e tra quelli utilizzati per gli animali vi sono la scala visuale analogica (VAS), la scala numerica analogica (NAS), la scala numerica verbale (VNS) e la scala descrittiva semplice (SDS).
Le prime tre quantificano il dolore come una linea orizzontale (numerata da 0 a 10 o da 0 a 100 nelle scale NAS e VNS) che considera ai propri estremi rispettivamente l’assenza o il massimo grado di dolore. La SDS presenta solamente 4 o 5 intensità di dolore quali: assente, lieve, moderato, severo, estremo. Di questa esiste anche una versione più complessa, la Canine Simple Descriptive Pain Scale dell’Università del Colorado, che associa ad ogni valore numerico (da 0 a 4) una figure iconografica.
La Mathews Pain Scoring System è simile alla SDS, ma ampliata con 10 possibilità di punteggio (Bufalari, 2012).
Da tutto ciò si evince che le scale multiparametriche sono quanto più oggettive e utilizzate in medicina veterinaria di quelle monoparametriche, meno comuni. Tuttavia, il giudizio personale di alcuni paramestri resta critico: per esempio la vocalizzazione può derivare da uno stato di dolore, da un’espressione caratteriale, da uno stato di paura, delirio o stress (Bufalari, 2012).
- 19 -
- 20 -
Fig. 1.4: scala della valutazione del dolore 4avet.
- 21 - 1.4 Dolore chirurgico: approccio terapeutico
Il dolore chirurgico può essere considerato un dolore intra-anestetico e postoperatorio che si manifesta in un tempo abbastanza breve e può quindi essere considerato un dolore acuto, ma che, in alcune sue conseguenze o complicanze, può originare forme iniziali di dolore persistente, potenzialmente di tipo neuropatico (Bufalari, 2012).
Pertanto, la terapia di tale dolore dovrebbe essere presa in considerazione mediante un’analgesia soprattutto preventiva, che precede cioè la chirurgia. Alcuni farmaci impiegati nella terapia del dolore perioperatorio sono rappresentati da:
- oppioidi
- farmaci antinfiammatori non steroidei (FANS) - corticosteroidi
- alfa2- agonisti
- anestetici locali
Fig. 1.5: Principali farmaci analgesici e loro interferenza con i processi che sottendono lo sviluppo di dolore (Della Rocca, “Principi di terapia del dolore”).
- 22 - Oppioidi
Gli oppioidi hanno un’elevata attività antidolorifica. Essi agiscono modificando la polarizzazione della membrana cellulare modificando la conduttanza ionica (i recettori mu e delta incrementano il trasporto del potassio, i k riduce quella del calcio) portando a un’inibizione del rilascio presinaptico di alcuni neurotrasmettitori (es: sostanza P e glutammato) e a una sensibilizzazione della membrana postsinaptica. Tutto ciò si traduce in una riduzione della progressione dello stimolo algico verso i centri d’integrazione a livello del sistema nervoso cemtrale (Della Rocca, http://centri.unipg.it/cesda).
Antinfiammatori non steroidei (FANS)
Gli antinfiammatori non steroidei sono utilizzati per il controllo del dolore acuto e cronico, spesso in associazione a farmaci oppioidi. È stato visto che la somministrazione di FANS insieme agli oppioidi migliora l’analgesia e riduce la dose di quest’ultimo (Egger et al., 2014). L’azione analgesica e antinfiammatoria sembrano essere mediate soprattutto dagli inibitori delle ciclossigenasi dell’isoforma 2 (COX-2) e, visti i diversi effetti collaterali associati al loro uso cronico e il tentativo di trovare una forma di facile somministrazione, sono continuamente studiati e sperimentati nuove molecole della stessa classe, tra i quali uno dei più recenti è il cimicoxib (Kim et al., 2012).
Corticosteroidi
I corticosteroidi esercitano un’azione antinocicettiva grazie alla loro attività antinfiammatoria. Il loro utilizzo è controindicato se sono stati precedentemente impiegati dei FANS perché può verificarsi un aumento del rischio di ulcere gastro-duodenali (Della Rocca, http://centri.unipg.it/cesda). Per ridurre gli effetti avversi connessi alla somministrazione sistemica, questi farmaci sono utilizzati nel cane in modo mirato, soprattutto a livello intrarticolare. Anche la via epidurale nella protusione discale ha mostrato un
- 23 -
effetto anti analgesico, ma il loro utilizzo per il dolore spinale dev’essere ancora approfondito (Egger, 2014).
Alfa-2-agonisti
Basse dosi EV dei sedativi medetomidina (1-3 µg/ kg) o dexmedetomidina (0,5-1 µg/ kg), anche in CRI (1-2 µg/ kg/h e 0,5-1 µg/ kg/h), possono essere utilizzate nel periodo post-operatorio per incrementare l’analgesia nel cane e nel gatto (Gaynor, 2002). Nell’uomo, un’infusione continua di alfa2-agonisti, dopo la chirurgia, ha mostrato una minor richiesta di oppioidi, un miglioramento del metabolismo proteico, soprattutto dell’azoto e, se somministrata insieme a un bolo di 15 µg/kg di fentanyl, una riduzione della frequenza cardiaca e un incremento della pressione arteriosa polmonare (Gaynor, 2002).
Vista la loro lipofilicità, la loro azione analgesica è maggiore quando sono impiegati nell’analgesia spinale e diffondono nel liquido cefalo rachidiano piuttosto che come farmaci epidurali, dove si è visto hanno scarso effetto analgesico (Gaynor, 2002).
Anestetici locali
Gli anestetici locali bloccano la conduzione dello stimolo nervoso inibendo i canali del Na2+ voltaggio-dipendenti sulla membrana assonale (Egger, 2014). Essi, vista la loro azione analgesica prolungata di ore, possono essere somministrati già in premedicazione, oppure anche dopo la chirurgia se si vuole prolungarne l’effetto.
Alcuni anestetici, come per esempio la bupivacaina, agiscono maggiormente sulle fibre nocicettive (Aδ e C). Generalmente, le fibre nervose più piccole e quelle amieliniche sono bloccate prima delle fibre nervose mieliniche di grosse dimensioni: quindi le fibre nocicettive, amieliniche (C) e mieliniche (Aδ), sono coinvolte prima di quelle più grandi sensoriali tattili e pressorie (Aβ) e motorie/ propriocettive (Aα). Tuttavia, in alcune condizioni, le fibre C sono più resistenti all’azione degli anestetici locali, anche dopo il completo blocco delle
- 24 -
fibre motorie (Egger, 2014). La risoluzione del blocco, invece, ha un andamento inverso a quello della sequenza d’insorgenza (Staffieri, 2013).