Introduzione
INTRODUZIONE
1. OBESITÀ
1.1 Obesità: Epidemiologia e classificazione
Ad oggi, l’obesità è definita come una malattia cronica caratterizzata da un eccesso di peso corporeo espresso soprattutto da un grande accumulo di tessuto adiposo, tanto da influire negativamente lo stato di salute. Secondo l’Organizzazione Mondiale della Sanità (OMS), la prevalenza dell’obesità in tutto il mondo occidentale ha raggiunto negli ultimi decenni livelli epidemici (Catenacci VA et al., 2009). Dati raccolti dal “National Health And Nutrition Examination Surveys” (NHANES) dal 1960 al 2000 relativi
a soggetti adulti (di età compresa fra 20 e 74 anni), indicano che nel 1974 l’obesità colpiva circa il 14.5% della popolazione statunitense mentre nel 1999 i soggetti colpiti erano il 30.9%. La tendenza alla crescita di questo valore non accenna a ridursi e in un successivo studio del NHANES, eseguito per gli anni 2007-2008 l’incidenza risultava del 33.8%. In linea con questi risultati, i dati del NHANES indicano che nel 1999-2000 il 64.5% degli statunitensi adulti erano in sovrappeso (BMI ≥ 25 kg/m2), con una percentuale di soggetti obesi pari al 27.7% nei maschi e al 33.4% nelle femmine (Flegal KM et al., 2002); nel 2007-2008 la percentuale di statunitensi adulti in sovrappeso risultava pari al 68.0% con una distribuzione nei maschi e
Introduzione
nelle femmine del 32.3% e 35.5%, rispettivamente (Flegal KM et al., 2010).
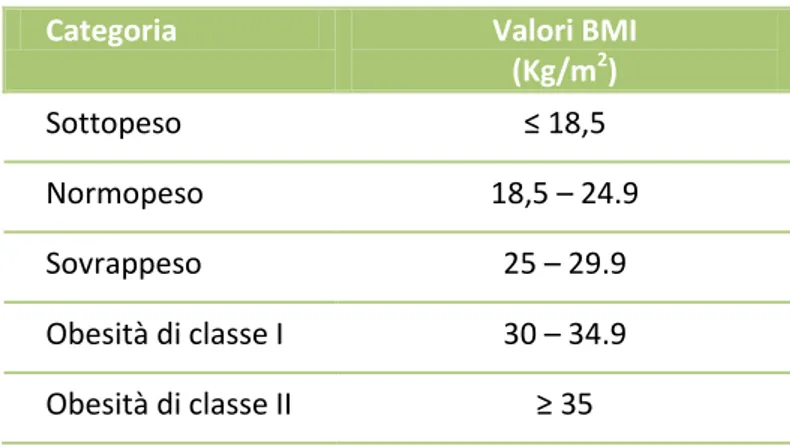
L’Obesità viene classificata utilizzando l’indice di massa corporea (BMI) calcolato come il rapporto tra il peso, in kg, e l’altezza, in metri, elevata al quadrato (kg/m2). Nella popolazione adulta si definisce sovrappeso un valore di BMI compreso tra 25.0 e 29.9 kg/m2, mentre valori ≥ 30 kg/m2 sono indicativi di obesità (López-Jiménez F & Cortéz-Bergoderi M, 2011) (Tab. 1).
Tabella 1 - Criteri diagnostici per l'obesità
Modificato da López-Jiménez F & Cortéz-Bergoderi M, 2011
Categoria Valori BMI (Kg/m2) Sottopeso ≤ 18,5 Normopeso 18,5 – 24.9 Sovrappeso 25 – 29.9 Obesità di classe I 30 – 34.9 Obesità di classe II ≥ 35
Dati epidemiologici relativi a soggetti studiati per più di 10 anni indicano che nel mondo industrializzato (occidentale), tanto negli uomini quanto nelle donne, la tendenza ad essere obesi si concentra nella fascia di età compresa fra i 40 e i 59 anni. In particolare, è sovrappeso il 72.3% degli uomini ed il 64.1% di tutte le donne di età ≥ 20 anni. La sopravvivenza media è ridotta di 0-1 anno per le persone oltre i 60 anni che hanno valori di BMI fra 25 - 27.5 kg/m2, di 1-2 anni per le persone con una BMI fra 27.5 - 30 kg/m2, e di 2-4 anni per gli obesi con un BMI fra 30 - 35 kg/m2. Molte meno informazioni sono disponibili per BMI al di sopra di 35 kg/m2 tuttavia la
Introduzione
sopravvivenza media sembra ridotta di circa 8-10 anni con una BMI di 40-50 kg/m2 (Fig. 1) (Whitlock G et al., 2009).
Figura 1 - Rapporto fra BMI e durata della vita Effetti stimati del BMI sulla sopravvivenza a partire da 35 anni. In A sono indicate le principali categorie di BMI; in B sono comprese anche le categorie estreme, rappresentate con linee tratteggiate perché i dati da cui provengono sono scarsi. Modificato da Whitlock G et al., 2009
Come negli altri paesi industrializzati, anche in Italia l’incidenza dell’obesità e del soprappeso è in forte aumento. Le indagini Multiscopo ISTAT riportano che dal 1999 al 2005 il numero degli Italiani in sovrappeso è passato dal 33.1% al 34.2% mentre per gli obesi dal 9.7% al 9.8%. Nel 2005 il sovrappeso risultava maggiormente presente negli uomini (42.5%) rispetto alle donne (26.6%), mentre per l’obesità le differenze sono minori ma comunque significative (10.5% per gli uomini e 9.1% per le donne). La frequenza delle due condizioni aumenta con l’età con un massimo tra 55 e 64
Introduzione
anni per l’obesità e tra 65 e 69 anni per il soprappeso, specialmente nel sesso femminile.
Anche la distribuzione del tessuto adiposo in diversi depositi anatomici ha implicazioni sulla morbilità. In particolare, il grasso intraddominale e sottocutaneo addominale correla più strettamente con le complicanze metaboliche dell’obesità come l’insulino-resistenza (IR), il diabete mellito, l’ipertensione arteriosa, l’iperlipemia, e tutti i fattori che contribuiscono a definire il rischio cardiovascolare globale.
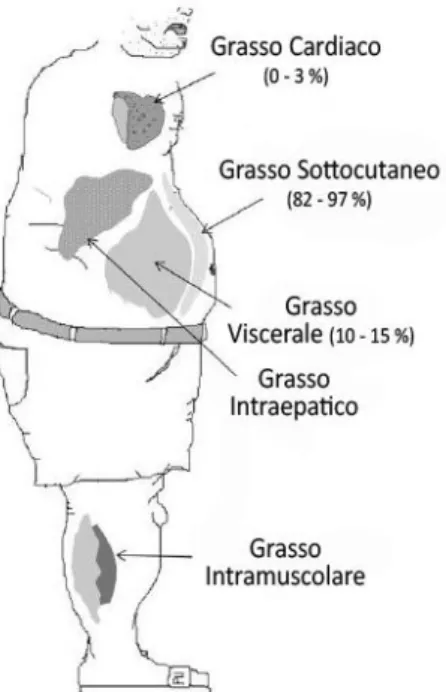
1.1.1 I principali siti di accumulo ectopici del grasso
Il principale sito di accumulo del grasso è rappresentato dal tessuto adiposo subcutaneo. Il grasso ectopico è invece caratterizzato dalla deposizione di trigliceridi in cellule appartenenti a tessuti diversi dal tessuto adiposo che normalmente ne contengono solo piccole quantità. Il grasso ectopico si accumula nell’area viscerale, nel fegato, nel cuore e nei muscoli. Molto spesso la presenza di grasso non è limitata ad un unico organo ma può essere presente contemporaneamente in più sedi (Fig. 2). Inoltre, esiste una relazione stretta fra alcuni di questi depositi come ad esempio fra il grasso viscerale e il grasso epatico (Gastaldelli A et al., 2007; Kotronem A & Yki-Jarvinen H, 2008), fra il grasso cardiaco (Iacobellis G et al., 2003; Sironi AM et al., 2004) e muscolare e anche fra il grasso cardiaco (Perseghin G et al., 2008), epatico e i depositi muscolari (Hwang JH et al., 2007).
Introduzione
Figura 2 - Principali siti di distribuzione ectopica di grasso Modificato da Gastaldelli A & Basta G, 2010
Il grasso viscerale rappresenta circa il 10-15% del grasso totale ed è un tipo di deposito altamente lipolitico dove gli acidi grassi vengono rilasciati direttamente nella circolazione portale fino al fegato (Ferrannini E et al., 2008). Esistono evidenti relazioni fra la grandezza del deposito viscerale e la quantità di acidi grassi liberi (FFA) presenti nel fegato (Jensen MD, 2008). In particolare il grasso viscerale contribuisce a sviluppare steatosi epatica e IR stimolando la gluconeogenesi, principale causa di iperglicemia (Gastaldelli A et al., 2004; Gastaldelli et al., 2007; Jensen MD, 2008).
Un altro sito ectopico di grasso è il cuore. Soggetti con IR manifestano un maggior deposito grasso tanto intorno al cuore (grasso epicardico e intratoracico) quanto all’interno delle cellule miocardiche (Perseghin G et al., 2008; Kankaanpaa M et al., 2006; Mahabadi AA et al., 2009). Diversi studi dimostrano che questi depositi correlano
Introduzione
l’IR, l’aumento dei trigliceridi, l’ipertensione e in generale con la sindrome cardio-metabolica (Iacobellis G et al., 2003; Sinoni AM et al., 2004; Iozzo P et al., 2009).
Nel fegato, i depositi di grasso sono tipicamente associati a soggetti, prevalentemente maschi, affetti da non-alcoholic fatty liver disease (NAFLD) anche se si tratta di persone magre e prive di sintomi che riconducono alla sindrome metabolica (Bugianesi E et al., 2005). I trigliceridi possono accumularsi dentro e tra le cellule muscolari e questo è tipicamente causa di lipotossicità e ostacolo al metabolismo glucidico (Moro C et al., 2008).
1.1.2 Patologie associate
L’obesità comporta un enorme costo sociale in termini di spesa sanitaria e la sua sempre maggiore incidenza coinvolge non solo il settore medico ma anche quello epidemiologico e economico.
Molti studi hanno mostrato una forte relazione fra l’obesità e l’incidenza di diabete mellito, malattie cardiovascolari (CVD) e cancro (Whitlock G et al., 2009); nei paesi industrializzati, dove l’obesità è molto diffusa, è aumentato in modo proporzionale anche il rischio di CVD (Sowers JR, 2003); inoltre, il “Framingham Heart Study” ha dimostrato che l’obesità rappresenta uno dei maggiori
determinanti dell’ipertensione (Kennel WB et al., 2000). L’insieme dei fattori di rischio cardiovascolare associati all’obesità rende conto del fatto che la coronaropatia, insieme alle altre patologie di tipo aterosclerotico (come lo stroke e l’arteriopatia periferica) rappresenta
Introduzione
uno dei problemi più significativamente correlati all’obesità. Inoltre, come ulteriore elemento, l’esistenza di sedi ectopiche di deposito di grassi facilita l’insorgenza dell’obesità addominale che ad oggi si è dimostrata il migliore indicatore di CVD e morte (Alberti KG et al., 2009; Gastaldelli A & Basta G, 2010).
Molto spesso la causa principale di mortalità è rappresentata dall’aterosclerosi, definita come una condizione di infiammazione cronica della parete dei vasi sviluppata a seguito della continua infiltrazione di colesterolo dal plasma alla tunica intima. Qui, nel sottoendotelio, le lipoproteine che trasportano il colesterolo si ossidano e sviluppano un processo infiammatorio che recluta macrofagi e linfociti i quali interagendo con le cellule circostanti rafforzano la flogosi e portano alla formazione della così detta placca aterosclerotica (Pontieri GM et al., 2005; Rocha VZ & Libby P, 2009). L’infiammazione associata all’obesità è in grado di accelerare tutti questi fenomeni. La leptina ad esempio incrementa l’attività fagocitaria dei macrofagi favorendo la formazione della placca aterosclerotica; mentre i bassi livelli di ADN tipici dell’obesità contribuiscono al danneggiamento della funzione endoteliale dovuto alla produzione di specie reattive dell’ossigeno (ROS) (Ryo M et al., 2004; Fantuzzi G & Mazzone T, 2007).
Studi epidemiologici hanno mostrato che l’obesità è anche considerata un fattore causale di altre patologie quali l’apnea notturna ostruttiva (OSA), il reflusso gastroesofageo, nel NAFLD e alcune forme di cancro epatico (Bugianesi E et al., 2005; Catenacci VA et al., 2009).
Introduzione
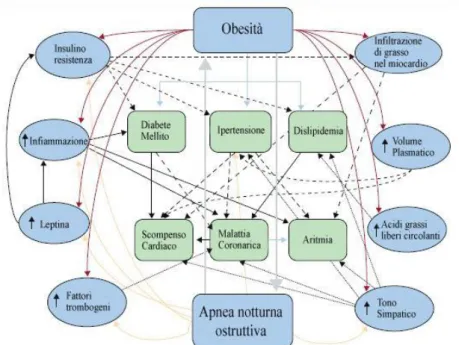
La Figura 3 riporta le complesse interazioni fra obesità e patologia cardiovascolare.
Figura 3 - Obesità e malattie cardiovascolari Modificato da López-Jiménez F & Cortéz-Bergoderi M, 2011
1.2 Obesità e Insulino-resistenza
L'IR è una condizione caratterizzata da una diminuzione degli effetti biologici dell'insulina che a concentrazioni fisiologiche produce una risposta biologica ridotta. L’insulina è l’ormone che regola l’omeostasi del glucosio; la sua attività è di fondamentale importanza per un corretto controllo del metabolismo favorendo le principali attività cataboliche come lipogenesi, glicogeno sintesi e glicolisi. Studi epidemiologici hanno dimostrato che la maggior parte delle persone obese (BMI ≥ 30 kg/m2) ha una predisposizione molto spiccata verso la resistenza all’azione dell’insulina (Pratley RE et al., 2000; Stern SE et al., 2005); Una condizione molto simile si presenta nel caso di soggetti sovrappeso (BMI fra 25 e 29.9 kg/m2).
Introduzione
In generale, l’IR rappresenta il meccanismo che più tipicamente diminuisce la tolleranza al glucosio e spesso causa come conseguenza l’insorgenza di diabete mellito tipo 2 (T2DM), definito comunemente “non insulino-dipendente” (NIDDM) (Einorn D et al., 2003; DeFronzo RA et al., 2004; Purnamasari D et al., 2010).
Una delle teorie maggiormente accreditate per spiegare la patogenesi dell’IR spiega anche la stretta relazione esistente con l’obesità. Nel tessuto sensibile all’insulina dell’obeso, si osserva spesso un eccessiva quantità di FFA (van de Woestijne AP et al., 2011). Questo succede perché da una parte, nel tessuto adiposo obeso l’aumento di dimensioni degli adipociti promuove la funzione della lipasi ormono-sensibile; dall’altra parte, negli altri tessuti, l’abbondante concentrazione di lipoproteine (anche questa una conseguenza diretta dell’obesità) facilita l’attività della lipoprotein-lipasi (Lass A et al., 2011). L’eccesso di FFA che ne consegue, in quanto tale, genera resistenza perché crea un’eccessiva quantità di substrati disponibili ad essere metabolizzati. Inoltre, sempre gli FFA sono responsabili della compromissione a valle dei meccanismi di trasduzione del segnale (Liu YF et al., 2004; Thirone AC et al., 2006), in quanto elevate quantità di FFA inibiscono l’effetto anti-lipolitico di cui l’insulina è responsabile (Kolditz CI & Langin D, 2010; Li Y et al., 2011).
Altre ipotesi indicano come causa prevalente dell’IR l’infiammazione e la risposta immunitaria innata, entrambi meccanismi considerati predittivi dello sviluppo di T2DM (Schmidt MI et al., 1999; Pradhan AD et al., 2001). In particolare, è ampiamente dimostrato come
Introduzione
l’infiammazione, soprattutto se cronica e di basso grado, sia capace di compromettere l’azione ormonale dell’insulina (Fernández-Real JM et al., 2003)
1.2.1 Patologie associate
L’IR rappresenta un’importante condizione fisiopatologica non solo per il diabete ma anche per molte altre patologie che ad essa è possibile correlare, in particolare alla sindrome cardio-metabolica (Grundy SM et al., 2004).
In soggetti non diabetici, i primi segni associabili all’IR sono rappresentati da (Reaven GM, 1988):
- iperinsulinemia;
- ridotta tolleranza al glucosio; - dislipidemia;
- ipertensione;
L’iperinsulinemia è la prima vera conseguenza dell’IR, ottenuta come adattamento fisiologico alla resistenza che comporta una maggiore richiesta dell’ormone. Infatti, la riduzione della funzione insulinica nei tessuti periferici può essere compensato solo se le cellule beta pancreatiche, responsabili della secrezione, sono in grado di aumentarne la produzione; questo, con il perdurare della resistenza, porta a un cronico aumento dei livelli plasmatici di insulina.
La ridotta tolleranza al glucosio è il risultato di un’insufficiente azione insulinica. Questo può presentarsi nel caso in cui contestualmente all’iperinsulinemia, gli elevati livelli di insulina non sono in grado di
Introduzione
compensare la riduzione della funzione; per questo motivo l’organismo non è in grado di controllare efficacemente la glicemia. Per quanto riguarda la dislipidemia, il deficit insulinico ha importanti effetti sul metabolismo dei lipidi in quanto l’insulina, oltre a regolare il metabolismo glucidico, è coinvolto anche nel metabolismo lipidico, in particolare a livello di lipoproteine. Il risultato è rappresentato da ipertrigliceridemia e bassi livelli di lipoproteine ad alta densità (HDL). L’ipertrigliceridemia è causata dalla ridotta funzionalità della lipoprotein-lipasi endoteliale che comporta un aumentata permanenza in circolo di tutte le lipoproteine ricche di trigliceridi (Chilomicroni e VLDL), ma anche delle lipoproteine a densità intermedia (IDL). La carenza insulinica si riflette anche sul fegato impedendo il normale controllo della sintesi dell’apoproteina ApoB100 e di conseguenza accentuando la capacità biosintetica di nuove lipoproteine (in particolare VLDL). I bassi livelli di HDL circolanti sono da associare sia agli effetti dell’ipertrigliceridemia, sia all’aumentata attività della proteina trasportatrice degli esteri del colesterolo (CETP). Quest’ultima favorisce il trasferimento reciproco di esteri del colesterolo dalle HDL alle lipoproteine ricche di trigliceridi (VLDL, IDL) e di trigliceridi dalle lipoproteina alle HDL. Le HDL arricchite di trigliceridi si riducono di dimensione in seguito alla lipolisi intravascolare ad opera della lipoprotein-lipasi endoteliale e vengono rimosse dalla circolazione più rapidamente.
L’ipertensione è causata dagli effetti che la resistenza all’azione insulinica ha sulla trasduzione del segnale dentro le cellule bersaglio.
Introduzione
L’IR inibisce selettivamente le vie di trasduzione del segnale insulinico, in particolare quelle mediate dalla fosfatidil-inositolo-3-chinasi (PI3K) e dell’AKT. Le altre vie di trasduzione di cui l’insulina è responsabile che non sono influenzate dalla resistenza (come la via delle chinasi MAP, MAPK), sono inappropriatamente stimolate a causa dell’iperinsulinemia. Questa condizione influenza principalmente le cellule endoteliali, di cui l’insulina contribuisce a regolare la vasomotilità. Proprio tramite la via PI3K, l’insulina induce la produzione di monossido di azoto (ossido nitrico, NO); mentre per mezzo della via delle MAPK promuove la sintesi di endotelina (ET-1). L’alterato squilibrio fra produzione di NO, noto agente vasodilatatore e ET-1, che al contrario è un forte vasocostrittore, a favore di quest’ultimo, è una delle cause dell’insorgenza di ipertensione (Pontieri GM et al., 2005).
1.3 Obesità e Infiammazione
1.3.1 Citochine infiammatorie
Con il termine generale di citochine si intendono dei mediatori polipeptidici non antigene-specifici che fungono da segnali di comunicazione fra le cellule del sistema immunitario e fra queste e diversi organi e tessuti; sono dunque un importante gruppo di proteine regolatorie coinvolte nei circuiti di comunicazione extra-cellulare. Le citochine sono in genere prodotte da una varietà di tipi cellulari; la loro è una produzione transitoria; agiscono a breve distanza e di regola non si trovano in quantità importanti in circolo in condizioni normali;
Introduzione
molte citochine sono pleiotropiche, nel senso che agiscono su una grande varietà di cellule e tessuti; inoltre, citochine strutturalmente diverse hanno azioni che in larga misura si sovrappongono.
Le citochine possono essere classificate utilizzando criteri diversi; una classificazione utile dal punto di vista operativo è quella che distingue le citochine sulla base delle loro proprietà funzionali. Una classificazione funzionale delle citochine comprende:
- citochine emopoietiche,
- citochine dell’immunità specifica; - citochine infiammatorie primarie;
- citochine infiammatorie secondarie (chemochine); - citochine anti-infiammatorie.
I principali membri della famiglia delle citochine infiammatorie primarie sono l’interleuchina (IL)-1, l’IL-6, e del fattore di necrosi tumorale (TNF). Il loro spettro d’azione comprende una grande varietà di cellule e di tessuti. IL-1 e TNF hanno la capacità di mettere in movimento l’intera cascata di mediatori caratteristici di una risposta infiammatoria; IL-6 tende ad essere in una certa misura un mediatore secondario, nel senso che costituisce la molecola responsabile della produzione di proteine della fase acuta, amplificando così a livello sistemico i meccanismi dell’immunità innata e del rimodellamento tessutale. La cascata delle citochine infiammatorie è soggetta a circuiti di regolazione negativa, che agiscono a livello locale o sistemico. Un primo circuito di regolazione negativa è costituito da citochine anti-infiammatorie, e.g. IL-10 e il fattore di crescita trasformante
Introduzione
(TGF)-β; un secondo circuito di regolazione negativa, riguarda l’asse ipotalamo-ipofisi-surrene, attivato in seguito alla stimolazione nocicettiva da parte delle citochine sulla corteccia somato-sensitiva: sull’ipotalamo, le citochine pro-infiammatorie, inducono la produzione di fattori di rilascio che provocano la produzione di ACTH da parte dell’ipofisi, il quale a sua volta induce la produzione di ormoni glucocorticoidi da parte del surrene; questi ultimi tendono poi a spegnere la produzione di IL-1 e TNF.
Per quanto riguarda il TNF, questo deve il suo nome all’attività necrotizzante esplicata nei confronti di alcuni tumori sperimentali. Si tratta però di un termine fuorviante nel senso che l’effetto antitumorale non costituisce la sua principale attività biologica. Il TNF esiste in due isoforme, il TNF-α e il TNF-β o linfotossina; quest’ultima è prodotta principalmente da cellule linfoidi.
TNF-α è un mediatore centrale delle risposte infiammatorie che condivide buona parte dei suoi effetti con IL-1. E’ sintetizzato come proteina di 26 kDa trans-membrana, classificata di tipo II poiché dotata di un’estremità azoto-terminale all’interno della membrana plasmatica. In questa forma, il TNF-α è un precursore che viene successivamente processato da una metalloproteasi detta TNF-α converting enzyme (TACE) fino ad ottenere una proteina solubile da
17 kDa, che costituisce la forma attiva.
Le sorgenti principali di TNF-α sono i fagociti mononucleati anche se altri tipi cellulari sono in grado di produrre questa citochina. Il TNF-α, sia la forma di membrana che la forma solubile, interagisce con due
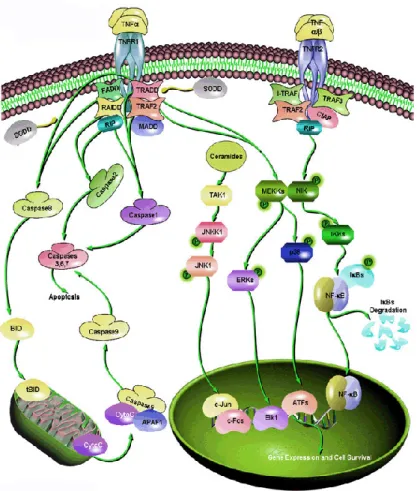
Introduzione
tipi di recettori detti di tipo I (TNF-R1 o p55), e di tipo II (TNF-R2 o p75). Nella sua forma solubile TNF è un omotrimero e interagendo con il recettore causa la multimerizzazione delle catene recettoriali. La formazione di omotrimeri recettoriali attiva la via di trasduzione del segnale. Come mostrato in Figura 4 il recettore di tipo I è principalmente un recettore di morte, in grado di attivare un programma di morte per apoptosi centrato sull’attivazione di una cascata di enzimi proteolitici, le caspasi; il recettore di tipo II è invece un recettore che attiva funzionalmente la cellula ed alcuni dei geni indotti dal recettore di tipo II hanno la funzione di inibire la morte cellulare attivata dal recettore p55.
Introduzione
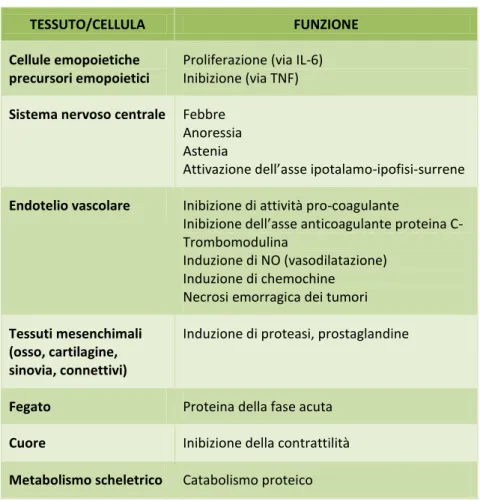
I principali bersagli tessutali e cellulari di TNF sono riportati nella Tabella 2.
Tabella 2 - Bersagli tessutali e cellulari del TNF
TESSUTO/CELLULA FUNZIONE
Cellule emopoietiche precursori emopoietici
Proliferazione (via IL-6) Inibizione (via TNF) Sistema nervoso centrale Febbre
Anoressia Astenia
Attivazione dell’asse ipotalamo-ipofisi-surrene Endotelio vascolare Inibizione di attività pro-coagulante
Inibizione dell’asse anticoagulante proteina C- Trombomodulina
Induzione di NO (vasodilatazione) Induzione di chemochine
Necrosi emorragica dei tumori Tessuti mesenchimali
(osso, cartilagine, sinovia, connettivi)
Induzione di proteasi, prostaglandine
Fegato Proteina della fase acuta
Cuore Inibizione della contrattilità
Metabolismo scheletrico Catabolismo proteico
Un esempio dell’importanza delle interazioni fra TNF-α e obesità è rappresentato dagli effetti esercitati nella nonalcoholic steatohepatitis (NASH), dove il TNF-α, ad oggi, è considerato un fattore critico nella progressione di queste patologie epatiche. Infatti, studi clinici eseguiti confrontando pazienti affetti da NASH con pazienti affetti da nonalcoholic fatty liver (NAFL) dimostrano che l’espressione del
TNF-α è aumentata in modo statisticamente significativo solo nei primi rispetto ai soggetti con NAFL (Crespo J et al., 2001). L’effetto del TNF-α si esprime con l’attivazione del fattore trascrizionale
Introduzione
nuclear factor-κB (NF-κB) tramite il TNF-R1 e comporta la
produzione di un gran numero di citochine pro-infiammatorie (Feldstein AE et al., 2004). Inoltre, sempre il TNF-α induce negli epatociti ulteriore accumulo di acidi grassi favorendo la lipogenesi de novo. In questo modo la citochina infiammatoria riveste un ruolo
rilevante nell’evoluzione delle complicanze di lipotossicità negli epatociti.
Per quanto riguarda IL-6, questa è una citochina che in generale è coinvolta come ultimo effettore delle risposte generate sia da IL-1 che da TNF e su di queste ha una funzione regolatoria. Inoltre ha un ruolo centrale nell’induzione della risposta di fase acuta a livello epatico. IL-6 è una citochina di circa 16 kDa di peso molecolare prodotta da una varietà di tipi cellulari, in particolare dai monociti-macrofagi. IL-6 interagisce con un recettore costituito da due differenti subunità: una subunità α ed una subunità detta GP130, comune a recettori che riconoscono altre citochine quali IL-11 e cardiotrofina. La catena specifica importante per il riconoscimento di IL-6 è la catena detta IL-6R. Quest’ultima funziona in modo peculiare nel senso che interagisce con il ligando ed è capace di formare un complesso recettoriale IL-6R-ligando-GP130, sia associato alla membrana sia in forma solubile. Questo meccanismo (detto di trans-signaling) permette che possano rispondere all’IL-6 cellule quali le endoteliali che non esprimono la catena IL-6R. IL-6 agisce attivando la via JAK-STAK. In modo schematico, l’interazione del recettore IL-6R-GP130 causa l’attivazione di enzimi tirosin-chinasici della
Introduzione
famiglia JAK (Janus kinase), i quali fosforilano il recettore attivandolo. In questo modo il recettore viene legato da fattori trascrizionali presenti nel citoplasma appartenenti della famiglia STAT (Signal Transducers and Activator of Transcription) e questi, legati al recettore, sono anch’essi oggetto di fosforilazione da parte delle tirosin-chinasi JAK. Successivamente, gli STAT fosforilati, formano dimeri che migrano nel nucleo e attivano la trascrizione genica (Fig. 5).
Figura 5 - Via del segnale di IL-6
IL-6 è anche un fattore di crescita emopoietico, che agisce in particolare sulla differenziazione megacariocitaria e uno stimolatore della proliferazione dei linfociti T e B. Quest’ultima proprietà è importante in alcune patologie neoplastiche del sistema emopoietico
Introduzione
quale il mieloma multiplo. IL-6 agisce sull’endotelio vascolare amplificando l’espressione di molecole adesive e di alcune chemochine. In questo contesto si ritiene che IL-6 sia particolarmente importante nel favorire la trascrizione dell’infiammazione acuta a quella cronica, favorendo la produzione di chemochine attive sui monociti rispetto a chemochine attive sui neutrofili. Ancora, come già detto, IL-6 è il mediatore ultimo responsabile di alcuni effetti di IL-1 e TNF, quali la febbre. Inoltre, IL-6 gioca un ruolo centrale a livello epatico inducendo la produzione di proteine della fase acuta (Pontieri GM et al., 2005)
1.3.2 Meccanismi di induzione
E’ attualmente ben noto che il tessuto adiposo bianco contiene, oltre ad adipociti maturi contenenti acidi grassi, molti altri tipi cellulari, compresi pre-adipociti immaturi, cellule mesenchimali multipotenti, fibroblasti, cellule endoteliali, cellule nervose e persino cellule immunitarie e macrofagi (Suganami T et al., 2005; Lumeng CN et al., 2007; Bittolo Bon G., 2008; Tedesco L et al, 2008; Nishimura S et al., 2009).
Questo tessuto subisce sostanziali alterazioni quando un individuo diventa obeso e questo si riflette sia a livello cellulare che molecolare, influenzando il metabolismo sistemico. Come prima cosa, negli adipociti di persone obese si osserva un aumento di FFA e glicerolo. In particolare gli FFA sono causa di IR e ridotta espressione della perilipina, importante proteina utile per favorire la mobilitazione degli
Introduzione
acidi grassi (Whang Y et al., 2003; Greenberg AS et al., 2006; Bezaire V et al., 2009). Inoltre, confrontato con quello di persone magre, il tessuto adiposo obeso mostra un’ampia espressione di proteine pro-infiammatorie come TNF-α, IL-6 (Kern PA et al., 2001; Tilg H et al., 2008; Gustafson B, 2010) insieme con altri marcatori infiammatori
quali TGF-β, e l’inibitore dell’attivatore del plasminogeno (PAI)-1 (Tworowska-Bardzińska U et al., 2009).
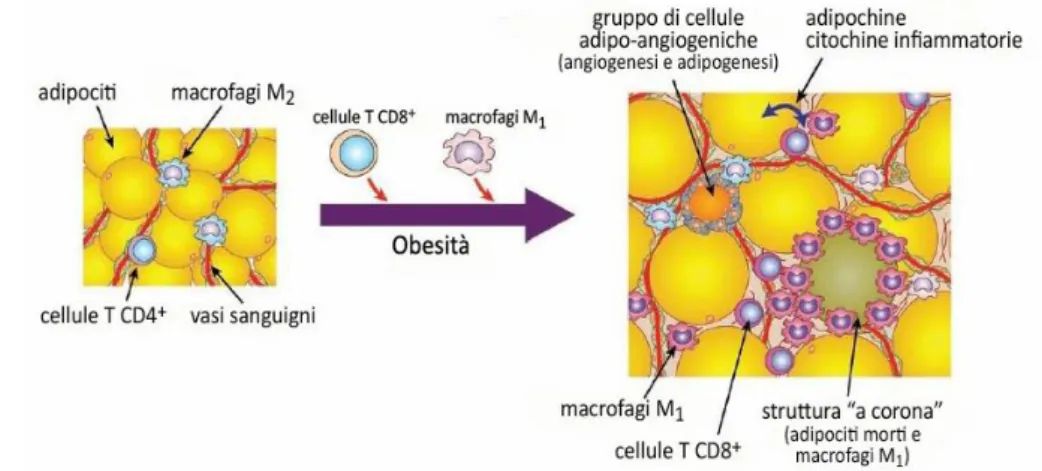
Recenti studi hanno dimostrato che il tessuto adiposo obeso si caratterizza anche per un aumentata infiltrazione di macrofagi (Weisberg SP et al., 2003), a causa dell’effetto chemiotattico di cui sono responsabili i grandi adipociti a fine ciclo cellulare, ampiamente espressi nel tessuto obeso (Fig. 6) (Cinti S et al., 2005). L’infiltrazione macrofagica è molto importante in quanto i macrofagi contribuiscono all’aumentata secrezione di citochine infiammatorie (Tilg H et al., 2008).
Figura 6 - Tessuto adiposo, obesità, infiammazione. L’obesità del grasso viscerale induce una cascata infiammatoria con accumulo di cellule immunitarie, attivazione di leucociti, cellule endoteliali accoppiata con angiogenesi, adipogenesi e morte degli adipociti. Modificato da Nishimura S
Introduzione
L’esistenza di una precisa comunicazione paracrina fra adipociti “obesi” e macrofagi è stata dimostrata su cellule in coltura e questa condizione potrebbe essere la causa della flogosi tessutale osservata negli obesi (Berg AH. et al., 2004). Uno dei principali segnali paracrini prodotti dai macrofagi è il TNF-α: l’effetto diretto del TNF-α sugli adipociti è quello di indurre lipolisi, cioè il rilascio in circolo di FFA, e modulare la sintesi di adipochine anti-infiammatorie come l’ADN (Maeda N et al., 2001; Guilherme A et al., 2009). Tuttavia anche gli FFA dimostrano di possedere una funzione analoga al TNF-α, agendo come messaggeri pro-infiammatori sui macrofagi tramite l’interazione con il Toll-like receptor 4 (TLR4) con cui inducono uno stato pro-infiammatorio sugli adipociti e la produzione di TNF-α nei macrofagi (Shi H et al., 2006; Nguyen MT et al., 2007). Si stabilisce così un circolo vizioso in cui il TNF-α derivato dai macrofagi stimola il rilascio di FFA dagli adipociti, e quest’ultimi di conseguenza aumentano l’attività pro-infiammatoria dei macrofagi, in quanto causano la rinnovata sintesi di TNF-α (Suganami T et al., 2005).
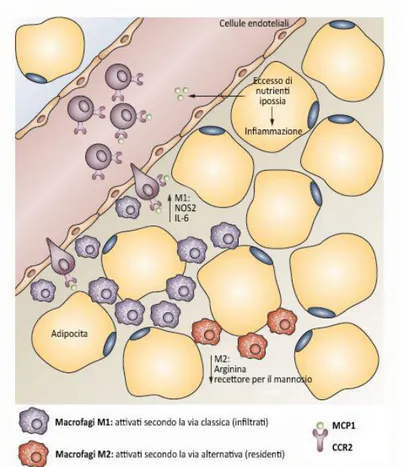
Studi su modelli animali hanno permesso di meglio comprendere il coinvolgimento dei macrofagi in questo processo, ponendo l’attenzione sulle due sottoclassi; i macrofagi M1 e M2 (Fig. 7). Nel
tessuto adiposo obeso, rispetto ai macrofagi M2, produttori di
citochine anti-infiammatorie sono presenti prevalentemente i macrofagi M1. Gli M1 sono tipicamente rappresentati in contesti
Introduzione
rapporti di popolazione con una prevalenza di M1. L’alterazione del
bilancio fra i due tipi di macrofagi contribuisce a determinare la condizione pro-infiammatoria tipica dell’obesità (Gordon S, 2007; Lumeng CN et al., 2007).
Figura 7 - Popolazione di macrofagi nel tessuto adiposo obeso Modificato da Rocha VZ & Libby P, 2009
Un altro aspetto rilevante è rappresentato dal coinvolgimento del sistema immunitario (Fig. 8): in topi obesi, tramite studi di imaging, è stata osservata una chiara infiltrazione nel tessuto adiposo di linfociti T CD8+, cellule NK e monociti che precede l’infiltrazione dei macrofagi (Nishimura S et al., 2009). L’ipotesi a tutt’oggi più accreditata è che i linfociti T CD8+ rappresentino i reali iniziatori della cascata infiammatoria che causa l’infiltrazione e la differenziazione
Introduzione
macrofagica nonché l’innesco di altre manifestazioni, quali la neoangiogenesi e la morte cellulare per necrosi. Ad oggi, non si conoscono i meccanismi molecolari specifici che inducono i leucociti ad attivarsi; tuttavia, sia in modelli animali che nell’uomo è stata rilevata un’aumentata espressione chemochine attrattive ed in particolare il regulated upon activation, normal T-cell expressed and secreted (RANTES) e il suo recettore CC-receptor 5 (CCR5) nel
tessuto adiposo. Questo potrebbe spiegare l’aumentata localizzazione in questa sede dei linfociti T (Wu H et al, 2007).
Figura 8 - Relazione fra linfociti T CD8+, macrofagi e adipociti Modificato da Nishimura S et al., 2009
L’importanza del coinvolgimento linfocitario è sottolineato dal fatto che ridurre il loro livello significa ridurre la quantità di macrofagi M1 presenti nel tessuto, sia che avvenga nelle prime fasi
dell’infiammazione oppure successivamente. Fra linfociti, macrofagi e adipociti si stabilisce un fine dialogo inter-comunicativo, necessario per il mantenimento della flogosi tessutale (Nishimura S et al., 2009). L’origine del processo infiammatorio a seguito dell’accumulo di
Introduzione
glucosio e acidi grassi è legato al fatto che il loro metabolismo porta alla produzione, in particolare, di diacilgricerolo, ceramidi e specie reattive dell’ossigeno. Queste ultime sono in grado di attivare alcune vie di segnalazione intracellulare tipicamente pro-infiammatorie e in grado di indurre IR come ad esempio la via c-Jun
N-terminal Kinase (JKN)/activator protein (AP)-1, e quella I-kappaB
kinase (IKK)/nuclear factor (NF)-B (Brose N et al., 2002; Ozcan U et al., 2004; Schenk S et al., 2008) nonché di attivare alcuni recettori
lipidici come TLR4, CD36, GRP (Lee YJ et al., 2003; Shi H et al., 2006). Questo porta a un’aumentata espressione di citochine e molecole di adesione la cui entità aumenta non solo in ambito adipocitario ma anche a livello sistemico, definendo così una situazione di infiammazione cronica.
E’ stato anche ipotizzato che alla base del processo infiammatorio ci sia l’aumento delle dimensioni degli adipociti: l’espansione che le cellule del tessuto adiposo subiscono a causa dell’obesità è responsabile di una ipossia localizzata (Trayhurn P et al., 2008). Da ciò si sviluppa direttamente un’infiammazione cronica, attraverso processi di adattamento, negli adipociti ma anche nei macrofagi, che prevede l’attivazione di alcuni fattori trascrizionali, quali HIF-1 e NF-B (Ye J et al., 2007).
Un altro meccanismo proposto per spiegare l’associazione fra infiammazione e obesità è lo stress del reticolo endoplasmatico perché l’eccesso di nutrienti che si verifica in queste condizioni può influenzarne la funzione portando ad un accumulo di proteine
Introduzione
unfolded (Hotamisligil GS, 2010), responsabili dell’attivazione di
risposte infiammatorie fra cui in particolare la via del JNK-1 e di NF-B (Hirosumi J et al., 2002; Nakatani Y et al., 2005; Antuna-Puente et al., 2008; Hotamisligil GS, 2010; van de Woestijne AP et al., 2011).
1.3.3 Effetti del processo di flogosi sul metabolismo energetico
L’infiammazione, è considerata un evento chiave per molti processi patologici, quali l’evoluzione di una placca aterosclerotica verso la rottura o l’induzione di IR (Hotamisligil GS, 2006; Rocha VZ & Libby P, 2009). Il bilancio fra mediatori pro-infiammatori e anti-infiammatori è un punto essenziale per lo sviluppo di alterazioni metaboliche e cardiovascolari.
Nel tessuto adiposo l’infiammazione, causata dall’aumentata produzione di citochine pro-infiammatorie, potrebbe rappresentare una risposta fisiologica protettiva nei confronti dell’abnorme accumulo energetico di cui l’obesità si caratterizza. Nelle persone obese si osserva infatti uno sbilanciamento dell’equilibrio metabolico/funzionale rivolto verso l’accumulo di energia. Nel 2010 Ye J. e collaboratori (Ye J & Keller JN, 2010), hanno mostrato come gli effetti del processo infiammatorio si ripercuotano a feedback sul tessuto adiposo stesso con l’obiettivo di ridurre ulteriore accumulo di energia (Fig. 9).
Introduzione
Questa funzione si esplica attraverso:
- riduzione del numero di adipociti e inibizione della loro attività endocrina;
- rimodellamento del tessuto adiposo; - mobilitazione di acidi grassi;
- regolazione dell'accumulo di energia.
Figura 9 - L'Infiammazione nell'obesità Modificato da Ye J et al., 2009
Per quanto riguarda il primo punto, le citochine infiammatorie esercitano un effetto inibitorio sulla differenziazione dei pre-adipociti e, nelle cellule mature, sulla produzione di diverse adipochine, fra cui l’ADN. In questo modo l’infiammazione inibisce la possibilità di ulteriori accumuli di glucosio e acidi grassi, riducendo il numero di cellule, cioè di adipociti maturi, in grado di acquisirli. Tuttavia, le conseguenze dirette di questo adattamento sono l’insorgenza di IR, iperglicemia e in ultima analisi T2DM.
Introduzione
L’attività dei macrofagi è invece il fulcro del secondo effetto. Durante l’infiammazione, infatti, i macrofagi non producono solo citochine, ma anche molti fattori angiogenici. I più rappresentati sono PDGF (Platelet-derived growth factor), TGF-β e HGF (Hepatocyte growth factor), normalmente utili durante le fasi di maturazione del tessuto; in
questo contesto risultano sovra-espressi causando un graduale effetto di rimodellamento. In più, i macrofagi sono in grado di regolare anche il flusso di sangue in quanto inducono la produzione di NO, un tipico agente vasodilatatore endoteliale (Lijen HR, 2008; Chistiaens V & Lijnen HR, 2010).
Inoltre, le citochine infiammatorie, in particolare TNF-α e IL-6, sono in grado di regolare la mobilitazione di FFA verso altri tessuti. Ciò ha l’obiettivo di evitare l’ulteriore accumulo di grassi negli adipociti. In questo senso infatti, l’aumento del livello di FFA in circolo accelera il consumo di energia (perché non vengono accumulati negli adipociti trigliceridi), ma possiede anche l’effetto negativo di aumentarne il deposito in sedi extra adipocitiche, ovverosia di aumentare la quantità di grasso ectopico. La conseguenza in questo caso è un aumentato rischio aterosclerotico (Ye J et al., 2010).
Infine, sempre le citochine, sono coinvolte nella regolazione fra assorbimento e consumo di energia tramite un’azione diretta sul sistema nervoso centrale. Nella condizione di obesità, in particolare IL-1 e IL-6 si sono dimostrate in grado di ridurre l’iperfagia e l’assunzione di cibo (Chida D et al., 2006). Le citochine rappresentano veri e propri segnali anti-obesità e possono servire
Introduzione
come mezzo di comunicazione fra sistema nervoso e tessuti periferici, nel controllo del bilanciamento energetico dell’organismo.
In conclusione, le attività che le citochine infiammatorie esercitano a livello degli adipociti, ma anche del sistema nervoso, sottolineano il ruolo positivo dell’infiammazione nell’obesità che risulta nell’inibizione di un eccessivo e controproducente accumulo di energia. Questo adattamento fisiologico, tuttavia, aumenta la suscettibilità a patologie quali T2DM, aterosclerosi, sindrome metabolica (Ye J et al., 2010); studi recenti eseguiti su modelli animali mantenuti a regime dietetico a basso contenuto calorico indicano che la restrizione calorica porta a una riduzione dell’infiammazione e dell’incidenza delle diverse complicanze (Fontana L, 2009).
La restrizione calorica ha effetti benefici anche in modelli non obesi, sia umani che di roditori (Colotti C et al., 2005; Redman LM et al., 2008). Ciò indica che la riduzione dell’adiposità non è l’unico effetto positivo della restrizione calorica; da qui l’importanza di ridurre l’accumulo energetico perché ciò può avere effetti benefici nella popolazione in toto (obesi e non obesi).
1.4 Obesità e malattia cardiovascolare
E’ oramai accertato, sulla base di grandi studi epidemiologici, che l’obesità è il maggior fattore di rischio cardiovascolare (Whitlock G et al., 2009).
Introduzione
Le malattie cardiovascolari (CVD) rimangono ancora oggi uno dei più gravi problemi di salute pubblica, nonostante gli enormi progressi terapeutici degli ultimi anni (Marchegiani F et al., 2009). Ad oggi le CVD sebbene non completamente curabili, possono essere controllate e possono essere prevenute grazie anche alla conoscenza dei molti fattori di rischio in grado sia di “influenzarne” l’insorgenza sia di individuare gli individui maggiormente a rischio. Fra questi fattori i più importanti sono l’età, il sesso, la pressione sanguigna, i livelli di colesterolo, il fumo, il diabete, l’obesità e lo stile di vita (Tab. 3). A conferma dell’importanza di questi fattori è stato osservato che grazie al solo cambiamento dello stile di vita (riduzione del numero di sigarette fumate e aumento dell’attività fisica) e al controllo di fattori quali la pressione arteriosa e i livelli di colesterolo, si è avuta una riduzione dei casi di CVD nelle donne di oltre il 20% (Brown JR & O’Connor GT, 2010).
Tabella 3 - Fattori di rischio cardiovascolari Modificato da Marchegiani F et al., 2009
Fattori di rischio non modificabili Fattori di rischio parzialmente modificabili Fattori di rischio modificabili
Età Diabete Mellito Mancanza di attività fisica
Sesso Ipertensione arteriosa Fumo
Storia personale di CVD Obesità Alimentazione ricca di grassi
Fattori genetici Ipercolesterolemia Abuso di alcool
Basso colesterolo HDL
Le più rilevanti complicanze cardiovascolari associate all’obesità sono rappresentate dalla malattia coronarica (CAD), dall’insufficienza
Introduzione
cardiaca (HF), e dalla cardiomiopatia dilatativa (DMC) (López-Jiménez F & Cortéz-Bergoderi M, 2011).
L’obesità e il sovrappeso rappresentano entrambi un fattore di rischio cardiovascolare, soprattutto in pazienti che hanno già sofferto di infarto del miocardio. Infatti, più dei due terzi dei pazienti con CAD è obeso o in sovrappeso (Romero-Corral A et al., 2006; López-Jiménez F et al., 2008). Inoltre, rispetto all’accumulo generale di grasso, a rivestire una maggiore importanza come fattore di rischio, è il deposito in altri sedi ectopiche. Queste sono strettamente correlate ai fattori di rischio convenzionali per le CVD (i.e. iperlipidemia, diabete, ipertensione, stile di vita) (Gastaldelli A et al., 2010).
1.4.1 Grasso ectopico e malattie cardiovascolari
Il grasso viscerale è associato a tutti i fattori di rischio cardiometabolici e, in particolare esiste uno stretto legame fra grasso addominale e CAD (Despres JP et al., 2008; Yusuf S et al., 2004) come riportato anche dal risultato dello studio Framingham (Mahabadi AA et al., 2009). Inoltre, lo studio “Heart Outcomes Protection Evaluation” (HOPE), che includeva 6620 uomini e 2182 donne
seguite per 4.5 anni, ha mostrato come l’aumento della circonferenza vita (>103 nei maschi o >98 nelle femmine) aumenti il rischio di morte per cause cardiovascolari del 29%, di infarto del miocardio del 27% e la morte in generale del 35% (Dagenais GR et al., 2005). Il deposito di grasso maggiormente implicato nella patogenesi della CAD è il grasso epicardico, non solo perché esiste una stretta
Introduzione
relazione anatomica fra le coronarie e il grasso epicardico (Iacobellis G et al., 2005). Diversi studi hanno infatti evidenziato una correlazione diretta fra questo tipo di grasso e la presenza di aterosclerosi coronarica (Taguchi R et al., 2001; Djaberi R et al., 2008). Lo studio Framingham indica che l’incidenza di CAD e infarto del miocardio è più strettamente correlata al grasso epicardico piuttosto che al viscerale (Mahabadi AA et al., 2009). Il grasso epicardico è sorgente di citochine (Sacks HS et al., 2007) che possono indurre i monociti infiltrati nell’intima a differenziare in macrofagi così da influenzare l’evolversi del processo aterosclerotico (Shimabukuro M, 2009). Nei pazienti con CAD, il grasso epicardico secerne molti mediatori dell’infiammazione (e.g. interleuchine, TNF-α e il monocyte chemotactic protein-1, MCP-1) e presenta una espressione di geni associati con l’infiammazione significativamente maggiore rispetto al tessuto adiposo sottocutaneo (Taguchi R et al., 2001; Sacks HS et al., 2007).
Il tessuto adiposo ectopico (epicardico e epivascolare) può influenzare meccanicamente e funzionalmente tutto il sistema cardiovascolare. Soggetti con un aumento di depositi ectopici di grasso (sia viscerali che cardiaci) manifestano ridotta contrattilità cardiaca (Sironi AM et al., 2008) e ridotta funzione diastolica (Rijzewijk LJ et al., 2008). Per
la loro localizzazione anatomica, il grasso epicardico e intra-miocardico sono direttamente implicati nel metabolismo cardiaco: possibili effetti lipotossici a livello cardiaco potrebbero essere coinvolti nell’insorgere e nella progressione di cardiomiopatie.
Introduzione
La presenza di depositi di grasso ectopico è una caratteristica tipica anche di soggetti ipertesi (Sironi AM et al., 2004). Lo studio Framingham ha mostrato che negli individui obesi e in sovrappeso l’incidenza di ipertensione, alterata tolleranza al glucosio a digiuno, e sindrome metabolica aumenta linearmente e in modo significativo all’aumento di massa grassa viscerale (Fox CS et al., 2007).
1.4.2 Sindrome metabolica e rischio cardiovascolare
Secondo il “National Cholesterol Education Program Adult Treatment Panel III” (NCEP-ATP III), il rischio relativo di sviluppare CVD associata con sindrome metabolica è aumentato dalle due alle cinque volte sia negli uomini che nelle donne. Soggetti con sindrome metabolica presentano aumentata sia morbilità che mortalità per malattie cardiovascolari (Isomaa B et al., 2001). Più in generale si calcola che la sindrome metabolica sia la causa di circa il 7% della mortalità mondiale e più del 17% di quella per CVD. Dati ottenuti dal “Framingham Heart Offspring Study” mostrano che la sindrome metabolica incide per il 34% negli uomini e per il 16% nelle donne sull’incidenza del CVD. (Ford ES, 2005).
Inoltre, uno studio condotto in Quebec (Quebec Cardiovascular Study), è emerso che persone con livelli elevati di adipo-B, LDL e
iperinsulinemia hanno un rischio di CVD aumentato esponenzialmente a differenza di individui che non hanno nessuna di queste alterazioni metaboliche (Lamarche B et al., 1998). Dall’”United Kindom Prospective Diabetes Study”, livelli circolanti di
Introduzione
lipidi superiori al range di normalità sono identificati come il principale fattore di rischio di malattia coronarica, particolarmente tra le donne. Infatti elevati livelli di trigliceridi e bassi livelli di HDL sono chiari indici di aumentato rischio cardiovascolare (Ryden L et al., 2007).
Queste osservazioni indicano che sebbene l’aumento del rischio di malattie cardiovascolari associato a sindrome cardio-metabolica abbia molte cause, la dislipidemia è quella che gioca un ruolo di primo piano.
1.4.3 Obesità, fegato e malattia cardiovascolare
L’obesità e il tessuto adiposo viscerale, insieme con diabete mellito e ipertensione rappresentano fattori di rischio per lo sviluppo di patologie epatiche. In particolare l’obesità influenza un importante causa di malattia cronica del fegato, conosciuta come NAFLD e caratterizzata principalmente da steatosi epatica non associata ad abuso di alcool (McCollough AJ, 2002). Molto spesso la steatosi è causata da un eccessivo consumo di bevande alcoliche: l’assunzione di soli 20 g di alcol al giorno per le donne e 30 g al giorno per gli uomini è sufficiente per causare la compromissione del fegato in tal senso (Angulo P et al., 2004). Lo “studio Dionysos”, che ha eseguito analisi di popolazione con l’impiego di una tecnica ad ultrasuoni per la rilevazione della quantità di grassi nel fegato ha mostrato la presenza di una percentuale di grassi pari al 76% in soggetti obesi non bevitori, rispetto al 10-15% nelle persone normali (Bedogni G et al.,
Introduzione
2005); inoltre, confrontato con i controlli, il rischio di steatosi si è rivelato più alto di 4.6 volte in persone obese non bevitrici e più alto di circa 5.6 volte per gli obesi che sono anche assidui bevitori. Da questi dati si può dedurre l’esistenza di altri elementi, oltre all’alcolismo, come causa di steatosi: i fattori di rischio associati a NAFLD sono fra questi.
A seconda dei fattori eziologici, si possono distinguere due classi di NAFLD (Lazo M et al., 2008):
- NAFLD primarie: emergono in associazione con la sindrome metabolica
- NAFLD secondarie: associate frequentemente ad infezioni, uso/abuso di farmaci e predisposizioni genetiche.
Dal punto di vista fisiopatologico, le NAFLD possono manifestarsi come NAFL, oppure come reazioni infiammatorie definite come NASH spesso accompagnate da fibrosi portale da cui si sviluppa cirrosi.
Dati epidemiologici confermano che il 10% dei pazienti affetti da NAFLD manifesta anche la NASH e di questi ultimi fra l’8-26% evolve in cirrosi (Matteoni CA et al., 1999). Questi pazienti hanno un alto rischio di sviluppare cancro epatocellulare (HCC), ipertensione portale con emorragie gastroesofagee, ascite e insufficienza epatica (Guzman G et al., 2008) (Fig. 10).
Ad oggi, la principale causa che è considerata di primaria importanza nello sviluppo di NAFL è il livello di FFA circolanti. L’assunzione con il cibo e la lipolisi offerta dall’attività del tessuto adiposo
Introduzione
viscerale ne sono i responsabili. Donnelly e collaboratori (Donnelly KL et al., 2005) hanno mostrato che il tessuto adiposo è fra i due, il fattore preponderante, contribuendo all’aumento dei livelli di FFA per oltre l’85% in condizioni di digiuno e per il 62% dopo i pasti. Le conseguenze che gli epatociti subiscono sono dovuti all’eccesso di acidi grassi: l’accumulo ha un effetto tossico (soprattutto l’acido palmitico e stearico) in grado di indurre apoptosi tempo e dose dipendente (Malhi H et al, 2007). Infatti la saturazione tossica da FFA causa nella cellula l’attivazione della via apoptotica promossa da JNK (Shattenberg JM et al., 2006; Wree A et al., 2011).
Un’altra conseguenza dell’accumulo di acidi grassi è relativo alla secrezione di citochine pro-infiammatorie e in particolare di TNF-α, in grado di aumentare l’accumulo di lipidi negli epatociti. L’importanza di questa citochina è sottolineata da studi farmacologici e genetici in grado di inattivarne la via di segnalazione di cui è responsabile: in questo caso è ben documentata la riduzione dell’accumulo lipidico (Barbuio R et al., 2007).
L’influenza del tessuto adiposo viscerale nella patogenesi delle NAFLD si conferma nell’osservazione che pazienti affetti da questo tipo di disturbo sono caratterizzati della variazione dei normali livelli di molte altre adipochine, (oltre quelle di natura infiammatoria) come la leptina, l’ADN, la resistina e la visfatina (Marra F & Bertolani C, 2009; Wree A et al., 2011).
Introduzione
Figura 10 - Influenza del tessuto adiposo viscerale nella NAFLD Modificata da Wree A et al., 2011
Negli ultimi anni, l’interesse fra obesità e fegato si è spostato sullo studio di altre patologie. In particolare, l’obesità è riconosciuta ad oggi un cofattore predisponente al danno epatico indotto dall’epatite cronica di tipo C (Monto A et al., 2002; Negro F, 2002; Wree A et al., 2011); studi recenti hanno dimostrato un’importante associazione fra alti valori di BMI e danni epatici in grado di evolvere in insufficienza epatica acuta (Cambay A et al., 2009); inoltre, obesità e T2DM sono considerati fattori di rischio per l’evoluzione di tumori epatici come ad esempio il più frequente HCC (Caldwell SH et al., 2004).
Inoltre, le NAFLD sono riconosciute come fattori di rischio per le CVD (Lautämaki R et al., 2006; Lamb HJ et al., 2008; Gastaldelli A et al., 2009; Gastaldelli A & Basta G, 2010). La presenza di depositi
di grasso epatico è associata al rilascio di un maggior numero di marker infiammatori (e.g. C-reactive protein, CRP) e fattori pro-aterosclerotici, con un aumentato rischio di sviluppare CVD
Introduzione
(Burgianesi E et al., 2005; Villanova N et al., 2005; Iannou GN et al., 2006; Kotronen A & Yki-Jarvinen H, 2008). Recenti evidenze sottolineano che le NAFLD influenzano negativamente il metabolismo cardiaco, facilitando l’accumulo di grasso epicardico e intratoracico (Perseghin G et al., 2008). In soggetti con T2DM e CAD, il grasso epatico rappresenta un chiaro indicatore tanto di IR quanto di ridotta capacità contrattile del miocardio (Lautamaki R et al., 2006); mentre in soggetti affetti da NAFLD studi sull’endotelio
rivelano una ridotta funzionalità vasodilatatoria proporzionale alla gravità del danno epatico (Villanova N et al., 2005). Anche nel caso di steatosi semplici è dimostrata la presenza di placche aterosclerotiche in corrispondenza delle carotidi (Gastaldelli A et al., 2009) che tendono a peggiorare in soggetti con NAFLD e in particolare NASH (Targher G et al., 2006).
Introduzione
2. IL TESSUTO ADIPOSO
2.1 Definizione e funzioni
Il tessuto adiposo è un tipo di tessuto comune costituito da adipociti il cui ruolo principale è quello di rappresentare una riserva energetica sotto forma di grasso che protegge e isola il corpo, essendo localizzata principalmente sotto gli strati cutanei e interna agli organi interni. Inoltre, possiede un’importante funzione endocrina scoperta più di recente, producendo numerose sostanze biologicamente attive. Il tessuto adiposo nel mammifero può essere distinto in tessuto adiposo bianco (WAT) e tessuto adiposo bruno (BAT). La rispettiva quantità dei due tipi varia a seconda della specie, del genere, dell’età e delle diverse condizioni ambientali e nutrizionali.
Gli adipociti bruni, che costituiscono il BAT, sono cellule “multiloculari” così denominate perché possiedono numerose gocce lipidiche sparse per il citoplasma, con un nucleo centrale rotondo e grossi mitocondri. Questo tipo di tessuto adiposo risulta abbondante nel neonato ma è molto scarso nell’uomo adulto e appare brunastro se osservato al microscopio ottico sia per la presenza massiccia di mitocondri che per l'elevata vascolarizzazione. Sebbene sia poco chiaro quale possa essere il suo ruolo, le ultime ipotesi al riguardo sottolineano il possibile coinvolgimento del BAT nella dissipazione di energia sottoforma di calore. Infatti, diversamente dalle altre cellule, i mitocondri dell’adipocita bruno esprimono una proteina specializzata nel meccanismo del disaccoppiamento, quel fenomeno biologico che
Introduzione
agisce sulla fosforilazione ossidativa e grazie al quale è possibile dissipare calore invece che sintetizzare ATP (Virtanen KA et al., 2009).
A differenza del tessuto adiposo bruno, WAT è costituito da adipociti così detti “uniloculari”: sono cellule di forma tondeggiante che in gruppo esprimono un aspetto poliedrico, con un nucleo schiacciato in periferia e un sottile strato citoplasmatico a causa dell’accumulo di lipidi. Costituisce il tessuto adiposo più abbondante nell’adulto e può essere a sua volta suddiviso in subcutaneo e viscerale a seconda della localizzazione e della funzione: il tessuto adiposo subcutaneo ha il compito di accumulare calorie in eccesso mentre quello viscerale di rifornire d’energia tutto l’organismo (Bittolo Bon G, 2008).
2.2 Il Tessuto Adiposo come organo endocrino
Il tessuto adiposo bianco è tipicamente considerato un organo esclusivamente dedito all’accumulo energetico e alla regolazione della sua omeostasi, i.e. alla capacità di accumulare energia nella forma di trigliceridi o di rilasciarla nella forma di FFA in funzione delle esigenze (Kahn CR, 2000). Negli ultimi anni, è stata ampiamente riconosciuta la funzione del tessuto adiposo quale organo endocrino. Infatti, è stato osservato che alcuni mediatori umorali, importanti per molti fenomeni quali la regolazione dell’omeostasi energetica, le complicanze dell’obesità, e molti altri effetti tessutali, derivano dagli adipociti del tessuto adiposo bianco. Per questo, già nel 1987, Siiteri
Introduzione
sulla produzione di steroidi sessuali (Siiteri PK, 1987). E’ solo nel 1994, con l’identificazione della leptina (Zhang Y et al., 1994), che l’opinione scientifica inizia ad accettare concretamente questa ipotesi. Successivamente, nel 1996, Smith definiva il tessuto adiposo come “organo endocrino” indagando il ruolo giocato proprio dalla leptina (Smith SR, 1996).
In letteratura, l’”organo endocrino” non è un termine ben definito. Esso è usato comunemente per definire un tessuto od organo che attualmente non appartiene al sistema endocrino, come l’intestino, il polmone e anche la pelle. Dal momento che quasi tutti gli organi sono in grado di secernere alcune molecole nel plasma con un bersaglio indiretto, azione questa definita come endocrina dal “Medical Subject Heading” (MeSH) degli US “National Institutes of Health” (NIH), il termine “organo endocrino” non sembra avere una definizione univoca. Comunque, applicare questo titolo al tessuto adiposo enfatizza il suo ruolo attivo, riconosciuto tutt’oggi dalla sua capacità di produrre un gran numero di sostanze biologicamente attive, indicate complessivamente con il termine di adipochine (Trayhurn P & Beattie JH, 2001, Tedesco L et al., 2008).
2.2.1 Adipochine: definizione
Ad oggi si conoscono più di 50 adipochine (Tab. 4). Fra queste, di importante rilevanza sono la leptina, l’ADN, la resistina e le citochine pro-infiammatorie come TNF-α e IL-6 (Kern PA et al., 2001).
Introduzione
Come mostrato in Figura 11, le adipochine costituiscono una classe di proteine estremamente eterogenea, sia in termini strutturali che funzionali; tuttavia presentano alcune caratteristiche in comune:
-
sono sempre prodotte ex-novo dalla trascrizione dei loro geni e non vengono mai accumulate nella cellula come molecole preformate;
-
hanno un’attività pleiotropica, ovvero agiscono su tipi cellulari diversi;
-
possono avere effetti diversi sulla stessa cellula bersaglio, ovvero una può antagonizzare l’effetto di un’altra, dirette entrambe sulla stessa cellula;
-
la loro attività è spesso ridondante, ovvero adipochine differenti possono svolgere la stessa azione biologica;
-
la loro azione dipende dal legame a specifici recettori presenti sulle cellule bersaglio. Queste ultime possono essere: le stesse che secernono l’adipochina (azione autocrina); vicine o a breve distanza (azione paracrina); lontane, attraverso la circolazione periferica (azione endocrina).
Introduzione
Figura 11 - Proteine secrete dagli adipociti. Modificato da Tedesco L et al, 2008
2.2.2 Adipochine: classificazione e funzioni
Il tessuto adiposo invia in tutto l’organismo una vasta quantità di segnali proteici attraverso le adipochine che includono fattori di crescita, citochine, chemochine, proteine della fase acuta, fattori “complement-like” e molecole d’adesione. Le proteine responsabili di queste azioni sono elencate nella Tabella 4. Le adipochine influenzano il comportamento delle cellule specifiche verso cui sono indirizzate, agendo da mediatori e/o da segnali intercellulari.
Il WAT secerne adipochine diverse a seconda della localizzazione; questo è molto importante quando si considerano i rischi associati all’incremento della massa di tessuto adiposo. Per esempio, l’incremento del WAT viscerale piuttosto che l’aumento dei depositi di grasso subcutaneo, rappresenta un fattore di rischio molto più grave per IR, diabete e malattie cardiovascolari (Rasmussen MS et al., 2006; Rodríguez A et al., 2007; Ohman MK et al., 2008; Taksali SE et al., 2008; Gómez-Abellán P et al., 2010).
Introduzione
Tabella 4 -Classificazione delle adipochine
Fattori di crescita
fibroblast growth factors (FGFs), insulin-like growth factor-1 (IGF-1), HGF, nerve growth factor
(NGF), vascular endothelial cell growth factor (VEGF);
Citochine IL-1β, IL-4, IL-6, IL-8, IL-10, IL-18, TNF-α,
macrophage migration inhibitory factor (MIF);
Fattori
complemento-simili (correlati) adipsina, ADN, acylation stimulating protein (ASP);
Molecole di adesione e componenti della
matrice
α2-macroglobulina, vascular cell adhesion molecule-1 (VCAM-1), intracellular adhesion molecule-1 (ICAM-1), collagene tipo I,II,III,IV,VI,
fibronectina, matrix metalloproteinase;
Proteine della fase
acuta CRP, Serum Amyloid A3 (SAA3), PAI-1, aptoglobina;
Chemochine MCP-1, macrophage inhibitory protein-1α (MIP-1α);
Adipochine coinvolte in processi metabolici
adipocyte fatty acid binding protein (aP2), apolipoprotein E (apoE), resistina, omentina,
vaspina, apelina, retinol binding protein 4 (RBP4), visfatina, ADN, leptina;
Altre adipochine
produzione di PGE2 e PGI2 (prostacicline), sistema renina-angiotensina, pathway nell’ossido nitrico sintasi, tissue inhibitors of metalloproteinases (TIMPs).
Dal punto di vista funzionale, le adipochine sono coinvolte in un ampio numero di processi fisiopatologici e patologici (Fig. 12). Molte adipochine agiscono come ormoni endocrini mentre altre agiscono
Introduzione
localmente; in entrambi i casi si tratta di proteine in grado di modulare non solo la funzionalità di organi distinti come il fegato, il muscolo scheletrico o il cervello, ma anche la capacità stessa degli adipociti di crescere e differenziare. Inoltre esse modulano la sensibilità dei tessuti periferici all’azione dell’insulina, regolano l’appetito, il dispendio energetico, il metabolismo glucidico e lipidico, l’emostasi, l’angiogenesi, la pressione arteriosa e tutto l’asse endocrino e riproduttivo. Molte appaiono fortemente correlate all’immunità e all’infiammazione, tanto che gli adipociti sono paragonati alle cellule immunitarie.
Alcune adipochine giocano un ruolo specifico nell’IR e nelle complicazioni cardiovascolari associate all’obesità. Ci sono infatti molte differenze fra il tessuto adiposo viscerale e quello subcutaneo, soprattutto nell’IR nell’infiammazione correlata all’obesità per quel che riguarda l’espressione genica e di conseguenza la secrezione di un differente insieme di adipochine (Bastard JP et al., 2006; Antuna-Puente B et al., 2008).
Una possibile disregolazione della produzione di adipochine, che si verifica tipicamente nell’obesità, è il motivo per cui gli studi epidemiologici accostano il tessuto adiposo a patologie molto diffuse in abito sia cardiovascolare che metabolico come T2DM, sindrome metabolica, ipertensione, trombosi (Bittolo Bon G., 2008).
Introduzione
Figura 12 - Ruolo funzionale delle adipochine. Modificato da Bittolo Bon G., 2008
2.2.2.1 La leptina: un esempio di funzione endocrina del tessuto
adiposo
La funzione del tessuto adiposo nel metabolismo è ben illustrata dalla secrezione della leptina importante nella regolazione della glicemia e del consumo energetico.
Si tratta di un polipeptide di 167 amminoacidi appartenente alla famiglia delle citochine, identificata nel 1994 da Friedman (Zhang Y et al., 1994) e codificato dal gene dell'obesità Lep(ob). Ha un peso
molecolare di 16 kDa ed è coinvolto nella regolazione del metabolismo lipidico e del consumo energetico, tanto che la sua mutazione è la responsabile dell’obesità in diversi modelli animali, (come ad esempio nei topi ob/ob o nei ratti Zucker), e persino nell’uomo dove il deficit congenito di leptina determina un’obesità grave, trattabile con leptina ricombinante (Farooqi IS et al., 2001). La leptina è secreta quasi esclusivamente dagli adipociti differenziati del
Introduzione
direttamente correlabile alla gravità dell’obesità; la leptina è quindi considerata un indicatore della massa corporea totale (Considire NV et al., 1996): i livelli plasmatici di questo peptide sono normalmente più
elevati nei soggetti obesi piuttosto che nei magri e in condizioni normali aumentano subito dopo il pasto e diminuiscono nel digiuno prolungato.
Esistono diversi recettori per la leptina, identificati in molti tessuti incluso il tessuto adiposo stesso; questo indica l’ampio spettro di funzioni che la leptina ha non solo come fattore endocrino ma anche come fattore paracrino così come la maggior parte delle adipochine. Uno dei recettori maggiormente studiato, denominato ob-Rb, è stato localizzato in particolari regioni ipotalamiche come il nucleo arcuato e il nucleo paraventricolare (Håkansson ML et al., 1998); qui, la leptina esplica la sua funzione principale: agisce sul controllo centrale del bilanciamento energetico favorendo effetti anoressizzanti (poiché influenza negativamente la sensazione della fame) e la riduzione della massa grassa. La leptina è in grado di esprimere anche effetti “insulino-mimetici” in modo similare all’ADN, attraverso l’attivazione dell’ AMP-activated protein kinase (AMPK) responsabile della ridotta lipogenesi e dell’aumentata β-ossidazione. (Minokoshi Y et al., 2002). Infatti, in pazienti affetti da lipodistrofia in cui si manifesta grave ipoleptinemia, IR, steatosi epatica e displipidemia, somministrazioni di questa adipochina riducono l’accumulo di lipidi e migliorano il metabolismo glucidico (Oral EA et al., 2002). Il ruolo della leptina nel metabolismo energetico è tuttavia