3.1. Diabete mellito e conseguenze patologiche
Il diabete mellito è una patologia cronica ad eziologia multipla caratterizzata da un’iperglicemia persistente e da disturbi del metabolismo dei carboidrati, dei lipidi e delle proteine, conseguente ad una alterazione della secrezione o dell’azione dell’insulina. L’insorgere di questo disordine metabolico è dovuto principalmente a fattori genetici, a volte anche sconosciuti, che possono provocare una diminuita o addirittura mancata secrezione dell’insulina. Sono stati proposti vari metodi di classificazione per il diabete mellito, in base all’età di insorgenza (giovanile e senile), oppure alle necessità terapeutiche (insulino-dipendente e non-insulino-dipendente); il verificarsi però di quadri clinici particolari, ad esempio casi di diabete senile ad insorgenza giovanile, oppure diabete non-insulino-dipendente curato con insulina, hanno portato l’OMS nel 1999 a definire le più diffuse tipologie di diabete in:
• Diabete mellito di tipo I: dovuto a fattori genetici, immunitari, ambientali, i quali portano alla distruzione delle cellule β degli isolotti di Langerhans e quindi alla mancata sintesi di insulina. Nella maggior parte dei casi si manifesta in giovane età e risulta curabile solo con iniezioni di insulina.
• Diabete mellito di tipo II: dovuto a fattori genetici, acquisiti o ambientali, caratterizzato dall’insufficiente produzione di insulina che quindi non riesce a smaltire totalmente il glucosio plasmatico. Sembra essere maggiormente diffuso in età avanzata, ma è stato riscontrato anche in soggetti giovani. Generalmente la terapia prevede l’utilizzo di ipoglicemizzanti orali (sulfaniluree e derivati biguanidinici) e, in casi più gravi, di insulina. È sicuramente la forma patologica più diffusa (il 90% dei soggetti affetti da diabete presenta quello di tipo II).
• Diabete mellito secondario: insorge in seguito ad altre patologie come pancreatiti, sindrome di Cushing (aumento di cortisolo, ormone antagonista dell’insulina), acromegalia, infezioni ecc.
• Diabete mellito gestazionale: evento transitorio che colpisce il 2-5% delle donne in gravidanza.
L’iperglicemia persistente causata dal diabete porta ad una serie di conseguenze patologiche tra le quali emergono complicanze acute e complicanze a lungo termine.
9 Complicanze acute:
Chetoacidosi diabetica: tipica del diabete mellito di tipo I, caratterizzata
da un’eccessiva formazione di corpi chetonici dovuta alla carenza di insulina.
Coma iperosmolare non chetosico: tipico del diabete mellito di tipo II, si
manifesta in pazienti anziani; la chetosi acida non è presente perché la poca insulina presente è necessaria a contenere la chetogenesi epatica.
9 Complicanze a lungo termine:
Predisposizione ad infezioni batteriche e fungine: maggiori organi
bersaglio sono cute, mucosa orale e genitale, tratto urinario.
Macroangiopatia diabetica: tendenza a sviluppare più facilmente
l’aterosclerosi, l’eccesso di glucosio nel sangue infatti provoca la glicazione delle proteine LDL, fenomeno alla base dell’aterogenesi.
Microangiopatia diabetica: nel rene (glomerulopatia diabetica) e nel
sistema nervoso periferico (neuropatia diabetica).
Malattie vascolari della retina: retinopatie diabetiche, emorragie e
microaneurismi, cataratta diabetica, glaucoma. In alcuni casi si arriva alla completa cecità.
Anche se non ci sono ancora dei solidi collegamenti patogenetici tra iperglicemia e complicanze diabetiche a lungo termine, molti meccanismi sembrano essere coinvolti negli effetti tossici dovuti all’eccesso di glucosio. Tra i fattori implicati si ritrovano sicuramente l’attivazione della proteina chinasi C (PKC), l’aumentata glicazione delle proteine con la formazione di prodotti finali della glicazione avanzata (AGEs), il verificarsi di stress ossidativo con formazione di specie reattive dell’ossigeno (ROS) ed infine l’attivazione della via dei polioli.2
3.1.1 Complicanze diabetiche legate direttamente all’iperglicemia
L’aumento cronico della glicemia svolge un ruolo critico nello sviluppo e nel progresso delle principali complicanze diabetiche. L’iperglicemia prolungata causa sia cambiamenti acuti e reversibili nel metabolismo cellulare, sia modificazioni irreversibili a lungo termine in macromolecole stabili. Gli effetti dannosi dell’iperglicemia sono più evidenti nei tessuti nei quali l’ingresso del glucosio non dipende dall’insulina e che, quindi, non sono capaci di regolare il trasporto del glucosio attraverso la membrana cellulare (ad esempio il cristallino e il rene).3Tra i molti meccanismi responsabili delle complicanze diabetiche, quelli legati direttamente all’iperglicemia sono:
a) glicazione non enzimatica delle proteine; b) stress ossidativo;
c) attivazione della proteina chinasi C.
a) Glicazione non enzimatica delle proteine
In condizioni di iperglicemia, la quantità in eccesso di glucosio reagisce con le proteine o con i costituenti del sangue, aumentando il tasso fisiologico della glicazione non enzimatica. Grazie alle loro caratteristiche chimiche, i prodotti finali della glicazione avanzata (AGEs) ricoprono un ruolo importante nello sviluppo delle complicanze diabetiche.
La formazione degli AGEs ha inizio con la reazione tra il gruppo carbonilico del glucosio e un gruppo amminico libero delle proteine o degli amminoacidi, formando dei complessi labili quali le basi di Schiff. Una volta formati, i complessi di Schiff subiscono un lento riarrangiamento chimico, che può durare anche delle settimane, il quale termina con la formazione dei prodotti di Amadori, più stabili ma ancora chimicamente reversibili. Questi prodotti subiscono una serie di reazioni a cascata, quali ad esempio reazioni di disidratazione,
condensazione, frammentazione, ossidazione e ciclizzazione che li trasformano in prodotti finali della glicazione avanzata (Fig. 1).
Figura 1. Glicossidazione, autossidazione del glucosio e glicazione non enzimatica delle
proteine.
Alcuni studi chimici e immunologici hanno dimostrato che l’accumulo degli AGEs nei cristallini dei diabetici velocizza il processo della catarattogenesi.3
Gli AGEs sono capaci di formare legami covalenti con i gruppi amminici di altre proteine alterandone la funzione. Per esempio, la formazione di AGEs nel collagene e in altre proteine di matrice riducono, a livello del tessuto vascolare, la vasodilatazione mediata dall’ossido nitrico (NO) e la sensibilità ai fattori antiproliferativi (Fig. 2). Nel glomerulo, la modificazione della matrice da parte degli AGEs può alterare la permeabilità della membrana basale glomerulare all’albumina.
Le alterazioni patologiche vascolari nel diabetico sono legate alla interazione degli AGEs con diverse proteine quali il collagene, le proteine circolanti, e con i recettori specifici sui macrofagi, monociti e sulle cellule endoteliali. Il legame con i macrofagi e con i monociti stimola la produzione del fattore di necrosi tumorale (TNFα), dell’interleuchina 1 (IL-1), del fattore di crescita insulino-simile (IGF-1) e del fattore stimolante la crescita dei granulociti-macrofagi (GM-CSF) con proliferazione delle cellule muscolari lisce e aumento della produzione di matrice.
Nella cellula endoteliale, il legame del complesso AGE-proteina ai recettori specifici produce alcune modificazioni geniche pro-coagulanti e la generazione di stress ossidativi con crescente aumento dell'espressione di molecole di adesione per i leucociti. A livello glomerulare una serie di eventi simili si verifica anche nelle cellule mesangiali dando luogo a quelle modificazioni strutturali, quali l’espansione e l’ipercellularità mesangiale, di costante riscontro nella nefropatia diabetica.
Oltre alle proteine, gli AGEs sono in grado di modificare i gruppi amminici primari dei fosfolipidi e delle apo(b) delle lipoproteine a bassa densità (LDL). Gli AGE-LDL non sono riconosciuti dai recettori tissutali per le LDL, per cui non vengono metabolizzati e si accumulano nel plasma. Sono inoltre in grado di iniziare una serie di reazioni ossidative che promuovono la generazione delle LDL ossidate. Le LDL modificate possono essere riconosciute da recettori specifici a livello delle cellule endoteliali e dei monociti/macrofagi; queste proteine circolanti, inoltre, sono in grado di indurre alcune modificazioni fenotipiche di tipo secretorio e proliferativo, quale la produzione di molecole di adesione, di fattori chemiotattici, di citochine e fattori di proliferazione, accelerando così lo sviluppo e il processo di maturazione della lesione aterosclerotica.4
b) Stress ossidativo
Tra i molti meccanismi proposti come collegamenti patogenetici diretti tra l’iperglicemia e le complicanze diabetiche, lo stress ossidativo è un’ipotesi altrettanto importante insieme a quella della glicazione avanzata delle proteine e sembra essere dovuto principalmente a reazioni di autoossidazione del glucosio. In condizioni fisiologiche il glucosio, come le altre α-idrossialdeidi, può enolizzare e quindi ridurre l’ossigeno molecolare (O2), formando così il radicale anione superossido, dal quale poi originano le altre specie reattive dell’ossigeno come l’H2O2 e il radicale ossidrile (OH.). Anche i prodotti di Amadori possono essere sottoposti ad autoossidazione, contribuendo così al danno ossidativo.
Nelle reazioni di autoossidazione si formano prodotti dicarbonilici molto reattivi, i quali contribuiscono all’attacco covalente dei monosaccaridi con le proteine. La glicazione non enzimatica e lo stress ossidativo sembrano quindi essere strettamente correlati e il processo viene spesso indicato con il nome di glicossidazione.
L’iperglicemia non soltanto porta alla formazione di molte specie reattive dell’ossigeno (ROS), ma colpisce anche i meccanismi antiossidanti attraverso la glicazione di enzimi radical-scavenger come il glutatione. Lo stress ossidativo, inoltre, è promosso dal riarrangiamento del metabolismo energetico dei carboidrati e dei lipidi.
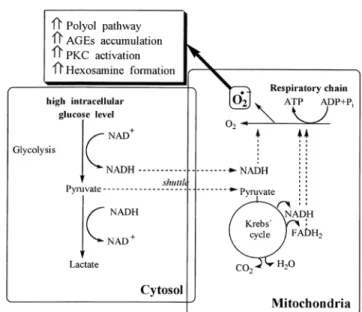
Un’altra recente ipotesi suggerisce che lo stress ossidativo possa essere anche promosso a livello mitocondriale, come conseguenza dell’aumentato metabolismo intracellulare del glucosio (Fig. 3). In condizioni di iperglicemia, infatti, la via glicolitica è saturata e quindi abbiamo la massima formazione di NADH e piruvato; questi migrano nel mitocondrio in grandi quantità e provocano un’accelerazione nel flusso di elettroni attraverso la catena respiratoria portando alla formazione dei ROS, soprattutto del radicale anione superossido. Le conseguenze della formazione di questa specie reattiva sono l’attivazione della via dei polioli, l’aumento dell’accumulo degli AGEs, l’attivazione della proteina chinasi C (PKC) e l’attivazione della via metabolica delle esosammine. Il meccanismo con cui il radicale anione superossido attiva la via dei polioli può
essere collegato alla sua capacità di diminuire la concentrazione intracellulare dell’ossido nitrico (NO), il quale inibisce l’aldoso reduttasi con una S-tiolazione della cisteina-298 presente sul sito attivo; il verificarsi degli altri tre effetti è invece dovuto all’inibizione dell’enzima gliceraldeide-3-fosfato deidrogenasi (GAPDH).3
Figura 3. Stress ossidativo nel mitocondrio.
c) Attivazione della proteina chinasi C
Le protein-chinasi sono enzimi che catalizzano il trasferimento di un gruppo fosfato dalla molecola di ATP a un gruppo idrossilico della molecola bersaglio, quale ad esempio la serina, treonina o tiroxina. Questo processo di fosforilazione è condizione essenziale affinché le proteine possano essere attivate ed esplicare le loro funzioni intracellulari.
L’iperglicemia porta ad un aumento del contenuto di diacilglicerolo (DAG) in parte per nuova sintesi e forse anche per idrolisi della fosfatidilcolina. L’aumentata concentrazione di DAG attiva, a sua volta, varie isoforme di protein-chinasi C (PKC), con inizio di una fitta rete di segnali intracellulari capaci di modificare l’espressione genica di numerosi fattori. La PKC attivata aumenta la produzione di citochine, di matrice extracellulare, del fattore inibitore
dell’attivatore del plasminogeno (PAI-1) ad azione fibrinolitica e dell’endotelina-1. La PKC inoltre media anche l’aumento della produzione del fattore di crescita endoteliale vascolare (VEGF). Tutte queste alterazioni possono contribuire ad alcune delle anomalie caratteristiche della disfunzione endoteliale che si verifica nel diabete (Fig. 4).4
Figura 4. Rappresentazione schematica delle anomalie caratteristiche della disfunzione endoteliale
3.1.2 Complicanze diabetiche legate alla via dei polioli
L’aldoso-reduttasi (ARL2) è un enzima appartenente alla superfamiglia delle aldo-cheto-reduttasi; è distribuito in vari tessuti tra cui il cristallino e in tutti quei tessuti che non richiedono insulina per l’up-take del glucosio e che manifestano le patologie associate al diabete.5 L’ARL2 è il primo enzima della via dei polioli ed ha la funzione di ridurre il glucosio a sorbitolo con una reazione NADPH dipendente. In condizioni fisiologiche, la produzione di sorbitolo è minima mentre in situazioni di iperglicemia cronica, con l’aumento quindi del substrato per l’enzima, la conversione di glucosio a sorbitolo è molto elevata e si accumula nella cellula. Anche la concentrazione di fruttosio, l’altro prodotto della via metabolica dei polioli, risulta aumentata di parecchie volte nei tessuti del diabetico; conseguenza di ciò è la fruttosilazione di proteine e la fornitura di nuovo substrato per la produzione di prodotti finali della glicosilazione avanzata (AGEs). Un altro aspetto legato all’attivazione della via dei polioli consiste nell’alterazione dello stato redox cellulare; questo alterato equilibrio viene definito “stress ossidativo” e determina un’eccessiva produzione di prodotti ossidanti come l’anione superossido, il perossido di idrogeno (H2O2) e radicali idrossilici (ROS) che possono direttamente provocare lesioni cellulari gravi fino alla necrosi. I principali meccanismi attraverso cui i ROS contribuiscono indirettamente alle alterazioni endoteliali che caratterizzano il diabetico4 possono essere individuati in una serie di eventi quali: l’inattivazione dell’ossido nitrico, la modificazione ossidativa delle LDL, l’attivazione della PKC e del fattore di trascrizione NF-κB.
Stress osmotico
In condizioni fisiologiche, il grande quantitativo di glucosio viene metabolizzato dalla via glicolitica. Nell’iperglicemia, il glucosio a disposizione di questa via metabolica tende a crescere. Il glucosio in eccesso quindi prende altre vie e viene convertito in sorbitolo dall’aldoso reduttasi nella via dei polioli, la quale, in condizioni normali, ha il compito di convertire le aldeidi in alcoli.
La conversione del glucosio in sorbitolo utilizza NADPH come donatore di protoni e si conclude con una diminuzione del rapporto NADPH/NADP+. L’ossidazione del sorbitolo a fruttosio ad opera della sorbitolo deidrogenasi, inoltre, utilizza come cofattore NAD+ provocando un aumento del rapporto NADH/NAD+ (Fig. 5).
Figura 5. Via dei polioli e aldoso reduttasi (ARL2). ARL2 riduce le aldeidi generate dalle specie
reattive dell’ossigeno (ROS) ad alcool e il glucosio a sorbitolo utilizzando NADPH come cofattore. Nelle cellule in cui l’attività dell’ARL2 è capace di influenzare la quantità di glutatione ridotto libero, lo stress ossidativo risulta aumentato.
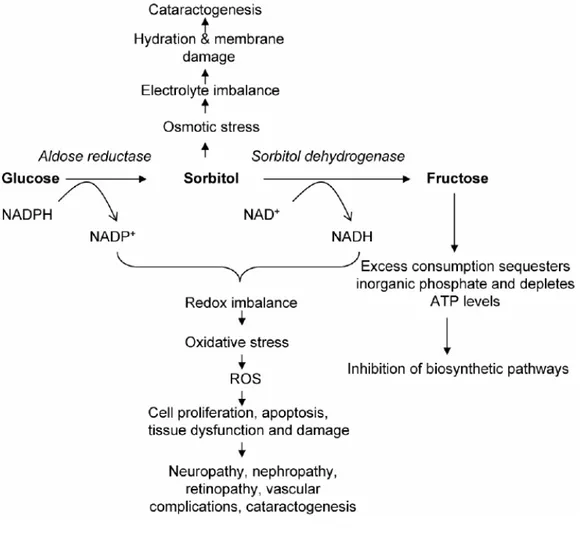
Il sorbitolo non attraversa facilmente le membrane cellulari, può infatti accumularsi nelle cellule; questo determina un gradiente osmotico che richiama acqua, ioni sodio e cloruro nella cellula provocando un aumento della permeabilità cellulare con perdita di ioni potassio, amminoacidi liberi, mioinositolo e GSH.3 Studi fatti sugli occhi di ratto, dimostrano che, durante la catarattogenesi diabetica e galattosemica, è presente un’elevata attività dell’aldoso reduttasi e che, in queste condizioni, si ha un accumulo di sorbitolo e galattitolo. Il trattamento con inibitori dell’aldoso reduttasi (ARIs) migliora notevolmente questa condizione patologica. In base a queste osservazioni è stato proposto che l’accumulo di sorbitolo, dovuto alla riduzione del glucosio da parte dell’ALR2, causi uno stress osmotico capace di determinare a sua volta uno squilibrio ionico e l’insolubilizzazione delle proteine, provocando così la catarattogenesi. Una simile sequenza di eventi può inoltre essere correlata con la retinopatia, la nefropatia, e la neuropatia diabetica (Fig. 6).6
Figura 6. Coinvolgimento della via dei polioli nelle complicanze diabetiche.
Stress ossidativo
L’aumento della pressione osmotica, dovuto all’accumulo dei polioli a livello cellulare, non può essere considerato l’unico fattore scatenante delle complicanze diabetiche.
Visto che l’aldoso reduttasi utilizza NADPH (nicotinamide-adenin-dinucleotide fosfato) per catalizzare la riduzione del glucosio, è stato proposto che i danni tissutali associati all’iperglicemia possano essere dovuti, in parte, all’aumentato utilizzo di NADPH da parte della via dei polioli. In presenza di concentrazioni normali di glucosio (5.5 mM), la riduzione catalizzata dall’ALR2 è pari a meno del 3% dell’utilizzazione totale del glucosio; in condizioni di
iperglicemia (glucosio 20 mM), invece, più del 30% del glucosio totale segue la via dei polioli: questi dati indicano che il profondo aumento dell’attività della via metabolica catalizzata dall’aldoso reduttasi è responsabile di una significativa diminuzione nelle riserve di NADPH.
Il NADPH viene usato dalla cellula per molti importanti passaggi metabolici, quali ad esempio la riduzione delle specie reattive dell’ossigeno (ROS) e degli idroperossidi, ad opera del sistema enzimatico glutatione reduttasi/glutatione perossidasi. Per questo motivo un ampio drenaggio nelle riserve di NADPH può compromettere la capacità delle cellule di difendersi dallo stress ossidativo.7
Per quanto riguarda l’apoptosi cellulare, un ruolo chiave sembra essere svolto dalla formazione di addotti proteine-4-idrossinonenale (HNE), prodotto della perossidazione lipidica. Sembra infatti che i prodotti della perossidazione lipidica, presenti in grandi quantità durante lo stress ossidativo, abbiano un’importanza notevole nella modulazione della crescita delle lesioni vascolari. Questo è supportato da alcuni studi su colture cellulari, nelle quali basse concentrazioni di HNE aumentano la crescita delle cellule della muscolatura liscia vascolare (VSMC), mentre concentrazioni elevate causano la morte cellulare per apoptosi. Tale conseguenza si riscontra anche a livello oculare (Fig. 6).8
Pseudoipossia e attivazione della PKC
L’attivazione della via dei polioli, oltre alla diminuzione delle riserve di NADPH, provoca l’aumento della concentrazione di NAD+ ridotto, legato all’eccessiva attività della sorbitolo deidrogenasi. Il cambiamento nello stato di ossidazione dei coenzimi piridinici è responsabile di differenti alterazioni metaboliche:
o induzione di uno stato di pseudoipossia;9 o sintesi di ossido nitrico (NO);
In particolare, è stato ipotizzato che l’aumento di NADH in seguito all’aumentata attività della via dei polioli porti alla sintesi del diacilglicerolo (DAG) a partire dal diidrossiacetone fosfato.11 I livelli del DAG possono inoltre essere incrementati dallo stress, responsabile dell’attivazione della fosfolipasi C.
Il DAG, un attivatore essenziale dei membri della famiglia delle protein-chinasi C, gioca un ruolo importante nell’espansione mesangiale e nella proliferazione delle cellule della muscolatura liscia indotte dall’iperglicemia.12
Figura 7. Meccanismi di attivazione della PKC.
La famiglia delle protein-chinasi comprende 11 isoforme che sono coinvolte nel meccanismo di trasduzione del segnale maggiormente utilizzato dai messaggeri lipidici e dagli esteri del forbolo; studi recenti hanno dimostrato il loro coinvolgimento nelle complicanze diabetiche, in particolare delle isoforme PKC-β1 e PKC-β2. In seguito ad esperimenti condotti su colture cellulari esposte ad elevate concentrazioni di glucosio e a tecniche biomolecolari, è stato possibile rilevare l’immediata traslocazione delle due isoforme dal citosol alla membrana cellulare. È stato inoltre evidenziato un coinvolgimento delle isoforme PKC-γ e PKC-δ entro 60 minuti dall’esposizione delle cellule al glucosio.13Non risultano invece coinvolte le isoforme PKC-α. Sono in corso studi clinici sulla prevenzione delle complicanze microvascolari e neuropatiche mediante l’uso di un inibitore
selettivo dell’isoforma della PKC, che sembra essere coinvolta nello sviluppo delle alterazioni del microcircolo.
L’attivazione dell’aldoso reduttasi quindi promuove la formazione di fosfolipasi C (PLC) che porta alla sintesi di diacilglicerolo (DAG). Il DAG, a sua volta, è responsabile dell'attivazione dell’isoforma C della PK ed in particolare:
9 PKC-β2 : a livello dei tessuti vascolari questa proteina è associata ad un aumento della permeabilità e alla sintesi di mediatori vasocostrittori come l'endotelina e i prostanoidi. Inoltre tale molecola è legata all’angiogenesi e alla proliferazione cellulare endoteliale indotta dal fattore di crescita endoteliale vascolare (VEGF). L’inibizione selettiva della PKC-β2 previene quindi la crescita cellulare della muscolatura vasale indotta dall’iperglicemia e la generazione di ROS. La sua inibizione inoltre, migliora il microcircolo a livello della retina e previene la dilatazione mesangiale.
9 PKC-β1: non è ancora molto chiaro il ruolo svolto nelle complicanze diabetiche. Nelle cellule mesangiali la sua attivazione, determinata dalle alte concentrazioni di glucosio, è associata alla traslocazione di una particolare proteina (NF-kB p50, proteina che lega il fattore k nucleare) che potrebbe essere un importante mediatore dell'infiammazione vascolare.
9 PKC-δ: la sovraespressione in cellule muscolari vasali aumenta l’attività della p38 chinasi, la quale potrebbe contribuire all’arresto della crescita cellulare e all’apoptosi. È stato anche ipotizzato che la sua attivazione rappresenti la causa dell’instabilità delle placche ateromatose caratteristiche del diabete; l’inibizione dell'ALR2 porta ad una diminuzione dell’attivazione di questa isoforma (PKC-δ), con conseguente miglioramento della stabilità delle lesioni vascolari in pazienti diabetici.
9 PKC-ε: la sua attivazione sembra essere un ulteriore meccanismo di protezione nei confronti dello stress ossidativo e dell’ischemia.
Ulteriori studi dovranno essere condotti sulle isoforme α e γ, poiché la loro attività e il ruolo svolto nelle complicanze diabetiche non sono ancora del tutto chiari.13
3.2. Aldoso reduttasi
L’aldoso reduttasi è un enzima monomerico NADPH dipendente, appartenente alla superfamiglia delle aldo-cheto reduttasi7 che include:
♦ Aldoso reduttasi (ARL2) ♦ Aldeide reduttasi (ARL1)
♦ Fattore di crescita dei fibroblasti (FR-1) ♦ 3α-idrossialdeide deidrogenasi (3α-HSD)
Questi enzimi sono tutti costituiti da una singola catena polipeptidica, conservano il cofattore nicotinammide per esplicare la loro attività e presentano uguali caratteristiche del sito attivo.
Pur essendo enzimi molto simili, è comunque necessario considerare che la variazione di un singolo residuo amminoacidico a livello del sito attivo può indurre un cambiamento nel meccanismo di azione dell’enzima che può quindi compromettere la sua capacità ossido-riduttiva del gruppo carbonilico dello zucchero. L’analisi cristallografica ha dimostrato una struttura tridimensionale composta da segmenti α/β simili.
L’ARL2 è costituito da una singola catena polipeptidica di 315 residui. Contiene 8 unità α/β parallele con filamenti che costituiscono un foglietto β chiuso a formare un cilindro. Le α eliche che collegano i β filamenti sono disposte tutte all’esterno del cilindro. Il sito di binding è una larga e profonda cavità ellittica delimitata da 7 residui amminoacidici aromatici (Trp20, Tyr48, Trp111, Phe121, Phe122 e Trp219) e da 4 residui apolari (Val47, Pro218, Leu300 e Leu301) con l’anello nicotinammidico del NADPH alla base. Nonostante il meccanismo di catalisi non sia stato ancora definito, la struttura cristallina suggerisce un coinvolgimento nella reazione enzimatica di alcuni amminoacidi quali la Tyr-48 e la Lys-77 e dell’anello nicotinammidico (NAD+). Studi cristallografici indicano la presenza di un potenziale sito di binding anionico, il quale sembra essere delimitato dall’anello nicotinammidico, dalla Tyr-48 e dall'Hys-110. Uno di questi due residui potrebbe rappresentare il donatore di protone durante la reazione di riduzione del glucosio in sorbitolo. È stato osservato, in seguito, che il gruppo naftalenico del tolrestat e quello benzotiazolico dello zopolrestat si adattano molto bene ad una tasca idrofobica presente nell’enzima. Tale tasca emerge dopo un cambiamento conformazionale che interessa un’ansa (residui 121-135) e un breve segmento (residui 298-303); questa modificazione dell’enzima provvede alla specificità del ligando verso l’ALR2.2
Figura 10. Sito catalitico dell’ALR2.
Le caratteristiche principali di una reazione enzimatica sono: la velocità, la stereospecificità e la suscettibilità al controllo. L’ALR2 manca di questi tre requisiti in relazione alla riduzione del glucosio a sorbitolo. Questo enzima, infatti, fisiologicamente svolge un ruolo detossificante su particolari substrati, come ad esempio le aldeidi. Quando il glucosio diventa substrato dell’ALR2, quest’ultimo si comporta come un enzima a bassa specificità per il proprio substrato. La misura della potenza catalitica di un enzima, in generale, è data dal valore di Kcat/Km che è il valore più basso della velocità assunto dalla cinetica di associazione tra enzima e substrato. L’ALR2 mostra una bassa velocità di associazione ed è caratterizzato da una bassa stereospecificità verso alcuni monosaccaridi. Le forme D e L dell’arabinosio e del glucosio mostrano velocità di associazione quasi identiche, stimate dall’ossidazione del NADPH.14 In presenza di NADPH l’enzima converte il glucosio in sorbitolo, che è unicamente metabolizzato a fruttosio attraverso la sorbitolo deidrogenasi, con la contemporanea riduzione di NAD+. Poiché l’ALR2 possiede una bassa affinità per il glucosio, la conversione di tale substrato a sorbitolo, in condizioni di
normoglicemia, è generalmente poco significativa. L’ALR2 compete direttamente con l’esochinasi della via glicolitica per l’utilizzo del glucosio e, poiché l’affinità per il substrato dell’esochinasi è più elevata, il glucosio viene preferenzialmente fosforilato con ATP attraverso questo enzima. In condizioni di iperglicemia l’esochinasi viene rapidamente saturata e la via dei polioli di conseguenza attivata. Il sorbitolo viene formato molto più velocemente di quanto non sia metabolizzato a fruttosio, e la sua polarità ne impedisce il passaggio attraverso le membrane e la successiva rimozione dai tessuti per diffusione.15
3.2.1 Meccanismo catalitico dell’ALR2
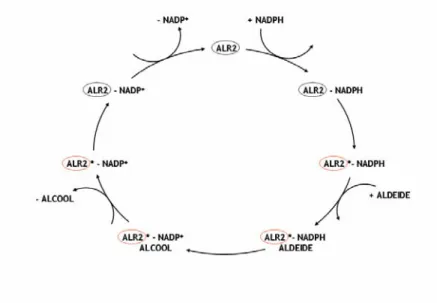
Il meccanismo catalitico di ALR2 appare piuttosto semplice e si realizza seguendo un preciso ordine di reazione.
L’interazione del cofattore NADPH con ALR2, a costituire il complesso ALR2-NADPH, determina un cambiamento conformazionale dell’enzima che consente il legame con il substrato aldeidico. Si forma così un complesso ternario ALR2∗-NADPH-ALDEIDE all’interno del quale l’enzima interviene a catalizzare la riduzione del substrato ad alcool, che viene successivamente rilasciato. Si realizza poi un secondo cambiamento conformazionale, che consente la dissociazione del complesso ALR2∗-NADP+ed il ripristino dell’enzima come tale, il quale torna disponibile per un nuovo ciclo catalitico.
La riduzione del substrato aldeidico consiste in un trasferimento stereospecifico di un idruro dall’atomo di carbonio C4 dell’anello nicotinammidico al carbonio carbonilico del substrato. Quasi contemporaneamente, l’ossigeno carbonilico, man mano che incrementa la propria carica negativa, sottrae un atomo d’idrogeno da un opportuno gruppo donatore. In seguito all’analisi cristallografica del complesso enzima substrato è stato possibile individuare in prossimità del substrato solo tre residui amminoacidici come potenziali donatori di idrogeno: Tyr-48, His-110, Cys-298.
Il gruppo ossidrilico della Tyr-48, l’atomo d’idrogeno legato a N dell’His-110 ed il gruppo solfidrico della Cys-298 si trovano, infatti, ad una distanza di 4.52, 5.12 e 4.13 Å, rispettivamente, dall’atomo di carbonio C4 dell’anello nicotinamidico. Tra questi, solo la Tyr48 e l’His 110 sono comuni alla superfamiglia delle reduttasi NADPH-dipendenti tra cui l’ARL2 e sono pertanto i più probabili candidati. Tra i due poi, l’His110 è la meno favorita poichè, essendo vicina a tre residui idrofobici (Val147, Trp79 e Trp111) probabilmente presenta un valore di pKa basso e non risulta quindi protonata al valore di pH in cui l’ARL2 presenta la massima attività (pH =6.5).
La Tyr-48 rimane quindi il residuo più favorito, considerando anche che il proprio gruppo ossidrilico forma un ponte ad idrogeno con il gruppo amminico di un residuo di lisina, la Lys-77, e che ciò può facilitare il trasferimento dell’idrogeno.
La reazione di riduzione del substrato carbonilico avviene pertanto con il seguente meccanismo:
Figura 12. Meccanismo catalitico dell’ARL2.
3.2.2 Ruolo detossificante dell’ALR2
L’aldoso reduttasi catalizza la riduzione di un’ampia gamma di aldeidi sature ed insature, con un’efficienza 103-104 volte più alta rispetto a quella di catalisi del glucosio.16 L’enzima è particolarmente efficiente nella riduzione di aldeidi a media e lunga catena (C-6/C-18), come quelle generate in rilevante quantità durante la perossidazione lipidica.17 L’enzima catalizza inoltre la riduzione di prodotti di coniugazione di aldeidi insature con il glutatione, in molti casi con un'efficienza molto più alta di quella delle aldeidi libere di partenza.18 La riduzione dei prodotti di coniugazione potrebbe rappresentare un meccanismo protettivo da utilizzare nel controllo e nella mitigazione della reattività del gruppo aldeidico non complessato dal glutatione.18
Figura 13. Ruolo detossificante dell’ALR2.
Il ruolo dell’aldoso reduttasi come enzima detossificante è supportato da alcuni studi strutturali, i quali hanno evidenziato la mancanza di residui ionici nel sito attivo dell’ALR2, tipici delle proteine che legano i carboidrati.19 Analisi a raggi-X di cristalli dell’ALR2 hanno invece rivelato un sito attivo altamente plastico e idrofobico.20 Questo sito potrebbe potenzialmente accogliere un ampio gruppo di derivati aldeidici, anche strutturalmente non correlabili tra loro, se la funzione aldeidica si orientasse in maniera tale da essere compresa tra i due residui ionici del sito attivo, His-110 e Tyr-48, i quali partecipano alla catalisi acido-base. La struttura del complesso binario tra l’enzima e il NADP+ indica anche una profonda variazione conformazionale dopo il legame con il NADPH.21 Quindi, risultato dell’alta affinità con il NADPH, l’ALR2 si comporta come una inusuale “aldeide-removasi”, proprietà che sembra essere criticamente necessaria per un enzima detossificante coinvolto nella rimozione di aldeidi e di addotti del glutatione con aldeidi generati durante la perossidazione lipidica.
L’alta specificità e selettività con cui l’enzima catalizza la riduzione dei prodotti di coniugazione suggerisce che tali composti potrebbero costituire in vivo i veri substrati dell’enzima. Il glucosio quindi, con molta probabilità, rappresenta
per l’enzima un substrato accidentale, che viene usato soltanto in condizioni patologiche oppure per metabolismi tessuto-specifici occasionali.7
La riduzione di coniugazione attraverso l’ALR2 potrebbe essere fisiologicamente significativa particolarmente in condizioni di stress ossidativo, quando gli altri meccanismi antiossidanti vengono saturati. In queste condizioni, l’ALR2, riducendo le aldeidi libere e i loro glutatione-coniugati, promuove un’efficiente rimozione e detossificazione delle aldeidi insature, le quali rappresentano i principali prodotti elettrofili finali della perossidazione lipidica.
3.2.3 Regolazione dell’attività dell’ALR2
In accordo con il suo ruolo detossificante, è stato dimostrato sperimentalmente che l’attività dell’ALR2 è regolata da aldeidi generate dalla perossidazione lipidica, da agenti tiolo-riducenti, da ioni metallici e dall’ossido nitrico (NO). I livelli tissutali dell’aldoso reduttasi aumentano inoltre in condizioni di elevato stress ossidativo come ad esempio in seguito all’avvelenamento da ferro, a patologie epatiche attribuibili all’alcool, o in seguito ad infarto e ad infiammazioni vascolari.
L’ALR2 è inoltre up-regolata durante le vasculiti, in modo specifico nelle aree caratterizzate da un’alta formazione del 4-idrossinonenale (HNE) e, l’inibizione dell’enzima, provoca un aumento della sua concentrazione e dei sui addotti con le proteine, accompagnato da un aumento del numero di cellule apoptotiche (fino a 3 volte).22 Altri studi dimostrano che l’ALR2 è anche presente in grandi quantità nel cuore ischemico.
Un’importanza notevole, per quanto riguarda la regolazione dell’aldoso reduttasi, è da attribuirsi alle specie reattive dell’ossigeno e all’ossido nitrico. L’alta sensibilità dell’enzima a queste due specie è dovuta alla presenza di un residuo altamente reattivo di cisteina (Cys-298).23 Gli ossidanti come l’H2O2 provocano l’inattivazione dell’enzima così come la glutatiolazione della Cys-298. Tuttavia, cambiando le condizioni di reazione e il donatore di NO, l’ALR2 può essere S-tiolato (e quindi inattivato) oppure S-nitrosato (e quindi attivato). Sulle basi di queste osservazioni, è stato ipotizzato che l’NO svolga una funzione
regolatrice sull’attività intracellulare dell’ALR2 e, di conseguenza, sul flusso di glucosio attraverso la via dei polioli.24 Visto che, nell’iperglicemia, la sintesi dell’NO è notevolmente ridotta rispetto alle condizioni di normoglicemia, è stato proposto che l’attività dell’ALR2 possa essere up-regolata nei tessuti diabetici.25
3.3 Inibitori dell’aldoso reduttasi
Le prime osservazioni su composti dotati di attività inibitoria sull’ALR2 risalgono al 1965, quando si notò che acidi a lunga catena manifestavano tale comportamento. Da allora sono stati considerati molti composti, sia di derivazione sintetica, sia di derivazione naturale. Nonostante l’ampia varietà di ARIs (Aldose Reductase Inhibitors) sintetizzati, le prime sperimentazioni cliniche sono stati deludenti. Molti studi, infatti, hanno rivelato soltanto modesti miglioramenti accompagnati da non pochi effetti collaterali. I risultati di queste prime sperimentazioni tuttavia, anche se poco promettenti dal punto di vista terapeutico, hanno fornito molte informazioni sull’enzima e sul suo ruolo nel metabolismo del glucosio, sulla sua azione detossificante, e sul ruolo svolto nell’infiammazione e nella crescita.7
Oggi una terapia vera e propria per ridurre le complicanze diabetiche non esiste. Il diabete è curato con insulina sintetica, trapianto di pancreas e con ipoglicemizzanti orali. Studi recenti hanno dimostrato effetti favorevoli in pazienti trattati con insulina e ARIs dopo il trapianto pancreatico. Il trattamento di pazienti neuropatici con ARIs, ha provocato, durante il primo mese di trattamento, aumenti nella normale velocità di conduzione delle fibre nervose, accompagnati da una significativa diminuzione dei sintomi dolorosi, determinato dalla migliorata condizione metabolica delle terminazioni nervose stesse. Intorno al secondo anno di trattamento si nota un progresso nella velocità di conduzione nervosa dovuta alla rigenerazione delle fibre, accompagnato da un certo recupero sensoriale. Il miglioramento della nefropatia riguarda soprattutto la filtrazione glomerulare, con la diminuzione dell’escrezione di albumina durante la condizione di normoglicemia indotta dagli ARIs e dalla contemporanea somministrazione di insulina. Per la retinopatia, infine, sono state registrate differenze sostanziali tra
una popolazione di pazienti trapiantati trattati con la sola insulina e un’altra popolazione di pazienti trapiantati trattati con l’insulina e gli ARIs. Nella prima, la retinopatia risulta peggiorata fin dalle prime settimane di trattamento; in quella trattata con gli ARIs, invece, si riscontra a livello della retina una riduzione della formazione di microaneurismi senza alcun effetto degenerativo.26
3.3.1 Meccanismo d’azione degli ARIs
Studi di cinetica e di competizione, eseguiti sull’enzima purificato, indicano che gli ARIs esercitano nei confronti dell’enzima un’inibizione di tipo competitivo oppure non competitivo; tutti cioè interagiscono con l’enzima a livello di uno stesso sito, il sito d’inibizione, indipendentemente dalla presenza del substrato.
Gli ARIs si legano al complesso ALR2∗-NADPH, oppure a quello ALR2∗ -NADPH-ALDEIDE, senza ostacolare in alcun modo la formazione del legame dell’ALR2 con l’aldeide. La loro azione di inibizione si esplica impedendo il cambiamento conformazionale necessario al rilascio dell’alcool dal complesso ALR2∗-NADP+-ALCOOL inibito dall’ARI.27
Dal momento che l’interazione tra l’inibitore ed il sito enzimatico dipende sia da fattori sterici che elettronici, la capacità di queste sostanze di inibire l’ALR2 deve essere legata ad analogie strutturali con il sito enzimatico.
Pur essendo chimicamente eterogenei, gli ARIs, possiedono caratteristiche strutturali comuni, che possono essere identificate in una regione aromatica principale, in una regione lipofila ed in un gruppo ionizzabile.
o Regione aromatica principale: planare, lipofila e ben delineata. o Regione lipofila: più ampia della principale.
o Gruppo ionizzabile: costituito da una funzione carbossilica o da un anello idantoinico, collocato ad una opportuna distanza dalla regione aromatica principale.28
Queste caratteristiche strutturali risultano perfettamente complementari al modello del sito attivo dell’ALR2, identificato grazie ad analisi cristallografiche. La porzione ionizzabile dell’inibitore, infatti, può interagire con i residui aminoacidici polari del sito enzimatico, Tyr-48 o His-110, mediante la formazione di legami ad idrogeno. La porzione aromatica principale invece può stabilire interazioni di tipo idrofobico, aromatico-aromatico, con gli aminoacidi lipofili che delimitano il sito stesso, in particolare Trp-20, Trp-111, Phe-122 e Leu-300.
L’ulteriore presenza di una porzione aromatica sull’inibitore, consente inoltre di poter rafforzare il legame con l’enzima, grazie ad un’interazione idrofobica aromatico-aromatico con i residui di Trp-111 e Leu-300.29
Figura 15. Rappresentazione del legame tra un generico inibitore con il sito attivo dell’enzima.
R1: porzione ionizzabile degli ARIs; R2: porzione aromatica principale; R3: sostituente aromatico
3.3.2 Classificazione degli ARIs
Attualmente sono conosciuti molti inibitori dell’aldoso reduttasi (ARIs), con caratteristiche strutturali diverse. Questi composti possono essere suddivisi in sei classi principali:
a) Immidi cicliche.
b) Derivati degli acidi carbossilici. c) Arilsulfonilnitrometani.
d) Derivati aminoacidici. e) Flavonoidi.
f) Composti naturali.
Immidi cicliche
Il sorbinil è il prototipo della classe dei derivati spiroidantoinici (IC50 = 150nM) (Pfizer, 1978). Grazie ad una farmacocinetica particolarmente favorevole, il sorbinil presenta una eccellente attività in vivo in modelli animali tanto da essere ritenuto lo standard d’elezione per la valutazione della potenza ed efficacia dei nuovi ARIs. In seguito alla sua scoperta, sono stati sviluppati numerosi composti a struttura idantoinica, che hanno consentito di incrementare l’efficacia biologica di questa classe di derivati. In particolare, per quanto riguarda il sorbinil, esso ha la capacità di raggiungere concentrazioni terapeutiche in 2h. Pazienti diabetici trattati con questo farmaco non hanno manifestato miglioramenti nello sviluppo della nefromegalia, nell’espansione glomerulare e nell’escrezione dell’albumina.
Tra gli effetti avversi del sorbinil vi è una reazione di ipersensibilità nelle prime settimane di terapia, indotta probabilmente dal gruppo idantoinico. Per risolvere il problema dell’ipersensibilità è stato sostituito il gruppo idantoinico con un gruppo bioisostero tiazolidindionico; tale sostituzione ha conferito al farmaco effetti antiossidanti e proprietà antiiperglicemiche.
Figura 16.
Da studi cristallografici è risultato che l’enantiomero S del sorbinil è considerevolmente più potente di quello R, e questo consente di affermare che il sito di inibizione enzimatica è altamente stereoselettivo.30 Studi SAR di questa classe di composti hanno permesso di evidenziare come l’attività inibitoria, sia in
vitro che in vivo, sia fortemente condizionata da un adeguato arrangiamento
dell’anello aromatico. La sua idrogenazione, la rimozione o anche lo spostamento della spirogiunzione dalla posizione adiacente all’anello aromatico fa diminuire drasticamente l’attività. L’anello benzenico può essere sostituito anche da altri sistemi aromatici e l’introduzione di sostituenti, in particolare atomi di alogeno, determina un apprezzabile incremento dell’attività. Anche la sostituzione della porzione aliciclica, più precisamente nella posizione 2, consente di ottenere derivati più attivi come ad esempio il metosorbinil (IC50 = 93nM), il fidarestat (IC50 = 35nM), o ARI509 (IC50 = 10nM).
O N H N H O O F O N H N H O O F O NH2 N N H N H O O F O Br F O N H N H O O F Fidarestat Minarestat Sorbinil Metosorbinil
Figura 17. Principali immidi cicliche.
Derivati degli acidi carbossilici
I derivati più efficaci di questa classe di inibitori sono rappresentati da Tolrestat (IC50 = 35nM), Epalrestat (IC50 = 10nM), zenarestat (IC50 = 4.4 nM) e zopolrestat (IC50 = 3nM).28
Il tolrestat, risultato attivo in studi clinici, è stato utilizzato come farmaco d’elezione nel trattamento delle patologie diabetiche clinicamente sintomatiche.
L’epalrestat presenta una buona attività in vivo; determina una riduzione nell’accumulo di sorbitolo nel nervo sciatico di ratti diabetici e migliora la conducibilità nervosa. E’ risultato essere efficace anche in studi clinici e per questo è stato recentemente introdotto in commercio in Giappone.
Zenalrestat e Zopolrestat sono stati sottoposti a studi clinici e attualmente sono in Fase II. Zopolrestat in particolare, costituisce il derivato carbossilico migliore in quanto, grazie ad un eccellente farmacocinetica, combina una potente attività in
vitro con una concreta efficacia in vivo.
Gli studi in vitro effettuati su questa classe di derivati carbossilici hanno permesso di stabilire le seguenti relazioni struttura-attività:
♦ La sostituzione del gruppo acetico con il gruppo benzilico porta ad un drastico calo dell’attività; questo a conferma del fatto che il gruppo acetico flessibile, se posto nella giusta posizione per l’interazione con il sito di binding sull’enzima, potrebbe essere importante ai fini dell’attività inibitoria.
♦ L’introduzione di un atomo di alogeno sull’anello benzilico migliora la potenza dell’attività inibitoria, in seguito all’instaurarsi di legami idrogeno e all’aumentata lipofilicità. Sulla base di questo, l’introduzione di un gruppo metossile (-OCH3) sullo stesso anello aumenta l’attività. N S COOH CF3 O S N O S COOH N N COOH O F Br N N COOH O N S CF3 N N COOH O F Br O Cl Tolrestat Epalrestat Ponalrestat Zopolrestat Zenalrestat
Figura 18. Principali derivati degli acidi carbossilici.
Il ponalrestat (Fig. 18) sembra essere uno dei composti più promettenti sviluppati per l’inibizione dell’ALR2, in quanto mostrava in vitro una considerevole attività inibitrice sull’enzima. Studi clinici effettuati sull' uomo,
tuttavia, non hanno riportato alcun effetto benefico, con la conseguente interruzione dello sviluppo di tale farmaco. Per trovare ulteriori composti orali più attivi e più potenti sono stati sintetizzati derivati dell’acido tionaftostirilacetico, i quali possiedono una buona potenza inibitoria in vitro ed in vivo.
N
O O
COOH
Alrestatin
Figura 19. Alrestatin
L’alrestatin (Fig. 19) è stato il primo ad essere studiato. È stato recentemente chiarito che tale composto si lega all’ALR2 tramite un unico tipo di legame in cui le due molecole sono tenute insieme nella tasca lipofila in un arrangiamento a “doppio-ponte”.28
Nonostante questi composti abbiano dimostrato sostanziali effetti sull’ALR2, sono stati richiesti ulteriori sviluppi molecolari per ridurre gli effetti dannosi riscontrati a livello tissutale legati al gruppo naftostirilico.
Le complicanze diabetiche sono strettamente collegate alle malattie cardiovascolari come l’IMA (infarto acuto del miocardio). Gli inibitori dell’ALR2 sono stati studiati per prevenire i fosfati ad alta energia e quindi per proteggere i cuori diabetici da ischemia e riperfusione. L’ALR2 è un enzima coinvolto in questa via e lo zopolrestat (Fig. 18) ha giocato un ruolo importante nella protezione da ischemia.
Arilsulfonilnitrometani
Gli arilsulfonilnitrometani, come il composto in Fig.20, sono derivati nitrometilchetonici. Tali derivati recentemente hanno mostrato attività inibitorie verso l’ALR2 anche a bassissime concentrazioni.
Figura 20. Esempio di arilsulfonilnitrometano.
Derivati aminoacidici
Negli ultimi dieci anni la sostituzione dell’N con radicali amminoacidici ha assunto un ruolo importante nella ricerca di questa classe di ARIs. Sono stati sintetizzati derivati N-sostituiti della glicina e dell’alanina, in particolare la 2-fenilglicina, la metilglicina e la β-alanina. L’analisi dell’inibizione di questa serie di composti ha individuato che la loro cinetica di inibizione risulta simile anche se esistono differenze sostanziali nella relazione struttura-attività.31
Flavonoidi
I primi studi sui flavonoidi, derivati del benzopiran-4(4H)-one, come composti inibitori dell’ALR2 risalgono al 1975. Costituiscono una classe di molecole particolarmente interessante dal punto di vista farmaceutico poichè presentano un’ampia varietà di attività biologiche. Tra i loro molteplici effetti benefici si annoverano proprietà antivirali, antinfiammatorie, antiallergiche, antitumorali ed antiossidanti. Tutte queste attività potrebbero essere particolarmente importanti in molte malattie. Numerosi composti di questo tipo inibiscono efficacemente l’ALR2 e sono dotati di una concomitante e apprezzabile attività antiossidante.32 Al contrario della quasi totalità degli ARIs, proprio per la loro elevata solubilità in acqua, tali molecole potrebbero non essere assorbite in maniera efficace dopo somministrazione orale. Attualmente esistono agliconi fenolici che hanno caratteristiche lipofile, le quali consentono a queste molecole di oltrepassare le membrane biologiche.
Tra i derivati flavonoidi noti, quelli che presentano una buona attività come inibitori dell’ARL2 sono: la quescetina (IC50 = 5µM), la quercitrina (IC50 = 0.49µM), la miricetina (IC50 = 124µM) e l’axillarina (IC50 = 0.026µM)
La quercetina è stato il primo composto fenolico sintetizzato e testato; la sua attività consiste in una diminuzione nell’accumulo di sorbitolo nel cristallino della cavia, ritardando così l’insorgenza della cataratta su base diabetica. La potenziale efficacia della quercetina sembra essere dovuta all’aumentata secrezione di insulina, ad una migliore protezione delle cellule β-pancreatiche dal danno indotto dai radicali liberi e all’inibizione della aggregazione piastrinica. La quercetina ha una bassa biodisponibilità; in seguito a somministrazione orale infatti la quantità di farmaco assorbita è circa l’1%.31
O O OH OH OH O H OH O O O-Ramnosio OH OH O H OH O O OH OH OH O H OH OH O O OMe OH OH O H OH MeO Quercetina Quercitrina Miricetina Axillarina
Figura 21. Derivati a struttura flavonoide.
Composti naturali
Sono composti generalmente di origine naturale, come l’aporfina, la benzilisochinolina, la papaverina, ecc. Test sul cristallino di animali da esperimento non fornivano risultati soddisfacenti, nelle sperimentazioni in vivo
invece, diversi pazienti con cataratta traevano benefici dal trattamento con acido lipoico e con alcune vitamine (ad es. vit. E, vit. A) che aumentavano i livelli e l’attività del glutatione. La vitamina B (riboflavina), ad esempio, gioca un ruolo essenziale come precursore del flavin-adenin-dinucleotide (FAD), co-fattore della glutatione reduttasi, importante sistema detossificante dell’organismo umano (Fig.
22).31
3.3.3
Prospettive future
Per ottenere i massimi benefici dall’inibizione dell’aldoso reduttasi, è necessario che gli ARIs siano altamente specifici e selettivi. Anche se gli inibitori attuali si legano all’enzima con una notevole affinità, presentano alti livelli di tossicità aspecifica. A causa della mancanza di studi farmacocinetici dettagliati, rimane ancora oggi poco chiaro se la dose di inibitori dell’ALR2 utilizzata nella sperimentazione clinica sia sufficiente ad inibire l’enzima. Devono essere condotti quindi, sugli ARIs, ulteriori studi per determinare l’entità e la durata dell’inibizione dell’enzima per una determinata dose e, ancora più importante, è necessario studiare dei nuovi inibitori dell’ALR2, i quali inibiscano selettivamente la capacità dell’enzima di catalizzare la riduzione dei glutatione-coniugati (importanti per la trasmissione di segnali intracellulari) e del glucosio, senza diminuirne la capacità detossificante nei confronti delle aldeidi.
Alcuni studi struttura-attività con aldeidi libere ed i loro analoghi coniugati con glutatione suggeriscono che l’enzima presenta dei siti di legame distinti: uno per il glutatione e un altro per le aldeidi. La modificazione selettiva dell’enzima può prevenire, quindi, il riconoscimento e la riduzione dei glutatione-coniugati senza colpire la capacità aldeide-detossificante. Questi interessanti risultati suggeriscono la possibilità di poter regolare, in maniera indipendente, il ruolo detossificante e la capacità di trasmettere segnali intracellulari dell’ALR2. Sviluppando questo aspetto importante potranno essere disegnati in futuro inibitori ancora più selettivi, i quali potranno prevenire i danni cellulari legati alle complicanze diabetiche senza compromettere la difesa antiossidante.18
Molti dati sperimentali hanno indicato che l’ALR2, catalizzando la riduzione di aldeidi derivanti dai lipidi e dei loro coniugati con glutatione, protegge dallo stress ossidativo; potrebbe quindi essere efficace una terapia basata sulla combinazione di ARIs e di antiossidanti. Gli effetti benefici e detossificanti dell’enzima, infatti, diminuiscono con l’aumentare dei prodotti della perossidazione lipidica e questo può determinare l’insorgere delle complicanze diabetiche a lungo termine. La contemporanea somministrazione di inibitori
dell’ALR2 e di antiossidanti, che hanno la capacità di prevenire la perossidazione lipidica o aumentare l’espressione di enzimi antiossidanti, potrebbe compensare la diminuzione dell’azione detossificante dell’ALR2. Il trattamento con antiossidanti può inoltre mantenere l’enzima nella forma ridotta, evitando così la tipica resistenza che l’ALR2 sviluppa verso i farmaci durante l’iperglicemia, in seguito alle sue modificazioni strutturali.7
3.4 Introduzione alla parte sperimentale
L’aldoso reduttasi (ALR2) è il primo enzima della via dei polioli, una via metabolica degli zuccheri che assume particolare importanza in condizioni di elevati livelli di glucosio. Questo enzima catalizza la riduzione NADPH-dipendente del glucosio a sorbitolo.
In condizioni fisiologiche, l’ALR2 compete direttamente con l’enzima esochinasi per il legame con il glucosio, tuttavia data la minore affinità di ALR2 rispetto all’esochinasi il glucosio viene preferenzialmente fosforilato con ATP da questo enzima. Questo processo risulta alterato in condizioni patologiche. In particolare, in presenza di iperglicemia, come nel diabete, si verifica un accumulo intracellulare di glucosio e l’esochinasi viene saturato con conseguente attivazione della via dei polioli. Il sorbitolo si forma più rapidamente di quanto non venga convertito a fruttosio e si accumula nelle cellule. Le elevate concentrazioni intracellulari di sorbitolo sono dannose per molti tessuti e sono spesso responsabili di numerose complicanze diabetiche, tra cui neuropatie, nefropatie e retinopatie. Aldose reductase NADPH NADP+ Sorbitol Sorbitol dehydrogenase fructose NAD+ NADH Irreversible morphological and functional changes Aldose Reductase
Inhibitors (ARIs)
Glucose
Per questo motivo gli inibitori dell’ALR2 (ARIs), che sono in grado di limitare il marcato aumento intracellulare di sorbitolo, sono considerati un’importante possibilità terapeutica per il trattamento delle complicanze associate al diabete. Questi farmaci possono infatti prevenire gli effetti patologici a carico dei tessuti senza rischio di provocare iperglicemia, in quanto non hanno
effetti sui livelli plasmatici di glucosio. Gli inibitori dell’ALR2 (ARIs) più conosciuti sono generalmente suddivisi in due classi: derivati dell’acido acetico come il tolrestat, zopolrestat ed epalrestat, ed immidi cicliche come il sorbinil.
O CF3 N S COOH O N H N H F O O S N O S COOH N N COOH O N S CF3 Tolrestat Sorbinil Epalrestat Zopolrestat
Figura 23. Principali ARIs.
Nonostante le loro differenze strutturali, entrambe queste classi di composti possiedono comuni requisiti, rappresentati da una porzione planare aromatica e da una funzione acida entrambe in grado di interagire con il sito attivo dell’ALR2.
La porzione acida interagisce con il sito anionico dell’enzima, mentre la porzione lipofila si inserisce in una tasca idrofobica, che sembra essere responsabile non solo dell’affinità ma anche della selettività nei confronti di questo enzima. Uno dei più noti inibitori dell’ALR2 è il sorbinil, in cui la porzione ciclica di tipo idantoinico è legata in forma spiro al carbonio 4 di un anello cromanico. Tuttavia questo composto non è stato impiegato in terapia in quanto provoca reazioni di ipersensibilità, imputabili principalmente alla porzione idantoinica.
Sono quindi stati sviluppati numerosi composti, in cui l’anello immidico è stato sostituito con bioisosteri come gruppi tiazolidindionici, ossazolidindionici e succinimmidici.
NH HN O O NH S O O NH O O O HN O O tiazolidindionici ossazolidindionici succinimmidici Figura 24.
Successivi studi di relazione struttura-attività hanno dimostrato che i composti più attivi nei confronti dell’ALR2 sono quelli che possiedono uno scheletro base di tipo cromanico ed una porzione acida flessibile, spesso legata ad un azoto ammidico.
Molti di questi composti tuttavia, pur possedendo una buona attività in vitro, si sono rivelati inefficaci in vivo a causa della comparsa di effetti collaterali o a causa della loro scarsa biodisponibilità.
La ricerca è oggi orientata verso due principali obbiettivi: comprendere a fondo le interazioni enzima-inibitore per ottimizzare i requisiti strutturali e limitare o eliminare gli effetti indesiderati.
Nel laboratorio presso il quale è stata svolta una parte di questa tesi di dottorato, erano state precedentemente progettate e sintetizzate nuove molecole analoghe al cromakalim, un attivatore dei canali KATP; questi nuovi composti possiedono una porzione benzopiranica presente nel sorbinil, anche se sostituita in posizione 2 con due raggruppamenti lipofili, e un eterociclo di tipo morfolonico (A) o ossazolidinonico (B) legato al carbonio 4 in forma spiro33.
O N O OH cromakalim O N O O R' R A O N O O R' R B NC
Figura 25. cromakalim e nuovi riarrangiamenti molecolari.
L’analogia strutturale di tali composti con il sorbinil ha suggerito l’idea di introdurre in alcune di queste molecole un gruppo acetico, considerato fondamentale per l’attività ALR2 inibitrice. La presenza di un raggruppamento acido negli inibitori dell’aldoso reduttasi sembra infatti essere un requisito essenziale ai fini dell’attività.
O NH HN O O F O R COOH SORBINIL I CF3 H3CO S N CH3 COOH TOLRESTAT
Figura 26. Possibili composti (I) risultanti dalla fusione delle classi delle immidi (sorbinil) e dei
derivati dell’acido acetico (tolrestat).
Su tale presupposto, furono sintetizzati i derivati cromanici 4-spiro-sostituiti in cui una funzione acetica è legata all’azoto della spiro-ossazolidina (1,2 o B) o all’azoto dello spiro-morfolone (A).
O O N O COOH O O N O COOH Br O O N O COOH R R1 O R N O O COOH R1 1 2 A B R = H, Br; R1 = OMe, Cl, Br
Figura 27. composti sintetizzati.
I composti 1,2 presentano una porzione 2,2-dimetil-benzopiranica non sostituita (1) o sostituita in posizione 6 con un atomo di bromo (2), in quanto nel sorbinil e in alcuni suoi analoghi la alogeno-sostituzione in questa posizione sembra essere importante per una buona affinità.
I derivati di tipo A differiscono dai composti 1,2 oltre che dalla presenza di un sostituente di tipo spiro-morfolonico in posizione 4 del sistema benzopiranico, anche dal fatto che in posizione 2 al posto del raggruppamento gem-dimetilico è presente un metile e un sistema fenilico opportunamente sostituito (analogamente a quanto avviene per i composti di tipo B). La presenza di questo raggruppamento lipofilo più ingombrante dovrebbe essere in grado di aumentare l’interazione del ligando con la tasca idrofobica presente nel sito attivo dell’enzima.
L’attività biologica dei nuovi composti sintetizzati presso il gruppo di ricerca in cui ho svolto questa tesi di dottorato, è stata valutata mediante test in vitro con un estratto purificato di ALR2 allestito da cristallini di ratto e impiegando come cofattore NADPH e come substrato D,L-gliceraldeide.
L’attività di inibizione dell’ALR2 è stata determinata spettrofotometricamente, a 30°C, misurando il decremento di assorbanza a 340nm dovuto all’ossidazione del NADPH a NADP+.
Gli IC50 dei composti sintetizzati sono riportati in tabella e sono relativi alle miscele diastereoisomeriche dei derivati 4-spiro-ossazolidinonici che presentano in posizione 2 due gruppi metilici (1,2) o un raggruppamento metilico e uno fenilico opportunamente sostituito (3-6).
O O N O COOH R 1, 2 O O N O COOH R R1 3-6 Tabella: Composti R R1 IC50 µM 1 H - 42.3 2 Br - 17.3 3 H p-OMe 43.8 4 Br p-OMe 1.6 5 H p-Cl 6.11 6 Br p-Cl 6.30 Sorbinil - - 0.65 Tolrestat - - 0.05
Dai risultati indicati in tabella si può osservare che per quanto riguarda i derivati spiro-ossazolidinonici sostituiti in posizione 6 con un atomo di bromo sul sistema benzopiranico (2,4,6), la sostituzione di un gruppo metilico in posizione 2 (2) con un raggruppamento più lipofilo come un fenile opportunamente sostituito (4 e 6) porta ad un marcato miglioramento dell’attività inibitoria nei confronti dell’ARL2. Lo stesso andamento è osservabile anche per gli analoghi non sostituiti sul sitema benzopiranico (1,3,5), anche se in questo caso l’attività sembra essere fortemente influenzata dal sostituente in posizione para del fenile (3: IC50 = 43.8 µM vs 5: IC50 = 6.11 µM).
Con lo scopo di comprendere meglio l’effetto delle modifiche strutturali apportate ai derivati spiro-ossazolidinonici sulle proprietà inibitrici, in questa tesi di dottorato è stato ritenuto interessante i singoli diastereoisomeri che costituiscono le miscele dei derivati sintetizzati e valutarne la loro attività.
Per fare questo è stato necessario selezionare due composti attivi che differissero esclusivamente per il sostituente sull’anello fenilico (4,6) e che possedessero una apprezzabile attività come miscele diastereoisomeriche. Le due miscele diastereoisomeriche selezionate sono i derivati 6-bromo sostituiti sul sistema benzopiranico (4,6), che presentano come sostituente in posizione 2 un 4-metossifenile (4) e un 4-clorofenile (6), rispettivamente.
Parte di questa tesi di dottorato è consistita nella preparazione su larga scala dei due derivati spiroossazolidinonici seguendo lo schema sintetico riportato nello schema e nello studio di una metodica analitica mediante HPLC che permettesse la separazione dei singoli diastereoisomeri che costituiscono le miscele di composti 4 e 6.
I composti 4,6 sono stati sintetizzati come è descritto nello schema.
I derivati 9a,b, ottenuti per reazione del metossiacetofenone (8a) o del 4-cloroacetofenone (8b) con il 5-bromo-2-idrossiacetofenone (7) e pirrolidina, sono stati sottoposti a reazione con trimetilsililcianuro (TMSCN) in presenza di quantità catalitiche di ZnI2 per dare i trimetilsilil derivati 10a,b. Questi, sono stati ridotti ad aminoalcool 11a,b utilizzando il LiAlH4 e successivamente sono stati sottoposti a reazione di ciclizzazione con 1,1-carbonildimidazolo (CDI) per formare i derivati 12a,b. L’addizione del bromoacetato di etile sull’azoto
ossazolidinonico dei composti 12a,b utilizzando il BuLi ha condotto ai derivati
13a,b dai quali, per reazione di saponificazione con KOH, sono stati ottenuti i
composti finali 4 e 6. Schema 8a, R = OMe 8b, R = Cl Br O OH
+
O R 7 Br O O R 9a,b Br O R TMSO CN Br O R O H NH2 O Br O N H O R O Br O N O COOEt R 10a,b 11a,b 12a,b 13a,b a b c d e f 4, 6Reagenti e condizioni: a: pirrolidina, CH3CN, riflusso b: TMSCN, ZnI2, CH2Cl2, t.a.
c: LiAlH4, THF, -10°C-t.a. d: CDI, THF, t.a.; e: BrCH2COOEt, BuLi, THF, -70 °C;
f: KOH 50%, MeOH, riflusso.
Una volta preparata la miscela diastereoisomerica è iniziato lo studio rivolto a verificare la possibilità di separare tale miscela. A questo proposito è stata utilizzata una strumentazione HPLC semipreparativa che non necessita di un uso eccessivo di prodotto. La colonna impiegata per l’individuazione del metodo di separazione è stata una RP18 in fase inversa.
Sono state effettuate svariate prove utilizzando come eluenti MeOH, AcCN o miscele delle stesse (tabella). In seguito alle prove effettuate, la miscela migliore è risultata essere quella costituita da MeOH:AcCN in rapporto 70:30 che sembra consentire una certa separazione di due picchi presumibilmente corrispondenti ai due diastereoisomeri.
Tabella:
Miscela eluente(%) Flusso (ml/min)
AcCN MeOH 100 - 1 95 5 4 70 30 1 50 50 1 30 70 0.5 30 70 1 10 90 0.5 10 90 1 - 100 1 - 100 2 AcCN H2O 30 70 2 H2O MeOH 5 95 2 10 90 1 10 90 2 15 85 2 i-PrOH MeOH 90 10 1 40 60 1 40 60 2 10 90 2 10 90 1
Il cromatogramma riportato in figura è stato ottenuto dalla miscela diastereoisomerica del composto 6. E’ evidente la presenza di due picchi che potrebbero essere attribuiti ai due diastereoisomeri.
Cromatogramma: 2.5 5.0 7.5 10.0 12.5 15.0 Minutes -0.12 0.00 0.25 0.50 0.75 1.00 AU 0. 016 8. 20 8 9. 352 10 .723 F ile: C hannel: Las t rec alc :
c :\star\data\rapposelli\16-1-08\k 52 70m 30a 1 50ul.run 1 = 207 nm R es ults N A O O N O COOH Br Cl 6 * *
Ad oggi sono ancora in corso studi per valutare i seguenti punti:
a) Attendibilità e riproducibilità del metodo su larga scala;
b) Se effettivamente i due picchi individuati con la miscela eluente costituita da MeOH:AcCN (70:30) corrispondono ai due diastereoisomeri che costituiscono la miscela del derivato spiro-ossazolidinonico 6.
3.5 Parte sperimentale
3.5.1 Materiali e metodi
La struttura dei composti è stata controllata per mezzo della spettrometria NMR. Gli spettri di risonanza magnetica nucleare sono stati eseguiti con uno spettrofotometro Varian Gemini 200 operante a 200 MHz. Le soluzioni erano circa 10% in CDCl3 e DMSO-d6 usando come standard interno TMS; i chemical shifts sono stati espressi in ppm scala δ. Degli spettri NMR vengono riportati solo i particolari più significativi. I punti di fusione sono stati determinati al microscopio di Kofler e non sono stati corretti. Le analisi elementari sono state eseguite dal nostro laboratorio di Chimica Analitica; la differenza tra i valori teorici e quelli ottenuti è risultata compresa in un intervallo di ±0.4%. Le evaporazioni sono state eseguite in evaporatore rotante e le disidratazioni delle fasi organiche sono state eseguite usando Na2SO4. Per le cromatografie su colonna è stato usato gel di silice 70-230 Mesh; per le TLC preparative sono state utilizzate lastre Merk di gel di silice G-60 con indicatore di fluorescenza 20 × 20.2 mm. Per la scansione UV è stato utilizzato uno spettrofotometro UV/VIS della PerkinElmer Lambda25. Per la separazione è stata utilizzata una strumentazione HPLC preparativa ProStar210 con due pompe PrepStar218 e un rivelatore UV ProStar 325. La colonna utilizzata, di tipo semipreparativo, è stata una Polaris C18 5µm (150 x 10,0mm) della Varian.
L’eluito è stato raccolto con un collettore di frazione ProStar704 (Varian) e successivamente evaporato a secco sottovuoto a 40° con un evaporatore ruotante (Buchi).
Sintesi dei cromanoni 9a,b
Ad una soluzione di 5-bromo-2-idrossiacetofenone commerciale 7 (7.90 g; 36.72 mmoli) in CH3CN (10 ml) è stato aggiunto l’opportuno acetofenone 4-sostituito 8a,b (36.72 mmoli) e la pirrolidina (0.78 g; 11.61 mmoli). La miscela di reazione è stata lasciata in agitazione a riflusso per 3 giorni. Trascorso tale periodo il solvente è stato evaporato e il residuo ripreso con AcOEt e lavato con HCl e NaOH. L’AcOEt è stato poi essiccato, filtrato ed evaporato ottenendo un olio grezzo che è stato purificato tramite cromatografia su colonna usando come miscela eluente esano/AcOEt in rapporto 95:5.
9 6-bromo-2-(4-metossifenil)-2-metil-2,3-diidro-4H-cromen-4-one (9a)
Resa: 22%
¹H-NMR (CDCl3): δ 1.74 (s, 3H, Me); 3.04 (d, 1H, J=16.5 Hz, CH2); 3.3 (d, 1H, J=16.5Hz, CH2); 3.75 (s, 3H, OMe); 6.81 (d, 2H, J=8.79 Hz, Ar); 6.92 (d, 1H, J= 8.79 Hz; Ar); 7.3 (d, 2H, J=8.79 Hz, Ar); 7.51 (dd, 1H, J=2.56; 8.79 Hz, Ar); 7.8 (d, 1H, J=2.38 Hz, Ar) ppm. Analisi elementare: C17H1503Br C H % Calc 58.81 4.35 % Trov 58.44 4.54 9 6-bromo-2-(4-clorofenil)-2-metil-2,3-diidro-4H-cromen-4-one (9b) Resa: 45% p.f.= 90-92°C 1 H-NMR (CDCl3): 1.74 (s, 3H, Me); 3.07 (d, 1H, J=16.6 Hz, CH2); 3.28 (d, 1H, J=16.6 Hz, CH2); 6.95 (d, 1H, J=8.8 Hz, Ar); 7.24-7.34 (m, 4H, Ar); 7.54 (dd, 1H, J=2.6, 8.8 Hz, Ar); 7.86 (d, 1H, J=2.6 Hz, Ar) ppm. Analisi elementare: C16H1202ClBr C H % Calc 54.63 3.41 % Trov 55.01 3.59
Sintesi delle O-trimetilsililcianidrine10a,b
Ad una soluzione dell’opportuno cromanone 9a,b (1.95 mmoli) in CH2Cl2 (6.2 ml) sono stati addizionati nell’ordine trimetilsililcianuro (290 mg; 2.92 mmoli) e ZnI2 (86.7 mg; 0.27 mmoli). La soluzione così ottenuta è stata lasciata in agitazione a temperatura ambiente per 24h. Trascorso tale periodo sono stati eseguiti dei lavaggi con H2O e la fase organica è stata quindi essiccata, filtrata ed evaporata ottenendo il composto desiderato 8a,b .
9
6-bromo-4-(O-trimetilsilil)-2-(4-metossifenil)-2-metilcroman-4-carbonitrile (10a)
Resa: 90%
¹H-NMR (CDCl3): δ 0.31 (m, 9H, Me); 1.70 (s, 3H, Me); 2.53 (d, 1H, J=14.1 Hz, CH2); 2.81 (d, 1H, J= 14.1 Hz, CH2); 3.79 (s, 3H, OMe); 6.85-6.93 (m, 3H, Ar); 7.25-7.30 (m, 3H, Ar); 7.38-7.44 (m, 1H, Ar); 7.58-7.59 (m, 1H, Ar) ppm.
Analisi: C21H2403NBrSi C H N % Calc 56.50 5.42 3.14 % Trov 56.21 5.59 2.97 9 6-bromo-4-(O-trimetilsilil)-2-(4-clorofenil)-2-metilcroman-4-carbonitrile (10b) Resa: 84% p.f.= 81-84°C 1 H-NMR (CDCl3): 0.30 (s, 9H, Me); 1.70 (s, 3H, Me); 2.55 (d, 1H, J= 14.3 Hz, CH2); 2.78 (d, 1H, J= 14.3 Hz, CH2); 6.92 (d, 1H, J= 8.8 Hz, Ar); 7.28-7.36 (m, 4H, Ar); 7.42 (dd, 1H, J= 2.1, 8.8 Hz, Ar); 7.59 (d, 1H, J= 2.1 Hz, Ar) ppm.
Analisi:
C20H2102NBrClSi C H N
% Calc 53.28 4.70 3.11