CLASSIFICAZIONE DEI TUMORI MAMMARI
NELLA CAGNA
I tumori mammari sono le neoplasie più frequenti nella cagna. Il 50% dei tumori mammari è maligno e tra questi il 50% metastatizza per via linfatica, più frequentemente ai linfonodi regionali ed ai polmoni ed in misura inferiore ai linfonodi sottolombari, al fegato, ai reni, alle ossa, al cuore ed al SNC.
Il tessuto mammario è costituito da diverse popolazioni cellulari quali epiteliale, mioepiteliale e connettivale e da ognuna può originare un tumore.
Tra i tumori maligni i più rappresentati sono i carcinomi, mentre i sarcomi sono meno frequenti. I primi originano dall’epitelio ghiandolare o dal mioepitelio mentre i sarcomi originano dal connettivo intralobulare.
I tumori mammari del cane derivano in gran parte dagli alveoli lobulari e dai piccoli dotti e raramente dai dotti interlobulari (carcinoma papillare) o dai dotti più grandi (carcinoma duttale).
Riguardo ai fattori di rischio esiste una vasta letteratura in entrambe le specie.
L’insorgenza dei tumori mammari è età-dipendente. L’età media d’insorgenza nel cane è tra 10-11 anni. Tali tumori sono anche ormone-dipendenti. Infatti grazie all’ovarioisterectomia precoce l’incidenza nella cagna è in declino; se fatta prima del primo calore è in grado di ridurre il
rischio di tumori mammari fino all’80%, tra il primo e secondo calore del 40% e dopo il secondo calore non previene la comparsa della neoplasia. I metodi di classificazione dei tumori mammari possono essere di tipo istogenetico, prognostico e morfologico descrittivo. La classificazione istogenetica non sempre è accessibile poiché a volte vi è la perdita completa dell’architettura lobulare ed anche per le incertezze relative agli elementi cellulari quali il mioepitelio.
Nel cane la classificazione istopatologica migliore è quella dell’Organizzazione Mondiale Della Sanità (OMS) e dell’ Armed Forced Institute of Pathology (AFIP).
Si tratta di una chiara classificazione che accanto ad una descrizione morfologica descrittiva aggiunge anche elementi di natura prognostica. (Marconato e Del Piero, 2005) ; (Misdorp et al., 1999); (Lana et al., 2001).
Classificazione istopatologica di Misdorp (Misdorp et al., 1999) dei tumori della mammella del cane
Tumori maligni
Carcinoma in situ (non infiltrante)
Carcinoma complesso (tubulopapillare,solido) Carcinoma semplice
- Carcinoma solido - Carcinoma anaplastico Carcinoma a cellule fusate Carcinoma squamocellulare Carcinoma adenosquamoso Carcinoma mucinoso
Carcinoma ricco in lipidi Sarcoma Fibrosarcoma - Osteosarcoma - Condrosarcoma Carcinosarcoma Tumori benigni Adenoma semplice Adenoma complesso Adenoma basalioide Fibroadenoma - A bassa cellularità - Ad alta cellularità Tumori misti benigni Papilloma duttale semplice Papilloma duttale complesso
Segue una breve descrizione per l’identificazione istologica della neoplasie mammarie secondo classificazione WHO.
CARCINOMI
Carcinoma in situ (non infiltrante): si tratta di un tumore epiteliale maligno semplice che non ha invaso la membrana basale. È caratterizzato da lesioni multicentriche non visibili macroscopicamente. Istologicamente è classificato come carcinoma semplice ed è difficile da differenziare dall’iperplasia. Morfologicamente può essere cribriforme, solido o con necrosi centrale comedonica o che aderisce alla membrana basale.
Carcinoma complesso: è una neoplasia maligna comune nel cane, lobulato macroscopicamente fatto sia da cellule epiteliali che mioepiteliali. Può espandersi nel tessuto connettivo circostante ma solo un 10% invade i vasi linfatici e le metastasi sono rare. La malignità è in ordine crescente nei morfotipi tubulopapillare, solido e anaplastico.
Carcinoma semplice: può essere classificato come tubulare, papillare, tubulopapillare, solido e anaplastico. Esso tende ad invadere il tessuto circostante e i vasi linfatici con metastasi ematogene e linfatiche piuttosto frequenti. Ne esistono due varianti:
- carcinoma semplice tubulare: ha una struttura tubulare, le cellule maligne che rivestono i tubuli sono pleomorfe con nuclei ipercromatici e quantità variabili di citoplasma. Evidente pleomorfismo nucleare e cellulare.
- Carcinoma semplice papillare: neoplasia maligna caratterizzata da proliferazioni papillari all’interno dei lumi tubulari. Le cellule neoplastiche sono simili al carcinoma tubulare con pleomorfismo cellulare e nucleare meno marcato. Possono essere presenti infiltrazioni intraluminali linfatiche stromali da parte delle cellule neoplastiche.
Carcinoma semplice solido: le cellule epiteliali maligne che occupano i lumi duttali formano monostrati solidi ad apparenza insulare. Si evidenziano aree di necrosi al centro dei lobuli neoplastici come comedoni (comedocarcinoma). Le cellule presentano vari gradi di pleomorfismo cellulare e nucleare e numero variabile di figure mitotiche. Possono essere presenti anche cellule singole o isolette infiltranti i vasi linfatici con metastasi ai linfonodi regionali. Il carcinoma cribriforme è frequente nel gatto ed è una variante del carcinoma semplice solido, caratterizzato da piccole aperture.
Carcinoma cellule fusate: in questa neoplasia le cellule fusate sono disposte in fasci che si incrociano e presentano moderato pleomorfismo e attività mitotica.
Carcinoma a cellule squamose: neoplasia epiteliale maligna con differenziazione squamosa che può originare dalle cellule duttali squamose del capezzolo e dalle cellule galattofore duttali cubiche. È difficile capire se si tratta di una neoplasia di origine cutanea epidermica oppure duttale poiché la morfologia è identica. Sono presenti isole epiteliali squamose che possono formare masse cheratiniche rotondeggianti (perle cheratiniche). Tale neoplasia invade i linfatici ma le metastasi a distanza sono rare. Il carcinoma adenosquamoso è considerato una variante del carcinoma squamocellulare ed è caratterizzato da strutture ghiandolari.
Carcinoma mucinoso: si tratta di una neoplasia mammaria caratterizzata dalla presenza di cellule epitelioidi o forme mioepiteliali maligne poliedriche e vacuolizzate immerse in un’abbondante mucina PAS positiva.
Carcinoma ricco in lipidi: si tratta di una neoplasia così classificata quando le cellule neoplastiche che producono lipidi sono presenti in percentuale maggiore dell’80%.
SARCOMI
Fibrosarcoma: è una neoplasia maligna mesenchimale composta da fibroblasti che producono collagene. Tali neoplasie possono insorgere da un tumore mammario preesistente o dallo stroma interstiziale mammario.
Osteosarcoma: generalmente è associato ad una massa mammaria presente da qualche tempo caratterizzata da crescita molto veloce. La neoplasia può essere un osteosarcoma puro oppure presentare componenti fibrose e cartilaginee o può insorgere da un tumore mammario misto benigno. Il comportamento biologico è simile a quello degli altri osteosarcomi che insorgono in aree scheletriche o extrascheletriche; è frequente la diffusione ematogena ai polmoni.
Condrosarcoma: rara neoplasia maligna a differenziazione cartilaginea.
Carcinosarcoma: si tratta di una neoplasia maligna infrequente che appare come una massa circoscritta di consistenza dura e ossea. Le metastasi possono essere di tipo misto carcinomatoso o sarcomatoso.
TUMORI BENIGNI
Adenoma semplice: tale tumore ha due varianti: - adenoma tubulare semplice
- adenoma solido semplice
il primo è costituito da proliferazioni tubulari epiteliali. È una neoplasia multilobulata e composta da un doppio strato di cellule epiteliali basofile con nuclei ipercromatici e poco citoplasma eosinofilico. Il secondo, invece, è una rara neoplasia composta da cellule mioepiteliali fusiformi o stellate circondate da matrice intercellulare basofila.
Adenoma basalioide: si tratta di un tumore composto da corde e gruppi di cellule omogenee che possono cheratinizzare. È caratteristica la palizzata di cellule epiteliali lungo una sottile membrana basale.
Adenoma complesso: proliferazione epiteliale duttale e mioepiteliale benigna incapsulata. La proliferazione iniziale mioepiteliale è fusiforme e stellata ed adiacente all’epitelio duttale entro i limiti della membrana basale. All’aumento delle cellule neoplastiche si accumala matrice intercellulare con scomparsa della membrana basale.
Tumore misto benigno: è una proliferazione epiteliale duttale e mioepiteliale benigna con formazione di cartilagine, osso, tessuto adiposo e midollo emopoietico in quantità variabili. Potrebbe essere considerato un adenoma complesso con aree metaplastiche.
Fibroadenoma: neoplasia a duplice proliferazione epiteliale e mesenchimale senza cartilagine, osso e grasso sia periduttale che intraduttale. Lo stroma prolifera intorno ai dotti i quali sono delimitati da un doppio strato di cellule epiteliali e mioepiteliali. Spesso è presente una capsula connettivale demarcante e lo stroma può essere duro sclerotico come pure lasso e mixoide.
Papilloma duttale: neoplasia epiteliale benigna caratterizzata da proliferazione arboriforme composta da fronde epiteliali e mioepiteliali sostenute da una stroma fibrovascolare. I dotti interessati dal papilloma possono essere dilatati fino alla formazione di cisti.
STADIAZIONE ISTOLOGICA
La stadiazione istologica sembra essere importante ai fini prognostici poiché con l’aumentare del grado istologico diminuisce la sopravvivenza. (Marconato e Del Piero, 2005). A causa della mancanza di omogeneità nel sistema di gradazione istologica, e nelle differenze individuali tra i patologi, non si utilizza un sistema di gradazione uniforme. Il sistema di gradazione basato sul grado di invasività, però, è senz’altro quello usato con maggior successo.
La stadiazione istologica proposta per i carcinomi mammari canini è la seguente (tabella 1).
Tabella 1
GRADO CRITERI DI INCLUSIONE
0 carcinoma in situ (non invasivo, incapsulato)
I proliferazione maligna estesa dello stroma senza invasione linfatica e vascolare
II proliferazione maligna invasiva con invasione linfatica-vascolare e metastasi linfonodali
III proliferazione maligna invasiva con invasione linfatica-vascolare e metastasi a distanza
Tab 1: “Griglia per la stadiazione istologica dei tumori mammari”
Grado 0 = indica che la proliferazione maligna del tumore è limitata ai bordi anatomici del sistema dei dotti della mammella, detto anche carcinoma in situ.
Grado I = mostra una proliferazione maligna che si estende oltre il sistema dei dotti verso lo stroma circostante, ma non all’interno dei vasi linfatici e vascolari.
Grado II = mostra un carcinoma invasivo con invasione vascolare e linfatica o con metastasi ai linfonodi.
Grado III = indica metastasi distanti.
L’entità dell’invasione oltre l’epitelio dei dotti, però, non è il solo riscontro di importanza prognostica. Il grado di differenziazione nucleare, infatti, influisce sulla frequenza delle recidive, anche a parità di stadio d’invasione. (Nelson e Couto, 2006).
I tumori maligni possono essere classificati come ben differenziati, moderatamente differenziati e scarsamente differenziati.
I tumori scarsamente differenziati (anaplastici) si ripresentano nel 90% dei casi nel giro di due anni dall’avvenuta mastectomia della cagna, mentre quelli moderatamente differenziati si ripresentano, rispettivamente, nella percentuale dl 68% e del 24%. (Nelson e Couto, 2006).
STADIAZIONE CLINICA
Un’accurata stadiazione clinica è importante prima di iniziare il trattamento.
I più importanti requisiti di stadiazione sono la valutazione del tumore primario, i linfonodi regionali, le zone metastatiche, i linfonodi più distanti e i polmoni. Le cose più rilevanti da tener presenti nel tumore primario sono il rapido accrescimento, le dimensioni e l’invasività clinica evidente (aderenza sulla pelle o sulla fascia), le ulcere ed il grado di infiammazione. Le parti più interessate dalle metastasi sono i polmoni, i linfonodi prescapolari, sternali e sottolombari, il fegato e raramente le ossa. (Marconato e Del Piero, 2005).
Tabella 2 – “Classificazione TNM per i tumori mammari canini”
T- tumore primitivo
T1 - diametro massimo del tumore < di 3 cm T2 - diametro massimo del tumore 3-5 cm T3 - diametro > di 5 cm
N- linfonodi regionali
N0 - LNF regionali istologicamente non coinvolti N1 - LNF istologicamente coinvolti
M - metastasi a distanza
M0 - massima evidenza di metastasi a distanza M1 - metastasi presenti I T1 N0 M0 II T2 N0 M0 III T3 N0 M0 IV qualsiasi T N1 M0 V qualsiasi T qualsiasi N M1
CARCINOMA INFIAMMATORIO NELLA DONNA
E NELLA CAGNA
L’ incidenza dei tumori mammari nella cagna è probabilmente tre volte superiore rispetto alla donna.
Molti di questi tumori sono tumori mammari misti mentre un terzo è rappresentato dai carcinomi che somigliano morfologicamente ai carcinomi del seno.
Il carcinoma infiammatorio (IBC) è una rara forma di carcinoma che colpisce sia la donna che la cagna con caratteristici aspetti clinico-patologici.
Il carcinoma infiammatorio è più frequente nel cane 17,7% rispetto alla donna 4,4-7,6% e può servire per studi volti a nuove terapie.
Si tratta di un tumore molto aggressivo, ad esordio acuto con decorso clinico fulminante e sopravvivenza breve. È caratterizzato da una precoce età alla diagnosi, infatti al momento della visita il tumore è sempre in fase avanzata (Owen, 1979). Tale neoplasia si accresce e metastatizza molto velocemente. Al momento della diagnosi nel 90% dei casi sono già presenti metastasi. I siti più frequenti sono i linfonodi regionali ed i polmoni.
Il cane presenta debolezza, anoressia, dolore e raramente poliuria- polidipsia secondaria alla secrezione di progesterone.
La presentazione clinica può essere confusa con una dermatite o una grave mastite poiché la mammella appare dura, aumentata di volume,
eritematosa, a volte ulcerata e dolente. La mastite, però, è localizzata e tende a comparire dopo l’estro o la falsa gravidanza.
Istologicamente è caratterizzato da infiltrati cellulari sia mononucleati che polimorfonucleati ed è accompagnato da edema. Le cellule neoplastiche presentano un evidente pleomorfismo nucleare e cellulare; il citoplasma è scarso o, più frequentemente, molto abbondante con attività fagocitica. Tale tumore non appartiene ad alcuno sottotipo specifico ma gli istotipi prevalenti nel cane sono il carcinoma solido, tubulare, papillare, adenosquamoso, anaplastico e scirroso (Marconato e Del Piero, 2005).
La caratteristica distintiva è l’imponente carcinosi dei vasi linfatici dermici (linfangectasia carcinomatosa) con occlusione e stasi linfatica secondaria che provoca edema della parte. L’invasione linfatica dermica è una caratteristica solo del carcinoma infiammatorio.
Figura 1: Immagine di sezione istologica di carcinoma infiammatorio. Si
nota una massiva embolizzazione da parte delle cellule neoplastiche nei linfatici del derma, associata ad infiltrato infiammatorio di tipo mistocellulare (ingrandimento 40x). Ematossilina-Eosina
Oltre all’invasione linfatica sono frequenti anche disordini di coagulazione quali: coagulazione intravasale disseminata (CID) visibili con petecchie, ematomi, secondari al rilascio di tromboplastina da parte del tumore; anemia e trombocitopenia.
Clinicamente si distinguono due forme:
• Carcinoma infiammatorio primario:si sviluppa molto rapidamente senza la comparsa di noduli mammari precedenti.
• Carcinoma infiammatorio secondario:si sviluppa con precedenti noduli mammari rimossi chirurgicamente. Questa è la forma più comune sia nella donna che nella cagna.
Nella maggior parte dei cani l’aspetto clinico ed istopatologico coincidono ma occasionalmente il paziente può avere solo i sintomi oppure la sola evidenza istopatologica di emboli tumorali linfatici dermici (carcinoma infiammatorio occulto) che però precede il carcinoma infiammatorio vero e proprio.
La chirurgia a scopo terapeutico è controindicata perché può portare a CID, micrometastasi intravascolari che portano a recidive e disseminazione metastatica. La chirurgia a scopo terapeutico è controindicata, mentre può essere eseguita a scopo diagnostico (bioptico), (Marconato e Del Piero, 2005).
Nella donna il carcinoma localmente avanzato rappresenta 1-5% dei tumori mammari. Il carcinoma mammario localmente avanzato corrisponde nel sistema di stadiazione TNM allo stadio III B. Il quadro è caratterizzato da
coinvolgimento della cute e/o della parete toracica e/o dalla presenza di masse linfonodali dovute all’estensione del tumore.
Nella donna, sebbene l’IBC sia rapidamente distinguibile dalle altre forme di carcinomi può essere confuso con il carcinoma non infiammatorio locale LABC (non-inflammatory locally advanced breast carcinoma ). Sono stati stabiliti degli aspetti clinico-patologici che non permettono di distinguere l’IBC dal LABC.
Per prima cosa entrambi sono carcinomi che si sviluppano localmente caratterizzati da prognosi infausta. Secondariamente l’IBC dal punto di vista clinicopatologico è caratterizzato da un diffuso eritema ed edema, nella donna chiamato “buccia d’arancia”, spesso senza una massa sottostante palpabile di temperatura elevata.
La presentazione clinica è dovuta a degli emboli tumorali all’interno dei vasi linfatici del derma (Anderson et al.,2003); (Günhan-Bilgen et
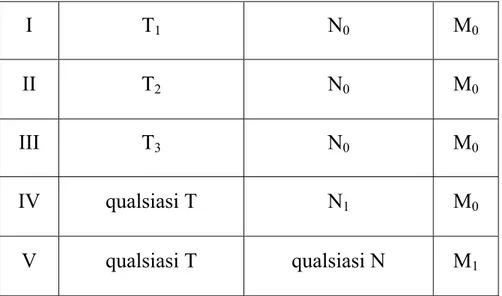
Figura 2: Mammografie di una donna di 44 anni con una massa dura e
diffuso eritema nel seno di destra. Vista medio laterale obliqua di entrambi i seni. (a) A destra una grande massa occupa l’intero seno; sono evidenti aumentata opacità, legamenti ispessisiti e aumento della vascolarità. (b) Una massa non palpabile (frecce) in profondità dovuto ad un carcinoma duttale clinicamente non evidente (Dershaw et al.,1994).
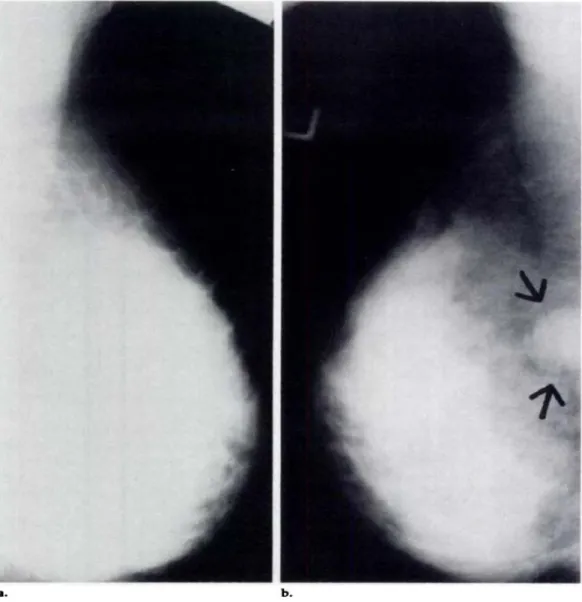
Figura 3: Mammografie di una donna di 57 anni con segni clinici evidenti
di carcinoma infiammatorio. Vista cranio caudale di entrambi i seni. (a) A sinistra aumentata opacità, ispessimento della pelle e addensamento stromale (Dershaw et al.,1994).
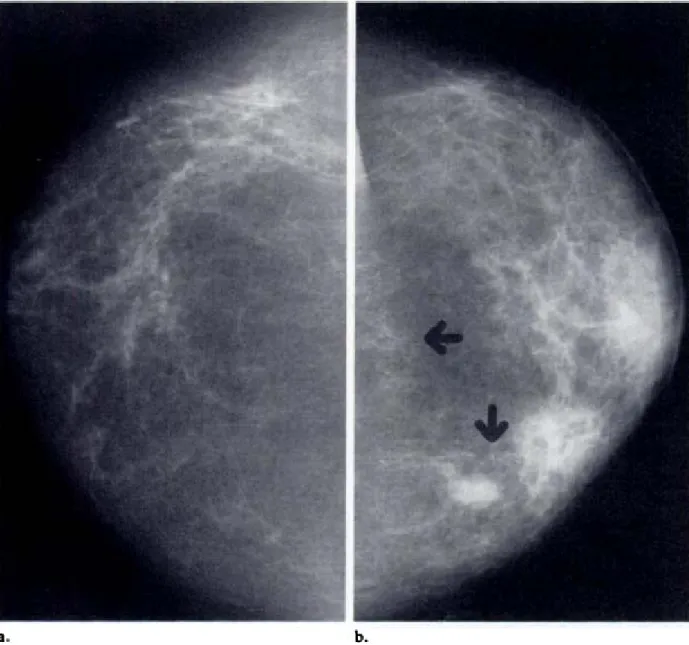
Figura.4: Mammografie di una donna di 51 anni con segni di carcinoma
infiammatorio a sinistra. Vista cranio caudale dei seni. (a) Evidente aumento di opacità della mammella di sinistra, pelle ispessita e addensamento stromale (b) La mammella di destra è normale (Dershaw et
(c) Vista della mammella di sinistra in proiezione medio laterale obliqua; è presente una massa con microcalcificazioni (frecce), (Dershaw et al., 1994).
Figura 5: Mammografie di una donna di 62 anni con pelle ispessita,
eritema nella mammella di destra. Vista cranio caudale di entrambe le mammelle. (a) La mammella di sinistra è normale. (b) Nella mammella di destra è presente un nodulo mediale, ispessimento della pelle e un vago aumento dell’opacità. Le frecce indicano le microcalcificazioni che sono
Sebbene ci siano delle differenze per brevità della vita tra cagna e donna e per l’età di insorgenza, alcuni fattori prognostici sono simili in entrambe le specie.
Le metastasi ai linfonodi regionali non sembrano avere una rilevante importanza nella cagna, ed anche l’attività mitotica non è importante come nella donna.
L’avanzamento metastatico è ben marcato in entrambe le specie eccetto il coinvolgimento al fegato e allo scheletrico nella cagna non è comune come nella donna (Owen, 1979).
Secondo Perez Alenza et al. (1997) sono state valutate le variabili cliniche, riproduttive e le caratteristiche patologiche quali fattori prognostici della malattia tumorale mammaria nel cane.
In questo studio il follow-up è stato realizzato su 74 cagne senza metastasi a distanza al momento della diagnosi per un periodo di 18 mesi dopo l’ escissione chirurgica dei noduli mammari.
L’età alla presentazione, le dimensioni del tumore, il coinvolgimento linfonodale, il grado istologico di malignità ed il grado nucleare rappresentano le variabili che sono in gradi di predire il tempo di sopravvivenza in cani con neoplasie mammarie.
Il tempo di sopravvivenza libero da malattia è invece associato all’età, alla presenza di tumori maligni multipli, al volume tumorale e all’ulcerazione cutanea.
Uno studio fatto su cani Beagle ha mostrato la presenza nella ghiandola mammaria di noduli iperplastici e/o neoplastici, tutto ciò era correlato al fatto che i cani avevano ricevuto una grande quantità di progesterone. Il progesterone risulta coinvolto inoltre nella patogenesi del carcinoma infiammatorio della donna: l’uso di progestageni nella contraccezione ha aumentato l’incidenza di carcinomi (Owen, 1979).
Come nella donna i recettori per estrogeni e progesterone sono stati studiati nei carcinomi mammari della cagna.
A sottolineare la loro influenza è l’ovariectomia che se effettuata precocemente riduce il rischio di neoplasia. I recettori per estrogeni i progesterone sono presenti in proporzione più elevata nella ghiandola mammaria normale e nei tumori benigni rispetto a quelli maligni e le aree metastatiche sono frequentemente negative (Perez et al., 2000).
Di conseguenza gli ormoni steroidei agiscono nelle cellule target durante gli stadi precoci della cancerogenesi mammaria, ma sembrano perdere il loro effetto stimolatante durante l’ultimo stadio della malattia.
Un altro fattore che gioca un ruolo importante nello sviluppo del tessuto normale e neoplastico è l’ “epidermal growth factor” (EGF) e “trasforming growth factor” (TGFs ), (Nerurkar et al., 1987), (Rutteman et al.,1990). Anche un eccesso di ormone della crescita (GH) indotto da progestinici dovrebbe influenzare lo sviluppo del tumore mammario.
In uno studio di cagne ovariectomizzate si è notato che l’obesità nella giovane età incrementava il rischio di tumori mammari e che la
proporzione di grasso nella dieta abituale dei cani malati era più bassa che nei controlli (Sonnenschein et al.,1991).
Poco è conosciuto riguardo le cause dell’IBC nella cagna.
L’IBC colpisce le giovani donne ed è caratterizzato da una scarsa sopravvivenza. Sebbene la sopravvivenza delle pazienti è stata migliorata dall’uso combinato dei trattamenti, le donne che hanno tale patologia sono soggette a morte rispetto a quelle con altri tipi di carcinoma mammario. Nella donna i fattori di rischio per il carcinoma mammario sono stati riconosciuti da molti anni come nella statistica riportata nella tabella sottostante (Kelsey et al., 1988); (Ferrero et al., 1994); (Vatten, 1998); (Verheul et al., 2000).
Tabella 3 - Fattori di rischio nel carcinoma mammario nella donna
Fattori Rischio elevato Basso rischio
Grandezza del differenziale
di rischio
Età Vecchio Giovane >>>
Paese di nascita Nord America e
Europa del nord Asia Africa >>> Classe socio-economica Alta Bassa >>
Stato Matrimoniale Mai sposata Sposata >
Luogo di residenza Urbano Rurale >
Razza Bianca Nera > Età al primo parto Sopra i 30 Sotto i 20 >
Ovariotomia No Si >>
Forma fisica dopo la
menopausa Obesa Magra >>
Età alla prima mestruazione Precoce Tardiva >
Età alla menopausa Tardiva Precoce >
Presenza di casi di carcinoma mammario
pre-menopausa nella famiglia
Si No >>>
Precedenti casi di carcinoma
mammario Si No >>>
Precedenti casi di malattia
fibrocistica Si No >>
Presenza di parenti di primo grado affetti da carcinoma
mammario
Si No >>
Precedenti casi di cancro alle
ovaie o all’endometrio Si No >>
Esposizione alle radiazioni Larga dose Minima
1. >>> Rischio relativo maggiore di 4.0 2. >> Rischio relativo compreso tra 2.0 e 4.0 3. > Rischio relativo compreso tra 1.1 e 1.9
Tabella 4 - Rischio relativo al cancro del seno sotto i 45 anni considerando la durata del trattamento con contraccettivi orali prima della prima gravidanza
Durata del trattamento Rischio relativo adattatoa 95% del limite di confidenza Mai 1.0 1-12 1.0 0.5-1.9 23-48 2.0 1.0-3.8 >48 2.6 1.3-5.4
a Rischio adattato per età al primo parto, alla prima mestruazione, alla menopausa, alla recidività di malattie mammarie benigne, e precedenti casi di carcinoma mammario in famiglia.
La bibliografia riporta molti studi fatti sull’incidenza e sulla sopravvivenza dell’IBC. Alcuni autori Chang et al. (1988) hanno usato i dati relativi al programma di sorveglianza, di epidemiologia ed i risultati finali del National Cancer Institute in Texas per il periodo dal 1975 al 1992 per calcolare la giusta età di incidenza e sopravvivenza tra 913 donne bianche e 121 donne afro-americane con IBC.
I risultati emessi sono stati che tra il 1975 e 1977 e 1990 e 1992 l’incidenza si è raddoppiata, aumentando per le donne bianche da 0,3 a 0,7 casi per 100.000 persone all’anno e per le donne afro-americane da 0,6 a 1,1 casi. Nell’insieme la sopravvivenza era peggiorata significativamente per i pazienti affetti da IBC che per i pazienti con non- IBC e per le donne afro-americane rispetto a quelle bianche.
Fra i bianchi la sopravvivenza è migliorata di 3 anni per i pazienti con IBC rispetto ai non- IBC fra il 1975 e 1979 e tra 1988 e 1992 aumentando dal 32% al 42% per i pazienti con IBC e dall’ 80% al 85% per quelli con non-IBC.
Tabella 5 - IBC e altri carcinomi mammari: Andamento del tasso d'incidenza adattato all'età in base alla razza
IBC: carcinoma infiammatorio
Non-IBC: altri tipi di carcinomi mammari CI: intervallo di confidenza
RAZZA BIANCA AFRO AMERICANI
IBC Non-IBC IBC Non-IBC Percentuale del Tasso Periodo Nr. (n=913) Tasso (95% CI) Nr. (n=166.375) Tasso (95% CI) Nr. (n=121) Tasso (95% CI) Nr.
(n=13.674) Tasso (95% CI) IBC Non-IBC 1975-77 97 0,3 (0,33-0,27) 22,386 76,8 (78,2-75,4) 14 0,6 (0,81-0,39) 1617 65,1 (69,5-60,7) 2,0 (1,63-2,37) 0,85 (0,84-0,86) 1978-80 107 0,4 (0,44-0,36) 22,900 75,5 (76,9-74,1) 14 0,5 (0,67-0,33) 1736 63,8 (68,0-59,6) 1,3 (1,07-1,53) 0,85 (0,84-0,86) 1981-83 140 0,4 (0,44-0,36) 25,424 80,8 (82,2 79,4) 7 0,2 (0,26-0,14) 2057 70,2 (74,4-66,0) 0,5 (0,42-0,58) 0,87 (0,87-0,88) 1984-86 165 0,5 (0,54-0,45) 29,335 90,2 (91,6-88,8) 17 0,5 (0,65-0,35) 2522 79,4 (83,7-75,1) 1,0 (0,85-1,15) 0,88 (0,87-0,89) 1987-89 173 0,5 (0,55-0,45) 32,702 96,9 (98,4-95,4) 29 0,8 (1,02-0,58) 2703 79,5 (83,7-75,3) 1,6 (1,38-1,82) 0,82 (0,81-0,83) 1990-92 231 0,7 (0,77-0,64) 33,628 96,3 (97,7-94,9) 40 1,1 (1,39-0,81) 3039 83 (87,1-78,9) 1,6 (1,41-1,79) 0,86 (0,85-0,87)
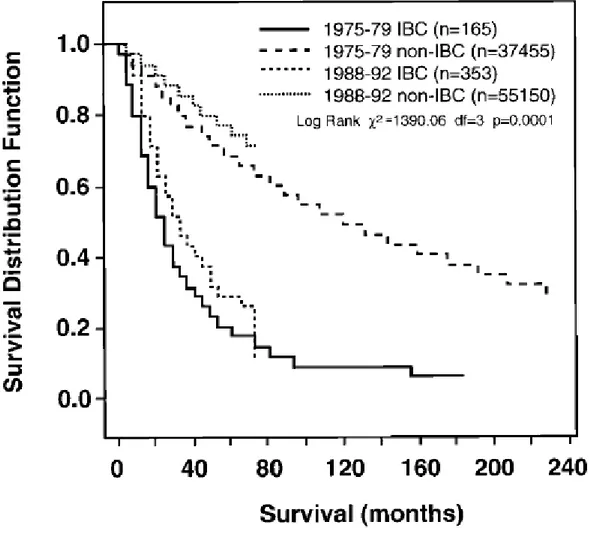
Figura 6: Le stime di sopravvivenza sono mostrate in base al carcinoma
mammario e alla razza. Sono state comparate le sopravvivenze dei pazienti con carcinoma infiammatorio e con altri tipi di carcinoma mammario: per i pazienti con IBC, “log rank” x2= 6,62; df =1; P = 0,01 e per i non- IBC “log rank” x2 =703,46; df =1; P =0,00001. Sono state comparate anche le razze. Circa le donne afro-americane il “log rank” x2=173,67; df =1; P =0,00001 e circa le donne bianche il “log rank” x2 =1631,17; df=1; P=0,00001.
Figura 7: Sono riportate le stime di sopravvivenza per le donne con IBC e
per quelle con non-IBC durante il periodo tra 1975-1979 e 1988-1992. I dati calcolati nello stesso intervallo di tempo sono: “log rank” x2 = 5,69; df =1; P =0,02 per le pazienti con IBC e per quelle non-IBC “log rank” x2 =504,02; df =1; P =0,00001.
Un altro studio portato avanti da Hance et al. (2005) sullo stesso modello del precedente ha mostrato un incremento dell’incidenza dell’ IBC dal 1998 al 1999 e dal 1997 al 1999 da 2,0 a 2,5 su 100.000 donne all’anno. Inoltre l’incidenza era più elevata nella donna di colore (3,1) che in quella bianca (2,2) durante il periodo di studio. Anche l’età di diagnosi è più precoce nell’IBC rispetto agli altri tumori mammari.
Figura 8: L’istogramma mostra la distribuzione dell’età dei pazienti con
differenti sottotipi di carcinomi al seno. A) Carcinoma mammario non T4.
B) Carcinoma mammario non infiammatorio localmente avanzato. C)
Carcinoma mammario infiammatorio
Anche la sopravvivenza ha rispecchiato i risultati precedenti infatti le donne con IBC andavano incontro a morte più velocemente rispetto a quelle con altri carcinomi mammari. La media di sopravvivenza secondo il test di Kaplan- Meier delle donne affette da IBC è di 2,9 anni, molto più bassa rispetto ai non-IBC (6,4-10 anni).
Infine dallo studio è emerso che le donne di colore con IBC sono più soggette a scarsa sopravvivenza rispetto alle donne bianche.
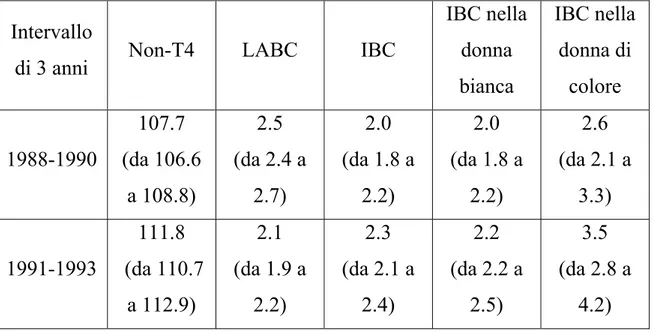
Tabella 6 - Tasso di incidenza relativo all'età e 95% di intervallo di confidenza per ogni sottotipo di cancro al seno
Intervallo
di 3 anni Non-T4 LABC IBC
IBC nella donna bianca IBC nella donna di colore 1988-1990 107.7 (da 106.6 a 108.8) 2.5 (da 2.4 a 2.7) 2.0 (da 1.8 a 2.2) 2.0 (da 1.8 a 2.2) 2.6 (da 2.1 a 3.3) 1991-1993 111.8 (da 110.7 a 112.9) 2.1 (da 1.9 a 2.2) 2.3 (da 2.1 a 2.4) 2.2 (da 2.2 a 2.5) 3.5 (da 2.8 a 4.2)
1994-1996 112.9 (da 111.9 a 114.0) 2.1 (da 1.9 a 2.2) 2.4 (da 2.2 a 2.5) 2.4 (da 2.2 a 2.5) 3.0 (da 2.4 a 3.6) 1997-1999 100.5 (da 99.5 a 101.4) 2.0 (da 1.9 a 2.2) 2.5 (da 2.3 a 2.6) 2.5 (da 2.3 a 2.7) 3.1 (da 2.5 a 3.7) Test del Chi2 P=.0084 P=.0025 P<.0001 P<.0001 P=.3153
LABC = Carcinoma mammario localmente avanzato IBC = Carcinoma infiammatorio
Figura 9: Le curve di Kaplan-Meier mostrano le curve di sopravvivenza
specifiche relative al carcinoma mammario. Il tempo medio di sopravvivenza è espresso in anni per ogni gruppo. A) Sottotipo di carcinoma mammario. B) Carcinoma infiammatorio.
Storicamente i pazienti con IBC al seno che sono stati curati con la sola chirurgia hanno avuto scarsi risultati.
Similmente la terapia locale con radiazione o con combinazione di radiazione e chirurgia non ha dato notevoli miglioramenti (Giordano e Hortobagyi, 2003). Tuttavia lo sviluppo della chemioterapia usato con la terapia locale ha dato un miglioramento notevole nella prognosi per i pazienti affetti da questa forma veramente aggressiva di cancro al seno. Da svariati studi è emerso che l’IBC ha risposto bene all’induzione del FAC (5-fluoracile, doxorubicina e ciclofosfamide) . Dopo questa i pazienti dovrebbero procedere alla terapia locale definitiva con radiazione, con chirurgia o entrambe.
Vista la prognosi infausta esistono pareri discordanti riguardo al trattamento locale ottimale poiché in alcuni casi è stata applicata la mastectomia che ha dato benefici mentre in altri casi non ha offerto vantaggio di sopravvivenza.
Per concludere, anche dopo la chemioterapia e la terapia locale i tassi di ricaduta rimangono molto alti, è perciò consigliata chemioterapia ausiliaria con antracicline o taxani dopo trattamento locale.
Nonostante i progressi significativi che sono stati realizzati nel trattamento di questa forma aggressiva di cancro al seno la maggior parte delle donne è soggetta a morte come nella cagna (Giordano e Hortobagyi, 2003).
I MARCATORI TUMORALI NEI TUMORI
MAMMARI
Il cancro della mammella rappresenta la prima causa di mortalità per tumore nella donna e l’incidenza aumenta con l’età. La malattia è rara negli uomini (1%).
Nel cancro della mammella i marcatori tumorali hanno un ruolo come parametri complementari, per le indagini nella fase iniziale della malattia, nel follow-up e nel monitoraggio del trattamento della malattia avanzata. In quest’ultima situazione i marcatori possono avere un ruolo primario, fornendo indicazioni precoci rispetto ad altre indagini.
I marcatori tumorali sono sostanze prodotte direttamente dal tumore, come ormoni, enzimi o altre proteine, più o meno correlate con la crescita numerica delle cellule tumorali oppure sono sostanze prodotte dall'organismo in risposta al tumore, come le proteine della fase acuta dell'infiammazione.
Negli ultimi anni si è lavorato molto per ottenere marcatori tumorali con una buona specificità per il cancro della mammella e ne sono stati individuati un certo numero: CA 15.3, MCA, CEA, TPA, CA 549, CA 27-29, CA-50, Beta2-Microglobulina, Ferritina.
Il marcatore è un segnale che indica uno stato di malattia prima della comparsa dei sintomi clinici o di evoluzione di neoplasia in assenza di segni clinici, capace di indirizzare in modo più preciso una diagnosi
Tali sostanze possono essere rilevabili in campioni di tessuto tumorale per mezzo di tecniche immuno-cito/isto-chimiche.
Particolare attenzione è rivolta allo studio ed allo sviluppo dei marcatori circolanti nei liquidi biologici che permettono, per mezzo di un semplice prelievo, di svelare a distanza la presenza e l’evoluzione di una neoplasia nella donna.
Per questa ragione l’utilizzazione dei marcatori tumorali ha avuto un notevole sviluppo negli ultimi anni e col passare del tempo stanno diventando sempre più test di routine all’interno dei laboratori di analisi cliniche.
Idealmente un marcatore tumorale dovrebbe soddisfare i seguenti requisiti :
- Specificità : deve essere prodotto soltanto dal cancro con esclusione di
ogni altro tessuto.
- Sensibilità : deve essere capace di rivelare il cancro anche negli stadi più precoci.
- Utilità : deve avere interesse diagnostico, prognostico e terapeutico, con valori correlabili allo stadio della malattia.
- Praticità : deve essere rilevabile per mezzo di tecniche semplici ed
economiche.
Purtroppo questo marcatore “ideale” non esiste, dal momento che la somiglianza della cellula cancerosa con quella normale impedisce una distinzione qualitativa tra malattie neoplastiche e non.
un “valore soglia (cut-off)” che produrrà un certo numero di falsi positivi
e/o falsi negativi (Palombella http://web.mac.com/sims.sims/iWeb/Tumori%20del%20Seno/Marcatori.ht
ml).
I marcatori tumorali possono aiutare il clinico nella diagnosi differenziale tra patologia benigna e maligna. La fase nella quale i marcatori tumorali trovano migliore applicazione è l’identificazione precoce di recidive o metastasi nel paziente neoplastico libero da malattia.
Un innalzamento del marcatore è fortemente significativo di ripresa di malattia, purché il valore del marcatore sia confermato da altri due o tre dosaggi successivi e sia stata esclusa qualsiasi patologia benigna concomitante. Non sempre un valore negativo di marcatore esclude la presenza di malattia.
Il marcatore tumorale può essere utile anche durante il monitoraggio della terapia in quanto variazioni di concentrazione riflettono il successo o l’insuccesso di una terapia. Anche in questo caso, però, valori negativi di marcatore non sono sempre significativi di risposta alla terapia.
FATTORI PROGNOSTICO-PREDITTIVI NEL
CARCINOMA DELLA MAMMELLA
L’ esigenza del clinico di disporre di fattori prognostico-predittivi sempre più precisi ha portato nell’ultimo decennio allo studio di una serie di caratteristiche tumorali di cui si è verificato il valore clinico.
Nel 1992 McGuire ha descritto una serie di caratteristiche che devono essere soddisfatte per ritenere un biomarcatore un fattore prognostico-predittivo quali la rilevanza biologica nel processo di progressione neoplastica; la riproducibilità nel laboratorio delle tecniche utilizzate per la sua determinazione; la rilevanza clinica; il valore clinico indipendente da altri fattori e l’ utilizzazione di valori cut-off.
Gli indicatori sia prognostici che predittivi possono essere raggruppati in diverse categorie:
fattori clinico-patologici: indicatori di estensione e di morfologia cito-istologica della malattia;
fattori biologici: indicatori di ormonosensibilità, proliferazione cellulare ed invasività;
fattori bio-molecolari: espressione di alterazioni di oncogeni o geni sopressori.
FATTORI CLINICO-PATOLOGICI
La dimensione tumorale, la presenza o meno di metastasi linfonodali al momento della chirurgia e/o di metastasi a distanza rappresentano i fattori prognostici meglio conosciuti e di maggiore rilevanza clinica.
Essi sono fattori di routine nella pratica clinica da alcuni decenni e forniscono informazioni indispensabili per una corretta terapia.
Dimensioni del tumore
Il diametro del tumore mammario primitivo al momento della prima diagnosi rappresenta un fattore prognostico di ricorrenza di malattia e di sopravvivenza indipendente dalle altre informazioni clinico-patologiche del tumore.
Nella donna la probabilità di sopravvivenza con diametro tumorale <1cm è infatti globalmente di circa il 98%, probabilità che scende al 89% per tumori con diametro compreso tra 1 e 3 cm ed arriva al 85% per quelle con diametro tumorale da 3 a 5 cm.
Nella cagna con diametro tumorale <3 cm si ha una ricaduta della malattia dopo un anno del 30%, dopo due anni del 40%. Se il tumore è > di 3 cm la ricaduta della malattia è del 70% dopo un anno, dell’80% dopo due anni. Il diametro tumorale è anche predittivo di presenza di metastasi linfonodali al momento della chirurgia (Correale et al. Rivista mensile di Medicina, anno 20).
Stato linfonodale ascellare
La presenza o l’assenza di metastasi ai linfonodi ascellari al momento della chirurgia rappresenta per le pazienti con carcinoma mammario un fattore prognostico di notevole importanza per l’andamento clinico della malattia. La presenza di cellule tumorali nei linfonodi regionali o cellule visibili nei vasi linfatici alla biopsia sono indice di una cattiva prognosi.
Grado di differenziazione cito-istologica
Nella pratica di routine viene determinato il grado di differenziazione cellulare ed istologico. La sua definizione si basa su parametri morfologici. La metodica più frequentemente utilizzata per la definizione del grado è rappresentata dalla classificazione di Scarff-Bloom-Richardson che prende in considerazione tre parametri: l’indice mitotico, il grado di differenziazione istologica del tessuto neoplastico ed il pleomorfismo nucleare (Sarli et al., 2002).
L’ ulcerazione è un importante parametro morfologico prognostico che sembrerebbe avere significato sfavorevole, in campo umano è stata associata ad un elevata attività mitotica (McGovern et al., 1982).
Tabella 7-Fattori prognostici Ricaduta della malattia dopo 1 anno Ricaduta della malattia dopo 2 anni Mortalità Dimensioni Diametro < 3 cm 30% 40% Diametro > 3 cm 70% 80% Invasività Linfonodale 90% 100% Tipo Istologico Lobulare NA NA 20% Duttale NA NA 65% Altri tipi NA NA 15% Stadio Istologico
0 Confinato Localmente (in situ) 10% 20% I Invasione Locale
Ben Diffuso 40% 40%
Moderato 40% 63%
Scarsamente 40% 77%
FATTORI BIOLOGICI
Recettori per l’Estrogeno e Progesterone
E’ stato dimostrato da alcuni decenni che la cellula tumorale mammaria media la sensibilità ai farmaci ad azione antiestrogenica, grazie alla presenza intracellulare di recettori per estrogeno (ER) e/o per il progesterone (PRg), (Peña et al., 2007).
La loro presenza è stata analizzata sia come fattore di tipo prognostico che predittivo (Millanta et al., 2005).
Inizialmente è emerso che pazienti con tumore provvisto di recettori per ER hanno avuto un maggior intervallo di tempo libero da malattia e una maggior sopravvivenza fino a 5 anni dall’intervento. Questi dati, però, non sono stati confermati per pazienti con follow-up più lungo.
Il vantaggio in termini di sopravvivenza libera da malattia per le pazienti con tumore ER+ è risultato evidente soprattutto per quelle che avevano ricevuto un trattamento antiestrogenico.
Attualmente i Recettori per Estrogeno e Progesterone sono ritenuti clinicamente utili nel predire la risposta alla terapia endocrina.
La presenza contemporanea di ER e PgR nel tumore primitivo sembra garantire una probabilità di risposta agli antiestrogeni del 60-70% in confronto ad una probabilità del 10% che caratterizza le pazienti con tumore ER ed RPg negativo (Peña et al., 2003).
Una probabilità intermedia di risposta caratterizza invece le pazienti provviste solo di uno dei due recettori (Correale et al. Rivista mensile di Medicina anno 20).
Per classificare le pazienti affette da carcinoma mammario provvisto o meno di recettori ormonali si utilizzano valori cut-off positivo/ negativo. La ormonoresponsività della malattia è proporzionalmente maggiore all’aumentare dell’espressione del recettore poiché esiste una relazione continua tra la concentrazione dei recettori e la probabilità di risposta alla terapia (Pérez-Alenza et al., 2000).
I recettori possono essere determinati con metodo biochimico o immunoistochimico .
Il metodo biochimico è più indaginoso ed è difficilmente eseguibile in neoplasie piccole (inferiori a 0.5 cm).
Il metodo immunoistochimico ha il vantaggio di una maggiore praticità, infatti può essere eseguito anche su sezioni istologiche contigue a quelle utilizzate per la diagnosi morfologica ed è utilizzato soprattutto nei tumori di piccole dimensioni.
I risultati emersi per la determinazione immunoistochimica degli ER hanno evidenziato un’elevata variabilità dei risultati tra i diversi laboratori.
Il ciclo cellulare ed i Marker di proliferazione cellulare
Il ciclo cellulare viene classicamente suddiviso nelle seguenti fasi: G1, S, G2 che precedono la mitosi Fase M; altre cellule che entrano in una sorta di quiescenza, vengono a trovarsi in una fase reversibile definita G0.
Si definisce interfase l’intervallo compreso tra due mitosi.
Il periodo di mezzo dell’interfase in cui avviene la sintesi del DNA è la fase S ed i due momenti che precedono e seguono sono rispettivamente lo stadio G1 e lo stadio G2 . L’insieme di queste fasi con l’aggiunta della fase di divisione vera e propria, la mitosi, costituisce il “ciclo cellulare”.
Nei tessuti normali esiste un equilibrio tra proliferazione cellulare, arresto di crescita, differenziazione e morte cellulare programmata (apoptosi). Il numero di cellule prodotte deve essere uguale al numero di cellule morte. Il tumore cresce se esistono squilibri tra crescita e morte cellulare.
Il ciclo cellulare è caratterizzato da una serie di eventi che determinano la crescita della cellula e la sua divisione in due cellule figlie con equa ripartizione del materiale genico.
Le cellule che derivano dalla divisione mitotica costituiscono tre sottopopolazioni:
• Cellule labili, mitoticamente attive per sostituire le perdite. Di queste fanno parte le cellule epiteliali e di rivestimento, quelle delle mucose del tratto gastroenterico, quelle di transizione del tratto urinario, quelle del midollo osseo e le cellule dei tessuti emopoietici.
• Cellule permanenti, che non possono più rientrare nel ciclo cellulare come neutrofili maturi, globuli rossi, tessuto nervoso, cellule del muscolo scheletrico e cardiaco.
• Cellule stabili,che possono rientrare nel ciclo cellulare a seguito di uno stimolo appropriato e andare incontro a rapida replicazione ricostituendo in breve tempo il tessuto di origine; ne fanno parte le cellule staminali o ghiandolari.
La conoscenza dettagliata del ciclo cellulare è fondamentale per capire i principi che regolano la terapia oncologica.
Le caratteristiche di crescita e la risposta alla terapia dipendono dalla distribuzione delle cellule nel ciclo cellulare, a sua volta influenzata dal tipo istologico, dalla massa tumorale e dallo stadio clinico del tumore. I tumori composti soprattutto da cellule che replicano attivamente rispondono meglio alle terapie antineoplastiche, quali chemioterapia e radioterapia.
Infatti, quest’ultime insieme alla chirurgia sono le principali modalità terapeutiche. La resistenza farmacologia acquisita, l’ instabilità genetica e l’ eterogenicità delle cellule neoplastiche sono tutti fattori che concorrono in alcuni casi al fallimento terapeutico.
La migliore conoscenza degli eventi molecolari coinvolti nella progressione tumorale, le caratteristiche biologiche del tumore come il potenziale metastatico, hanno consentito di sviluppare nuove strategie terapeutiche antitumorali tra cui l’inibizione dell’angiogenesi e la terapia genica (Marconato e Del Piero, 2005).
La velocità di crescita della neoplasia rappresenta un importante indice di aggressività non solo biologica ma anche clinica della malattia.
Sono state messe a punto alcune tecniche laboratoristiche che permettono di definire molte caratteristiche della cinetica di proliferazione cellulare delle neoplasie umane.
delle cellule che incorporano 3H-Timidina (TLI) ed è basato sulla capacità delle cellule che sintetizzano DNA di incorporare il precursore marcato. Il TLI determinato sul tumore primitivo è indipendente dalle dimensioni tumorali, dalla presenza o meno di metastatizzazione linfonodale loco-regionale mentre mostra una relazione con altre caratteristiche biologiche (recettori ormonali, ploidia) e morfologiche (grado di differenziazione cito-istologica).
Inoltre il TLI, fornisce informazioni prognostiche indipendenti da altre variabili cliniche (età) o patologiche (dimensioni del tumore) e biologiche. Recentemente la disponibilità di anticorpi ha permesso determinazioni immunoistochimiche per l’ identificazione di marcatori antigeni nucleari di proliferazione.
Tra questi, particolare attenzione ha suscitato l’antigene riconosciuto dall’anticorpo monoclonale Ki-67, oggi parzialmente caratterizzato come proteina non-istonica del peso molecolare di 345-395 kD, codificata da un gene localizzato sul cromosoma 10q25-ter, ed espressa in tutte le cellule proliferanti.
Un successivo approccio utilizzato è la determinazione della percentuale di cellule in fase S, ossia in sintesi di DNA (CMF-S), mediante citometria a flusso. La metodica si basa sulla capacità di alcuni fluorocromi (ioduro di propidio, mitramicina, bromuro di etidio, DAPI) di legarsi stechiometricamente al DNA e di emettere una fluorescenza, direttamente proporzionale al contenuto nucleare di DNA.
La percentuale di cellule in fase S viene calcolata utilizzando modelli matematici che consentono di determinare le frazioni di cellule anche nelle altre fasi del ciclo (GO1, G2/M).
La determinazione citofluorimetrica permette di analizzare in breve tempo un elevato numero di cellule e può essere condotta su materiale fresco o congelato o su tessuti fissati in formalina ed inclusi in paraffina.
La limitazione sta nel fatto che essa viene condotta su sospensioni cellulari o nucleari ottenuti da disaggregazione del tessuto tumorale e cioè su campioni contenenti tutte le componenti cellulari.
Marker di invasività
Il sistema degli attivatori del plasminogeno gioca un ruolo importante nell’invasione tumorale e nella metastatizzazione. Il gruppo tedesco di Janicke per primo ha riportato che i livelli tissutali tumorali dell’attivatore del plasminogeno di tipo urochinasico e del suo inibitore (PAI-1) sono fattori prognostici importanti sia per le pazienti con carcinoma mammario operabile con metastasi ascellari linfonodali che con linfonodi negativi.
Marker di neoangiogenesi
Lo sviluppo del tumore primitivo e delle sue metastasi dipendano dalla neoangiogenesi tumore-indotta. Questo delicato processo coinvolge una cascata di eventi e fattori pro ed antiangiogenici presenti a livello extra ed intracellulare (Millanta et al., 2002).
Numerosi di questi fattori sono stati studiati come fattori prognostici per il carcinoma mammario umano.
La misura più comunemente utilizzata per la determinazione delle caratteristiche neoangiogeniche del singolo tumore è rappresentata dalla conta al microscopio ottico del numero di vasi intratumorali evidenziati o con anticorpo anti Fattore VIII, portato avanti anche nello studio di Millanta et al. (2002) o anti CD31.
Figura 11: Carcinoma infiammatorio: embolizzazione massiva di vasi. La
parete dei vasi è stata evidenziata marcando le cellule endoteliali con anticorpo anti-Fattore VIII. (metodo streptavidina-perossidasi, controcolorazione con ematossilina-eosina, ingrandimento 40x).
Altri fattori angiogenici di interesse neoplastico sono stati valutati come il Vascular Endotelial Growth Factor (VEGF), di cui sono state identificate e sequenziate 5 isoforme: VEGF-A, VEGF-B, VEGF-C, VEGF-D, PIGF e il Fibroblast Growth factor B. La linfoangiogenesi è indotta prevalentemente da VEGF-C e VEGF-D, mentre il VEGF-A è il più potente mitogeno per le cellule endoteliali.
La valutazione delle caratteristiche angiogenetiche tumorali permettere di distinguere tumori con fenotipo più aggressivo (Gasparini 2001).
FATTORI BIO-MOLECOLARI
Oncogene C-erbB-2/Her2/neu
L’oncogene HER-2/neu, localizzato sul cromosoma 17q21 ed anche noto come c-erbB-2, codifica per una glicoproteina trasmembrana di 185-kd correlata ma distinta dal recettore per l’Epidermal Growth Factor e provvista di attività tirosino- chinasica (Parton et al., 2004).
Alterazioni del gene e/o overespressione della proteina risultano presenti in circa il 30% dei carcinomi mammari nella donna. Per l’analisi delle alterazioni di questo gene possono essere utilizzate diverse tecniche laboratoristiche quali immunoistochimica ed ELISA per determinare la espressione della proteina; un Southern blotting o tecnica di fluorescenza in situ (FISH) per la valutazioni delle amplificazioni del gene.
La tecnica di laboratorio più utilizzata è sicuramente quella immunoistochimica che comunque risulta delicata dal punto di vista della riproducibilità in laboratorio.
Dopo un primo dato pubblicato da Slamon nel 1987, altri studi hanno verificato l’eventuale valore prognostico delle alterazioni di questo gene (Parton et al., 2004), (Millanta et al., 2005).
In letteratura l’overespressione di HER- 2/neu è risultata associata ad una prognosi infausta sia in termini di intervallo libero di malattia che di sopravvivenza limitatamente alle pazienti con linfonodi ascellari positivi (McCarty et al., 2002); (Parton et al., 2004). Al contrario, contrastanti
risultano i dati sul significato prognostico di HER-2/neu nei pazienti con linfonodi negativi.
Interessante, infine lo studio delle relazioni esistenti tra livelli di antigene HER-2/neu nel siero di pazienti con cancro alla mammella ed espressione tissutale tumorale del recettore (Parton et al., 2004).
L’aspetto sicuramente più interessante dell’analisi tissutale tumorale di HER-2/neu è comunque attualmente rappresentato dalla sua valenza come fattore predittivo di risposta al trattamento chemio e/o ormonoterapico. Per quanto riguarda la chemioterapia, il valore predittivo di HER-2/neu è in relazione al tipo di farmaco o combinazione utilizzata. Infatti, interessante è la relazione con l’efficacia clinica delle antracicline (Parton et al., 2004). Diversi studi hanno sottolineato la relazione tra espressione tissutale tumorale di HER-2/neu e resistenza al tamoxifene.
La sovraespressione di HER-2/neu è stata messa in relazione con la resistenza clinica agli antiestrogeni soprattutto nel sottogruppo di tumori provvisti di ER.
Di recente, ha avuto un decisivo impulso lo sviluppo di un anticorpo monoclonale umanizzato (Trastuzumab) contro HER-2/neu capace di neutralizzare in vitro il ruolo cruciale che questo recettore svolge nel processo di cancerogenesi e progressione della malattia. Il vantaggio terapeutico è comunque limitato alle pazienti con tumore non negativo per HER- 2/neu.
Come testimonia lo studio fatto da Millanta et al. (2005) nei carcinomi mammari felini, è stato valutato lo stato recettoriale di HER-2 e il potenziale prognostico.
La percentuale di carcinomi felini overesprimenti i recettori era più alta rispetto a quelli umani. Questi studi preliminari risultano un supporto definitivo per il comportamento maligno di questo tumore nel gatto e suggeriscono un possibile importante ruolo dell’overespressione di HER-2 come marker di malignità nel carcinoma mammario felino.
Nel cane lo studio fatto da De Las Mulas nel 2003 testimonia che, attraverso indagine immunoistochimica dell’espressione di HER-2, è stata riscontrata una overespressione nel 17,6% dei casi nel carcinoma mammario canino. Tale percentuale è molto simile a quella osservata nel carcinoma mammario umano (15-30%).
Il carcinoma mammario canino ha aspetti epidemiologici, clinici, morfologici e prognostici molto simili a quelli del carcinoma del seno. Per questo potrebbe essere utilizzato come modello per quel sottotipo di carcinomi mammari umani che manifestano una overespressione di HER-2.
L’overespressione di HER-2 risulta un indicatore di prognosi sfavorevole al pari di altri parametri classici (le dimensioni del tumore, il grado istologico (III), il tipo invasivo di crescita, il tipo istologico semplice e l’assenza dei recettori per gli ormoni steroidei).
Figura 12: Espressione HER-2 “+2” in emboli di carcinoma
infiammatorio. Immunoreattività di membrana da moderata ad intensa. (ingrandimento 40x).
ONCOGENI ED ONCOSOPPRESSORI
Il tumore si sviluppa quando una cellula normale muta geneticamente e diventa una cellula maligna. Alla base di questo processo vi è un’alterazione irreversibile del genoma cellulare, che converte un protoncogene in un oncogene.
Il protoncogene (c-onc) è un gene che regola la crescita e la differenziazione delle cellule mediante l’espressione dei geni, la sintesi del DNA ed il metabolismo cellulare. I prodotti dei protoncogeni (proteine) sono regolati in maniera ottimale per garantire la normale omeostasi cellulare.
Le classi di protoncogeni comprendono i fattori di crescita e i loro recettori (EGF, EGFR), le proteine nucleari (fattori di trascrizione myc, myb, fos, jun), le chinasi citoplasmatiche.
Gli oncogeni, invece, sono protoncogeni alterati, che permettono alla cellula di subire una trasformazione maligna. I meccanismi genetici che trasformano un protoncogene in un oncogene comprendono l’inserzione, la traslocazione di cromosomi, l’amplificazione genica, la mutazione puntiforme o la delezione genica. Tali mutazioni portano alla perdita di regolazione dell’espressione del protoncogene o alla sintesi di proteine anormali.
Un’altra alterazione importante è la perdita dei Tumor Suppressor Gene (TSG) od oncosoppresssori. Sono geni che codificano per proteine
dei segnali, iniziano la riparazione del materiale genico danneggiato e iniziano il processo di apoptosi nelle cellule danneggiate.
La perdita o il malfunzionamento di TSG permette alle cellule di replicare in maniera incontrollata e ciò può portare allo sviluppo e alla crescita tumorale.
Le cellule diventano capaci di eludere la sorveglianza immunologica e diventano capaci di tollerare l’ipossia, diventano angiogeniche, invasive metastatiche e chemioresistenti (Marconato e Del Piero, 2005).
ANGIOGENESI
Si definisce angiogenesi o neovascolarizzazione la formazione di nuovi vasi a partire da quelli preesistenti. I vasi sanguigni hanno un ruolo critico nell’apportare ossigeno e nutrienti ai tessuti e nell’eliminare i prodotti tossici che derivano dal metabolismo cellulare.
L’angiogenesi è cruciale in molti processi fisiologici o fisiopatologici, quali embriogenesi, ovulazione, gravidanza o guarigione delle ferite, e patologici quali arteriosclerosi, retinopatia diabetica, crescita tumorale e sviluppo di metastasi.
La crescita tumorale è angiogenesi-dipendente; il comportamento biologico del tumore è infatti influenzato dalla capacità della neoplasia di indurre la crescita e l’organizzazione endoteliale (Millanta et al., 2002). Senza un adeguato supporto sanguigno il tumore non può crescere oltre 1 mm3 ed il suo tasso metastatico è basso o assente.
Questo stadio è definito come fase prevascolare. Al contrario, una neoplasia aggressiva con un potenziale metastatico elevato sopprime i fattori antiangiogenetici e favorisce la produzione locale e propria di fattori angiogenetici che stimolano lo sviluppo di una vascolatura che nutre solo il tumore.
Grazie ai vasi neoformati il tumore può crescere esponenzialmente in un intervallo molto breve. L’evoluzione maligna di un tumore è strettamente correlata dal reclutamento di nuovi vasi.
Una vascolatura funzionale, infatti, oltre a provvedere in senso metabolico, facilita la diffusione metastatica delle cellule neoplastiche.
In prossimità del tumore, le cellule endoteliali, attivate dai fattori promotori secreti dalle cellule tumorali, cominciano a proliferare, mentre i fattori antiangiogenetici sono inibiti.
Le cellule endoteliali secernono alcuni enzimi proteolitici che degradano la membrana basale e la matrice extracellulare, facilitando la loro penetrazione nello stroma. Si forma un cordone capillare solido che si canalizzerà formando un nuovo vaso; le molecole di adesione creano una rete di comunicazione tra capillari neoformati e quelli preesistenti.
Infine le cellule muscolari lisce ed i periciti migrano a livello del vaso neoformato conferendo un supporto strutturale.
In corrispondenza del tumore la vascolarizzazione è diversa rispetto ai tessuti normali sia da un punto di vista morfologico che biochimico.
I vasi neoformati hanno un pattern morfologico del tutto anarchico, decorso tortuoso e molto irregolare, terminano a fondo cieco e spesso formano shunt arterovenosi. L’apporto ematico è disorganizzato e caotico con inadeguato rifornimento di ossigeno e nutrienti.
L’ipossia che ne deriva è un potente stimolo angiogenico: a mano a mano che il tumore si accresce le zone ipossiche aumentano, stimolando l’angiogenesi, con conseguente riossigenazione delle aree meno ossigenate del tumore. L’ipossia è un fattore prognostico negativo associata alla progressione tumorale.
La densità vascolare del tumore “microvessel density” (MVD) misura l’intensità dell’angiogenesi ed è riconosciuta con tecniche di immunoistochimica. Nello studio condotto da Toi et al. (1995) e da Millanta et al. (2002) dall’analisi immununoistochimica è emerso una correlazione tra l’incremento di MVD e l’espressione del VEGF.
La regolazione dell’angiogenesi deriva da un delicato bilancio tra fattori promotori e inibitori.
Oggi, si conoscono più di venti fattori promotori naturali, tra cui il fattore di crescita vascolare endoteliale (VEGF), il fattore basico di crescita fibroblastico (bFGF), il fattore di necrosi tumorale, il fattore di crescita piastrinica e la ciclossigenasi-2.
Tra i fattori inibitori abbiamo l’angiostatina, l’endostatina, l’interferone α, β e γ, interleuchina-1 e 12, fattore piastinico 4 e trombospondina-1.
Il fattore fondamentale che regola il processo fisiologico di vascologenesi e di angiogenesi è il Vascular Endothelial Growth Factor (VEGF).
Il fattore di crescita vascolare endoteliale è una glicoproteina che promuove la neovascolarizzazione ed è prodotta da numerose cellule, tra cui cellule tumorali, macrofagi, plasmacellule, megacariociti, linfociti e neutrofili, in risposta a stimoli ipossici o infiammatori.
Il VEGF è un potente mitogeno per le cellule endoteliali ed esercita le sue funzioni paracrine tramite specifici recettori localizzati sull’endotelio, stimolando l’angiogenesi (Millanta et al., 2002).
fuoriuscita di proteine che esercitano una pressione oncotica e impediscono allo stesso tempo il drenaggio linfatico che ridurrebbe l’accumulo di fluidi. Nello sviluppo del tumore si distinguono due fasi: una avascolare di quiescenza delle piccole lesioni (<2mm) e una seconda fase nella quale la crescita tumorale necessita della vascolarizzazione. La transazione alla seconda fase, lo switch angiogenico, è mediata dal VEGF.
Il VEGF rilasciato dal tumore agisce a livello dei recettori del VEGF presenti sulle cellule endoteliali, attivando l’angiogenesi. In tal modo il VEGF stimola la formazione di una vascolarizzazione nuova e immatura che presenta anomalie strutturali e funzionali.
La produzione di VEGF da parte del tumore crea un feedback positivo attraverso il quale l’angiogenesi indotta dal VEGF rende possibile un’ulteriore crescita tumorale. Come risultato di questo rapido accrescimento il tumore supera i limiti della sua vascolarizzazione, l’apporto di ossigeno e delle sostanze nutritive diviene inadeguato, dando luogo ad aree di ipossia. L’ipossia stimola un’ulteriore produzione di VEGF, che a sua volta stimola la formazione di nuovi vasi. Una volta che il tumore è entrato nella fase vascolare, la formazione di nuovi vasi prosegue durante tutta la crescita tumorale.
IL VEGF agisce anche come fattore di permeabilità vascolare, grazie alla sua capacità di indurre la fenestrazione dei vasi (formazione di falle nella parete vascolare) e di aumentare la permeabilità del microcircolo (Millanta
et al., 2002). L’aumento della permeabilità dei vasi sanguigni tumorali nei
proteine plasmatiche (per esempio, il fibrinogeno e altre proteine della coagulazione), con la conseguente formazione di una stroma pro-angiogenico.
Un’ulteriore conseguenza dell’aumentata permeabilità è l’innalzamento della pressione interstiziale, che inverte i gradienti di pressione normalmente presenti nel tessuto e in definitiva impedisce la penetrazione nei tessuti delle molecole, compresi gli agenti chemioterapici.
L’angiogenesi, stimolata dal VEGF, favorisce il contatto delle cellule tumorali con i vasi sanguigni, offrendo alle cellule una via per invadere i vasi stessi.
Il VEGF è coinvolto anche nella linfangiogenesi stimolando la formazione di vasi linfatici giganti, fornisce quindi un’altra possibile via di diffusione metastatica.
Il VEGF è il mediatore fondamentale dell’angiogenesi tumorale. Pertanto, con un’azione mirata del VEGF si può prevedere di ottenere l’inibizione dell’angiogenesi, insieme ad altri effetti, sulla vascolarizzazione tumorale volti a inibire la crescita del tumore, senza compromettere la funzione della normale vascolarizzazione nei tessuti sani.
La traduzione del segnale da parte del VEGF può essere inibita agendo sia sul ligando che sul recettore. Tanto la molecola del VEGF quanto i suoi recettori costituiscono dei possibili bersagli promettenti per il trattamento antitumorale.
Gli anticorpi anti-VEGF si legano al VEGF, eliminando la quota libera in circolo e impedendo che si leghi ai recettori. L’utilizzo degli anticorpi per agire su questa via presenta diversi vantaggi:
• gli anticorpi, che sono stati appositamente disegnati, sono altamente specifici e si legano al solo VEGF.
• inibendo il VEGF, gli anticorpi sono in grado di inibirne l’attività su tutti i recettori con i quali il ligando interagisce. Di conseguenza, agendo sul VEGF è possibile inibire gli effetti pro-angiogenici del VEGF mediati da tutti i recettori ai quali si lega.
• il legame con tutto il VEGF libero inibisce completamente la stimolazione dei recettori del VEGF mediata dal ligando.
E’ prevedibile che l’inibizione del VEGF inibisca sia l’angiogenesi tumorale e quindi la formazione di nuovi vasi sanguigni sia la crescita del tumore e lo sviluppo di metastasi.
Gli effetti dell’inibizione del VEGF sulla vascolarizzazione esistente comportano la sopravvivenza dei vasi sanguigni tumorali maturi con un assetto funzionale più fisiologico e la perdita di vasi immaturi che funzionano in modo anomalo.
Questo processo di sfrondamento e regressione dei vasi porta a una vascolarizzazione del tumore più ordinata, più fisiologica e più efficiente nel fornire sangue al tumore. Ne consegue una riduzione della permeabilità vascolare che determina un abbassamento della pressione interstiziale all’interno del tumore. La riduzione della pressione interstiziale nel tumore
consente una migliore penetrazione da parte di molecole come quelle dei chemioterapici e pertanto gli agenti anti-VEGF sembrano migliorare la diffusione di altre terapie utilizzate in associazione, compresa la chemioterapia.
La presenza di una vascolarizzazione caotica nel tumore comporta un rilascio di ossigeno non ottimale e dà luogo ad aree tumorali ipossiche. Per essere efficaci, le radiazioni ionizzanti hanno bisogno di ossigeno e quindi le aree tumorali ipossiche sono resistenti alla radioterapia.
L’inibizione del VEGF e la conseguente creazione di una vascolarizzazione del tumore simile a quella normale e più efficiente nel rilasciare l’ossigeno, induce una migliore ossigenazione e una maggiore sensibilità alla radioterapia.
Gli effetti antitumorali delle terapie anti-VEGF non si limitano a inibire la formazione di nuovi vasi sanguigni ma sono potenzialmente in grado di indurre direttamente la morte delle cellule tumorali e di rafforzare gli effetti dei trattamenti concomitanti (Folkman, 1992).
Concludendo, l’angiogenesi aumenta con l’incrementare dell’aggressività biologica del tumore pertanto il VEGF potrebbe essere sfruttato per valutare la malignità ed il potenziale di crescita di alcuni tumori.
Il valore prognostico di VEGF è stato studiato per tumori mammari, seminoma, linfoma, melanoma cutaneo ed emangiosarcoma.
Un inibitore dell’angiogenesi è l’angiostatina. Essa è un frammento interno del plasminogeno, precursore della plasmina, enzima responsabile della
Si pensa che alcune cellule tumorali siano in grado di attivare alcune proteasi capaci di produrre l’angiostatina a partire dal plasminogeno circolante.
Infine l’interferone α esercita azione antineoplastica sia direttamente, inibendo l’angiogenesi, sia indirettamente, inibendo la produzione di bFGF da parte delle cellule tumorali (Marconato e Del Piero, 2005).
SCOPO DELLA RICERCA
Visto il comportamento aggressivo del carcinoma infiammatorio della cagna, lo scopo della ricerca è stato di valutare il potenziale angiogenetico (VEGF) comparandolo con l’espressione di questa citochina in carcinomi non infiammatori
In oncologia veterinaria molti studi volti a valutare il significato prognostico dell’angiogenesi coinvolgono i tumori mammari canini. A causa dell’impatto epidemiologico e del comportamento clinico aggressivo del carcinoma infiammatorio canino (IMC) lo scopo di questo studio è valutare il processo angiogenetico.
Per tale scopo è stata valutata l’espressione del VEGF nei IMC attraverso immunoistochimica .
Un altro scopo di ricerca è stata la valutazione immunoistochimica dell’espressione di HER-2 sul possibile ruolo come marker di malignità. In bibliografia il ruolo dell’ HER-2 e del suo recettore è stato studiato nei carcinomi mammari canini e su linee cellulari derivate dal tumore sia attraverso indagini d’ibridazione sia d’immunoistochimica.
Gli studi preliminari hanno evidenziato una overespressione di questo oncogene con frequenza simile nel carcinoma mammario umano.
Infine è stata valutata l’espressione del recettore per estrogeno (ER) e di quello per il progesterone (PR).