5.2.3 Lo stress ossidativo: il ruolo della Cys 34 e il cambiamento di conformazione dell’albumina
L’HSA è il più grande sistema antiossidante dell’organismo, ad esempio reagisce con i radicali perossilici, ●OH e ●NO2 e proprio per questa sua ultima proprietà
l’albumina è già stata messa in relazione con certi stati patologici. L’HSA è infatti costituita da una miscela di HMA (human mercapto-albumin, o mercaptoalbumina), HNA 1 (human mercapto-albumin, o non-mercaptoalbumina ossidata reversibilmente) ed HNA 2 (non-non-mercaptoalbumina ossidata irreversibilmente) e si riscontra una netta diminuzione di HMA con l’avanzare dell’età ed in varie patologie come quelle a carico dei reni (insufficienza renale da glomerulopatie e nefropatie) e del fegato [67].
I potenziali siti di ossidazione sono la Cys 34, che a cose normali è l’unico residuo cisteinico che non fa nessun ponte disolfuro, insieme alla Met 123, Met 298, Met 446 e Met 548 [67]. Il legame degli acidi grassi all’albumina promuove l’ossidazione della Cys 34 e converte il complesso Cu-albumina da forte antiossidante a pro-ossidante. Il rame (Cu) è capace di convertirsi nelle due forme ioniche, Cu+ e Cu2+ grazie a reazioni ossido-riduttive che compie con altri reagenti antiossidanti, come l’acido ascorbico. Ruoli importanti del rame sull’albumina sono sicuramente nel mantenimento della vita della medesima e come realizzatore di essenziali funzioni catalitiche. Paradossalmente, le stesse proprietà redox del rame possono renderlo estremamente pericoloso perché esso può catalizzare reazioni che danno prodotti di intermedi di radicali liberi derivati dall’ossigeno molecolare. I fattori coinvolti nella regolazione dell’attività redox del legame tra
rame ed albumina non sono ancora ben chiariti. Sono stati studiati gli effetti delle modifiche della Cys 34 e del legame degli acidi grassi non esterificati sull’attività ciclica redox del complesso Cu-albumina. Poiché l’acido ascorbico è il più abbondante naturale riducente/ scavenger dei radicali liberi nel plasma sanguigno, per monitorare l’attività ciclica del complesso Cu/HSA è stato fatto uso di un campione dell’ascorbato che riguarda la risonanza paramagnetica elettronica (EPR). E’ stato osservato che sotto i valori di rapporto 1:1 tra albumina complessata con il rame e la forma libera, il rame era virtualmente legato nella forma redox inattiva, così come la Cys 34 era nelle forma ridotta (cioè Cys-SH). Durante l’attività redox ciclica dell’albumina indotta dalla sua interazione con il rame risultano evidenti le possibili modificazioni post-traduzionali non enzimatiche, quali l’alchilazione, la nitrosilazione o l’ossidazione di Cu/HSA a carico quasi esclusivo della Cys 34. Sono stati condotti degli esperimenti di ultrafiltrazione di Cu/HSA alchilata con N-etilmaleimide (Cu/HSA-NEM) che hanno mostrato che in rapporti al di sotto di 1:1 tra la forma complessata e quella non complessata, la produzione di HSA-NEM e di HSA S-nitrosilata (HSA-NO) era, comunque, più di un ordine di grandezza minore che in una soluzione contenente una equivalente concentrazione di ioni rame liberi. Mentre la forma di albumina ridotta (Cu/HSA-SH) è inattiva, il legame alla medesima dell’acido oleico o linoleico induce all’attività ciclica Cu-dipendente con un picco di attività raggiunta con il legame dell’acido grasso alla proteina in un rapporto di 3:1 con l’acido oleico e di 2:1 con l’acido linoleico. E’ stato concluso che il legame degli acidi grassi all’albumina causa profondi cambiamenti conformazionali nella molecola stessa e facilita l’ossidazione della Cys 34 con circa gli stessi rapporti di
quelli che causano l’attività ciclica redox del complesso Cu/HSA. Altra conclusione conseguente alla prima è che gli acidi grassi regolano le proprietà anti-pro-ossidanti della Cu-HSA per mezzo del controllo dello stato di ossidazione della Cys 34 [68].
La rottura della struttura sopraffina dei siti leganti il rame nelle forme varianti aumenta l’attività redox del rame e causa un danno e conseguente morte cellulare. Non è sorprendente, infatti, che la liberazione del rame come bersaglio per enzimi sia rigorosamente controllata all’interno delle cellule e nei fluidi. Le più abbondanti proteine plasmatiche sono l’albumina e la ceruloplasmina; entrambi sono proteine leganti il rame per la prevenzione della sua dannosa attività redox. La maggior riserva di rame plasmatico legato alla ceruloplasmina rimane apparentemente inattivo rispetto alla formazione del radicale libero. La più ampia riserva di rame plasmatico è quello associato all’albumina e il sito di legame per il rame ed è chiamato “motivo” legante Cu2+/ Ni2+: si trova a livello del tetrapeptide N-terminale Asp-Ala-His-Lys [69].
Sebbene sotto circostanze comuni, meno dell’1% dell’albumina (circa 110 mg /dl ovvero circa 1,6 μM) lega il rame, l’HSA rappresenta ancora una grande riserva di rame legato all’albumina, tenendo presente che in tutto l’organismo umano ci sono circa 400 g di albumina plasmatica (circa 6 mmol). In alcune malattie umane, come la Wilson o nelle artriti, i livelli di rame che si complessa con l’albumina possono notevolmente aumentare. L’HSA contiene un residuo di Cys ridotto (la Cys 34) che, a causa dell’enorme quantità di albumina plasmatica, costituisce la più ampia riserva di tioli reattivi nel plasma. Il gruppo SH della Cys 34 è ritenuto essere essenziale nella protezione allo stress ossidativi e la sua concentrazione sembra che
diminuisca nel caso di malattie, quali l’insufficienza renale o con l’avanzamento dell’età.
Mentre sia il legame con il rame che le proprietà nucleofile della Cys 34 sono importanti per la funzione antiossidante dell’albumina nella protezione contro gli stress ossidativi, gli specifici meccanismi coinvolti nella regolazione della sua attività redox non sono ancora completamente chiariti. E’ noto che l’albumina può subire sia modifiche traduzionali che post-traduzionali non enzimatiche, come la glicosilazione, l’acetilazione e l’ossidazione della Cys 34. Tali modifiche portano a profondi cambiamenti conformazionali, modificando i siti di legame con i ligandi naturali dell’albumina la quale potrebbe non essere più in grado di proteggere l’organismo umano dagli stress ossidativi e a lungo andare si potrebbero verificare aggravamenti delle malattie renali, se queste sono già in corso, oppure l’insorgenza di queste negli individui sani. Come sappiamo l’albumina è il più grande trasportatore di acidi grassi non esterificati e il loro sito di legame si trova principalmente nei domini 2 e 3 i quali hanno un’alta affinità di legame. Il legame degli acidi grassi all’albumina può essere associato ai drastici cambiamenti conformazionali che subisce la proteina in quanto questi possono riguardare strettamente le sue proprietà funzionali.
5.3
Varianti albuminiche umane
Le varianti di albumina sono proteine codificate dal medesimo gene posizionato sul cromosoma 4q11-22, composto da 15 esoni intervallati da 14 introni; l’ultimo esone non viene tradotto. Qualsiasi mutazione interessa una singola sostituzione aminoacidica generata da una mutazione puntiforme di una tripletta di DNA che porta una base nucleotidica diversa rispetto alla forma normale di albumina (wilde type).Un esempio classico di mutazione puntiforme che riguarda l’albumina è la tripletta AAA che muta in GAA, che determina la sostituzione di una lisina con un acido glutammico. Un’altra frequente sostituzione è quella da glutammico a lisina e in questo caso la mutazione classica della tripletta è GAG→ AAG, dove una guanina viene sostituita da una adenina come prima base della tripletta. Tramite l’analisi proteomica, in particolare con la 2-DE, è stato possibile identificare alcune delle numerose varianti albuminiche esistenti. Alcune mutazioni possono bloccare la maturazione della proteina e la proalbumina può arrivare ad essere il 50% dell’albumina totale. Esempi di questo tipo sono la variante Christchurch (-1Arg→Gln), Takefu (-1Arg→Pro), Jaffna (-1Arg→Leu) e Lille (-2Arg→His) [70]. Queste varianti di albumina si sono ritrovate nei sieri di pazienti affetti da insufficienza renale cronica; esistono, poi, delle varianti di albumina benigne che portano alla condizione di alloalbuminemia [71]. Quando la mutazione intercorre tra la posizione 225 e 333, essa appartiene al dominio II, se invece cade nell’intervallo dei residui 501-573 siamo nel dominio III [72].
In modo particolare abbiamo selezionato, tra tutte le mutazioni puntiformi che si conoscono dell’albumina, quelle in cui la mutazione riguarda esclusivamente i due aminoacidi lisina e acido glutammico: le mutazioni scelte, per cui, sono soltanto o
di tipo E→ K o viceversa, cioè K→ E. Sebbene queste mutazioni puntiformi riguardino solo due aminoacidi, i cambiamenti conformazionali, strutturali e funzionali dell’albumina possono essere modificati notevolmente, specialmente se queste mutazioni si trovano in punti “strategici” della proteina, come ad esempio presso un ponte disolfuro o ai capi di un loop o a livello di un dominio legante composti fisiologicamente importanti per l’organismo umano, come gli acidi grassi o i radicali liberi che devono essere eliminati in quanto altamente nocivi.
Le mutazioni puntiformi dell’albumina che riguardano esclusivamente la lisina e l’acido glutammico sono 20 sulle 50 note, sono tutte superficiali e vanno dalla posizione 60, dove nella forma “wilde type” c’è un Glu, alla 573, dove c’è una Lys. Già da questa informazione possiamo dire che se potessimo immaginare tutte quante le 20 mutazioni insieme tra loro si potrebbe vedere che riguardano un po’ l’intera molecola, interessando da più a meno i 3 domini.
La mutazione più studiata e più conosciuta del tipo K→E è quella denominata variante “Church Bay”, che riguarda la posizione 560 della sequenza aminoacidica. La variante Church Bay è una forma di albumina che è stata individuata sia con SDS-PAGE che con metodiche spettrometriche tipo l’ESI-MS [73].
Si tratta di un’albumina che presenta, in posizione 560, un Glu al posto di una Lys e questo è il risultato di una mutazione puntiforme (AAG→GAG) del nucleotide 98 dell’esone 13. Questa mutazione le conferisce una maggiore mobilità elettroforetica verso l’anodo, una maggiore velocità elettroforetica e quindi un incremento di polarità della molecola mutante, rispetto a quella normale [73]. Questo si spiega con il fatto che l’albumina Church Bay pesa 1 Da meno di quella normale proprio perché nelle condizioni a cui si fa l’elettroforesi, ovvero a pH poco
superiore a 7, la Lys è carica positivamente (l’ε-amino gruppo è protonato) mentre il Glu risulta carico negativamente, avendo il gruppo γ-carbossilico deprotonato. Tale mutazione è anche una delle più studiate perché è in un punto molto critico della struttura terziaria della proteina, in quanto la posizione 560 cade nel dominio III a ridosso di un ponte disolfuro, il quale potrebbe non essere formato nella variante per una diversa disposizione delle cariche date dalla mutazione puntiforme che potrebbero aumentare la lunghezza del loop vicino; inoltre tale sostituzione aminoacidica potrebbe interferire con la capacità di legame degli acidi grassi, visto che il sito con la maggiore affinità è proprio in questo dominio [73]. Non solo ma la variante Church Bay, che presenta un Glu in posizione 560 al posto della Lys, non è più suscettibile di attacco proteolitico da parte della tripsina, enzima che taglia dal lato C-terminale i residui di Arg o di Lys . Questo fatto potrebbe indurre a pensare che la variante in tale punto non potendo essere attaccata dalla tripsina non forma un peptide tipicamente lungo come nel caso dell’albumina normale ma potrebbe formare un peptide più lungo a causa dell’assenza, in quel punto della Lys.
Tale modifica potrebbe, in buona sostanza, influire su una diversa selettività di filtrazione glomerulare in quanto è stato comunque dimostrato che le varianti insieme ai peptidi prodotti dall’azione proteolitica si ritrovano nel siero e non vanno nelle urine, anche nei pazienti sani, oltre che negli insufficienti renali cronici.
La caratterizzazione delle varianti genetiche albuminiche ha prodotto chiarimenti univoci nelle specificità delle proteasi coinvolte nel suo processo e ha facilitato l’identificazione della propeptide convertasi epatica. Inoltre, nuove varianti
potrebbero indubbiamente portare chiarimenti sulla stabilità molecolare ed aiutare a definire i siti di legame nella molecola.
Nella tabella 3 che segue vengono mostrate le caratteristiche principali di alcune varianti albuminiche che riguardano gli aminoacidi K ed E, che sono quelle più ricorrenti e più studiate:
Nome Posizione Residuo di partenza Residuo mutato Differenza di carica
Coari-Porto Alegre I 358 E K +2
Porto Alegre II 501 E K +2
Maku 541 K E -2
Church Bay 560 K E -2
Tab. 3 – Caratteristiche principali delle varianti “Coari-Porto Alegre I”, “Porto Alegre II”, “Maku” e “Church Bay”. Da notare che quando la mutazione è del tipo E→K la differenza di
carica è +2 (mutazione da un residuo acido ad uno basico); se la mutazione è del tipo K→E la differenza di carica è –2 (mutazione da un residuo basico ad uno acido).
La differenza di carica è basata sul fatto che la proteina è immersa in un ambiente (plasma) il cui pH è intorno a 7,4: a questo valore un residuo di E in superficie alla molecola è sicuramente caricato negativamente, così come un residuo di K è caricato positivamente. Anche le mobilità elettroforetiche dell’electrofocusing risulteranno diverse da quelle dell’albumina normale perché cambia inevitabilmente, se pur di poco, il loro punto isoelettrico.
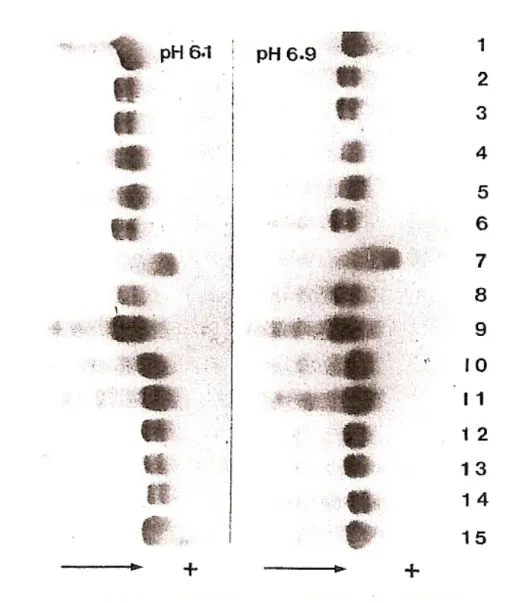
Sono state effettuate essenzialmente due tipi di elettroforesi su gel, una ad un pH di 6,1 e l’altra a pH 6,9 e sono stati paragonati i percorsi fatti dalle varie albumine, compresa quella normale per far vedere le diverse mobilità elettroforetiche che le
albumine varianti hanno rispetto a quella normale: questo viene mostrato in fig. 13 [74].
Fig. 13. Mobilità elettroforetiche a confronto tra l’HSA normale e alcune varianti. A sinistra
c’è il sistema a pH 6,1, a destra quello a pH 6,9. La banda numero 1 corrisponde all’albumina normale; Coari I (banda 2); Porto Alegre I (banda 3); Gainesville (tipo Christchurch, proalbumina, banda 4); Pollibauer (tipo Lille, proalbumina, banda 5); Porto Alegre II (banda 6), artefatto (forma denaturata di albumina B, banda 7); Vancouver da Huss et al, PNAS 1988, vol. 85. pag. 6692-6696 (banda 8); Manaus I (banda 9); Cooperstown (tipo Reading, banda 10); Mexico da Takahashi N. et
al, PNAS, 1987, vol. 84, pag. 4413-4417 (banda 11); Maku (banda 12); Oriximiná I (banda 13);
Come si può notare da questa immagine, sia a pH 6,1 che a pH 6,9 Maku, Oriximiná I e Mura I presentano una maggior mobilità perché hanno una carica netta di –2 rispetto a quella normale e nei sistemi tamponanti si comportano in maniera simile. Le varianti Coari e Porto Alegre I mostrano una mobilità elettroforetica minore in quanto hanno una carica netta positiva di +2 rispetto all’albumina normale, sia nei sistemi a pH più acidi (pH 5,3 e 6) che in sistemi meno acidi (pH 6,1 e 6,9). La variante Porto Alegre II ha una mobilità elettroforetica ancora più bassa (carica netta paragonata con quella normale +2). Le varianti albuminiche hanno una mobilità elettroforetica relativamente diversa a seconda della sostituzione aminoacidica singola. Continuando la descrizione di alcune varianti prese in considerazione nella figura di sopra, si può osservare che la variante Mexico “corre” meno nel gel in quanto la sostituzione in posizione 550 è di tipo Asp→Gly, infatti ai valori di pH a cui sono state eseguite le varie elettroforesi l’acido aspartico è carico negativamente mentre la glicina ha carica netta zero. La variante Cooperstown (313Lys→Asn) presenta una carica negativa in più e quindi percorre una maggior distanza nel gel rispetto a quella normale, così come le varianti Gainesville (tipo Christchurch, -1Arg→Gln) e la Pollibauer (tipo Lille, in cui una His è al posto di una Arg in posizione –2) [74]. Sia le varianti che si sono originate nei paesi dell’America latina, come il Brasile, Messico, Cile e paesi limitrofi, che quelle che abbiano preso origine dai paesi asiatici come alcune popolazioni dell’India, del Giappone o della Nuova Zelanda si ritrovano nei pazienti affetti da malattie renali croniche di qualsiasi entità. Malgrado questi pazienti manifestino una generale e più o meno grave insufficienza renale con una netta riduzione della frazione glomerulare da circa 120 ml/ min/ 1,73 m
≥
10 ml/ min/ 1,73 m2, la forma di albumina che comunque permane è quella normale [74, 75].
5.3.1 Varianti del tipo Glu→Lys ( E→K )
E’ un tipo di mutazione che fa cambiare la carica risultante di +2 poiché si tratta di sostituzione di un residuo acido con uno basico.
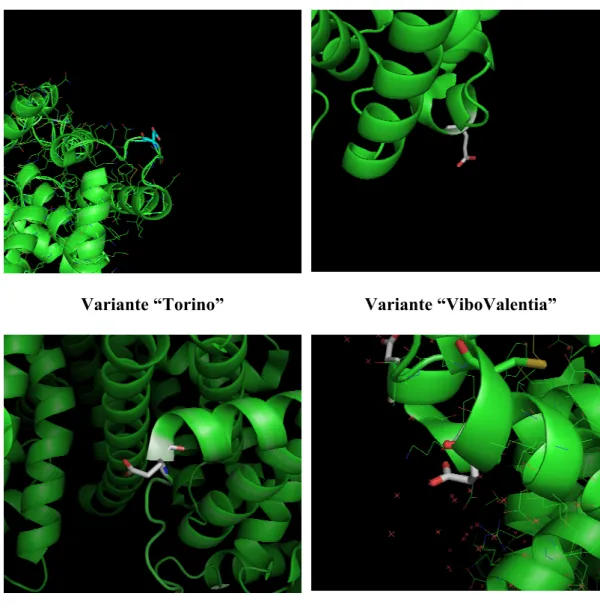
Variante “Torino” Variante “ViboValentia”
Variante “Nagoya” Variante “Coari - Porto Alegre I”
Fig. 14- Esempi di varianti di tipo E→K. Notare come tutti i residui siano in superficie
Abbiamo scelto 4 esempi di questo tipo (fig. 14) di mutazione per far vedere che si tratta sempre di posizioni superficiali in quanto i due aminoacidi sono molto idrofilici e quindi tendono ad essere maggiormente esposti all’ambiente acquoso, piuttosto che nell’interno della struttura della molecola, dove risiedono più i residui idrofobici.
Per quanto riguarda la variante “Torino” il residuo in posizione 60 (Glu 60) è in una posizione strategica: appartiene al dominio I, sottodominio A (I A), è a livello di un loop che separa due eliche ed è molto vicino ad un ponte disolfuro tra Cys 53-Cys 62. In questo caso la sostituzione con una Lys può sicuramente portare ad un attacco proteolitico da parte della tripsina, in quanto è molto esterno. Questo potrebbe avere come conseguenza diretta l’accorciamento di un peptdide triptico rispetto alle condizioni normali.
Considerando infine il problema relativo alla filtrazione glomerulare, si può ipotizzare che con la sostituzione in posizione 60, la Lys che si sostituisce potrebbe causare un ingrandimento di alcuni Å, sufficienti da non permettere il passaggio selettivo attraverso i pori glomerulari della molecola mutata e questo darebbe una spiegazione e una possibile conferma dell’ipotesi che le varianti albuminiche non vengono filtrate o vengono completamente riassorbite insieme ai peptidi che si formano in seguito alla digestione triptica a livello plasmatico.
Per quanto riguarda la variante “Vibo Valentia” la posizione 82 sembra essere un po’ meno “strategica” della 60 in quanto non ha ponti S-S particolarmente vicini. E’ comunque un residuo molto esterno che con la sostituzione di un residuo di Lys potrebbe diventare un facile attacco triptico, riducendo così la lunghezza del peptide che deriva dal taglio proteolitico. Anche in questo caso la mutazione
potrebbe portare ad un allargamento della molecola con una conseguente non filtrazione di questa specie, né dei suoi peptidi prodotti dalla scissione proteolitica della tripsina. La carica netta risulta incrementata di +2 e questo ha un effetto diretto sul cambiamento del punto isoelettrico della proteina che, come nel caso precedente, diventa più basica, avendo un residuo in più di Lys. Bisogna ricordare che il raggio medio dell’albumina in forma A è di circa 36 Å e che i pori glomerulari hanno una selettività media per il passaggio di molecole che non superano, mediamente i 40-45 Å, per cui non si può dire con certezza se questo tipo di mutazione, dato che quelle scelte sono tutte a carico della Lys e del Glu, possa portare ad una modifica di selettività di filtrazione da parte della barriera glomerulare. Di sicuro si può affermare che anche questa mutazione porta ad un radicale cambiamento conformazionale della molecola. Le stesse considerazioni sono state fatte per le varianti “Nagoya” e “Coari- Porto Alegre I.
5.3.2 Varianti del tipo Lys→Glu ( K→E )
E’ un tipo di mutazione che fa cambiare la carica risultante di -2 poiché si tratta di sostituzione di un residuo basico con uno acido. Abbiamo scelto 4 esempi di questo tipo (fig. 15) di mutazione per far vedere che si tratta sempre di posizioni superficiali in quanto i due aminoacidi sono molto idrofilici e quindi tendono ad essere maggiormente esposti all’ambiente acquoso, piuttosto che nell’interno della struttura della molecola, dove risiedono più i residui idrofobici.
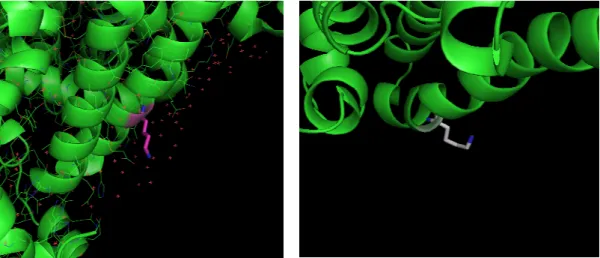
Variante “Herborn” Variante “Naskapi”
Variante “Castel di Sangro” Variante “Church Bay”
Fig. 15- Esempi di varianti di tipo K→E. Notare come, anche in questo caso, tutti i residui siano
in superficie dell’albumina.
Questi 4 esempi di mutazioni di tipo K→E confermano che si tratta di sostituzioni aminoacidiche superficiali che possono portare la molecola ad essere più anionica, in quanto il Glu ha la propria catena laterale caricata negativamente nelle condizioni “ambientali” in cui l’albumina si trova. Cosa certa è che cambia il punto isoelettrico della proteina, verso un valore più acido ma tale tipo di sostituzione non fornisce ad enzimi proteolitici come la tripsina un sito specifico di taglio.
6. CONCLUSIONI
Dalla letteratura fin qui ricercata ed analizzata si possono trarre alcune importanti conclusioni: il modello matematico che ci suggeriscono Deen e collaboratori (1985) mette in luce la possibile filtrazione selettiva glomerulare delle sostanze. Vengono fatte due ipotesi, una secondo la quale la filtrazione glomerulare avvenga attraverso una popolazione di pori glomerulari omogenei (modello dell’isoporo), adattabile, sicuramente, più nel caso di una filtrazione nei pazienti sani. In questo caso, si è dedotto e, spesso confermato, che l’albumina nella sua forma normale (albumina A) viene filtrata in piccole quantità, che si ritrova nelle urine. Quando invece si analizzano casi di pazienti affetti da malattie renali, quali le varie nefropatie, glomerulopatie croniche, che portano, inesorabilmente, ad una insufficienza renale quasi sempre cronica, il modello matematico che più si adatta a queste situazioni è quello eteroporoso, in cui la grandezza dei pori è variabile e cambia con il grado della malattia. In questo caso, invece, si è visto che i livelli di albumina A escreti possono notevolmente aumentare. Questi pazienti, però, manifestano anche la presenza di forme albuminiche diverse dalla A, le cosiddette forme varianti: quest’ultime sono generate tutte da sostituzioni aminoacidiche singole, per cui si tratta sempre di mutazioni puntiformi. Poiché anche le forme di albumina varianti, come quella normale, possono subire attacchi proteolitici specifici da parte della tripsina ed altre proteasi, i peptidi triptici che risultano dalla digestione di tali enzimi non vengono filtrati dalla barriera selettiva glomerulare oppure vengono frammentat durante la fase di riassorbimento tubulare, a livello lisosomiale alveolare. Quindi, sia le varianti di albumina nelle forme integre, che i
vari frammenti peptidici risultanti dalla digestione triptica, permangono nel siero e tornano nel torrente sanguigno e se ne trovano solamente una quantità trascurabile a livello delle urine.
Una seconda fondamentale conclusione riguarda strettamente le varianti albuminiche ed i possibili siti in cui l’albumina normale subisce degli stress ossidativi .Posso affermare che dopo un’attenta analisi alle posizioni relative alle sostituzioni riguardanti esclusivamente la lisina e l’acido glutammico, posso concludere che tutte, più o meno, sono situate in siti “strategici” della molecola: sono tutte in superficie e spesso possono coinvolgere da vicino i ponti disolfuro, sia perché nelle immediate vicinanze ad essi, sia perché appartengono a loop anche molto lunghi. L’albumina viene “stressata” da vari cicli ossido-riduttivi attraverso l’interazione di composti chimici sia organici che non e naturalmente questi stress la modificano notevolmente inducendo la molecola ai notevoli cambiamenti conformazionali. L’immediata conseguenza è che l’enorme affinità di legame che essa normalmente ha per i vari composti, specialmente per quelli metabolici, cambia notevolmente, riducendosi.
La cosa più sorprendente è che, in tutte queste mutazioni e molto probabilmente in tutte le mutazioni in assoluto dell’albumina i ponti disolfuro si “salvano”, rimanendo intatti: l’albumina, così, può salvaguardare se stessa da ogni tipo di stress ossidativo indotto da qualsiasi sostanza o radicale libero.
Analizzando attentamente il quadro generale delle due dipendenze principali che determinano la selettività della filtrazione glomerulare (il poro e l’albumina nelle
sue varie forme) si può concludere che il modello di filtrazione che possa rappresentare meglio le varie situazioni, normali e patologiche, sia quello ad isoporo con una popolazione eterogenea di proteine coinvolte nel processo selettivo filtrante del glomerulo.