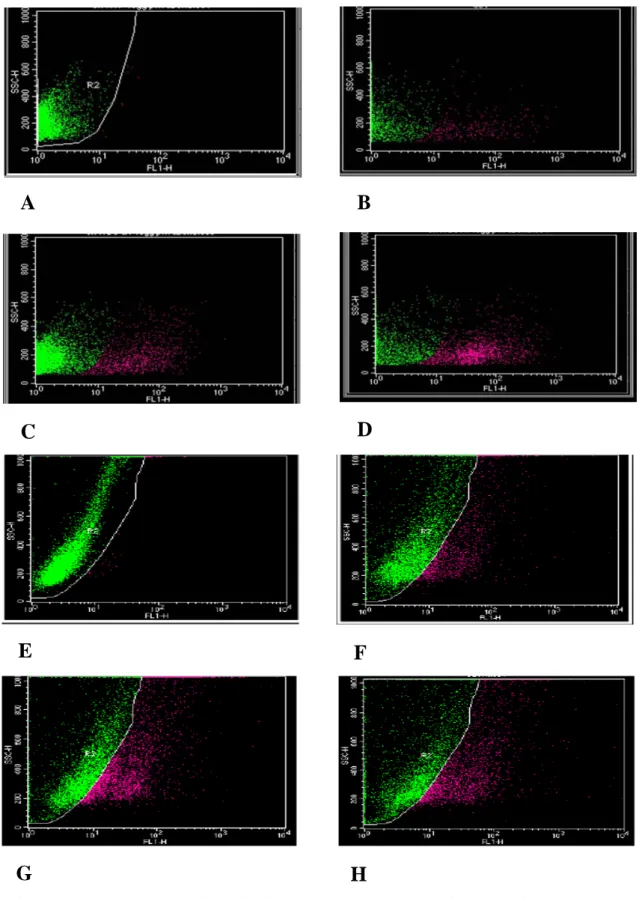
Con questo saggio è possibile evidenziare il contenuto di Env espresso sulla superficie delle cellule, contare il numero di cellule Env-positive e, quindi, valutare il livello di espressione relativa tra i cloni wild-type e quelli mutagenizzati in env. Operativamente, le cellule sono state trasfettate e coltivate a 37 °C, temperatura alla quale le cellule hanno svolto le loro normali ed indotte attività metaboliche, tra le quali la produzione di FIV e l’endocitosi di Env. Al terzo giorno dalla trasfezione le cellule sono state marcate con l’anticorpo primario anti-Env ed incubate a 4 °C per bloccare il processo di endocitosi e “fotografare” il contenuto in Env sulla loro superficie. L’analisi ha dimostrato che a livelli di p25 molto simili corrispondevano notevoli differenze relativamente al livello di espressione di Env. Mentre le cellule trasfettate con clone wild-type (∆00) risultavano Env-positive per il 10%, il clone ∆00AI ha dato luogo al 40% di cellule fluorescenti. Più contenuta, ma ugualmente importante, la differenza con ∆00XX per il quale la percentuale di cellule positive era il 19%. Lo stesso saggio replicato sui cloni modificati anche in ORF-A ha portato a risultati simili. A fronte del 16% di cellule Env-positive dopo trasfezione con il clone ∆23, le cellule trasfettate con ∆23AI e ∆23XX erano positive rispettivamente per il 31% ed il 28% (Fig. 4.2).
A B
D
C
E
F
G
H
Figura 4.2: Percentuale cellule esprimenti Env sulla superficie esterna.
A: K- 0.10 %; B: ∆00 10.04 %; C: ∆00XX 18.92 %; D: ∆00AI 39,80 %; E: K- (seconda trasfezione): 0,80 %; F: ∆23 16.38 %; G: ∆23XX 27.98 %; H: ∆23AI 31.56 %.
0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 1,8 ∆00 ∆00XX ∆00AI ∆23 ∆23XX ∆23AI O. D. p 25
Figura 4.3: valori O.D. p25 misurati con ELISA test
CrFK
0 5 10 15 20 25 30 35 40 45 ∆00 ∆00XX ∆00AI ∆23 ∆23XX ∆23AI % cellule Env-positiveFigura 4.4: analisi livello di espressione di Env mediante
Questo saggio permette di rilevare l’espressione e soprattutto la localizzazione della glicoproteina Env. Operativamente le cellule sono state trasfettate in doppio per ogni singolo test ed a cinque giorni dalla trasfezione sottoposte ad analisi per immunofluorescenza anti-Env. Le repliche sono state analizzate con lo stesso saggio eseguito in modo tale da valutare, nel primo caso, Env sottoposta ad endocitosi e nel secondo Env esposta sulla superficie. Nella prima replica le cellule trasfettate sono state addizionate dell’anticorpo primario anti-Env, quindi poste ad incubare a 37 °C per dare modo al complesso Env-anticorpo di essere endocitato dalla cellula. Le cellule sono state quindi lavate con tampone acido per rimuovere l’anticorpo rimasto sulla superficie cellulare, permeabilizzate ed incubate con l’anticorpo secondario. In questo modo è stato messo in evidenza il solo complesso Env-anticorpo presente nella porzione citoplasmatica. Nella seconda replica le cellule sono state incubate con l’anticorpo anti-Env nelle stesse condizioni, ma a queste è stato aggiunto direttamente l’anticorpo secondario senza alcuna permeabilizzazione. In questo caso quindi veniva evidenziato il solo Env presente sulla superficie cellulare. I risultati ottenuti hanno messo in evidenza che nelle cellule trasfettate con i cloni ∆00XX, ∆00AI, ∆23XX e ∆23AI Env era presente per la maggior parte sulla superficie delle cellule. Al contrario, con i cloni ∆00 e ∆23 si osservava un’intensa marcatura citoplasmatica ed una scarsissima fluorescenza sulla superficie (Fig. 4.5 e 4.6).
A
B
C
D
E
F
Figura 4.5: Saggio di immunofluorescenza in cellule trasfettate con i
cloni molecolari mutati in env.
A: ∆00 marcatura Env di superficie; B: ∆00 marcatura citoplasmatica; C: ∆00XX marcatura Env di superficie; D: ∆00XX marcatura citoplasmatica; E: ∆00AI marcatura Env si superficie; F: ∆00AI marcatura citoplasmatica.
G
H
L
I
N
M
Figura 4.6: Saggio di immunofluorescenza con cellule trasfettate con
cloni molecolari mutati in env ed ORF-A.
G: ∆23 marcatura Env di superficie; H: ∆23 marcatura citoplasmatica; I: ∆23XX marcatura Env di superficie; L: ∆23XX marcatura citoplasmatica; M: ∆23AI marcatura Env di superficie; N: ∆23AI marcatura citoplasmatica.
Uno dei requisiti fondamentali per un vaccino è la stabilità. Nel caso di un vaccino geneticamente attenuato è essenziale quindi che le modificazioni introdotte nel genoma virale siano stabili e non siano soggette a mutazioni o retromutazioni che potrebbero aumentare la virulenza del ceppo vaccinale. Abbiamo quindi voluto testare la stabilità delle mutazioni inserite in env e, nei cloni Δ23, anche in ORF-A. A questo proposito il surnatante delle cellule trasfettate contenenti le particelle virali generate dai cloni molecolari, è stato usato per infettare cellule CrFK fresche; questo procedimento è stato effettuato per tre passaggi seriali a distanza di sette giorni l’uno dall’altro. Il virus generato dai diversi cloni è stato quindi propagato in vitro per ventuno giorni al termine dei quali il virus contenuto nel surnatante di coltura è stato sequenziato nei geni env ed ORF-A. Non è stato osservato alcun riarrangiamento delle mutazioni inserite che si sono quindi mantenute stabili per tutto il periodo di osservazione.