INDICE
CAPITOLO PRIMO: neoplasie maligne della mammella… ……….……….3
1.1 Epidemiologia ed eziologia………..……3
1.2 Classificazione istologica………....…4
1.3 Diagnosi e stadiazione………....…7
1.4 Terapie e loro complicanze………..…14
1.4.1Chirurgia………...14
1.4.2 Radioterapia………22
1.4.3 Chemioterapia e terapia ormonale………..…24
CAPITOLO SECONDO: Linfedema………..…26
2.1 Fisiopatologia………...….26 2.2 Classificazione……….….…27 2.3 Compòicanze………..…28 2.4 Valutazione clinica………..………..…29 2.5 Misurazione……….………..…30 2.6 Trattamento……….………...31 2.6.1 Linfodrenaggio manuale……….………...…31 2.6.2 Bendaggio………..………32 2.6.3 Altre terapie………...…32
CAPITOLO TERZO: Organizzazione del centro senologico dell’Azienda Ospedaliera Pisana………...………36
CAPITOLO QUARTO: Studio sperimentale……….…38
4.1 Scopo dello studio………..……….…38
4.3 Risultati……….………41 4.4Conclusioni………44 Bibliografia……….……….…46
CAPITOLO PRIMO:
NEOPLASIE MALIGNE DELLA MAMMELLA
1.1 Epidemiologia ed eziologia
Il carcinoma della mammella è una neoplasia maligna che deriva dalle cellule epiteliali che rivestono i lobuli o i dotti mammari.
Negli Stati Uniti l’incidenza è di circa 210000 nuovi casi ogni anno, mentre in Italia tale valore è di 33000 casi all’anno.[1] Questo tumore colpisce maggiormente le popolazioni dei Paesi occidentali; l’incidenza diminuisce invece tra le donne asiatiche. Negli ultimi anni si è assistito ad un incremento dell’incidenza e a una parallela diminuzione della mortalità: questo può essere interpretato come un’espressione dei miglioramenti diagnostici e terapeutici degli ultimi anni. Sono stati individuati almeno 4 geni implicati nel carcinoma mammario; mutazioni nella linea germinale si ritrovano tuttavia in meno del 10% dei casi. Nella sindrome di Li Fraumeni, che causa, oltre al carcinoma mammario, altri tumori in vari organi, ad essere mutato è il gene oncosoppressore p53.. Le donne che ereditano l’allele mutato del gene oncosoppressore BRCA-1 presentano una probabilità del 50-80% di sviluppare un carcinoma mammario e del 33% di sviluppare un carcinoma ovarico. Altri geni implicati in forme familiari di carcinoma mammario sono BRCA-2 e PTEN.
Nei casi sporadici si osservano mutazioni del gene PTEN in circa il 10% dei casi e del gene p53 nel 40% dei casi. Infine, in un quarto circa dei casi, si osserva un aumento nell’espressione dell’oncogene erbB2, la cui proteina fa parte della superfamiglia dei recettori del fattore di crescita epidermico.
Il carcinoma della mammella è ormono-dipendente. I fattori ormonali che più ne influenzano l’insorgenza, in particolare, sono le età di menarca, prima gravidanza a termine e menopausa: il rischio di svilupparlo è infatti proporzionale alla durata dell’età fertile e, in particolare, al periodo tra menarca e prima gravidanza a termine. Sembra, al contrario, che un periodo di allattamento prolungato protegga dall’insorgenza di tumore al seno..
Anche l’obesità rappresenta un fattore di rischio, in quanto l’attività aromatasica del tessuto adiposo costituisce un’importante fonte di estrogeni endogeni.
L’assunzione di contraccettivi orali non sembra giocare un ruolo importante, mentre più controverso è il ruolo della terapia ormonale sostitutiva durante la menopausa: sembra che quest'ultima aumenti il rischio, ma solo a seguito di uso prolungato, e che in particolare peggiori il rischio di recidiva in donne già trattate per cancro mammario.[2]
1.2 Classificazione istologica
Esistono due varianti istologiche principali di tumore mammario: il carcinoma duttale e il carcinoma lobulare.
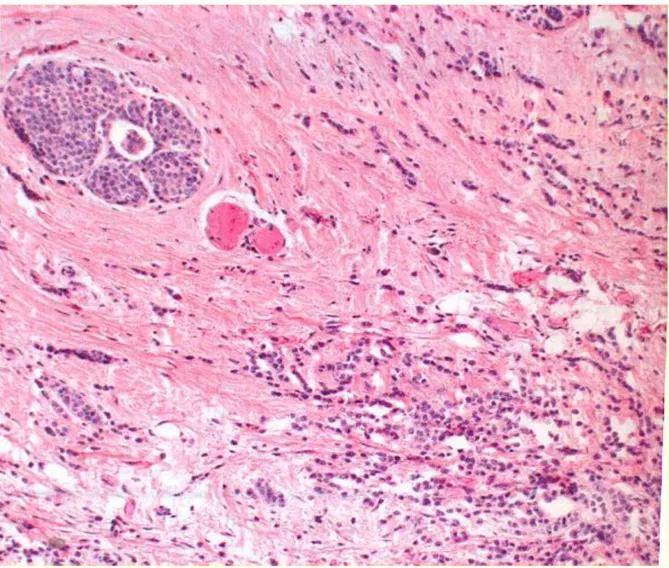
Il carcinoma duttale si presenta in genere come una lesione singola accompagnata da una reazione sclerosante e che, in alcuni casi, può presentare una necrosi centrale. Quando il tumore interessa i lobuli gli acini vengono deformati, assumendo l’aspetto di piccoli dotti (Fig. 1.1).
Il carcinoma lobulare è spesso multicentrico e, talvolta, bilaterale. Le sue cellule sono grandi e poco adese tra loro. Solitamente il tumore non deforma le strutture circostanti, perciò gli acini restano riconoscibili come lobuli (Fig. 1.2).
Entrambi gli istotipi possono presentarsi come carcinoma in situ o invasivo: la differenza tra i due risiede nell'infiltrazione della membrana basale, assente nel primo caso.[3]
Il 75% dei casi di tumore invasivo sono di istotipo duttale, caratterizzato da dotti irregolari e atipia cellulare di grado variabile, oltre che da cellule disposte in agglomerati solidi.
Quando questo tipo istologico interessa uno dei dotti maggiori si può verificare infiltrazione della cute del capezzolo, che si manifesta clinicamente con la cosiddetta malattia di Paget.
Il carcinoma midollare è una variante rara costituita da cellule grandi con tendenza all'aggregazione è caratterizzata da infiltrazione linfoide reattiva.
Il carcinoma mucinoso, costituito da cellule disperse in laghi di muco, ha una consistenza gelatinosa ed è abbastanza ben delimitato.
Il carcinoma papillare infiltrante è costituito da papille che sporgono nel lume dei dotti e che sono rivestite da cellule epiteliali atipiche; si ritiene che questa variante rappresenti uno stadio avanzato o una forma aggressiva del papilloma non infiltrante.
Il carcinoma tubulare è costituito da tubuli ben differenziati.
Il carcinoma neuroendocrino è costituito da cellule del sistema endocrino diffuso. Occorre sottolineare che nella mammella normale non sono presenti cellule del sistema endocrino diffuso, la cui presenza, dunque, è indice di malattia neoplastica.
Figura 1.1 Sinistra: carcinoma duttale infiltrante ben differenziato. Tubuli ben formati e nidi di cellule con piccoli nuclei monomorfi invadono lo stroma causando una circostante reazione desmoplastica. Destra: carcinoma duttale invasivo scarsamente differenziato. Lamine disordinate di cellule pleomorfe senza formazione di tubuli infiltrano lo stroma circostante.
Il carcinoma lobulare invasivo, costituito da piccole cellule variamente disposte, deriva dai duttuli che si trovano nei lobuli.[4]
Figura 1.2 Carcinoma globulare invasivo. File parallele di piccole celluleregolari con scarso citoplasma che infiltrano in file singole o come gruppetti di cellule.
1.3
Diagnosi e stadiazione
Il primo passo nella diagnosi del carcinoma mammario è l’esame obiettivo: attraverso la palpazione della mammella possono essere individuate masse solide, che tipicamente si presentano di consistenza dura, indolenti e con margini poco definiti e che possono aderire ai piani superficiali e
cute, quali retrazioni della cute e del capezzolo, cute a buccia d’arancia, erosioni, ulcerazioni. Una presentazione particolare, di significato prognostico negativo, è quella osservata in corso di carcinoma infiammatorio, in cui la mammella è arrossata, edematosa e dolente.
La palpazione dei linfonodi ascellari, sovraclaveari e laterocervicali, inoltre, consente di individuare eventuali metastasi linfonodali.
Va tuttavia considerato che la sensibilità della palpazione è scarsa.
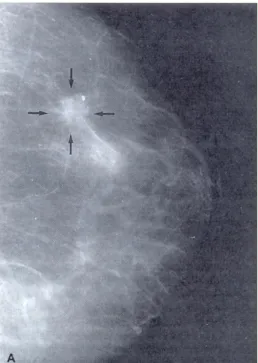
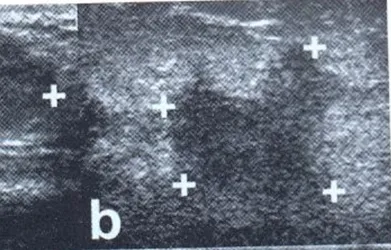
Mediante la diagnostica per immagini, al contrario, è invece possibile individuare lesioni anche molto piccole e non palpabili e di caratterizzarne la natura mediante integrazione tra ecografia e mammografia. Masse solide che all'esame mammografico presentino contorni poco definiti e che distorcano il parenchima circostante sono fortemente sospette di malignità, così come la presenza di microcalcificazioni all’interno della lesione (Fig. 1.3). L’ecografia è l’esame ideale per distinguere le masse cistiche da quelle solide (Fig. 1.4). Tuttavia è necessario ribadire che i due esami devono essere integrati perché lesioni visibili alla mammografia possono non esserlo all’ecografia e viceversa.
Figura 1.3 Mammografia che mostra un carcinoma duttale infiltrante. Si notano i margini irregolari e la presenza di una piccola calcificazione.
Figura 1.4 Ecotomografia che mostra un carcinoma mammario. Si nota una formazione polilobata a margini mal definiti con ecostruttura solida ipoecogena.
Negli ultimi anni la risonanza magnetica ha ricevuto un crescente consenso nello stidio della mammella.
Le indicazioni principali sono:
valutazione delle protesi mammarie in caso di sospetta rottura (Fig. 1.5).
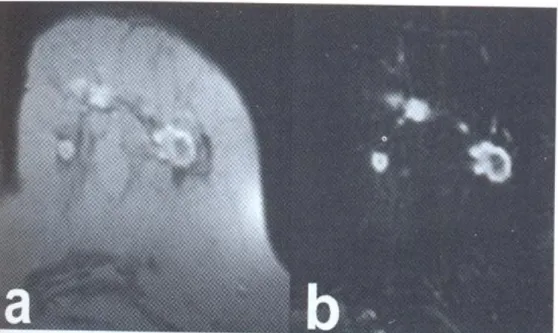
La stadiazione locale del carcinoma mammario per valutarne l’esatta estensione soprattutto in caso di discordanza tra i reperti mammografico ed ecografico, di sospetta infiltrazione del muscolo pettorale o di multifocalità o multicentricità (Fig. 1.6).
Valutazione della mammella operata in caso di sospetta recidiva locale o di margini di escissione istopatologicamente positivi (Fig. 1.7).
Valutazione di sospetti noduli periprotesici (Fig. 1.8).
Valutazione dell’efficacia della chemioterapia neoadiuvante.
Ricerca del tumore primitivo in soggetti con metastasi linfonodali e mammografia ed ecografia negative.
Nella RM mammaria si effettua una scansione diretta e una con mezzo di contrasto paramagnetico, si valutano inoltre le immagini ottenute per sottrazione.
La sensibilità di questa tecnica è del 95% per i carcinomi invasivi e del 75-80% per i carcinomi in situ. Òa specificità è dell’80% [20].
Figura 1.5 Risonanza magnetica in proiezione sagittale T2-pesata che mostra la rottura di una protesi mammaria. Si nota la fuoriuscita del materiale polimerico che fluttuando dà luogo ad una tipica immagine a “spaghetto cotto”.
Figura 1.6 Risonanza magnetica in proiezione trasversale T1-pesata, a: subito dopo iniezione di mezzo di contrasto, b: immagine di sottrazione. Si nota la presenza di noduli tumorali multipli nei quadranti superiori della mammella.
Figura 1.7 Immagine RM di sottrazione in proiezione trasversale T1-pesata. Si apprezza la presenza di una formazione tondeggiante a margini irregolari. Si tratta di una sospetta recidiva post-chirurgica di carcinoma mammario.
Figura 1.8 Immagine RM T1-pesata di recidiva tumorale su protei, a: proiezione trasversale, b: proiezione coronale ottenuta dopo sottrazione del segnale del grasso. Si apprezza una formazione a basso segnale, rotondeggiante, a margini irregolari con spiculature che arrivano fino al piano cutaneo.
L’agoaspirazione con ago sottile è un esame poco invasivo che spesso consente di porre una diagnosi definitiva; i casi di falsa negatività, dovuti a errori di posizionamento della punta dell’ago, vengono minimizzati dai prelievi sotto guida ecografica o mammografica. È possibile effettuare delle analisi sul materiale prelevato per determinare l’eventuale presenza di recettori per gli
L’agobiopsia ha virtualmente sostituito la biopsia chirurgica che viene effettuata solo in caso di risultato dubbio dell’istologia.
Un’altra tecnica bioptica utilizzabile è il mammotome. Si tratta di un dispositivo che, utilizzando una tecnica ecografica o mammografica stereotassica, effettua delle agobiopsie mirate in zone sospette.
Le sedi più frequenti di diffusione del carcinoma mammario sono il polmone, il fegato, le ossa e l’encefalo. Per effettuare la stadiazione di questo tumore sono quindi necessari radiografia toracica, ecografia addominale, scintigrafia ossea e TC cranica. La scintigrafia ossea, in particolare, è sensibile ma poco specifica: una lesione ossea può essere visibile alla scintigrafia anche sei mesi prima che si positivizzi la radiografia, tuttavia anche lesioni di natura benigna possono captare il tracciante. Di conseguenza le lesioni eventualmente visualizzate devono essere studiate tramite radiografia o TAC (Tabb. 1.1 e 1.2).[1]
T0 Tis T1 T2 T3 T4
Nessun segno di tumore primitivo Carcinoma in situ
Tumore 2 cm
Tumore > 2 cm ma 5 cm Tumore > 5 cm
Estensione alla parete toracica, infiammazione, lesione satellite, ulcerazioni
N0 N1
N2
N3
Assenza di metastasi ai linfonodi regionali Metastasi in 1-3 linfonodi ascellari o metastasi ai linfonodi mammari interni con malattia
microscopica evidenziata dall’asportazione del linfonodo sentinella, ma non evidente
clinicamente
Metastasi in 4-9 linfonodi ascellari o evidente positività clinica dei linfonodi mammari interni in assenza di metastasi ai linfonodi ascellari Metastasi in 10 o più linfonodi ascellari o metastasi ai linfonodi infraclavicolari o evidente positività clinica dei linfonodi mammari interni omolaterali in presenza di 1 o più linfonodi ascellari positivi, o metastasi in più di 3 linfonodi ascellari con metastasi microscopiche
clinicamente non evidenti ai linfonodi mammari interni, o metastasi ai linfonodi sovraclaveari omolaterali
M0 M1
Assenza di metastasi a distanza
Metastasi a distanza (inclusa la diffusione ai linfonodi sovraclaveari omolaterali)
Tabella 1.1 Classificazione TNM del carcinoma mammario
Stadio 0 Stadio I Stadio IIA Stadio IIB Stadio IIIA Stadio IIIB Stadio IIIC Stadio IV Tis T1 T0 T1 T2 T2 T3 T0 T1 T2 T3 T4 Ogni T Ogni T Ogni T N0 N0 N1 N1 N0 N1 N0 N2 N2 N2 N1-2 Ogni N N3 N3 Ogni N M0 M0 M0 M0 M0 M0 M0 M0 M0 M0 M0 M0 M1
Tabella 1.2 Stadiazione del carcinoma mammario.
1.4 Terapie e loro complicanze
1.4.1 Chirurgia
La terapia del cancro mammario in fase iniziale (stadio I e II) è in prima battuta chirurgica, eventualmente seguita da radioterapia o chemioterapia. In passato l’intervento più praticato era la mastectomia radicale secondo Halsted che prevedeva l’asportazione della mammella, della cute sovrastante, dei muscoli pettorali e dei linfonodi ascellari. Si trattava di un intervento demolitivo che presentava, oltre al danno estetico, anche pesanti conseguenze sulla motilità dell’arto e che oggi viene riservato ai soli casi in cui il tumore infiltra i muscoli pettorali. La mastectomia radicale
allargata, che prevedeva anche l’asportazione dei linfonodi mammari interni, è stata completamente abbandonata.
Attualmente l’intervento più praticato è la mastectomia modificata, che prevede la conservazione del muscolo grande pettorale (variante di Patey) o di entrambi i muscoli pettorali (variante di Madden).
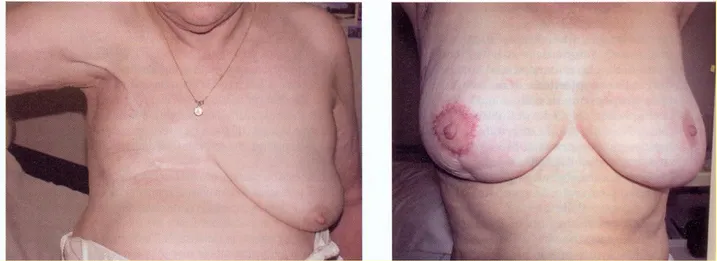
Più recentemente è stata introdotta la chirurgia conservativa che prevede l’asportazione di un solo quadrante della mammella, della cute sovrastante e della porzione corrispondente della fascia del pettorale. Con questo tipo di intervento si affida alla radioterapia il compito di eliminare le eventuali cellule maligne residue. La quadrantectomia non viene praticata se il tumore ha dimensioni troppo grandi (>2 cm), se si trova in posizione sfavorevole (tumore a localizzazione areolare), se è multifocale, se, pur essendo in situ , è molto esteso, se la mammella è troppo piccola (risultato estetico scadente) e se la paziente non può essere sottoposta a radioterapia (paziente affetta da collagenopatia in fase attiva, in gravidanza o già sottoposta a radioterapia) (Fig. 1.9).[1][4]
Figura 1.9 Terapia chirurgica del carcinoma mammario. Asinistra esito di mastectomia radicale modificata secondo Madden, a destra esiti della chirurgia conservativa.
La tecnica della mastectomia skin sparing è una procedura che mira a salvaguardare più cute possibile rimuovendo solo quella sovrastante il tumore; questo facilita la successiva ricostruzione del seno.[5]
Un aspetto importante della chirurgia della mammella è, appunto, la ricostruzione post-mastectomia, effettuata tramite il posizionamento di protesi eventualmente associato alla
trasposizione di tessuto autologo. Il tipo di intervento va stabilito in base a diversi fattori: volume e dalla forma del seno nativo, tipo di tumore, stato dei tessuti circostanti la mammella, condizioni generali della paziente ed eventuali terapie adiuvanti alle quali dovrà essere sottoposta. La
ricostruzione del capezzolo è di solito eseguita successivamente, quando la ricostruzione del seno e la terapia adiuvante sono state completate.
La ricostruzione tramite posizionamento di protesi può essere effettuata in un singolo tempo chirurgico, subito dopo l’asportazione della mammella. Questo approccio è applicabile in caso di seno piccolo e tessuto cutaneo e muscolare residuo abbondante, ma presenta un risultato estetico scarso.
Nella maggior parte dei casi al momento della mastectomia viene posizionato tra il muscolo grande pettorale e il dentato anteriore un espansore tissutale che viene successivamente gonfiato con soluzione salina in modo da creare una tasca che accoglierà la protesi definitiva dopo circa due mesi.
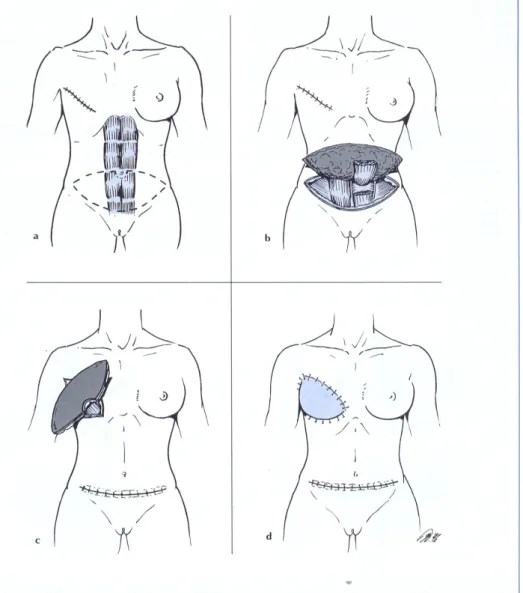
La ricostruzione con lembi di tessuto autologo offre un risultato estetico migliore, tuttavia questa procedura è tecnicamente impegnativa e costringe la paziente ad una anestesia molto lunga (5-10 ore). L’intervento consiste nel trasferire a livello del torace un lembo di tessuto cutaneo-muscolo-adiposo solitamente ottenuto dall'addome (muscoli traverso e retto addominale) o dal dorso (muscolo grande dorsale) conservando i peduncoli vascolari (Figg. 1.10 e 1.11); in alternativa i
lembi possono essere prelevati dai glutei o dalle cosce, ma in questo caso sarà necessaria una procedura di chirurgia microvascolare per anastomizzare i vasi sanguigni.[6]
Figura 1.10 Ricostruzione delle mammella tramite trasposizione del lembo muscolo-cutaneo del grande dorsale. a: rotazione del lembo anteriormente, b: inserzione tendinea sull’omero.
Figura 1.11 Ricostruzione della mammella tramite trasposizione del lembo muscolo-cutaneo del retto addominale: a- incisione della cute in regione ipogastrica, b- isolamento del muscolo, c- trasferimento del muscolo in regione mammaria, d- sutura.
Per quanto riguarda i linfonodi ascellari, la tendenza è quella di evitare la loro rimozione ogni volta che sia possibile per risparmiare alla paziente effetti collaterali gravi quali il linfedema e le
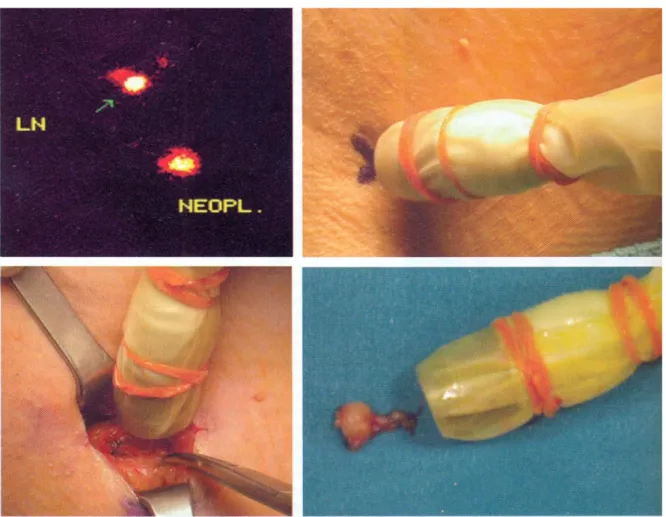
complicanze infettive dell’arto superiore. L’individuazione del linfonodo sentinella, ovvero di quello che per primo drena la linfa dalla zona del tumore, tramite l’iniezione di un tracciante colorato o radioattivo ha permesso di ridurre il numero delle linfoadenectomie non necessarie. Durante l’intervento il linfonodo sentinella è prelevato e sottoposto a esame istologico
estemporaneo (Fig. 1.12): lo svuotamento ascellare viene effettuato solo se il linfonodo sentinella risulta infiltrato da cellule tumorali, o in un secondo momento se queste verranno rivelate dalle successive analisi istopatologiche.[1]
Tra le complicanze che conseguono alla chirurgia del cancro al seno si annoverano la riduzione della sensibilità cutanea e della motilità della spalla, la scapola alata, la linfosclerosi, la fibrosi e il linfedema.
L’intervento chirurgico provoca inevitabilmente un danno alle diramazioni nervose sensitive con conseguente riduzione della sensibilità nella regione mammaria che può estendersi anche alla parete laterale del torace, al dorso, all’ascella e alla faccia mediale del braccio e che può coesistere con parestesie di vario genere. Questa sintomatologia tende alla risoluzione spontanea, per quanto il processo possa richiedere un tempo molto prolungato.
La riduzione dell’ampiezza dei movimenti dell’arto ipsilaterale riguarda soprattutto i movimenti di flessione e di abduzione, può essere marcata e di solito si accompagna a dolore. La paziente deve essere istruita a compiere più volte al giorno movimenti di flessione, abduzione e extrarotazione degli arti superiori: questi esercizi portano ad un graduale aumento dell’ampiezza dei movimenti con risoluzione completa della problematica in qualche mese.
Quando, durante l’intervento, viene sezionato il nervo toracico lungo si ha la comparsa di scapola alata.
Nelle pazienti sottoposte a dissezione dei linfonodi ascellari o a biopsia del linfonodo sentinella può comparire la linfosclerosi, una sindrome che comprende dolore a livello ascellare, difficoltà nel compiere i movimenti di abduzione dell’arto e presenza di un cordoncino visibile e palpabile di consistenza dura a livello dell’ascella che può estendersi anche fino al polso (Fig. 1.13). Si pensa che il meccanismo che sottende alla linfosclerosi siano la stasi, la trombosi e la fibrosi causate dal trauma chirurgico sui vasi linfatici e sulle vene del sistema fasciale superficiale dell’ascella e del braccio. I pochi esami istologici documentati mostrano infatti sclerosi delle vene e dei linfatici circondata da fibrosi; queste osservazioni richiedono tuttavia ulteriori conferme. Alcuni studi mostrano che l’incidenza della linfosclerosi è maggiore nelle pazienti sottoposte a dissezione
ascellare piuttosto che in quelle sottoposte a biopsia del linfonodo sentinella, ma l’esperienza presso il nostro centro non conferma tale tendenza. Questa manifestazione si autolimita e si risolve spontaneamente in 8-16 settimane, ma il massaggio e l’esercizio fisico accorciano i tempi di guarigione. In alcune pazienti al cordoncino tipico della linfosclerosi si accompagnano dei noduli che possono localizzarsi lungo tutto il decorso del cordone e che, quando presenti in sede ascellare, vanno differenziati da una lesione metastatica.[7][8]
Figura 1.13 Linfosclerosi: si noti la presenza del tipico cordone in ascella.
formazione di una capsula fibrosa, troppo grande per essere degradata dal sistema immunitario. La presenza della capsula intorno alla protesi può essere vantaggiosa perché contribuisce a mantenere la protesi stessa in sede, quando però il processo fibrotico diventa troppo esuberante la paziente può avvertire senso di pesantezza, indurimento del seno, dolore e si può osservare la risalita della protesi dalla sua sede iniziale. A ciò si può aggiungere contrattura del muscolo pettorale. Si è molto
dibattuto su quali fossero le cause che favoriscono la contrattura capsulare, sono stati chiamati in causa la radioterapia, la posizione della protesi, il materiale di cui è costituita la protesi, il tempo che intercorre tra la fine dell’espansione e il posizionamento della protesi definitiva, tuttavia l’unico fattore che sembra correlato positivamente con una maggiore incidenza di contrattura capsulare è l’esecuzione di un nuovo intervento chirurgico per ovviare a complicanze quali infezioni e rottura della protesi.[9]
1.4.2 Radioterapia
Nel trattamento loco-regionale del carcinoma mammario in stadio precoce la radioterapia svolge il compito di eliminare le eventuali cellule maligne residue; viene effettuata sempre dopo quadrantectomia, e in caso di mastectomia con tumore >5 cm, più di 4 linfonodi ascellari metastatici, margini di resezione del tumore infiltrati, edema o ulcerazioni della cute o presenza di noduli cutanei satelliti.[1]
Normalmente la radioterapia viene somministrata 4-5 mesi dopo l’intervento con tre fasci, due tangenziali sulla mammella (laterale e mediale) e uno anteriore in regione ascellare, raggiungendo una dose totale di circa 5000 cGy suddivisi in frazioni di 200 cGy nell'arco di un periodo di 5 settimane (Figg. 1.14 e 1.15).
Un’opzione più recente è la radioterapia intraoperatoria (IORT) che consiste nel somministrare l’intera dose durante l’intervento chirurgico.[4]
Nei casi in cui sia necessaria la radioterapia dopo la mastectomia è preferibile somministrarla dopo aver posizionato l’espansore.
Le sequele della terapia radiante si suddividono in acute (eritema, epidermolisi secca e umida) e tardive (fibrosi e, molto raramente, necrosi e fibrosi polmonare); la loro incidenza è direttamente proporzionale alla dose totale somministrata e, a parità di questa, quanto maggiore è la dose per frazione.
L’irradiazione della regione ascellare aumenta l’incidenza e la gravità del linfedema dell’arto superiore che, naturalmente, può conseguire anche al solo intervento chirurgico.
Figura 1.15 Radioterapia dopo chirurgia conservativa della mammella.
1.4.3 Chemioterapia e terapia ormonale
Ad eccezione dei casi a rischio molto basso la terapia loco-regionale è seguita da una terapia sistemica che può essere di tipo chemioterapico e/o ormonale.
Il rischio di recidiva di malattia viene valutato in base all’analisi di alcuni parametri: l’interessamento linfonodale, la presenza di recettori ormonali sulle cellule tumorali, le dimensioni del tumore, il grado istologico e l’età della paziente; linfonodi istologicamente positivi, assenza di recettori ormonali, dimensioni >2 cm, grado istologico 2 o 3, età della paziente <35 anni rappresentano fattori prognostici negativi.
Nei casi a rischio maggiore si intraprende un trattamento chemioterapico seguito, nei casi con positività recettoriale, dall’ormonoterapia.[1] Il trattamento chemioterapico standard prevede 6 cicli: 3 cicli con 5-fluorouracile, una antraciclina (epirubicina o adriamicina) e ciclofosfamide seguiti da 3 cicli con i taxani. Gli effetti collaterali più comuni si osservano a livello delle mucose
(diarrea, mucositi, ulcerazioni) e del midollo osseo (anemia, leucopenia), con vomito e alopecia. Inoltre il 5-fluorouracile provoca fotosensibilizzazione cutanea e le antracicline causano cardiotossicità che può essere acuta (disturbi del ritmo) e cronica (insufficienza cardiaca congestizia); a dosi elevate la ciclofosfamide può causare cistite emorragica i taxani causano una neurotossicità che si estrinseca con deficit della sensibilità alle estremità.[10]
La terapia ormonale è effettuata con un antiestrogeno (tamoxifene) o con un inibitore dell’aromatasi (anastrazolo). Di solito il tamoxifene viene impiegato in premenopausa, l’anastrazolo in postmenopausa o nelle pazienti che non tollerano il tamoxifene.[1] Gli effetti collaterali del tamoxifene sono vampate di calore, irritabilità e aumento di peso.
Nei tumori positivi per la presenza dell’antigene erbB-2 può essere utilizzato il trastuzumab, un anticorpo monoclonale specifico.
CAPITOLO SECONDO:
LINFEDEMA
2.1 Fisiopatologia
Il linfedema è un aumento di volume di un segmento corporeo causato da un accumulo nell’interstizio, in particolare nel sottocutaneo, di linfa, un fluido derivato dal plasma ricco in proteine e lipidi che rappresenta una quota dei liquidi che arriva ai tessuti tramite il versante arteriolare dei capillari (Fig. 2.1). Tale linfa viene riassorbita dai capillari linfatici e rientra nella circolazione venosa attraverso i vasi linfatici e il dotto toracico.
Il sistema linfatico svolge un ruolo importante anche nell’immunità: infatti la linfa contiene anche microrganismi patogeni che vengono trasportati ai linfonodi dove vengono eliminati dalle cellule immunitarie.
Normalmente la quota di fluidi rimossa dal sistema linfatico ammonta a circa il 10% dei liquidi che giungono ai tessuti con il flusso sanguigno; il volume può divenire cospicuo in caso di incremento del flusso sanguigno ma, in condizioni normali, il flusso linfatico può aumentare in modo da evitare l’accumulo nei tessuti.
Quando il sistema linfatico è danneggiato (ostruzione, rimozione dei linfonodi) il flusso linfatico non può variare, con eventuale accumulo di linfa nei tessuti.
Come detto la linfa è molto ricca in proteine: il loro accumulo nell’interstizio aumenta la pressione colloido-osmotica interstiziale con richiamo di liquidi dal compartimento vascolare. In questa fase la componente liquida è ben rappresentata e il linfedema è improntabile. L’accumulo di linfa dilata i vasi linfatici e rende le loro valvole insufficienti: si ha cosi un reflusso di linfa nei tessuti e si crea un circolo vizioso.[11]
La stasi linfatica stimola la fibrogenesi da parte dei fibroblasti: ciò porta, nel linfedema cronico, a fibrosi del sottocutaneo. Nella fase fibrotica il linfedema diviene sempre meno improntabile.[12]
Figura 2.1 Linfedema dell’arto superiore conseguente a dissezione dei linfonodi ascellari.
2.2 Classificazione
Il linfedema può essere classificato come primario o secondario.
Il linfedema primario insorge senza una causa apparente; si tratta di un gruppo di malattie a eziologia ignota, per quanto recentemente siano stati individuati dei geni che sembrano essere implicati nel controllo della crescita dei vasi linfatici e che quindi potrebbero essere correlati alla loro insorgenza.[13] Nel linfedema primario si verifica un insufficiente sviluppo dei vasi linfatici con conseguente accumulo di linfa nei tessuti. L'età di insorgenza è molto variabile: la forma congenita (malattia di Milroy) insorge in epoca neonatale, la forma precoce (malattia di Meige) intorno alla pubertà, la forma tardiva dopo i 35 anni.
Il coinvolgimento linfonodale da parte di una neoplasia o l’asportazione chirurgica come anche l’irradiazione possono portare a linfedema nel territorio di drenaggio dei linfonodi interessati; per quanto riguarda le infezioni la causa più frequente a livello mondiale è la filariasi, seguita dalla linfangite recidivante (di solito di origine streptococcica), mentre molto più raro è il linfedema conseguente a infezione tubercolare (Tab. 2.1).[14]
Primitivo Secondario
Congenito (compresa la malattia di Milroy) Precoce (compresa la malattia di Meige) Tardivo Linfangite recidivante Filariasi Tubercolosi Neoplasie Interventi chirurgici Terapia radiante
Tabella 2.1 Classificazione eziologia del linfedema.
2.3 Complicanze
La complicanza più comune del linfedema che consegue alla terapia del cancro mammario è l’erisipela, ovvero l’infezione della cute e del sottocutaneo conseguente alla penetrazione di batteri attraverso lesioni di continuo della cute dell’arto interessato. Da sottolineare che possono essere sufficienti lesioni di piccole dimensioni quali graffi e punture d’insetto per causare l’infezione, poiché con l’asportazione dei linfonodi ascellari viene a mancare l’azione immunitaria di queste strutture.
Va notato come tutte le patologie che rallentano il drenaggio linfatico (linfangiti, linfedema cronico) aumentano il rischio di sviluppare l’erisipela.
L’agente eziologico più frequentemente chiamato in causa è lo streptococco di gruppo A (Streptococcus pyogenes); più raramente si ritrovano streptococchi di gruppo C o G e lo Staphylococcus aureus.
L’erisipela insorge improvvisamente e ha decorso rapido: il paziente si presenta con febbre, l’arto interessato è dolente, arrossato ed edematoso e si può avere cute a buccia d’arancia. Tipica dell’erisipela è la netta demarcazione dell’area interessata rispetto alla cute circostante. Nei casi più gravi al secondo o terzo giorno si può avere la formazione di vescicole o bolle. Dopo la guarigione si può avere desquamazione della cute.
La terapia antibiotica viene effettuata con penicillina o macrolidi nei pazienti allergici.[15][16] In letteratura è riportata la possibilità, molto rara (1% dei casi), di sviluppare un angiosarcoma come conseguenza del linfedema cronico.[12]
2.4 Valutazione clinica
Durante la raccolta anamnestica è necessario stabilire se l’insorgenza è stata improvvisa o graduale e se ci sono stati eventi scatenanti; in generale tutti gli eventi che aumentano l’afflusso di sangue nell’arto colpito aumentano il rischio di sviluppare linfedema. Deve anche essere stabilito qual è stato il decorso del linfedema, ovvero se il volume dell'arto sia rimasto stabile o se sia variato e se sia aumentata l’estensione. Il paziente può riferire la presenza di dolore e di senso di pesantezza nella parte colpita. L’anamnesi dà anche modo di indagare a proposito delle cause del linfedema come l’interessamento linfonodale da parte di neoplasie, l’asportazione o l’irradiazione dei linfonodi regionali. Anche le infezioni recidivanti come erisipela o linfangiti possono portare a linfedema.
Ispettivamente si possono valutare le eventuali alterazioni del colore della cute, che può presentarsi lucida e tesa o certe volte cianotica o ipercheratosica, oltre che l’eventuale presenza di cicatrici adese a ostacolare il drenaggio linfatico. Durante l’esame obiettivo possono essere evidenziate le riduzioni della motilità che possono essere presenti in caso di linfedemi importanti.
consistenza del linfedema, variabile in base alla quantità di liquidi e proteine e della presenza di fibrosi: sarà molle in caso di prevalenza della componente liquida, pastosa quando prevalgono le proteine e dura quando c’è fibrosi. Allo stesso modo la fovea è più evidente quando prevale il liquido e tende a scomparire man mano che si sviluppa fibrosi (Fig. 2.2). Nell’arto inferiore può essere verificata la presenza del segno di Stemmer: pinzando la cute del secondo dito, se si riesce a sollevare una plica cutanea si può ipotizzare un’origine linfatica dell’edema.
Normalmente non sono necessari esami di laboratorio nella valutazione del linfedema a meno che non si sospetti la presenza di malattie epatiche, renali o intestinali che possono portare a dispersione proteica. Nel caso in cui l’origine venosa o linfatica dell’edema sia incerta si può effettuare un eco-color Doppler per verificare se si è in presenza di una insufficienza venosa. La linfoscintigrafia è indicata in caso di sospetto di linfedema primario.[12]
2.5 Misurazione
Il metodo più accurato per misurare il volume di un arto edematoso è quello dello spostamento dell’acqua: si immerge l’arto edematoso in un volume noto di acqua e si calcola la differenza di volume prima e dopo l’immersione.
Più pratica anche se meno precisa è la misurazione della circonferenza dell’arto rilevata a intervalli regolari per tutta la sua lunghezza.
2.6 Trattamento
La gestione del linfedema inizia innanzi tutto dalla profilassi. Si deve raccomandare al paziente di evitare ogni tipo di ferita, comprese le punture di insetti, nell’arto affetto. Si deve consigliare l’applicazione di pomate antibiotiche su ogni soluzioni di continuo della cute allo scopo di
prevenire le infezioni. Il paziente deve inoltre evitare sforzi e lavoro eccessivo o ripetitivo.
2.6.1 Linfodrenaggio manuale
Il linfodrenaggio manuale è una tecnica fisioterapica che mira a favorire il drenaggio della linfa dall’arto colpito attraverso vie linfatiche collaterali: si tratta di un massaggio che interessa prevalentemente la porzione superficiale dell’arto e che tende a far muovere la linfa verso la porzione prossimale seguendo la fisiologica direzione del drenaggio linfatico. Le prime regioni ad essere massaggiate sono quelle prossimali in modo da svuotare i linfatici di queste zone ed evitare gli accumuli di linfa che si avrebbero se si tentasse di svuotare prima le zone distali.
Esistono diverse tecniche di linfodrenaggio manuale (Leduc, Vodder, Foldie) ma non sono state dimostrate significative differenze in termini di efficacia tra queste tecniche.
Una seduta di linfodrenaggio dura in media 40-60 minuti, mentre la durata complessiva del trattamento è commisurata alla gravità del linfedema; di solito si effettuano almeno dieci sedute
Solitamente il linfodrenaggio è molto efficace nel ridurre il linfedema, tanto che in alcuni casi anche dopo una sola seduta se ne può apprezzare una riduzione.
Pur essendo efficace nell’immediato, un limite del linfodrenaggio è quello di apportare un beneficio solo temporaneo. Infatti, se non viene applicato un bendaggio elastocompressivo, entro poco tempo tornano ad accumularsi liquidi portati dal flusso sanguigno.
Il linfodrenaggio è controindicato nei pazienti cardiopatici e nefropatici poiché rimettendo in circolo liquidi dallo spazio interstiziale può causare un sovraccarico; un’altra controindicazione è la presenza di trombosi venosa per il rischio di provocare un’embolia.
Si discute molto sul rischio connesso al linfodrenaggio manuale di mandare in circolo cellule maligne eventualmente presenti nel liquido linfatico di pazienti affetti da patologia neoplastica. Sebbene non vi siano prove di una reale pericolosità di questa procedura, si preferisce iniziare il linfodrenaggio dopo un certo numero di cicli di chemioterapia.
2.6.2 Bendaggio
Il bendaggio è un trattamento che può essere complementare al linfodrenaggio oppure essere utilizzato in prima battuta, soprattutto quando il linfedema è di dimensioni ridotte, o in quei casi di lunga durata che presentino una consistenza aumentata.
Normalmente un ciclo di trattamento con il bendaggio prevede una decina di applicazioni.
2.6.3 Altre terapie
Una volta concluso il ciclo di trattamento con il linfodrenaggio e/o il bendaggio è necessario istituire una terapia di mantenimento, che viene effettuata tramite l’applicazione di guaine elastiche sull’arto affetto. Esistono guaine a maglia circolare che hanno una forma cilindrica e che esercitano una pressione uniforme su tutto l’arto e sono più adatte per trattare l’edema di natura venosa. Per il linfedema vengono utilizzate guaine a maglia piatta che hanno una forma che riprende quella
dell’arto e che esercitano una pressione maggiore distalmente e minore nella porzione prossimale, quindi simile a quella del linfodrenaggio e del bendaggio.
Le guaine vengono inoltre classificate in base alla loro elasticità quindi in base al grado di compressione che esercitano.
La lunghezza della guaina viene adattata alle esigenze del paziente: può estendersi dal polso all’ascella o comprendere anche la mano con o senza le dita; la scelta viene operata in base all’estensione del linfedema.
La guaina viene indossata nelle ore diurne e viene tolta durante la notte: questo perché a differenza del bendaggio la guaina necessita del movimento muscolare per drenare al meglio la linfa. Il rinnovo viene programmato all’incirca ogni sei mesi poiché nel tempo l'elasticità tende a diminuire. Il trattamento viene effettuato a tempo indeterminato (Figg. 2.3, 2.4 e 2.5).
.
.
Figura 2.4 Guaina elastica per l’arto superiore.
A B Figura 2.5 Particolari della figura 2.5 A: mano, B: braccio.
Un’altra tecnica per il trattamento del linfedema è la compressione pneumatica mediante un dispositivo costituito da dei manicotti contenenti più camere pneumatiche gonfiate alternativamente. Il dispositivo è automatico e un ciclo di trattamento inizia con una compressione a livello della porzione prossimale dell’arto seguita da una compressione sulla porzione distale, infine viene praticata una compressione sequenziale che procede dall’estremità verso la radice dell’arto.[18] La maggiore efficacia della compressione pneumatica rispetto al bendaggio elasto-compressivo deve ancora essere dimostrata.[19]
I linfedemi che non rispondono alla compressione possono essere trattati mediante tecniche microchirurgiche volte a creare un'anastomosi tra vasi linfatici e venosi. Questa tecnica presenta forti limitazioni: innanzitutto non è efficace nei linfedemi cronici ormai fibrotici, inoltre se dopo la chirurgia non viene instaurata una terapia compressiva il linfedema tende a recidivare.
Anche la liposuzione può essere utilizzata nei linfedemi di vecchia data nei quali la componente adiposa sia ben rappresentata. Questa tecnica si esegue praticando una serie di piccole incisioni di circa 3 mm su tutta la superficie dell’arto comprendendo, se necessario, anche le dita. In queste incisioni vengono inserite delle cannule e il tessuto adiposo viene aspirato tramite una pompa che crea una pressione negativa. Una volta conclusa la procedura sull’arto viene applicata una guaina compressiva.
CAPITOLO TERZO:
ORGANIZZAZIONE DEL CENTRO SENOLOGICO DELL’AZIENDA
OSPEDALIERA PISANA
Nel nostro servizio ambulatoriale di riabilitazione oncologica le pazienti affette da cancro della mammella vengono seguite durante tutto il percorso diagnostico e terapeutico.
Questo percorso inizia appunto con la diagnosi, prosegue con il trattamento chirurgico e si conclude con quello riabilitativo.
Per quanto concerne il trattamento chirurgico le pazienti vengono sottoposte sia alla chirurgia oncologica vera e propria sia a quella ricostruttiva se necessaria. Tale trattamento viene effettuato in regime di week hospital, mediante il quale le pazienti vengono ricoverate per un periodo di circa tre giorni. Il ricovero breve contribuisce a diminuire l’impatto psicologico dell’ospedalizzazione. Nelle settimane successive all’intervento le pazienti vengono seguite sia dall’equipe chirurgica per quanto riguarda la gestione della ferita, sia dai fisioterapisti.
Il lavoro dei fisioterapisti consiste sia nel dare le indicazioni sul comportamento da tenere durante la convalescenza per salvaguardare la mobilità della spalla, sia, se necessario, nell’effettuare vere e proprie sedute fisioterapiche.
Durante queste sedute le pazienti vengono trattate per ridurre il dolore, l’edema del seno e, se presente, la linfosclerosi.
Al servizio di riabilitazione oncologica giungono le pazienti che sviluppano complicanze più tardive quali linfedema, aderenze cicatriziali, contrattura capsulare, erisipela.
I pazienti arrivano al nostro ambulatorio come pazienti esterni inviati dal medico di famiglia o da uno specialista. Una volta stabilito che il paziente necessita di un trattamento fisioterapico i pazienti vengono inseriti in una lista d’attesa che prevede tre livelli di priorità. Tale priorità viene stabilita sulla base della gravità del caso e delle terapie a cui il paziente dovrà essere sottoposto: nel caso dei linfedemi viene data la precedenza ai casi che presentino insorgenza recente e rapida, volume
dell’arto importante, dolore, impedimento funzionale. Nei casi di aderenze cicatriziali e di marcata fibrosi, oltre che ai casi più gravi, viene data la precedenza ai pazienti che devono essere sottoposti a radioterapia. La presenza della fibrosi infatti diminuisce l’efficacia della terapia radiante.
Un altro importante servizio che viene offerto alle nostre pazienti è quello delle riunioni che vengono organizzate una volta al mese, cui partecipano prevalentemente le pazienti operate da poco, ma che sono aperte a tutti. L’incontro si svolge alla presenza di un medico, di un fisioterapista, di uno psicologo e di volontari. Si danno informazioni sulle precauzioni da osservare dopo l’intervento (soprattutto per chi ha subito lo svuotamento ascellare), sugli effetti collaterali della chemioterapia e sui loro risvolti psicologici. Questa è una occasione per i pazienti di avere chiarimenti, porre domande e confrontarsi con altre persone che stanno attraversando o hanno attraversato le loro stesse difficoltà.
Questo tipo di servizio riabilitativo può essere utile anche nei pazienti affetti da altri tipi di neoplasie che possono andare incontro ad aderenze delle cicatrici dell’intervento e a linfedema in seguito a dissezione linfonodale. Si pensi, per esempio, ai casi di melanoma, di carcinoma della vescica, della prostata, del colon-retto, del distretto testa - collo o di tumori ginecologici.
È importante inoltre sottolineare come al servizio afferiscano pazienti in ripresa di malattia o affetti da sintomatologia algica di importante entità, indirizzati prevalentemente dai reparti di Oncologia, Radioterapia e Terapia Antalgica.
CAPITOLO QUARTO:
STUDIO SPERIMENTALE
4.1 Scopo dello studio
In letteratura è possibile trovare dati contrastanti sull’efficacia del bendaggio elasto-compressivo rispetto ad altri tipi di trattamento. Dai dati ricavati da una review del 2007[21] si evince che i trattamenti quali linfodrenaggio manuale seguito o meno dal bendaggio elasto-compressivo, terapia laser e compressione pneumatica generalmente sono più efficaci nel ridurre il volume del linfedema rispetto al solo bendaggio, agli esercizi, alla elevazione dell’arto e all’auto-massaggio da parte della paziente. In particolare due studi che verificavano l’efficacia del bendaggio da solo[22] [23], hanno riportato una riduzione del volume di 38 ml (7%) e 20 ml (4%). In altri quattro studi[22] [23] [24] [25] con il solo bendaggio si è ottenuta una riduzione di 20-49 ml (4-8%). Risultati migliori si ottengono quando al bendaggio si associa un auto-massaggio: riduzione del volume di 243 ml (24,4%).
Una review pubblicata nel 2011[26] mette a confronto 25 studi condotti tra il 1980 e il 2009 che confrontano l’efficacia delle varie modalità di trattamento del linfedema secondario a patologia neoplastica. In alcuni degli studi esaminati viene messa in evidenza la maggiore efficacia
dell’aggiunta del linfodrenaggio manuale alla terapia compressiva nel trattamento del linfedema del braccio rispetto alla sola terapia compressiva. Tuttavia uno solo di questi studi si è dimostrato essere statisticamente significativo[27] Uno studio condotto su 90 partecipanti[28] mostra il beneficio del bendaggio effettuato per 18 giorni (e seguito da una terapia di mantenimento con guaina elastica) rispetto alla sola guaina. L’efficacia del bendaggio è sia immediata che dopo un follow-up di 24 settimane.
In definitiva questa review evidenzia come la terapia compressiva (bendaggio e guaina elastica) sia efficace sia a breve che a lungo termine nel ridurre il volume del linfedema sia a livello degli arti
superiori che inferiori. Negli studi esaminati il linfedema era secondario a carcinoma mammario o a sarcoma di Kaposi. Per quanto concerne il linfedema secondario al carcinoma mammario gli studi esaminati mostrano un lieve incremento nell’efficacia del bendaggio quando viene associato al linfodrenaggio manuale, tuttavia un solo studioha mostrato delle differenze statisticamente significative.
Lo scopo di questo studio sperimentale è quello di mettere a confronto l'efficacia del bendaggio elasto-compressivo da solo e associato al linfodrenaggio manuale nel trattamento del linfedema dell’arto superiore correlato al trattamento chirurgico del carcinoma mammario.
4.2 Materiali e metodi
Per effettuare questo studio sono state reclutate donne sottoposte a trattamento chirurgico del carcinoma mammario a seguito del quale hanno sviluppato un linfedema dell’arto superiore. Nello studio sono state incluse solo le pazienti che erano affette da linfedema dell’arto dominante, suddivise in due gruppi: le appartenenti al primo hanno ricevuto come trattamento il bendaggio elasto-compressivo, le appartenenti al secondo il linfodrenaggio manuale seguito dal bendaggio. Ogni paziente è stata sottoposta a dieci sedute di trattamento; le misurazioni sono state effettuate prima dell’inizio del trattamento entrambi gli arti) e dopo la terza e la decima seduta (solo l'arto affetto).
L’applicazione del bendaggio inizia con il posizionamento di un manicotto in puro cotone a contatto con la cute. Tale manicotto ha un diametro variabile per adattarsi al meglio al volume dell’arto. Al di sopra del manicotto, a partire dal polso fino all’ascella, viene avvolta, in un singolo strato, una benda chiamata salvapelle che ha una altezza di 7 cm. Il manicotto in cotone e la benda salvapelle hanno lo scopo di proteggere la cute e di contribuire a distribuire la pressione delle bende uniformemente lungo tutto l’arto. Le dita vengono bendate separatamente l’una dall’altra. A questo
utilizzate 4 o 5 garze a seconda dei casi. Su ogni dito la garza può essere avvolta più volte a seconda della pressione che si vuole ottenere. A livello della mano, dell’avambraccio e del braccio vengono applicate delle bende a media estensibilità lunghe 4,5 m. Per la mano viene usata una sola benda di 6 cm di altezza. Per il braccio e l’avambraccio vengono utilizzate tre bende di 8 o 10 cm di altezza a seconda del livello di compressione che si vuole ottenere. Infatti ogni avvolgimento della benda può essere parzialmente sovrapposto a quello adiacente. Maggiore è il grado di sovrapposizione degli avvolgimenti maggiore è il potere compressivo del bendaggio. Le bende elastiche a media estensibilità agiscono comprimendo l’arto, e quindi facilitando il drenaggio linfatico, sia a riposo che durante i movimenti: infatti l'estensibilità delle bende si oppone all’aumento di volume dei muscoli favorendo il drenaggio anche durante la loro attivazione (Fig. 4.1).
Il bendaggio viene applicato ogni giorno, eventualmente dopo il linfodrenaggio (ove indicato) e viene mantenuto per 24 ore o comunque sino alla seduta successiva. Il bendaggio, a differenza della guaina, può essere tenuto anche durante la notte. Se, una volta che l’arto viene sbendato, si osserva un arrossamento della cute prima di applicare il nuovo bendaggio viene applicata una crema lenitiva allo zinco.
B C
Figura 4.1 A: Bendaggio elasto-compressivo dell’arto superiore, B: particolare della mano, C: particolare del braccio.
Il volume degli arti è stato stimato misurandone la circonferenza a vari livelli ogni 5 cm a partire dalla base dell’unghia del terzo dito.
Con la paziente in posizione seduta vengono segnati sulla cute con un pennarello indelebile i punti di misurazione. Le circonferenze vengono misurate con un metro a nastro ponendo il bordo sempre sopra o sotto il punto. Il metro viene posto ad angolo retto rispetto all’asse longitudinale dell’arto. La misurazione viene effettuata con il metro ben aderente alla cute e senza effettuare la minima trazione.
Di ogni paziente è stata calcolata la differenza tra le circonferenze medie dell’arto leso e dell’arto sano prima e dopo il trattamento. Sono state poi calcolate le differenze tra questi valori e in seguito il rapporto percentuale tra tale differenza e la differenza tra i due arti prima del trattamento.
Le variazioni tra i due gruppi sono state saggiate tramite il test statistico di Student, la differenza viene considerata significativa se P<0,05.
I risultati delle misurazioni sono elencati nelle tabelle 4.1 e 4.2 e rappresentati nelle Figure 4.2 e 4.3.
CMS CMLpre CMLpost DIFFpre DIFFpost VAR %
23.8 25.9 24.4 2.1 0.6 1.5 71
20.9 27.4 26.4 6.5 5.5 1 15
24.6 29.2 28.1 4.6 3.5 1.1 24
19.9 23.3 21.6 3.4 1.7 1.7 50
LEGENDA
CMS=circonferenza media dell’arto sano
CMLpre=circonferenza media dell’arto leso prima del trattamento CMLpost=circonferenza media dell’arto leso dopo il trattamento DIFFpre=CMLpre-CMS
DIFFpost=CMLpost-CMS VAR=DIFFpost-DIFFpre %=(VAR/DIFFpre)X100
Tabella 4.1 Misurazioni relative al gruppo trattato con linfodrenaggio e bendaggio.
CMS CMLpre CMLpost DIFFpre DIFFpost VAR % 31 33 30.7 2 -0.3 2.3 115 25.2 27.3 25.7 2.1 0.5 1.6 76 25.6 32.2 25.1 6.6 -0.5 7.1 108 21.9 23.2 22.5 1.3 0.6 0.7 54 17.8 18.2 18.1 0.4 0.3 0.1 25 LEGENDA
CMS=circonferenza media dell’arto sano
CMLpre=circonferenza media dell’arto leso prima del trattamento CMLpost=circonferenza media dell’arto leso dopo il trattamento DIFFpre=CMLpre-CMS
DIFFpost=CMLpost-CMS VAR=DIFFpost-DIFFpre %=(VAR/DIFFpre)X100
Tabella 4.2 Misurazioni relative al gruppo trattato col solo bendaggio.
Figura 4.3 Variazione della circonferenza media del braccio (gruppo 2)
Nel primo gruppo, comprendente 4 pazienti, la diminuzione media del volume del braccio è risultata essere del 40% (con un minimo del 15% e un massimo del 71%).
Nel secondo gruppo, composto da 5 pazienti, è da notare la presenza di due casi nei quali il volume finale dell’arto leso è risultato inferiore a quello dell’arto sano. La diminuzione media del volume dell’arto sano è risultata essere del 75,6% (con un minimo del 25% e un massimo del 115%).
4.4 Conclusioni
Dai dati raccolti si può osservare come, almeno apparentemente, il bendaggio da solo sia più efficace del linfodrenaggio seguito dal bendaggio: infatti la diminuzione media della circonferenza degli arti sottoposti al solo bendaggio è di 2,3 cm, quella degli arti sottoposti a linfodrenaggio e bendaggio è di 1,3 cm. In percentuale tali diminuzioni medie sono rispettivamente del 74 e del 40%.Tuttavia l’analisi statistica mediante test di Student indica che le differenze tra i due gruppi non sono significative.
Bisogna innanzi tutto mettere in evidenza il fatto che il campione non sia sufficientemente numeroso, spiegando quindi la non significatività dei risultati.
Va inoltre sottolineato come la maggior parte delle pazienti di questo studio siano in fase acuta, avendo quindi un linfedema di entità lieve o moderata da poco tempo. Di conseguenza questi linfedemi hanno come componente prevalente quella liquida che può essere rimossa efficacemente sia dal linfodrenaggio che dal bendaggio.
Alla luce di questi dati si può ipotizzare che, nei casi di linfedema acuto, il bendaggio elasto-compressivo sia una tecnica molto efficace anche quando non associato al linfodrenaggio. Questo fatto potrebbe assumere ulteriore rilevanza se si considera che il tempo necessario per applicare un bendaggio è di norma molto inferiore rispetto a quello di una seduta di linfodrenaggio manuale. Quindi il bendaggio elasto-compressivo potrebbe rivelarsi una tecnica che consentirebbe di risparmiare tempo ottenendo risultati simili a quelli del linfodrenaggio. Questa ipotesi va approfondita mediante la prosecuzione dello studio su un maggior numero di casi.
Va inoltre notato come in due casi alla fine del trattamento l’arto leso sia risultato essere più piccolo dell’arto sano. Visto che, in condizioni fisiologiche, l’arto dominante è un po’ più grande del controlaterale, questo risultato apparentemente paradossale può essere spiegato ipotizzando che la muscolatura dell’arto in questione sia andata incontro ad un processo di atrofia dovuta al relativo non uso. Anche in questo caso il numero dei soggetti e delle misurazioni è tuttavia troppo esiguo per trarre conclusioni certe.
BIBLIOGRAFIA
1 De Placido, S. De Laurentis, M. Bianco, A.R. (2003), Carcinoma della mammella in Manuale di oncologia clinica, A.R. Bianco, 3° edizione, Milano, McGraw-Hill, 109-138 2 Lippman, E.E. (2008), Carcinoma della mammella in Harrison principi di medicina interna,
A.S. Fauci, E. Braunwald, D.L. Kasper, S.L. Hauser, D.L. Longo, J.L. Jameson, J. Lo scalzo, 17° edizione, Milano, McGraw-Hill, volume 1, 556-564
3 Lester, S.C. (2005) La mammella in Le basi patologiche delle malattie, Robbins & Cotran, 7° edizione, Torino, Elsevier (1120-1154)
4 Farinon. A.M. Tucci, G.F. Dionigi, G. Rovera, F. (2006) Mammella in Chirurgia – basi teoriche e chirurgia generale, R. Dionigi, 4° edizione, Milano, Masson (388-422)
5 Carlson G.W. (2011) Technical advences in skin sparing mastectomy, International journal of surgical oncology, Atlanta, C. H. Vip, volume 2011, 03 marzo
6 Cordero P.G. (2008) Breast reconstruction after surgery for brest cancer, New England journal of medicine, Clinical therapeutics, 09 ottobre, (1590-1601)
7 Aydogan F. Korkut Balli A. Baghaki S. Karabulut K. Tahan G. Uras C. (2008) Axillary web syndrome after sentinel node biopsy, Breast care, vol.3, 11 agosto 2008, (277-278) 8 Tilley A. Thomas-MacLean R. Kwan W. (2009) Lymphatic cording or axillary web
syndrome after breast cancer surgery
9 Weintraub J. L. Kahn D. M. (2008) The timing of implant exchange in the development of capsular contracture after breast reconstruction, Open access journal of plastic surgery, 29 maggio 2008, (303-311)
10 Bianco A. R. Tortora G. Ciardiello F. Tagliaferro P. De Placido S. (2003), Terapia medica in Manuale di oncologia clinica, A.R. Bianco, 3° edizione, Milano, McGraw-Hill, 45-74 11 Guyton A. Hall J. E. (1999), Il microcircolo e il sistema linfatico: lo scambio dei liquidi nei
capillari, il liquido interstiziale e il flusso linfatico in Fisiologia medica 3° edizione Napoli Edises (186-200)
12 Brorson H. (2003) Liposuction in arm lymphedema treatment, Scandinavian journal of surgery 92 (287-295)
13 Cueni L.N. Detmar M. (2006) New insights into the molecular control of the lymphatic vascular system and its role in disease, Journal of investigative dermatology 126 (2167-2177)
14 Creager M.A. Loscalzo J. (2008), Malattie dei vasi periferici in Harrison principi di medicina interna, A.S. Fauci, E. Braunwald, D.L. Kasper, S.L. Hauser, D.L. Longo, J.L. Jameson, J. Lo scalzo, 17° edizione, Milano, McGraw-Hill, volume 2, 1524-1531 15 Wessels M.R. (2008), Infezioni streptococciche ed enterococciche in Harrison principi di
medicina interna, A.S. Fauci, E. Braunwald, D.L. Kasper, S.L. Hauser, D.L. Longo, J.L. Jameson, J. Lo scalzo, 17° edizione, Milano, McGraw-Hill, volume 1, 866-874
16 Esposito R. Antinori S. (2003) Malattie esantematiche e infezioni dei tegumenti in Malattie infettive Moroni M. Esposito R. Lalla F. 6° edizione Milano Masson 265-342
17 Martin M.L. Hernandez M.A. Avendano C. Rodriguez F. Martinez H. (2011) Manual lymphatic drainage therapy in patients with breast cancer related lymphoedema
18 Adams K.E. Rasmussen J.C. Darne C. Tan I.C. Aldrich M.B. Marshall M.V. Fife C.E. Maus E.A. Smith L.A. Guilloid R. Hoy S. Sevick-Muraca E.M. (2010) Direct evidence of lymphatic function improvement after advances pneumatic compression device treatment of lymphedema
19 Harris S.R. Hugi M.R. Olivotto I.A. Levine M. Clinical practice guidelines for the care and treatment of breast cancer: 11. Lymphedema
20 Cittadini, G. Cittadini, G. Sardanelli, F.(2008) Mammella in Diagnostica per immagini e radioterapia, VI edizione, Genova ECIG (887-901)
21 Moseley, A.L. Carati, C.J. Piller, N.B. (2007) A systematic review of common conservative therapies for arm lymphoedema secondary to breast cancer treatment, Oxford journals medicine annals of oncology, Vol. 18 Issue 4, 18 aprile (639-646)
22 Korpon, M. I. Vacarini, G. Schneider, B. Fiala Moser, V.Effects of compression therapy in patients with lymphoedema after breast cancer surgery, Annual congresses of American College of Phlebology, San Diego, California, agosto 2003
23 Johansson, K. Albertsson, M. Ingvar, C. Ekdahl, C. Effects of compression bandaging with or without manual lymph drainage treatment in patients with postoperative arm
lymphoedema. Lymphology 1999;32:103-110
24 Johansson, K. Lie, E. Ekdahl, C. Lindfeldt, J A randomized study comparing lymph drainage with sequential pneumatic compression for treatment of postoperative arm lymphoedema. Lymphology 1998;31:56-64
25 Swedborg, I. Effects of treatment with an elastic sleeve and intermittent pneumatic
compression in postmastectomy patients with lymphoedema of the arm. Scand J Rehab Med 1984 ;16:35-41
26 McNeely, M.L. Peddle, C.J. Yurick, J.L. Dayes, I.S. Mackey, J.R. (2011) Conservative and dietary interventions for cancer-related lymphedema. A systematic review and meta-analysis. Cancer vol. 17 issue 6. 15 marzo (1136-1148)
27 Didem, K. Ufuk, Y.S. Serdar, S. Zumre, A. The comparison of two different physiotherapy methods in treatment of lymphedema after breast surgery. Breast cancer res. Treat.
2005;93:49-54
28 Badger, C.M. Peacock, J.L. Mortimer, P.S. A randomized, controlled, parallel-group clinical trial comparing multilayer bandaging followed by howiery versus hosiery alone in the treatment of patients with lymphedema of the limb. Cancer 2000;88:2832-2837