1
1. Introduzione
1.1 IRA: definizione, classificazione e diagnosi
L’insufficienza renale acuta (IRA o acute renal failure, ARF) viene definita come una rapida, significativa e duratura riduzione del filtrato glomerulare (glomerular filtration rate, GFR) che porta ad un accumulo di sostanze azotate (urea e creatinina) e di altri cataboliti con importanti effetti extra-renali, metabolici e sistemici.
Infatti, l’insufficienza d’organo si manifesta nel momento in cui vengono a mancare le funzioni dell’organo stesso, e le funzioni del rene sono molteplici: filtrare e depurare il plasma, produrre l’urina, mantenere l’equilibrio acido-base, etc. Oltre alle sensibili alterazioni nell’omeostasi dei fluidi e degli elettroliti, l’ARF complica la gestione dei prodotti del metabolismo e dei farmaci introducendo elementi ulteriori di attenzione e complessità nella gestione di chi ne è colpito. Affermare però che l’IRA si manifesta quando sale la creatinina, diminuisce la diuresi, oppure si hanno degli squilibri idroelettrolitici non corrisponde sempre a verità. Ad esempio l’oligoanuria può essere una risposta fisiologica alla disidratazione, come un danno renale conclamato può manifestarsi senza alterazioni della diuresi. Inoltre anche un minimo danno renale si può correlare ad una prognosi invalidante sia a medio sia a lungo termine. Questo spiega, da una parte un’infinità di definizioni di Insufficienza Renale Acuta (IRA), dall’altra la necessità di una definizione condivisa e di una classificazione per gradi di severità della patologia, come peraltro era già stato fatto per patologie complesse come l’ALI/ARDS e la SIRS/SEPSI nella medicina intensiva (1)
.
Ci sono due sistemi di classificazione ampiamente usati e condivisi: il RIFLE, introdotto dalla seconda “Consensus Conference” internazionale del gruppo sulla qualità della dialisi (Acute Dialysis Quality Iniziative, ADQI) e l’AKIN proposto dall’Acute Kidney Injury Network.
2
La classificazione AKIN tiene conto dell’aumento della creatinina, considerando significativo un aumento maggiore di 0,3 mg/dl o di 1,5 volte il valore basale, oppure una riduzione della diuresi a valori inferiori a 0,5 ml/Kg/h per più di 6 ore (2). Anche la classificazione RIFLE utilizza la creatinina e la diuresi come biomarkers di danno renale, aggiungendo inoltre la quantità della filtrazione glomerulare (GFR). RIFLE è un acronimo che suddivide la patologia renale in tre gradi successivi di gravità di danno (a seconda appunto della creatinina, del GFR e della diuresi) e in due esiti clinici possibili (secondo la durata dell’insufficienza). Abbiamo quindi il rischio di danno renale (Risk), il danno renale (Injury) e l’insufficienza renale (Failure). Poi i due esiti clinici possibili: la perdita (Loss) temporanea della funzione renale con necessità di terapia sostitutiva (RRT) e la fase terminale (End stage renal disease) con necessità di dialisi cronica (1).
1.2 IRA: epidemiologia
Nella letteratura medica ci sono più di trentacinque definizioni per diagnosticare un’insufficienza renale acuta. Questo implica una difficoltà nel valutare l’incidenza di tale malattia. Essa varia, infatti, dall’1 al 44% a seconda della definizione e del valore della variazione di creatinina considerato. Bisogna sottolineare però, come già detto, che anche danni renali lievi si associano ad importanti effetti sulla mortalità intraospedaliera. La classificazione di IRA secondo il RIFLE score ha permesso di uniformare i dati. Accolta con entusiasmo dalla letteratura e utilizzata dal 2006, RIFLE è una classificazione adeguata perché esiste una progressione dei malati che da una classe a minor rischio vanno verso quella a maggior severità come nella storia naturale della malattia. Inoltre ad ogni livello di maggiore severità corrisponde una ospedalizzazione più lunga ed una più alta mortalità. Nelle terapie intensive l’IRA ha un’incidenza elevata, che segue quella della sepsi e dell’ARDS, ed è pari a 2000-3000 malati per milione/anno.
Alcune definizioni di IRA si basano sulla necessità di iniziare una terapia sostitutiva (RRT) o meno, ma anche le indicazioni per una RRT non sono uniformi e questo implica che i dati epidemiologici non sono attendibili. Circa il 4-5% dei pazienti ricoverati in terapia intensiva vanno incontro ad una RRT. Tale percentuale è andata aumentando con gli anni: l’indicazione per una RRT si sta infatti allargando a pazienti sempre più anziani e più compromessi e dipende comunque dalle abitudini e dai protocolli propri del centro di cura. La mortalità dei pazienti sottoposti ad RRT, invece, è rimasta invariata negli anni, ma rimane molto elevata ed è del 50-60%. Anche se la maggior parte dei pazienti che sopravvivono alla RRT ha un buon recupero funzionale, esiste comunque una piccola quota che sviluppa uno stadio terminale (ESRD) con necessità di dialisi cronica (3).
3
1.3 IRA: eziopatogenesi
L’insufficienza renale acuta si divide classicamente in pre-renale, renale intrinseca e post-renale. L’IRA pre-renale è reversibile ed è dovuta ad una ipoperfusione renale assoluta o relativa. Se l’ipoperfusione non viene prontamente corretta, allora si avrà la necrosi tubulare ischemica. Il danno renale intrinseco è causato tipicamente da patologie mediche che si dividono in glomerulari, tubulari, interstiziali e vascolari. Le cause di patologia post-renale sono invece classicamente chirurgiche, ovvero ostruzione della vescica o degli ureteri (4).
Il danno vascolare indotto dall’ischemia e la successiva riperfusione sono alla base del meccanismo patogenetico responsabile dell’IRA. L’ischemia è la più importante e comune causa di danno renale. L’ischemia renale è una complicanza possibile della chirurgia vascolare maggiore, della cardiochirurgia, dell’arresto cardiaco, ma anche della sepsi e della nefropatia da mezzo di contrasto.
L’ischemia e il successivo danno endoteliale sono alla base del meccanismo patogenetico sia nella patologia prerenale, che nella patologia prettamente renale. In quest’ultima sono le sostanze tossiche, come alcuni farmaci o endotossine come il lipopolisaccaride, che causano direttamente il danno endoteliale o inducono l’apoptosi. L’endotelio danneggiato espone delle molecole (ICAM) che fanno da chemorecettori per le cellule dell’infiammazione. Si ha così un’amplificazione del meccanismo che, attraverso il sistema dell’NO, dei reagenti dell’O2 e di altri numerosi mediatori, porta al danno microvascolare ischemico. Tra i mediatori dell’infiammazione e del danno tissutale sono da ricordare l’endotelina, il trombossano A2, l’angiotensina II, TNF, IL6, etc. (5)
. A livello intracellulare il meccanismo patogenetico dell’IRA comprende il consumo dell’adenosina trifosfato (ATP) e l’accumulo intracellulare del Ca2+
. Il rilascio di ossidanti attiva un fattore di trascrizione nucleare, il nuclear factor kappa B (NF-kB), che sembra essere il primo segnale di una cascata di eventi che culmina nel danno da ischemia/riperfusione renale. A livello nucleare il NF-kB attiva un elevato numero di geni responsabili della cascata proinfiammatoria, si ha così la trascrizione delle molecole di adesione (ICAMs), delle citochine e delle chemochine (6). Più recentemente si è visto che la riduzione della perfusione renale è solo uno dei meccanismi proposti. Altri fattori che contribuiscono al danno renale sono l’ostruzione tubulare con il conseguente stravaso a monte del filtrato e la riduzione del coefficiente di filtrazione capillare glomerulare.
Inoltre tutti questi mediatori dell’infiammazione sono capaci di dialogare con altri organi al di fuori del rene. Essi in sostanza si diffondono nell’organismo estendendo l’infiammazione al polmone, al cuore, al SNC e al fegato. Sono sempre più numerosi gli studi che confermano il danno
4
provocato da interleuchina/citochine, stress ossidativi e apoptosi innescati dal rene ed esportati al polmone (dove sono causa di ALI/ARDS), al cuore (dove causano la sindrome cardiorenale) oppure al cervello (dove questi meccanismi si aggiungono al danno dell’encefalopatia uremica). Questo dialogo o interscambio di mediatori è ancora più evidente tra rene e fegato: noxa iniziale di quella che sarà la sindrome epatorenale (7).
L’utilizzo di farmaci capaci di interferire con questi mediatori e di intervenire così sul danno microvascolare potrebbe essere una strategia di successo nella prevenzione e cura dell’IRA.
1.4 IRA: istopatologia
La classificazione istopatologica del danno renale si rifà alla suddivisione anatomofunzionale del rene. I tre compartimenti anatomofunzionali del rene sono il glomerulo, il tubulo ed i vasi. Abbiamo quindi:
- le patologie del glomerulo: glomerulosclerosi e glomerulonefrite membranosa; - le patologie del tubulo: necrosi tubulare acuta (ATN) e nefriti interstiziali;
- le patologie vascolari: le vasculiti renali, la microangiopatia trombotica e l’arteriolosclerosi ialina.
La necrosi tubulare acuta è la patologia che ci interessa di più. Essa è definita da insufficienza renale acuta e danno tubulare in assenza di una significativa patologia a carico del glomerulo o dei vasi. Il rene riceve il 20% della gittata cardiaca. Di questo elevatissimo flusso sanguigno più del 90% va alla corticale, dove ci sono i glomeruli, mentre solo il 6% va alla midollare dove ci sono i tubuli e i collettori renali. Inoltre a livello tubulare l’estrazione di O2 è molto elevata a causa della notevole mole di lavoro necessaria per il riassorbimento dei soluti e la creazione del gradiente osmolare necessario alla concentrazione dell’urina (8)
. Risulta chiaro perché un’eventuale sofferenza ischemica fino alla necrosi è più frequente a livello tubulare piuttosto che corticale. La necrosi tubulare acuta si accompagna ad un rapido aumento della creatinina e talvolta ad ematuria microscopica e piccole quantità di proteinuria. Siccome la necrosi tubulare acuta è rara, essendoci quasi sempre solamente un danno tubulare ischemico, recentemente la necrosi tubulare acuta viene definita come lesione renale acuta (AKI). I due termini sono quindi intercambiabili anche se in letteratura c’è un po’ di confusione.
5
Nelle patologie glomerulari e vascolari il meccanismo d’azione è prevalentemente idiopatico, immunologico o farmaco-indotto. Sono quindi da considerarsi patologie prettamente mediche. L’ATN invece è prevalentemente causata da un danno ischemico da ipoperfusione renale. In realtà anche alcuni farmaci possono causare un danno tubulare diretto (aminoglicosidi o antivirali), oppure essere causa di ipoperfusione mediante l’azione indiretta sulle arteriole afferenti (FANS, ACE-inibitori, ciclosporina). L’ATN può insorgere anche in conseguenza di soluzioni iperosmolari come il mannitolo e le immunoglobuline endovenose, oppure nella rabdiomiolisi e nell’emolisi intravascolare (9).
1.5 IRA: fisiopatologia
I meccanismi di compenso del rene si attuano a tre livelli: - controllo del flusso renale,
- controllo del GFR, variando la tonicità delle arteriole afferenti ed efferenti, - controllo del riassorbimento tubulare.
Un rene sano utilizza tutti e tre questi meccanismi in modo completo ed efficace. Un rene patologico ha già di base instaurati questi meccanismi, per cui un ulteriore insulto si tradurrà in insufficienza fino a perdita di funzione o stato patologico terminale. Il paziente epatopatico, ad esempio, caratterizzato da un’alta portata cardiaca e da basse resistenze periferiche, da accumulo di NO e altre sostanze tossiche, ha già attivati tutti i meccanismi di compenso renali. In questo paziente, infatti, l’ipoperfusione stimola il sistema renina/angiotensina e il sistema nervoso periferico con vasocostrizione delle arteriole afferenti, diminuzione del GFR ed aumento del riassorbimento del Na. Qualsiasi altro insulto porterà a un’ulteriore diminuzione del filtrato glomerulare fino alla comparsa della sindrome epatorenale e dell’insufficienza d’organo terminale (10)
.
Per concludere, quando ci si approccia all’insufficienza renale acuta, bisogna tener presente che il rene può giocare diversi ruoli. Un’ipoperfusione può risultare in una necrosi tubulare acuta conclamata, a causa di meccanismi intra-renali; oppure il rene può essere la vittima di meccanismi extrarenali che traducono l’ipoperfusione sistemica in insufficienza renale. Infine il rene può essere uno spettatore innocente, dove un’ipoperfusione severa non è sufficiente ad indurre un danno d’organo persistente (11)
6
2. IRA: PREVENZIONE E TERAPIA
2.1 IRA: prevenzione primaria, secondaria e markers biologici
La prevenzione in medicina è definita come un’attività finalizzata a prevenire l’insorgenza delle malattie, promuovendo la salute con un notevole risparmio per la collettività.
Distinguiamo:
a. la prevenzione primaria con tutte quelle attività finalizzate a prevenire etiologicamente la malattia, ad impedire cioè il contatto con la causa patogena;
b. la prevenzione secondaria che si attua quando la causa morbosa si è già insediata nell’organismo; essa opera ad un livello patogenetico. La prevenzione secondaria utilizza programmi di screening e test diagnostici finalizzati a una diagnosi precoce, mira quindi a bloccare la progressione della malattia;
c. la prevenzione terziaria interviene a malattia ormai chiaramente manifesta, cerca di evitare la progressione verso situazioni invalidanti.
Per prevenire una patologia renale bisogna innanzitutto identificare quali sono i pazienti a rischio. Una prevenzione primaria nell’IRA si attua nei pazienti a rischio. Ha la funzione di evitare a questi pazienti il contatto con sostanze e procedure nefrotossiche. Nel momento in cui i pazienti devono essere inevitabilmente sottoposti ad un possibile danno, prima cioè di una procedura diagnostica o chirurgica necessaria ed inevitabile si devono attuare tutte la procedure per ridurne le possibili conseguenze. Identificare i pazienti a rischio per danno renale ormai è procedura comune, come limitare le indagini diagnostiche ed utilizzare mezzi di contrasto sempre meno lesivi. I pazienti a rischio per danno renale sono i pazienti che hanno già un’insufficienza renale cronica con valori di creatinina già elevati, i pazienti diabetici soprattutto quelli insulino-dipendenti, i pazienti anziani ipertesi in terapia cronica con farmaci potenzialmente nefrotossici, i pazienti con instabilità emodinamica e con una funzionalità ventricolare depressa, i pazienti con diverse comorbidità.
Molto più difficile è invece una prevenzione secondaria, quando cioè la procedura, l’intervento o il trauma è già avvenuto. In questo caso il danno si è già instaurato anche se non ancora visibile clinicamente e dal punto di vista funzionale. Ecco allora l’importanza di identificare dei markers biologici precoci, come è stato fatto per il miocardio con la troponina, capaci di diagnosticare il danno renale prima che sia visibile, prima che diminuisca la funzionalità. Markers biologici capaci di seguire l’andamento patologico del rene nel tempo e quindi il successo di una terapia.
7
La creatinina è il marker biologico più utilizzato ed esiste da più di sessanta anni, le sue limitazioni son ben note. I suoi valori variano con la massa muscolare, il sesso, l’età, la dieta, i farmaci, l’emodiluizione, il metabolismo, l’apporto proteico e l’esercizio intenso. Circa il 10-40% della clearance della creatinina è dovuto a secrezione tubulare e quindi non è stima del filtrato glomerulare. I valori di creatinina calano nella sepsi. Infine la creatinina sierica diviene alterata solo dopo una diminuzione di almeno il 50% del filtrato glomerulare e potrebbe aver bisogno anche di 24 ore prima di raggiungere livelli misurabili nel sangue (12). Nonostante questo, la creatinina è ancora molto utilizzata ed è anche parte fondamentale delle classificazioni più accreditate come l’AKIN e la RIFLE. Le stesse considerazioni sulla creatinina sono ancor più valide per l’urea, mentre la diuresi oraria è più un monitoraggio emodinamico che un indice di funzionalità renale.
La ricerca sperimentale sta validando altri biomarkers quali KIM1 (kidney injury molecule), NGAL (neutrophil gelatinase associated lipocalin), L-FABP (liver-type fatty acid binding protein), IL-18 (Interleukin-18) e la Cistatina C, rilevabili nelle urine e nel siero.
L’NGAL normalmente esercita un’attività protettiva, batteriostatica e antiossidante. Si pensa abbia un ruolo nel trasporto del ferro e come fattore di crescita. L’NGAL misura lo stress tubulare, la sua concentrazione si eleva drammaticamente sia nel sangue che nelle urine dopo danno tubulare e precede l’innalzamento della creatinina di 24 ore. Se lo paragoniamo alla troponina, la sua performance come marker renale sembrerebbe sufficiente per giustificarne l’utilizzo clinico e l’inclusione nei criteri diagnostici di IRA.
Il L-FABP viene espresso in diversi organi compreso il fegato ed il rene. La sua funzione, sia nel fegato come nel rene, è quella di far entrare gli acidi grassi nelle cellule e promuoverne il metabolismo intracellulare. Grazie al suo piccolo peso molecolare è filtrato dai glomeruli e riassorbito dal tubulo prossimale e ciò in parte spiega il suo accumulo in caso di danno tubulare. Dopo shock settico i livelli urinari di L-FABP si riducono nei sopravvissuti dopo trattamento, ipotizzando una sua utilità nella valutazione di una terapia efficace.
IL-18 è un’importante citochina proinfiammatoria. Negli animali è un mediatore del danno renale post-ischemico. È prodotto a livello del tubulo prossimale e si misurano valori elevati nelle urine quando viene indotto danno renale acuto sperimentale. Nei pazienti che non sono cirrotici, l’IL-18 ha un’elevata accuratezza nella diagnosi differenziale tra necrosi tubulare acuta ed altre cause di disfunzione renale come l’insufficienza prerenale, le infezioni del tratto urinario o le patologie renali croniche (13).
8
Il KIM-1 è una glicoproteina transmembrana, che non si trova normalmente nel rene, ma che viene espressa solamente in caso di danno tubulare sia ischemico che nefrotossico. La parte esterna della proteina viene persa nelle urine dove si può misurare (12).
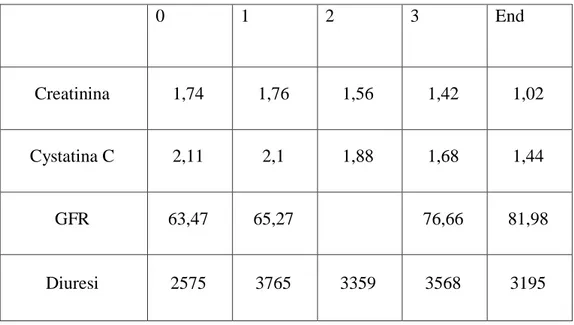
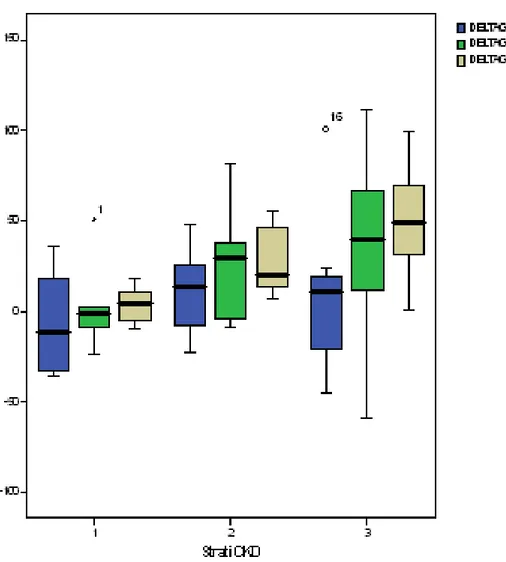
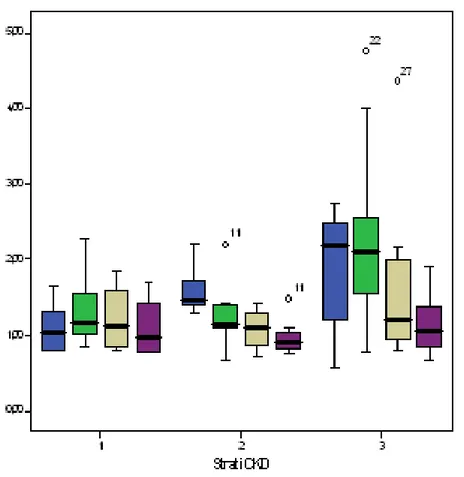
La Cistatina C, in particolare, è un polipeptide a basso peso molecolare, che è prodotto in maniera costante da tutte le cellule nucleate, filtrato liberamente dai glomeruli e riassorbito e catabolizzato dalle cellule tubulari prossimali. Di conseguenza le concentrazioni sieriche di Cistatina C sono determinate dal filtrato glomerulare indipendentemente dall’età, dal sesso, dalla massa muscolare, o dalla presenza di stati infiammatori. E’ quindi un marker affidabile soprattutto nei pazienti cirrotici caratterizzati da una massa muscolare ridotta, da una ridotta biosintesi di creatinina e da alti livelli di bilirubina ematica. La Cistatina C è ancora più affidabile nel paziente trapiantato, dove lo stato infiammatorio e l’utilizzo di immunosopressori rendono la creatinina inaffidabile. Valori elevati di Cistatina C prima del trapianto predicono un’elevata probabilità di IRA postoperatoria (14). Insomma la Cistatina C è un marker affidabile di funzionalità renale nell’immediato periodo post-OLT, soprattutto quando il fine è identificare cambiamenti anche moderati di GFR (15).
Tutti questi marker hanno un buon valore predittivo positivo che aumenta quando non sono usati singolarmente e quando sono affiancati ai valori funzionali. Tuttavia, nonostante la necessità e l’utilità di monitorizzare il danno renale fin dalle prime fasi, risulta difficile poi sul piano clinico, utilizzarli (16). Anche farmaci, come ad esempio l’eritropoietina, che sono ancora a un livello sperimentale e hanno solo un valore profilattico, quando cioè il danno ancora non si vede, sono poco utilizzati (17). L’eritropoietina, infatti, quando somministrata nei ratti sia prima dell’evento ischemico sia subito dopo, prima della riperfusione, previene l’attivazione delle caspasi con diminuzione dell’apoptosi cellulare e dell’infiammazione (18)
.
Infine la prevenzione terziaria si attua al malato nefropatico con la finalità di impedirne la progressione verso l’End Stage Renal Disease e la dialisi a vita.
2.2 IRA: terapia non farmacologica
Possiamo dividere la prevenzione e la terapia dell’IRA in tre punti: non farmacologica,
farmacologica e terapia sostitutiva. La terapia non farmacologica, che è sicuramente la più
efficace, si avvale di due capisaldi. Da una parte si attua semplicemente evitando l’esposizione a sostanze nefrotossiche, dall’altra con la fluidoterapia e il controllo emodinamico.
9
La disidratazione si è dimostrata essere un fattore predisponente di danno renale, soprattutto in concomitanza con la somministrazione di mezzo di contrasto. La fluidoterapia endovenosa, quindi è molto importante. Essa ha l’obiettivo di mantenere la pressione di perfusione renale, il bilancio idroelettrolitico e l’equilibrio acido-base. L’idratazione deve essere corretta e monitorizzata. Tra i vari presidi utilizzati per il monitoraggio della fluidoterapia, sembra avere un ruolo sempre maggiore l’ecografia toracica perché facile da utilizzare ed effettuabile a letto del paziente. Soprattutto nel trauma e nella rabdomiolisi una fluidoterapia aggressiva è risolutiva. Bisogna stare attenti però che non sempre questo è vero. In letteratura ci sono sempre più lavori che affermano l’effetto dannoso di fluidoterapie troppo aggressive o eccessive (19). Queste si associano a danno renale perché concausa di sindrome compartimentale addominale. Ciò è maggiormente vero nei pazienti compromessi della terapia intensiva, con stati infiammatori generalizzati, danno epiteliale con aumento della permeabilità capillare, bilanci positivi, edema e infine stato anasarcatico con aumento delle resistenze toracoaddominali, etc. (20).
Per quanto riguarda i tipi di fluidi da somministrare, ora la letteratura è abbastanza concorde nel preferire le soluzioni elettrolitiche bilanciate come il Ringer Lattato, anche nel caso ci siano elevati valori di potassio nel sangue. Abbondanti infusioni di soluzione fisiologica possono provocare invece un’acidosi metabolica ipercloremica. Un fenomeno, già descritto da Stewart, dove il pH dipende tra l’altro anche dalla concentrazione plasmatica degli ioni forti, tra cui lo ione cloro. Tale teoria spiega come nel caso di un aumento dello ione cloro con carica negativa, debba aumentare la produzione di idrogenioni di carica opposta, in modo da pareggiare le cariche. L’acidosi metabolica ipercloremica è responsabile di disfunzione intestinale, del sistema nervoso centrale e della coagulazione e infine di disfunzione renale con il perpetuarsi del danno. Infine nell’eterna diatriba tra colloidi e cristalloidi sembra che in questa situazione vincano i cristalloidi, poiché un’eccessiva quantità di colloidi può rendere la preurina troppo viscosa con danno del tubulo prossimale. Questo è valido anche per i nuovi plasma expander come l’amido idrossietilico (21)
. Anche il mannitolo e le soluzioni iperosmolari si sono dimostrati dannose per il rene. Il mannitolo agisce come un diuretico osmotico e aumenta il carico di Na che giunge al tubulo spesso del braccio ascendente dell’ansa di Henle. A questo livello l’assorbimento del Na ha un costo energetico tre volte maggiore rispetto al tubulo prossimale. Di conseguenza il mannitolo aumenta il consumo di O2 a livello della zona più esterna della midollare, la regione del rene più sensibile al danno ipossico. Dal punto di vista fisiologico quindi somministrare il mannitolo per prevenire l’IRA sembra assurdo (22). La somministrazione combinata di fluidi, furosemide e mannitolo invece si è
10
dimostrata efficace nell’aumentare il flusso tubulare e disostruire i tubuli dai detriti, possibile causa di danno (23).
Evitare le sostanze dannose per il rene non sempre è facile. Gli aminoglicosidi ad esempio sono una causa molto comune di IRA. Somministrazioni giornaliere ripetute, causa di livelli plasmatici elevati e sostenuti nel tempo, sono maggiormente responsabili di tossicità renale, mentre l’effetto battericida degli aminoglicosidi dipende dalla concentrazione di picco. Inoltre il riassorbimento tubulare del farmaco avviene secondo un meccanismo saturabile, per cui quando gli aminoglicosidi sono somministrati in bolo unico, la maggior parte del farmaco viene escreto senza essere riassorbito e quindi senza accumularsi nel tubulo dove è causa di danno. Insomma diversi studi clinici consigliano la somministrazione in un'unica dose giornaliera.
Anche l’Amfotericina B, nella formulazione convenzionale, è causa di danno renale nel 25-30% dei pazienti, con un rischio progressivo all’accumularsi delle dosi. La formulazione lipidica si è dimostrata meno lesiva per il rene e dovrebbe quindi essere utilizzata preferenzialmente in quei pazienti che hanno già un’evidenza di danno tubulare (24)
. La Caspofungina, un nuovo antimicotico, si è dimostrata avere un profilo ancora più sicuro (25).
L’aprotinina, un inibitore utilizzato per diminuire le perdite di sangue durante gli interventi di cardiochirurgia, è stata associata a un rischio aumentato di danno renale e di ricorso alla dialisi.
Il mezzo di contrasto resta la sostanza che più di tutte è responsabile di danno renale. Un terzo delle insufficienze renali acute è causato dal mezzo di contrasto. Sono sempre maggiori le procedure che lo utilizzano, soprattutto nella cardiologia interventistica e nella chirurgica vascolare. La nefropatia da mezzo di contrasto è una patologia ben distinta. Si definisce come un aumento della creatinina maggiore di 0.5 mg/dl o più del 25% del valore basale nelle 48-72 ore successive alla somministrazione, senza altra causa evidente di danno renale. L’incidenza può essere fino al 25% nei pazienti che hanno già un’insufficienza renale cronica o che fanno parte di una categoria a rischio. Il rischio di sviluppare una nefropatia da mezzo di contrasto aumenta ovviamente quando se ne utilizzano grandi quantità e quando si utilizzano mezzi di contrasto iperosmolari. Sono meno dannosi invece i mezzi di contrasto non ionici e a bassa osmolarità o addirittura isosmolari, questi sono utilizzati ormai quasi ovunque. L’abbondante idratazione prima della procedura è fondamentale per ridurre il rischio di danno. Inoltre anche la N-Acetilcisteina si è dimostrata efficace nel ridurre il rischio e comunque il suo basso costo e il buon profilo tossicologico ne consigliano l’utilizzo prima delle procedure nei pazienti a rischio. Altri farmaci come il Bicarbonato di Sodio e la Teofillina
11
possono essere utili. La concomitante terapia con gli ACE inibitori invece, aumenta il rischio di sviluppare la nefropatia da contrasto (26)(27).
2.3 IRA: terapia farmacologica: diuretici e dopamina
Diversi farmaci vengono utilizzati nella prevenzione e nella terapia dell’IRA.
I diuretici sono molto utilizzati in terapia intensiva. Quasi il 70% degli intensivisti e dei nefrologi utilizza i diuretici nella terapia e prevenzione dell’IRA. La loro popolarità risiede nel fatto che aumentano la diuresi, permettendo una facile gestione del bilancio idrico del paziente e permettono un illusorio miglioramento clinico passando da un’IRA oligurica a una non oligurica. In teoria i diuretici dell’ansa e in special modo la furosemide, aumentando la diuresi favoriscono il deflusso e quindi il lavaggio dei tubuli renali dai detriti cellulari. Si impedisce così che avvengano delle ostruzioni con conseguente edema interstiziale (19). La furosemide bloccando i canali di trasporto Na/K/Cl diminuisce il consumo di O2 e attraverso un meccanismo di inibizione delle prostaglandine aumenta il flusso renale. Alti dosaggi di furosemide sono immunosopressivi e antinfiammatori. A tutti questi meccanismi apparentemente protettivi, non corrisponde però beneficio clinico. Anzi dagli studi sembrerebbe che l’utilizzo della furosemide si associ a una maggiore mortalità. Alti dosaggi di furosemide provocano sordità temporanea e tinnito (24). Un ritardo nel ricorrere a una terapia sostitutiva (RRT) aumenta la mortalità e riduce la probabilità di guarigione renale. Perciò, in caso di IRA, il ricorso alla terapia diuretica è giustificabile solamente come pre-test prima di iniziare la RRT oppure per ridurre temporaneamente i sintomi di un edema polmonare da sovraccarico (20). La furosemide non si è dimostrata efficace nemmeno in concomitanza all’RRT, per un più rapido svezzamento dalla macchina e un più veloce recupero della funzionalità renale (28).
La dopamina è stata descritta per la prima volta nel 1910 ed è stata proposta come un vasodilatatore, in quanto induceva ipotensione negli animali da esperimento. Fisiologicamente viene sintetizzata dalla fenilalanina mediante due enzimi citosolici, la tirosina-idrossilasi e la dopa-decarbossilasi. La dopamina è poi convertita in noradrenalina dalla dopamina β idrossilasi, da cui deriva poi anche l’adrenalina (29). Essa agisce sui recettori α, β, D1 e D2 aumentando la frequenza e
la gittata cardiaca e le resistenze vascolari. La dopamina è usata clinicamente da più di quarant’anni. Il suo largo utilizzo è dovuto al fatto che, a bassi dosaggi (LDD, cioè <3mcg/Kg/min), attraverso un’azione selettiva sui recettori dopaminergici D1 e D2 aumenta la perfusione renale vasodilatando
12
l’arteriola afferente del glomerulo e aumentando la diuresi. I recettori dopaminergici di tipo 1 e 2 sono largamente rappresentati in tutto il rene. In particolare il tipo 1 è responsabile della natriuresi e diuresi non solo con la vasodilatazione, ma anche attraverso un meccanismo meno conosciuto a livello del tubulo prossimale, con l’escrezione attiva di Na, che comporta un consumo di energia ed O2. Come abbiamo visto però, l’eziologia dell’insufficienza renale è multifattoriale ed il contributo dell’ipovolemia e dell’ipoperfusione renale rimane sconosciuto. Fino ad oggi gli studi clinici randomizzati e le ampie metanalisi non hanno mai dimostrato l’efficacia della dopamina nel prevenire e curare l’IRA nei malati critici. Ci sono evidenze solo sulla sua inutilità. La dopamina è un neurotrasmettitore naturale. Anche a bassi dosaggi raggiunge una concentrazione che è un centinaio di volte superiore a quella del corrispettivo endogeno. Inoltre ha una marcata variabilità farmacocinetica interindividuale, per cui è difficile prevederne la concentrazione plasmatica a partire da un determinato dosaggio. La dopamina è implicata nella patogenesi della psicosi e aumenta il rischio di sviluppare il delirio. Anche a bassi dosaggi agisce sui recettori α e β e nei soggetti predisposti può scatenare episodi di tachiaritmia e attacchi ischemici cardiaci. Come per le altre amine, anche per la dopamina esiste l’effetto della tachifilassi, ovvero diminuisce l’effetto con il perdurare dell’infusione. La dopamina agisce anche sui centri che regolano il respiro, smorzando il “drive” respiratorio, con un possibile effetto negativo sul weaning dal ventilatore. In conclusione l’utilizzo della dopamina a basso dosaggio come protettore renale sebbene aumenti la pressione di perfusione e la gittata cardiaca, non è efficace né nella prevenzione né nella terapia dell’IRA. Non è quindi giustificato il termine “dosaggio renale” e non dovrebbe più essere utilizzato (30)(31)
.
N-Acetilcisteina è un ottimo farmaco perché poco costoso e con un ampio profilo di sicurezza. Esso è usato come profilassi nei pazienti nefropatici da sottoporre ad indagini o procedure dove si utilizzi il mezzo di contrasto. Un’ampia metanalisi ha dimostrato la sua inefficacia nella medicina perioperatoria: non riduce la mortalità né l’insorgenza di IRA dopo chirurgia maggiore quando non viene utilizzato il mezzo di contrasto. Non è ancora chiaro invece se l’N-Acetilcisteina possa avere un ruolo in medicina perioperatoria in quei pazienti che hanno già un danno renale prima di essere sottoposti all’intervento chirurgico (32)
.
Altri farmaci sono stati proposti nella profilassi dell’IRA. La dopamina, il peptide natriuretico atriale, gli ACE-inibitori, i Ca-antagonisti, etc.: nessuno si è dimostrato migliore del placebo. In conclusione, a parte il mantenimento della normo volemia, nessun approccio terapeutico da solo si è dimostrato efficace nel prevenire e curare l’IRA nel postoperatorio. Si può concludere dicendo che si deve tenere sempre in considerazione un approccio multimodale quando si affronta questa complessa e ancora in parte sconosciuta patologia (33).
13
3.4 IRA: terapia renale sostitutiva (RRT)
Nonostante decenni di studi clinici e di test farmacologici, l’unica terapia valida dell’IRA rimane la terapia renale sostitutiva. Le indicazioni assolute ad iniziare una dialisi sono ben convalidate e condivise. Esse sono l’iperkaliemia severa, la presenza di segni clinici evidenti di uremia e il sovraccarico di volume, incluso l’edema polmonare complicato da ipossiemia e shock cardiogenico. Tutte queste sono situazioni cliniche conclamate, dove il danno renale è ormai avanzato e l’inizio di una RRT non è messo in discussione.
Il concetto di una dialisi “profilattica” era già stato introdotto negli anni ’60 e diversi studi hanno dimostrato che una RRT precoce si associa a minor mortalità e a minor tempo di degenza (34). Sfortunatamente quando iniziare la dialisi e su quali dati clinici e laboratoristici basarsi, rimane una questione irrisolta e controversa.
Dialisi ad alto dosaggio si correla con un miglioramento dell’outcome e più precisamente ad una diminuzione della mortalità. Comunque al di sopra di una dose minima, di solito 20 mL/kg/ora, ulteriori aumenti non si associano a un beneficio maggiore. Dosaggi lievemente superiori (25 mL/kg/ora) sono da raccomandare solamente nel caso di ripetute ostruzioni del filtro dovute a coaguli, oppure in previsione di utilizzo di mezzo di contrasto.
Non c’è ancora un accordo su quale modalità di RRT sia superiore rispetto all’altra. La modalità continua CVVH attua una lenta correzione degli elettroliti e una graduale rimozione dei fluidi; appare più fisiologica rispetto a quella intermittente e dovrebbe essere quindi tollerata meglio nei pazienti critici e nei pazienti con instabilità emodinamica. Purtuttavia non c’è stata finora, in letteratura, una chiara evidenza clinica che questi vantaggi dal punto di vista fisiologico si siano tradotti poi in una diminuzione della mortalità. La modalità di terapia scelta dipende da diversi fattori, inclusi la disponibilità e l’esperienza del reparto, i costi e le relative risorse. Bisogna sottolineare però che alcune tipologie di pazienti sono state escluse da questi studi di comparazione, poiché è comunemente accettato che i pazienti cranici soprattutto se emodinamicamente instabili e i pazienti con un’epatite acuta fulminante in corso si possano giovare solo della modalità continua.
Gli anticoagulanti sono comunemente usati per prevenire l’ostruzione del filtro. Si possono usare le eparine non frazionate, le eparine a basso peso molecolare o il citrato. La durata del circuito non varia a seconda del farmaco utilizzato, comunque il citrato sembra essere più tollerato e si associa a una mortalità più bassa, anche se il suo utilizzo è più impopolare e necessita di maggiore competenza e perizia (35).
14
3. IRA NEI DIVERSI CONTESTI CLINICI
3.1 IRA in Terapia Intensiva
L’incidenza dell’IRA nei pazienti ospedalizzati è di circa il 7%, mentre l’incidenza di IRA nelle Terapie Intensive aumenta e arriva fino al 36-67% secondo la definizione usata. Abbiamo visto che esistono più di trentacinque definizioni di IRA, le due più utilizzate la RIFLE e la AKIN sono state sviluppate per i pazienti critici delle Terapie Intensive: esse escludono infatti nella loro definizione i pazienti con patologie renali primarie come la glomerulonefrite o le nefriti interstiziali. Utilizzando, quindi, queste definizioni con criteri diagnostici più restrittivi e più severi, l’incidenza in Terapia Intensiva diminuisce e varia dal 4% al 25% con un ricorso alla dialisi nel 5-6% dei pazienti. La mortalità è molto elevata e raggiunge anche il 50-70% nei pazienti che necessitano di RRT. Le cause che portano ad IRA in Terapia Intensiva sono molte. Tra le più comuni ricordiamo la sepsi, il trauma, la grossa chirurgia e soprattutto la chirurgia cardiotoracica, le ustioni e la nefropatia da mezzo di contrasto. Caratteristica comune dell’IRA in Terapia Intensiva è comunque la sua eziologia multifattoriale.
La diagnosi di IRA in Terapia intensiva utilizza i soliti criteri: la storia clinica e l’esame fisico del paziente, compresa l’indagine ecografica; tra gli esami di laboratorio ancora il più utilizzato è la creatinina sierica. Essa non si correla linearmente con il danno renale, poiché si eleva sostanzialmente in ritardo rispetto alla diminuzione del filtrato glomerulare. Non fornisce un mezzo utile e soprattutto “real time” della funzionalità renale. Inoltre la creatina sierica può essere influenzata da altri fattori. Il trimethoprim e la cimetidina, ad esempio, impediscono la secrezione tubulare di creatinina e un suo innalzamento in questo caso non rifletterà una reale diminuzione del filtrato glomerulare. L’utilizzo dell’esame microscopico delle urine assieme alla misurazione della frazione di escrezione del Na, può essere utile nel distinguere un danno pre-renale da un danno intra-renale, come la necrosi tubulare acuta o la nefropatia da mezzo di contrasto. La frazione urinaria di Na è <1% nelle ipoperfusioni renali, mentre è >2% con presenza di cellule epiteliali tubulari nella necrosi tubulare acuta.
Bisogna tener presente però che patologia prerenale e intrarenale spesso coesistono in Terapia Intensiva, essendo le cause del danno multifattoriali, ovvero una combinazione di sepsi, ipovolemia, farmaci ed instabilità emodinamica. Anche l’IRA in conseguenza del trauma ha diversi meccanismi associati. Shock emorragico, sindrome compartimentale addominale, rabdomiolisi, quando poi non sopraggiunga anche la sepsi.
15
La terapia migliore anche in Terapia Intensiva consiste nella profilassi primaria ovvero nel cercare di evitare il danno. Evitare l’esposizione al mezzo di contrasto quando possibile con metodologie diagnostiche alternative, evitare farmaci nefrotossici, evitare voluminose paracentesi nei pazienti cirrotici, porre particolare attenzione negli interventi che necessitano di bypass cardiopolmonare. Uno stretto controllo della glicemia si è rivelato utile anche nel prevenire l’IRA, anche se non è ancora del tutto chiaro se a essere protettiva sia l’insulina o l’ipoglicemia.
Infine ricordiamoci che i pazienti malnutriti hanno una prognosi peggiore e che i pazienti con IRA sono ipercatabolici con bilancio azotato negativo. Questo comporta sia un catabolismo proteico, che una sintesi deficitaria. Il ricorso tempestivo a una RRT permette, quindi, anche di somministrare un’adeguata nutrizione enterale con il relativo carico idrico (35)
.
3.2 IRA in Medicina Perioperatoria
L’incidenza di IRA nel perioperatorio è simile a quella riportata nella popolazione generale dei pazienti ricoverati in ospedale e varia dall’1% al 5%. In un ampio studio condotto su pazienti precedentemente sani, si è visto che l’incidenza di IRA nel postoperatorio non cardiochirurgico è dello 0.8% ed il ricorso alla RRT è dello 0.1% (36). La mortalità per IRA in generale è elevata e si aggira attorno al 50%. Nel perioperatorio la situazione si aggrava, la prognosi in caso di IRA è molto sfavorevole con una mortalità maggiore che varia dal 64% all’83% a seconda della chirurgia presa in esame.
I fattori di rischio per sviluppare l’IRA perioperatoria sono sempre gli stessi e sono associati allo stato clinico del paziente da una parte e al tipo di procedura dall’altra. Tra questi abbiamo: valori di creatinina sierica e di azotemia elevati nel preoperatorio, età avanzata, funzionalità cardiaca depressa, endocardite batterica attiva, patologia neoplastica avanzata, ipoalbuminemia, malnutrizione ma anche obesità, diabete ed ipertensione arteriosa. La chirurgia in elezione ha un’incidenza più bassa comparata con la chirurgia in regime di emergenza. Un originale studio del SOFA Group dell’European Society of Intensive Care Medicine mostra che i più importanti fattori di rischio per lo sviluppo di IRA sono: insufficienza circolatoria e respiratoria all’ammissione in UTI, età > 65 anni, infezioni, storia di scompenso cardiaco, linfoma, leucemie e cirrosi (37). La patologia cronica polmonare BPCO e la patologia epatica cronica si sono dimostrati dei fattori di rischio indipendenti di sviluppo di IRA nel postoperatorio (4).
16
Le chirurgie a più alto rischio sono la cardiochirurgia, il trapianto di fegato e comunque l’utilizzo della circolazione extracorporea, la chirurgia vascolare maggiore, soprattutto nelle patologie aortiche toracoaddominali con necessità di “clamp” sopra l’arteria celiaca, le nefrectomie ovviamente e la chirurgia urologica maggiore. Anche l’utilizzo della laparoscopia sembra associarsi a danno renale. Valori di pressione intraddominale < 15 mmHg sono considerati sicuri. Nei pazienti ad alto rischio è comunque consigliata la laparoscopia “gasless”.
La protezione renale nel perioperatorio avviene sempre con i medesimi criteri: mantenimento dell’euvolemia con un’adeguata perfusione renale e non utilizzo dei farmaci nefrotossici; non ci sono al momento dei farmaci protettivi consigliati in modo chiaro ed univoco dalla letteratura da poter utilizzare preventivamente (18)(38). Il mantenimento della pressione di perfusione renale nel perioperatorio è molto importante: lo dimostra il fatto che episodi, anche temporanei, di ipotensione intraoperatoria e l’utilizzo di vasopressori o diuretici (sia furosemide che mannitolo) si associano ad insorgenza di IRA nel postoperatorio. Una recente metanalisi ha dimostrato che l’ottimizzazione emodinamica, secondo il criterio della “goal-directed therapy”, riduce significativamente il danno renale postoperatorio nei pazienti ad alto rischio. Sempre la stessa metanalisi non è riuscita a dimostrare, però qual è il monitoraggio corretto e il grado d’invasività appropriato (39). E' importante, quindi, il monitoraggio della volemia mantenendo una MAP > 65 mmHg (valori più elevati di 85 mmHg non danno un ulteriore beneficio), una diuresi > 0.5mL/Kg/ora, la PVC 10-15 mmHg ed eventualmente utilizzare un monitoraggio più invasivo dove indicato. Nella fluidoterapia va preferito il Ringer Lattato, poiché la soluzione salina ad alti dosaggi induce un’acidosi ipercloremica e aggrava l’iperkaliemia. L’amido idrossietilico (HES) sembra essere nefrotossico nei pazienti a rischio con sepsi.
L’ipotensione controllata effettuata con gli alogenati sembra essere più dannosa per il rene rispetto alle anestesie integrate con la peridurale. Altri studi, invece, affermano che gli alogenati sono protettivi con un meccanismo “precondizionante” simile a quanto avviene per il miocardio (18)
. Bisogna evitare l’utilizzo degli ACE inibitori e dei Sartanici nei pazienti ipovolemici. Bisogna limitare alle 48 ore l’infusione con i FANS e comunque non utilizzarli nei pazienti fortemente a rischio. L’aprotinina, un inibitore della serina proteasi che si utilizza per ridurre i sanguinamenti e il ricorso alle emotrasfusioni in chirurgia cardiaca, poi estesa nella grossa chirurgia ortopedica e trapiantologica, dovrebbe essere evitata nei pazienti ad alto rischio (4). L’anestesista è una figura centrale nella prevenzione del danno renale, egli può attuare diversi accorgimenti e anche se non esiste un unico farmaco può comunque cercare di dipanare la matassa del labirintico mondo dell’IRA postoperatoria (38).
17
3.3 IRA IN CARDIOCHIRURGIA
Un milione di pazienti l’anno si sottopone a chirurgia cardiaca; l’AKI occorre in un numero significativo di pazienti: a seconda delle definizioni l’AKI può riguardare fino a più del 30% di pazienti post-cardiotomia. Questa complicazione impatta severamente sul management e sull’outcome (40). Numerosi studi si sono proposti perciò di valutare l’incidenza di IRA dopo CABG,
di identificare i predittori intra e postoperatori di questa complicazione, di valutarne gli effetti sull’outcome in termini di necessità di RRT, di degenza in UTI e di mortalità.
Il Continuous Improvement in Cardiac Surgery Program score (CICSP) è il miglior predittore di IRA in ambito cardiochirurgico. Esso riconosce quali fattori di rischio: bassa frazione di eiezione, chirurgia valvolare, COPD, NYHA IV, malattie vascolari periferiche, l’uso del contropulsatore aortico nel preoperatorio, la pregressa chirurgia cardiaca, l’edema polmonare, la pressione arteriosa superiore a 160 mmHg in caso di chirurgia coronarica, la pressione inferiore a 120 mmHg in chirurgia valvolare e la clearance della creatinina calcolata mediante la formula di Cockroft-Gault. Bove ha analizzato i dati relativi a 5068 pazienti sottoposti a cardiochirurgia con bypass cardiopolmonare dal 1998 al 2002. Sesso, età, chirurgia in regime di emergenza, bassa frazione di eiezione, necessità di uso del contropulsatore aortico, pregressa chirurgia cardiaca, diabete, chirurgia valvolare mitralica, durata del bypass cardiopolmonare e disfunzione renale preoperatoria sono risultati indipendentemente associati all’insorgenza di IRA all’analisi multivariata.
I pazienti che si sottopongono a CABG hanno complessivamente un outcome a breve termine eccellente, mentre in coloro che sviluppano IRA la prognosi è peggiore, soprattutto quando richiedano RRT (41). Inoltre, l’ARF è fattore di rischio per insufficienza respiratoria dopo chirurgia cardiaca e prolunga significativamente sia la degenza in UTI che in ospedale. La prevenzione del deterioramento renale nei pazienti con preesistente insufficienza renale può migliorare morbidità e mortalità dopo chirurgia cardiaca (42).
Il ruolo della disfunzione renale preoperatoria è conseguente alla riduzione della riserva funzionale renale. L’età determina invecchiamento del rene, riduzione della sua funzionalità e della capacità di compenso di eventuali ipoperfusioni. La bassa frazione di eiezione, l’uso dello IABP, gli interventi in emergenza e i reinterventi sono da interpretare quali indici di instabilità emodinamica e quindi di ipoperfusione renale che può verificarsi prima, durante e dopo l’intervento chirurgico.
La circolazione extracorporea è associata a numerose alterazioni nella fisiologia e nella funzione renale. Questi fenomeni sono precipitati dal flusso non pulsatile, dagli insulti micro e
18
macroembolici dovuti a detriti organici e inorganici, dall’aumento delle catecolamine circolanti e dei mediatori dell’infiammazione, dal rilascio di emoglobina libera dai globuli rossi traumatizzati. Durante la circolazione extracorporea si hanno considerevoli diminuzioni (dal 25 al 75%) del flusso ematico renale con conseguente diminuzione della filtrazione glomerulare e aumento delle resistenze vascolari renali; si sviluppano inoltre radicali liberi dell’ossigeno dai neutrofili attivati. L’impatto di questi fenomeni sull’outcome clinico è considerevole, soprattutto se il bypass cardiopolmonare è prolungato. Una necrosi tubulare acuta può essere la conseguenza di una sindrome da bassa portata o di una SIRS (42).
Tra i nuovi marcatori biologici per valutare la funzionalità renale in cardiochirurgia stanno acquisendo importanza IL-18 e il NGAL. IL-18 è una interleukina proinfiammatoria prodotta dall’enzima caspasi-I coinvolta nella patogenesi dell’insufficienza renale acuta: IL-18 si eleva 12 ore dopo il by-pass cardiopolmonare. Il NGAL invece si eleva già dopo sei ore dal by-pass cardiopolmonare. Entrambi questi marcatori sono dei buoni predittori di severità di danno renale dopo intervento cardiochirurgico (4).
Mentre si attendono nuove strategie per proteggere la funzione renale in cardiochirurgia, è necessario mantenere per tutto il periodo perioperatorio un output cardiaco adeguato, una pressione di perfusione e un’oxigen delivery adeguate nei pazienti ad alto rischio (41). Più precisamente una terapia di ottimizzazione emodinamica “goal directed”, similmente al protocollo di Rivers, si è dimostrata essere la più efficace forma di prevenzione e terapia dell’eventuale danno renale. I parametri da tenere maggiormente in considerazione sono la SvO2 > 70%, la pressione di perfusione
MAP tra 70 e 90 mmHg e la gittata sistolica indicizzata >35mL/m2. Altre variabili di cui tener conto in seconda battuta sono una frequenza cardiaca <90bpm, CVP<15mmHg e livelli di lattati < 2mmol/L (43).
Diverse metanalisi hanno analizzato l’utilizzo della dopamina a dosaggio renale nella prevenzione dell’ARF in cardiochirurgia, ma tutte hanno trovato gli stessi risultati negativi (31)
. Numerosi studi hanno valutato i vasodilatatori endovenosi nella prevenzione e nel trattamento del danno renale, ma sono discordi e non ancora conclusivi. Tra i vasodilatatori il Fenoldopam sembra essere la molecola più promettente. Infine lo stress ossidativo correlato alla circolazione extracorporea potrebbe essere attenuato dalla N-Acetilcisteina. Essa fungerebbe da “scavenger” dei radicali liberi, impedendo il danno a carico dei vari organi incluso il rene. Sono necessari comunque studi molto numerosi per evidenziare una reale efficacia di questi farmaci (42).
19
3.4 IRA NEL PAZIENTE EPATOPATICO CON CIRROSI
L’occorrenza di IRA nel paziente epatopatico con cirrosi ne aggrava drasticamente la prognosi. Il 19% dei pazienti cirrotici ricoverati in ospedale sviluppa un’IRA che, nella maggior parte dei casi (68%), è di natura pre-renale. Delle forme di insufficienza pre-renale solo il 25% sono diagnosticabili come sindrome epatorenale (HRS). La necrosi tubulare acuta è molto più comune della HRS tra le cause di IRA, essendone responsabile in più di un terzo dei casi (44).
C’è una notevole interconnessione tra disfunzione renale ed epatica. L’insufficienza renale acuta è una complicazione comune e grave nella cirrosi epatica avanzata e i livelli ematici di creatinina e di azotemia (BUN) sono potenti predittori di mortalità nei pazienti con cirrosi scompensata. I pazienti cirrotici sono a rischio di sviluppare ogni forma di IRA.
- L’IRA pre-renale dovuta a ipoperfusione renale senza iniziale danno glomerulare o tubulare è detta anche azotemia pre-renale ed è rapidamente reversibile se si corregge la causa sottostante. I pazienti cirrotici tuttavia possono sviluppare una forma unica e temibile di IRA, che è la sindrome epatorenale (HRS): talvolta reversibile, è una forma di IRA pre-renale, che però non è responsiva alla fluidoterapia. Nella sua patogenesi hanno un ruolo fondamentale l’ascite e l’ipertensione portale con il rilascio a livello splancnico di NO e di altri vasodilatatori e la conseguente vasodilatazione splancnica e periferica. L’ipovolemia relativa che si viene a creare stimola meccanismi di compenso quali il sistema renina – angiotensina, il sistema nervoso periferico e il rilascio di ormone antidiuretico. Si ha così vasocostrizione sistemica e renale con diminuzione del GFR e aumento del riassorbimento del Na con peggioramento dell’ascite. Con il tempo la vasodilatazione conduce a una sindrome ad alta portata e la risposta del cuore comincia a essere insufficiente. Dati recenti supportano l’idea che la disfunzione epatica, renale e cardiaca siano strettamente interconnesse e portino all’aggravamento del quadro clinico della cirrosi (45)
.
- L’IRA post-renale, dovuta a un’ostruzione del deflusso dell’urina, deve essere prontamente diagnosticata perché il danno è direttamente proporzionale alla durata dell’ostruzione
- L’IRA intrinseca renale è la conseguenza di un danno ai tubuli renali sia ischemico sia tossico; tipica è la necrosi tubulare acuta, dove il danno ischemico al tubulo può essere la conseguenza di un evento ipotensivo dopo un sanguinamento o una sepsi severa, oppure il danno al tubulo può essere tossico secondario all’utilizzo di aminoglicosidi. L’IRA intrinseca renale è anche la conseguenza di un danno all’interstizio (autoimmune o allergico) oppure un
20
danno ai vasi o al glomerulo. Recentemente si è scoperto che nell’ESLD da cirrosi indotta da epatite C si associa spesso una glomerulosclerosi da immunocomplessi (46).
La diagnosi differenziale tra le diverse forme di IRA non è facile anche perché nella maggior parte dei casi coesistono e si aggravano reciprocamente.
La diagnosi di HRS si basa sull’esclusione di ogni altra causa di AKI e non ci sono test specifici. I criteri diagnostici maggiori di HRS (47) sono i seguenti:
Insufficienza epatica e ascite, Creatininemia > 1.5 mg/dl,
Assenza di shock, di infezione batterica, di farmaci nefrotossici o di disidratazione, Nessun miglioramento dopo sospensione del diuretico e dopo fluidoterapia,
Proteinuria < 500 mg/ 24 h, assenza di anormalità ecografiche.
Ci sono due sottotipi di HRS con caratteristiche differenti e differenti implicazioni prognostiche:
- Tipo 1: rapidamente progressiva, con creatininemia che raddoppia e supera i 2.5 mg/dl o con clearance della creatinina che si riduce del 50% e a meno di 20 ml/min in meno di due settimane. Spesso si presenta nel paziente che si ricovera per un evento precipitante (infezione batterica, sanguinamento gastrointestinale, recente chirurgia, paracentesi evacuativa, epatite acuta, insufficienza epatica sintomatica con ittero, coagulopatia, encefalopatia e disfunzione circolatoria);
- Tipo 2: è la forma più “cronica”, caratterizzata da stabilità e da una lenta progressiva crescita della creatininemia nel paziente ascitico domiciliare. Questa forma, però, non rientra nei criteri diagnostici di IRA.
La mortalità è più alta nella HRS tipo 1 con una sopravvivenza mediana di 2-4 settimane vs i 5-6 mesi della HRS tipo 2 (48).
Lo sviluppo di HRS in presenza di cirrosi è una complicanza devastante con impatto su morbidità e mortalità: la presenza di HRS pretrapianto correla con un maggior numero di complicazioni, ricovero in UTI prolungato e maggiore mortalità rispetto alla sua assenza (49)(50).
Non tutti gli indici di severità utilizzati in Terapia Intensiva sono attendibili nel paziente cirrotico. Il SOFA (Sequential Organ Failure Assessment) e il MELD (Model for End stage Liver
21
Disease) hanno un valore prognostico maggiore dell’APACHE (Acute Physiology and Chronic Health Evaluation) e del CTP (Child-Turcotte-Pugh). I primi due, infatti, tengono conto nella loro valutazione dei valori di creatinina e della funzionalità renale, importanti predittori di mortalità nel paziente con cirrosi (51).
Il trattamento dell’IRA nel paziente cirrotico non è comunque facile e dipende dalla causa e dalla severità. La migliore terapia resta la prevenzione, identificando già la fase di danno renale (AKI), individuandone e trattando le cause specifiche (un sanguinamento gastrointestinale, farmaci nefrotossici, mezzo di contrasto, infezioni batteriche, sepsi, malnutrizione, iper o ipoglicemia). L’IRA pre-renale deve essere trattata con il riempimento volemico e l’immediata sospensione dei diuretici, del lattulosio (perché causa frequente di diarrea con perdita di liquidi) ed eventuali vasodilatatori. La causa di ipoperfusione dovrebbe essere sempre ricercata e trattata prontamente. Ad esempio, nel sanguinamento gastrointestinale le trasfusioni e i plasma expanders dovrebbero essere somministrati in modo aggressivo e sempre con un attento monitoraggio emodinamico. E’ essenziale mantenere adeguati i parametri emodinamici e il volume intravascolare: così si ottimizza la perfusione renale e si preserva la funzione renale. Evitare i farmaci nefrotossici quando possibile, soprattutto i FANS e gli aminoglicosidi. Prima di esami con mezzo di contrasto, quando non possono essere evitati, utilizzare la profilassi con idratazione ed N-Acetilcisteina (per os o endovena). Trattare sempre la peritonite batterica subacuta con cefotaxime e albumina. Evitare paracentesi evacuative senza la contemporanea somministrazione di albumina.
Visto il meccanismo d’azione della HRS, i vasocostrittori analoghi della vasopressina, come la terlipressina e l’ornipressina, o gli analoghi della somatostatina come l’octreotide o gli alfa adrenergici come il midodrine, se somministrati assieme all’albumina si sono dimostrati efficaci nel contenere il danno e la progressione della malattia, probabilmente perché agiscono soprattutto a livello splancnico. La terlipressina, in particolare, è preferita rispetto agli altri analoghi della vasopressina perché ha una minore incidenza di effetti collaterali a livello cardiaco e perché non richiede un’infusione endovenosa continua, anche se ultimamente si è visto che l’infusione continua, a bassi dosaggi, si correla ad ancor minori effetti collaterali a livello cardiocircolatorio (52). L’albumina oltre che come plasma espander, funziona anche perché si lega alle sostanze vasodilatatrici presenti in circolo. Qualche speranza sembrerebbe derivare anche dalla combinazione di midodrine e di octreotide, che hanno il vantaggio di poter essere somministrate per os oppure sottocute (50). Anche la noradrenalina ha dimostrato di migliorare la disfunzione emodinamica presente nella HRS e secondo alcuni recenti studi sarebbe paragonabile alla terlipressina (53). Nonostante gli interventi terapeutici, il tasso di mortalità è elevato nei cirrotici che vengono
22
ricoverati in UTI, sia che presentino IRA all’ammissione sia che la sviluppino durante la degenza: solo le misure di prevenzione dell’IRA è dimostrato che migliorino la prognosi (54)
.
Tentativi di vasodilatazione arteriosa renale con fenoldopam, dopamina o prostaglandine non si sono dimostrati efficaci (55).
Se la HRS progredisce in insufficienza renale franca, si rende necessaria la terapia sostitutiva renale ed eventualmente sistemi di supporto artificiale (MARS, SPAD, etc.).
La terapia definitiva è però il trapianto di fegato. Nei pazienti con HRS prolungata può essere necessario il trapianto sia epatico che renale (49). In generale, pazienti con ARF ma senza necessità di RRT possono ricevere trapianto epatico isolato; nei pazienti con insulto renale persistente, una durata superiore a dodici settimane è la soglia per valutare il duplice trapianto epatorenale; se tuttavia l’ARF è secondaria a HRS e/o AKI, la necessità di sei settimane di dialisi è stata di recente definita la soglia per una ridotta o assente capacità renale di recupero: i candidati a dialisi per meno di sei settimane possono quindi ricevere un trapianto epatico isolato (56). Ci potrebbero essere anche pazienti con riduzione del GFR non in RRT che potrebbero beneficiare del duplice trapianto: questi pazienti possono essere identificati da una biopsia renale che valuti la severità della patologia renale e predica la funzionalità renale a lungo termine. Linee guida basate su studi di popolazione hanno suggerito che i pazienti con glomerulosclerosi maggiore del 30%-35% o fibrosi interstiziale maggiore del 25%-30% indipendentemente dalla causa possono essere considerati per il trapianto combinato (57).
Dei pazienti con HRS, dopo il trapianto epatico si ha recupero della funzione renale nel 77% dei casi, necessità di RRT nell’8-17% con una percentuale accresciutasi ulteriormente nel tempo a causa di pazienti con maggiori comorbidità che vengono oggi sottoposti a trapianto.
Infine i pazienti che non sono candidabili al trapianto possono comunque beneficiare della TIPS (Transjugular Intrahepatic Portosystemic Shunt). Se eseguita in seguito alla terapia farmacologica si è dimostrata prolungare la sopravvivenza dei pazienti con HRS. La TIPS, infatti, migliora l’ipertensione portale ed aumenta la volemia (58)
23
3.5 IRA NEL PAZIENTE SOTTOPOSTO A TRAPIANTO ORTOTOPICO DI FEGATO (OLT).
L’insufficienza renale acuta, anche se temporanea o lieve, è un importante fattore di rischio nel trapianto ortotopico di fegato: essa determina un impatto negativo sulla sopravvivenza del paziente e sul trapianto. L’IRA aumenta la mortalità dei pazienti in lista d’attesa ed è poi una complicazione frequente dopo il trapianto epatico, con un’incidenza che nella letteratura varia dal 12 al 70% (59) o addirittura dal 48 al 94% secondo Yalavarthy (60). In particolare, inoltre, la mortalità può raggiungere il 40-90% quando si rende necessaria una RRT (9-33% dei pazienti) (61).
Lo studio di Junge fa vedere come sia difficile a volte confrontare i dati a causa di definizioni più o meno stringenti di ARF e a causa di differenti criteri di inclusione/esclusione dei pazienti negli studi: Junge arriva infatti ad affermare che, al contrario, l’IRA che si sviluppa dopo OLT dimostra una buona prognosi, con il ritorno ad una situazione di compenso entro 4 settimane dalla chirurgia nel 97% dei casi (62). Tuttavia anche in Brasile Afonso et al. con la sua analisi dettagliata descrive un’incidenza elevata di danno renale post-OLT del 41.52%. Egli dimostra che una disfunzione renale preoperatoria correla con maggior incidenza di ARF postoperatoria, distinguendo i pazienti con funzione renale normale o moderatamente compromessa, che hanno sopravvivenza simile, dai pazienti in cui la funzione renale è severamente compromessa. Questi pazienti, una volta sviluppata un’ARF severa, ne risentono in termini di sopravvivenza a medio e lungo termine e questo anche indipendentemente dalla funzionalità renale preoperatoria (63).
La mortalità dopo OLT aumenta modestamente (<2 volte) in presenza di ARF pre-trapianto, al contrario incrementa addirittura di più di otto volte nel caso di ARF che insorge dopo il trapianto; la mortalità non è influenzata dal tipo di RRT usata. I pazienti che non presentano mai disfunzione renale hanno invece una mortalità intraospedaliera solo del 5%. Dopo OLT aumenta anche il rischio di insufficienza renale cronica (CKD), soprattutto per la tossicità degli inibitori della calcineurina (ciclosporina e tacrolimus) (60). D’altronde l’insufficienza renale cronica, come vedremo più avanti, è una conseguenza quasi inevitabile nei pazienti che necessitano di RRT intraoperatoria (64).
Infine lo studio di O’Riordan utilizza i criteri comunemente concordati della classificazione RIFLE per valutare l’incidenza e i fattori di rischio di IRA nel trapianto di fegato. Questo nel tentativo di uniformare e rendere comparabili i dati. Anche considerando questi criteri il danno renale acuto (AKI) e l’insufficienza renale acuta (ARF), sono complicazioni frequenti dopo trapianto, rispettivamente 11.1% per l’AKI e 25.7% per l’ARF. Inoltre hanno rilevato anche che questi due diversi gradi di malattia renale hanno fattori di rischio distinti e l’ARF ha serie
24
conseguenze cliniche, in termini di mortalità e degenza in terapia intensiva. Ipertensione ed epatopatia alcolica sono fattori di rischio per l’AKI; elevata creatininemia pre-OLT, uso di inotropi e di aminoglicosidi sono fattori di rischio per la ARF. L’ARF ma non l’AKI ha impatto sulla sopravvivenza a trenta giorni e a un anno e su una prolungata degenza ospedaliera (65).
Il trapianto epatico è ora considerato la terapia di scelta per un ampio raggio di patologie epatiche croniche prima fatali. Ottimizzare il timing del trapianto è importante per non intervenire troppo precocemente o troppo tardivamente e quindi rendere futile l’intervento. La grave prognosi di un’ARF preoperatoria è stata presa in considerazione nel MELD score per assegnare con priorità un organo ai pazienti in lista d’attesa. L’uso del MELD score ha aumentato il numero di pazienti con IRA che si presentano al trapianto.
Il Model for End-Stage Liver Disease (MELD) è stato introdotto per quantificare il rischio di morte dovuto alla patologia epatica; i principali componenti di tale modello sono la bilirubina, l’INR e la creatininemia. La creatininemia ben correla con la mortalità a tre mesi nei pazienti cirrotici senza OLT. Con l’introduzione del MELD score si è cercato di dare la priorità tra i pazienti in lista a quelli con patologia epatica pretrapianto più severa in generale e peggior funzione renale in particolare, per cercare con il trapianto di migliorare anche la condizione del rene. Il MELD score ha aumentato il numero di pazienti che presentano creatininemia preoperatoria >2mg/dL o in RRT al momento del trapianto.
Durante il trapianto di fegato il danno renale può essere di tipo sia renale sia pre-renale sia post-renale. Inoltre la procedura chirurgica è a rischio di IRA in tutte le sue fasi: all’induzione, nella fase anepatica e nel post-operatorio. Diverse sono le cause e possono agire insieme e successivamente tanto da parlare di multifattorialità. L’insufficienza renale post-OLT, ad esempio, può essere causata da: a) ipoperfusione renale conseguente a una ridotta pressione di perfusione (o ad un aumento delle resistenze vascolari renali) correlata allo sviluppo di una sindrome epatorenale, b) ridotta perfusione del parenchima renale a seguito di perturbazioni emodinamiche durante la fase perioperatoria o, infine, c) nel post-operatorio, a seguito di eventi quali ipotensione, coagulopatia, ipovolemia, necessità di trattamento con farmaci nefrotossici (antibiotici, mezzi di contrasto, farmaci immunosoppressori) e ipertensione addominale.
FATTORI CHE INFICIANO LA FUNZIONE RENALE NEL PERIOPERATORIO (66): A. Fattori pre-trapianto:
25 o Sindrome epatorenale
o Elevati livelli di bilirubina o Ipoproteinemia, ipoalbuminemia o APACHE II score
o Iponatriemia B. Fattori intraoperatori:
o Instabilità emodinamica durante la fase di induzione dell’anestesia e nella fase anepatica
o Tecniche chirurgiche (con o senza bypass venovenoso vs tecnica piggyback) o Fattori di rischio convenzionali
C. Fattori di rischio post-operatori:
o Necrosi tubulare acuta secondaria ad insulti ischemici o tossici o Mancata funzionalità del fegato trapiantato (immediata o ritardata) o Sindrome da riperfusione
o Nefropatia da contrasto
o Nefrite interstiziale farmaco-indotta
o Uso prolungato di dopamina o vasopressori o Infezioni batteriche
o Reintervento
o Entità di emotrasfusioni perioperatorie
o Terapia immunosoppressiva con inibitori della calcineurina (ciclosporina e tacrolimus)
o Associazioni farmacologiche (es. uso di antibiotici multipli può indurre nefrite interstiziale)
Come abbiamo visto, la disfunzione renale pretrapianto è associata con una ridotta sopravvivenza non solo prima durante e a breve termine dopo il trapianto, ma anche a lungo termine per una correlazione con l’insufficienza renale cronica post-trapianto. Sia AKI che CKD dopo OLT sono associate con prolungata degenza in UTI e in ospedale, con necessità di dialisi post-operatoria, con complicanze infettive, con rigetto acuto, con ridotta sopravvivenza.
La funzione renale pretrapianto è ben dimostrato essere predittore della sopravvivenza post-OLT: creatininemia > 1.5 mg/dl e GFR < 50 mL/min sono fattori di rischio indipendenti; sono inoltre importanti le caratteristiche del centro trapiantologico, fattori perioperatori (fattori di rischio indipendenti sono l’elevato numero di emotrasfusioni, tempo di ischemia >8 ore, encefalopatia