INDICE
RIASSUNTO 1
ABSTRACT 3
1. INTRODUZIONE 4
1.1 Le cellule staminali (CS) nel cervello embrionale ed adulto 4 1.1.1 Le cellule neuroepiteliali NEP 4 1.1.2 Le cellule della Glia Radiale (GR) 6 1.1.3 Le cellule staminali nel cervello adulto 7 1.2 Le CS embrionali (ES) come fonte di cellule staminali del
cervello 9
1.2.1 Derivazione delle cellule ES 9 1.2.2 Differenziamento delle cellule ES verso un destino neurale 10
1.3 Generazione di fonti espandibili di cellule staminali neurali 12
1.4 I trapianti come strumento per valutare le capacità di
integrazione e differenziamento delle CS neurali 15 1.4.1 CS neurali non amplificate ex vivo 16
1.4.2 CS immortalizzate 16
1.4.3 CS neurali da tessuto fetale 19
1.4.4 CS neurali derivate da cellule ES 20
2. OBIETTIVO DELLA TESI 26
3. RISULTATI 28
3.1 Trapianto di cellule NS in ippocampo di topo adulto: generazione di cellule con morfologia ed orientamento
tipico dei neuroni endogeni 28
3.1.1 Analisi del comportamento di cellule NS Cor1 GFP dopo 28 trapianto in ippocampo
3.1.2 Analisi del comportamento di cellule NS-ES LC1 GFP 30 dopo trapianto in ippocampo
3.1.3 Analisi della morfologia e quantificazione di cellule 32 Cor1 GFP dopo trapianto in ippocampo
3.1.4 Analisi del comportamento di diverse linee di NS dopo 33 trapianto in ippocampo
3.2 Il comportamento delle cellule donatrici dopo 34 trapianto in ippocampo è indipendente dalle proprietà
del tessuto ricevente
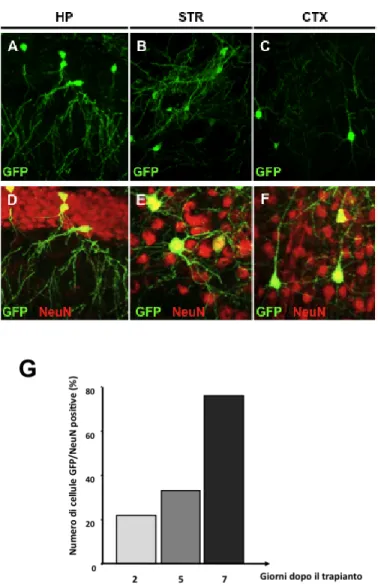
3.3 Le cellule GFP+/NeuN+ mostrano morfologia identica 35 ai neuroni endogeni anche dopo trapianto in striato e
corteccia cerebrale
3.4 La generazione di neuroni GFP+ in seguito a trapianto 37
non è dovuta ad un trasferimento genico o proteico da cellule donatrici NS e cellule endogene
dovuta al verificarsi di un evento di fusione tra cellule NS trapiantate e cellule dell’ospite
3.6 Le cellule NS Cor1 GFP non fondono con cellule gliali e 42 microgliali
3.6.1 Analisi per marcatori gliali e microgliali in vivo 42
3.6.2 Analisi per marcatori gliali e microgliali in vitro 44 mediante esperimenti di co-coltura
3.7 Le cellule NS trapiantate fondono con elementi neuronali 46 sia in vivo che in vitro
3.7.1 Analisi mediante marcatura con la BrdU in vivo 46
3.7.2 Analisi in vitro mediante esperimenti di co-coltura 48
4. MATERIALI E METODI 50
4.1 Linee e colture cellulari 50
4.2 Derivazione astrociti primari e cellule microgliali 51
4.3 Derivazione colture primarie di ippocampo 51
4.4 Preparazione co-colture 52
4.5 Animali 52
4.6 Trapianti e processamento tessuti 53
4.7 Immunoistochimica 53
4.8 Ibridazione in situ 54
4.10 Analisi delle immagini 54
4.11 Esperimenti di Time-lapse 55
5. DISCUSSIONE 56
5.1 La comparsa del fenotipo neuronale non è dovuto a 57 passaggio di materiale genico o proteico tra cellule
donatrici e cellule endogene
5.2 La comparsa del fenotipo neuronale è il risultato della 59 fusione tra cellule NS donatrici e cellule endogene
5.3 La fusione è indipendente dalla linea cellulare di NS 60 trapiantata e dalla risposta immunitaria dell’ospite
5.4 La fusione è un evento cellula-specifico 62
5.5 La fusione genera cellule ibride con un singolo nucleo 63
6. RINGRAZIAMENTI 66
7. BIBLIOGRAFIA 67
RIASSUNTO
Le cellule staminali (CS) neurali sono diventate uno strumento promettente da utilizzare nella ricerca di base e nella medicina rigenerativa.
Studi condotti mediante trapianto intracerebrale di CS neurali hanno mostrato come queste cellule siano in grado di assumere un fenotipo neuronale specifico della zona cerebrale in cui esse vengono trapiantate e di essere capaci a stabilire connessioni neurali verso i bersagli corretti.
In questo lavoro, sono state studiate le competenze neurogeniche e capacità integrative di CS neurali denominate NS (‘Neural Stem’), precedentemente caratterizate nel laboratorio dove ho svolto la tesi di dottorato, sottoposte ad un pre-differenziamento neurale in vitro e poi trapiantate in cervello di topi wilde-type adulti.
I risultati ottenuti mostrano che dopo trapianto di cellule NS GFP in ippocampo, e meno frequentemente, in striato e corteccia, un buon numero di cellule GFP+ acquisiscono un fenotipo neuronale con caratteristiche morfologiche tipiche
del sito dove sono state trapiantate divenendo indistinguibili dai neuroni endogeni. Tuttavia, analisi approfondite hanno dimostrato che il fenotipo neuronale osservato è il risultato della fusione cellulare tra cellule NS trapiantate ed elementi neuronali residenti, che lo stesso fenotipo si osserva in seguito a trapianto di sei diverse linee di cellule NS, e che sembra essere un fenomeno rapido (7 giorni dopo il trapianto) capace di persistere nel tempo, visto che si osservano cellule GFP+ anche 18 mesi
dopo il trapianto. Inoltre la fusione si mostra come evento cellula-specifico in quanto non tutte le tipologie cellulari sono in grado di andare incontro a fusione cellulare con le NS, le cellule microgliali e gli astrociti non risultano coinvolti in questo processo. Mentre si osserva la formazione di cellule GFP+ con morfologia neuronale tipica delle cellule dei granuli del giro dentato dell’ippocampo come risultato di fusione tra cellule NS GFP e neuroni ippocampali sia maturi che di nuova generazione. Questo inaspettato fenotipo fusogenico delle cellule NS è stato osservato anche in vitro in co-colture cellulari tra cellule NS e progenitori
ippocampali derivati da tessuto cerebrale embrionale murino a E18 ma non in co-colture con astrociti primari e cellule microgliali.
La fusione di cellule staminali neurali NS donatrici con elementi neuronali endogeni evidenzia una proprietà biologica sottostimata del tessuto nervoso che potrebbe rivelarsi interessante per studi di base e terapeutici.
ABSTRACT
Neural stem cells (NSCs) have become promising tools for basic research and regenerative medicine. Intracerebral transplantation studies have suggested that these cells may be able to adopt neuronal phenotypes typical of their engraftment site and to establish appropriate connections in the recipient circuitries. Here, we examined the in vivo neurogenic competence of well-characterized Neural Stem (NS) cell lines subjected to in vitro priming and subsequent implantation into the adult intact mouse brain.
Upon implantation into the hippocampus and, less frequently, in the striatum and in the cerebral cortex, numerous GFP-tagged cells acquired differentiated features indistinguishable from resident neurons. However, we found that this outcome resulted from fusion of donor cells with local neuronal elements generating long-term persistent GFP+ neuronal hybrids. This phenotype is also observed follow transplantation in hippocampus of six different NS cell lines, and seems to be cell-type specific, indeed the fusion appears 7 days after transplantation only between NS cells and neuronal elements but none with astrocytes or microglia cells. Similar findings were consistently obtained with different mouse recipients and donor cell labelling methods. This fusogenic behaviour of NS cells was unexpected and also observed in vitro in co-culture of NS cells with E18 hippocampal immature neural cells, but not with microglia or astrocytes. Similar findings were consistently obtained with different NS cell lines, mouse recipients and donor cell labelling methods.
The frequent and cell type-specific fusion of donor NS cells with host neurons highlights a previously underestimated biological property of the nervous tissue that might prove profitable for basic and therapeutically oriented studies.
1. INTRODUZIONE
1.1 Le cellule staminali nel cervello embrionale ed adulto.
Uno degli obiettivi della biologia delle cellule staminali (CS) è quello di approfondire la conoscenza delle caratteristiche biologiche e funzionali di queste cellule, al fine di accumulare informazioni trasponibili in ambito biomedico per lo sviluppo di terapie di sostituzione cellulare o di reclutamento delle CS endogene. Le CS costituiscono infatti una fonte inesauribile di cellule in grado di rigenerare tutti i tipi cellulari specializzati e funzionalmente attivi di un tessuto. In particolare, le CS neurali suscitano grande interesse nei ricercatori, poiché rappresentano un valido strumento sia per indagare i meccanismi molecolari alla base dello sviluppo del sistema nervoso, sia per il loro potenziale utilizzo terapeutico in patologie neurodegenerative ad oggi farmacologicamente intrattabili.
Vista la mancanza di marcatori specifici le CS neurali vengono definite mediante criteri operativi e funzionali come cellule caratterizzate da:
• capacità di auto-rinnovamento. Questa rappresenta la proprietà che permette alle CS neurali di generare, mediante divisioni cellulari simmetriche, due cellule figlie identiche alla cellula originale;
• mantenimento della multipotenza, ossia la capacità di dare origine a tutti i tipi cellulari specializzati del tessuto nervoso quali neuroni, astrociti ed oligodendrociti (Gage, 2000).
La presenza di CS neurali è stata riscontrata in vivo sia durante lo sviluppo del sistema nervoso centrale (SNC) sia nel cervello adulto di mammiferi. In particolare durante lo sviluppo, sono state descritte diverse tipologie di popolazioni di staminali neurali: le cellule neuroepiteliali (NEP); le cellule della glia radiale e le cellule staminali adulte.
1.1.1 Le cellule neuroepiteliali NEP
Durante lo sviluppo del sistema nervoso, la piastra neurale e successivamente il tubo neurale, sono composti da un singolo strato di cellule, le
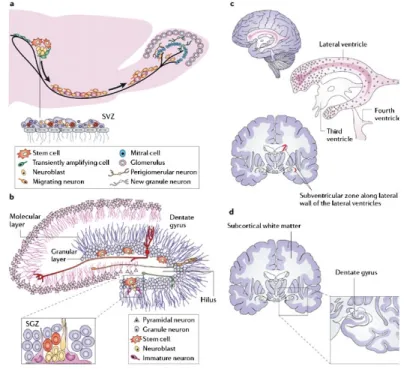
cellule neuroepiteliali (NEP). La placca neurale origina dalle cellule dell’ectoderma dorsale che sono indotte dal sottostante mesoderma a dare origine alle cellule neuroectodermiche. I margini distali della placca neurale nelle fasi di sviluppo successive (circa 9 giorni di vita embrionale nel topo o 21 giorni di gestazione nell’uomo) si ispessiscono e migrano verso la linea mediana fino a fondersi a formare il tubo neurale sito al di sotto dell’ectoderma (Fig. 1). L’epitelio ventricolare costituisce la zona proliferativa. Le cellule NEP rivestono le pareti dei ventricoli encefalicie sono presenti nelle fasi precoci di sviluppo precedenti la neurogenesi, a partire da E9 nel telencefalo del topo. Durante questa prima fase le cellule NEP si dividono simmetricamente espandendosi e solo nella fase di neurogenesi, da E10 a E17 nel topo, vanno incontro a divisioni asimmetriche che origineranno neuroni ed altri precursori neurali. L’epitelio ventricolare germinativo appare come una struttura pseudo-stratificata in quanto costituita da un singolo strato di cellule neuroepiteliali che prendono contatto da un lato con la superficie apicale verso il lume dei ventricoli e dall’altro con la superficie piale a livello basale. Lungo questo asse apico-basale i nuclei delle cellule si muovono a seconda della fase del ciclo cellulare per migrazione nucleare intercinetica. Queste cellule appaiono polarizzate ed infatti esprimono marcatori diversi nelle diverse parti della cellula, come ad esempio la prominina (o CD133) a livello della superficie apicale verso la cavità interna del tubo neurale, l'integrina α6 sul lato basale e le giunzioni strette e aderenti nella membrana laterale.
1.1.2 Le cellule della glia radiale (GR)
Con il procedere della neurogenesi le NEP perdono alcune caratteristiche epiteliali ed iniziano ad esprimere marcatori astrogliali originando un tipo cellulare collegato ma distinto dal precursore neuroepiteliale: le cellule della glia radiale (GR) (Goetz e Huttner, 2005). La GR condivide con le cellule NEP la morfologia bipolare e la migrazione nucleare intercinetica. I nuclei delle cellule della GR non si muovono lungo tutto lo spessore del tubo neurale, ma rimangono confinati verso la regione apicale che risulta densamente arricchita di nuclei cellulari e viene definita zona ventricolare (VZ). Una regione al confine con la VZ verso l'interno viene invece definita zona subventricolare (SVZ) e presenta l'accumulo di neuroni postmitotici generati dalle cellule NEP e di un numero crescente di progenitori basali, così definiti proprio perchè si dividono sul lato basale della VZ (Malatesta et al., 2008) (Fig. 2). Le principali differenze che distinguono le cellule della GR dai NEP risiedono nelle proprietà gliali della GR. Infatti, mentre l'espressione di marcatori neurali come Nestin e RC2 è una caratteristica comune, l'espressione di marcatori tipici degli astrociti maturi è una peculiarità delle cellule della GR. Tra le caratteristiche astrocitarie della GR rientrano la presenza di granuli di glicogeno, l'espressione di GLAST (Glutamate Astrocyte-Specifc Transporter), BLBP
(Brain-Lipid Binding Protein), Vimentina (proteina dei filamenti intermedi), della proteina
S100b che lega il Calcio, della molecola di adesione Tenascina-C e in alcune specie anche di GFAP (il promotore di GFAP nelle cellule della GR è attivo nei primati, ma non nei roditori). Per molto tempo la GR è stata considerata una componente strutturale con la funzione di guidare i neuroni di nuova generazione verso il luogo di maturazione definitiva, ma è stato dimostrato che le cellule della GR sono la principale fonte di neuroni in diverse regioni del sistema nervoso centrale (Malatesta et al., 2000). Il contributo alla neurogenesi da parte della GR non è limitato esclusivamente al periodo di sviluppo, ma continua anche dopo la nascita. Attraverso studi di marcatura della discendenza cellulare è stata tracciata una connessione tra le cellule della GR ed i precursori neuronali presenti nel cervello adulto. È stato infatti dimostrato che cellule della GR presenti nella VZ di topi
post-natali (P1) danno origine agli astrociti della SVZ che sostengono la neurogenesi nel cervello adulto di mammiferi (Merkle et al., 2004).
Figura 2. Diverse popolazioni di progenitori neurali nel cervello fetale, post-natale e adulto. Le cellule neuroepiteliali presenti in tempi precoci di sviluppo (a) danno origine alla GR (blu) che durante la neurogenesi embrionale produce gran parte dei neuroni del cervello (b). Le CS neurali possono infatti produrre progenie neuronale direttamente o attraverso la formazione di progenitori intermedi (verde) che popolano la zona subventricolare. Le cellule della GR persistono nel periodo post-natale e vanno incontro a modificazioni morfologiche (c) che le porteranno a trasformarsi in cellule astrocitarie di tipo B che costituiscono le CS neurali adulte presenti nella SVZ (d). (Merkle et al., 2006)
1.1.3 Le cellule staminali nel cervello adulto
La neurogenesi non avviene solo durante lo sviluppo, ma anche nell’adulto si verifica la produzione di nuovi neuroni grazie alla presenza di cellule staminali situate in particolari zone germinative. Le prime evidenze di questo evento risalgono agli anni Ottanta, in seguito alla scoperta di attività neurogenica a livello del nucleo di controllo del canto nell’iperstriato ventrale del canarino adulto (Goldman e Nottebohm 1983). Successivamente, sono state identificate due aree neurogeniche nel cervello adulto dei mammiferi: la zona subventricolare (SVZ) a livello dei ventricoli laterali nel telencefalo e la zona subgranulare (SGZ) nel giro dentato dell’ippocampo (Gage et al., 1998) (Fig. 3). Nei roditori, le CS site nella SVZ
generano catene di neuroblasti che migrano anteriormente fino a raggiungere l’epitelio olfattivo dove differenziano originando nuovi neuroni olfattivi che rimpiazzano quelli che fisiologicamente vengono persi. La SVZ rappresenta una struttura peculiarmente organizzata sia a livello morfologico che cellulare. Essa è infatti costituita da quattro tipologie cellulari: i neuroblasti migranti (cellule di tipo A), i precursori immaturi (cellule di tipo C), gli astrociti (cellule di tipo B) e le cellule ependimali (cellule di tipo E) (Doetsch et al., 1997). Dalla scoperta dell’esistenza di cellule proliferanti, fonti di nuovi neuroni nell’adulto, i ricercatori hanno concentrato gli sforzi nel capire come identificare e isolare a scopi terapeutici le CS neurali. L’identità delle CS neurali nella SVZ ha rappresentato un campo di attiva ricerca con risultati spesso contrastanti. Ad oggi, i ricercatori sono tuttavia concordi nell’affermare un’origine non ependimale delle CS neurali ed ad identificarle negli astrociti (cellule di tipo B) del subependima (Doetsch et al., 1999).
Figura 3. Rappresentazione schematica della localizzazione e struttura della zona subventricolare (SVZ) e subgranulare (SGZ) del cervello adulto nei roditori e nell’uomo. a) La SVZ costituisce la più grande area neurogenica dell’adulto. Essa riveste i ventricoli laterali del telencefalo la cui localizzazione nel cervello è mostrata nella sezione c). Da
quest’area le cellule di nuova generazione migrano tangenzialmente verso i bulbi olfattori. b) Un’ulteriore regione neurogenica nell’adulto è costituita dalla SGZ che si trova nel giro dentato dell’ippocampo. I neuroni che originano da quest’area si integrano funzionalmente nello strato delle cellule dei granuli. La localizzazione dell’ippocampo nel telencefalo è riportata in d). (Vescovi et al., 2006)
1.2 Le CS embrionali (ES) come fonte di CS del cervello
1.2.1 Derivazione delle cellule ES
Un approccio alternativo per l’ottenimento di CS/precursori neurali in coltura è rappresentato dall’utilizzo di cellule CS embrionali (ES), evitando quindi il ricorso al tessuto fetale o adulto. Le cellule ES, isolate per la prima volta dal topo da Martin ed Evans (Evans e Kaufman, 1981; Martin 1981) e più recentemente anche dall’uomo da Thomson (Thomson et al., 1998), sono cellule pluripotenti, in grado di dare origine a tutti i tessuti di un organismo derivanti dai tre foglietti germinativi (endoderma, mesoderma ed ectoderma), eccetto i tessuti extraembrionali. Le cellule ES vengono ottenute in coltura esclusivamente a partire da embrioni pre-impianto allo stadio di blastocisti e piu’ propriamente dalla massa cellulare interna (MCI) della blastocisti stessa. Le cellule ES possono essere coltivate in vitro mantenendo le loro caratteristiche di pluripotenza a lungo termine anche dopo diversi passaggi. Le condizioni ottimali per la coltura stabile delle CS embrionali murine sono state definite in modo preciso. Infatti, esse sono dipendenti dalla presenza di LIF (Leukaemia Inhibitory Factor) in combinazione con siero o BMP (Bone
Morphogenetic Protein). Tuttavia, si sono evidenziate divergenze tra le condizioni
di crescita delle cellule ES murine e quelle umane, dimostrando che non è possibile traslare interamente le informazioni biologiche e molecolari dalla prime alle seconde. Infatti, diversamente dalle cellule ES murine, quelle di natura umana non dipendono dal LIF per il loro mantenimento, ma piuttosto si sono dimostrate essere dipendenti dall'FGF-2 e dalla presenza di un feeder layer di cellule che fungono da cellule di “sostegno” alla crescita.
Negli ultimi anni molti ricercatori hanno esplorato fonti alternative, rispetto alla blastocisti, per la generazione di linee di staminali pluripotenti umane sia per
evitare la complessità di reperimento e la scarsa efficienza della derivazione da blastocisti, sia per scongiurare il dibattito etico sull’utilizzo delle blastocisti di origine umana ai fini di ricerca.
Nel 2006 queste problematiche sono state potenzialmente risolte grazie ad un nuovo metodo di induzione della pluripotenza in cellule somatiche mediante l’espressione di pochi e specifici fattori (Takahashi e Yamanaka et al., 2006; Okita et al., 2007; Wernig et al., 2007). Infatti, il gruppo del Prof. Yamanaka è riuscito a riprogrammare dei fibroblasti murini ad uno stato di pluripotenza simile a quello delle cellule ES tramite trasduzione di particelle retrovirali veicolanti quattro geni:
Oct4, Sox2, c-myc e Klf4. Le cellule pluripotenti ottenute mediante questa procedura
sono state definite cellule iPS (ossia “staminali pluripotenti indotte”) (Yamanaka et al., 2007). È stato inoltre riportato che anche solo due fattori, Oct4 e Sox2, insieme all’aggiunta di acido valproico, un inibitore delle istone deacetilasi, sono sufficienti per l’ottenimento delle cellule iPS (Huangfu et al., 2008). Recenti studi hanno dimostrato che anche una diversa combinazione di fattori (Oct4, Sox2 e Lin28) possono portare alla riprogrammazione da cellule somatiche umane (Hyun et al., 2007). Questi ultimi risultati sostengono l'idea che gli oncogeni c-myc e klf4 non siano essenziali per il processo di riprogrammazione. Rispetto alla derivazione di cellule staminali dalla blastocisti, questo approccio permetterebbe di ottenere facilmente cellule pluripotenti ad hoc, per esempio da pazienti, per poi differenziarle verso il tipo cellulare necessario ad un eventuale terapia cellulare sostitutiva. Permangono tuttavia ancora una serie di problematiche da affrontare prima di poter pensare ad affrontare un processo di traslazione verso la clinica. Oltre alle problematiche tecniche già proprie delle cellule ES, bisogna infatti capire meglio i meccanismi molecolari alla base della riprogrammazione e superare la limitazione legata all’utilizzo di vettori retro virali, potenzialmente pericolosi, per veicolare in maniera sicura i geni di interesse.
1.2.2 Differenziamento delle cellule ES verso un destino neuronale.
Le cellule ES rappresentano una fonte praticamente inesauribile di cellule somatiche staminali e mature. L’induzione del differenziamento delle cellule ES in
tipi cellulari definiti prevede la loro esposizione in coltura a particolari condizioni che favoriscono la perdita della pluripotenza e la conversione verso tipologie cellulari somatiche. Questo originariamente avveniva coltivando le cellule su substrati non adesivi in un siero contenente siero ma depleto di LIF, condizioni che favoriscono la formazione di aggregati multicellulari in sospensione, detti Corpi Embrioidi (CE). I CE sono caratterizzati dalla presenza di cellule dei tre foglietti germinativi, capaci di produrre in vitro il programma di sviluppo pur mancando di una vera e propria organizzazione spaziale (Smith, 2001). L’indirizzamento verso il destino neurale è stato originariamente ottenuto mediante esposizione dei CE all’acido retinoico in assenza di LIF (Bain et al., 1995) inducendo un differenziamento, seppur non omogeneo, in senso neurale e la loro conversione direttamente in neuroni postmitotici.
I protocolli basati sui CE hanno fornito uno strumento fondamentale per analizzare in vitro la pluripotenza delle CS embrionali ma in genere rappresentano un sistema molto eterogeneo e poco adatto per un’analisi fine dei meccanismi molecolari che guidano la specificazione del destino maturativo delle CS embrionali. Tuttavia, l’eliminazione delle popolazioni cellulari “contaminanti” può essere effettuata mediante la tecnica di selezione del lineage. Tale strategia è applicabile a qualsiasi popolazione cellulare specifica per la quale esistano dei marcatori specifici. Dal primo tentativo per purificare i precursori neurali (Li et al., 1998), con il tempo questo approccio è stato ottimizzato utilizzando una linea di CS embrionali (linea 46C) in cui l’espressione della cassetta di selezione eGFP-IRES-PuroR era sotto il controllo del promotore del gene Sox1 endogeno. L’espressione di Sox1 in vivo è ristretta alle cellule proliferanti presenti nel neuroectoderma e nel cristallino, permettendo quindi la selezione specifica (tramite FACS o tramite utilizzo dell’agente selezionante puromicina) di cellule di tipo neuro-ectodermico ottenute dal differenziamento delle cellule 46C in senso neurale (Stavridis e Smith, 2003). L’analisi della fluorescenza permette inoltre di studiare i meccanismi molecolari alla base della specificazione a lineage neurale e definire protocolli di coltura per un efficiente differenziamento neurale. Utilizzando questa linea reporter, gli stessi ricercatori hanno infatti messo a punto un metodo per convertire, con
elevata efficienza, le CS embrionali in precursori neuroectodermici in monocoltura, senza la formazione di aggregati cellulari, ed evitando l’utilizzo di siero o co-coltureTali cellule si dispongono a formare strutture denominate “rosette”, conformazione tipica delle cellule neuroepiteliali (Ying et al., 2003; Ying e Smith, 2003; Elkabetz 2008).
Lo sviluppo di questi metodi di conversione delle CS embrionali in precursori neurali ha reso possibile effettuare una caratterizzazione molecolare fine di queste cellule. Oltre ad una caratterizzazione in termini di capacità proliferativa, potenziale differenziativo e di espressione di alcuni marcatori specifici.
1.3 Generazione di fonti espandibili di cellule staminali neurali
Le CS neurali presenti in vivo durante lo sviluppo o nel cervello adulto sono state isolate in vitro per poter essere meglio studiate e caratterizzate. Negli studi in
vitro una delle maggiori difficoltà riscontrate dai ricercatori è quella di propagare
stabilmente coltu re omogenee di CS neurali isolate dal tessuto fetale o adulto. Uno dei metodi inizialmente utilizzato per permettere l’espansione cellulare
in vitro è l’immortalizzazione, ottenuta tramite l’espressione di oncogeni virali
(myc, TAg di SV40). Tuttavia l’immortalizzazione comporta alterazioni fenotipiche e cariotipiche, inoltre l’introduzione di molecole trasformanti compromette la rilevanza fisiologica di queste linee. Per questo motivo i protocolli per l’isolamento e la propagazione di CS/precursori neurali derivati dal tessuto nervoso fetale o adulto si basano sull’utilizzo di fattori di crescita. Nel 1992 Reynolds e Weiss isolarono e mantennero in proliferazione CS/precursori dello striato di topo adulto (3-18 mesi) in presenza di EGF (fattore di crescita epidermico), senza siero e senza substrato adesivo. Al terzo giorno di coltura in vitro le cellule formavano degli aggregati che si staccavano e continuavano a proliferare: tali aggregati vennero chiamati neurosfere (Reynolds e Weiss, 1992). Queste vengono derivate a partire dalla dissezione del tessuto fetale o adulto il quale viene digerito enzimaticamente, triturato meccanicamente e filtrato; le cellule così ottenute vengono piastrate in un mezzo contenente fattori di crescita come l’EGF in combinazione con l'FGF-2 (o
bFGF, fattore basico di crescita dei fibroblasti). Una volta formatesi e cresciute, le neurosfere possono subire dei passaggi in vitro attraverso dissociazione meccanica o enzimatica e ripiastramento nelle stesse condizioni. L’analisi clonogenica ha dimostrato che le neurosfere contengono CS responsive all’EGF, capaci sia di dividersi che di differenziare. Ma uno dei principali limiti del sistema delle neurosfere è la loro composizione altamente eterogenea. L’eterogeneità cellulare in cui si trovano le CS all’interno delle neurosfere sembra ricreare il microambiente in
vitro che ne permette l’auto-rinnovamento e grazie a questa caratteristica il metodo
delle neurosfere è risultato un valido strumento in vitro per isolare, selezionare, mantenere, arricchire e quantificare CS fetali neurali o adulte. Questi presupposti hanno fatto si che il metodo delle neurosfere fosse ampiamente utilizzato come indice per valutare la frequenza di CS neurali in vivo e misurarne la variazione in seguito a trattamenti o stimoli. Tuttavia molti di questi studi sono in corso di rivalutazione nella comunità scientifica. Infatti, alcuni dei ricercatori che per primi hanno messo a punto il saggio delle neurosfere hanno dimostrato che tale saggio sovrastima la frequenza delle CS neurali, invalidando la significatività statistica di molti studi. Infatti essi hanno dimostrato che poiché i progenitori, caratterizzati da una limitata capacità proliferativa, possono dare origine a neurosfere propagabili per non più di due o tre passaggi, la definizione di CS neurale dovrebbe essere applicata solo a cellule in grado di ricostituire serialmente nuove neurosfere a lungo termine, almeno oltre i cinque passaggi. Applicando questa definizione operazionale, anziché considerare esclusivamente la capacità di formare neurosfere, l'effettiva frequenza di CS neurali all’interno delle neurosfere passa dal 2,4% a circa lo 0,16% (Reynolds e Rietze, 2005). È stato quindi proposto un nuovo saggio per effettuare una valutazione numerica delle CS neurali basato sull’isolamento e l’identificazione di cellule neurali in grado di formare colonie (di dimensioni maggiori di 2mm) in vitro (Louis et al., 2008). A differenza del saggio delle neurosfere che si basa sulla crescita in sospensione, in questo saggio le cellule, isolate dallo striato di topi a E14 o dalla zona subependimale/periventricolare dell’adulto, vengono coltivate in un medium a cui viene aggiunto del collagene bovino a dare una matrice semisolida, consentendo la derivazione accurata di colonie di origine clonale.
Tuttavia, l’unico vero metodo per isolare, selezionare e caratterizzare una CS neurale rimane comunque il saggio clonale, nonostante le difficoltà tecniche e la laboriosità che lo rendono poco adatto ad un’analisi su larga scala.
Durante gli ultimi anni è sorta la necessità di sviluppare sistemi di propagazione di cellule staminali neurali che potessero ovviare alle limitazioni del sistema neurosfera. Studi recenti, condotti nel nostro laboratorio, mostrano come le CS neurali possano crescere in monostrato senza utilizzo di siero ed essere propagate in colture omogenee (Conti et al., 2005). Infatti per la prima volta è stata identificata una nuova strategia per la derivazione delle CS neurali e per la loro propagazione stabile nel tempo. Partendo dalle cellule ES, è stato dimostrato che precursori neurali, normalmente destinati a differenziare rapidamente in neuroni e glia, possono essere efficientemente espansi come linee cellulari staminali che crescono in monostrato in seguito a stimolazione di EGF ed FGF-2. Inoltre è importante notare che le cellule in queste condizioni si espandono secondo divisioni simmetriche senza differenziamento e mantenendo la loro capacità di generare neuroni ed astrociti sia in vitro che in seguito a trapianto intracerebrale.
La caratterizzazione molecolare di queste cellule rivela una corrispondenza alla glia radiale del forebrain, recentemente considerate come sorgenti di neuroni e glia durante lo sviluppo del sistema nervoso centrale (Gotz et al.,2002; Kerr et al., 2004; Malatesta P. et al., 2003).
Quindi i nostri risultati indicano che cellule staminali embrionali pluripotenti possono essere efficientemente convertite in distinte linee cellulari staminali somatiche omogenee, le quali sono state chiamate cellule NS (da Staminale Neurale), che possono essere espanse in vitro in condizioni di monostrato per molto tempo. Queste colture di cellule NS non danno origine ad eventi di differenziamento e crescono come cellule tipo glia radiale.
Un dato importante ci suggerisce che le cellule NS non sono prerogativa delle cellule embrionali staminali in quanto esse sono state ottenute anche dal sistema nervoso fetale ed adulto. È possibile dire ce le cellule NS sono le corrispondenti cellule staminali neurali delle neurosfere.
Ulteriori caratterizzazioni non hanno dimostrato differenze fra le linee NS ottenute da diverse sorgenti, infatti tutte mantengono le stesse caratteristiche di rinnovamento, di potenzialità differenziativa e caratteristiche antigeniche.
Le cellule NS rappresentano il sistema più idoneo attualmente disponibile per lo studio della biologia delle cellule staminali e potrebbe rappresentare il sistema ideale per creare modelli cellulari per lo studio delle malattie neurodegenerative e per lo sviluppo di strategie trapiantologiche.
1.4 I trapianti come strumento per valutare le capacita’ di integrazione e differenziamento delle CS neurali.
La possibilità di isolare CS neurali da fonti diverse e propagarle in vitro in presenza di mitogeni o in seguito a strategie di immortalizzazione mediante l’utilizzo di oncogeni, ha posto l’attenzione sui trapianti intracerebrali come mezzo per studiare le proprietà biologiche di queste cellule, anche al fine di sviluppare un loro impiego per terapie di sostituzione cellulare (Lindvall and Kokaia, 2010).
In questi anni, i trapianti hanno fornito importanti informazioni sul potenziale di certi tipi cellulari come mezzo per studiare il comportamento di cellule donatrici dopo trapianto in un tessuto ospite, nonostante questo però i trapianti risultano essere una tecnica difficile da studiare e sviluppare soprattutto per la difficoltà che si incontra nel monitorare da vicino, e per un lungo periodo, le cellule trapiantate. Tuttavia, è importante tenere presente che la riuscita del trapianto non dipende soltanto dalla fonte da cui provengono le cellule ma anche dall’ambiente in cui vengono impiantate, per cui parametri come l’età del donatore e del ricevente possono rivestire ruoli importanti per la corretta integrazione (Rossi and Cattaneo, 2002).
Nel corso degli anni sono state utilizzate diverse tipologie di CS neurali valutate in paradigmi trapiantologici differenti tramite i quali valutare le caratteristiche biologiche e capacità di integrazione di cellule staminali neurali dopo trapianto in un tessuto ospite.
1.4.1 CS neurali non amplificate ex vivo
Diversi studi di trapianto condotti utilizzando progenitori neurali isolati da tessuto cerebrale fetale fresco, hanno evidenziato la possibilità di ristabilire una circuiteria neuronale complessa sia nel cervello di topi appena nati che di topi adulti. In particolare, esperimenti condotti trapiantando cellule corticali fetali murine derivate da embrioni al 14° giorno di gestazione (E14) nel cervello di topi adulti, precedentemente sottoposti a lesione corticale, hanno evidenziato che le cellule trapiantate erano in grado di generare proiezioni a lunga distanza capaci di raggiungere correttamente ed in maniera specifica aree corticali e subcorticali, con una distribuzione topografica simile a quella che si osserva in animali wild-type. Inoltre, queste proiezioni mostravano una corretta mielinizzazione, indicando quindi anche una loro possibile maturazione funzionale (Gaillard et al., 2007).
1.4.2 CS immortalizzate
Le linee cellulari immortalizzate multipotenti, sono più facilmente reperibili e coltivabili in vitro rispetto a precursori neurali derivati da tessuto fetale fresco. Studi effettuati trapiantando linee immortalizzate di precursori neurali, in cervello di topi neonati, hanno messo in evidenza la capacità di queste cellule di differenziare sia in senso neuronale che gliale. Infatti Gao e colleghi (Gao and Hatten, 1994) hanno dimostrato come, in seguito a trapianto di una linea cellulare immortalizzata (GC-B6) derivata da progenitori neurali presenti nello strato esterno del cervelletto, in cervello di topi a 2 giorni di età (P2), questa fosse capace di dare origine a diversi tipi cellulari presenti nel cervelletto, come i neuroni dei granuli, interneuroni, le cellule di Golgi, glia di Bergmann ed astrociti. Gli stessi risultati sono stati ottenuti anche trapiantando una linea immortalizzata derivata da precursori embrionali di ippocampo di ratto, in ippocampo di ratti P2 osservando la generazione di cellule con fenotipo sia neuronale che gliale tipico delle cellule ippocampali ( Renfranz et al., 1991). Una delle linee immortalizzate, derivata da progenitori neurali, meglio caratterizzata e studiata per le sue spiccate qualità neurogeniche è la RN33B (Whittemore and White, 1993). Questa linea ha mostrato possedere delle ottime qualità differenziative, sia dopo trapianto in cervello post-natale che adulto (Onifer
et al., 1993; Shihabuddin et al., 1995), dando origine a cellule morfologicamente simili a quelle presenti nel sito di trapianto. In particolare è stato dimostrato che cellule RN33B trapiantate in ippocampo di ratti adulti, erano capaci di generare neuroni ben integrati e con morfologia simile ai neuroni endogeni presenti nei diversi strati ippocampali, ma questo risultato si osservava solo se il trapianto veniva eseguito in tessuto ippocampale integro. Cellule trapiantate in tessuto lesionato, in modo da colpire selettivamente cellule dei granuli del giro dentato o neuroni piramidali dell’ippocampo, erano capaci di dare origine solamente a cellule con morfologia bipolare, tipica di neuroni immaturi (Shihabuddin et al., 1995). Questo risultato ha confermato che la capacità neurogenica di linee neurali immortalizzate, e non solo precursori neurali derivati da tessuto fetale, è strettamente correlata all’ambiente i cui queste cellule vengono impiantate e non solamente dalle loro proprietà intrinseche, infatti l’interazione cellula-cellula mediata da molecole di superficie presenti sui neuroni endogeni sembra essere necessaria ai fini di generare una cellula ‘donatrice’ con caratteristiche morfologiche di neurone maturo. Nonostante che il potere neurogenico delle cellule RN33B fosse fortemente influenzato dalle condizioni del tessuto ospite, esperimenti successivi hanno dimostrato che queste cellule, a differenza di altre linee cellulari immortalizzate come le HiB5 (Renfranz et al., 1991) e le C17-2 (Snyder et al., 1992), non solo erano in grado di integrarsi in diverse aree cerebrali quali la corteccia cerebrale e lo striato assumendo le morfologie tipiche dei neuroni di queste aree, ma che inoltre erano capaci di generare proiezioni a lunga distanza. Lundberg e colleghi (Lundberg et al., 2002) ai fini di studiare al meglio le caratteristiche differenziative di queste cellule, hanno utilizzato RN33B geneticamente modificate ad esprimere in maniera costitutiva il gene reporter eGFP (Green Fluorescent Protein). Le cellule così ottenute sono state trapiantate in diverse aree del cervello di ratti P2, come lo striato, l’ippocampo e la corteccia cerebrale e rivelate mediante esperimenti di immunoistochimica utilizzando anticorpi specifici contro la eGFP. I risultati ottenuti hanno mostrato che già dopo tre settimane dal trapianto si osservava la presenza di cellule eGFP+ con morfologia neuronale tipica delle cellule presenti nelle aree di trapianto e che una quota delle cellule trapiantate assumeva un fenotipo
riconducibile ad un differenziamento in senso gliale (astrocita ed oligodendrocita). Inoltre la presenza di fasci di fibre eGFP+ distribuite nelle diverse aree e proiettanti a lunga distanza, in quanto osservate a livello della capsula interna dello striato, in grado di attraversare tutto il nucleo striatale, a livello ippocampale in grado di attraversare tutto l’ippocampo dorsale formando dei fasci molto densi a livello degli strati oriens, radiatum e lucidum, a livello corticale capaci di attraversare la corteccia cerebrale incluso il corpo calloso, hanno contributo a confermare le ottime capacità neurogeniche di queste cellule non solo nel generare neuroni morfologicamente maturi, ma anche capaci di emettere fibre nervose a lunga distanza e verso target corretti. Esperimenti di elettrofisiologia condotti su fettine di tessuto (corteccia cerebrale) derivate da cervelli di ratti P2 trapiantati con cellule RN33B/eGFP, hanno dimostrato che queste cellule oltre a stabilire connessioni a lunga distanza, erano capaci di generare potenziali di azione, ricevere e trasmettere segnali eccitatori ed inibitori provenienti dalle cellule endogene e quindi di integrarsi correttamente nella circuiteria neuronale dell’ospite (Englund et al., 2002). Questi ed atri risultati (Cunningham and McKay, 1994; Renfranz et al., 1991; Snyder et al., 1992) hanno generato ottimismo riguardo alla capacità di linee staminali neurali espanse ex vivo di dare origine a diversi sottotipi neuronali una volta trapiantate in vivo (Tai and Svendsen, 2004).
1.4.3 CS neurali da tessuto fetale
I risultati ottenuti in generale sul comportamento di cellule staminali neurali dopo trapianto intracerebrale di roditore hanno messo in evidenza una limitazione nel potenziale differenziativo di queste cellule soprattutto se trapiantate in un ambiente poco plastico come il cervello adulto. Dunque sembrava interessante provare a ‘spingere’ ulteriormente le cellule verso un destino neuronale mediante l’impiego di protocolli di differenziamento in vitro.
In esperimenti di trapianto condotti da Winkler e colleghi, è stato dimostrato come neurosfere derivate dalle eminenze ganglionari (laterale e ventrale) di topi a stadio embrionale di 14 giorni (E14) ed espanse in vitro solamente in presenza di EGF, trapiantate nei ventricoli telencefalici di ratti a E15 fossero in grado di dare
origine solamente a cellule con morfologia gliale (Winkler et al., 1998). Anche esperimenti condotti da altri gruppi hanno evidenziato la predisposizione dei precursori neurali cresciuti come neurosfere a differenziare verso un destino prevalentemente gliale dopo trapianto in cervello di topi o ratti appena nati (Espinosa-Jeffrey et el., 2002; Hitoshi et al., 2002: Parmar et al., 2002). Mentre in esperimenti condotti da Eriksson e colleghi è stato dimostrato che neurosfere derivate da diverse aree cerebrali fetali ed esposte per 6 giorni ad un protocollo di differenziamento in vitro in presenza di bFGF ed EGF erano capaci di dare origine a cellule con morfologia neuronale matura. In particolare trapiantano neurosfere derivate da topi transgenici GFP in ippocampo, striato e corteccia di ratti P2 osservando la presenza di cellule GFP+ con morfologia tipica delle cellule presenti
nelle aree di trapianto, come i neuroni medi spinosi striatali per quanto riguarda lo striato, e certe tipologie di interneuroni per i trapianti effettuati in ippocampo e corteccia cerebrale (Eriksson et al., 2003). Dunque il differenziamento neuronale indotto in vitro sembra incrementare di molto le capacità neurogeniche di precursori neurali derivati da tessuto fetale.
Risultati molto interessanti sono stati ottenuti anche trapiantando progenitori neurali derivati da tessuto fetale umano. In un lavoro di Wu e colleghi (Wu et al., 2002) sono stati messi a confronto due diversi protocolli di induzione in vitro, andando ad analizzare il comportamento delle cellule staminali neurali umane dopo trapianto in cervello di ratto adulto, sia in aree neurogeniche, ippocampo, che non neurogeniche come la corteccia prefrontale e il midollo spinale. Un mese dal trapianto si osservava la presenza di cellule eGFP+/NeuN+ con morfologia tipica dei neuroni presenti nelle aree in cui le cellule sono state trapiantate. Inoltre, analisi di immunoistochimica confermavano l’assenza di cellule neuronali immature, in quanto non si osservava espressione di Nestina, e di cellule con caratteristiche gliali, sia astrociti che oligodendrociti. Mentre, le cellule trapiantate senza aver subito induzione neurale in vitro, mostravano capacità di dare prevalentemente origine a cellule con fenotipo astrocitario. Inoltre l’induzione del differenziamento neuronale con bFGF ma non Shh, sembrava aumentare notevolmente il differenziamento in senso colinergico delle cellule trapiantate, come dimostrato da esperimenti di
immunoistochimica per ChAT (coline acetyltransferase) dove cellule GFP+/ChAT+ risultavano essere presenti in maggior numero se trapiantate in aree ricche in questa tipologia neuronale come il midollo spinale ed il setto mediale (Wu et al., 2002). Inoltre esperimenti condotti trapiantando le stesse cellule nelle stesse condizioni di induzione in vitro in un modello animale di lesione della midollo spinale, hanno dimostrato la capacità delle cellule di integrarsi anche in un tessuto ospite danneggiato generando proiezioni assonali verso i bersagli corretti, sostituendo la funzionalità delle cellule mancanti e portando ad un recupero, anche se parziale, delle funzioni motorie dell’animale (Gao et al., 2005).
1.4.4 CS neurali derivate da cellule ES
Studi effettuati utilizzando cellule staminali embrionali (ES) murine e staminali neurali umane, hanno dimostrato che protocolli di neuralizzazione in vitro possono drammaticamente influenzare il destino differenziativo e la capacità di generare proiezioni assonali a lunga distanza verso i bersagli corretti delle cellule donatrici dopo trapianto. Uno dei lavori più importanti in cui è stata studiata la capacità di cellule ES murine differenziate in vitro, verso un destino corticale, di mantenere il fenotipo acquisito anche dopo trapianto in cervello di topi P2, è stato eseguito da Gaspard e colleghi (Gaspard et al., 2008). Gli autori descrivono come cellule ES-GFP+ differenziate per 12-17 giorni in un mezzo definito in presenza di ciclopamina
e poi trapiantate in corteccia pre-frontale di topi P2 siano in grado di dare origine a cellule GFP+ con morfologia tipca dei neuroni piramidali endogeni senza mai andare origine a formazioni tumorali. Inoltre sono state analizzate anche le proiezioni assonali generate dalle cellule trapiantate e paragonate al profilo delle proiezioni corticali endogene. I risultati mostrano che in molti animali trapiantati, ed analizzati dopo un mese, si osserva la presenza di numerose proiezioni GFP positive attraverso la capsula esterna del corpo calloso fino alla corteccia contro- ed ipsilaterale, le quali corrispondono alle proiezioni cortico-corticali. Proiezioni GFP +
che corrispondono alle efferenze sub-corticali sono state osservate in striato, talamo, nel mesencefalo e verso i nuclei pontini nel romboencefalo. Mentre quando vengono effettuati trapianti nelle stesse condizioni precedenti ma con cellule differenziate
solo in presenza di medium definito senza ciclopamina, le cellule donatrici GFP+
con morfologia neuronale mostrano una minor quantità di ramificazioni e capacità di generare proiezioni corticali. Dunque il fenotipo che viene osservato dopo trapianto rispecchia il destino a cui le cellule sono state indotte mediante protocolli di differenziamento in vitro. Quindi la capacità di differenziare correttamente è una caratteristica che i progenitori neurali derivate da ES riescono ad acquisire in vitro e mantenere dopo trapianto.
Risultati interessanti riguardo al tipo di induzione neurale da effettuare in vitro ai fini di ottenere specifiche popolazioni neuronali in vivo, sono stati ottenuti nel laboratorio di James Weimann a Stanford, dove per la prima volta sono stati trapiantati progenitori corticali derivati da cellule ES murine, capaci di dare origine a specifiche sottopopolazioni corticali proiettanti. In particolare le cellule ES sono state ingegnerizzate in modo da esprimere la eGFP in maniera costitutiva e sottoposte a due un protocolli di differenziamento distinti prima del trapianto, uno che prevedeva la co-coltura delle ES con cellule stromali MS5, l’altro il passaggio di induzione neurale via generazione di corpi embrioidi (CE). Le cellule così trattate sono state trapiantate allo stadio di precursore neuronale in corteccia di topi P2. I risultati mostrano che le cellule derivate da entrambi i protocolli di differenziamento sono capaci di dare origine a cellule eGFP+ con morfologia e localizzazione tipica dei neuroni piramidali corticali dello strato 5/6; ma che solo le cellule derivate dalla co-coltura con le MS5, mostrano caratteristiche fenotipiche molto specializzate come le spine dendritiche, dendrite apicale rivolto verso gli starti più superficiali e dendrite basale che si ramifica verso gli strati più profondi della corteccia. Inoltre solo le cellule coltivate con le MS5, una volta depositate in corteccia visiva, somatosensoriale e motoria, mostrano proiezioni eGFP+ verso aree subcorticali specifiche come, rispettivamente, il ponte, la decussazione piramidale e il primo tratto del midollo spinale (Ideguchi et al., 2010). Dunque il processo di induzione in
vitro risulta condizionare moltissimo le capacità differenziative di cellule
1.5 La fusione cellulare nel trapianto di CS
Il comportamento delle cellule staminali dopo trapianto intracerebrale nei roditori, è stato sempre interpretato seguendo l’idea che queste fossero capaci di differenziare acquisendo un fenotipo neuronale maturo e quindi capaci di integrarsi nel tessuto ospite sano o di sostituire le cellule morte in un tessuto danneggiato. Una possibile interpretazione alternativa di questi dati potrebbe essere l’idea della fusione cellulare tra le cellule trapiantate e cellule endogene dell’ospite.
Questa possibilita’ prevede che la visualizzazione di cellule neuronali fenotipicamente mature e funzionalmente integrate nel tessuto ospite dopo trapianto potrebbe essere il risultato di una mediazione cellulare e non di una capacità intrinseca delle cellule staminali.
La fusione cellulare è un evento biologico che prevede l’unione tra due cellule. Questo evento si verifica in numerosi processi biologici che vanno dalle prime fasi dello sviluppo a particolari condizioni patologiche (Chen et al., 2007). La fusione può avvenire tra due cellule somatiche identiche, fusione omotipica, come si osserva durante la formazione dei miotubi, degli osteoclasti, della placenta e delle cellule giganti derivate dai macrofagi (Ogle et al., 2005), oppure tra due cellule diverse, fusione eterotipica, dando origine ad una cellula somatica ibrida detta eterocarionte se presenta due nuclei distinti, oppure sincarionte se presenta un unico nucleo tatraploide.
Nel cervello in vivo, la fusione cellulare e’ stata osservata tra cellule derivate dal midollo osseo (BMDCs) e i neuroni di Purkinje del cervelletto. BMDCs derivate da topi transgenici CMV-Cre, dove la Cre viene espressa in maniera costitutiva in tutte le cellule del corpo, sono state iniettate per via intraperitoneale in topi R26R. Questi animali sono caratterizzati dall’espressione del gene reporter β-gal la cui espressione è bloccata da una cassetta di stop fiancheggiata da due siti loxP. In presenza di fusione, la ricombinasi Cre presente nelle BMDCs è in grado di eliminare la cassetta di stop permettendo l’espressione del gene reporter β-gal presente nelle cellule endogene. Analisi eseguite su vari tessuti di animali R26R trapiantati con cellule BMD CMV-Cre hanno evidenziato espressione della β-gal
solamente in certi tessuti fra cui quello cerebrale. In particolare si è osservata la presenza di cellule di Purkinje β-gal+ contenenti due nuclei, uno con morfologia e struttura tipica delle cellule di Purkinje ed uno più piccolo di origine midollare. Ulteriori analisi condotte in microscopia elettronica e per immunoistochimica hanno confermato che la cellula fusa aveva mantenuto tutte le caratteristiche morfologiche e molecolari tipiche di un neurone di Purkinje del cervelletto (Alvarez-Dolado et al., 2003). Dunque la fusione cellulare tra cellule di origine diversa sembra essere un evento possibile e stabile nel tempo, visto che gli eterocarionti β-gal+ nel cervelletto vengono osservati anche dopo mesi dal trapianto. Inoltre, il contributo delle BMDCs ai neuroni di Purkinje è stato osservato anche nell’uomo. Donne adulte affette da tumori del sangue e riceventi trapianto di midollo osseo da uomini hanno mostrato la presenza di neuroni di Purkinje tetraploidi (XXXY) confermando che la fusione può avvenire spontaneamente tra cellule trapiantate e neuroni endogeni (Weimann et al., 2003a). Da questi risultati si deduce che nell’uomo, come nel topo, le cellule BMD donatrici sono in grado di attraversare la barriera ematoencefalica e contribuire al pool cellulare dei neuroni di Purkinje del cervelletto. Per capire il meccanismo alla base della formazione di un eterocarionte stabile sono state condotte analisi della composizione nucleare della cellula fusa, quindi se la formazione dell’eterocarionte fosse derivata da cellule BMD generate de novo oppure tramite fusione con cellule del Purkinje endogene pre-esistenti. Weimann e colleghi (Weimann et al., 2003b) hanno dimostrato, trapiantando cellule BMD derivate da topi transgenici eGFP maschi in topi femmine wild-type, che la generazione degli eterocarionti eGFP+ era il risultato della fusione tra cellule BMD e neuroni endogeni sia mediante analisi al microscopio confocale che mediante tecniche più sofisticate come la FISH (Fluorescent In Situ Hybridization) la quale ha permesso di stabilire con precisione che il cromosoma Y era presente solamente in uno dei due nuclei. Dunque la presenza di cellule Purkinje eGFP+ è il risultato di una fusione cellulare che conserva il fenotipo e le caratteristiche morfologiche della cellula ospite. Ma da un’analisi più dettagliata dei nuclei della cellula fusa, si osservava anche la presenza di cellule GFP+ con due nuclei simili a quelli osservati nei neuroni di Purkinje, e non di uno neurale e l’altro simile a quello delle cellule midollari, e che il numero
delle cellule con due nuclei Purkinje-like aumentava col passare del tempo. Dunque la formazione dell’eterocarionte sembra un processo stabile che porta alla riprogrammazione del nucleo derivato dalle cellule BMD verso un profilo neuronale, in particolare di cellule di Purkinje. Infatti in animali trapiantati con cellule midollari, derivate da topi transgenici in cui il controllo dell’espressione della eGFP è regolato dal promotore specifico di cellule di Purkinje denominato L7-pcp2, si osserva la formazione di eterocarionti GFP+ e quindi capaci di esprimere il promotore specifico delle Purkinje, L7-pcp2, con morfologia di cellule di Purkinje (Weimann et al., 2003). A differenza di altri tessuti come il fegato (Wang et al., 2003), dove eventi di fusione portano alla formazione di cellule proliferanti con un singolo nucleo contenente sia il DNA del donatore che dell’ospite (Vassilopoulos et al., 2003; Wang et al., 2003), la fusione con cellule neuronali post-mitotiche porta sempre alla formazione di eterocarionti stabili. Inoltre la formazione degli eterocarionti stabili nel cervelletto, sembra aumentare sia in presenza di stati infiammatori cronici e transienti che di stati infettivi (Johansson et al., 2008). Non solo, anche in condizioni di danno tessuto-specifico (cervelletto) il numero di eterocarionti e la loro velocità di comparsa aumenta rispetto a condizioni fisiologiche. Nonostante questo, esperimenti condotti da Magrassi e colleghi (Magrassi et al., 2007) dimostrano che la fusione tra cellule midollari e neuroni di Purkinje potrebbe essere un meccanismo fisiologico che avviene anche in assenza di stati patologici o trapianto di cellule BMD. Animali sottoposti a trapianto con cellule BMD derivate da topi transgenici per la eGFP, ma non sottoposti ad irradiazione totale del corpo, mostrano lo stesso presenza di cellule eGFP+ nel cervelletto con morfologia identica a quella delle cellule di Purkinje endogene. Inoltre, per dimostrare la spontaneità di questo evento, hanno analizzato per immunoistochimica sezioni di cervelletto di animali wilde-type adulti non sottoposti a nessun tipo di trattamento osservando la presenza di qualche cellula di Purkinje binucleata. Oltre al cervelletto anche la corteccia cerebrale sembra mostrare predisposizione a generare cellule fuse in seguito ad induzione di stati infiammatori come ad esempio l’introduzione di virus. Osservazioni recenti hanno mostrato come l’aumento della neurogenesi corticale osservato dopo iniezioni di particelle virali nel ventricolo
laterale di cervello di ratti P2 fosse il risultato di un fenomeno di fusione tra microglia endogena infettata e neuroni endogeni (Ackman et al., 2006).
L’evento di fusione, anche se estremamente raro nel cervello in condizioni fisiologiche, è un fenomeno da tenere altamente in considerazione specialmente nell’interpretazione di risultati ottenuti in seguito a trapianto di cellule donatrici.
2. OBIETTIVO DELLA TESI
Nonostante la scoperta delle notevoli potenzialità delle cellule staminali come strumento da utilizzare in ambito biomedico per lo sviluppo di terapie di sostituzione cellulare, sono ancora poche le conoscenze circa i meccanismi molecolari che stanno alla base delle loro capacità di integrazione e riparazione dei circuiti nervosi danneggiati in seguito a trapianto intracerebrale. Dunque, approfondire la conoscenza delle caratteristiche biologiche e funzionali di queste cellule una volta trapiantate in tessuto cerebrale sano, potrebbe incrementare ed ampliare il loro potenziale utilizzo terapeutico in patologie neurodegenerative ad oggi farmacologicamente intrattabili.
L’attività di ricerca svolta nel corso di questo Dottorato ha avuto come argomento principale lo studio in vivo del comportamento di Cellule Staminali Neurali isolate e cresciute secondo un protocollo di coltura in monostrato sviluppato in laboratorio che consente di ottenere popolazioni pure di cellule staminali neurali denominate “cellule NS”. In particolare è stato analizzato il comportamento di cellule NS derivate da corteccia fetale murina e sottoposte ad un protocollo di pre-differenziamento in vitro, in seguito a trapianto in cervello di topo adulto. Lo studio ha incluso indagini dettagliate sulla capacità di sopravvivenza, di integrazione e di differenziamento di cellule NS, una volta trapiantate in diverse aree cerebrali, effettuando analisi morfologiche e molecolari a diversi tempi dal trapianto, sia a breve che a lungo termine. Vista la comparsa di cellule donatrici con un fenotipo neuronale molto interessante, sono stati effettati anche saggi molecolari e biochimici per verificare la possibilità di passaggio di materiale proteico o genico, dalle cellule donatrici a quelle endogene. Dunque sono state trapiantate cellule NS in condizioni non vitali, in ippocampo di topi wild-type, per escludere il passaggio di materiale proteico dalle cellule NS a quelle del tessuto ospite; mentre per escludere il passaggio di materiale genico sono stati effettuati saggi ELISA per rivelare la presenza della proteina virale p24 nel mezzo di cellule NS rese capaci di esprimere la GFP in seguito a traduzione virale. Inoltre, sono state effettuate analisi di
ibridazione in situ per dimostrare che solo le cellule GFP positive donatrici mostravano espressione del gene della GFP.
Nel corso degli esperimenti, verificata l’assenza di artefatti dovuti al trapianto, è stata valutata la possibilità che le cellule NS trapiantate potessero incorrere in fenomeni di fusione cellulare con elementi cellulari endogeni., lo studio si è concentrato sulla caratterizzazione dell’evento di fusione, il quale è stato analizzato trapiantando le cellule NS in modelli transgenici murini nei quali le cellule del tessuto cerebrale sono marcate geneticamente. In questo modo è stato possibile distinguere nel tessuto trapiantato le cellule donatrici NS da quelle endogene. Inoltre, la fusione cellulare è stata analizzata anche in esperimenti in vitro co-coltivando le cellule NS con cellule di diversa origine, sia neuronale che gliale, derivate da animali transgenici.
3. RISULTATI
3.1 Trapianto di cellule NS in ippocampo di topo adulto: generazione di cellule con morfologia ed orientamento tipico dei neuroni endogeni.
3.1.1 Analisi del comportamento di cellule NS Cor1 GFP dopo trapianto in ippocampo
Studi condotti precedentemente in laboratorio hanno osservato il comportamento generale di cellule NS proliferanti in seguito a trapianto in striato di topi adulti, dimostrando la capacità di queste cellule di sopravvivere nel tessuto ospite e di generare elementi cellulari sia MAP2+ che GFAP+ (Conti et al., 2005).
In questi studi però la morfologia osservata delle cellule trapiantate era quella di neuroni immaturi, dunque le condizioni in cui le cellule venivano mantenute in vitro e poi trapiantate, non erano in grado di far valutare completamente la capacità neurogenica di queste cellule.
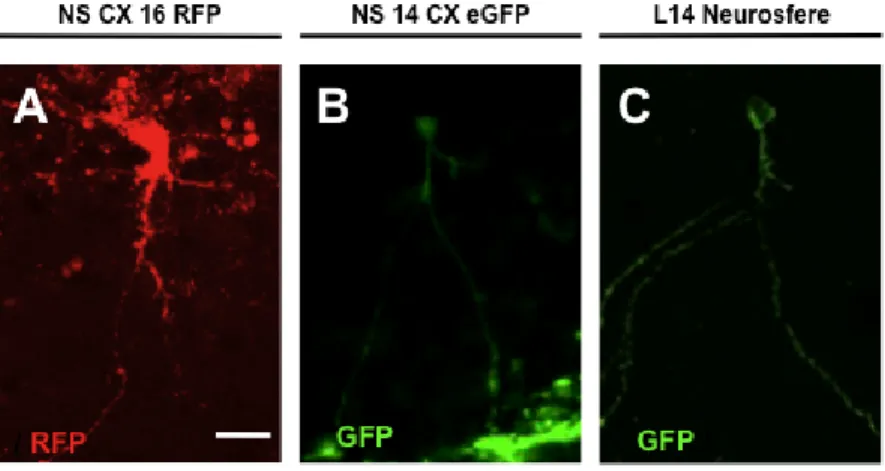
Per rispondere a questa domanda, inizialmente abbiamo testato il comportamento di cellule NS GFP+ derivate da tessuto fetale, denominate Cor1-GFP, dopo trapianto in ippocampo di topi adulti sia in condizioni proliferanti che sottoposte ad un protocollo di pre-differenziamento in vitro (Fig1) durante il quale le cellule vengono esposte per tre giorni ad un protocollo di differenziamento neuronale (Spiliotopoulos et al., 2009).
Figura 1: Schema sintetico che mostra come le cellule NS derivate da tessuto fetale e coltivate in
monostrato in condizioni proliferanti possono essere indotte a pre-differenziare per poi essere trapiantate in cervello di topo adulto. (prolif. = proliferanti; pre-diff= pre-differenziate)
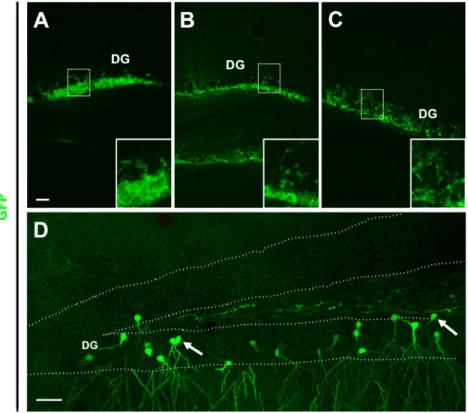
Il pre-differenziamento in vitro delle Cor1GFP è stato effettuato ai fini di incrementare le loro potenzialità di differenziamento dopo trapianto e quindi promuovere la loro integrazione nel tessuto ospite. Inizialmente ho trapiantato le cellule in ippocampo di topi adulti wilde-type eseguendo un trapianto singenico, cioè cellule derivate da uno specifico ceppo murino, in questo caso s/v 129, impiantate in topi riceventi appartenenti allo stesso ceppo murino da cui derivano le cellule. Gli animali così trattati sono stati sacrificati a tempi precoci, 6 e 24 ore dal trapianto, ed a tempi più tardivi, 3 e 7 giorni dal trapianto, ed i rispettivi ippocampi processati mediante analisi per immunoistochimica in fluorescenza utilizzando un anticorpo specifico contro la eGFP. I risultati ottenuti mostrano, sia a tempi precoci (Fig. 2A e B) che a tempi tardivi (Fig. 2C e D), la presenza di un buon numero di cellule GFP+ nel giro dentato (DG) dell’ippocampo e che la loro distribuzione e morfologia cellulare cambia con il passare del tempo.
Figura 2: Immunofluorescenza contro la GFP, eseguita su sezioni coronali di ippocampo di topo
adulto trapiantato con cellule Cor1 GFP pre-differenziate, a 6 (A), 24 (B) 72 (C) ore e una settimana (D) dopo il trapianto. I riquadri in A, B e C mostrano i graduali cambiamenti di morfologia delle cellule
nel tempo. Sette giorni dopo il trapianto si osserva la comparsa di cellule GFP+ con morfologia identica
a quella delle cellule dei granuli del DG (freccia in D). La linea tratteggiata indica i confini dello strato dei granuli del DG. Scale bars: 500 µm (A-C) e 100 µm (D)
Infatti, sette giorni dopo il trapianto, si osserva la comparsa di cellule GFP+
che mostrano morfologia, orientamento e posizione tipica delle cellule dei granuli del giro dentato dell’ippocampo (Fig. 1D) mentre a stadi più precoci le cellule mostrano una morfologia tipica di neuroni immaturi (Fig. 2A-C). Ho osservato gli stessi risultati anche trapiantando le cellule in condizioni proliferanti (Fig. 3A-D) anche se, in queste condizioni, la frequenza della comparsa di cellule GFP+ con morfologia simile alle cellule dei granuli del DG dell’ippocampo 7 giorni dopo il trapianto è molto più bassa (Fig. 1D). Mentre un mese dopo il trapianto la frequenza della comparsa delle cellule GFP+ con fenotipo neuronale aumenta (dato non
mostrato).
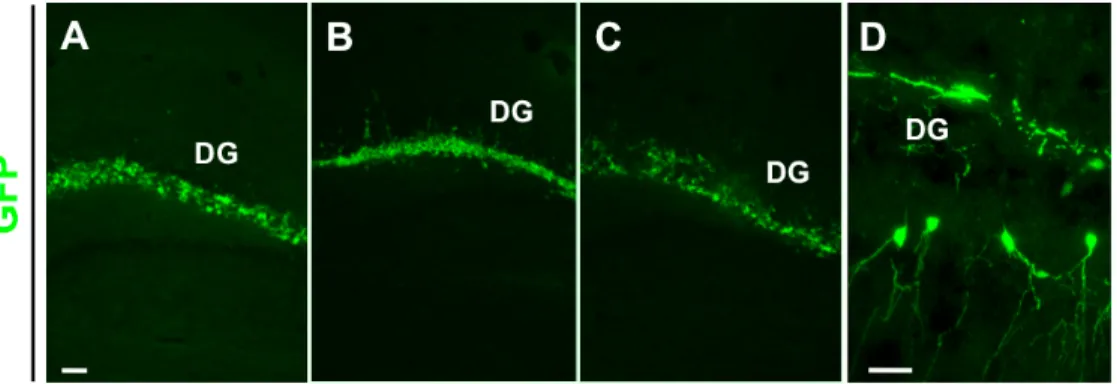
Figura 3: Sezioni coronali di ippocampo di topo adulto trapiantato con cellule Cor1 GFP proliferanti e
processate mediante Immunofluorescenza contro la GFP a 6 (A), 24 (B) 72 (C) ore e una settimana (D) dopo il trapianto. Una settimana dal trapianto si osserva la comparsa di cellule GFP+ con morfologia
identica a quella delle cellule dei granuli del DG (freccia, D). Scale bars: 500 µm (A-C) e 100 µm (D) 3.1.2 Analisi del comportamento di cellule NS-ES LC1 GFP dopo trapianto in ippocampo
Un comportamento simile è stato osservato in seguito a trapianto in ippocampo di topi adulti di NS derivate da cellule ES denominate LC1 GFP (Conti et al., 2005), anche in questo caso le cellule sottoposte a pre-differenziamento in
vitro mostrano lo stesso comportamento osservato per le NS Cor1GFP, anche se
necessitano di un tempo maggiore, un mese, prima di dare origine a cellule GFP+ con morfologia neuronale matura. Il segnale della GFP è stato osservato in un gran numero di cellule posizionate lungo tutto l’ippocampo, molte delle quali con morfologia ed orientamento simile a quello dei neuroni piramidali ippocampali endogeni, inoltre, anche in questo caso, sono state osservate cellule GFP+ con
morfologia identica a quella dei granuli del DG dell’ippocampo (Fig. 4A).
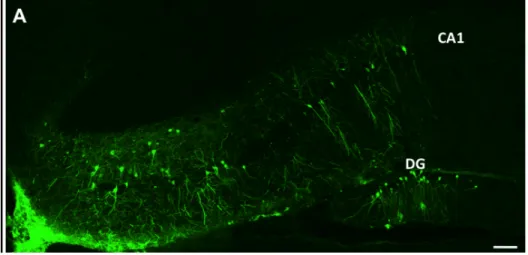
Figura 4: Sezione coronale di ippocampo di topo adulto trapiantato con cellule NS derivate da ES LC1
GFP pre-differenziate e processate contro la GFP un mese dopo il trapianto. La presenza di cellule GFP+ con una morfologia neuronale si osserva in tutti gli starti piramidali dell’ippocampo (i.e. CA1) e
del giro dentato DG. Inoltre è presente anche una buona quantità di processi GFP+ che si disperdono in
tutto il tessuto. Scale bar 100 µm.
Oltre a trapianti a breve termine, è stato analizzato anche il fenotipo delle cellule Cor1 GFP dopo 3 (Fig. 5A) e 18 mesi (Fig. 5B) dal trapianto in ippocampo. I risultati ottenuti mostrano che le cellule sono capaci di sopravvivere anche dopo diversi mesi dal trapianto d ando origine a cellule GFP+ con morfologia neuronale
Figura 5: Immunofluorescenza contro la GFP condotta su sezioni coronali di ippocampo di topo adulto
trapiantato con cellule Cor1 GFP pre-differenziate e sacrificato a 3 (A) e 18 (B) mesi dopo il trapianto. Scale bar 50 µm.
3.1.3 Analisi della morfologia e quantificazione di cellule NS Cor1 GFP dopo trapianto in ippocampo
Dopo aver effettuato un’ analisi prevalentemente basata sull’osservazione del comportamento nel tempo delle cellule trapiantate, ho condotto un’ analisi basata esclusivamente sulla morfologia delle cellule GFP+ (Fig. 6A).
Due giorni dopo il trapianto più del 70% delle cellule GFP+ mostrano una
morfologia tipica di cellule indifferenziate, mentre a sette giorni dopo il trapianto circa l’80% delle cellule GFP+ mostrano una morfologia ‘differenziata’ in quanto le
cellule mostrano processi neurali ramificati e orientamento non casuale rispetto al tessuto in cui sono state impiantate (Fig. 6B).
B