U
NIVERSITÀ DI
P
ISA
Dipartimento di Scienze Veterinarie
Scuola di Specializzazione in Sanità Animale, Allevamento e Produzioni Zootecniche
Indagine sierologica sulla prevalenza di paratubercolosi in un
gregge ovicaprino in provincia di Lucca
Candidato
Dott.ssa Irene Cianfagna
Relatore
Dott. Filippo Fratini
Correlatore
Dott.ssa Alessia Galiero
Anno Accademico 2013 – 2014
!Nel mezzo delle difficoltà nascono le opportunità Albert Einstein
RIASSUNTO
Mycobacterium avium paratuberculosis è l'agente eziologico della paratubercolosi, malattia che colpisce principalmente i ruminanti domestici e selvatici. Molto poco si sa circa l'epidemiologia della paratubercolosi nei piccoli ruminanti.
Le principali vie di trasmissione sono quella orale, attraverso il colostro ed il latte dei ruminanti infetti ed attraverso pascoli e acqua potabile contaminati con le feci di animali infetti ed intrauterina attraverso la placenta.
Il segno clinico più comune di paratubercolosi nei piccoli ruminanti è la perdita di peso; a differenza dei bovini, le capre e le pecore possono presentare diarrea intermittente e di minima entità. Le lesioni macroscopiche sono principalmente visibili nell'intestino e nei linfonodi mesenterici; i tessuti presentano un ispessimento della mucosa ileale ed un marcato aumento di volume dei linfonodi mesenterici.
Alcuni studi hanno evidenziato la presenza di cellule di Map vitali e di DNA nel latte crudo e nei formaggi di capra e pecora.
Lo scopo di questo studio era quello di esaminare ventinove capre e trenta pecore di due allevamenti in provincia di Lucca (Toscana, Italia) con il test ELISA e l’esame colturale su campioni di formaggio. Quattro capre (13,79%) sono risultate positive al test ELISA. Inoltre sono stati analizzati due lotti di formaggio: Map è stato rilevato in coltura in formaggi caprini stagionati per 3–7 giorni.
I dati ottenuti da questo studio rivelano la presenza di Map nel patrimonio ovino e caprino in provincia di Lucca.
ABSTRACT
Mycobacterium avium paratuberculosis is the aetiologic agent of paratuberculosis disease which primarily affects wild and domestic ruminants.
The main routes of transmission are oral, through the colostrum and milk of infected ruminants and through pasture and drinking water contaminated with feces of infected animals, and intrauterine through placenta.
The most common clinical sign of paratuberculosis in small ruminants is weight loss; unlike cattle, goats and sheeps can show an intermittent and unremarkable diarrhea.
Macroscopic lesions are primarily seen in the intestine and in the mesenteric lymph nodes; tissues exhibite thickening of ileal mucosa and severe enlargement of mesenteric lymph nodes.
Some studies have highlighted the presence of viable Map cells and Map DNA in goat and sheep milk and cheese.
Very little is known about the epidemiology of paratuberculosis in small ruminants.
The aim of this study was to examine twentynine goats and thirty sheeps of two flocks in Lucca district (Tuscany, Italy) with ELISA test and bacteriological analysis from cheese samples. Four goats (13,79%) were positive to ELISA surveys.
Moreover two cheese manufacturing batches were analyzed: Map was detected by culture in caprine cheeses ripened for 3–7 days.
Data obtained from this study reveals the presence of Map in goat and sheep population in Lucca district.
!
!
Sommario
!
!
Capitolo Uno – Parte Generale ... 1
1.1 DEFINIZIONE ... 1 1.2 STORIA ... 1 1.3 EZIOLOGIA ... 3 1.4 EPIDEMIOLOGIA ... 6 1.4.1 Diffusione ... 6 1.4.2 Trasmissione ... 7 1.4.3 Resistenza ... 10 1.5 PATOGENESI ... 11 1.6 SINTOMATOLOGIA ... 13 1.7 DIAGNOSI ... 14 1.7.1 Esame anatomo-patologico ... 14 1.7.2 Metodiche Dirette ... 18 1.7.3 Metodiche Indirette ... 20 1.8 PROFILASSI ... 25 1.8.1 Profilassi Diretta ... 25 1.8.2 Profilassi Indiretta ... 26 1.9 TERAPIA ... 26 1.10 RIFERIMENTINORMATIVI ... 27 1.11 ASPETTIZOONOSICI ... 28
Capitolo Due – Parte Sperimentale ... 29
2.1 MATERIALIEMETODI ... 29
2.1.1 Popolazione in esame ... 29
2.1.2 Siero ... 29
2.1.3 ELISA ... 29
2.1.4 Formaggi ... 32
2.1.5 Esame colturale formaggio ... 32
2.1.6 Estrazione DNA e PCR ... 32
2.2 RISULTATI ... 33
2.2.1 ELISA ... 33
2.2.2 Map nei campioni di formaggio ... 35
2.3 CONCLUSIONI ... 36
Bibliografia ... 37
Ringraziamenti ... 45
!
1
C
APITOLO UNO
Parte generale
1.1 DEFINIZIONE
La Paratubercolosi o Malattia di Johne è una patologia contagiosa a carico dell’intestino sostenuta da Mycobacterium avium subsp. paratuberculosis (OIE, 2012). La denominazione Malattia di Johne dovrebbe essere utilizzata in caso di sintomatologia clinica (Lombard, 2011); la fase preclinica dovrebbe invece essere definita propriamente paratubercolosi.
Colpisce primariamente i Ruminanti, sia domestici che selvatici ed è caratterizzata da un lungo periodo di incubazione che esita in infiltrazioni granulomatose dell’intestino con conseguenti deperimento e morte degli animali (Whittington et al., 2011).
1.2 STORIA
Dalla seconda metà del XIX secolo viene riscontrata sempre più frequentemente una patologia enterica debilitante nel bestiame, la cui causa rimane sconosciuta per circa settant’anni. In questi decenni, tuttavia, vengono identificati i patogeni tubercolari umani e aviari e le malattie che ne conseguono sia nell’uomo che nel bovino. Nel 1894, in Germania ed in particolare dalla regione Oldenburg, una bovina da latte è sottoposta ad esame anatomopatologico dal Dr. H. A. Johne dell’Istituto di Patologia Veterinaria di Dresda per sospetta tubercolosi intestinale in seguito a mancata produzione lattea e mantenimento del peso soddisfacenti segnalati dal veterinario. Insieme al Dr. Johne si trova il collega di Boston, Dr. L. Frothingham, che collabora alla descrizione delle lesioni e viene notata la presenza di microrganismi acido-resistenti a livello di tratto intestinale: a questo punto sembra confermata la diagnosi di tubercolosi intestinale, ma la coltura del microrganismo non risulta possibile e l’esperimento di riprodurre la malattia in una cavia inoculata con tessuto infetto fallisce. Per questo motivo i due ricercatori sospettano il coinvolgimento del patogeno responsabile della tubercolosi aviare, proponendo per la malattia il nome di enterite pseudotubercolare, una sorta di “falsa tubercolosi”.
A seguito di questa prima descrizione, inizia a manifestarsi lo stesso tipo di segnalazione da tutto il mondo, indicando una diffusione importante della malattia. Durante il primo decennio del XX secolo il danese Bang, incuriosito da questa malattia, la cui eziologia rimane ancora sconosciuta, riconosce che nei tessuti le lesioni non sono di origine tubercolare e propone un nuovo nome per la malattia, paratubercolosi, cioè che ricorda la tubercolosi. Lo studioso nota anche che gli animali affetti da paratubercolosi non manifestano risposta alla sensibilizzazione con la tubercolina, mentre invece si
2
sensibilizzano ai preparati a base di tubercolina aviare; queste osservazioni danno origine ai primi test diagnostici. In circa vent’anni, a partire cioè dalla prima descrizione anatomopatologica, la malattia è riconosciuta e segnalata in Europa e negli Stati Uniti.
Nel 1910, Twort, scienziato britannico, riesce ad isolare il patogeno grazie ad un evento fortuito e propone il nome di Mycobacterium enteriditis chronicae pseudotuberculosis bovis johne. Decisamente meno accidentale è invece il lavoro di Holth, che purtroppo, nonostante sia stato riconosciuto e accettato dagli Studiosi contemporanei, è andato perso nel tempo: lo scienziato riesce ad isolare il microrganismo in un lavoro indipendente e nello stesso anno di Twort, denominandolo semplicemente bacillo della paratubercolosi e ipotizzando la presenza di più specie dello stesso.
Grazie all’isolamento dell’agente eziologico e l’estrazione dei suoi antigeni, si aprono le porte agli esperimenti per comprenderne il comportamento biologico e la patogenesi e, di conseguenza, allo sviluppo di strumenti diagnostici come fissazione del complemento, agglutinazione, test cutanei. Valle e Ringard, nel 1923, durante una serie di esperimenti per studiare la trasmissione della malattia, osservano che l’inoculazione sottocutanea non determina malattia e in seguito a ciò si sviluppa un vaccino. Sempre nello stesso anno, è pubblicata la prima edizione del Bergey’s Manual of Determinative Bacteriology e, riconoscendo la nomenclatura di Bang e Holth, nomina ufficialmente la malattia come paratubercolosi e il suo agente patogeno Mycobacterium paratuberculosis. A partire dagli anni Venti, in seguito agli studi e alle scoperte, la comunità scientifica chiede che la malattia venga denunciata e controllata poichè, a livello mondiale, si assiste ad una diffusione importante che allerta e porta l’attenzione a sistemi di prevenzione e controllo. Infatti, tra il 1922 e il 1935, almeno dodici paesi a livello mondiale si muovono per applicare misure di controllo. Anche il World Health Organization richiede la classificazione e il controllo della malattia, così come era stato fatto per la brucellosi. Nonostante l’appello di un’organizzazione di così alto livello, le misure di controllo vengono ignorate seppure la malattia sia già riconosciuta e classificata come una “comune” malattia del bestiame (Chiodini, 1993).
Dagli anni Trenta ad oggi sono poche le scoperte o gli studi di grande impatto sulla paratubercolosi importanti dal punto di vista storico. Questo senza sminuire il lavoro svolto da numerosi ricercatori durante gli ultimi decenni e il loro contributo per permettere ai posteri di conoscere e comprendere meglio la malattia, rendendo fondamentale l’insieme dei lavori svolti, più che la considerazione del singolo studio: infatti sono stati sviluppati test diagnostici, studi sperimentali e osservazionali, misure di prevenzione, soprattutto durante i primi anni Trenta e Quaranta. Nel 1939, un ceppo di laboratorio di M. paratuberculosis micobactina-indipendente viene depositato all’American Type Culture Collection come ceppo di riferimento e designato con ATCC 12227, conosciuto anche con il nome “ceppo 18”; fino al 1968 è considerato il “ceppo tipo” su cui fondare le ricerche per la paratubercolosi, poiché successivamente viene ritirato dall’ATCC e oggi si è a conoscenza che il “ceppo 18”, probabilmente un contaminante di laboratorio, è in realtà un ceppo di M. avium serovar 2. Di
3
conseguenza, molte ricerche e dati sviluppati tra il 1920 (anni in cui il ceppo è stato descritto per la prima volta) e gli anni Settanta risultano non validi.
Nel 1983 Richard Merkal del National Animal Disease Center in Iowa organizza un convegno per raccogliere a livello mondiale tutti i ricercatori impegnati nello studio della paratubercolosi e per la prima volta il meeting è dedicato unicamente alla malattia: nasce così The International Colloquium on Research in Paratuberculosis, un piccolo gruppo rappresentato però dai maggiori esperti del tempo in materia di paratubercolosi. L’anno successivo M. paratuberculosis è isolato da un paziente umano affetto da morbo di Crohn, determinando la prima prova fisica di un collegamento tra M. paratuberculosis negli animali da reddito e morbo di Crohn nell’uomo. Già dalla seconda metà dell’Ottocento è segnalata la somiglianza tra le due malattie e, mano a mano, sempre più ricerche sembrano accomunarle ulteriormente. Nel 1988 Marie Thorel e Dick Merkal organizzano in Francia, ad Alfort, un secondo meeting sempre unicamente dedicato alla paratubercolosi denominandolo Second International Colloquium on Paratuberculosis: è durante questo incontro che nasce l’identità dello stesso e la sua dedizione alla malattia, tanto che l’anno successivo l’associazione viene ufficialmente fondata, registrata e aperta all’iscrizioni di membri. Sempre nel 1989, una sequenza del genoma specie-specifica di M. paratuberculosis, conosciuta come IS900, è identificata da due gruppi di ricercatori indipendenti gli uni dagli altri. Questa scoperta fornisce i primi mezzi definitivi e non-soggettivi per l’identificazione di questo organismo, oltre che promuovere il miglioramento delle prove diagnostiche per il riconoscimento delle specie.
Nel 1990, Marie Thorel e i suoi collaboratori pubblicano le loro scoperte sull’analisi di matrice di M. paratuberculosis e diverse specie di M. avium concludendo che il primo appartiene al M. avium complex; si propone quindi di modificare la denominazione di M. paratuberculosis in M. avium subsp. paratuberculosis. Con la pubblicazione della proposta di modifica di nomenclatura sull’International Journal of Systematic Bacteriology, M. avium subsp. paratuberculosis (comunemente abbreviato con Map), diventa ufficialmente e formalmente il nome del microrganismo.
1.3 EZIOLOGIA
La Paratubercolosi è sostenuta da Mycobacterium avium subsp. paratuberculosis.
Mycobacterium è l’unico genere della famiglia Mycobacteriaceae che secondo il sequenziamento del gene 16S rRNA rientra nell’ordine Corynebacteriales e raccoglie numerose specie, anche di rilevanza sanitaria. I micobatteri sono microrganismi aerobi, leggermente curvi o di forma bastoncellare (0,2-0,6 x 1,0-10 µm), immobili, asporigeni e, nonostante risultino difficili da evidenziare con la colorazione di Gram, vengono considerati Gram positivi. Si caratterizzano per resistere agli acidi per la composizione della parete cellulare e la tecnica di colorazione Ziehl-Neelsen è fondamentale per individuarli all’osservazione microscopica (Magee e Ward, 2012). I micobatteri sono organismi che richiedono particolari terreni per la coltura, arricchiti ad esempio con proteine dell’uovo, acido oleico e albumina
4
e, nel caso di Mycobacterum avium subsp. paratuberculosis, è necessario come supplemento di crescita la micobactina (Zavanella, 2012).
Al momento della stesura del Bergey’s Manual® (2012) gli Autori riportano l’esistenza di 129 specie e sottospecie riconosciute del genere Mycobacterium. Identificazione e descrizione dei micobatteri hanno subito modifiche nel tempo passando da una caratterizzazione fenotipica (velocità di crescita, temperatura, morfologia e pigmentazione delle colonie, tolleranza a NaCl e crescita su terreno MacConkey per i ceppi a rapida crescita) ad una genotipica; nonostante ciò, uno dei caratteri distintivi rimane la velocità di crescita delle colonie in coltura. Infatti, la maggior parte delle specie può essere suddivisa per motivi pratici in due gruppi tassonomici: uno a lenta crescita, cioè sono necessari almeno sette giorni di incubazione a temperatura ottimale per ottenere colonie da inoculi altamente diluiti, e uno a rapida crescita, dove a parità di condizioni colturali, si ottengono colonie in meno di sette giorni. Generalmente le specie di interesse sanitario appartengono al primo gruppo. E’ proprio l’interesse clinico ad influenzare la tassonomia dei micobatteri; inizialmente sono stati suddivisi e classificati in relazione a Mycobacterium tuberculosis, agente patogeno della tubercolosi umana, generando un gruppo di “micobatteri atipici” che raccogliesse i ceppi non identificabili come Mycobacterium bovis o Mycobacterium tuberculosis. Solo a partire dagli anni cinquanta la classificazione subisce una modificazione, tuttora accettata e utilizzata. Runyon suddivide tutti i micobatteri, ad eccezione di Mycobacterium tuberculosis complex e di altri non coltivabili, in quattro gruppi (schema di Runyon) in base alla velocità di crescita e caratteristiche di colorazione delle colonie (Magee e Ward, 2012). Nel tempo si è manifestata una maggiore diffusione di micobatteri atipici, chiamati anche con l’acronimo MOTT (Mycobacteria other than tuberculosis), probabilmente in seguito a chemioterapia fortemente applicata per combattere le forme tubercolari e all’interesse che i ceppi atipici hanno stimolato (Zavanella, 2012). Le Tabelle 1 e 2 schematizzano quanto sopra descritto.
Mycobacterium tuberculosis complex
M. africanum M. bovis M. microti M. tuberculosis
Micobatteri atipici – gruppi di Runyon
I. Fotocromogeni II. Scotocromogeni
III. Non cromogeni a lenta crescita IV. A rapida crescita
Tabella 1. Classificazione dei micobatteri patogeni (Bergey’s Manual), da Zavanella (2012), modificato.
!
!
!
5 Gruppo I di Runyon M. kansasii M. marinum M. simiae Gruppo II di Runyon M. scrofulaceum M. szulgai M. xenopi
Gruppo III di Runyon
M. avium complex M. genavense M. haemophilus M. malmoense Gruppo IV di Runyon M. abscessus M. chelonae M. fortuitum M. mucogenicum
Tabella 2. MOTT – Gruppi di Runyon, da Zavanella (2012), modificato.
Mycobacterium avium complex (MAC), appartenente al Gruppo III di Runyon, inizialmente raccoglieva solo due specie, denominate M. avium e M. intracellulare, a causa della difficoltà delle tecniche diagnostiche a differenziare le numerose specie raggruppabili nel complex. Negli ultimi decenni, grazie all’avvento di metodi diagnostici genotipici e fenotipici, è stato possibile evidenziare l’esistenza di una varietà importante di microrganismi ambientali e associati agli animali con differenti caratteristiche di patogenicità, preferenze d’ospite e distribuzione nell’ambiente esterno: all’interno del complex si ritrovano, quindi, nove specie di micobatteri a lenta crescita, compresi anche quelli non ancora definitivamente classificati, come riportato in Tabella 3, dove si nota l’ulteriore suddivisione della specie M. avium in quattro sottospecie (Rindi e Garzelli, 2014).
!
Specie Sottospecie Patogenicità Preferenza d’ospite
M. avium
subsp. avium TB aviare Uccelli
subsp. hominissuis Polmonite e infezioni multiple dei tessuti molli, linfoadenite cervicale Uomo, suino subsp. paratuberculosis Malattia di Johne Ruminanti subsp. silvaticum Malattia simil TB Colombo
M. intracellulare Polmonite Uomo
M. colombiense Infezioni multiple, linfoadenopatia Uomo
M. chimaera Polmonite Uomo
M. marseillense Polmonite Uomo
M. timonense Polmonite Uomo
M. boucherdurhonense Polmonite Uomo
M. vulneris Linfoadenopatia, ferite Uomo
M. arosiense Osteomielite Uomo
Atri MAC Polmonite, infezioni multiple Uomo
Tabella 3. Il Mycobacterium avium complex, da Rindi e Garzelli (2014), modificato.
Secondo l’identificazione di alcune sequenze genomiche (IS900 e IS1311), Mycobacterium avium subsp. paratuberculosis (Map) è stato inizialmente classificato in due gruppi che ne riflettevano parzialmente la specificità d’ospite: tipo S (sheep), identificato anche come tipo I, prevalente nelle pecore, e tipo C (cattle) o tipo II, con uno spettro d’ospite maggiore, ma più frequentemente isolato in bovini e capre (Stevenson, 2010; Dimareli-Malli et al., 2013 a; Rindi e Garzelli, 2014); recentemente è
6
stato identificato un sottotipo del tipo I, denominato tipo III o “intermedio” (Rindi e Garzelli, 2014). Lo studio svolto da Whittington et al. (2011) ha evidenziato gli isolamenti di ceppi in diversi animali in altrettanti paesi come Stati Uniti, Spagna, Irlanda del Nord e Australia individuando le varianti C in bovini, ovicaprini, un primate, Ruminanti selvatici e un camelide, le varianti S in bovini, pecore e un camelide e la variante B unicamente in un bisonte.
Map è un bacillo di 1-2 µm di lunghezza, acido-resistente, asporigeno, immobile, aerobio. Questo micobatterio necessita di una sostanza chelante il ferro conosciuta come micobactina, sintetizzata da tutti i micobatteri eccetto Map. La crescita di alcuni ceppi può essere stimolata ulteriormente dall’aggiunta di sodio piruvato e al contrario rallentata o inibita da pH 5,5 e concentrazioni al 5% di NaCl; tutti i ceppi sono tolleranti alla cicloserina (50 µg/ml). Nonostante gli accorgimenti colturali, Map richiede almeno 3-4 mesi per un primo isolamento (Magee e Ward, 2012), con differenze tra le varianti.
La coltura di M. avium subsp. paratuberculosis dagli ovini è sempre risultata meno appagante e soddisfacente rispetto a quella ottenuta da altre specie affette da paratubercolosi e uno studio australiano ha dimostrato che è necessario applicare accortezze aggiuntive nell’allestimento dei terreni di coltura (Whittington et al., 1999). I ceppi ovini presentano una crescita più lunga, fino a otto mesi contro le 4-16 settimane dei ceppi bovini, a parità di 37°C di temperatura (Zavanella, 2012).
1.4 EPIDEMIOLOGIA
1.4.1 DiffusioneLa Paratubercolosi è diffusa a livello mondiale, ad eccezione di alcune regioni australiane e della Svezia che ne dichiarano l’indennità (www.oie.int); la prevalenza della malattia negli animali e negli allevamenti di molti paesi rimane tuttora sconosciuta o comunque in aumento nel caso non vengano applicate misure di controllo (Salem et al., 2013; VinodhKumar et al., 2013). Nei paesi invece dove l’allevamento di tipo intensivo è meno praticato e il clima si presenta più secco e asciutto, non è facile individuare la malattia e l’incidenza risulta più bassa (Pavlik et al., 2000 a).
In Italia sono state effettuate indagini sierologiche in Toscana e nelle Marche dalle quali risulta una prevalenza stimata tra l’11,1% ed il 19,1% (Tabella 4).
Regione Provincia Specie Test Prevalenza Bibliografia Marche Macerata ovini ELISA 18,7% Attili et al., 2011 Marche Ancona ovini ELISA 11,1% Attili et al., 2011 Toscana Lucca capre AGID 19,1%, 18% Cerri et al., 2002
7
Un metodo di indagine epidemiologica, meno dispendioso rispetto agli strumenti diagnostici utilizzati per confermare la presenza di Map ma altrettanto significativo, può essere la sorveglianza al macello, soprattutto in situazioni dove si presentano elevata numerosità di capi (Sergeant e Baldock, 2002), vastità del territorio e scarse risorse economiche (VinodhKumar et al., 2013).
Come già accennato precedentemente, gli isolati di Map sono stati identificati per più di un secolo in base a caratteristiche fenotipiche evidenziate durante la coltura su terreni appositi; di queste, quelle maggiormente importanti per differenziare le colture del microrganismo sono la dipendenza da micobactina, sostanza esogena necessaria alla crescita del batterio, la velocità di sviluppo delle colonie e, non sempre, la loro colorazione. In particolare, per quest’ultima caratteristica, Stevenson et al. (2002) hanno descritto come la colorazione giallo-arancio dell’intestino per la massiva presenza di micobatteri caratterizzi la paratubercolosi nelle pecore; il pigmento sembra essere una caratteristica propria, si manifesta durante le fasi di crescita batterica e non si altera in seguito a trasmissione tra animali. Ed è proprio il pigmento a caratterizzare i ceppi che presentano come ospite principale la pecora (ceppi S), anche se possono produrre infezione, per via sperimentale, nel bovino, dove le colonie isolate non producono pigmento (ceppi C). I ceppi S e C hanno quindi caratteristiche fenotipiche e genotipiche comuni, ma anche piccole eterogeneità che ne consentono la distinzione. Questa divisione in cluster supporta osservazioni precedenti sulla presenza di due forme differenti di Paratubercolosi ovina in Inghilterra, una causata dal ceppo prevalentemente isolato nel bovino e l’altra sostenuta da un ceppo a lenta crescita e pigmentato. Dallo studio effettuato gli Autori quindi evidenziano che esiste una preferenza di ospite, ma non una specie-specificità di infezione: in Australia e in Nuova Zelanda, ad esempio, vengono più frequentemente isolati nelle pecore i ceppi S, mentre in Europa è il ceppo C a predominare nelle infezioni di Ruminanti e non; altrettanto non è possibile limitare la distribuzione geografica di un ceppo rispetto all’altro (Stevenson et al., 2002). Studi sperimentali hanno comunque confermato che la pecora può essere infettata sia da ceppi ovini che bovini (Stewart et al., 2004). Con un lavoro del 2007, condotto da Florou et al. per studiare l’interazione di Map tra Ruminanti al pascolo e animali selvatici, è stata dimostrata la presenza di un ceppo S in un ratto, permettendo di ampliare lo studio epidemiologico e la possibilità di infezione a più specie animali. Per quanto riguarda la velocità di crescita su terreni solidi invece, Motiwala et al. (2006) distinguono due differenti fenotipi isolati da ospiti specifici. Un fenotipo manifesta crescita di colonie dopo 16 settimane (a lenta crescita, spesso pigmentato e generalmente isolato da feci di pecora), l’altro dopo 6-12 settimane (a rapida crescita e più frequentemente isolato da feci di caprini e bovini).
1.4.2 Trasmissione
La trasmissione di M. avium subsp. paratuberculosis si realizza generalmente:
a) per via oro-fecale tramite l’assunzione di latte, colostro, mangime ed acqua contaminati da feci contenti Map;
8
b) per via congenita;
c) per via transmammaria tramite l’ingestione di latte e colostro infetto (Lombard, 2011).
Sono state ipotizzate anche altre vie di infezione, sebbene considerate di minore importanza, ad esempio quella venerea e, meccanicamente, durante procedure veterinarie di embryotransfer o esplorazione rettale (Corner et al., 2003).
Studi sperimentali (Corner et al., 2003) hanno suggerito come altra possibile via d’infezione quella respiratoria; è stata messa in evidenza la presenza di Map nella polvere di ricoveri in una stalla con bovini infetti, suggerendo quindi la possibilità che il batterio possa essere trasportato e trasmesso tramite aerosol (Eisenberg et al., 2010). Un ulteriore studio riporta il ritrovamento del microrganismo in animali infetti nei linfonodi tracheobronchiali, a supporto della possibilità che si verifichi una trasmissione per via respiratoria (Pavlik et al. 2000 b).
Conoscere le diverse modalità di trasmissione e le specie suscettibili è fondamentale per poter controllare e prevenire la malattia: per questo sono stati effettuati diversi studi sulle diverse vie di ingresso di Map.
a) Trasmissione oro-fecale: è la via di trasmissione più studiata; il contatto e l’ingestione di feci eliminate da animali clinicamente infetti permettono l’entrata del microrganismo nell’ospite e quindi la possibile evoluzione a malattia. Generalmente l’ingresso della malattia in un allevamento avviene con l’introduzione di nuovo capo infetto che elimina il patogeno con le feci (Salem et al., 2013); l’eliminazione, soprattutto nei primi stadi sub-clinici della malattia, può essere intermittente, cosicché ad uno screening iniziale si possono avere risultati falsi negativi (Cousins et al., 2002). La gestione del ricovero o del pascolo negli allevamenti di tipo semi-intensivo o estensivo è di fondamentale importanza al fine di evitare o limitare la diffusione di Map nell’ambiente. Ciò è particolarmente importante nell’allevamento ovino in cui i neonati ed i giovani, molto più sensibili e suscettibili all’infezione, rimangono a stretto contatto con le madri e gli adulti (a differenza ad esempio dell’allevamento della bovina da latte dove generalmente il vitello è allontanato dalla madre dopo poche ore dal parto) e pascolano su terreni infetti. La suscettibilità dell’individuo all’infezione naturale è stata esaminata da McGregor et al. (2012) utilizzando la pecora come modello di studio, al fine di valutare come età dell’individuo e carica batterica influenzino l’evoluzione della malattia. La recettività all’infezione è massima nell’agnello e diminuisce con l’aumentare dell’età; in soggetti che si sono infettati da giovani con elevate quantità di microrganismo, l’escrezione di Map con le feci è anticipata: attorno ai 6 mesi di età per il primo isolamento da un agnello, 11 mesi per una femmina e 18 mesi per un agnellone. L’elaborazione dei dati ottenuti da questo studio ha permesso agli Autori di costatare che Map è in grado di colonizzare, anche a basse dosi infettanti, l’intestino ed i linfonodi tributari di pecore di ogni età.
9
b) Trasmissione congenita: il passaggio di Map attraverso la barriera placentare è stato documentato in diversi studi. Nonostante il meccanismo di infezione fetale non sia al momento ben conosciuto, si ipotizza una contaminazione dell’embrione a seguito della diffusione del microrganismo all’utero per via ematica o linfatica. Secondo uno studio di Sweeney et al. (1992 a) circa il 17% delle bovine con malattia subclinica ed elevata eliminazione fecale del microrganismo partorisce vitelli positivi all’esame colturale. L’infezione si realizza nel vitello per via congenita nel 39% dei soggetti nati da madre con malattia clinicamente manifesta e nel 9% dei soggetti nati da madre con infezione subclinica (Whittington e Windsor, 2009). Per quanto riguarda la specie ovina, gli studi sono meno numerosi, probabilmente con positività sottostimate in seguito alla difficoltà di isolamento del ceppo S ed alla mancanza di lesioni fetali (Clarke, 1997). Lambeth et al. (2004) hanno pubblicato uno studio per determinare la percentuale di agnelli infetti nati da pecore con malattia subclinica e clinica. Negli agnelli nati da madri con forma subclinica l’infezione era presente solo nel 1,9% degli animali, mentre in quelli nati da madri con forma clinica l’infezione era presente nel 100% dei soggetti (Tabella 5).
Stato infezione pecore Numero pecore Numero feti Numero di feti infetti % pecore con feti infetti % feti infetti (95% CI) Malattia clinica 5 6 5 100 83 (36,100) Malattia subclinica 54 63 1 1,9 1,6 (0,9) Assenza infezione 47 50 0 0 0 (0,7) Malattia clinica o assenza infezione 101 113 1 1 0,9 (0,5) Totale 106 119 6 5,7 5,0 (2,11)
Tabella 5. Confronto dei feti infetti e relative madri, da Lambeth et al. (2004), modificato.
c) Trasmissione per ingestione di colostro e latte infetto: la mammella continua ad essere oggetto di studio per la trasmissione della paratubercolosi. In particolare, l’attenzione degli Studiosi converge sulla possibilità che il microrganismo possa raggiungere il tessuto mammario ed essere escreto insieme al latte o colostro (Lombard, 2011). Esistono diversi studi che riportano la possibilità di infezione transmammaria nel bovino non solo in animali con forma clinica, ma anche in animali con forma subclinica (Streeter et al., 1995). L’escrezione mammaria è correlata a quella fecale – anche se il numero di cellule batteriche nel latte infetto può comunque risultare nettamente inferiore rispetto a quello presente nei campioni fecali (Sweeney et al., 1992 b); nei capi con sintomatologia clinica l’eliminazione è maggiore (Giese e Ahren, 2000). Il colostro invece risulta più ricco di microrganismi, probabilmente in seguito alla tipica presenza elevata di macrofagi (Meylan et al., 1996); i neonati, più sensibili all’infezione, assumendo colostro con anticorpi per Map manifestano un aumento della fagocitosi dei microrganismi da parte delle cellule intestinali M (Momotani et al., 1988). Di conseguenza si
10
ipotizza che l’infezione neonatale avvenga più facilmente in seguito ad ingestione di colostro infetto piuttosto che di latte, anche se il ruolo epidemiologico del latte ovino nella trasmissione della paratubercolosi non è ancora del tutto chiaro.
1.4.3 Resistenza
Come tutti i microrganismi appartenenti al genere Mycobacterium, Map si caratterizza per una forte resistenza nell’ambiente esterno grazie all’elevato grado di impermeabilità della parete cellulare (Hett e Rubin, 2008). Questa, infatti, si compone di uno spesso strato di cere costituite fino al 60% di complessi lipidici che conferiscono la tipica caratteristica di acido-resistenza, idrofobia e quindi capacità di resistere a bassi valori di pH, alte temperature e prodotti chimici (Klanicova et al., 2012). La resistenza di Map è documentata in numerosi studi, particolarmente per quanto riguarda la possibilità di trasmissione del patogeno tramite acqua (Whittington et al., 2005; Aboagye e Rowe, 2011) ed alimenti ed è stato ipotizzato che il batterio, in condizioni ambientali avverse, sia in grado di sviluppare uno stato di quiescenza senza lo sviluppo di spore (dormancy) che ne permette la persistenza nell’ambiente (Whittington et al., 2004; Rowe e Grant, 2006). La resistenza al calore è di particolare interesse per gli Studiosi in quanto può avere ripercussioni sulla salute pubblica, poiché diverse ricerche hanno dimostrato la resistenza del patogeno alla pastorizzazione (Chiodini e Hermon-Taylor, 1993; Stabel et al., 1997; Grant et al., 2002 a; Grant et al., 2002 b) ed il trattamento del latte con raggi UV non è risultato tuttora una valida alternativa (Donaghy et al., 2009). Map risulta resistente agli ambienti acidi (Sung e Collins, 2003), tanto che anche i foraggi possono rappresentare fonte di infezione per gli animali poiché l’acidità degli insilati, in seguito alla liberazione di acidi organici durante la fermentazione della matrice vegetale, non è sufficiente ad inattivare completamente i microrganismi (Cook et al., 2012). E’ addirittura improbabile che lo smaltimento delle carcasse di animali, in condizioni sperimentali di ricostruzione di siti di compostaggio, possa inattivare completamente Map (Tkachuk et al., 2013). La Tabella 6 di Whittington et al. (2004) riassume le tempistiche di resistenza di Map finora riportate negli studi di laboratorio e di campo con diverse condizioni ambientali.
11 Substrato Origine Map T (°C) Sopravvivenza Bibliografia Liquidi dipping, letame, feci,
urine
Dipping amitraz per bovini
(pH 12,4) Feci naturalmente infette 22 >2, <3 settimane Eamens et al., 2001 Letame bovino anaerobico
(feci, urine, paglia e acqua)
Da coltura 5 >252, <287 giorni Jorgensen et al., 1977 Letame bovino anaerobico Da coltura 15 >98, <112 giorni Jorgensen et al., 1977 Letame bovino anaerobico Da coltura 35 >21, <28 giorni Olsen et al., 1985 Letame bovino anaerobico Da coltura 53-55 <1 giorno Olsen et al., 1985 Feci bovine Feci naturalmente infette Mancante >5 mesi Stuart et al., 1965 Feci bovine Da coltura Non certa 11 mesi Vishnevskii et al., 1940 Feci bovine (liquide) Feci naturalmente infette -3 – 23 >246, <284 giorni Lovell et al., 1944 Feci bovine Feci naturalmente infette -2 – 23 >208, <236 giorni Lovell et al., 1944 Feci bovine Feci naturalmente infette -2 – 23 <5 mesi Lovell et al., 1944 Feci caprine Feci naturalmente infette -2 – 23 >67 giorni Lovell et al., 1944 Urine bovine Da coltura Non certa 7 giorni Vishnevskii et al., 1940 Urine bovine Da coltura 38 <30 giorni Larsen et al., 1956 Urine e feci bovine Da coltura 38 <30 giorni Larsen et al., 1956 Acqua
Di rubinetto (pH 7) Da coltura 38 >17, <19 mesi Larsen et al., 1956 Di rubinetto (pH 5 o 8,5) Da coltura 38 >14, <17 mesi Larsen et al., 1956 Distillata, sterile (pH 6,4-6,8),
in bottiglia sigillata
Da coltura 9 – 26 >9, <13 mesi Lovell et al., 1944 Di rubinetto, sterile (pH
7,1-8,0) in bottiglia sigillata
Da coltura 9 – 26 >9, <13 mesi Lovell et al., 1944 Di stagno e fango, sterile (pH
5,3-5,9), in bottiglia sigillata Da coltura 9 – 26 >9, <13 mesi Lovell et al., 1944 Di fiume in bottiglia Raschiati intestino bovino Ambiente >113, <141 giorni Lovell et al., 1944 Di fiume Raschiati intestino bovino -7 – 18 >135, <163 giorni Lovell et al., 1944 Di fiume Raschiati intestino bovino -7 – 18 <163, <218 giorni Lovell et al., 1944 Distillata Da coltura Incerta 455; 69-92 Dvalue Collins et al., 2001 Modelli di laboratorio
Insilamento (pH 4,4) Da coltura 30 – 37 <14 giorni Katayama et al., 2000 Insilamento NH3>1% Da coltura 37 <14 giorni Katayama et al., 2001
Soluzione fisiologica Da coltura 38 >17, <19 mesi Larsen et al., 1956 Colture essiccate Da coltura 38 >17 mesi Larsen et al., 1956 Colture essiccate Da coltura 38 >47 mesi Larsen et al., 1956 Colture essiccate Da coltura Variabile Vitale Larsen et al., 1956 Colture essiccate Da coltura Variabile Vitale Larsen et al., 1956 Colture essiccate Da coltura Fino a 44 >65, <100 ore Larsen et al., 1956 Feci bovine Feci naturalmente infette -70 >15 settimane Richards et al., 1977 Feci bovine Feci naturalmente infette -70 >15 settimane Richards et al., 1981 Feci bovine Feci naturalmente infette -70 <15 settimane Richards et al., 1981
Tabella 6. Riassunto della durata di sopravvivenza registrata di MAP, ceppo C, da Whittington et al. (2004), modificato.
!
1.5 PATOGENESI
La patogenesi della paratubercolosi non è ancora del tutto conosciuta: si suppone che gli animali contraggano l’infezione nelle prime fasi di vita e possano in seguito sviluppare la malattia o rimanere infetti ma asintomatici, oppure resistere all’infezione stessa (Clarke, 1997; Gillan et al., 2010 b; Whittington et al., 2012). I segni clinici cominciano a manifestarsi mesi o anni dalla prima esposizione, più frequentemente in prossimità del parto; il periodo di incubazione varia a seconda della specie ospite e del ceppo di Map: nel bovino, in genere, il periodo di incubazione va dai 3 ai 10 anni, mentre negli ovicaprini è di 3-4 anni (Whittington et al., 2012). Le lesioni riscontrate negli animali con sintomatologia clinica mostrano un certo grado di variabilità, ad eccezione della pecora dove si classificano due tipi di lesioni, identificate in base alla composizione cellulare di macrofagi e
12
linfociti, cioè paucibacillari o multibacillari (Clarke e Little, 1996; Pérez et al., 1996). In uno studio recente, è stata valutata la differenza tra lesioni in agnelli infettati sperimentalmente con ceppi C ed S: nel primo caso l’infezione si sviluppa più rapidamente generando gravi ed estese lesioni accompagnate da una altrettanto elevata risposta immunitaria che però determina, col tempo, una riduzione delle lesioni stesse. Al contrario, l’infezione indotta con ceppi S provoca lesioni granulomatose focali a carico del tessuto linfoide dell’intestino presenti durante l’intero periodo di osservazione degli animali (Fernández et al., 2014). Considerando l’esposizione orale come la modalità di infezione principale, sono state esaminate sperimentalmente due possibili vie con cui il microrganismo può infettare l’ospite. La prima è l’invasione delle tonsille, testimoniata dalla presenza di Map nel tessuto linfoide retrofaringeo poco dopo l’esposizione; da questa sede si può avere la diffusione del patogeno attraverso la via ematica o linfatica fino all’ileo ed ai linfonodi mesenterici tributari. La seconda via, quella più accreditata, è rappresentata dall’ingresso di Map direttamente a livello di ileo dell’ospite (Sweeney, 2011). In particolare, il target dell’infezione, probabilmente per la scarsità di lisosomi ed enzimi idrolitici, è costituito dalle cellule M che costituiscono parte della mucosa intestinale ed appartengono al tessuto linfoide delle placche del Peyer (Sigur-Dardóttir et al. 2001; Coussens et al., 2010). E’ grazie alle cellule M che avviene la traslocazione di Map dal lume intestinale alla sottomucosa, dove sono i macrofagi a fagocitare i microrganismi. Nel caso i macrofagi siano in grado di eliminare Map, l’infezione si arresta; purtroppo, la caratteristica resistenza del patogeno fa sì che la risposta immunitaria non sia in genere sufficiente ad arginare l’infezione, portando alla cronicizzazione della stessa. Infatti, citochine come il γ-interferone, prodotte dai linfociti T helper1 e T helper2, interverrebbero per indurre l’eliminazione intracellulare di Map, ma, per meccanismi ancora sconosciuti, pare che il microrganismo prevenga l’attivazione dei macrofagi stessi evitando l’azione battericida di enzimi lisosomiali e di radicali liberi (Sweeney, 2011). In genere, le prime fasi dell’infezione si caratterizzano per una risposta immunitaria abbastanza efficace: non si manifestano segni clinici e, soprattutto, non sono apprezzabili eliminazione fecale di Map e presenza di anticorpi, di conseguenza non è possibile rilevare la presenza del patogeno se non tramite coltura da campionamento dell’ileo o dei linfonodi tributari o con la PCR. La continua presenza di Map stimola il richiamo di nuovi macrofagi e linfociti, con la conseguente formazione di granulomi con cellule giganti multinucleate e ulteriore richiamo di cellule infiammatorie: le lesioni da localizzate diventano più estese fino a determinare sintomatologia clinica (Sweeney, 2011). La mancata efficacia dell’immunità cellulo-mediata nel controllare l’infezione con la produzione di γ-interferone per attivazione di linfociti Th1, si associa spesso all’attivazione di un’altra popolazione di linfociti, i Th2, che secernono altri tipi di citochine come IL-4 e IL-10 e sono coinvolti nella produzione di anticorpi, spesso non rilevabili in questa fase mediante tecnica ELISA; la causa scatenante la modificazione dell’immunità dell’animale rimane tuttora sconosciuta. Da questo momento, inizia l’eliminazione fecale di Map e la possibile diffusione ad altri organi come utero, mammella e muscolo (Sweeney, 2011).
13
1.6 SINTOMATOLOGIA
La malattia di Johne presenta differente sintomatologia a seconda che siano colpiti i bovini o i piccoli Ruminanti. Whitlock e Buergelt (1996) individuano quattro stadi della malattia nel bovino in base ai segni clinici, alla quantità di Map eliminata ed ai rilievi di laboratorio; secondo questi criteri gli animali con sintomatologia clinica rappresentano solo una percentuale minima, al contrario degli eliminatori asintomatici e quelli infetti (Tabella 7), tanto da identificare la situazione epidemiologica di un gruppo di animali positivi a Map come un iceberg. L’analogia con l’iceberg riassume adeguatamente il comportamento della malattia in allevamento, dove il numero di casi clinici non coincide mai con la prevalenza di paratubercolosi: solo bovini classificabili come III stadio manifestano perdita di peso e diarrea intermittente con comunque segni vitali, frequenza cardiaca e respiratoria e temperatura normali. Con la progressione della malattia gli animali presentano progressivamente emaciazione e cachessia, accompagnate da riduzione della produzione lattea – motivi che portano alla macellazione – e, a differenza degli stadi precedenti, i bovini generalmente risultano positivi alla coltura fecale e ai kit commerciali ELISA e AGID. L’ultimo stadio della malattia di Johne si manifesta con diarrea cronica e profusa, edema intermandibolare da ipoalbuminemia, deperimento e morte dell’animale (Fecteau e Whitlock, 2010).
Stadio IV Malattia clinica avanzata 1 animale Stadio III Malattia clinica 1-2 animali Stadio II Malattia subclinica: adulti portatori 4-8 animali Stadio I Infezione silente: vitelli, giovani e adulti 10-14 animali
Totale 15-25 animali
Tabella 7. L’effetto “iceberg”, da Whitlock e Buergelt (1996), modificato.
!
Nei piccoli Ruminanti la malattia di Johne ha una sintomatologia simile a quella dei bovini: i segni clinici più comuni sono, infatti, la perdita di peso, l’edema sottomandibolare, il calo di produzione di lana e la debolezza. A differenza dei bovini, però, gli ovicaprini non presentano come sintomo clinico distintivo la diarrea, la quale può manifestarsi, in una piccola percentuale di soggetti, in forma intermittente (Robbe-Austerman, 2011). I segni clinici della malattia di Johne nella pecora si limitano alla perdita di peso cronica che si manifesta in animali di due anni e che porta alla morte gli animali entro i 3-5 anni d’età. L’edema non si presenta necessariamente, anche se sono riportate ipoalbuminemia e ipocalcemia. La maggior parte di pecore che viene a morte per malattia presenta feci di consistenza normale, anche se la diarrea si può presentare in piccola percentuale (Begg e Whittington, 2010). Come già anticipato, per la capra sono riconosciuti gli stadi della malattia analogamente al bovino, anche se i sintomi clinici sono comunque meno evidenti: solo negli stadi
14
avanzati gli animali presentano condizioni generali scadenti con mantello rovinato, emaciazione, disidratazione, sensorio depresso, anemia; difficilmente si riscontra diarrea, anche se le feci possono avere consistenza più ridotta (Djønne, 2010; Lybeck et al., 2011; Tharwat et al., 2012).
1.7 DIAGNOSI
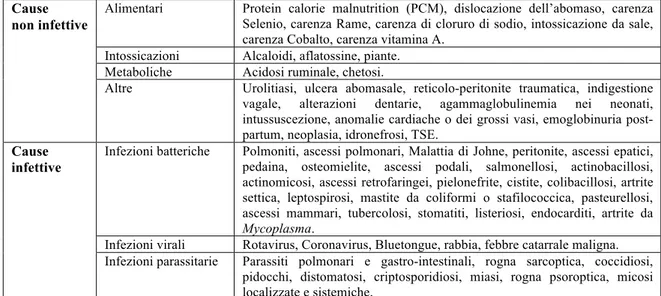
Come già descritto nel paragrafo precedente, il dimagramento progressivo è l’unico sintomo costante nella malattia di Johne negli ovicaprini: di conseguenza, nel momento in cui la perdita di peso risulta evidente, è necessario considerare in diagnosi differenziale numerose altre patologie, più o meno frequenti, che possono essere di natura infettiva o meno, come riportato in Tabella 8 (Maas e Stratton Phelps, 2009).
Cause non infettive
Alimentari Protein calorie malnutrition (PCM), dislocazione dell’abomaso, carenza Selenio, carenza Rame, carenza di cloruro di sodio, intossicazione da sale, carenza Cobalto, carenza vitamina A.
Intossicazioni Alcaloidi, aflatossine, piante. Metaboliche Acidosi ruminale, chetosi.
Altre Urolitiasi, ulcera abomasale, reticolo-peritonite traumatica, indigestione vagale, alterazioni dentarie, agammaglobulinemia nei neonati, intussuscezione, anomalie cardiache o dei grossi vasi, emoglobinuria post-partum, neoplasia, idronefrosi, TSE.
Cause infettive
Infezioni batteriche Polmoniti, ascessi polmonari, Malattia di Johne, peritonite, ascessi epatici, pedaina, osteomielite, ascessi podali, salmonellosi, actinobacillosi, actinomicosi, ascessi retrofaringei, pielonefrite, cistite, colibacillosi, artrite settica, leptospirosi, mastite da coliformi o stafilococcica, pasteurellosi, ascessi mammari, tubercolosi, stomatiti, listeriosi, endocarditi, artrite da
Mycoplasma.
Infezioni virali Rotavirus, Coronavirus, Bluetongue, rabbia, febbre catarrale maligna. Infezioni parassitarie Parassiti polmonari e gastro-intestinali, rogna sarcoptica, coccidiosi,
pidocchi, distomatosi, criptosporidiosi, miasi, rogna psoroptica, micosi localizzate e sistemiche.
Tabella 8. Cause di dimagramento nei Ruminanti, da Maas e Stratton (2009), modificato.
La ricerca di Map può avvenire mediante esame anatomo-patologico e metodiche dirette e/o indirette.
1.7.1 ESAME ANATOMO-PATOLOGICO
Le lesioni indotte da Map, generalmente confinate all’intestino ed ai linfonodi mesenterici, più raramente a fegato e tonsille, possono essere valutate dal punto di vista macro e microscopico. I linfonodi si presentano aumentati di volume, poco induriti e, sezionandoli, si riscontra un aspetto lardaceo uniforme, sarcomatoide, generalmente nel bovino senza necrosi o calcificazione che invece si possono talvolta ritrovare nei piccoli Ruminanti. All’esame istologico (Figura 1), nello stadio iniziale dell’interessamento linfonodale, si descrive una modesta infiltrazione di macrofagi epiteliodi che evolve successivamente in proliferazione granulomatosa a focolai confluenti nella zona corticale dell’organo: la popolazione cellulare infiammatoria è costituita da cellule epiteliodi e giganti, in ugual
15
misura o con prevalenza delle une o altre, fino a destrutturare il linfonodo. La colorazione Ziehl-Neelsen dell’organo rivela un gran numero di micobatteri acido-resistenti nelle cellule del granuloma. Tali cellule contengono anche abbondante ferritina e lactoferrina. Queste proteine leganti il ferro favoriscono lo sviluppo intracellulare dei micobatteri ai quali cedono il ferro ad essi indispensabile (Marcato, 2002 a). Le lesioni intestinali si manifestano con un’enterite granulomatosa (Figura 2); sono generalmente colpiti digiuno ed ileo, dove si può ritrovare la mucosa ispessita (generalmente è più evidenziabile nel bovino, tanto da definirla con “aspetto encefaloide” per le corrugazioni che si formano simili a quella corteccia cerebrale); può essere presente essudato sieroso in cavità peritoneale, edema della sierosa e del mesentere. Solitamente, soprattutto nella capra, si possono anche evidenziare piccoli focolai caseosi o caseo-calcifici di alcuni millimetri in tutto lo spessore della parete intestinale e a carico dei linfonodi tributari. Nella capra si identificano quattro tipi di lesioni istologiche, a focolai o diffuse, come riassunto in Tabella 9.
Figura 1. Linfonodo meseraico di capra. Numerosi micobatteri acido-resistenti in macrofagi epitelioidi, colorazione Ziehl-Neelsen; da Marcato (2002 a), modificato.
!
C
C
Figura 2. Reperti post mortem di 3 capre con paratubercolosi. A – parete intestinale ispessita; B – corrugazione della mucosa intestinale; C – aumento di volume dei linfonodi mesenterici; da Tharwat et al. (2012), modificato.A
B
16 Lesioni a
focolai
piccoli granulomi nelle placche del Peyer o nella adiacente lamina propria della mucosa. Lesioni
diffuse − multibacillari: enterite granulomatosa multifocale con massiva presenza di macrofagi carichi di micobatteri e conseguente ispessimento della parete. − linfocitarie: popolazione cellulare a prevalenza linfocitaria, con pochi macrofagi e pochi
micobatteri.
− miste: pari proporzione di macrofagi e linfociti con scarsa presenza di micobatteri.
Tabella 9. Classificazione delle lesioni istologiche nella capra, da Marcato (2002 b), modificato.
Alle lesioni diffuse si aggiungono necrosi dei linfatici della mucosa, del mesentere e dei linfonodi e l’ispessimento della parete si riscontra più evidente nel digiuno rispetto all’ileo.
Nella pecora (Figura 3) le lesioni istologiche sono limitate, nella fase iniziale, alle placche del Peyer ileocecali, poi alla lamina propria della mucosa che le sovrasta con formazione di granulomi costituiti da macrofagi epiteliodi. Successivamente le lesioni si estendono alla mucosa non associata alle placche, con confluenza dei granulomi a formare lesioni diffuse e lepromatose con predominanza di macrofagi o linfociti e si è dimostrato che la presenza di questi ultimi è inversamente proporzionale alla quantità di Map (Marcato,
2002 b). Recentemente si è valutata la tecnica ultrasonografica per ricercare e valutare le lesioni, soprattutto intestinali (ispessimento della mucosa, aumento di volume dei linfonodi), indotte dall’infezione nelle capre (Tharwat et al., 2012): poiché lo strumento ecografico è utilizzato nella pratica clinica per la diagnosi di gravidanza, è probabile che possa essere ulteriormente sfruttato per la valutazione dei tratti intestinali e linfonodi tributari durante l’esame clinico, associato comunque ad ulteriori indagini diagnostiche (Figura 4, Figura 5, Figura 6).
Figura 3. Pecora: la lamina propria della mucosa è infiltrata da
numerosi macrofagi epitelioidi che contengono micobatteri acido-resistenti, colorazione Ziehl-Neelsen; da Marcato (2002 b), modificato.
Figura 4. Reperto ecografico di mucosa intestinale corrugata in capra con paratubercolosi. Le lesioni (frecce) sono ben
17
Figura 5. Aspetto ecografico della parete intestinale ispessita in 4 capre con paratubercolosi. Confronto
tra controllo (A), lieve (B), moderato (C) e severo (D) ispessimento. SI=piccolo intestino; Ds=dorsale; Vt=ventrale. Da Tharwat et al. (2012), modificato.
Figura 6. Aspetto ecografico dei linfonodi mesenterici aumentati di volume in 4 capre con
paratubercolosi. A – corticale ipoecogena e midollare iperecogena; B – corticale e midollare ipoecogene; C – corticale e midollare scarsamente distinguibili; D – corticale e midollare con piccole lesioni ipoecogene (frecce). C=corticale; M=midollare; Ds=dorsale; Vt=ventrale. Da Tharwat et al. (2012), modificato.
18
1.7.2 METODICHE DIRETTE
1) Esame batteriologico: l’identificazione di Map avviene mediante l’esame microscopico e
l’isolamento colturale (OIE, 2012). Nel primo caso è necessario utilizzare la colorazione di Ziehl-Neelsen su strisci fecali o di mucosa intestinale: la diagnosi è presunta nel caso si evidenzino gruppi (almeno tre microrganismi) di bacilli acido-resistenti di 0,5-1,5 µm (OIE, 2012), ma poiché possono verificarsi falsi negativi, soprattutto negli animali subclinici, questo tipo di esame non è considerato definitivo (Cousins et al., 2002). Solo l’isolamento colturale di Map fornisce diagnosi definitiva di infezione poiché, con specificità del 100%, non produce falsi positivi (OIE, 2012; Sweeney et al., 2012) tanto che, nonostante limitazioni come costi elevati, tempi di incubazione protratti e possibili contaminazioni delle colture, la metodica è considerata il “gold standard” per il rilevamento del patogeno (Gilardoni et al., 2012; Salem et al., 2013). L’isolamento avviene da materiale fecale (o tessuto intestinale), tanto che paesi come l’Australia utilizzano pool di feci di gruppi di pecore (fino a 50 animali) – PFC, pooled faecal culture – come test di screening nei programmi di controllo della malattia (Whittington et al., 2000). Generalmente, la coltura fecale è in grado di identificate la maggior parte degli animali malati e con sintomatologia (sensibilità quasi del 100%), mentre può dare origine a risultati falsi negativi nelle prime fasi della malattia o per eliminazione intermittente di Map, perciò è necessario considerare anche altre metodiche diagnostiche (Gilardoni et al., 2012). Uno dei pochi studi che riporta il contrario, è quello di Lybeck et al. (2011), dove nei greggi di capre esaminate, l’eliminazione fecale avviene prima rispetto alla movimentazione anticorpale: secondo i ricercatori, però, questa condizione dipende da fattori come un’infezione particolarmente precoce (in utero) o contatto con elevate cariche microbiche (condizione plausibile, data la storia pregressa di paratubercolosi negli allevamenti esaminati). Esistono diverse tecniche colturali per isolare Map, in ogni caso è sempre necessario aggiungere in supplemento la micobactina per favorire la crescita del patogeno e decontaminare il campione per limitare la crescita di funghi o altri microrganismi che replicherebbero molto più facilmente e rapidamente (Cousins et al., 2002; OIE, 2012). Per decontaminare la coltura al momento esistono due protocolli di base da applicare al terreno solido a base di uovo per la coltura convenzionale (Oie, 2012; Salem et al., 2013). Il primo prevede l’aggiunta di acido oxalico e NaOH per decontaminare utilizzando per la crescita il terreno Löwenstein-Jensen (LJ), il secondo invece una decontaminazione a base di cloruro cetilpiridino monoidrato (HPC) in combinazione con il terreno Herrold’s egg yolk medium (HEYM) e in entrambi i casi è necessario aggiungere micobactina (Cousins et al., 2002; OIE, 2012; Salem et al., 2013). La coltura può avvenire mediante due tecniche (Cousins et al., 2002):
• Coltura convenzionale su terreno solido.
• Coltura su terreno liquido dove la crescita di Map è identificata dalla presenza di metaboliti marcati radiometricamente (BACTEC™) su un terreno Middlebrook 7H9 modificato contenente acido palmitico legato a 14C e antibiotici (Salem et al., 2013); questa tecnica richiede molto meno tempo per ottenere i risultati ed è considerata molto più sensibile rispetto alla
19
tecnica colturale tradizionale dei ceppi C ed S (Whittington et al., 1999) e la sensibilità può essere ulteriormente incrementata dalla decontaminazione del campione mediante doppia incubazione in HPC e aggiunta di antibiotici (Eamens et al., 2000). Poiché non tutti i laboratori sono attrezzati alla gestione di campioni radioattivi recentemente, sebbene non ancora valutati in modo approfondito, sono stati introdotti altri metodi rapidi basati sulla fluorescenza per isolare Map (MGIT – mycobacteria growth indicator tube), sempre su terreni liquidi, al fine di evidenziare la crescita dei microrganismi (Cousins et al., 2002; Marchetti et al., 2012; Salem et al., 2013). Negli ultimi anni, infine, è stato introdotto un altro sistema di indagine mediante il test FASTPlaqueTB (Biotec Laboratories Limited, Ipswich, UK), basato sulla capacità del micobatteriofago D29 di replicarsi solo all’interno delle cellule di Mycobacterium spp. vitali e di indurne la lisi: tale risultato si evidenzia grazie alla formazione di placche sul terreno di coltura entro 24-48 ore e si esprime in Unità Formanti Placca (UFP/ml) (Marchetti et al., 2012).! La coltura dei diversi ceppi di Map presenta notevoli differenze a seconda del terreno utilizzato, tanto che risulta necessario valutarne i vantaggi e gli svantaggi nel loro utilizzo, la specie animale esaminata, la natura del campione e l’attrezzatura disponibile in laboratorio (Cernicchiaro et al., 2008; Dimareli-Malli et al., 2013 a): colonie visibili di ceppi S si osservano 2-9 settimane su terreno solido Middlebrook 7H10 modificato se già passate su terreno liquido, ma possono raggiungere le 20 settimane se vengono unicamente seminate sul terreno 7H10 (Cousins et al., 2002; OIE, 2012). Le colonie su questo terreno appaiono convesse, soffici, umide e brillanti, di colorazione variabile tra il bianco e il marrone chiaro, simile a quella del terreno; hanno la dimensione di una capocchia di spillo, ma possono raggiungere 1 mm di diametro, fino a 1,5 mm sebbene sia raro e nel caso siano poco numerose (Cousins et al., 2002). Recentemente Dimareli-Malli et al. (2013 a) hanno condotto uno studio per valutare il terreno migliore per la crescita di ceppi C ed S che colpiscono i piccoli Ruminanti; tra tutti quelli citati precedentemente, il terreno più appropriato è risultato il Middlebrook 7H11 supplementato, oltre che con micobactina, con acido oleico, albumina, destrosio, catalasi e siero bovino inattivato.
2) PCR: Map può essere identificato dalla crescita colturale (su terreno solido o liquido) mediante
PCR (polymerase chain reaction) (Cousins et al., 2002), dove è previsto il rilevamento di sequenze genomiche tipiche per distinguerlo dagli altri micobatteri (Merkal, 1984; Ellingson et al., 1998). Questa indagine si dimostra essere di prima scelta quando è necessario ottenere risultati in tempi brevi, ma non può sostituirsi completamente all’esame colturale, poiché piccole quantità di Map possono non essere rilevate (Schönenbrücher et al., 2008). Inoltre, quando applicata ai microrganismi isolati in coltura, la PCR presenta una sensibilità del 100%, che però non mantiene affatto se il campione di partenza è materiale biologico (feci e tessuti, colostro e latte), che richiede, quindi, un trattamento per ridurre al minimo le interferenze tra le componenti del campione e le reazioni del test al fine di evitare risultati falsi negativi (Bölske e Herthnek, 2010; Gilardoni et al., 2012). McFadden et al. (1987 a,
20
1987 b) hanno identificato una sequenza, denominata IS900, specifica per Map. Nonostante IS900 sia stata ritrovata solo in Map, è stato riportato che altri micobatteri, anche distanti dal punto di vista filogenetico, posso generare un esito positivo con alcuni protocolli di PCR (Cousins et al., 1999); come conseguenza sono stati cercati nuovi sistemi di PCR al fine di evitare queste limitazioni, così come altri geni che si suppone essere specifici per Map, come riportati in Tabella 10 (Bölske e Herthnek, 2010). Solitamente, una tipizzazione rapida dei ceppi isolati C o S può avvenire con l’amplificazione e restrizione del gene IS1311 (Cousins et al., 2002) o con la multiplex DMC-PCR, (Collins et al., 2002).
Gene N. copie Riferimenti bibliografici circa la validazione e utilizzo di PCR Is900 15-20 Möbius et al., 2008; Schönenbrücher et al., 2006; Irenge et al., 2009.
f57 1 Vansnick et al., 2004; Tasara e Stephan, 2005; Bosshard et al., 2006; Herthnek e Bölske, 2006; Glanemann et al., 2008; Herthnek et al., 2008; Möbius et al., 2008;
Schönenbrücher et al., 2008; Irenge et al., 2009.
ISMav2 3 Strommenger et al., 2001; Stratmann et al., 2002; Shin et al., 2004; Glanemann et al., 2008; Möbius et al., 2008; Schönenbrücher et al., 2008.
hspX 1 Ellingson et al., 1998, 2000; Stabel et al., 2004. Gene 251 1 Bannantine et al., 2002; Sibley et al., 2007. Gene 255 1 Bannantine et al., 2002; Möbius et al., 2008. ISMap02 6 Stabel e Bannantine, 2005; Irenge et al., 2009.
Tabella 10. Sequenze genomiche di Map utilizzate per PCR nella diagnosi di paratubercolosi, da Bölske e Herthnek (2010),
modificato.
Esistono molte varianti di PCR oltre alla convenzionale (nested, multiplex) (Gilardoni et al., 2012), ma recentemente, grazie ai progressi tecnologici, è la real-time PCR ad essere considerata come tecnica diagnostica molecolare di riferimento (Salem et al., 2013; Sonawane e Tripathi, 2013). Questa tecnica sfrutta molecole marcate con fluorescenza per monitorare l’amplificazione delle sequenze genomiche durante ogni ciclo di PCR, evitando così la necessità di utilizzare l’elettroforesi su gel per visualizzare i geni amplificati (Salem et al., 2013). Nello studio condotto da Sonawane e Tripathi (2013) con pecore macellate provenienti da allevamenti con storia pregressa di paratubercolosi, si evidenzia l’elevata sensibilità (100%) della real-time PCR nella ricerca del genoma di Map, sia nelle forme paucibacillari che multibacillari, tanto da considerarla come strumento valido nella diagnosi retrospettiva e nei programmi di controllo della malattia.
1.7.3 METODICHE INDIRETTE
La diagnosi indiretta prevede la valutazione della risposta immunitaria dell’ospite che dipende dalla fase della malattia. Le fasi subcliniche sono tipicamente caratterizzate da una forte risposta immunitaria di tipo cellulare, contrariamente alla fase clinica, dove a predominare è una risposta di tipo umorale (Gilardoni et al., 2012). Per le caratteristiche della malattia, più precocemente si rileva la presenza di Map, minore è il rischio di trasmissione e mantenimento della stessa (Hughes et al., 2013), di conseguenza gli studi si concentrano sulla valutazione della metodica migliore a seconda del risultato che si vuole ottenere, cioè il controllo della patologia e la sua eventuale eradicazione.
21
a) Immunità cellulare
La prima risposta dell’ospite in seguito all’entrata di Map è mediata da cellule, soprattutto da linfociti T, come precedentemente descritto. I test a disposizione in grado di valutare questa condizione si possono eseguire in vivo, con la reazione intradermica, e in vitro, mediante il rilevamento della produzione di γ-interferone.
1) Reazione intradermica: in seguito ad infezione da Map, l’animale sviluppa un’ipersensibilità di tipo IV che può essere rilevata mediante reazione intradermica. La prova di sensibilizzazione, uguale a quella per la tubercolosi, si esegue iniettando in sede intradermica 0,1 ml (0,5 mg/ml, 25000 UI) di PPD-A (proteina purificata di M. avium) o di PPD-J (Johnina), nel terzo medio del collo o a livello di piega caudale. L’ispessimento della cute è valutato con un calibro prima e dopo 72 ore: si considerano positive misurazioni superiori a 2 mm (Pérez et al., 1999) o 3 mm (Cousins et al., 2002). Questa metodica ormai viene poco utilizzata per emettere diagnosi, poiché si caratterizza per ridotte sensibilità e specificità per la probabilità di cross-reazioni (Cousins et al., 2002; Gilardoni et al., 2012).
2) IFN-γ test: la metodica prevede di valutare la produzione della citochina IFN-γ prodotta dai linfociti T in seguito a stimolazione antigenica di Map (Gilardoni et al., 2012). Studi nella specie ovina riportano risultati attendibili e importanti al fine di utilizzare il test per capire se c’è stata esposizione al patogeno (Gwozdz et al., 2000; Stewart et al., 2004; Gillan et al., 2010 b). In tutti gli studi, dove è utilizzata PPD-J, la risposta immunitaria di tipo cellulare si riscontra nelle prime fasi dell’infezione e tende a diminuire con il progredire e la manifestazione clinica della malattia, tanto da considerare che in animali infetti naturalmente e che presentano una forte risposta cellulare, le lesioni intestinali sono di tipo paucibacillare (Pérez et al., 1999; Gwozdz et al., 2000): questa condizione porta ad ipotizzare che nell’ovino, a differenza della specie bovina, la malattia possa avere due forme distinte (paucibacillare o multibacillare) e non essere una l’evoluzione dell’altra (Gillan et al., 2010 b). Stewart et al. (2004), utilizzando i ceppi C ed S per infettare sperimentalmente i capi, hanno riscontrato che i valori di IFN-γ, prodotto in seguito ad infezione con ceppo ovino, sono più bassi e permangono meno tempo rispetto all’infezione con ceppo bovino. Data la necessità di diagnosticare il più precocemente la malattia, soprattutto nei piani di eradicazione, la ricerca ha mosso l’attenzione nella produzione di proteine ricombinanti, come Hughes et al. (2013) che hanno valutato l’efficacia di utilizzo di diverse proteine ottenute da pecore naturalmente infette per la risposta all’IFN-γ test e la necessità di approfondire gli studi per ottenere metodiche più sensibili. Il limite di questo test è la possibilità di risultati positivi in animali negativi in seguito a cross-reazioni con patogeni che presentano epitopi simili a Map (Gwozdz et al., 2000; Stewart et al., 2004; Salem et al., 2013). Per la specie caprina non si hanno dati definitivi circa l’utilizzo di questa metodica: Lybeck et al. (2011) hanno valutato diverse tecniche diagnostiche ottenendo risultati molto differenti rispetto alle specie bovina e ovina. Ad