I I I
SOMMARIO
Argomento della tesi è l’analisi del sistema di raffreddamento rigenerativo di un motore bipropellente a perossido di idrogeno ed etano. Tale endoreattore è già stato sperimentato presso Alta s.p.a. all’interno dell’attività “Self-Pressurized Green Propellant Technology”. La variazione rispetto al modello già esistente consiste nel cambiare il fluido refrigerante (acqua) con l’ossidante, ottenendo diversi vantaggi soprattutto per una potenziale applicazione in configurazione di volo.
La trattazione seguente può essere suddivisa in due parti: una di introduzione nella quale si presenterà il motore, i propellenti e uno schema analitico per definire i valori di ingresso necessari all’impostazione e alla soluzione del problema di scambio termico all’interno del condotto di refrigerazione. La seconda parte è invece focalizzata sullo studio di fattibilità del sistema di raffreddamento.
E’ stata riscontrata una certa difficoltà nel reperire dati completi sul perossido di idrogeno, infatti in letteratura non si trovano molte fonti ed esse sono spesso incomplete obbligando ad utilizzare ipotesi semplificative.
Particolare attenzione è stata posta sul modello di coefficiente di scambio termico e sono state proposte diverse soluzioni per cercare di ottenere condizioni di utilizzo sicure. Per questo è stato proposto anche un modello a microcanali che, secondo diverse campagne sperimentali, incrementa notevolmente il coefficiente convettivo e permette di ottenere risultati migliori rispetto alle più comuni superfici alettate, anche esse analizzate in questo lavoro.
A causa della dimostrata inadoperabilità del perossido per il suo possibile comportamento esplosivo anche a basse temperature, è stato realizzato anche un modello analitico per la previsione del comportamento dell’altro propellente (etano) come fluido refrigerante. In questo caso, dato l’elevato valore della tensione di saturazione, si è reso necessario un modello di fluido bifase anche se semplificativo. L’etano non corre il rischio di esplosione, ma il vincolo sul valore delle portate, fornito come specifica, è particolarmente stringente e la sua efficacia come refrigerante non è accettabile per limiti tecnologici.
In conclusione si può affermare che non è possibile un raffreddamento rigenerativo del prototipo realizzato. Tuttavia la mancanza di dati sperimentali specifici per il problema, non consente di conoscere quale possa essere l’entità dell’errore introdotto dall’utilizzo di relazioni empiriche per il calcolo delle varie grandezze.
II II II
ABSTRACT
This thesis deals with the regenerative cooling system of a hydrogen peroxide and ethane bipropellant rocket engine. Such an engine was already tested at Alta S.p.A. within the framework "Self-Pressurized Green Propellant Technology". What's different with respect to the pre-existing model is the use of the oxidizer itself as a coolant instead of water: this allows to obtain several advantages, also from a propulsive standpoint.
The following treatise can be split in two parts: the first one deals with the characteristic features concerning with the engine and the propellants; an analytical scheme used to determine the input data necessary for the formulation and resolution of the heat transfer problem inside the refrigeration duct is also presented. In the second part, which is the heart and object of this work, the feasibility of a regenerative-type cooling system is assessed.
Collecting a whole data set about hydrogen peroxide was a hard task; in fact the few sources found in the technical literature were somewhat incomplete forcing the use of simplified assumption.
Great attention has been paid to the heat transfer model and a number of solutions are suggested to provide a safe use. For this purpose a microchannel model has been also presented. According to several experimental investigations, this configuration seems to increase remarkably the convective coefficient, giving at the same time better results if compared with the typical finned configuration (which are also discussed).
In consequence of the explosive behavior of hydrogen peroxide, a second analytical model for the prediction of ethane behavior as a coolant has also been developed. In the latter, due to the large value of the saturation pressure, it is necessary to work out a simplified biphasic fluid model. Ethane does not show susceptibility to explode, but the reduced mass flow and technological limitations prevent its use as a coolant. This finding has been supported by high value of inner and outer wall temperature. In conclusion, a regenerative-type cooling system for this rocket engine is not feasible if the constraints in terms of mass flow and chamber geometry are to be respected. It should be noted, however, that the lack of exhaustive data for this specific problem does not permit an appreciation of the error resulting from the use of empiric relations in the evaluation process.
III III III
INDICE
SOMMARIO ... I ABSTRACT ... II INDICE... III CAPITOLO 1 ... 1 INTRODUZIONE ... 1 1.1 Obiettivi ... 11.2 Programma Self-Pressurized Green Propellant Technology ed Fuel vapor pressurization ... 2
1.3 Principio di Funzionamento di un FVP ... 5
1.4 testi e siti web di riferimento ... 7
CAPITOLO 2 ... 8
IL MOTORE ... 8
2.1 principio di funzionamento dell’ endoreattore a perossido di idrogeno ed etano ... 9
2.2 serbatoio ... 10
2.3 letto catalitico ... 13
2.4 camera di combustione e ugello di scarico ... 15
2.5 iniettori dell’etano ... 19
2.6 sistema di raffreddamento ... 22
2.7 testi di riferimento ... 23
CAPITOLO 3 ...24
PEROSSIDO DI IDROGENO ... 24
3.1 Introduzione al perossido di idrogeno ad alte concentrazioni ... 24
3.2 Uso del perossido di idrogeno ad alte concentrazioni in applicazioni propulsive: cenni storici ... 25
3.3 Caratteristiche del perossido di idrogeno in alte concentrazioni ... 26
3.4 Proprietà termo-fisiche ... 27
3.5 Reazione di decomposizione ... 35
3.6 Comportamento esplosivo del perossido ... 37
3.7 Compatibilità dei materiali ... 39
3.8 Trattamento e sicurezza ... 40
3.9 Perossido di idrogeno usato ... 40
3.10 testi e siti web di riferimento ... 43
CAPITOLO 4 ...44
L’ETANO ... 44
4.1 proprietà termo-fisiche ... 45
4.2 La combustione dell’etano ... 55
IV IV IV
4.4 testi e siti di riferimento ... 57
CAPITOLO 5 ...58
PROBLEMATERMOCHIMICO E GASDINAMICO ... 58
5.1 problema termo-chimico ... 58
5.2 problema gasdinamico ... 64
5.3 testi e siti di riferimento ... 74
CAPITOLO 6 ...75
SITEMA DI RAFFREDDAMENTO ... 75
6.1 ipotesi e considerazioni preliminari ... 75
6.2 modello analitico ... 77
6.3 cadute di pressione ... 93
6.4 impostazione del problema di scambio termico ... 99
6.5 raffreddamento a perossido di idrogeno ... 107
6.6 raffreddamento ad etano ... 127
6.7 conclusioni e prospettive... 135
6.8 testi e siti di riferimento ... 137
APPENDICE A ... 138
A.1 ETHANE SAFE & HANDLING ... 138
APPENDICE B ... 140
B.1 SCRIPT PER IL PROBLEMA TERMOCHIMICO E GASDINAMICO ... 140
1 1 1
CAPITOLO 1
INTRODUZIONE
1.1 OBIETTIVI
Argomento della tesi è l’analisi del sistema di raffreddamento di un endoreattore bi-propellente a perossido di idrogeno (H2O2) ed etano (C2H6). Tale prototipo è il risultato di un progetto realizzato
presso Alta s.p.a. ai fini di una attività finanziata da ESA/ESTEC, che vede Alta s.p.a come Prime Contractor, MOOg sarl e il Dipartimento di Ingegneria Aerospaziale dell’Università di Pisa come Sub-Contractor. I dettagli sul prototipo verranno successivamente illustrati.
L’obiettivo della tesi è stato uno studio di fattibilità del sistema di raffreddamento. Ciò consiste nel valutare la possibilità di utilizzo o del propellente o dell’ossidante come refrigerante della camera di combustione. Verificando che le portate impiegate per la generazione della spinta sono idonee al raffreddamento rigenerativo del motore, permetterebbe al prototipo sviluppato di essere un candidato competitivo per un suo utilizzo come sottosistema propulsivo di volo. Sotto queste condizioni è stato proposto un modello analitico per il calcolo delle grandezze di interesse (la temperatura di parete, la caduta di pressione nel condotto, l’incremento di temperatura del fluido, il calore smaltito etc.). La reperibilità dei valori necessari al calcolo dello scambio termico del perossido di idrogeno ha presentato una certa difficoltà; per questa sostanza infatti non vi sono numerosi testi di riferimento [1],[2],[9],[10] e lo studio del suo comportamento esplosivo, ai fini di determinarne limiti di temperatura e pressione, è tuttora oggetto di diverse sperimentazioni [2]. Infine l’utilizzo di relazioni di tipo empirico, introducono un valore dell’errore non ben valutabile se non con una successiva campagna di sperimentazione.
Al fine di evitare che la temperatura di parete causi l’esplosione del perossido di idrogeno, sono state proposte diverse soluzioni per migliorare lo scambio termico tra camera di combustione e refrigerante. Convezione forzata del refrigerante, superficie esterna della camera alettata e la possibilità di utilizzare un microcanale realizzato tra la superficie della camera di combustione e la camicia, sono tra le soluzioni impiegate per risolvere il problema. La soluzione dei microcanali è stata suggerita dalle numerose campagne sperimentali in merito [3],[2], che hanno evidenziato un incremento notevole del coefficiente di scambio termico; le numerose relazioni empiriche trovate, sono però di tipo sperimentale e spesso danno risultati molto differenti tra loro. Sotto suggerimento del professor Celata (ENEA, Institute of Thermal-Fluid Dynamics), per avere dei risultati di tipo conservativo, è
2 2 2 conveniente accettare le relazioni comunemente usate per i macrocanali, oppure intraprendere una campagna sperimentale per lo specifico problema, per avere risultati attendibili. Tramite l’analisi effettuata e alla luce di quanto detto fino ad ora, si è dimostrata l’impossibilità di utilizzare il perossido di idrogeno con questo valore di portata, nel sistema di raffreddamento. Ciò non era affermabile a priori visto l’utilizzo che già ne è stato fatto in altri endoreattori.
Abbandonata l’idea del perossido di idrogeno, si è spostata l’attenzione sul propellente: l’etano. Il principale problema di questo fluido è la bassa portata prevista per generare la spinta (<2 g/sec). In tal caso però l’unico limite che si pone è quello tecnologico, che fornisce la temperatura massima alla quale può lavorare il materiale costituente la camera. Data l’elevata pressione di vapore dell’etano e la sua scarsa portata, è facile immaginare la necessità di creare un modello di scambio termico che preveda un fluido bifase per prevedere il comportamento del refrigerante, e che quindi tenga conto di tutte le conseguenze che questo comporta. La scelta dell’una o dell’altra relazione empirica [4], [5],[6] è fatta in base a criteri di similitudine col propulsore in oggetto. Anche in questo caso perciò, una campagna sperimentale potrebbe rendere noto il valore dell’errore introdotto.
In conclusione i risultati ottenuti negano la possibilità, almeno teorica, dell’utilizzo dell’ossidante o del propellente come fluido refrigerante, a meno di una sostanziale revisione del progetto iniziale in maniera tale da prevedere valori delle portate maggiori, con la ovvia conseguenza che il propulsore debba essere nuovamente progettato.
1.2
PROGRAMMA
SELF-PRESSURIZED
GREEN
PROPELLANT
TECHNOLOGY
ED
FUEL
VAPOR
PRESSURIZATION
Negli ultimi anni il costo dovuto all’utilizzo di propellenti non criogenici come l’idrazina
N2H4 ed i suoi derivati (MMH, UDMH) e il tetrossido di azoto NTO è aumentato notevolmente. Nonostante le elevate prestazioni propulsive ottenibili, idrazina e tetrossido di azoto sono estremamente tossici, cancerogeni ed esplosivi.
La graduale presa di coscienza dell’elevata tossicità di tali propellenti ha prodotto una progressiva diminuzione durante gli anni dei limiti di esposizione previsti e quindi un conseguente aumento dei costi inerenti a tutte le procedure di gestione e stoccaggio e riguardanti la sicurezza e l’incolumità del personale responsabile della manutenzione.
Questo ha portato ad un forte incremento dell’incidenza relativa dei propellenti sul costo totale di missioni a bassa e media spinta giustificando lo sviluppo di propellenti alternativi che permettano soluzioni più economiche.
Tra i possibili ossidanti, il perossido di idrogeno è un fluido stoccabile non criogenicamente, che evidenzia alcune caratteristiche che lo rendono particolarmente attraente; tali caratteristiche e le problematiche associate verranno affrontate nel capitolo 3 .
Confrontando le prestazioni propulsive con i propellenti di uso più comune, si può vedere come il perossido di idrogeno possa essere utilizzato sia come monopropellente ottenendo impulsi specifici non particolarmente elevati e comunque inferiori ai 200 sec (Figura 1-1 e Figura 1-2), sia come comburente in razzi bi-propellente o ibridi. In questo caso gli impulsi specifici ottenibili dipendono dal tipo di combustibile utilizzato e possono essere paragonabili. Per il caso bi-propellente, a quelli della
3 3 3 coppia tetrossido di azoto e idrazina (Figura 1-3). In particolare è utile notare come, data l’elevata densità del perossido di idrogeno e l’elevato valore del rapporto di miscelamento ottimale (a favore del perossido) con la maggior parte dei combustibili, l’impulso specifico volumetrico presenti valori maggiori di tanti altri propellenti (Figura 1-4). Questo è particolarmente interessante in casi in cui sia importante la minimizzazione del volume o la riduzione delle forze aerodinamiche che può essere ottenuta tramite il minor volume frontale a seguito dell’utilizzo di serbatoi più piccoli.
FIGURA 1-1 CONFRONTO TRA I VALORI DELL’IMPULSO SPECIFICO OTTENTUTO CON IL PEROSSIDO DI IDROGENO A DIVERSE CONCENTRAZIONI E CON L’IDRAZINA
FIGURA 1-2 GRAFICO DI CONFRONTO TRA GLI IMPULSI SPECIFICI NEL VUOTO TRA DIVERSI PROPELLENTI COMUNEMENTE UTILIZZATI IN ENDOREATTORI MONOPROPELLENTI
4 4 4 FIGURA 1-3 IMPULSI SPECIFICI OTTENUTI CON IL PEROSSIDO DI IDROGENO UTILIZZATO IN
ENDOREATTORI BIPROPELLENTI
FIGURA 1-4
Data l’importanza di argomenti quali costi e semplicità (requisiti di progetto), si è ritenuto opportuno specializzare lo studio ad un modello di endoreattore auto pressurizzato secondo il concetto FVP (Fuel Vapor Pressurization), in cui viene sfruttata l’elevata pressione di vapore di un idrocarburo leggero (in questo caso l’etano) per la pressurizzazione di entrambi i propellenti. In questo modo si ha una
5 5 5 notevole semplificazione di tutto il sistema di alimentazione che non necessita di impianti di pressurizzazione esterni (turbopompe o sistemi a gas) con una chiara riduzione di peso ed ingombro, e di conseguenza un’aumentata sicurezza ed affidabilità del sistema.
Da questa prima analisi ([7], [8]), si può dedurre che la combinazione di propellenti che meglio sfrutta i potenziali vantaggi del concetto FVP per la realizzazione di un sistema propulsivo semplice, sicuro, affidabile, economico e con ragionevoli prestazioni risulta essere quella
H2O2/C2H6.
1.3 PRINCIPIO DI FUNZIONAMENTO DI UN FVP
Il modello sviluppato, prende ispirazione dagli studi svolti da Daniel J. Moser (2001) su un prototipo denominato Comp-L, una variante del sistema propulsivo sviluppato da Utah Rocketry (1997). Lo schema di funzionamento è illustrato nella figura1-4.
Quando la valvola dell’ossidante viene aperta, il perossido di idrogeno raggiunge il catalizzatore, dove viene decomposto attraverso una reazione esotermica che produce una miscela calda di gas. Contemporaneamente viene aperta la valvola dell’etano. Nel caso in cui l’etano sia prelevato in fase vapore, tende a ricondensare in piccola parte durante l’espansione attraverso gli iniettori ed entra in contatto con la corrente di gas ossidante a valle del letto catalitico con il conseguente miscelamento tra i due propellenti. La velocità e la direzione del flusso porta la miscela in camera di combustione. Nell’ipotesi che la temperatura dei prodotti del letto catalitico, sia sufficientemente elevata, si ha una accensione spontanea ed una rapida reazione di combustione. Essendo i propellenti alla stessa pressione, sono sufficienti dei meccanismi passivi per la gestione delle portate (gola sonica e Venturi cavitante rispettivamente per il propellente e l’ossidante).
FIGURA 1-4 SCHEMA DELL’ENDOREATTORE BIPROPELLENTE P EROSSIDO DI IDROGENO-ETANO CON SERBATOIO AUTO-PRESSURIZZATO
6 6 6 I principali elementi che caratterizzano la configurazione del sistema FVP sono:
Il doppio serbatoio per la pressurizzazione di entrambi i propellenti.
Il sistema di alimentazione del perossido per fornire e distribuire l’ossidante verso il letto catalitico.
Il letto catalitico dove la decomposizione del perossido in ossigeno e vapore acqueo ha luogo. Il sistema di alimentazione dell’etano.
L’ugello convergente/divergente per l’accelerazione dei gas combusti e la generazione della spinta
L’utilizzo di un doppio serbatoio contenente entrambi i propellenti, separati da un’opportuna membrana elastica, consente sia l’effetto di pressurizzazione del perossido da parte dell’etano per semplice contatto attraverso la membrana, sia un volume più compatto per lo stoccaggio dei propellenti a discapito di una leggera complicazione costruttiva.
Il letto catalitico può essere definito l’elemento critico che determina il corretto funzionamento, i tempi di risposta e la vita operativa del sistema. Per questo sono stati intrapresi grossi sforzi tecnologici presso Alta S.p.A. orientati alla realizzazione di catalizzatori in grado di garantire una vita operativa lunga e delle prestazioni efficienti e ripetibili.
Oltre ai vantaggi introdotti dall’uso di propellenti non tossici, la coppia
H2O2/C2H6 presenta ulteriori caratteristiche da considerare all’interno del sistema FVP:
Il perossido d’idrogeno e l’etano possono essere immagazzinati in opportuni serbatoi in materiale composito a differenza della coppia NTO/MMH che risulta altamente corrosiva e incompatibile con la maggior parte delle materiali plastici e compositi a matrice polimerica. Questo permette di avere serbatoi più leggeri.
Durante lo svuotamento del serbatoio, la pressione di vapore e la temperatura dell’etano tendono a calare a causa dell’energia spesa dal sistema per l’evaporazione del combustibile. Nel caso i due propellenti siano in buon contatto termico, grazie all’elevata capacità termica del perossido e agli alti rapporti di miscelamento, tale fenomeno può essere significativamente ritardato. In particolare, essendo la temperatura critica dell’etano molto prossima a quella nominale di funzionamento (temperatura ambiente), il calore latente di vaporizzazione è relativamente basso, questo rende dunque possibile una modesta diminuzione della temperatura e della pressione e una conseguente degradazione delle prestazioni propulsive accettabile. Lo scostamento dal funzionamento nominale è ulteriormente ridotto in caso di operazione pulsata, nella quale l’intervallo fra uno sparo e il successivo è sufficiente a riportare la temperatura al valore nominale.
7 7 7
1.4 TESTI E SITI WEB DI RIFERIMENTO
[1] R.H. Perry, “Perry’s Chemical Engineers Handbook”
[2] M. Bernier, 2004, “An Experimental Investigation of Heat Transfer to Hydrogen Peroxide in Microtube”, Master of Science in Mechanical Engeneering at the Massachusetts Institute of Technology.
[3] G.P. Celata, 2004, “Heat Transfer and Fluid Flow in Microchannels”, G.F. Hewitt Editor
[4] V. Marinelli, 1975, “Termoidraulica dei Flussi Bifase nei Reattori ad Acqua Bollente ed in Pressione, Vol.1”, Comitato Nazionale per L’energia Nucleare
[5] G. Cammarata, L. Cammarata, 2007, “Fisica Tecnica Industriale – Volume Secondo:TermoFluidoDinamica”, Università di Catania Facoltà di Ingegneria
[6] S. Mancin, “Two-Phase e Single-Phase Heat Transfer and Fluid Flow Trough Enanched Surfaces and in Microgeometries”, Università degli Studi di Padova Dipartimento di Fisica Tecnica.
[7] A.Pasini, L.Torre, P.King, L.d’Agostino, 2007, “Self-Pressurized Green Propellant Technology – Technical Note 1”
[8] A.Pasini, L.Torre, L.Romeo, L.d’Agostino, 2007, “Self-Pressurized Green Propellant Technology – Technical Note 2”
[9] www.h2o2.com
8 8 8
CAPITOLO 2
IL MOTORE
In questa sezione verrà illustrato il principio di funzionamento di un propulsore bipropellente a perossido di idrogeno ed etano. Verranno successivamente illustrati brevemente i vari sistemi che lo compongono ed verranno illustrate le prestazioni previste per il motore in oggetto. Obiettivo di questo capitolo è dare sufficienti informazioni ai fini di avere un quadro completo del motore analizzato.
FIGURA 2-1 SEZIONE ASSIALE DEL COMPLESSIVO REATTORE CATALITICO-CAMERA DI SPINTA Catalytic Reactor Ethane Injector Thrust Chamber Cooling Jacket Catalytic Reactor Ethane Injector Thrust Chamber Cooling Jacket
9 9 9
2.1
PRINCIPIO
DI
FUNZIONAMENTO
DELL’
ENDOREATTORE A PEROSSIDO DI IDROGENO ED ETANO
Il principio di funzionamento di questo endoreattore può essere suddivisa in due fasi: una prima che prevede una decomposizione del perossido di idrogeno in un letto catalitico, ottenendo da questo processo un flusso gassoso di ossigeno e vapor acqueo ( a temperatura di circa 990°K ); questi gas caldi vengono fatti passare in una camera di miscelamento con l’etano, che anch’esso viene immesso allo stato gassoso. La direzione e la velocità del flusso portano la miscela in camera di combustione; attraverso una reazione ipergolica (auto accensione) dell’etano avviene l’ iniezione. Infine attraverso un ugello di espansione di forma convergente-divergente, opportunamente sagomato, i gas di scarico vengono espulsi e portati a pressioni tali da ottenere la condizione di matching alla sezione di sbocco.FIGURA 2-2 SCHEMA DI FUNZIONAMENTO DELL’ENDOREATTORE PEROSSIDO DI IDROGENO ETANO Regolazione portata etano Regolazione portata HP Il letto catalitico 2 6 C H m HP m Il serbatoio Membrana elastica HP 2 6 C H
10 10 10 Lo schema appena illustrato è rappresentativo del motore a perossido di idrogeno ed etano in configurazione FVP [1],[2].
I sistemi e le parti che lo compongono sono essenzialmente i seguenti:
Il serbatoio
Il letto catalitico
Gli iniettori dell’etano
La camera di combustione e l’ugello di scarico
Il sistema di raffreddamento
2.2 SERBATOIO
Il concetto su cui si basa il sistema di pressurizzazione del serbatoio tramite il combustibile (Fuel Vapor Pressurization FVP), è quello di utilizzare un solo serbatoio per entrambe i propellenti. Questo significa ridurre sensibilmente il peso finale e la complessità del sottosistema propulsivo, infatti tramite una membrana elastica, il propellente e l’ossidante possono essere separati all’interno dello stesso involucro. Con questa configurazione i due fluidi sono in contatto termico e l’elevata capacità termica del perossido rende facilmente controllabile la temperatura (riduzione della deriva termica dovuta all’evaporazione dell’etano durante la sua estrazione) e la pressione del serbatoio. In sostanza: l’etano si trova ad una temperatura molto prossima a quella critica (305.55°K) già a temperatura ambiente e questo significa bassi valori di calore latente di vaporizzazione. Quando il propellente viene estratto, il rimanente nel serbatoio tende ad evaporare in virtù del fatto che dispone di maggior volume. Questo significa che la pressione e la temperatura aumenterebbero abbastanza rapidamente. Il contatto termico con il perossido di idrogeno, attraverso lo spessore della membrana, inibisce questo incremento. Infatti la sua capacità termica e l’elevato rapporto stechiometrico tra ossidante e propellente (circa 9), rende questo fenomeno facilmente controllabile.
In seguito vengono illustrati lo schema, le ipotesi e i risultati sulla deriva termica e dell’andamento delle masse durante lo svuotamento del serbatoio[2],[4].
11 11 11 FIGURA 2-3 SCHEMA DEL SERBATOIO AUTO-PRESSURIZZATO
Le ipotesi che seguono sono alla base del modello da cui sono tratti i risultati. Tra di esse alcuna sono valide per tutto lo svuotamento del serbatoio, mentre ce ne sono alcune specifiche per il regime bifase dell’etano ed alcune per la condizione monofase, ovvero quando è completamente allo stato gassoso (parte finale dello svuotamento).
Ipotesi generali:
Condizione di adiabaticità
Perossido di idrogeno incomprimibile
Temperatura e pressione uniforme
Rapporto di miscelamento costante
Volume del serbatoio costante Ipotesi per la condizione bifasica dell’etano:
Equilibrio termodinamico tra fase liquida e vapore dell’etano (quando ancora è in miscela bifase)
Ipotesi per la condizione gassosa dell’etano:
12 12 12 2 V V V V V R T a p v b v e V V vV V V V v h c T R T v b
Con questo si ottiene un grafico della deriva termica di questo tipo [2]
FIGURA 2-4 VALORE DELLA TEMPERATURADEI PROPELLENTI NEL SERBATOIO DURANTE LO SVUOTAMENTO
FIGURA 2-5 ANALISI TERMODINAMICA DEL SERBATOIO
0 50 100 150 200 250 300 -0.5 0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 5
Analisi termodinamica del serbatoio Ti = 300 K, xH2O2 = 87.5%, xFi = 0%, i = stoich tempo t [s] m a s s e r e s id u e [ k g ] 0 50 100 150 200 250 300-0.5 0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 5 P re s s io n e d i s e rb a to io p ta n k [ M P a ] m L mV m F mox t * ptank
13 13 13
2.3 LETTO CATALITICO
Il reattore catalitico è costituito da una camera, da una piastra di immissione del perossido, da un letto catalitico costituito da sfere (LR-59) e da una piastra di diffusione in uscita.
Il perossido di idrogeno decompone in ossigeno e vapor acqueo nel contatto con la superficie delle sfere di catalizzatore. La reazione di decomposizione esotermica comporta un incremento della temperatura, con la conseguente vaporizzazione del perossido di idrogeno e dell’acqua. Si avrà quindi un evoluzione della decomposizione in cui si passa dalla decomposizione del solo liquido, a quella del solo stato gassoso, passando da una miscela bifase. Tale decomposizione è stata espressa da un modello cinetico con cui si considera una rapida reazione di adsorbimento con costante K1 seguita una
reazione di disadsorbimento del primo ordine .
FIGURA 2-6 SCHEMA DEL
REATTORE CATALITICO CON LE
DIVERSE FASI DEL
FLUIDO
2 1 1 2 f k K 2 2 2 2 2 2 H O SH O -S ad H O OLa caduta di pressione lungo il letto catalitico viene valutata secondo la legge consigliata da [5], per un flusso bifase omogeneo che attraversa un mezzo poroso. Questa insieme alle equazioni di flusso e ad ipotesi semplificative danno la possibilità di conoscere numericamente, la composizione locale e la pressione, e di conseguenza lo sviluppo del flusso in funzione della distanza dalla sezione di ingresso del letto catalitico. Trascurando la parte puramente numerica, vengono riportati i risultati più significativi quali la caduta di pressione, il parametro si avanzamento della reazione e la temperatura di decomposizione. Per una più approfondita analisi si rimanda a [2].
Liquid +Gas + Vapour Gas + Vapour
Liquid
14 14 14 FIGURA 2-7 VALORI DEL PARAMETRO DI AVAZAMENTO DELLA REAZIONE, DELLA PRESSIONE E
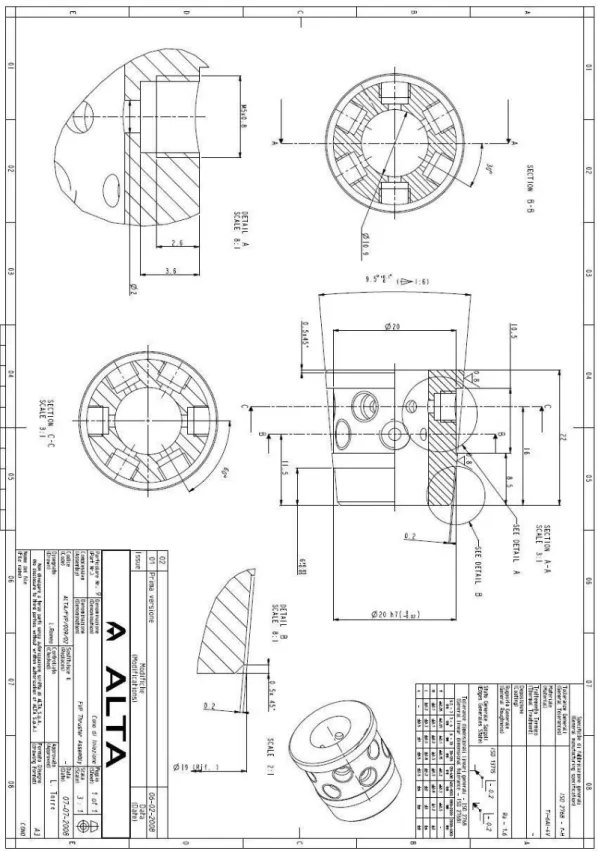
DELLATEMPERATURA LUNGO IL LETTO CATALITICO Viene anche mostrato un disegno CAD del reattore catalitico, figura 2-8.
FIGURA 2-8 REATTORE CATALITICO ESCLUSO IL CATALIZZATORE 0 0.005 0.01 0.015 0.02 0.025 0.03 0 50 100 x, [m] a d v a n c e m e n t p a ra m e te r, [ % ] 0 0.005 0.01 0.015 0.02 0.025 0.03 1.4 1.6 1.8x 10 6 x, [m] P re s s u re , [P a ] 0 0.005 0.01 0.015 0.02 0.025 0.03 0 500 1000 x, [m] T e m p e ra tu re , [K ] H2O2connecting flange retaining spring injection plate cartridge distribution plate seeger ring
connection with the cradle
interface with the clevis
groove for frontal seal changeable cylindrical insert
H2O2connecting flange retaining spring injection plate cartridge distribution plate seeger ring
connection with the cradle
interface with the clevis
groove for frontal seal changeable cylindrical insert
H2O2connecting flange retaining spring injection plate cartridge distribution plate seeger ring
connection with the cradle
interface with the clevis
groove for frontal seal changeable cylindrical insert
15 15 15
2.4 CAMERA DI COMBUSTIONE E UGELLO DI SCARICO
La camera di combustione si trova a valle del reattore catalitico (figura 2.13). Di seguito se ne analizzano alcuni degli aspetti fondamentali; per approfondimenti si rimanda ai capitoli successivi. Per ottenere il dimensionamento della camera di combustione, devono essere noti (da specifica) o calcolabili alcuni valori necessari alla soluzione del problema termo-chimico e gas-dinamico. Si considerano noti:
Il valore nominale della spinta nel vuoto (Fv=50N)
Il valore nominale della camera di combustione (pc=15atm)
Il valore della pressione statica alla sezione di uscita (condizione di matching)
Il valore nominale del rapporto di miscelamento dei 2 propellenti (9.1)
A questo punto possono essere valutate grandezze di interesse come la temperatura di reazione (Tc) dal
bilancio entalpico e dalla condizione di equilibrio della reazione. Con le grandezze, note o calcolate, si possono conoscere poi la velocità caratteristica C*, il valore del numero di Mach alla sezione di uscita (Me); da quest’ultimo si può trovare il rapporto tra sezione di uscita e sezione di gola (Ae/At).
dall’ipotesi di flusso isoentropico può essere valutato il coefficiente di spinta (CF).
Dalle informazioni ottenute con calcoli che non vengono riportati [1], si può ottenere il valore dell’area della sezione di gola.
𝐴∗= 𝐹𝑣
𝐶𝐹∗𝑝𝑐
Con chiara nomenclatura.
Secondo [6] la sezione di gola è il punto di partenza per il dimensionamento della camera di combustione. Infatti una volta nota la sezione di gola, la portata di propellente viene fissata:
𝑚 =𝑝𝐶∗𝐴∗
𝐶∗
Il flusso di massa del singolo propellente sarà poi definito attraverso il rapporto di miscelamento che è un dato di progetto. Se poi la camera di combustione è sotto la condizione critica in riferimento alla pressione totale del serbatoio, è possibile regolare le portate di propellente attraverso una gola sonica e un Venturi cavitante opportunamente dimensionati e disposti lungo la linea di alimentazione[1], [2]. All’interno del modello si è inoltre tenuto conto di altri aspetti presenti in un ugello “reale”, come lo spessore di spostamento in gola, il valore corretto della spinta tenendo conto delle perdite per divergenza dell’ugello e per la resistenza da esso fornita. Si è ritenuto opportuno giungere alla soluzione finale del progetto del prototipo, tramite un processo iterativo. Tutti i calcoli sono stati effettuati considerando un regime stazionario; non è stato infatti considerata la variazione di pressione dell’etano, dovuta alla deriva termica, durante lo svuotamento del serbatoio.
16 16 16 FIGURA 2-9 CAMERA DI SPINTA COMPRESA DEGLI INIETTORI DELL’ETANO E DEGLI INIETTORI
DEL REFRIGERANTE
nozzle
cooling jacket
ethane
injector
combustion chamber
nozzle
cooling jacket
ethane
injector
combustion chamber
17 17 17
18 18 18
Spinta (N) 50
Pressione in camera (bar) 15
Temperatura di combustione (K) 2820
Rapporto dei calori specifici 1.219
Pressione atmosferica (atm) 1
Diametro di gola (mm) 5.19
Diametro di uscita (mm) 8.91
Rapporto di espansione delle aree (--) 2.9 Semi-angolo del condotto convergente, αc (deg) 45
Semi-angolo del condotto divergente, αd (deg) 15
Raggio di raccordo del convergente (mm) 1.29 Raggio di raccordo convergente/divergente (mm) 3.89
TABELLA 2-1 PRESTAZIONIE VALORI GEOMETRICI DELLA CAMERA DI SPINTA
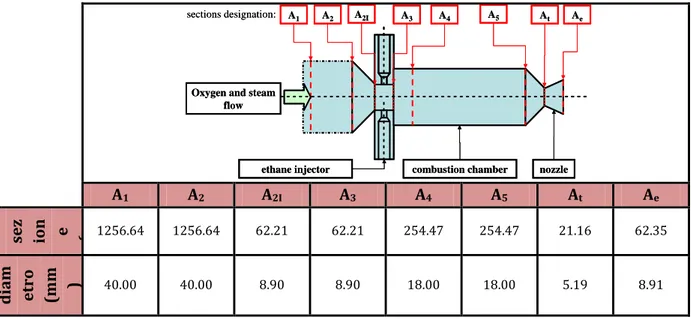
A1 A2 A2I A3 A4 A5 At Ae
Ar
e a
sez ion e (m 1256.64 2m) 1256.64 62.21 62.21 254.47 254.47 21.16 62.35
diam etro (mm ) 40.00 40.00 8.90 8.90 18.00 18.00 5.19 8.91
TABELLA 2-2 VALORE DELL’AREA E DEL DIAMETRO DELLE SEZIONI DI RIFERIMENTO
Oxygen and steam flow
ethane injector combustion chamber nozzle sections designation: A1 A2 A2I A3 A4 A5 At Ae
Oxygen and steam flow
ethane injector combustion chamber nozzle sections designation: A1 A2 A2I A3 A4 A5 At Ae
19 19 19
2.5 INIETTORI DELL’ETANO
Mediante il sistema di iniezione, l’etano viene introdotto attraverso dei fori disposti circonferenzialmente alla camera di miscelamento. Il getto di etano, che per l’espansione può ricondensare in goccioline liquide, entra in contatto con il flusso gassoso dei prodotti della decomposizione del perossido di idrogeno, che giungono in maniera ortogonale alla direzione dell’iniezione. Questo incontro comporta la deviazione verso valle del flusso iniettato. L’angolo di curvatura dell’asse del getto, in funzione della distanza dal centro del foro di immissione segue la legge empirica fornita da Shandorov:
2.55 1 1 2 2 1 cot o o o o q q x y y d q d d q
Dove q01 =ρ1*w 2 /2; q02=ρ2*w 2 /2;sono le pressioni dinamiche a monte e a valle dell’iniettore. Le altre grandezze sono evidenti dalla figura
FIGURA 2-11 SCHEMA DELL’INIEZIONE DELL’ETANO
Questo modello di ordine ridotto ha comunque permesso di calcolare la profondità di penetrazione e l’angolo di deflessione del flusso.
La portata dell’etano è fissata attraverso una sezione sonica posta lungo la linea di alimentazione. Il propellente arriva in una camera di distribuzione toroidale ed è iniettato trasversalmente al flusso dell’ossidante, attraverso piccoli fori. Sotto alcune ipotesi
HP m x y 2 6 C H m d jCL y jCL b
20 20 20
Attrito trascurabile
Flusso monodimensionale (si trascurano gli effetti di ingresso)
Gas perfetto
Condizioni stazionarie
E attraverso la scelta di alcuni parametri:
Numero dei fori (N=12)
Il rapporto tra la pressione totale e quella statica sulla sezione di uscita del foro (ptf/pf=1.03)
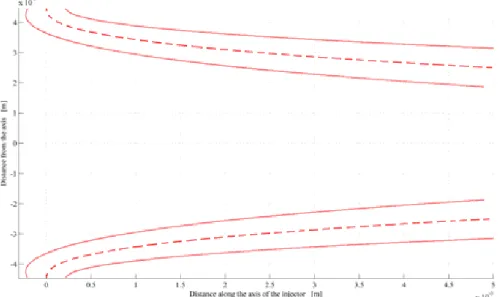
La distanza dell’asse del foro dalla sezione di ingresso della camera di combustione (b=5mm) Vengono calcolati il valore della sezione dei fori (r=0.41mm) e il Mach di immissione(0.05). Di seguito si riporta il grafico con l’andamento del getto funzione della distanza dall’asse del foro e le immagini del progetto.
FIGURA 2-12 DIREZIONE DEL FLUSSO IN FUNZIONE DELLA DISTANZA DALL’ASSE DELL’INIETTORE
21 21 21
22 22 22
2.6 SISTEMA DI RAFFREDDAMENTO
Il sistema di raffreddamento ad ora previsto consiste in un canale anulare ricavato tra la camera di combustione e la camicia e percorso da acqua con portate dell’ordine dei 100 g/sec. Questa tipologia di sistema è funzionale ai fini del raffreddamento, specie perché nella zona più critica (sezione di gola), la camera di combustione è stata provvista di superfici estese che ne migliorano lo scambio termico abbattendo la temperatura di parete.
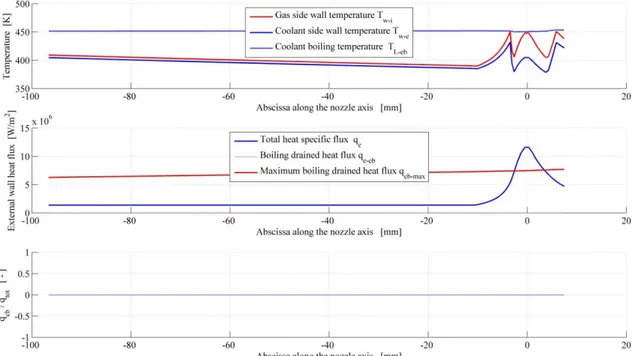
Lo schema utilizzato verrà illustrato nei capitoli successivi in maniera completa essendo il tema centrale della tesi. Riportiamo di seguito il grafico della temperatura ottenuto con questo sistema.
FIGURA 2-14 RISULTATI OTTENUTI CON SISTEMA DI REFRIGERAZIONE AD ACQUA E PORTATA PARI A CIRCA 100 G/SEC
23 23 23
2.7 TESTI DI RIFERIMENTO
[1] A.Pasini, L.Torre, P.King, L.d’Agostino, 2007, “Self-Pressurized Green Propellant Technology – Technical Note 1”
[2] A.Pasini, L.Torre, L.Romeo, L.d’Agostino, 2007, “Self-Pressurized Green Propellant Technology – Technical Note 2”
[3] A.Pasini, L.Torre, P.King, L.d’Agostino, 2007, “Self-Pressurized Green Propellant Technology – Technical Note 2 Appendix 1”
[4] S.Simoncini, 2007, “Sviluppo Concettuale di un Endoreattore Autopressurizzato a Perossido di Idrogeno ed Etano”
[5] Kaviany et al. , 1998, “The Handbook of Fluid Dynamics- Section 21: Flow in Porous Media”, CRC Press LLC
[6] Huzel D.K., Huang D.H., 1992, “Design of Liquid Propellant Rocket Engines”, Rocketdyne Division of Rockwell International
[7] Shandorov G.S., 1957, “Flow From a Channel into Stationary &Moving Media”, Zh. Tekhn. Fiz., 37,1
24 24 24
CAPITOLO 3
PEROSSIDO DI IDROGENO
Il perossido di idrogeno (formula chimica H2O2) è utilizzato in molte applicazioni industriali e, ad alte
concentrazioni, anche in applicazioni propulsive: come monopropellente o in combinazione con altri propellenti come ad esempio l’etano.
Nel caso monopropellente è sfruttata la potenza termica sviluppata in seguito alla sua decomposizione termica accelerata da un catalizzatore e poi accelerata tramite un ugello convergente - divergente. Nel caso di un motore a bipropellente i prodotti della decomposizione vengono usati come ossidante per innescare una successiva reazione ipergolica ( autoaccensione ) ed espandere successivamente nel condotto convergente - divergente.
3.1 INTRODUZIONE AL PEROSSIDO DI IDROGENO AD
ALTE CONCENTRAZIONI
25 25 25 Il perossido di idrogeno fu scoperto da Thenard nel 1818 [8]. In condizione ambiente si presenta come un liquido chiaro, incolore, con densità e viscosità maggiori dell’acqua. È un potente ossidante con la capacità di decomporsi esotermicamente, con acqua e ossigeno come prodotti: il vantaggio in termini di tossicità è quindi evidente, ed è uno dei motivi per cui viene definito propellente verde. Data la miscibilità con l’acqua, in qualsiasi proporzione, è spesso utilizzato in soluzione acquosa. A basse concentrazioni è utilizzato come agente sbiancante ad esempio nelle industrie cartiere. Ad alte concentrazioni (contenenti più del 70% in peso) è utilizzato per scopi industriali e militari.
Le soluzioni con tali concentrazioni sono definite High-Test Peroxide (HTP). Le applicazioni nei razzi utilizzano soluzioni con concentrazioni che vanno dal 70% al 98%, per cui ricadono nella categoria HTP.
3.2 USO DEL PEROSSIDO DI IDROGENO AD ALTE
CONCENTRAZIONI IN APPLICAZIONI PROPULSIVE: CENNI
STORICI
L’utilizzo dell’HTP per la generazione di potenza e le applicazioni a razzo, è abbastanza comune. Infatti il suo potenziale militare è usato già da prima del 1933 dalla marina militare americana. Anche in Germania prima e durante la seconda guerra mondiale, venivano effettuati studi di propulsione con il perossido di idrogeno. Nel 1936 era utilizzato nel motore di Helmut Walter come combustibile, per fornire spinta al velivolo Heinkel He 176. Il primo motore monopropellente utilizzava una soluzione all’80% di perossido di idrogeno miscelato con permanganato di calcio che serviva come catalizzatore per la sua decomposizione termica. Di lì a breve Walter sviluppò un secondo motore che utilizzava una soluzione al 30% di idrazina ed una soluzione all’80% di perossido di idrogeno come ossidante. Questo motore, il quale può essere catalogato come motore a razzo bi propellente caldo, utilizza la caratteristica ipergolica (auto-igniezione) di questa miscela propellente-ossidante e non richiede l’utilizzo di un catalizzatore per la reazione. Questi due motori furono i precursori di quello che forse è la più nota applicazione dell’ HTP durante la seconda guerra mondiale: il generatore di gas del razzo V2.
Dopo la seconda guerra mondiale l’interesse per la sua forte caratteristica di ossidante e per la il suo potenziale energetico estremamente compatto, inspirò molti progetti di ricerca che promossero il suo sviluppo, specie in Inghilterra, negli Stati Uniti d’America e in Unione Sovietica.
Alcune delle applicazioni sotto studio in quel periodo, riguardavano unità di potenza ausiliarie per aerei e sottomarini, sistemi di propulsione per elicotteri, liquidi esplosivi e avanzati sistemi di propulsione a razzo per aerei e veicoli spaziali. Un esempio è il razzo americano X-15.
Dopo un periodo di rapida scalata nel suo utilizzo, il perossido di idrogeno divenne presto obsoleto e lasciò spazio a propellenti che consentivano impulsi specifici più elevati come l’idrazina (N2H4), il tetrossido di azoto (N2O4) e l’ossigeno liquido (LOX). Il risultato di ciò è che l’HTP venne temporaneamente accantonato per propulsori a razzo almeno fino alla metà degli anni ’80 quando venne riscoperto come propellente verde, di minor costo e di più facile maneggiabilità rispetto agli altri propellenti.
26 26 26
3.3 CARATTERISTICHE DEL PEROSSIDO DI IDROGENO IN
ALTE CONCENTRAZIONI
L’HTP, come già detto, può essere usato come monopropellente sfruttando la vantaggiosa decomposizione esotermica in acqua e ossigeno. Storicamente questa reazione è stata ottenuta facendo fluire il perossido di idrogeno attraverso uno schermo catalitico di argento o platino. Con questi schermi e perossido di idrogeno al 100% si possono ottenere impulsi specifici nel vuoto che raggiungono valori di 190 sec, ma, a parità di condizioni, può raggiungere i 240 sec in un sistema bi propellente HTP-idrazina.
Nei bi propellenti viene usato come ossidante. Gli impulsi specifici ottenuti dalla combinazione 90%H2O2/RP-1 sono comparabili con quelli ottenuti dalla combinazione LOX/RP-1: rispettivamente
297 sec e 300 sec.
La densità del perossido di idrogeno al 100% è di 1.442,5 Kg/m3 a temperatura ambiente, questa è nettamente superiore a quella dell’acqua e comparabile con quella del tetrossido di azoto (1.447 Kg/m3
), questo ha il vantaggio di ridurre i volumi dei serbatoi.
Con un calore specifico molto alto (2.650 J/Kg-K) il perossido di idrogeno può essere utilizzato come refrigerante rigenerativo come è stato fatto nel Rocketdyne AR2-3 e nel motore a reazione LR-40. Anche la possibilità di immagazzinamento è buona grazie anche allo sviluppo degli additivi stabilizzanti e dei materiali dei serbatoi che rendono il perossido appetibile da questo punto di vista. La sua velocità di decomposizione risulta molto bassa: meno dell’1% per anno in serbatoi di pyrex®. Inoltre il perossido di idrogeno è considerato non tossico, specie se confrontato con gli altri propellenti con cui è spesso paragonato (N2O4, HNO3 e N2H4) che sono invece tossici, velenosi e cancerogeni. Inoltre la sua bassa pressione di vapore fa si che, anche in serbatoi di raccolta aperti, non si produce un’elevata quantità di vapore di perossido di idrogeno e questa quantità non è dannosa per la salute dell’uomo sotto normali condizioni di lavoro giornaliere.
I prodotti della decomposizione (acqua e ossigeno) come visto in precedenza non sono affatto tossici. Tale propellente ha la potenzialità di essere ipergolico (autoaccensione) quando messo in contatto con alcune sostanze. Questa caratteristica è da considerarsi positiva in quanto elimina i sistemi di accensione e quindi semplifica molto i sistemi propulsivi.
27 27 27
Perossido di idrogeno Caratteristiche generali
Formula bruta o molecolare H2O2
Massa molecolare [uma] 34,0
Aspetto liquido incolore
Numero CAS 7722-84-1 Proprietà chimico-fisiche Densità, in c.n. [g l^-1] 1,24 Temperatura di fusione [°K] 272,6 K (-0,4°C) Temperatura di ebollizione [°K] 423 K (150°C) Proprietà termochimiche 0 fH [kJ mol^-1] -187,8 0 fG [kJ mol^-1] -120,4 0
S
[J °K^-1 mol^-1] 109,6 0 p C [J °K^-1 mol^-1] 89,1 Indicazioni di sicurezzaTABELLA 3-1 ALCUNI VALORI DI INTERESSE DEL PEROSSIDO DI IDROGENO
3.4 PROPRIETÀ TERMO-FISICHE
Lo studio dell’analisi di trasferimento termico è stato fatto su una soluzione di idrogeno al 89,5 %. La scarsità di letteratura in merito non consente di avere l’andamento delle varie grandezze di interesse per la valutazione del coefficiente di scambio convettivo e del comportamento del liquido, a elevata pressione e temperatura; questo comporta che alcuni valori vengano estrapolati a temperatura ambiente o pressione atmosferica, qualora si creda che l’errore non sia troppo ampio.
3.4.1 DENSITÀ
La densità del perossido è superiore a quella dell’acqua. Nelle figure seguenti [9] si riportano l’andamento della densità in funzione della concentrazione per diverse temperature [figura 3-2], l’andamento in funzione della temperatura [figura 3-3] ed anche un grafico comparativo con la densità di altri comuni propellenti [figura 3-4].
28 28 28 FIGURA 3-2 VALORE DELLA DENSITÀ DEL PEROSSIDO DI IDROGENO VS CONCENTRAZIONE ED
ESPRESSA PER DIVERSE TEMPERATURE
L’andamento della densità in funzione della temperatura segue una legge di tipo esponenziale
𝜌 𝑇 = 𝑎 ∗ exp(𝑏 ∗ 𝑇) Dove
a=1768; b= -0.0008139;
29 29 29 FIGURA 3-3 DATI SPERIMENTALI E CURVA DI INTERPOLAZIONE
30 30 30 Estrapolando i valori per il perossido di idrogeno al 87,5 % si ottengono i seguenti valori di tabella che comunque sono riferiti a pressione atmosferica.
Temperatura [°K] Densità [Kg/m
3]
273 1413 293 1393 313 1373 333 1353 353 1326 373 1302TABELLA 3-2 VALORI DELLA DENSITÀ DEL PEROSSIDO DI IDROGENO A DIFFERENTI TEMPERATURE
3.4.2 VISCOSITÀ
Anche i valori della viscosità sono valutati a pressione ambiente [1] e la legge di variazione è stata ottenuta con curve di interpolazione scelte tra quelle fornite dal curve fitting di Matlab come somma di esponenziali 𝜇 𝑇 = 𝑎 ∗ exp 𝑏 ∗ 𝑇 + 𝑐 ∗ exp 𝑑 ∗ 𝑇 ; dove a= 0.7522; b= -0.02258; c= 0.0009732; d= -0.004935;
31 31 31 FIGURA 3-5 DATI SPERIMENTALI E CURVA DI INTERPOLAZIONE DELLA VISCOSITÀ DEL
PEROSSIDO DI IDROGENO
Temperatura
[°K]Viscosità [10
-3N*sec/m
2]
273 1,81 300 1,13 350 0,43 400 0,22 450 0,13 500 0,089 550 0,065 600 0,050
3.4.3 CALORE SPECIFICO A PRESSIONE COSTANTE
Il valore del calore specifico medio del perossido è considerato costante in un piccolo intervallo di temperatura, ma per scarsità di letteratura in merito, si considererà costante in tutto l’intervallo in cui si opera [2],[9],[11]. Tale valore è stato fissato a 2.650 J/Kg*K per concentrazioni del 90%. Tale approssimazione non è troppo limitante visto il comportamento della maggior parte dei liquidi; ad esempio per l’acqua tale valore varia di meno del 2 % nel range 0°-150°C.
TABELLA 3-3 VALORI DELLA VISCOSITÀ DEL PEROSSIDO DI IDROGENO A DIFFERENTI TEMPERATURE
32 32 32
3.4.4 CONDUCIBILITÀ TERMICA
Anche in questo caso i valori sono dati per diverse temperature ma la dipendenza dalla pressione non è nota [1]. La pressione a cui sono valutate è quella ambiente. Di seguito vengono riportati il grafico con l’andamento e la tabella con i valori che sono stati usati per l’interpolazione tramite legge potenziale k(T)=a*T^b+c; dove a= -1.195e-007; b= 2.104; c= 0.4998;
FIGURA 3-6 DATI SPERIMENTALI E CURVA DI INTERPOLAZIONE DELLA CONDUCIBILITÀ TERMICA DEL PEROSSIDO DI IDROGENO ALLO STATO LIQUIDO
33 33 33
Temperatura [°K] Conducibilità termica [W/m*K]
273 0,483 300 0,481 350 0,474 400 0,464 450 0,453 500 0,443 550 0,431 600 0,416
TABELLA 3-4 VALORI SPERIMENTALI DELLA CONDUCIBILITÀ TERMICA
3.4.5 TENSIONE SUPERFICIALE [3]
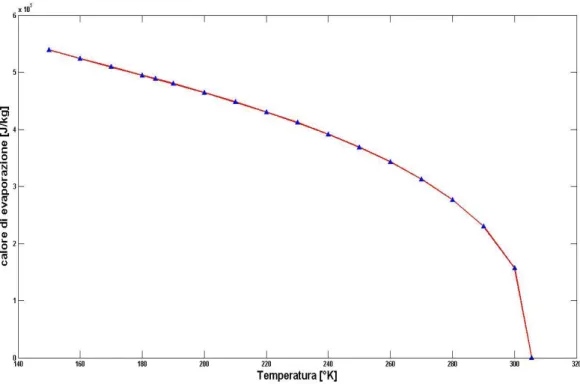
I valori della tensione superficiale servono per il calcolo del coefficiente convettivo nel caso di nucleazione di ebollizione sotto-raffreddata, per questo motivo vengono forniti di seguito il grafico del suo andamento in funzione della temperatura (figura 3-7) ed una tabella con i valori che sono stati interpolati (tabella 3-5) [3] con linee di tipo spline .
FIGURA 3-7 DATI SPERIMENTALI E CURVA DI INTERPOLAZIONE DELLA TENSIONE SUPERFICIALE
Temperatura [°K] Tensione Superficiale [KN/m
2]
273 82,23
289 79,93
311 76,43
333 72,63
34 34 34 373 65,43 433 52,73 500 38,23 566 22,83 633 8,13 647 6,63
TABELLA 3-5 VALORI SPERIMENTALI DELLA TENSIONE SUPERFICIALE
3.4.6 PUNTO DI EBOLLIZIONE E CONGELAMENTO [9] [11]
Il punto di congelamento a pressione atmosferica per elevate concentrazioni (>90%), è molto vicino a quello dell’acqua, mentre il punto di ebollizione è sensibilmente più alto. Di seguito viene riportato il grafico (figura 3-8) che ne presenta l’andamento in funzione della concentrazione della miscela [9],[11].
FIGURA 3-8 PUNTO DI EBOLLIZIONE E DI CONGELAMENTO IN FUNZIONE DELLA CONCENTRAZIONE IN PESO DEL PEROSSIDO DI IDROGENO
Sono di rilevante importanza anche i valori di pressione critica e temperatura critica, che per il perossido di idrogeno puro sono: Pcr=214 atm e Tcr=730 °K.[1]
35 35 35
3.5 REAZIONE DI DECOMPOSIZIONE
Il perossido di idrogeno isolato è abbastanza stabile [2],[4]. Tuttavia alcuni fattori come contaminanti, catalizzatori e il calore possono far allontanare la reazione dalla condizione di stabilità. Indipendentemente dalla sorgente perturbativa, il processo di decomposizione segue la reazione
H2O2(l) H2O(l) + ½ O2(g) + energia
A 298°K e 1 atm tale reazione libera circa 2.980 KJ/Kg con una temperatura adiabatica di reazione pari a circa 990°C . La decomposizione può distinguersi in tre tipi:
1. Decomposizione fotochimica: Il perossido, assorbendo radiazioni in un ampio spettro continuo, può decomporsi se esposto a lungo alla luce solare diretta.
2. Decomposizione omogenea: Quando il perossido d’idrogeno viene a contatto con sostanze solubili incompatibili può aversi una decomposizione accelerata nota come decomposizione omogenea. Tale decomposizione si verifica con un’ampia gamma di sostanze (in particolare sali di rame, cromo, ferro, vanadio, tungsteno, manganese, molibdeno e platino) e può essere causata anche da livelli estremamente bassi di contaminante.
3. Decomposizione eterogenea: Si tratta di una veloce decomposizione che ha luogo quando il perossido d’idrogeno entra in contatto con solidi insolubili. Il perossido d’idrogeno si decompone entrando in contatto con quasi tutti i materiali, sebbene la velocità di decomposizione vari enormemente con la natura e lo stato superficiale della superficie di contatto.
In particolare l’ultimo modo di decomposizione è interessante ai fini propulsivi, consentendo attraverso l’utilizzo di opportuni catalizzatori, una decomposizione estremamente rapida del perossido e dunque tempi di risposta e prestazioni accettabili.
Nonostante tutto il perossido di idrogeno segua la precedente reazione, alcuni fattori, come visto, ne influenzano la velocità. Di seguito se ne elencano i principali, ponendo particolare attenzione agli effetti della temperatura poiché è quella che interessa maggiormente ai fini realizzativi la tesi:
Attività della soluzione: alcuni ioni metallici (Fe+++, Cu++ e Cr+++) sono noti catalizzatori per il perossido di idrogeno. La loro concentrazione deve essere accuratamente controllata e degli stabilizzatori sono spesso utilizzati per ridurre il processo di decomposizione.
Attività superficiale: la velocità di decomposizione è fortemente suscettibile all’attività della superficie con cui il perossido entra in contatto. I comuni materiali da costruzione meccanica come l’acciaio, le leghe di rame le leghe di magnesio sono catalizzatori per il perossido di idrogeno. Altri materiali come il Pyrex® (vetro borosilicato), l’alluminio puro, l’acciaio inossidabile della serie 300 e alcuni polimeri, hanno invece bassa attività superficiale. Per la
36 36 36 miglior condizione di stoccaggio, il perossido di idrogeno predilige contenitori in Pyrex® (velocità di decomposizione minore del 1% annuo). Trattamenti superficiali come la passivazione possono notevolmente incrementare la stabilità del propellente in questione. In conclusione si può affermare che il perossido di per sé è stabile ma il contatto con qualsiasi materiale riduce la sua stabilità.
Effetti della temperatura: è ben noto che un incremento considerevole di temperatura comporta un incremento della decomposizione del perossido di idrogeno. A causa di questo incremento di velocità di reazione (raddoppia per ogni 10°C nell’intervallo 20°-100°C), la decomposizione termicamente indotta nel perossido di idrogeno porta spesso ad una reazione a catena incontrollata. La relazione che lega la potenza liberata in fase liquida (in forma di calore) e la temperatura del liquido segue una legge di tipo esponenziale alla Arrhenius:
𝑃𝑔𝑒𝑛 = 𝐵 ∗ exp[− 𝐸𝑎 𝑅 ∗ 𝑇] Dove
Pgen la potenza generata in KW/Kg B = 5,272*105 KW/Kg costante empirica
Ea = 16,319 Cal/mole energia di attivazione calcolata per via sperimentale R =1,987 cal/mole*K è la costante del perossido di idrogeno
37 37 37 FIGURA 3-9 POTENZA GENERATA DALLA DECOMPOSIZIONE TERMICA DEL PEROSSIDO DI
IDROGENO
Da tale equazione risultano chiari anche i vari contributi dei vari effetti instabilizzanti; ad esempio si vede che un incremento di temperatura rende la reazione più veloce con legge esponenziale ma anche che materiali con attività superficiali più alte, (quindi energie di attivazione più basse) tendono ad aumentare questo effetto.
3.6 COMPORTAMENTO ESPLOSIVO DEL PEROSSIDO
Soluzioni con elevata purezza di perossido di idrogeno non sono considerate esplosive[2][9]. Tuttavia a pressione atmosferica, il vapore di perossido di idrogeno, in concentrazione superiori al 26% molare (40% in peso), diventa esplosivo in un intervallo di temperatura intorno al punto di ebollizione. Di seguito viene inserito un grafico che rappresenta bene questo comportamento del perossido di idrogeno. L’area evidenziata è limitata superiormente dalla curva di ebollizione ed inferiormente dalla curva dell’esplosione del vapore ottenuta sperimentalmente. In questa regione, in cui si ha rischio di esplosione, la concentrazione del vapore è superiore al 26% in moli. La curva parabolica rappresenta il luogo dei punti della fase liquida con una concentrazione di vapore al 26% in moli. A sinistra di questa curva, la concentrazione di vapore critica non viene mai raggiunta e l’esplosione di vapore non avviene. A pressione atmosferica questo avviene per soluzioni liquide con concentrazioni di perossido di idrogeno minori del 73% in peso circa.
38 38 38 FIGURA 3-10 GRAFICO ESPLICATIVO DEL COMPORTAMENTO ESPLOSIVO DEL PEROSSIDO ID
IDROGENO
In conseguenza del fatto che la zone esplosiva è limitata dalla curva di ebollizione, non sorprende che ci sia un’influenza significativa anche della pressione. Ad esempio per una soluzione al 87,5 % si passa, come limite inferiore di temperatura, da un valore di 118°C circa ad 1 atm al valore di circa 132°C a 2 atm. Di seguito si allega anche il grafico in cui compare la dipendenza dalla pressione per valori moderati.
FIGURA 3-11 INFLUENZA DELLA PRESSIONE SULL’AREA ESPLOSIVA DEL PEROSSIDO DI IDROGENO
39 39 39 Da tale discussione risulta evidente che ci sono forti limitazioni nell’uso del perossido di idrogeno ad alto titolo come refrigerante per i razzi. Nonostante le alte pressioni coinvolte, la reazione di decomposizione termica indotta potrebbe causare surriscaldamenti locali che a loro volta potrebbero produrre concentrazioni di vapore abbastanza elevate da soddisfare le condizioni di innesco dell’esplosione.
3.7 COMPATIBILITÀ DEI MATERIALI
La maggior parte dei comuni materiali da costruzione hanno problemi di compatibilità col perossido a causa della sua forte capacità ossidante. In generale metalli duri come l’acciaio, il manganese, l’oro, l’argento, il platino ed altri, funzionano da catalizzatori e vanno quindi evitati. Alcuni dei materiali raccomandati sono invece il vetro borosilicato (Pyrex®), l’alluminio ad elevata purezza, l’acciaio inossidabile 304 e 316 e polimeri come il politetrafluoroetilene (PTFE® o Teflon®) e il fluorocarbon (FKM o Vitron®). La loro compatibilità viene suddivisa in classi basate sulla variazione di velocità di decomposizioni che essi comportano al contatto col perossido di idrogeno [2]. Di seguito viene riportata la tabella di suddivisione:
Definizione Esempi
CLASSE 1 Soddisfacente per utilizzo senza alcun vincolo
Zirconio,alluminio 1060 e 5254, Pyrex Teflon e Vitron
CLASSE 2 Soddisfacente per contatti ripetuti di breve periodo (4 h a 72°C o 1
settimana a 22°C)
Acciaio inox 304 e 316, silicone, polietilene, PVC, fluorolube
CLASSE 3 Solo per contatti di breve periodo(1 min a 72°C o 1 h a 22°C)
Inconel X, nichel, Tygon, acciai inox 17-4 ph
CLASSE 4 Da evitare Argento, cobalto, platino, oro, acciaio, titanio, rame, zinco, grafite TABELLA 3-6 DEFINIZIONE DELLE CLASSI DI COMPATIBILITÀ DEI MATERIALI CON IL
PEROSSIDO DI IDROGENO
Un trattamento di passivazione dei materiali può aiutare a ridurre l’attività superficiale inibendo la decomposizione.
40 40 40
3.8 TRATTAMENTO E SICUREZZA
Esistono alcune norme di sicurezza per il trattamento del perossido di idrogeno ad alte concentrazioni [12][4]. Di seguito verranno affrontati i principali pericoli e le principali problematiche nel trattamento
Pericolo per la salute
Il perossido di idrogeno è non tossico, tuttavia l’inalazione di vapori di perossido di idrogeno può causare irritazioni e infiammazioni del tratto respiratorio. Nel caso di serbatoi aperti è sufficiente un ambiente di lavoro ben ventilato e tempi di esposizioni che rientrano nelle 40 ore settimanali per prevenire questo tipo di problemi. Il pericolo maggiore deriva invece dal contatto del perossido di idrogeno con la pelle, con gli occhi e l’ingestione poiché tale sostanza è corrosiva e crea ustioni che possono portare anche alla morte. È quindi richiesta una copertura totale del corpo con tute complete di stivali e guanti in neoprene per il trattamento del perossido di idrogeno; è consigliato anche l’utilizzo di occhiali di protezione e maschere per il viso.
Pericolo esplosione
a causa del rischio esplosione occorre fare particolare attenzione a tenere il perossido di idrogeno lontano dai contaminanti che possono innescare la decomposizione e quindi l’esplosione. I vapori di perossido sono suscettibili a detonazioni dovute a shock ed impatti, è quindi richiesta particolare attenzione nel trattamento, nello stoccaggio e nell’immagazzinamento.
Trattamento
In conseguenza a quanto visto fino ad ora, in accordo con il manuale di sicurezza del FMC, il trattamento del HTP può essere riassunto in 4 semplici regole:
1. -nessun contaminante 2. -nessun confine 3. -nessun contatto
4. -acqua sempre disponibile
3.9 PEROSSIDO DI IDROGENO USATO
Il propellente che verrà effettivamente utilizzato per alimentare il prototipo, e che è già stato utilizzato per una precedente campagna sperimentale su endoreattori monopropellenti a perossido di idrogeno all’interno di Alta S.p.a., è un tipo di perossido di idrogeno ad elevata concentrazione prodotto da PEROXIDE PROPULSION. Si chiama P90 ed è caratterizzato da una certa facilità sia nella manipolazione che nello stoccaggio. Le sue principali caratteristiche fisiche sono riportate nella tabelle successive:
41 41 41 TABELLA 3-6 TABELLA RIASSUNTIVA DEL PEROSSIDO DI IDROGENO UTILIZZATO
TABELLA 3-7 VALORI FORNITI DAL P RODUTTORE SULLE IMPURITÀ PRESENTI NEL PEROSSIDO DI IDROGENO FORNITO
42 42 42 FIGURA 3-12 CONTENITORE DEL PEROSSIDO DI IDROGENO UTILIZZATO
43 43 43
3.10 TESTI E SITI WEB DI RIFERIMENTO
[1] R.H. Perry, “Perry’s Chemical Engineers Handbook”
[2] M. Bernier, 2004, “An Experimental Investigation of Heat Transfer to Hydrogen Peroxide in Microtube”, Master of Science in Mechanical Engeneering at the Massachusetts Institute of Technology
[3] F.Kreith, “Principi di Trasmissione del Calore”, Liguori Editore
[4] S.Simoncini, 2007, “Sviluppo Concettuale di un Endoreattore Autopressurizzato a Perossido di Idrogeno ed Etano”
[5] R.P. Poling, “The properties of Gases & Liquids “, McGraw-Hill Book Company [6] Coulson & Richardson “Chemnical Engineering Vol.1”, Butterworth Heinemann [7] L. d’Agostino, “Dispense del corso di Termofluidodinamica”
[8] www.wikipedia.org [9] www.h2o2.com [10] www.test.sdu.edu [11] www.webbook.nist.gov [12] www.solvaychemicals.us/static/wma/pdf/6/6/0/4/HH-2323.pdf
44 44 44
CAPITOLO 4
L’ETANO
3
H C
H C
3
FIGURA 4-1 MOLECOLA DELL’ETANO
L’etano è un composto chimico organico appartenente agli idrocarburi alifatici, secondo termine del gruppo degli alcani. A temperatura e pressione ambiente è un gas estremamente infiammabile, esplosivo in miscela con l'aria, incolore e inodore. Industrialmente si ottiene per distillazione frazionata del gas naturale, di cui è uno dei principali componenti, insieme al metano. In laboratorio può essere ottenuto per elettrolisi (elettrolisi di Kolbe) dell'acido acetico. Nell'industria chimica, è la materia prima per la produzione dell'etene per cracking catalico (processo attraverso cui si ottengono idrocarburi paraffinici leggeri per rottura delle molecole di idrocarburi paraffinici pesanti). Per via della repulsione elettrostatica reciproca tra gli elettroni, l'etano tende ad assumere preferibilmente una conformazione sfalsata, dove l'angolo diedro formato da due legami C-H ciascuno su un diverso atomo di carbonio è di 60°; la barriera energetica tra le due conformazioni è comunque sufficientemente bassa da consentire anche a basse temperature una rotazione completa attorno al legame che unisce i due atomi di carbonio. La tabella seguenteErrore. L'origine riferimento non è
45 45 45
Etano
Caratteristiche generali
Formula bruta o molecolare
2 6
C H
Massa molecolare [uma] 30,07
Aspetto gas incolore
Proprietà chimico-fisiche
Densità , in c.n. [g l^-1] 1,3562
Temperatura fusione [°K] 90,3 (-182,7°C)
Temperatura ebollizione [°K] 184,5 (-88,6°C)
Costante del gas R [KJ/Kg*K] 277,13
Temperatura critica [°K] 305,55 (32,4°C)
Pressione critica [MPa] 5,01
0 fusH [kJ mol^-1] 0,583 0 eb
H
[kJ mol^-1] 10 Proprietà termochimiche 0 fH [kJ mol^-1] -84 0 fG [kJ mol^-1] -32 0S
[J °K^-1 mol^-1] 229,2 0 p C [J °K^-1 mol^-1] 52,5 Indicazioni di sicurezza Flash point [°K] 138 (-135°C) Temperatura di autoignizione [°K] 788 (515°C)Limiti di esplosione 3 - 12,5% vol.
4.1 PROPRIETÀ TERMO-FISICHE
4.1.1 DENSITÀ
Per quanto riguarda la densità, essendo la temperatura critica dell’etano abbastanza bassa (305°K circa), occorre presentare sia l’andamento dell’etano allo stato liquido che allo stato gassoso, ai fini dello studio del sistema di raffreddamento.
46 46 46 Per ciò che riguarda lo stato gassoso, l’approssimazione di gas perfetto fornisce una legge di stato molto vicina ai valori sperimentali [Reynolds].
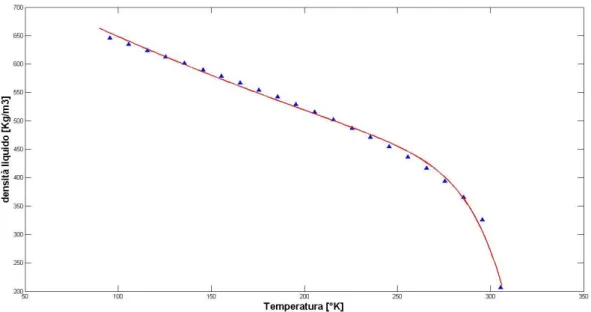
Per lo studio dell’andamento della densità nello stato liquido, è stata utilizzata una curva di interpolazione dei dati sperimentali [4] data dalla somma di due esponenziali:
𝜌(𝑇) = 𝑎 ∗ 𝑒𝑥𝑝(𝑏 ∗ 𝑇) + 𝑐 ∗ 𝑒𝑥𝑝(𝑑 ∗ 𝑇) Dove a =573.7; b =0.005161; c =2.142e-009; d =0.09647;
Di seguito vengono riportati il grafico e una tabella con i valori sperimentali che sono stati interpolati. Da notare comunque il basso valore della densità del liquido; questo comporta voluminosi serbatoi di immagazzinamento.
FIGURA 4-2 DATI SPERIMENTALI E CURVA DI INTERPOLAZIONE PER LA DENSITÀ DELL’ETANO ALLO STATO LIQUIDO
![FIGURA 2-8 REATTORE CATALITICO ESCLUSO IL CATALIZZATORE 00.0050.010.0150.020.0250.03050100x, [m]advancement parameter, [%]00.0050.010.0150.020.0250.031.41.61.8x 106x, [m]Pressure, [Pa]00.0050.010.0150.020.0250.0305001000x, [m]Temperature, [K]H2O2connecting](https://thumb-eu.123doks.com/thumbv2/123dokorg/7373390.95705/18.892.249.694.113.508/reattore-catalitico-catalizzatore-advancement-parameter-pressure-temperature-connecting.webp)