INDICE
RIASSUNTO ... 3
INTRODUZIONE... 6
CENNI SULLA CLASSIFICAZIONE DEL DIABETE ... 8
GENI E NEFROPATIA DIABETICA... 17
• Geni candidati ... 17
• Geni del sistema renina-angiotensina ... 23
• Geni della flogosi ... 26
• Geni coinvolti nella patogenesi del danno da iperglicemia ... 30
• Geni del metabolismo glucidico e lipidico ... 31
• Insulino-resistenza, geni da insulino-resistenza e nefropatia diabetica... 35
• Identificazione di geni candidati: scanning genomico ... 40
• Conclusioni... 43
GENI E RETINOPATIA DIABETICA ... 44
• Geni candidati ... 44
• Aldoso reduttasi (ALR2) ... 45
• Antigene leucocitario umano (HLA)... 47
• Enzima convertitore dell'angiotensina (ACE) ... 47
• α2β1 integrina ... 48
• Nitrossido sintetasi (eNOS) ... 48
• Adrenorecettore β3 ... 49
• Il gene PAI-1 ... 49
• Paraxonasi (PON 1) ... 50
• Altri geni... 52
• Conclusioni... 52
BACKGROUND E SCOPI DELLO STUDIO ... 54
MATERIALI E METODI... 56
• Soggetti... 56
• Determinazione dei genotipi ACE ID e PAI-1 4G5G ... 56
• Genotipo ACE ID ... 56
• Genotipo PAI-1 4G/5G... 60
• 4.5 Analisi statistica ... 61
RISULTATI ... 62
• Caratteristiche cliniche dei soggetti diabetici di tipo 1 e di tipo 2... 64
• Distribuzione di genotipi e frequenze alleliche nei soggetti diabetici di tipo 1 e di tipo 2... 66
• Diabete di tipo 1 ... 68
Nefropatia, retinopatia e polimorfismi genetici dell'ACE e del PAI-1. ...68
Patologia macrovascolare, ipertensione e polimorfismi genetici di ACE e PAI-1 ...74
• Diabete di tipo 2 ... 75
Nefropatia, retinopatia e polimorfismi genetici di ACE e PAI-1...75
Patologia macrovascolare, ipertensione e polimorfismi genetici di ACE e PAI-1 ...78
DISCUSSIONE E CONCLUSIONI ... 80
Riassunto
Background. Il sistema dell'attivatore del plasminogeno è ampiamente sotto il controllo
del sistema renina-angiotensina: l'angiotensina II, sintetizzata dall’enzima di conversione dell’angiotensina (ACE), aumenta l'espressione e l'attività dell’inibitore dell’attivatore del plasminogeno (PAI-1). Entrambi i sistemi promuovono meccanismi coinvolti nella proliferazione delle cellule muscolari lisce e delle cellule mesangiali nonché nell'accumulo di matrice extracellulare. Le attività dell’ACE e del PAI-1 sono regolate rispettivamente dal polimorfismo inserzione/delezione (I/D) localizzato sull'introne 16 del gene dell'ACE e dal polimorfismo 4G/5G localizzato sul promotore del gene del PAI-1.
Obiettivo. Studiare la plausibile interazione dei polimorfismi di ACE e PAI-1 nel modulare
la suscettibilità alle complicanze micro- e macrovascolari nel diabete mellito in 732 soggetti con diabete tipo 1 e 605 con diabete tipo 2, reclutati, in maniera occasionale, presso il Centro di Riferimento Regionale per il diabete mellito in età adulta negli ultimi cinque anni.
Mediante analisi logistica multivariata, applicata ad uno studio trasversale, sono stati analizzati gli effetti indipendenti o sinergici delle due varianti all’eliche (I/D e 4G/5G) sulla prevalenza di nefropatia, retinopatia, ipertensione e malattia macrovascolare (CVD).
Metodi. PCR (e PCR specifica per la sequenza di inserzione) o dHPLC e PCR + RFLP
(Restriction Fragment Length Polymorphism) sono state utilizzate rispettivamente per lo screening dei genotipi di ACE e PAI-1, su campioni di DNA ottenuto con estrazione salina. L’analisi genetica in DHPLC (Denaturing High Pressure Liquide Cromatography)
rappresenta un’alternativa rapida ed efficace nello screening del genotipo dell’ACE. L’associazione con la presenza di microangiopatia è stata anche indagata raggruppando i soggetti in base all’assenza di ogni complicanza, alla presenza di almeno una complicanza ad uno stadio iniziale (microalbuminuria e/o retinopatia background), o alla presenza di almeno una complicanza in stadio avanzato (nefropatia conclamata e/o retinopatia proliferante).
Risultati. In tutti i pazienti diabetici il polimorfismo 4G/5G era associato alla presenza di
complicanze microvascolari. Nel diabete tipo 1 il genotipo 4G4G risultava più frequente nei soggetti con aumentata AER (34 vs 24%, p=0.01), retinopatia proliferante (35 vs 25%, p=0.03) e microangiopatia renale e/o retinica avanzata o incipiente (37% e 25% vs 18%, X2=33.7, 4df p<0.001). Le relazioni fra il genotipo 4G4G e gli stadi di nefropatia, la retinopatia proliferante e le complicanze microvascolari avanzate risultavano indipendenti da durata del diabete, pressione arteriosa e HbA1c. Nelle femmine con diabete tipo 2 il genotipo 4G4G era associato a nefropatia conclamata (p=0.02) indipendentemente da pressione sistolica, HbA1c e BMI. Nel diabete tipo 1, ma non nel tipo 2, la frequenza del genotipo 4G4G era più elevata in presenza di CVD (47 vs 30%, p=0.003). Il polimorfismo I/D si associava significativamente con ipertensione e CVD nel diabete tipo 2: infatti, il genotipo II risultava più frequente in soggetti normotesi (19 vs 10%, p=0.01) ed in soggetti senza CVD (14 vs 7%, p=0.03). Nessuna interazione nè effetti sinergici tra i due polimorfismi sono stati osservati nel modulare il rischio di complicanze micro- e macrovascolari.
Conclusioni. I risultati suggeriscono che il polimorfismo 4G/5G del PAI-1, ma non quello
I/D dell’ACE, contribuisce in maniera indipendente nell'aumentato rischio di complicanze microvascolari, particolarmente nel diabete tipo 1. L’interazione biologicamente plausibile
tra polimorfismi ACE ID e PAI-1 4G5G in relazione al rischio di complicanze non emerge in una ampia coorte di soggetti con diabete tipo 1 e tipo 2.
INTRODUZIONE
ei soggetti con diabete la distribuzione delle complicanze sia in termini di prevalenza che in termini di momento della comparsa in funzione della durata e dell’intensità dell'esposizione alla malattia, suggerisce fortemente che la suscettibilità allo sviluppo delle complicanze è controllata, almeno in parte, da fattori genetici (1). I pazienti con diabete tipo 2 presentano un rischio tre volte superiore rispetto alla popolazione generale di sviluppare malattie cardiovascolari, cosicché circa il 75% di tali pazienti muore per eventi cardiovascolari. Ancor più elevato è il rischio dei soggetti con diabete tipo 1. L’aumentato rischio non è completamente spiegato dai fattori tradizionali quali fumo, ipercolesterolemia, ipertensione né da fattori “specifici” quali il controllo glicemico, né da fattori emergenti quali attivazione infiammatoria, insulino-resistenza, stato trombofilico o disfunzione endoteliale. Inoltre, il fatto che, indipendentemente dal grado del controllo glicemico, non tutti i diabetici sviluppano le complicanze, insieme all’evidenza di una forte aggregazione familiare, suggeriscono che la suscettibilità alla patologia cardiovascolare riconosce una base genetica. Analogamente, nel diabete tipo 1 e nel diabete tipo 2, le complicanze microvascolari sono espressione dell'interazione tra il disordine metabolico ed un substrato predisponente, di natura verosimilmente genetica. Tale ipotesi è indispensabile per spiegare le osservazioni epidemiologiche, per spiegare, per esempio, il peculiare andamento dell’incidenza della nefropatia in funzione della durata del diabete (2,3).
Se si confrontano l'andamento dell'incidenza di nefropatia e di retinopatia, almeno della forma di retinopatia background, in relazione alla durata del diabete, la peculiarità della nefropatia è subito evidente. L'incidenza della retinopatia cresce in modo proporzionale alla durata della malattia durante i primi 20 anni di diabete e rimane poi costante negli anni seguenti. Nel caso della nefropatia si osserva un picco di incidenza tra i 10 e i 15
anni di durata del diabete, seguito però da un calo progressivo. L’andamento peculiare dell'incidenza della complicanza renale, incremento e poi decremento, può essere spiegato solo ipotizzando l’esistenza di un sottogruppo di pazienti selettivamente predisposto a questa complicanza. Una volta esaurito questo sottogruppo (durante i primi 15-20 anni di diabete), i pazienti rimasti sono più resistenti alla complicanza renale e l'incidenza della nefropatia si riduce.
La ricerca di una predisposizione genetica, non necessariamente comune a tutte le complicanze microangiopatiche e macrovascolari del diabete, deve essere inserita in un contesto dove numerosi fattori di rischio giocano un ruolo importante (4). Iperglicemia ed ipertensione devono probabilmente coesistere per indurre l’insorgenza e modulare la progressione della nefropatia. Diabetici tipo 1 di lunga durata esenti da lesioni microvascolari rilevanti presentano livelli pressori inferiori a quelli della popolazione generale. Inoltre, la variabilità tra etnie nella prevalenza della nefropatia potrebbe essere almeno in parte spiegata dalle differenze nell’incidenza dell’ipertensione. D’altra parte, non è possibile escludere che la presenza di ipertensione possa agire solo come fattore di progressione di un danno renale altrimenti indotto.
Cenni sulla classificazione del diabete
Il diabete mellito è un disturbo metabolico dall’ eziologia multifattoriale, caratterizzato da una iperglicemia cronica; la causa dell’iperglicemia varia nelle diverse forme di diabete: nel diabete di tipo 1 è riconducibile ad una alterata secrezione dell’insulina mentre nel diabete di tipo 2 è causata da un’imperfetta azione insulinica, in altre forme di diabete le cause dell’iperglicemia possono essere entrambe.
Il termine “diabete mellito” descriveva “l’eccesso di urina dolce” in associazione con i sintomi peculiari della poliuria, accompagnata da polidipsia e rafforzata dalla caratteristica diagnostica della glicosuria.
Due sono le forme di diabete mellito:
Il diabete di tipo 1 o immunomediato o insulino-dipendente, più tipico ma non esclusivo dell’età infantile ed adolescenziale, è dovuto alla distruzione delle insule pancreatiche di tipo β secernenti l’insulina. E’ perciò caratterizzato da un deficit assoluto di insulina e sul piano terapeutico, dall’insulino-dipendenza che può essere associato a chetoacidosi. Tale forma comprende casi secondari a processi autoimmuni e quelli per cui l’eziologia della distruzione b-cellulare è ignote.
Il diabete di tipo 2 o insulino-indipendente, più tipico dell’età adulta, è abitualmente associato ad obesità ed è dovuto ad una insulino-resistenza. Il trattamento di questa forma di diabete consiste oltre che nella modifica dello stile di vita e delle abitudini alimentari anche nell’uso di ipoglicemizzanti orali.
Sono anche da ricordare le forme di diabete secondario a malattie pancreatiche (pancreatite, tumori, ecc) ed extra pancreatiche (varie endocrinopatir) ed alla assunzione protratta di farmaci ed ormoni ipoglicemizzanti (cortisolo ecc.).
Una posizione a parte occupa il diabete gestazionale (GDM) che insorge durante la gravidanza ed è potenzialmente responsabile di gravi complicanze a carico del feto e della madre.
Sia il diabete di tipo 1 che il diabete di tipo 2 riconoscono cause di origine genetico ed ambientale; è per questo motivo che il diabete è anche definito una malattia multifattoriale.
I tratti caratteristici delle varie forme di diabete sono mostrati in tabella 1.
Una forma particolare di diabete di tipo 1 è il MODY o Mature Onset Diabetes of the Young, che insorge generalmente dopo i 30 anni, può evolvere verso l’insulino-dipendenza ed ha una fortissima componente genetica.
Tabella 1-Aspetti caratteristici delle varie forme di diabete
Il diabete mellito è una malattia di grande rilievo sociale ed esercita un notevole impatto sulla salute pubblica per l’entità della sua diffusione e la gravità delle sue complicanze. Il diabete in italia è infatti diagnosticato nel 3% della popolazione (circa 1.500.000 individui).
Di questi, una parte di molto superiore al 10% è affetta da diabete di tipo 1 ed è in trattamento insulinico; il restante 90% è affetto da diabete di tipo 2 ed è in trattamento con insulina nel 10% dei casi, con ipoglicemizzanti orali nel 60% e con la sola dieta nel 30%.
“Diabete di tipo 1” caratterizzato da distruzione β-cellulare, su base autoimmune o idiopatica, che conduce a deficit insulinico assoluto.
“Diabete di tipo 2” caratterizzato da un difetto della secrezione insulinica, che può
progressivamente peggiorare nel tempo e che si instaura su una condizione preesistente di insulino-resistenza.
“Diabete gestazionale” cioè diagnostaicato per la prima volta durante la gravidanza,
con ripristino della normale tolleranza glucidica dopo il parto.
“Altri tipi specifici di diabete” dovuti a cause note (per es. difetti genetici della funzione
b-cellulare o dell’azione insulinica, malattie del pancreas esocrino) o indotti da farmaci o sostanze chimiche (farmaci usati nel trattamento dell’AIDS o dopo trapianto di organo).
Alla quota di diabete diagnosticato, pari al 35, si deve peraltro aggiungere una quota, dello stesso ordine di grandezza, di diabete non diagnosticato e rappresentato esclusivamente da diabete di tipo 2.
Si può ritenere, in defiitiva, che nel nostro Paese vi siano complessivamente non meno di 3.000.000 di diabetici solo per la metà riconosciuti come tali e quindi curati.
La prevalenza del diabete di tipo 2 aumenta con l’età; al di soèra dei 65 anni, oltre il 10% della popolazione è affetta da diabete.
Saranno le poplazioni in via di sviluppo, il cui stile di vita sta subendo radicali cambiamenti ad avere, negli anni a venire, un aumento molto consistente di pazienti con diabete (King et al., 1998).
Screening del diabete
Sono a rischio di sviluppare il diabete i tipo 2 familiari di soggetti diabetici, donne già affette da diabete gestazionale o che abbiano partorito feti macrosomici (>4000 gr), soggetti obesi, soggetti affetti da ipertensione arteriosa essenziale, ipercolesterolemia e/o ipertrigliceridemia.
Anche l’età, l’attività fisica e l’indice di massa corporea sono risultati importanti fattori indipendenti di rischio.
La presenza di autoanticorpi, rivolti contro le cellule β del pancreas, e lo screanning dei geni che conferiscono un aumentato rischio, permettono, con buona precisione, di calcolare la possibilità di sviluppare diabete di tipo 1.
La ricerca dei suddetti marcatori è rivolta principalmente ai soggetti con familiarità per il diabete di tipo1.
In tutte queste condizioni di aumentato rischio è consigliabile controllare la glicemia a digiuno e, nei casi dubbi, eseguire un carico orale di glucosio.
In ogni caso, al di sopra dei 45 anni è opportuno eseguire una glicemia, da ripetere, se normale, ogni due anni.
Infatti, quanto più precoce è la diagnosi, tanto più efficace è la terapia mirata alla prevenzione delle complicanze croniche.
Complicanze del diabete
Negli ultimi dieci anni, i progressi della terapia ipoglicemizzante (in particolare il trattamento insulinico), ha permesso di ridurre significativamente la mortalità legata alle complicanze acute del diabete mellito come la chetoacidosi o il coma iperosmolare. Attualmente, la principale minaccia per i pazienti diabetici è rappresentata dalle complicanze croniche che sono tuttora causa di elevata mortalità e di gravi invalidità. Il diabete è in grado di danneggiare numerosi organi ed apparati, quali l’apparato cardiocircolatorio, il rene, l’occhio, il sistema nervoso centrale ed il piede. I meccanismi che portano a tali danni sono molteplici, talora specifici della malattia diabetica (per esempio la microangiopatia), talora più generali (per esempio la minore resistenza alle infezioni), spesso legati alla durata ed al compenso metabolico.
Complicanze a carico dell’apparato cardiovascolare
L’apparato cardiovascolare è principalmente colpito dalla macroangiopatia che consiste nella degenerazione della parete delle arterie di medio e grande calibro, analoga all’aterosclerosi, che nel paziente diabetico si manifesta più precocemente e con quadri clinici di maggiore gravità.
Accanto al danno coronario, il cuore può essere interessato dalla cosiddetta “cardiomiopatia diabetica”, mentre la neuropatia vegetativa può essere responsabile di aritmie ventricolari anche fatali e di ipotensione ortostatica. La macroangiopatia è causa di ischemie a carico di diversi organi che si manifestanocon svariati quadri clinici: angina
pectoris, infarto miocardio, ictus e attacchi ischemici transitori cerebrali, claudicatio intermittens, ipertensione nefrovascolare, gangrena agli arti inferiori ecc. Dal punto di vista diagnostico occorre tener presente che la concomitante presenza di neuropatia può attenuare la sintomatologia dolorosa non permettendo così di riconoscere quadri clinici anche molto gravi (come ad esempio l’infarto miocardico silente).
La morbilità e mortalità cardiovascolare nei pazienti diabetici sono nettamente superiori rispetto alla popolazione generale.
La patologia cardiovascolare è particolarmente frequente nel diabete tipo 2, in cui spesso è presente una varietà di condizioni fisiopatologiche che definiscono la cosiddetta “sindrome metabolica”. Tra queste condizioni troviamo. Resistenza alla captazione del glucosio insulino-mediata, alterata tolleranza glucidica, obesità di tipo centrale, ipertensione arteriosa, ipertrigliceridemia, bassi livelli plasmatici di colesterolo HDL, aumento dell’escrezione urinaria di albumina (AER) e così via.
Complicanze a carico dell’occhio: retinopatia
Il disturbo oculare più frequente è la retinopatia emorragico-essudativa, mentre il più importante è la retinopatia proliferante, responsabile della perdita o di una grave riduzione della vista. Quest’ultima richiede, data la sua gravità, interventi tempestivi. Gran parte dei diabetici presenta segni di retinopatia, una lesione dei vasi sanguigni nella parte posteriore dell’occhio, entro dieci anni dall’insorgere del diabete.
La retinopatia diabetica rappresenta la principale causa di cecità nei soggetti adulti al di sotto dei 75 anni di età nei Paesi industrializzati. Oltre alla retinopatia, espressione dell’interessamento oculare da parte della microangiopatia, il paziente diabetico può presentare, con frequenza maggiore rispetto alla popolazione generale, cataratta, glaucoma, ed episodi di cheratocongiuntivite. Gli eventi fisiopatologici che si susseguono nella genesi della retinopatia sono rappresentati da occlusione capillare, aumentata
permeabilità e neoformazione vascolare. La retinopatia è particolarmente frequente nel diabete tipo 1, dove però non si verifica quasi mai durante i primi 5 anni di malattia o in età pre-puberbale; dopo venti anni di diabete è presente nell’80% dei pazienti. Nel paziente con diabete tipo 2 segni di retinopatia (come, peraltro, anche di nefropatia e neuropatia) possono essere riscontrati anche al momento della diagnosi della malattia; ciò può dipendere dal fatto che la presenza di diabete tipo 2 spesso viene riconosciuta con anni di ritardo rispetto all’inizio delle alterazioni metaboliche.
La stadiazione della retinopatia diabetica prevede la distinzione in retinopatia non proliferante (che può essere di grado lieve, moderato o severo) e retinopatia proliferante. All’esame del fondo dell’occhio la retinopatia non proliferante è caratterizzata da dilatazione dei vasi venosi, microaneurismi, essudati ed emorragie, mentre nella retinopatia proliferante oltre a tali alterazioni sono presenti anche i segni di neovascolarizzazione, tralci fibrosi, distacchi della retina, emoraggie vitreali. Un fattore importante ai fini funzionali è rappresentato dall’interessamento della macula (spesso sotto forma di edema maculare), cioè della zona della retina responsabile della visione centrale, con possibilità di perdita della vista per lesioni apparentemente limitate.
Complicanze a carico del rene: nefropatia
Altra complicanza è la nefropatia diabetica, che colpisce il rene al punto che questo organo non filtra adeguatamente le scorie del metabolismo. Nella sua forma più lieve interessa una buona percentuale di diabetici, di cui una parte degenera nell’insufficienza renale a cui segue la dialisi ed il trapianto del rene.
Oltre che dalla localizzazione a livello renale della microangiopatia, i reni dei pazienti diabetici possono essere colpiti da complicanze infettive (pielonefriti), nefroangiosclerosi, necrosi papillari, stenosi ateromastiche delle arterie renali.
Il segno più precoce di nefropatia diabetica è rappresentato dall’incremento dell’escrezione urinaria di albumina (AER) superiore a 20 µg/min o 30 mg/24h, che costituisce la cosiddetta microalbuminuria: tale stadio clinico viene definito nefropatia incipiente. Nel diabete tipo 1 la microalbuminuria compare generalmente dopo i primi dieci anni di malattia, mentre nel diabete di tipo 2 può essere presentata già al momento della diagnosi. In assenza di interventi di prevenzione secondaria, la permeabilità glomerulare tende a peggiorare negli anni fino allo stadio di nefropatia conclamata, caratterizzata da macroalbuminuria (AER>200µg/min o 300 mg/24h) (fig.1). Una volta insorta la nefroapatia conclamata, nel paziente con diabete tipo 1 si verifica un progressivo deterioramento della filtrazione glomerulare, con andamento variabile da caso a caso, che porterà ad insufficienza renale terminale fino al 50% di questi soggetti in dieci anni.
Complicanze a carico del sistema nervoso: neuropatia
Mentre è discussa la compromissione del sisema nervoso centrale è ben noto il quadro fisiopatologico della neuropatia diabetica periferica. Quest’ultima è una condizione veramente eterogenea sia per quanto riguarda i quadri clinici che la gravità.
La gravità della neuropatia varia da forme subcliniche, svelabili solo con accertamenti neurofisiologici, a forme particolarmente severe (neuropatie dolorose, comparsa di ulcere ai piedi con successiva evoluzione in gangrena e necessità di amputazione, ipotensione ortostatica invalidante); in particolare, la presenza di neuropatia autonomia si associa ad un elevato rischio di morte cardiovascolare in conseguenza dell’instabilità emodinamica e della predisposizione ad aritmie ventricolari fatali.
Complicanze a carico del piede
Il “piede diabetico” può essere considerato una complicanza della complicanza, infatti, esso è la conseguenza dei danni causati alle strutture del piede dalla neuropatia e dalla
macroangiopatia in diversa combinazione fra loro, su cui spesso si sovrappongono delle infezioni facilitate da una compromissione dei meccanismi di difesa.
Si ritiene che circa il 15% dei soggetti diabetici vada incontro almeno una volta ad ulcerazione del piede ed è noto che quasi la metà di tutte le amputazioni non traumatiche degli arti inferiori avviene in questi pazienti. L’attività preventiva è, quindi, di estrema importanza nell’impedire sia la comparsa delle lesioni iniziali sia la progressione verso la necessità di amputazione.
Può sembrare un paradosso, ma le complicanze a distanza sono meno temibili nelle forme più conclamate. Questo perché il diabete conclamato consente una diagnosi e un trattamento tempestivo, mentre una forma a lungo inapparente rimane misconosciuta e mina indisturbata gli organi bersaglio. Da qui l’imperativo categorico di una terapia che mantenga la glicemia nella normalità evitando fluttuazioni e picchi iperglicemici, che sembrano essere la causa principale delle complicanze.
Geni e nefropatia diabetica
Geni candidati
L’identificazione di geni di suscettibilità per malattie comuni, quali il diabete o le complicanze del diabete, è resa estremamente complessa dalla interazione tra fattori genetici e fattori ambientali, interazione che può largamente influenzare il manifestarsi della malattia (33,34). Inoltre, si assume che diversi geni abbiano una interazione complessa nello sviluppo e nella progressione della nefropatia. La maggior parte degli studi volti a identificare geni candidati (cioè testare direttamente gli effetti delle varianti genetiche di un gene potenzialmente coinvolto) utilizzano l’analisi caso-controllo per valutare la frequenza o l’incidenza di una particolare variazione genetica tra gli individui affetti. Si tratta di un metodo relativamente semplice, ma la cui efficacia può essere limitata da diversi fattori: ad esempio, da una inadeguata stratificazione tra casi e controlli nell’ambito della popolazione studiata, dalla insufficiente dimensione del campione che ne determina una scarsa potenza statistica, dall’esame, nell’ambito di un gene, di un numero di polimorfismi inadeguato per valutarne il reale coinvolgimento. A parziale soluzione di questi problemi il reale ruolo di geni candidati preliminarmente identificati dovrebbe poi essere confermato o smentito da metodologie di indagine più precise, quali ad esempio il transmission disequilibrium test (TDT). Questo metodo si basa su una ineguale probabilità di trasmissione di markers allelici diversi da genitori eterozigoti ad un figlio affetto (probando). La frequenza di trasmissione di un allele di interesse al probando è comparata con la frequenza di trasmissione di altri alleli che sono considerati non correlati alla malattia. Altri approcci, che coinvolgono il cloning posizionale e lo scanning del genoma, non sono stati ancora altrettanto ampiamente usati nello studio delle componenti genetiche delle complicanze del diabete.
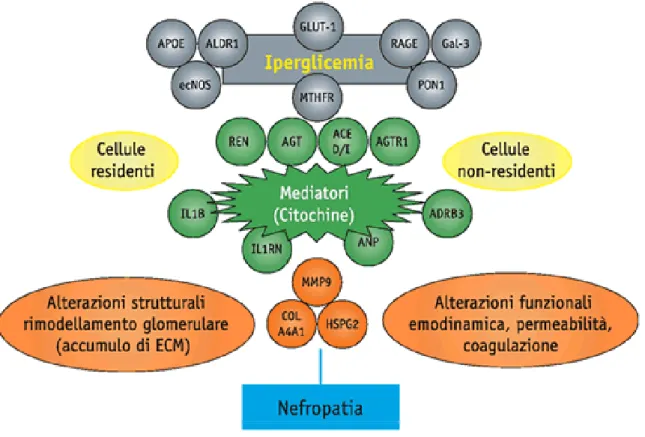
Le attuali conoscenze sulla fisiopatologia della nefropatia diabetica suggeriscono la presenza di complesse interazioni tra numerose pathway (figura 3), in cui sono coinvolte la sintesi e il rilascio di diverse citochine e fattori di crescita, l’attivazione di isoforme della protein-kinasi C (PKC), l’aumentato rilascio di peptidi vasoattivi quali endotelina, renina, angiotensina (AT), la formazione di specie reattive dell’ossigeno, l’aumentata produzione dei prodotti di glicosilazione avanzata, l’aumentata attività dell’aldoso reduttasi, le anomalie nei meccanismi di trasporto del glucosio (35,36).
Figura 3. Le attuali conoscenze sulla fisiopatologia della nefropatia diabetica suggeriscono la presenza di
complesse interazioni tra numerose pathway, in cui sono coinvolte la sintesi e il rilascio di diverse citochine e fattori di crescita, l’attivazione di isoforme della protein-kinasi C (PKC), l’aumentato rilascio di peptidi vasoattivi quali endotelina, renina, angiotensina, la formazione di specie reattive dell’ossigeno, l’aumentata produzione dei prodotti di glicosilazione avanzata, l’aumentata attività del pathway dell’aldoso reduttasi, le anomalie nei meccanismi di trasporto del glucosio.
Sulla base di queste conoscenze della biologia, è stata dedicata attenzione ai polimorfismi di geni candidati che possano modificare i livelli di attività di varie componenti di ciascuna di queste vie, ma al momento attuale l’evidenza di un reale contributo di questi geni candidati al rischio di malattia renale in corso di diabete è scarso. Le citochine coinvolte comprendono fattori di crescita, coinvolti prevalentemente nel controllo del ricambio cellulare e della matrice extracellulare, agenti vasoattivi, implicati soprattutto nella regolazione del tono e della permeabilità vascolari, fattori che modulano la coagulazione e la fibrinolisi e, infine, molecole di adesione, che mediano i contatti cellula e cellula-matrice e, al tempo stesso, tramite questi contatti, influenzano la funzione cellulare.
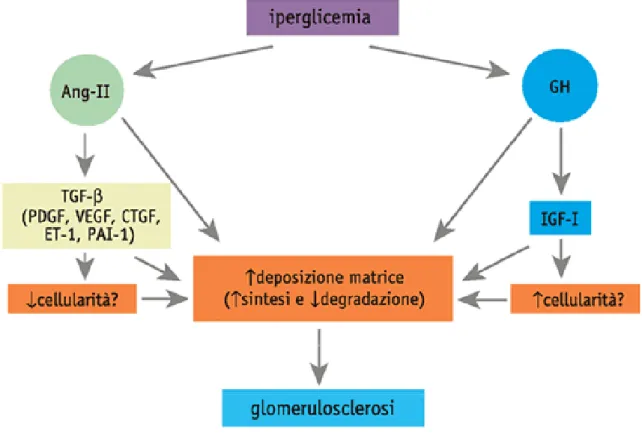
Figura 4. Alterata espressione di citochine e patogenesi della nefropatia diabetica. Effetti degli assi
angiotensina (Ang)-II/transforming growth factor (TGF)-β e ormone della crescita (growth hormone, GH)/insulin-like growth factor (IGF)-I.
Tra i fattori di crescita, un ruolo importante è da attribuirsi a due cosiddetti assi, l’asse angiotensina (Ang)-II/transforming growth factor (TGF)-β, che coinvolge anche il platelet-derived growth factor (PDGF), il vascular endothelial growth factor (VEGF) e il connective tissue growth factor (CTGF), ma anche l’endotelina 1, ET-1, e il plasminogen activator inhibitor (PAI)-1, e, con una funzione più che altro permissiva, l’asse dell’ormone della crescita (growth hormone, GH)/insulin-like growth factor (IGF)-I (figura 4).
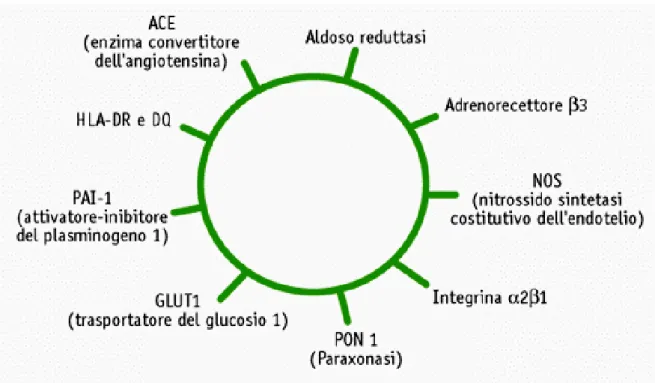
In ogni caso, a parte i geni del sistema renina-angiotensina (RAS), la maggior parte degli altri geni esaminati è implicata nella regolazione dei processi infiammatori, in relazione all'ipotesi che l’infiammazione giochi un ruolo importante anche nella patogenesi della nefropatia diabetica. La microalbuminuria è infatti considerata un marker di disfunzione endoteliale e un valido indicatore di una condizione pro-infiammatoria. Nella tabella 1 sono riportati solo alcuni dei possibili geni candidati allo sviluppo di nefropatia diabetica. Alcuni di questi geni sono potenzialmente coinvolti nella patogenesi dell’ipertensione e della malattia cardiovascolare. Altri, invece, hanno direttamente a che fare con i meccanismi fisiopatologici alla base del danno: l’iperglicemia, i mediatori tissutali dell’insulto, gli effetti di tipo strutturale (con accumulo di matrice extracellulare) o funzionale (con alterazioni emodinamiche, della permeabilità e della coagulazione). A complicare ulteriormente il quadro, alla luce di numerose evidenze epidemiologiche e cliniche, recentemente si è andato affermando il concetto che la proteinuria e la ridotta funzionalità renale, due caratteristiche cliniche che quasi sempre coesistono nella nefropatia diabetica, pur essendo entrambe ereditabili e pur presentando entrambe un’aggregabilità familiare, non sono necessariamente geneticamente correlate (37). Questa ipotesi, oltre a inquadrare la nefropatia diabetica come una patologia costituita da due processi distinti (aumento della proteinuria e declino del filtrato), giustifica la ricerca di geni candidati che possano separatamente influenzare la comparsa e il decorso di queste due entità.
Tabella 1 - Geni “candidati” studiati o ipotizzati in rapporto alle complicanze del diabete.
Ipertensione/malattie vascolari - ACE, enzima di conversione dell’angiotensina II - Angiotensinogeno (AGT)
- Recettore tipo 1 angiotensina II (AT1) - Renina
- Kallicreina (KLK1)
- Recettore per la bradichinina - α-adducina
- Peptide natriuretico atriale (ANP)
- Sintetasi endoteliale dell’ossido nitrico (eNOS) - Inibitore dell’attivatore del plasminogeno (PAI-1) - Glicoproteina piastrinica IIIa
- Paraoxonase
- Fattore di vonWillebrand (vWF) - Fattore VII (FVII)
- Fibrinogeno
- Antitrombina III (ATIII)
- Na+/H Scambiatore + (NHE-1)
Lipidi
- Lipoproteinlipasi - Lipoproteina (a) (Lp(a) - Apolipoproteina A1 (ApoA1) - Apolipoproteina E (ApoE) - Apolipoproteina B (ApoB) - Apolipoproteina C3 (ApoC3)
- CEPT - cholesterol ester transfer protein
Matrice extracellulare - Collagene tipo VI - Heparan sulfate protein - Interleuchina-1 (IL-1)
Altre
- Metilentetraidrofolato reduttasi - HLA human leucocyte antigen - Insulina
- Glicogeno sintetasi (GYS) - Glucochinasi (GCK)
- TGF-β trasforming growth factor- β
- Recettore adrenergico-β3 - TNF-α tumor necrosis factor-α
- Aldoso-reduttasi
- RAGE advanced glycation end-protucts receptors - Sorbitolo deidrogenasi
Geni del sistema renina-angiotensina
La maggior parte della ricerca genetica volta alla identificazione di geni candidati allo sviluppo della nefropatia diabetica si è focalizzata sul sistema renina-angiotensina (RAS), per l’associazione tra le alterazioni di questo sistema e la nefropatia diabetica in studi su modelli animali e sull’uomo (38,39). Per lo più si tratta di studi caso-controllo, volti a esaminare il ruolo di numerosi polimorfismi genici, ma i cui risultati non sono del tutto omogenei. Il polimorfismo più largamente studiato per la sua relazione con la nefropatia diabetica è l’inserzione/delezione (I/D) del gene che codifica per l’enzima di conversione dell'angiotensina (ACE). I risultati dei molti studi, condotti sia in soggetti non consanguinei sia in famiglie, inizialmente contraddittori, negli ultimi 3–4 anni sembrerebbero effettivamente confermare il ruolo di questo polimorfismo. Un importante studio prospettico pubblicato dallo EUCLID Study Group suggerisce che l’allele inserzione del polimorfismo inserzione/delezione (I/D) del gene dell'ACE espone al rischio di sviluppare microalbuminuria: due anni di follow up in 450 diabetici di tipo 1 normotesi normoalbuminurici suggeriscono che i pazienti con genotipo II siano caratterizzati da una più rapida progressione della escrezione urinaria di albumina (40); questi stessi pazienti, peraltro, si distinguevano nel follow-up per una migliore risposta agli ACE-inibitori. Tuttavia, un più recente studio prospettico fornisce risultati contrastanti (41): la progressione verso uno stadio più avanzato della nefropatia è stata valutata in 310 diabetici di tipo 1 proteinurici, seguiti per circa 6 anni. In questi pazienti le curve di Kaplan-Meier del tempo di raddoppio della creatinina sierica o del sopraggiungere dell’insufficienza renale identificano la condizione più sfavorevole negli omozigoti per l’allele D, una condizione di rischio intermedio per gli eterozigoti e una condizione di relativa maggiore protezione nei pazienti omozigoti per l’allele I. Un altro studio condotto in pazienti con diabete tipo 1 normotesi normoalbuminurici seguiti in un follow-up di 10 anni ha mostrato che solo i portatori dell'allele D sviluppavano nefropatia diabetica (42);
in questo studio l’allele D era predittore non solo dell’insorgenza della complicanza, ma anche del declino del filtrato glomerulare, osservazione confermata anche da altri autori nel diabete tipo 1 (43), ma non nel tipo 2 (44). Un importante contributo in questa disputa è stata la dimostrazione che i pazienti con diabete di tipo 2 micro-macroalbuminurici omozigoti per l’allele D, a parità di durata di malattia e di compenso metabolico, hanno un maggiore ispessimento della membrana basale glomerulare e una maggiore espansione del mesangio, cioè un grado più avanzato di glomerulopatia diabetica (45).
Recentemente è stata pubblicata una esaustiva metanalisi sugli studi di rilievo realizzati su questo argomento tra il 1994 e il 2004 (47 studi) che hanno analizzato 14.727 soggetti, di cui 8.663 casi, cioè pazienti con diabete di tipo 1 o di tipo 2 con nefropatia incipiente o avanzata, e 6.064 controlli normoalbuminurici (46). Da questa metanalisi emerge come i soggetti omozigoti per l’allele I abbiano un rischio di nefropatia diabetica del 22% inferiore rispetto ai portatori dell’allele D. I risultati di questa metanalisi, oltre a confermare un’associazione del polimorfismo I/D del gene ACE con la nefropatia diabetica, forniscono indicazioni utili all’uso degli ACE-inibitori nel trattamento di questa patologia. Il ruolo di questo gene nel determinismo della nefropatia diabetica in corso di diabete di tipo 1 ha ricevuto un forte sostegno da uno studio recente che, nei 1.365 pazienti partecipanti al DCCT/EDIC ha esaminato tre markers del gene ACE (rs1800764, inserzione/delezione e rs9896208) che permettono di cogliere variazioni genetiche negli aplotipi più comuni, quelli che si manifestino cioè con frequenza superiore al 5% in soggetti di razza caucasica (47). Tutti e tre questi markers erano fortemente associati allo sviluppo di nefropatia e agli outcomes renali in questa popolazione.
Interessanti appaiono essere anche alcuni studi di farmacogenetica sul ruolo del polimorfismo I/D nel determinismo della risposta terapeutica: ad esempio, un recente studio condotto in pazienti con diabete di tipo 2 trattati per un breve periodo con un ACE-inibitore o un bloccante del recettore AT (48).
L’analisi segregata per il polimorfismo dimostra che gli angiotensin receptor blocker (ARB) riducono significativamente le concentrazioni plasmatiche di transforming growth factor (TGF)-β rispetto agli ACE-inibitori nei pazienti omozigoti per l’allele I, ma non negli ID o nei DD, suggerendo che la identificazione del genotipo dell’ACE possa essere utile per selezionare quei pazienti che possano trarre beneficio da più elevate dosi di ACE-inibitori e da un trattamento più aggressivo per prevenire la nefropatia diabetica o ritardarne la progressione. Altri polimorfismi di geni coinvolti nel controllo del sistema ACE che sono stati sporadicamente associati alla presenza di nefropatia diabetica sono il genotipo CC di un polimorfismo del recettore 1 per l’angiotensina II (A1166C), per cui è stata dimostrata una elevata prevalenza nei pazienti diabetici tipo 2 microalbuminurici (49) e il polimorfismo (+/-) nell’esone 1 del gene per il recettore B2 della bradichinina, associato con un’aumentata escrezione urinaria di albumina sia nel diabete di tipo 1 che nel diabete di tipo 2 (50).
Più recentemente associazioni significative con la patologia renale nel diabete sono state confermate per il polimorfismo Met235Thr dell'angiotensinogeno o individuate per i polimorfismi T>C (-344) della aldosterone sintetasi e G>A (-1903) del gene della chinasi (51). Inoltre effetti combinati sono stati riconosciuti, almeno nella popolazione giapponese, per i polimorfismi del gene dell'ACE (tra cui l'inserzione delezione I/D), quelli dell'angiotensinogeno (Met235Thr) e del recettore tipo 1 dell'angiotensina II (52). Inoltre, le sempre più ampie informazioni relative all'interazione tra polimorfismi dell'ACE e sensibilità alla terapia con inibitori del RAS (53) fanno attualmente ipotizzare un possibile ruolo della genotipizzazione per il polimorfismo I/D dell'ACE quale parte integrante del trattamento della nefropatia diabetica (54).
Geni della flogosi
Le cellule mesangiali rivestono un ruolo centrale nella deposizione di collagene e altri componenti della matrice mesangiale, processo che esita in glomerulosclerosi intercapillare (55); i meccanismi precisi concernenti l’attivazione e la proliferazione delle cellule mesangiali, nonché il reclutamento di sistemi ancillari capaci di produrre citochine non è chiarito. Studi recenti hanno però sottolineato il ruolo dell’infiammazione nell’avvio di questi processi; in particolare, la infiltrazione mesangiale da parte dei monociti/macrofagi gioca un ruolo importante nella progressione verso la glomerulosclerosi e tale processo richiede l'intervento delle molecole di adesione (56). Tra i numerosi geni che codificano per citochine, fattori di crescita, enzimi, mediatori della flogosi, molecole di adesione, quelli che hanno destato maggiore interesse per la loro potenziale relazione con la comparsa e la progressione della nefropatia diabetica sono il gene del PAI-1, quello della matrix metalloproteinase (MMP)-9, e quelli che codificano per la ossido nitrico sintetasi endoteliale (eNOS).
Per quanto riguarda il gene del plasminogen activator inhibitor (PAI)-1(figura 5), il polimorfismo più studiato è il 4G/5G. Nei diabetici di tipo 1, anche se i pazienti nefropatici tendono ad avere livelli plasmatici di PAI-1 più elevati, non sono state evidenziate differenze nelle frequenze alleliche tra soggetti nefropatici e non (57). In una coorte di pazienti cinesi con diabete di tipo 2, il genotipo 4G/4G era un fattore di rischio indipendente per lo sviluppo di nefropatia (odds ratio - OR - 1,85) e, aspetto interessante, vi era un effetto sinergico con l’allele D del gene dell’ACE (58). L’analisi multivariata documentava che il genotipo 4G/5G (OR 1,9) e la presenza di ipertensione arteriosa (OR 2,8) erano gli unici predittori indipendenti di nefropatia in questi pazienti.
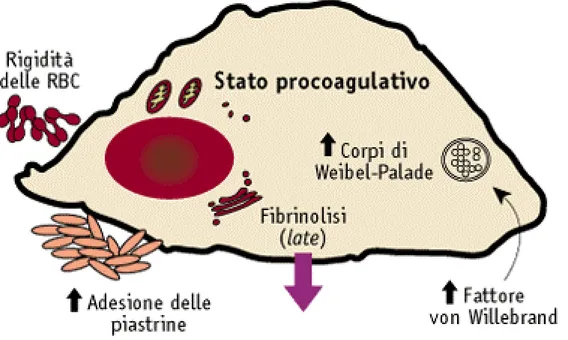
Figura 5. L’inibitore dell’attivazione del plasminogeno 1 (PAI-1) è un potente inibitore della fibrinolisi (figura 4)
(90). L’attività fibrinolitica è in gran parte determinata dai livelli circolanti di PAI-1. Nei soggetti con il diabete di tipo 2 (91, 92) l’attività di PAI-1 è elevata e si associa alterazioni vascolari sia nei soggetti diabetici che nei non-diabetici (93, 94). Il gene che codifica per PAI-1 è localizzato sul cromosoma 7q21.3-q22.
Recentemente, studiando un gruppo di 250 pazienti giapponesi con diabete di tipo 2, è stata identificata nell’ambito del gene della MMP-9 una sequenza ripetitiva di 9 alleli; tra questi, la frequenza dell’allele A21 era inferiore nei diabetici di tipo 2 microalbuminurici o con nefropatia conclamata rispetto ai pazienti non complicati (l’OR per nefropatia calcolato nei non-carrier, negli eterozigoti e negli omozigoti per l’allele A21 era rispettivamente 3,38-1,97 e 0,2), suggerendo un possibile ruolo protettivo di questo allele nei confronti dello sviluppo o della progressione di nefropatia, almeno nei soggetti di razza asiatica (59).
Considerando la microalbuminuria come indice di disfunzione endoteliale, è chiaro come sia stata presa in esame anche la possibile relazione tra geni correlati alla funzione endoteliale e nefropatia diabetica; tra questi, il gene che codifica per la eNOS (NOS3) e per la P-selectina. Il gene NOS3 (figura 6), localizzato sul cromosoma 7q35–36, appare
un forte gene candidato per la suscettibilità alla nefropatia diabetica, anche perché è localizzato nella regione cromosomica legata alla nefropatia nelle famiglie di indiani Pima affetti da diabete di tipo 2 (60). È stato descritto un singolo polimorfismo, T-789C nella regione promoter, in grado di influenzare la trascrizione riducendo l’attività del promotore.
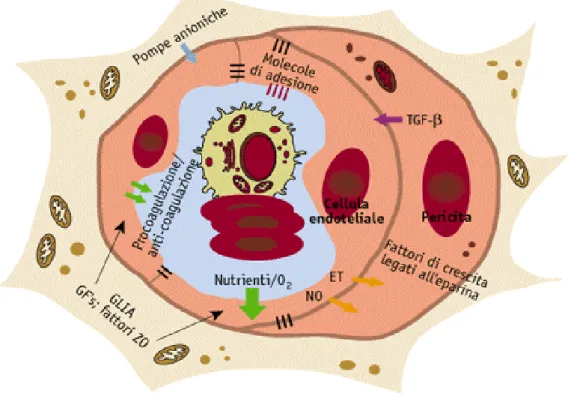
Figura 6. L’enzima nitrossido sintetasi (ecNOS) regola la vasodilatazione e la pressione sanguigna
endotelio-dipendente; la sua ridotta produzione è stata associata all’ipertensione, all’aterosclerosi e al diabete. L’ecNOS media l’ossidazione della L-arginina coinvolta nella produzione di NO determinando la produzione basale di nitrossido della parete vascolare. Le cellule endoteliali (CE) hanno un ruolo centrale nel mantenimento del normale flusso vascolare, nella reologia locale e nella conservazione dell’omeostasi metabolica. Le CE comunicano direttamente con i periciti e, attraverso le “gap junctions” con le cellule muscolari lisce, regolano attivamente il tono e il calibro dei capillari attraverso l’elaborazione di vasodilatatori (nitrossido, adenosina, prostanoidi) e vasocostrittori (endotelina 1, Ang II) in risposta ai bisogni metabolici locali.
In uno studio caso-controllo di 347 pazienti con diabete di tipo 1 e grado variabile di compromissione della funzione renale, l’allele -789C era più frequente nei casi con
nefropatia conclamata che nei casi con proteinuria ma con funzione renale conservata (61). Questo polimorfismo sembra essere anche legato alla suscettibilità a sviluppare albuminuria: in 590 fratelli caucasici provenienti da 230 famiglie con diabete di tipo 2 facenti parte della coorte del Diabetes Heart Study, l’allele -789C era associato con un aumento del rapporto albumina/creatinina, ed era documentato un eccesso di trasmissione dell’allele C in coloro che avevano un più alto rapporto albumina/creatinina (62).
Infine, suscitano interesse i risultati di uno studio di associazione caso-controllo condotto sul genoma di 466 pazienti (diabetici di tipo 2 retinopatici e macroalbuminurici) e 266 controlli (soggetti non diabetici o diabetici retinopatici ma normoalbuminurici), utilizzando polimorfismi single nucleotide (SNP) come markers (63). Dopo genotipizzazione di oltre 80.000 SNP, è emerso che il gene ELMO1 (un gene localizzato sul cromosoma 7p14, richiesto per la regolazione della motilità cellulare e per la rimozione delle cellule apoptotiche, e che è in grado di promuovere la fagocitosi e le modificazioni morfologiche cellulari) è un probabile candidato al conferimento di suscettibilità alla nefropatia diabetica, per la significativa associazione di un SNP di questo gene con la complicanza renale (OR 2,67; CI 95% 1,71–4,16).
Altri geni capaci di modulare il processo infiammatorio o coinvolti nei meccanismi di deposizione fibrotica o di ispessimento della membrana basale e associati al rischio di sviluppare nefropatia nel diabete tipo 1 sono stati individuati in studi più recenti. Così un polimorfismo situato nel codone 10 del gene del TGF-β 1 (64), il polimorfismo c343 G>T della xylosyltransferase 1 (XT-1) implicato nella biosintesi dei proteoglicani (65,66), un polimorfismo localizzato nel promotore del gene IGF-1 (67), sono stati assiociati con la presenza di nefropatia (64,66) o di microalbuminuria (67). Nel diabete tipo 2 associazioni sono state rilevate con il polimorfismo 59029 A/G del promoter del gene CCR5 (chemotactic cytokine receptor-5) in 191 soggetti giapponesi seguiti in un follow up di 10
anni (68), con polimorfismi della β-metalloproteasi (69), con il polimorfismo G-308A del TNF-α (tumor necrosis factor-α) (70), con varianti del gene del recettore per l'interleuchina-6 (IL-6r) (71) e con il genotipo GG (-1082) del gene di IL-10 (72).
Geni coinvolti nella patogenesi del danno da iperglicemia
Due geni associati al metabolismo glucidico contraggono stretti rapporti con le complicanze microvascolari del diabete: il gene dell’aldoso-reduttasi e quello della PKC. Riguardo al primo, l’allele z-2 del polimorfismo 5’-CA è il più studiato, ed è stato associato a una rapida progressione della nefropatia in pazienti diabetici di tipo 1 e 2 di razza asiatica (73,74). Un’autorevole conferma a questa associazione è venuta più recentemente da uno studio autoptico condotto su 186 pazienti con diabete di tipo 2: rispetto ai non carrier, gli eterozigoti e gli omozigoti per l’allele z-2 presentavano un aumento degli indici clinici di danno renale, un aumentato rischio di glomerulopatia diabetica classica (OR 1 vs 0,9 vs 3,3; p=0,026) ed erano caratterizzati istologicamente da una iperespressione di TGF-β, da una transdifferenziazione delle cellule mesangiali e da un’aberrante deposizione di matrice (75). Queste osservazioni non sono state mai confermate in pazienti di razza caucasica (76), suggerendo differenze in termini di etnia e, forse, una non adeguata selezione della casistica.
La PKC è una famiglia di enzimi che catalizzano la fosforilazione di alcune proteine essenziali nell’esplicare importanti funzioni intracellulari, funzionando come componenti-segnale per una varietà di fattori di crescita, ormoni, neurotrasmettitori e citochine. L’iperglicemia porta a un aumento del contenuto di diacilglicerolo, che attiva diverse isoforme di PKC, con inizio di una fitta rete di segnali intracellulari che possono modificare l’espressione genica di numerosi fattori. Tra le differenti isoforme di PKC, l'isoforma beta (PKC-β) è l'isoenzima predominante, attivato nei tessuti vascolari durante l'iperglicemia.
Recentemente è stato studiato il contributo dei polimorfismi del gene della PKC-β in uno studio prospettico osservazionale della durata di sei anni, condotto in 364 pazienti giapponesi con diabete di tipo 2 senza proteinuria franca, che sono stati genotipizzati per 5 polimorfismi (-1504C/T, -546C/G, -348A/G, -278C/T e -238C/G) nella regione del promoter (77). Le curve di Kaplan-Meier hanno rivelato che coloro che erano portatori sia dell’allele T del polimorfismo -1054C/T sia dell’allele G del polimorfismo -546C/G mostravano una transizione più rapida verso stadi più avanzati di danno renale (p=0,015), con una maggiore perdita annuale di filtrato (-2,96±0,62 vs -1,63±0,15 mL/min per 1,73 m2/anno, p=0,02).
Geni del metabolismo glucidico e lipidico
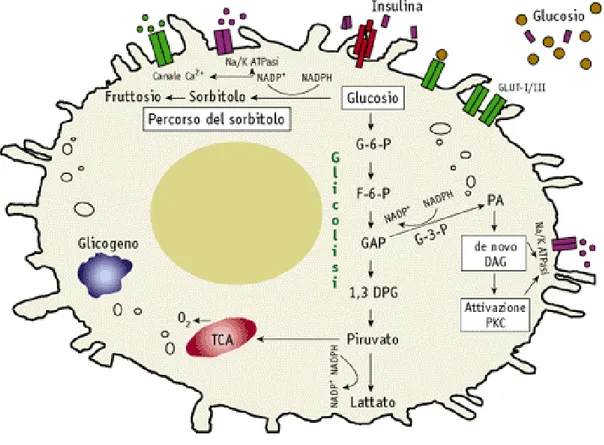
È ovvio che la condizione metabolica più tipica del diabete, cioè il difetto di secrezione e/o d’azione dell’insulina, abbia suscitato interesse anche per la potenziale relazione con la progressione della complicanza renale, soprattutto alla luce di un aumentato grado di insulino-resistenza nei pazienti con diabete di tipo 2 e micro o macroalbuminuria rispetto a quelli normoalbuminurici (78). In questo scenario, un ruolo è stato attribuito al gene del GLUT-1 (figura 7), il trasportatore del glucosio espresso nel rene, importante nella patogenesi del danno renale da iperglicemia perché mediatore della aumentata espressione di TGF-β e, conseguentemente dell’accumulo di matrice mesangiale (79). Il polimorfismo più studiato di questo gene è l’XbaI, inizialmente descritto come associato alla nefropatia diabetica in una coorte di pazienti cinesi con diabete di tipo 2 (80). Questa osservazione non è però stata confermata da altri Autori che hanno studiato pazienti con diabete di tipo 1 di etnia caucasica (81).
Figura 7. Gli effetti lesivi dell’iperglicemia sono caratteristicamente riscontrabili in quei tessuti che, come il
rene, non sono dipendenti dall’insulina per l’ingresso del glucosio nella cellula e, quindi, non sono in grado di ridurre il trasporto di glucosio in funzione dell’incremento dei livelli extracellulari di quest’ultimo. Al contrario, l’espressione del GLUT-1, il principale trasportatore di glucosio a livello glomerulare, è risultata aumentata in glomeruli di ratti e topi diabetici. Inoltre, topi db/db portatori di un transgene antisenso per GLUT-1 sono risultati protetti dallo sviluppo di nefropatia diabetica, mentre l’iperespressione transgenica di GLUT-1, guidata da un promotore modificato della b-actina, in glomeruli di topi db/m non diabetici ha prodotto lo sviluppo di proteinuria ed espansione mesangiale, caratteristici della nefropatia diabetica. Queste osservazioni hanno portato a ipotizzare che l’aumentata espressione di GLUT-1 a livello glomerulare alimenti il metabolismo intracellulare di glucosio e, di conseguenza, amplifichi i fenomeni di glucotossicità che accompagnano l’iperglicemia cronica. L’incremento del metabolismo intracellulare di glucosio per la via glicolitica comporta un aumento della generazione, del trasporto nei mitocondri e dell’ossidazione attraverso il ciclo di Krebs di piruvato, con generazione di NADH e FADH2. Questo comporta un accelerato flusso di elettroni lungo la catena respiratoria mitocondriale, con conseguente aumento del gradiente protonico e della produzione di superossido. Quest’ultimo a sua volta determina danno del DNA, attivazione dell’enzima riparatore poli (ADP-riboso) polimerasi (PARP), che ribosila e quindi inibisce l’enzima gliceraldeide fosfato deidrogenasi (glyceraldeyde phosphate dehydrogenase, GAPDH), favorendo così la diversione dalla via glicolitica verso
altre vie. Queste vie, la cui attivazione è stata dimostrata a livello renale e di altri tessuti bersaglio delle complicanze in modelli animali di diabete, comprendono la via delle esosamine, la sintesi de novo di diacilglicerolo con attivazione della protein kinase C (PKC), la produzione del precursore dei prodotti avanzati della glicazione (advanced glycation endproducts, AGE) metilgliossale, con conseguente accumulo di AGE, e la via dei polioli. A loro volta, l’attivazione della PKC viene favorita dall’attivazione della via dei polioli e delle esosamine e dalla formazione di AGE, mentre lo stress ossidativo risulta da modificazioni dello stato redox associate all’attivazione della via dei polioli e all’attivazione della PKC, via NADPH ossidasi, così come all’autossidazione del glucosio e dei prodotti iniziali di glicazione e all’interazione degli AGE con i propri recettori. La generazione di specie reattive dell’ossigeno (reactive oxygen species, ROS) attraverso queste vie è capace di innescare vie di segnale redox-sensibili che conducono all’attivazione della mitogen-activated protein kinase (MAPK) e quindi di fattori di trascrizione quali activated protein (AP)-1 e nuclear factor kB (NFkB).
Una recente metanalisi ha cercato di fare chiarezza su questi risultati contraddittori, esaminando cinque studi condotti su pazienti caucasici e uno su una popolazione asiatica. La metanalisi, pur documentando la grande eterogeneità di questi studi, conferma l’esistenza di un’associazione tra nefropatia diabetica e GLUT-1 (82). Recentemente è stato descritto un nuovo polimorfismo (A–2841T) nella flanking region 5’ del gene che codifica per GLUT-1, esaminato in 288 diabetici di tipo 1 e 101 controlli (83). È stata identificata una maggiore frequenza del genotipo TT2841 in pazienti nefropatici rispetto a quelli non complicati con lunga durata di malattia. Recentemente, nel contesto del GENEDIAB STUDY, è stata rilevata, in una ampia coorte di soggetti con diabete tipo 1, una associazione tra genotipo Gly 82 Ser del gene del RAGE (Receptor for Advanced Glycation End products) e nefropatia avanzata (84), mentre un altro polimorfismo dello stesso gene è stato associato ad un ridotto rischio di eventi ischemici a livello cardiaco (85).
Tra i geni coinvolti nella regolazione del metabolismo lipidico, interessanti per la loro relazione con la nefropatia diabetica appaiono essere quello che codifica per ApoE, e il
gene della paraoxonasi. ApoE consiste di tre isoforme (E2, E3 ed E4), codificate da tre alleli: e2, e3 ed e4 nell’esone 4 del gene. Ampi studi caso-controllo e studi familiari che hanno utilizzato il TDT descrivono un aumentato rischio di nefropatia in diabetici di tipo 1 portatori dell'allele e2 (86). Uno studio di follow-up, volto a confermare tali risultati, ha effettivamente dimostrato che questo allele è un fattore di rischio prognostico sia di sviluppo sia di progressione di nefropatia nei diabetici di tipo 2 di razza giapponese (87), nonché un marcatore di più rapido declino della funzionalità renale in pazienti di razza caucasica con diabete di tipo 2 e nefropatia conclamata (88). Altro gene che ha recentemente suscitato interesse è quello della paraoxonasi, un enzima che previene l’ossidazione delle low density lipoproteins (LDL) in vitro. Tra i polimorfismi presi in esame, appaiono interessanti il polimorfismo Met54Leu della paraoxonasi (PON)-1 e il Cys311Ser della PON-2. In adolescenti diabetici di tipo 1, il gene Ser/Ser della paraoxonasi-2 risultava significativamente più frequente nei microalbuminurici rispetto ai normo e, tra i normo, più frequente in coloro che avevano l’AER nel range superiore di normalità (89). Fra i tre geni che codificano per la paraoxonasi, per due polimorfismi del PON-2 (PON2-311 e PON2-148) è stata documentata un’associazione significativa (e indipendente dai tradizionali fattori di rischio) con la nefropatia diabetica in una coorte di 229 pazienti con diabete tipo 2 (90).
Recentemente il polimorfismo funzionale Ala54Thr del gene FABP2, codificante per una proteina espressa negli enterociti e responsabile dell’assorbimento degli acidi grassi a lunga catena, è stato genotipizzato in 1.042 pazienti brasiliani con diabete di tipo 2 (91). La prevalenza del genotipo TT era maggiore nei pazienti con danno renale incipiente o conclamato rispetto ai pazienti con funzionalità renale preservata. Questa osservazione è stata poi confermata in un secondo campione indipendente di 483 pazienti caucasici con proteinuria o insufficienza renale cronica. In diabetici tipo 2 di origine cinese è stata documentata una interessante interazione tra geni coinvolti nel metabolismo lipidico nella
modulazione del rischio di nefropatia diabetica. Un polimorfismo della lipasi epatica capace di rallentare la clearence dei remnant ricchi in trigliceridi interagisce con i polimorfismi di ApoE e della apolipoproteina C3 nel modulare il rischio di nefropatia (92). Interazioni analoghe sono state osservate anche tra ApoE, apolipoproteina C3 e polimorfismi della lipoproteinlipasi (93).
Insulino-resistenza, geni da insulino-resistenza e nefropatia diabetica
Numerosissime evidenze suggeriscono che l’insulino-resistenza rappresenti un momento patogenetico fondamentale sia per il diabete tipo 2 sia per la malattia aterosclerotica. L’insulino-resistenza svolge un ruolo patogenetico importante anche nel determinismo del danno renale, sia nella popolazione generale che nei pazienti con diabete tipo 1. Sono infatti numerosi gli studi condotti anche su ampie popolazioni che hanno documentato uno stretto legame tra insulino-resistenza (e sindrome metabolica) e la malattia renale. Chen e coll. hanno recentemente pubblicato i risultati di uno studio condotto su oltre 6.000 adulti americani che ha mostrato come esista una forte associazione tra la sindrome metabolica, l’insulino-resistenza e la presenza di microalbuminuria o di malattia cronica renale, definita da un filtrato glomerulare renale inferiore a 60 mL/min/1,73m2. In questa coorte, il rischio di microalbuminuria e di malattia cronica renale era aumentato di 1,9 e 2,6 volte, rispettivamente, nei soggetti con sindrome metabolica confrontati a soggetti senza sindrome metabolica e tale aumento era lineare con l’aumentare del numero dei componenti della sindrome metabolica (94). Mediante clamp euglicemico iperinsulinemico, è stato dimostrato che diabetici tipo 1 microalbuminurici, e quindi con malattia renale incipiente, hanno una ridotta sensibilità all’insulina (95). Successivamente, due studi prospettici, sebbene condotti con metodologie diverse e con diversa numerosità della popolazione studiata, hanno confermato questa associazione (96,97). Orchard e
coll. hanno documentato che i pazienti con diabete tipo 1 che al follow-up di 10 anni progredivano verso la nefropatia conclamata erano quelli che all’ingresso nello studio presentavano maggiore insulino-resistenza (97). Insulino-resistenza è stata documentata nei genitori di pazienti con diabete mellito tipo 1 e nefropatia diabetica (22) suggerendo che proprio la condizione di insulino-resistenza rappresenti uno dei fattori ereditari di suscettibilità alla complicanza renale. La dimostrazione, inoltre, che la storia familiare positiva per diabete tipo 2, per definizione caratterizzato da insulino-resistenza, sia più frequente nelle famiglie di pazienti con diabete tipo 1 e nefropatia, rafforza la possibilità che l’insulino-resistenza preceda e giochi un ruolo importante nel determinare l’insorgenza del danno renale. Una serie numerosa di studi atti a chiarire i rapporti tra insulino-resistenza e nefropatia diabetica sono stati condotti anche in pazienti con diabete tipo 2 (99,100). In oltre 700 pazienti con diabete tipo 2 è stata riportata una stretta e indipendente correlazione tra insulino-resistenza, stimata con un indice indiretto quale è l’HOMAir, e la escrezione urinaria di albumina (r=0,15, p=0,0001). In questo studio i pazienti più insulino-resistenti, soprattutto se maschi, avevano aumentato di oltre 4 volte il rischio di avere elevati valori di escrezione urinari di albumina (101). In questa stessa popolazione è stata anche documentata una stretta associazione tra sindrome metabolica e riduzione del filtrato glomerulare. La presenza di 2 o 3 componenti della sindrome metabolica, oltre al diabete, aumenta di 3,4 o 4,6 volte il rischio di malattia cronica renale (102).
I meccanismi attraverso i quali l’insulino-resistenza potrebbe giocare un ruolo determinante nella insorgenza del danno renale sono molteplici. Il primo potrebbe essere legato all’iperinsulinemia che caratterizza i soggetti insulino-resistenti e che, agendo a livello del tubulo renale, potrebbe essere la causa, attraverso una sua spiccata azione sodio-ritentiva, di un aumento del volume extracellulare e, conseguentemente, dei valori pressori sia a livello sistemico sia a livello intraglomerulare (103). L’insulino-resistenza
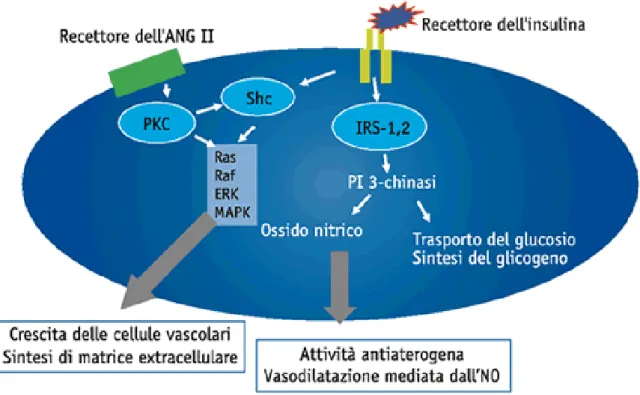
potrebbe contribuire anche alla maggiore sodio-sensibilità che caratterizza i pazienti con diabete tipo 2 e microalbuminuria (104). L’aumento della pressione intraglomerulare a sua volta potrebbe avviare una serie di danni che portano all’aumentata escrezione di albumina, ma, anche, attraverso meccanismi di modificazione dello shear stress, alla proliferazione del mesangio e della matrice mesangiale (105). Inoltre, in condizioni di normale sensibilità insulinica, l’insulina aumenta la produzione di ossido nitrico (NO), stimolando l’attivazione dell’eNOS o inducendo un’aumentata espressione di tale enzima (figura 8 e figura 9).
Figura 8. Meccanismi cellulari attraverso i quali l’insulina attiva l’utilizzazione glucidica e stimola la
vasodilatazione NO-mediata. Entrambi gli effetti sono mediati dall’attivazione di identiche vie di trasmissione del segnale insulinico. A livello del muscolo scheletrico il legame dell’insulina con il proprio recettore determina l’attivazione della cascata IRS/PI3-K/Akt e la conseguente traslocazione del trasportatore del glucosio insulino-dipendente (GLUT-4). A livello della cellula endoteliale l’attivazione della stessa via del
segnale comporta la trascrizione di eNOS, l’enzima responsabile della sintesi di ossido nitrico. In patologia umana l’insulino-resistenza si associa a un tipico difetto della cascata IRS/PI3-K/Akt, motivo per il quale ben si comprende come al ridursi dell’utilizzazione insulino-mediata di glucosio si possa associare una proporzionale riduzione dell’effetto vasodinamico dell’insulina. La riduzione della sintesi di NO, peraltro, non svolge un semplice ruolo dinamico ma esercita una forte azione anti-aterogena in quanto determina inibizione della trascrizione delle metalloproteinasi (MMP-2, MMP-9), stimola quella degli inibitori tissutali delle metalloproteinasi (TIMP) e regola il processo apoptotico. A livello cellulare, l’insulina attiva anche la via mitogena ERK/MAPK. Mentre a livello dei tessuti metabolicamente attivi questa via regola l’effetto anabolico dell’ormone, nel sistema vascolare, essa media non solo la crescita cellulare ma anche la capacità di migrazione delle cellule endoteliali, delle cellule muscolari lisce e dei monociti, oltre che l'espressione di PAI-1 e di endotelina, e modula la risposta a fattori vasoattivi come angiotensina II e prostaglandine.
Figura 9. In altre parole, sembra quasi che a livello endoteliale si stabilisca un delicato equilibrio tra azioni
anti-aterogene modulate dalla cascata IRS/PI3-K/Akt e azioni pro-aterogene mediate dalla via ERk/MAPK. Recentemente, è stato osservato che la condizione di insulino-resistenza coinvolge in modo abbastanza specifico la prima ma non la seconda delle vie del segnale intracellulare dell’insulina. Mediante biopsia muscolare eseguita al termine di clamp euglicemico-iperinsulinemico in soggetti normali e insulino-resistenti (obesi e diabetici) il deficit di azione insulinica si associava a una minore attivazione di PI3-K, mentre normale
risultava quella di ERK. Analogamente, in ratti Zucker obesi e insulino-resistenti, l'attivazione della PI3-K da parte dell'insulina è attenuata mentre normale è quella della MAPK. Queste osservazioni hanno fatto ipotizzare che, in presenza di insulino-resistenza, si venga a creare una condizione di sbilanciamento tra le due vie del segnale insulinico, squilibrio che può essere particolarmente marcato in caso di concomitante iperinsulinemia, come frequentemente si osserva in soggetti insulino-resistenti. Infatti, l’aumento dei livelli circolanti di insulina potrebbe determinare un eccesso di attivazione della via ERK/MAPK che, rispetto alla cascata IRS/PI3-K/Akt, mantiene una sua normale responsività. Questa ipotesi ha ricevuto recenti supporti sperimentali. Il blocco della PI3-K ottenuto con wortmannina in cellule endoteliali si accompagna a una marcata riduzione della trascrizione di eNOS in risposta alla esposizione a elevate concentrazioni di insulina, ma, nel contempo, a una iper-attivazione di MAPK. Questo eccesso di attivazione di MAPK si accompagna a un aumento dei processi di prenilazione delle proteine Ras e Rho, fattori iniziali del processo aterosclerotico, e dell’espressione delle molecole di adesione (ICAM, VCAM, E-selectina).
In condizioni fisiologiche l’insulina causa vasodilatazione e ritarda la migrazione e la crescita delle cellule muscolari lisce dei vasi. Quest’azione è ridotta negli stati caratterizzati da insulino-resistenza. Inoltre, in condizione di insulino-resistenza verrebbe esaltata l’attività delle MAPK, responsabile degli effetti mitogeni e pro-aterogeni dell’insulina che, a livello renale, si traducono in un aumento della deposizione di matrice extracellulare. Inoltre, la perduta azione vasodilatatrice, secondaria alla ridotta disponibilità di ossido nitrico, porterebbe a un aumento della pressione intraglomerulare in grado di indurre ipertrofia e iperplasia delle cellule mesangiali, con aumentata produzione locale di citochine e fattori di crescita e aumento della matrice extracellulare (figura 9). ENPP1/PC-1 è una glicoproteina ad azione inibitrice del segnale dell’insulina. Recentemente è stato individuato un polimorfismo del gene di ENPP1/PC-1, denominato K121Q, (cioè la glutamina - Q - sostituisce la lisina - K- nella posizione aminoacidica 121). La variante 121Q inibisce in maniera attiva il segnale insulinico (106) ed è associata nella popolazione generale a insulino-resistenza (107). A fronte di dati sostanzialmente negativi relativamente al ruolo del polimorfismo di ENPP1/PC-1 nell'insorgenza della nefropatia
diabetica, è stata dimostrata nei diabetici tipo 1 portatori dell’allele 121Q, una velocità di progressione della nefropatia, significativamente più elevata rispetto a pazienti omozigoti per l’allele 121K (7,2 vs 3,7 mL/min/anno di perdita di filtrato glomerulare) (108). Questa osservazione è stata recentemente confermata da Krolewski e coll. (109), mentre in una coorte di pazienti danesi con diabete tipo 1 e nefropatia diabetica, si sono avuti risultati discordanti (110). È da sottolineare, però, che nella popolazione danese non è stata trovata l’associazione tra allele 121Q e insulino-resistenza, venendo quindi a mancare il presupposto fisiopatologico che legherebbe ENPP1/PC-1 alla insulino-resistenza (111). Tra i pazienti con diabete tipo 1 e nefropatia portatori dell’allele 121Q di ENPP1/PC-1 quelli che presentano anche il genotipo DD dell’ACE presentano un rischio significativamente (p<0,001) maggiore di avere una elevata velocità di progressione del danno renale (112). Nel diabete tipo 2, i portatori dell'allele 121Q hanno un filtrato glomerulare più basso rispetto ai pazienti portatori del genotipo K121K (113).
Il PPARγ (recettore dell’attivatore della proliferazione dei perossisomi gamma) è un promettente gene candidato per il diabete tipo 2 e l’obesità poiché regola la differenziazione degli adipociti e il metabolismo lipidico e glucidico. Una associazione tra polimorfismo Pro12Ala e nefropatia diabetica è stata descritta da Herrmann e coll. in una coorte di 445 pazienti con diabete tipo 2 (114). In particolare l’allele Ala12 era associato a livelli più bassi di escrezione urinaria di albumina, suggerendo un ruolo protettivo nei confronti della insorgenza della complicanza renale (114). Caramori e coll. hanno successivamente confermato in una popolazione brasiliana di pazienti con diabete tipo 2 l’effetto protettivo dell’allele Ala12 rispetto alla nefropatia diabetica (115).
Il gene della eNOS, coinvolto nella modulazione della sensibilità all'insulina, presenta a livello dell'introne 4 una ripetizione di 5 nucleotidi ed un polimorfismo caratterizzato dalla delezione di uno dei 5 nucleotidi (ecNOS4a/4b). L'allele ecNOS4a (delezione di uno dei 5 nucleotidi) è associato a livelli circolanti di NO più bassi e anche alla presenza di malattia