\
Corso di Dottorato di Ricerca in
Scienza delle Produzioni Vegetali
AGR02 (Agronomia e Colture erbacee)
XXII Ciclo (2007-2009)
Tesi di dottorato
Ricerche bioagronomiche
su specie erbacee biocide
Candidata
Patrizia Fortuna
Presidente del Corso
Relatore
Prof. Alberto Pardossi
Prof. Mario Macchia
INDICE
1 Introduzione... 4
1.1.DIFESA DELLE PRODUZIONI IN AGRICOLTURA CON INSETTICIDI DI ORIGINE VEGETALE...4 1.2.INSETTICIDI BOTANICI...6 1.2.1 PIRETRO...6 1.2.2 NEEM...7 1.2.3 ROTENONE...7 1.2.4 OLI ESSENZIALI:...8 1.2.5 NICOTINA...12 1.2.6 RYANIA...12 1.2.7 SABADILLA...13
1.3.NUOVI POTENZIALI INSETTICIDI BOTANICI...13
1.3.1 ALCALOIDI NELLE PIANTE...14
1.3.2 FLAVONOIDI: FUNZIONE ED ATTIVITA’...16
1.3.3 PROTEINE...19
1.4.PROBLEMI PRATICI DI COMMERCIALIZZAZIONE...20
1.4.1 TENDENZE ATTUALI NELL’USO DI INSETTICIDI BOTANICI23 1.5.RUOLO DEGLI INSETTICIDI BOTANICI NEL FUTURO...24
1.6.PROBLEMATICHE NELLA CONSERVAZIONE DELLE DERRATE ALIMENTARI...26
1.6.1 METODI DI LOTTA IN MAGAZZINO...28
1.6.2 LA FUMIGAZIONE NEL CONTROLLO DEGLI INSETTI DELLE DERRATE...32
1.6.3 MODO DI AZIONE DEGLI OLI ESSENZIALI E DEI LORO COMPONENTI SUGLI INSETTI DELLE DERRATE...35
1.6.4 EFFETTI DEGLI O.E. SUI PRODOTTI ALIMENTARI: PROBLEMI E PROSPETTIVE...36
1.7 SPECIE AD ATTIVITA’ BIOCIDA OGGETTO DELLA RICERCA...38
1.7.1 FAMIGLIA FABACEAE...39
1.7.1.1 CASSIA SOPHERA (L.)...40
1.7.1.2 CLITORIA TERNATEA (L.)...41
1.7.1.3 MEDICAGO TRUNCATULA (GAERTN.)...46
1.7.1.4 TEPHROSTA CINEREA (L.) PERS...47
1.7.1.5 TEPHROSIA PURPUREA (L.) PERS...49
1.7.2 FAMIGLIA ASTERACEAE...51
1.7.2.1 AGERATUM CONYZOIDES (L.)...51
1.7.2.2 ARTEMISIA TRIDENTATA (NUTT.)...53
1.7.2.3 ARTEMISIA JUDAICA (L.)...54
1.7.2.4 ARTEMISIA VULGARIS (L.)...55
1.7.2.5 INULA CONYZA (DC.)...56
1.7.3 FAMIGLIA LAMIACEAE...57
1.7.3.1 HYPTIS EMORYI (TOR.)...57
1.7.3.2 HYPTIS LANCEOLATA (POIT.)...58
1.7.3.3 HYPTIS SPICIGERA (LAM.)...59
1.7.3.4 HYPTIS SUAVEOLENS (POIT.)...63
1.7.3.5 PLECTRANTHUS BARBATUS (ANDR.)...66
1.7.4 FAMIGLIA ASCLEPIADACEAE...67
1.7.4.1 CALOTROPIS PROCERA (AIT.)...67
2 Obiettivi dei tre anni di ricerca ... 71
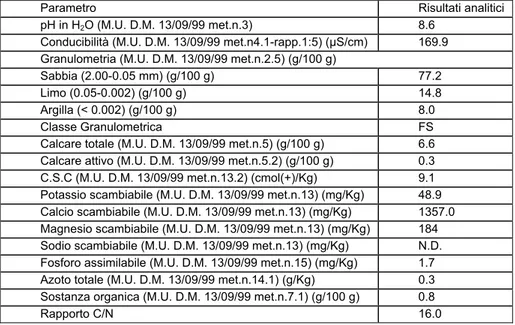
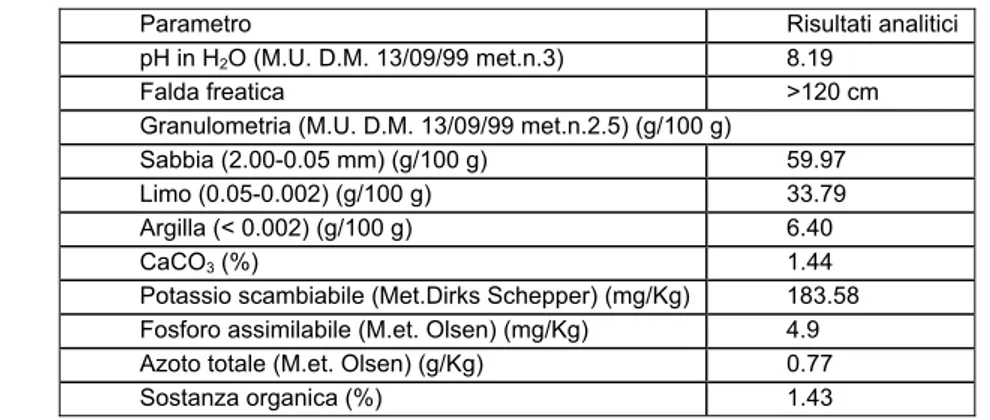
3 Materiali e Metodi ... 72
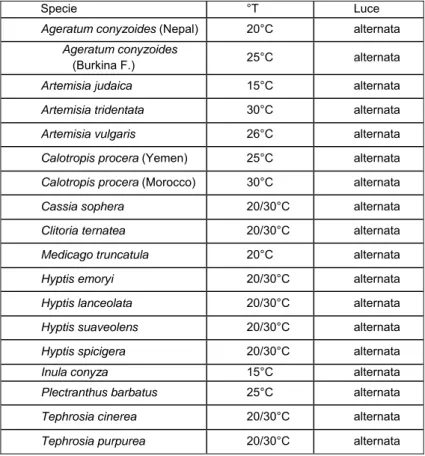
3.1 GERMOPLASMA...72
3.3 SPERIMENTAZIONE 2008...76
3.4 SPERIMENTAZIONE 2009...78
3.5 ESTRAZIONE DEGLI OLI ESSENZIALI...79
3.6 ANALISI STATISTICA...80 3.7 DATI METEOROLOGICI...80 4 Risultati e discussione... 84 4.1 FABACEAE...84 4.1.1 CASSIA SOPHERA (L.)...84 4.1.2 CLITORIA TERNATEA (L.)...91
4.1.3 MEDICAGO TRUNCATULA (GAERTN.)...100
4.1.4 TEPHROSIA CINEREA (L.) TEPHROSIA PURPUREA (L.) PERS...101
4.2 ASTERACEAE...120
4.2.1 AGERATUM CONYZOIDES (L.)...120
4.2.2 ARTEMISIA TRIDENTATA (NUTT.), ARTEMISIA JUDAICA (L.), ARTEMISIA VULGARIS (L.)...122
4.2.3 INULA CONYZA (DC.)...122
4.3 LAMIACEAE...124
4.3.1 HYPTIS EMORYI (TOR.), HYPTIS LANCEOLATA (POIT.),HYPTIS SPICIGERA (LAM.), HYPTIS SUAVEOLENS (POIT.)...124
4.3.2 PLECTRANTHUS BARBATUS (ANDR.)...129
4.4 ASCLEPIADACEAE...131
4.4.1 CALOTROPIS PROCERA (AIT.)...131
5 Considerazioni conclusive ...134
1 Introduzione
1.1. DIFESA DELLE PRODUZIONI IN AGRICOLTURA CON INSETTICIDI DI ORIGINE VEGETALE
Il controllo degli insetti nocivi in agricoltura e in selvicoltura, nella conservazione delle scorte, nell’allevamento del bestiame e nella cura degli animali domestici rappresenta sempre più un grave problema (Alexenizer M.et
al., 2007).
In agricoltura si è sempre sentita la necessità di difendere le produzioni da insetti, crittogame e fitopatie in genere, sia in pieno campo che in magazzino.
Già due millenni di anni fa in Cina, in Egitto, in Grecia ed in India si usavano derivati da piante con caratteristiche insetticide, così come in Europa e nel Nord America per oltre 150 anni, fino a quando la scoperta degli insetticidi chimici di sintesi, fra la metà degli anni 30 e il 1950, non ne ha decretatp il declino.
Lo slancio con cui sono stati usati principi attivi quali clororganici, carbammati, esteri fosforici, piretroidi, hanno relegato gli insetticidi botanici da un importante ruolo in agricoltura ad una posizione insignificante nel mercato dei prodotti per la protezione delle colture dalle fitopatie.
La storia ha dimostrato però che l’uso di prodotti di sintesi ha determinato problemi non previsti al tempo della loro introduzione, con conseguenze negative per l’ecosistema.
Vi sono stati casi di avvelenamento acuto e cronico degli operatori agricoli e perfino dei consumatori; morte di pesci e di uccelli, alterazione del controllo biologico naturale e dell’impollinazione, contaminazione di acqua, terreno, cibo. Grande è stata la minaccia per la salute dell’uomo e per l’equilibrio ambientale, ma il più grande ostacolo all’uso massiccio di insetticidi è stata l’ evoluzione di popolazioni resistenti ai trattamenti.
Molti Governi hanno risposto a questi problemi con azioni di limitazione, di proibizione o di sostituzione dei prodotti più dannosi ed hanno elaborato politiche per una conseguente rivalutazione dei prodotti ritenuti meno rischiosi per l’ecosistema e per l’uomo, fermo restando l’uso massiccio di insetticidi. Basti pensare che solo nel 2003 in California sono stati usati 80000 tonnellate di prodotti insetticidi, corrispondenti al 6% di quelli usati nel mondo, dei quali il 91% in agricoltura.
In USA, l’ Environmental Protection Agency ha fissato, con il Food Quality Protection Act del 1996, il livello massimo di insetticidi residui tollerato nei cibi, dopo la definizione di cosa fosse un insetticida “a rischio ridotto”.
Ciò ha avuto l’effetto di vietare l’uso di molti insetticidi di sintesi diffusi in agricoltura prima del 1980 (Isman M.B., 2006), come il bromuro di metile, ritenuto responsabile del buco dell'ozono, in accordo con le disposizioni di Montreal dell' aprile 2000.
Questo e altri problemi connessi ad un uso spesso sconsiderato di prodotti tossici hanno portato alla necessità di sviluppare un modo alternativo, di origine
biologica, per il controllo selettivo degli insetti.
Ecco che molti estratti vegetali ed oli essenziali possono rappresentare fonti alternative di controllo di insetti nocivi, anche ai prodotti conservati, in quanto costituiscono una ricca e potenziale fonte di principi bioattivi, sfruttabili commercialmente. (Salunke B.K. et al., 2005)
E' necessario infatticercare strategie alternative per il controllo degli insetti dannosi e delle altre fitopatie, per superare il problema delle forme di resistenza indotta e ridurre al minimo il pericolo che ne insorgano di nuove.
Inoltre, gli aspetti legati all' ambiente, come la persistenza dei principi attivi nel suolo, nelle falde acquifere e nelle acque superficiali, così come gli effetti sugli organismi non-target, devono essere considerati più coscienziosamente che in passato (Alexenizer M. et al., 2007).
Oggi si parla anche di modalità di lotta integrata, condotta quando ce ne sia reale necessità, valutando la soglia di intervento economico e includendo strategie per controllare la resistenza alle sostanze biocide. Più complessa rispetto alla lotta a calendario, sia per le infestazioni del suolo che per quelle sulla pianta, è più lunga e più difficile da attuare, anche dal punto di vista economico. Molti nemici del suolo e delle piante sono microscopici e possono avere diversi stadi di sviluppo, la cui virulenza è legata alle condizioni ambientali ed al numero di individui presenti. Alcuni insetti possono essere presenti come uova svernanti, quando la coltura viene seminata, o come stadio vitale successivo, che causa il danno durante la crescita della coltura stessa (Matthiessen J. N. & Kirkegaard J. A., 2006).
Auspicabili sono quelle preparazioni che esibiscano nuovi modi di azione ed agiscano specificatamente contro gli organismi che devono essere controllati. Negli ultimi venti anni molta attenzione è stata rivolta, come abbiamo già ricordato, agli agenti naturali di controllo, fra cui quelli di origine botanica, sostanze attive o miscele di composti, metabolicamente correlati, con diversi spettri di attività.
La complessità degli estratti crudi spiega l'uso versatile dei preparati etnobotanici. Le miscele agiscono in modo sinergico, cosa positiva in termini di efficacia e di gestione delle fitopatie, diminuendo considerevolmente lo sviluppo di forme di resistenza. Inoltre, le sostanze naturali sono degradate nell'ambiente piu velocemente e piu' facilmente dei composti sintetici (Alexenizer M. et al., 2007).
La letteratura scientifica degli ultimi 25 anni descrive centinaia di metaboliti secondari delle piante, che hanno manifestato, in prove di laboratorio, effetti repellenti o tossici verso i naturali nemici delle piante coltivate, ma pochi sono ancora gli insetticidi botanici in commercio, molti dei quali rappresentano una potenzialità per il mercato del futuro.
1.2. INSETTICIDI BOTANICI
Quattro sono i più importanti gruppi di prodotti botanici utilizzati a livello mondiale per il controllo degli insetti: piretro (oleoresina estratta dai fiori essiccati di Tanacetum cinerariaefolium (Asteraceae); neem (dai semi di
Azadirachta indica (Meliaceae); rotenone (uno dei vari isoflavonoidi estratti dalle
radici e dai rizomi delle Leguminose tropicali Derris e Lonchocarpus e dalle varie parti delle piante del Genere Tephrosia); oli essenziali di rutaceae,
asteraceae, canellaceae e labiatae.
Tre insetticidi contenenti alcaloidi, ma usati con limitazione, sono: nicotina (dalle foglie della pianta di tabacco); ryania (dal legno dell’albero caraibico
Ryania speciosa (Flacourtiaceae) e sabadilla (dai semi di Schoenocaulon
officinale, pianta sudamericana).
Altri estratti da piante ed oli, come l’olio di Brassica e l’oleoresina di
Capsicum (garlic), annona (dai semi dell’omonima pianta tropicale) hanno un
uso limitato ad alcuni Paesi (Isma M.B., 2006).
Dopo la messa al bando del bromuro di metile, la ricerca si è orientata verso principi attivi, anche di origine biologica, che lo sostituissero.
I glucosinolati, derivati dal metabolismo secondario delle Crucifere e contenuti nelle parti verdi, sono talvolta usati come biofumiganti contro nematodi, batteri, funghi (Gimsing A.L., Kirkegaard J.A., 2006). Da essi derivano gli isotiocianati, chimicamente simili al metilisotiocianato, principio attivo del fumigante sistemico metamsodio, usato come sostituto del bromuro di metile nel terreno.
Attualmente, la biofumigazione non è molto diffusa, in quanto si devono ancora superare problemi pratici di distribuzione e di commercializzazione. Inoltre, la biodegradazione microbica è un fenomeno così enigmatico, che può diminuire l’efficacia degli isotiocianati e di molti sostituti del bromuro di metile tuttora usati (Matthiessen J. N. & Kirkegaard J. A., 2006).
1.2.1 PIRETRO
Il nome si riferisce alle oleoresine estratte con esano od altro solvente non polare dai fiori essiccati e polverizzati di Tanacetum cinerariaefolium (Asteraceae). L’allontanamento del solvente lascia un liquido di colore arancio che contiene i principi attivi: tre esteri dell’acido crisantemico e tre esteri dell’acido piretrico. I più abbondanti fra questi, le piretrine, contenenti l’alcol piretrolone, svolgono molte delle attività insetticide e sono contenute nei formulati commerciali in percentuale dal 20 al 25%. L’azione insetticida è rapida, per contatto (effetto Knock-down), in particolare sugli insetti in volo, e induce convulsioni e iperattività, risultato dell’azione neurotossica delle piretrine stesse, che bloccano i canali sodio della trasmissione degli impulsi negli assoni, come il DDT e le organoclorine sintetiche. Moderatamente tossiche per i
mammiferi, quando sono in purezza, e ancora meno nei formulati commerciali, le piretrine sono particolarmente fotolabili agli UV, cosa che ha limitato il loro uso all’aperto. Ciò ha dato impulso, soprattutto negli anni ’70 e ’80 dello scorso secolo, alla diffusione dei derivati sintetici, molto più stabili alla luce del sole, i piretroidi, un raro esempio di insetticida chimico di sintesi basato su un modello naturale. Per molti anni i maggiori produttori al mondo di piretro sono stati Kenia, Tanzania ed Equador, attualmente vi sono anche Australia e Cina.
1.2.2 NEEM
Dai semi dell’albero indiano neem, Azadirachta indica (Meliaceae), possono essere ottenuti due tipi di insetticidi botanici. L’olio di neem, ottenuto dalla spremitura a freddo dei semi, può essere efficace contro insetti a il corpo morbido, acari e fitopatogeni, grazie alla presenza di disulfidi. Un alto valore insetticida è posseduto dagli estratti medio-polari, che rimangono come residuo nei semi dopo l’allontanamento dell’olio, che contengono il complesso triterpenico azadiractina ed altri triterpenoidi, tra cui salannin, nimbin ed altri loro derivati, dal ruolo controverso. I semi di neem contengono da 0.2% a 0.6% in volume di azadiractina, per cui sono richiesti dei processi chimici per concentrarla ai livelli del 10%-50% nei formulati commerciali.
Azadiractina, a livello fisiologico, blocca la sintesi e il rilascio degli ormoni della muta (ecdisteroidi) dalle ghiandole protoraciche e determina una muta incompleta negli insetti immaturi. Nelle femmine adulte, un simile meccanismo d’azione provoca steriità. In più, azidiractina ha un effetto antifeedant verso molti insetti, scoperto dallo scienziato Heinrich Schmutterer, il quale osservò che, nel deserto del Sudan, le locuste defogliavano tutta la flora locale, eccetto gli alberi del neem.
Il clamore suscitato negli anni ’80 e ’90 e l’accoglienza in ambito scientico del neem si sono affievoliti a livello commerciale, a causa del relativamente alto costo di produzione e del basso effetto. Ciò non ha impedito che gli insetticidi a base di tale p.a. costituissero un terzo degli insetticidi botanici usati in agricoltura nel 2003. In effetti, l’efficacia è legata alla loro azione fisiologica come “insect growth regulators”. L’effetto antifeedant varia da specie a specie, anche quelle inizialmente più suscettibili spesso diventano resistenti all’azadiractina, che comunque è considerarta non tossica verso mammiferi, pesci ed impollinatori, ma, come le piretrine, è fotolabile.
1.2.3 ROTENONE
Il rotenone, un isoflavonoide, è usato come insetticida da più di 150 anni, ma il suo impiego come veleno per i pesci risale a molto tempo prima. Quello usato attualmente deriva, per lo più, dal Genere Lonchocarpus, coltivato in Venezuela ed in Peru, chiamato spesso “cub´e root”.
L’estrazione dalle radici con solventi organici produce resine che contengono più del 45% di rotenoidi totali; formati principalmente da rotenone (44%) e da deguelina (22%) (Isman M:B., 2006).
Si ottiene rotenone anche dal Genere Tephrosia. Le foglie fresche di T.
vogelii, essiccate in camera climatica a 26-28°C per 7 gioni, vengono macinate
e sottoposte ad estrazione con Soxhlet, utilizzando come solvente organico esano, acetone o etanolo (Koona P.,& Dorn S., 2005).
Un altro metodo di estrazione, sempre partendo da materiale essiccato e triturato, consiste nella macerazione con etanolo, separando il solvente con filtrazione e concentrazione sotto vuoto, ottenendo così l’estratto organico crudo (Cristobal alejo et al., 2006).
Il rotenone, comunemente venduto in polvere per usi domestici o per giardinaggio, contiene dall’1% al 5% di principi attivi, ma la formulazione liquida, già usata nell’ agricoltura biologica, può contenere più dell’8% di rotenone e il 15% di rotenoidi totali.
E’ un insetticida che agisce per ingestione, a livello mitocondriale blocca la catena di trasporto degli elettroni ed impedisce la produzione di energia. In purezza è paragonabile al DDT, in termini di tossicità acuta sui mammiferi, sebbene sia molto meno tossico nei formulati commerciali. La sicurezza del rotenone è stata messa in discussione da articoli che riportano casi di lesioni cerebrali, osservate su cavie, paragonabili al Parkinson dell’uomo, e residui sulle produzioni alimentari. Proprio in Italia, nell’olio ottenuto da olive trattate con rotenone, è stato osservato un effetto residuale sopra il limite di tolleranza (Isman M:B., 2006) e recentemente ne è stato proibito l’uso in agricoltura biologica.
1.2.4 OLI ESSENZIALI:
Le piante aromatiche hanno tessuti specializzati nella secrezione di metaboliti secondari in diverse parti: radici, rizomi, foglie, fiori. I prodotti hanno natura chimica diversa tra loro: cristalli di ossalato di calcio, resine, gomme, mucillagini, terpeni, tannini, latici, pigmenti, oli essenziali.
Questi ultimi sono composti naturali complessi, volatili, caratterizzati da un intenso odore, ottenuti da distillazione sotto corrente di vapore o idrodistillazione, compiuta per la prima volta nel Medioevo dagli Arabi, che ne conoscevano la fragranza, le proprietà antisettiche, battericide, virocide, fungicide, medicinali. Li usavano come antimicrobici per la conservazione dei cibi, come analgesici, sedativi, antinfiammatori e spasmolitici in medicina.
Ai giorni nostri il loro uso non è cambiato molto, ma conosciamo meglio alcuni dei loro meccanismi d’ azione, specialmente a livello antimicrobico.
In natura, gli oli essenziali giocano un importante ruolo nella protezione della pianta da batteri, virus, funghi, insetti ed anche erbivori, riducendone l’appetito; possono attrarre gli impollinatori ed avere azione repellente.
Sono estratti da varie piante aromatiche, Asteraceae, Lamiaceae,
Rutaceae, Liliaceae, Magnoliaceae, Cupressaceae, Pinaceae, generalmente
originarie di zone a clima temperato-caldo, come il bacino del Mediterraneo o la fascia tropicale, dove rappresentano una parte importante della farmacopea tradizionale.
In base ai gruppi funzionali, i costituenti di un’essenza possono essere raggruppati in diverse categorie: idrocarburi non ramificati, derivati del benzene, terpeni aciclici e ciclici, composti ossigenati (aldeidi, chetoni, alcoli, esteri ed acidi), solforati od azotati.
Sono liquidi, volatili, limpidi, raramente colorati, solubili nei grassi e nei solventi organici, con densità generalmente più bassa di quella dell’acqua. Possono essere estratti da tutti gli organi della pianta: gemme, fiori, foglie, steli, semi, frutti, radici. Sono immagazzinati nel legno o nel cribro, in cellule secretorie, in cavità, canali, cellule epidermiche o tricomi glandolari.
Ci sono diversi metodi di estrazione degli oli essenziali, tra cui anidride carbonica liquida o microonde, distillazione ad alta o bassa pressione, acqua bollente o in corrente di vapore, a seconda dell’uso che se ne vuole fare.
Grazie alle loro proprietà, possono rappresentare una valida alternativa ai prodotti chimici di sintesi per proteggere l’equilibrio ecologico, anche se le loro caratteristiche variano in qualità, quantità e composizione, a seconda delle condizioni climatiche, del terreno, dell’organo e dello stadio vegetativo della pianta da cui sono estratti. Molti di quelli in commercio sono stati caratterizzati a livello chimico attraverso gascromatografia e spettrometria di massa (Bakkali F.
et al., 2008).
Il problema dell’isolamento e della purificazione dei metaboliti secondari è stato risolto con l’impiego di tecniche cromatografiche (TLC, gel filtrazione, HPLC preparativa in fase diretta ed in fase inversa).
La caratterizzazione strutturale è effettuata mediante indagini spettroscopiche preliminari (UV, ESI-MS, ESI-MS-MS), seguite dall’analisi degli spettri NMR monodimensionali (1H e 13C), di correlazione bidimensionale omonucleare (COSY) ed eteronucleare (HSQC). Talvolta si ricorre a tecniche NMR più raffinate, come l’effetto Overhauser (NOESY), secondo le indicazioni della Farmacopea Europea.
L’analisi dei campioni viene condotta mediante GC e GC-MS, utilizzando una serie di standard.
I processi estrattivi degli oli essenziali sono molteplici e variano a seconda della natura, delle proprietà e del tessuto che contiene l’essenza. Il metodo estrattivo può influenzare notevolmente la composizione e il pregio stesso dell’olio. Le tecniche di preparazione delle essenze sono: spremitura, distillazione a pressione ridotta o in corrente di vapore, estrazione mediante grassi o solventi (“Enfleurage”), estrazione con fluidi supercritici (Grassia A., 2005).
Sono state pubblicate monografie analitiche (ISO) per assicurare una buona qualità degli oli essenziali, in funzione del loro impiego. Attualmente se
ne conoscono circa 3000, 300 dei quali sono importanti dal punto di vista commerciale, specialmente nell’industria farmaceutica, alimentare, sanitaria, cosmetica, dei profumi e dei prodotti usati in agricoltura.
Per esempio, d-limonene, geranil acetato o d-carione sono impiegati nei profumi, nelle creme, nei saponi, come additivi per conferire sapore al cibo, come fragranza nei prodotti di pulizia della casa e nell’industria dei solventi. Sono usati anche per massaggi, in aromoterapIa, senza contare, le già citate proprietà medicinali.
Abbiamo detto che gli oli essenziali sono una miscela naturale molto complessa, che può contenere circa 20-60 varietà di composti volatili a diversa concentrazione, quelli a concentrazione maggiore determinano le caratteristiche biologiche di un olio. Due sono i gruppi di origine biosintetica diversa presenti: il principale è rappresentato da terpeni e terpenoidi, l’altro da composti alifatici ed aromatici a basso peso molecolare.
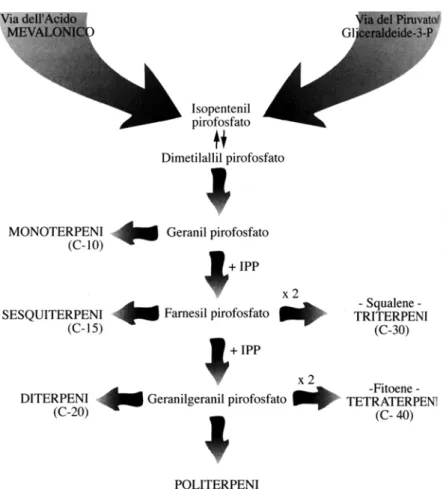
I terpeni, comprendenti classi diverse per struttura e funzione, sono formati dall’unione di diversi gruppi a 5 atomi di carbonio chiamati isoprene, secondo lo sche sotto riportato (figura 1).
Figura 1. Schema di sintesi dei terpeni
I principali sono monoterpeni (C10) e sesquiterpeni (C15), ma vi sono anche emiterpeni (C5), diterpeni (C20), triterpeni (C30) e tetraterpeni (C40), con una grande varietà di struttura.
nella addizione ripetuta di molecole di IPP a formare il prenyldifosfato, precursore delle varie classi di terpeni, il cui scheletro conferisce loro le proprietà funzionali.
I monoterpeni sono formati dall’unione di due unità isopreniche e rappresentano il 90% degli oli essenziali, con grande varietà di struttura e di funzione.
Vi sono carburi aciclici (myrcene, ocimene etc.), c. monociclici (terpinene, p-cimene, phellandrene, etc), c. diciclici (pinene, carene, camphene, sabinene, etc); alcoli aciclici (geraniolo, linalolo, citronellolo, lavandulolo, nerolo, etc), a. monociclici (mentolo, a-terpineolo, carveolo), a. diciclici (borneolo, fencholo, chrysanthenolo, thuyan-3-olo, etc); aldeidi acicliche (geraniale, nerale, citronellale, etc); cheetoni aciclici (tegetone, etc), c. monociclici (mentone, carvone, pulegone, piperitone, etc), c. diciclici (canfora, fencone, thuyone, ombellulone, pinocamphone, pinocarvone, etc); esteri aciclici (linalil acetato o propionato, citronellil acetato, etc), c. monociclici (a-terpinyl acetato, etc), c. diciclici (isobornyl acetato, etc); eteri (1,8-cineolo, menthofurano, etc); perossidi (ascaridolo, etc); fenoli (thimolo, carvacrolo, etc).
Quando la molecola è otticamente attiva, i due enantiomeri sono spesso presenti in piante diverse (Bakkali F. et al., 2008).
Cineolo, monoterpene comune negli oli essenziali di origine vegetale, è usato come espettorante e nei preparati cosmetici. Gli oli della scorza di Citrus
spp sono usati nei prodotti da forno; carvone, un importante costituente dell’olio
essenziale di C. carvi, Mentha spicata e Anethum graveolens, è usato come aroma nei dentifrici e nei medicinali (Rajendran S.et al., 2008).
I diterpeni derivano dalla condensazione di quattro unità isopreniche; in natura quelli a catena aperta, come il precursore, geranilgeranil difosfato (GGPP) e il suo isomero geranil linalolo, sono pochi e la maggior parte ha una struttura ciclica. Fitolo, uno dei diterpeni più semplici ed importanti, è una forma ridotta di geranilgeraniolo, che forma la catena laterale delle clorofille e delle vitamine E e K. Le reazioni di ciclizzazione del GGPP, attraverso un meccanismo di tipo carbocationico, in aggiunta alle possibili trasposizioni di Wagner-Merweein, consentono di formare un’ampia varietà strutturale di diterpenoidi.
Due gruppi di diterpeni sono caratterizzati dalla presenza di una funzione carbossilica: gli acidi resinici e le gibberelline. Gli acidi resinici sono contenuti negli essudati delle conifere e svolgono un ruolo protettivo contro gli attacchi degli insetti; le gibberelline sono un gruppo di fitoregolatori, presenti soprattutto nei semi, che stimolano la crescita delle piante superiori (Grassia, 2005) .
I sesquiterpeni sono formati dall’unione di tre frammenti isoprenici (C15). L’estensione della lunghezza della catena aumenta il numerio di anelli ciclici con una grande variabilità di struttura e funzioni, simili a quelle dei monoterpeni.
Vi sono carburi (azulene, b-bisabolene, cadinene, b-cariofillene, logifolene, curcumene, elemene, farnesene, zingiberene, etc); alcoli (bisabolo, cedrolo, b-nerolidolo, farnesolo, carotolo, b-santalolo, patchoulolo, viridiflorolo, etc);
chetoni (germacrone, nootkatone, cis-longipinan-2,7-dione, b-vetinone, turmerones, etc); epossidi (ossido di cariofillene, epossido di umulene, etc).
I composii aromatici derivano dal fenilpropano, ma sono meno frequenti dei terpeni. Le vie di biosintesi dei terpeni e dei derivati del fenilpropano nelle piante sono in genere separate, ma in alcune possono coesistere
I composti aromatici comprendono: aldeidi (cinnamaldeide), alcooli (alcool cinnamico), fenoli (cavicolo, eugenolo), derivati metossilici (anetolo, elemicina, estragolo, metileugenolo), composti metilen-diossido (apiolo, miristicina, safrolo).
Gli oli essenziali hanno dimostrato jn vitro azione citotossica sulla membrana cellulare e sulla sua permeabilità, coagulando il citoplasma e danneggiando lipidi e proteine nei batteri. Nelle cellule eucariote, possono depolarizzare la membrana mitocondriale e cambiare il potenziale redox, in funzione del tipo di organismo attaccato, del tipo di olio essenziale e della sua concentrazione. E’ stata osservata una tossicità a livello del DNA, in alcuni casi favorita dalla luce, ed effetti mutageni o antimutageni, con sinergia fra i vari componenti degli oli essenziali stessi. Secondo studi recenti, essi si comporterebbero anche come proossidanti sulle membrane cellulari e sugli organelli, spiegando così il loro effetto talvolta benefico (Bakkali F. et al., 2008). Sono stati usati con successo oli essenziali estratti da Schizonepeta tenuifolia per il controllo di Lepidotteri fitofagi (Park I.K. et al., 2006).
1.2.5 NICOTINA
Come piretro e rotenone, la nicotina, alcaloide ad attività insetticida ottenuto dalle foglie di Nicotiana tabacum e delle relative specie, ha una lunga storia.
Nicotina e due alcaloidi a catena chiusa ad essa correlati, normicotina e anabasina, sono veleni sinaptici, che mimano il neurotrasmettitore acetilcolina, causando sintomi di avvelenamento simili a quelli degli organofosfati e dei carbammati. Per l’ estrema tossicità della nicotina pura sui mammiferi (LD50 50mg Kg-1) ed il rapido assorbimento a livello epidermico nell’uomo, il suo
impiego, soprattutto come fumigante nelle serre contro insetti a corpo morbido, è andato via via declinando, fino alla sua recente proibizione nell’UE.
1.2.6 RYANIA
Altro insetticida il cui uso è in declino, ryania è ottenuto dalla macinazione del legno dell’arbusto caraibico Ryania speciosa (Flacourtiaceae). Il legno polverizzato contiene <1% di ryanodina, un alcaloide che interferisce con il rilascio del calcio nel tessuto muscolare, agendo per ingestione e contatto. Usato limitatamente nel controllo di Cydia pomonella sul melo in coltura biologica, risulta poco o per niente dannoso nei confronti degli insetti e degli acari utili.
1.2.7 SABADILLA
Sabadilla è un insetticida botanico ottenuto dai semi del giglio sud americano Schoenocaulon officinale. In purezza, i p.a., alcaloidi cevadina-simili, sono estremamente tossici per I mammiferi, ma I preparati commerciali ne contengono meno dell’1%, garantendo un margine di sicurezza. Agiscono come le piretrine, nonostante la struttura chimica sia diversa. In California, sabadilla è usato nel biologico sulle colture di limone e avocado (Isman M.B.,2006).
1.3. NUOVI POTENZIALI INSETTICIDI BOTANICI
Al declinare dell’epoca degli insetticidi sintetici, a causa dello sviluppo di popolazioni di insetti resistenti ai trattamenti e per il loro impatto negativo sull’ambiente, è comparsa una terza generazione di composti: i regolatori della crescita degli insetti (IGRs=insect growth regulators). Pur rivelando spesso alta selettività e bassa tossicità nei confronti dei mammiferi e dell’uomo, nonostante alcuni prodotti riusciti, non hanno ancora potuto prendere il posto degli insetticidi sintetici tradizionali.
Per eliminare l'uso di prodotti chimici sulle più importanti colture, è stata posta attenzione anche all'ingegneria genetica, ma questa via sembra ancora improbabile.
Finchè gli insetti rimarranno i nostri principali concorrenti per il cibo, giocando un ruolo sempre crescente nella trasmissione di malattie tropicali, non diminuerà lo sforzo per cercare nuovi agenti insetticidi, con modalità di azione e bersagli nuovi.
Alla luce di questo presupposto, è auspicabile la definitiva riscoperta degli insetticidi di origine vegetale. La ricerca è indirizzata verso la selezione di piante medicinali ed ornamentali che possano avere anche proprietà insetticide. Inoltre, secondo quanto asserito dalla “modellìstica molecolare evolutiva”, gli allelochimici prodotti dalle piante, che mediano la comunicazione tra specie e Regni diversi, possono colpire più di un bersaglio, come una strategia per contrattaccare gli adattamenti degli ospiti fitofagi specifici e combattere diversi gruppi di nemici (Alexenizer M. et al., 2007).
Negli anni 80 dello scorso secolo sono state approfondite le ricerche su
Melia azedarach (chinaberry tree), nei cui semi è contenuta acetogenina, con
riconosciute proprietà insetticide.
Negli anni 90 è stato scoperto l’effetto larvicida degli esteri naturali di zuccheri estratti dalle foglie di tabacco selvatico. Si sono cercati principi attivi nelle varie specie del Genere Melia, nei cui semi sono stati isolati triterpenoidi, che purtroppo hanno dimostrato efficacia d’azione bassa e non immediata, mancanza di azione residuale, senza contare gli alti costi di commercializzazione (Isman M. B., 2006).
Da molti anni sono in corso studi promettenti sugli effetti tossici degli estratti da piante di origine tropicale e subtropicale, ricche di alcaloidi, flavonoidi e
proteine, per il controllo dei Coleotteri che infestano i semi conservati, anche se non sono del tutto conosciuti gli effetti sui loro nemici naturali e sulla salute dell’uomo (Boeke S.J. et al, 2004).
1.3.1 ALCALOIDI NELLE PIANTE
Gli alcaloidi sono composti terpenici azotati di origine naturale, molto eterogenei per struttura chimica e attività biologica. Hanno nella loro molecola uno o più atomi di azoto, che li distingue dagli altri metaboliti secondari e ne caratterizzano il comportamento. Ne esiste una grande varietà per origine, biochimismo, struttura, proprietà chimiche e biologiche. Negli alcaloidi eterociclici, l’azoto è presente in una struttura eterociclica, i composti in cui l’azoto non è eterociclico sono chiamati proto alcaloidi.
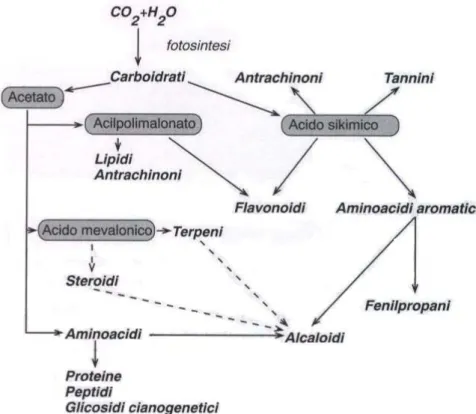
Come vediamo dallo schema sotto riportato (figura 2), che mostra la biosintesi dei principali metaboliti secondari della pianta, gli alcaloidi derivano dagli aminoacidi e incorporano l’azoto in uno scheletro formato da diverse reazioni biochimiche del metabolismo secondario delle piante, mostrando una pronunciata attività farmacologica o tossicologica, per cui sono usati come tali o per l’emisintesi di nuovi farmaci.
Figura 2. Schema di biosintesi dei principali metaboliti secondari
Sono presenti nei funghi, come Claviceps purpurea, nelle Pteridofite, equiseti e licopodi, nelle Gimnosperme come Tasso ed Ephreda, nelle Monocotiledoni, come le Famiglie delle Liliaceae e delle Amarylliaceae. Nelle Dicotiledoni sono presenti in molte Famiglie: Apocinaceae, Berberidaceae,
Euphorbiaceae, Fabaceae, Loganaceae, Papaveraceae, Ranunculaceae,
Rubiaceae, Rutaceae, Solanaceae e probabilmente in altre che non sono state
ancora studiate.
Utilizzati nella medicina popolare da secoli per le loro proprietà, basti pensare ad oppio, aconito, coca, belladonna, colchico, china e curaro, sono stati isolati per la prima volta nel 1800. I primi furono nicotina e morfina dall’oppio, coniina fu il primo alcaloidedi cui venne stabilita la struttura chimica.
Nelle piante si trovano nelle radici, come aconito e belladonna, nella corteccia, come china, nelle foglie, come coca, stramonio e tabacco, nei canali laticiferi, nelle capsule del papavero da oppio, nei semi, come cacao, cola, caffè, colchico e stricnina.
Poiché possono essere tossici anche per le cellule della pianta stessa e interferire con il metabolismo cellulare, gli alcaloidi sono accumulati all’interno di compartimenti appositi, come il vacuolo, che può essere considerato un organello di disintossicazione.
La loro sintesi avviene a livello delle endomembrane, poi vengono trasportati e depositati nel vacuolo stesso, dove si pensa che avvenga la loro immobilizzazione, attraverso la formazione di complessi chimici con altri composti. Non sembra sia necessario un meccanismo specifico di trasporto per il passaggio attraverso la membrana del vacuolo. Il tonoplasto infatti mantiene il gradiente di pH tra citosol e contenuto vacuolare, trattenere così gli alcaloidi al suo interno.
Dalla sede di sintesi, possono avere un trasporto attivo in altri organi della pianta, attraverso i vasi floematici o xilematici, come la nicotina, sintetizzata nelle radici e nel fusto e accumulata nelle foglie attraverso i vasi.
La funzione biologica degli alcaloidi nella pianta è stata molto discussa, senza che ci sia ancora un’ipotesi convincente. Pur non avendo un ruolo vitale, fanno parte di sequenze metaboliche specifiche e non devono essere considerati prodotti di rifiuto.
Il fatto che si trovino in organi caduchi, come le foglie e i frutti, e che siano presenti negli organi secretori, come i canali laticiferi del Papavero, dimostrerebbe che derivino dalla degradazione cellulare. Sembra accertato che siano fagodeterrenti e tossici verso gli erbivori e gli insetti, agendo anche contro i microorganismi. Alcuni sostengono che la pianta li produca quando si deve disintossicare da composti velenosi, nel corso del normale metabolismo. Altri ipotizzano che l’azoto presente negli alcaloidi abbia una funzione di riserva nutritiva e che essi abbiano una funzione simile ai fitoregolatori della crescita, concentrandosi nelle parti della pianta a forte attività cellulare. Viene sostenuta anche l’ipotesi che la loro presenza sia casuale, determinata da precursori enzimatici.
In alcuni casi, come nel Genere Aconitum, è stato visto che gli alcaloidi sono molecole scarsamente stabili, sia in acqua che in soluzione metanolica. La reazione di idrolisi, secondo alcuni spontanea nella pianta, darebbe origine a prodotti meno tossici e meno attivi di quelli di partenza.
Altri studi hanno individuato tossine associate alle piante, assunte dagli animali con l’alimentazione e trasmesse all’uomo attraverso latte, carne, uova, miele oppure direttamente da preparazioni di origine vegetale o da frumento contaminato. Tra esse vi sono alcaloidi, pirrolizidine, che provocano intossicazione al fegato, con effetti tossici in parte ancora sconosciuti. Sono stati identificati più di 350 alcaloidi da oltre 6000 piante in Europa, Asia, Africa ed Australia e sembra che certe molecole possano avere effetti cancerogeni e mutageni (Than K.A. et al., 2005).
1.3.2 FLAVONOIDI: FUNZIONE ED ATTIVITA’
Flavonoide è il nome generico dei composti che hanno uno scheletro a 15 atomi di carbonio, che consiste di due anelli fenilici (anelli A e B) collegati da un ponte di tre atomi di carbonio (anello C), sintetizzati in genere dalle piante vascolari e dalle briofite.
Se ne conoscono circa 5000, divisi in classi, per esempio antocianine, flavoni, flavonoli, flavanoni, diidroflavonoli, calconi, auroni, flavani e proantocianidine, isoflavoni, e sottoclassi, classificate secondo lo schema di sostituzione dell'anello C. Lo stato di ossidazione dell'anello eterociclico e la posizionedell'anello B sono importanti elementi di classificazione.
In molte piante sono presenti bioflavonoidi in cui gruppi idrossilici, metossilici, metilici si aggiungon o si sostituiscono al gruppo glicosidico.
Alcuni sembrano avere capacità antifeedant, possono inibire la germinazione dei semi, lo sviluppo delle radici delle stesse piante che li sintetizzano ed agire come inibitori dello sviluppo di alcuni funghi.
Le antocianine, conosciute per la loro funzione di attrarre gli impollinatori, sono usate in medicina per le loro proprietà antiossidanti e antitumorali. In molte piante alcuni flavonoidi glicosidi rappresentano uno schermo agli UV e molti Autori hanno messo in evidenza la capacità di flavoni e flavonoli di stimolare l’ovoposizione e di avere azione attrattiva e deterrente verso alcuni insetti.
Alcune piante utilizzano molti flavonoidi come deterrente contro insetti, funghi ed afidi nocivi, insieme a terpenoidi e ad alcaloidi. Alcune classi con tale proprietà sono, ad esempio, flavonoli, flavoni, proantocianidine, flavani ed isoflavonoidi, isolati nelle leguminose ed in alcune graminacee, nel cotone, nel pomodoro, in alcune fagacee e passifloracee.
Molti flavonoidi, isolati nelle radici, nei semi e nell’ipocotile di piante resistenti agli attacchi di alcune malattie fungine, sono ritenuti da alcunii Autori fitoalessine, come del resto lo sono alcaloidi, terpenoidi e cumarine. (Iwashina T., 2003).
Flavonoidi sono i pigmenti che si ritrovano nei fiori, a cui conferiscono i più vivaci colori, nei frutti e nelle foglie di numerose specie vegetali, dal giallo dei calconi e dei flavonoli, al rosso, blu e violetto delle antocianidine.
Si tratta di composti di tipo fenolico, che possiedono come stuttura base, definita aglicone, un benzo-pirano, i cui due anelli di benzene sono legati
tramite un etero ciclo, chiuso da ossigeno, che può derivare dal pirano, dal pirilio, dal pirone ed è diverso nei vari tipi di flavonoidi.
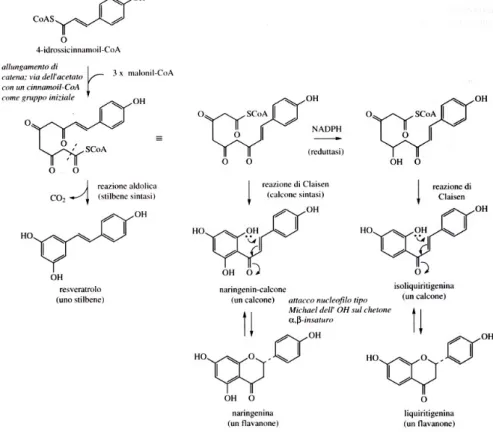
La ciclizzazione avviene tra il terzo carbonio della catena e il gruppo ossidrilico dell’anello A, in posizione orto rispetto alla catena, portando alla formazione di cromano, cromeno e cromone. Nella maggior parte dei casi, l’anello A dei flavonoidi è meta diidrossilato o triidrossilato, mentre l’anello B può essere monoidrossilato, orto diidrossilato o ancora triidrossilato. Queste differenze sono dovute al fatto che l’anello A si origina dalla via biosintetica dell’acetato, mentre l’anello B deriva dalla via shikimica. I flavonoidi, infatti hanno una via biogenetica mista. Gli acidi cinnamici e i loro esteri con il coenzima A (via dell’acetato) fungono da unità iniziatrici per l’allungamento di catena con un’unità di malonil CoA (via dello shikimato). Gli enzimi stilbene sintetasi e calcone sintetasi accoppiano un’unità di cinnamoil CoA con tre unità di malonil CoA per dare rispettivamente stilbeni e calconi (figura 3).
Figura 3. Via biosintetica dei flavonoidi
I calconi fungono da precursori di un’ampia gamma di flavonoidi, che si possono distinguere in flavoni (apigenina, luteolina); isoflavoni (daidzeina, genisteina); flavonoli (kampferolo, quercetina); flavononi (naringenina); auroni (ispidolo); antocianidine (pelargonidina, cianidina).
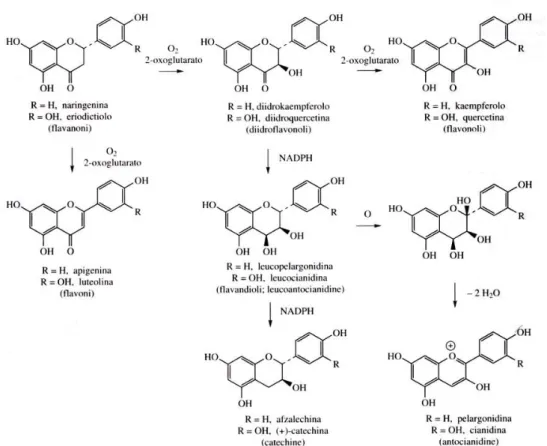
I flavonoidi, il cui schema di sintesi delle principali classi è rappresentato nella figura 4, possono subire diversi tipi di reazione, come addizione, eliminazione, metilazione del gruppo flavonoidico o dei gruppi ossidrilici, dimerizzazione che porta alla formazione di un bi flavonoide. Quella più importante è sicuramente la glicosilazione sui gruppi ossidrilici, formando
flavonoidi O-glicosilati o sul gruppo flavonoidico, formando flavonoidi C-glicosilati. Attualmente, si conoscono alcune centinaia di flavonoidi, che si differenziano per la porzione zuccherina, comunemente rappresentata da glucosio, galattosio, ramnosio e xilosio, legati attraverso legami O-glicosidici .
Figura 4. Schema di sintesi delle principali classi di flavonoidi
Negli organismi animali, i flavonoidi fungono da trasportatori di idrogeno, infatti una volta che si sono ossidati ad O-chinoni, fissano l’idrogeno, ritornando al loro stato ridotto.
I flavonoidi mostrano un ampio spettro di attività biologica, sono contenuti in numerosi cibi e bevande e sono assunti normalmente nella dieta. Ad esempio, i flavonoidi del vino rosso (quercetina, kaempferolo e antocianidine) e del tè (catechine) mostrano un’efficace azione nei confronti dei radicali liberi; grazie alla loro natura polifenolica, che permette loro di catturare radicali superossido ed ossidrile, altamente tossici.
Il flavonone esperidina (dalla buccia di Citrus spp), il flavonol glucoside rutina dal grano saraceno (Fagopyrum esculentum; Polygonaceae) e la quercetina aumentano la resistenza dei capillari e regolano la loro permeabilità. Essenziali nella protezione dall’ossidazione della vitamina C, proteggono dalle emorragie e dalle rotture dei capillari. I flavonoidi mostrano attività antivirale: soprattutto sul virus della poliomielite, dell’epatite A e B, dell’influenza e dell’HIV.
La presenza di gruppi ossidrilici liberi in posizione 5 e 7 o la glicosilazione in posizione 4’ sono responsabili dell’attività inibitoria dei flavonoidi sulla xantina
ossidasi, attività importante per la cura di malattie dovute all’accumulo dell’acido urico come la gotta, e l’ischemia miocardica.
I flavonoidi inoltre hanno la capacità di inibire l’enzima responsabile della formazione di angiotensina, che esercita azione vasocostrittrice e sodio ritensiva.
Questi composti sono in grado di ritardare lo sviluppo della cataratta in individui che presentano alterazioni congenite del metabolismo degli zuccheri, come accade nei diabetici (Grassia A., 2005).
1.3.3 PROTEINE
Quando sono attaccate da microrganismi nocivi, le piante possono innescare una serie di potenti meccanismi di difesa, uno dei quali è la sintesi di proteine, peptidi e composti a basso peso molecolare e ad effetto antimicrobico. Molto diffusi in natura, sono sintetizzati non solo dalle piante, ma anche da batteri, funghi, insetti e mammiferi.
La lista di proteine e peptidi antimicrobici nei vari organismi è lunga, con nuove continue scoperte: nei semi di Zea mais L:, di ravanello, di Raphanus
sativus L., in Amaranthus caudatus, nella cipolla ed in diverse altre piante.
Si pensa che essi giochino un ruolo di difesa dai patogeni, per la loro capacità a conferire tale resistenza alle piante transgeniche, che contengono nel loro patrimonio geni che li codificano.
Alcune proteine di origine vegetale hanno proprietà insetticide e possono, per esempio, proteggere i semi dall’attacco delle larve di Helicoverpa
punctigera (Wallengren). I semi usano strategie per germinare e sopravvivere
nei suoli che sono densamente abitati da un’ampia gamma di microfauna e di microflora. Quelli delle mono e dicotiledoni contengono varie proteine, con funzione di deposito di sostanze nutritive per la germinazione e la crescita e con attività antibatteriche ed antifungine, come chitinasi, b-glucanasi, tionine, proteine che inattivano i ribosomi.
In prove di laboratorio sui semi di Clitoria ternatea è stata purificata una proteina, denominata Finotin, che sembra inibire lo sviluppo di diversi funghi patogeni della pianta, batteri ed insetti che attaccano il fagiolo comune.
Queste scoperte giustificherebbero la resistenza a molte fitopatie che C.
ternatea mostra di avere in pieno campo. Finotin viene rilasciata dal seme
quando il suo tegumento è meccanicamente danneggiato, creando una zona di inibizione allo sviluppo del patogeno fungino in vitro, indipendentemente dalla temperatura, con meccanismo d'azione ancora da chiarire.
Particolare interesse hanno suscitato, per le loro proprietà antimicrobiche ed insetticide, le proteine di origine vegetale chiamate ciclotidi. Sono proteine circolari, nelle quali il carbonio del gruppo carbossilico e l’azoto del gruppo aminico terminali si legano tramite un ponte peptidico. Nel tubero della pianta originaria delle Ande cilene Oxalis tuberosa, è stata isolata una proteina simile, denominata ocatin, ad attività biocida (Kelemu S. et al., 2004).
L'albumina Pea 1b (PA1b) è un peptide solforato ricco di cisteina, estratto dai semi di pisello, chiamata anche leginsulin per i caratteristici legami eterologhi, simili ad un altro peptide isolato nei semi di soia. Sembrava che l'unica sua funzione sia quella di accumulo di zolfo, ma recentemente sono state scoperte proprietà insetticide. E' stata isolata negli estratti di semi di numerose Papilionoideae, ma non nelle Caesalpinioideae e nelle Mimosoideae, sebbene anch’esse manifestino una certa attività biologica simile.
A1b, individuata in Medicago truncatula, consiste di 37 aminocidi con tre ponti disolfuro, che le conferiscono alta stabilità contro l'inattivazione termica ed enzimatica ed alta affinità con le proteine della membrana.
La pratica di mescolare ai cereali immagazzinati semi di diversi legumi ha messo iin evidenza un’alta mortalità di Sitophilus spp, dovuta proprio a PA1b contenuta nel pisello, che non provoca alcuna tossicità agli esseri umani e al bestiame. Comunque, in S. oryzae è stato trovato un gene recessivo responsabile della resistenza a questo peptide (Louis S. et al., 2007).
1.4. PROBLEMI PRATICI DI COMMERCIALIZZAZIONE
Gli insetticidi botanici sembrano giocare un ruolo importante nell’agricoltura biologica dei Paesi industrializzati, nella produzione e nella conservazione post raccolta delle derrate alimentari nei Paesi in via di sviluppo.
Piretro e neem hanno una solida base commerciale, gli oli essenziali sono entrati recentemente sul mercato, l’uso del rotenone, già in diminuzione, è stato recentemente vietato nell’ UE.
Diversi fattori però sembrano limitare il successo degli insetticidi di origine vegetale, soprattutto nell’agricoltura convenzionale, per la concorrenza di prodotti più competitivi, come i nuovi principi attivi di sintesi, i prodotti della fermentazione e quelli microbici, che hanno un costo più basso che in passato.
Esistono attualmente barriere alla commercializzazione, dovute innanzitutto al problema della sostenibilità delle risorse botaniche. Per produrre insetticidi di origine botanica su scala commerciale, la fonte di biomassa vegetale deve provenire da coltivazioni su larga scala, preferibilmente non su base stagionale.
A parte quelle abbondanti in natura o già coltivate per altri scopi, alimentari od officinali, le specie devono essere di facile coltivazione, come lo sono piretro e neem in Africa, Australia e America Latina. In un futuro non molto distante, sarebbe auspicabile produrre insetticidi botanici da “Phytofarming”, basate sulla coltivazione in pieno campo di materiale vegetale di alta qualità, selezionato da diverse fonti botaniche.
Legata alla problematica agronomica vi è quella economica. Per esempio, l’uso in agricoltura del neem, già diffuso in India per la produzione di saponi e di oli industriali, ha fatto aumentare il prezzo dei semi di 10 volte. Al contrario, certi oli essenziali, già usati in profumeria e nell’industria conserviera in quantità massicce, mantengono un basso costo, che li rende interessanti anche come insetticidi.
Purtroppo, manca ancora una standardizzazione delle caratteristiche di un particolare prodotto, anche se preparato con lo stesso processo. Come esiste una variabilità delle caratteristiche organolettiche nel vino, nel caffè, nel tè o nella cioccolata, è stato provato che la zona geografica o l’andamento climatico, variabile da un anno all’altro, condizioni la capacità insetticida dei semi di A.
squamosa raccolta in Indonesia (Isman M.B., 2006).
Studi condotti su Hyptis spp hanno evidenziato che la composizione dell’olio essenziale varia molto in funzione della specie, del chemiotipo, delle condizioni climatiche, delle caratteristiche del terreno e delle pratiche agronomiche adottate (Tchoumbougnang F. et al.,2005). Studi su Hyptis
suaveolens in Brasile hanno confermato l’influenza di macronutrienti, età della
pianta, fotoperiodo sulla composizione dell’olio essenziale estratto da questa specie (Martin T.F. et al., 2007).
Perché un insetticida botanico sia realmente efficace, ci deve essere un certo grado di standardizzazione chimica, presumibilmente basata sui proncipi attivi presenti. Ciò è stato certamente raggiunto per piretro, neem e rotenone, ma i preparati crudi spesso contengono basse concentrazioni di principi attivi e se ne producono quantità insufficienti.
Per standardizzare le procedure di estrazione dei complessi chimici, occorrono validi metodi di analisi ed è necessario mescolare estratti di diversa origine. Tutto ciò richiede facilità di approvvigionamento del materiale vegetale e relativa stabilità dei principi attivi in esso contenuti, legata anche alla modalità di conservazione (Isman M.B, 2006).
In accordo con le linee guida dettate negli USA dal Food and Drug Administration (USFDA) e dall’Agenzia Europea per la valutazione dei prodotti medicinali, devono essere fissati i vari aspetti delle analisi, allo scopo di controllare la qualità dei preparati di origine vegetale, con un approccio olistico, che combini metodi estrattivi e tecniche di analisi con le attrezzature per la separazione.
L’intero processo analitico può andare sprecato se si impiega un modello di preparazione inadeguato, prima che i preparati botanici arrivino alla cromatografia. Ci sono diversi approcci per la preparazione dei campioni e per il saggio della bioattività, o per il marcatore dei composti negli estratti botanici.
Nella farmacopea, sono comunemente usati metodi di estrazione quali ultrasuoni, riscaldamento sotto riflusso (con refrigerante verticale), Soxhlet (per separare l’estratto etereo) ed altri metodi che portano via molto tempo e richiedono una grande quantità di solventi organici, oltre ad esserre poco efficienti e costosi.
Nel documento guida, USFDA richiede, oltre che i test di controllo qualità, anche una descrizione dei processi di produzione delle sostanze farmacologiche di origine botanica. La qualità dei prodotti botanici può essere influenzata dal tipo e dalla concentrazione del solvente usato per l’estrazione e dal tipo di processo di produzione, che può comprendere l’estrazione su fase solida (macerazione) o esaustiva (percolazione). Poiché da qui in avanti il
metodo di estrazione di composti bioattivi o marker giocherà un ruolo importante nel controllo dei prodotti botanici, è auspicabile che sia semplice, rapido e riproducibile, con un’alta efficienza di estrazione e non richieda l’uso eccessivo di solventi organici.
Allo scopo sono stati introdotti metodi nuovi di preparazione del campione, come l’ estrazione con solventi accompagnata dal riscaldamento con microonde (MAE: microwave assisted extraction), sistemi di estrazione in fase supercritica (SFE: supercritical fluid extraction), la tecnica di estrazione con solventi accelerata da temperatura e pressione elevate (ASE: accelerated solvent extraction), l’estrazione in fase liquida sotto pressione (PLE: pressurized liquid extraction) o l’estrazione sotto pressione con acqua calda (PHWE: pressurized hot water extraction).
L’acqua è un solvente non infiammabile, non tossico, disponibile e senza effetti negativi sull’ambiente, ma non è molto usata perché troppo polare per solubilizzare efficacemente sostanze organiche botaniche. E’ stato però dimostrato che l’aumento della temperatura, con sufficiente pressione per mantenere lo stato liquido, permette un’estrazione quantitativamente più efficiente di un’ampia varietà di soluti organici provenienti da differenti matrici. La capacità dell’acqua di estrarre sostanze organiche non polari, come gli idrocarburi aromatici policiclici (PAH) e i bifenili policlorinati (PCB), è collegata al fatto che la sua costante dielettrica (polarità) può essere ridotta in modo significativo aumentando la temperatura, anche se i composti bioattivi o marcatori presenti nelle sostanze di origine vegetale potrebbero degradare.
La strumentazione richiesta è relativamente semplice, evita il ricorso alle elevate pressioni dell’SFE ed è applicabile con basse percentuali di solventi organici, come etanolo. Le analisi finali vengono condotte in elettrocromatografia con una soluzione tampone, usata per la separazione di composti bioattivi termolabili o marker presenti nel materiale vegetale, o con microbore HPLC (Ong E.S. et al., 2006).
Oltre alla standardizzazione, una regolamentazione univoca per la loro approvazione rimane la più grande barriera alla commercializzazione di insetticidi botanici. Spesso vengono considerati come se fossero chimici di sintesi ed il loro mercato nei Paesi industrializzati, basato principalmente sul loro uso in serra e nell’agricoltura biologica, è troppo limitato per essere remunerativo e per controbilanciare gli altissimi costi di approvazione. Questo purtroppo può impedire che molti di essi raggiungano i mercati in cui la domanda è più alta.
Alcuni oli essenziali insetticidi non hanno obbligo di registrazione in Usa, ma non in altri Stati, perché ritenuti innocui, in quanto usati da lungo tempo nella conservazione degli alimenti e nella fabbricazione di aromi e di spezie. Molti Paesi stanno seguendo l’esempio degli Stati Uniti, come in Asia, dove si sta tentando di proibire alcuni tipi di insetticidi, rintracciabili nei cibi e ritenuti nocivi alla salute pubblica e degli operatori agricoli.
1.4.1 TENDENZE ATTUALI NELL’USO DI INSETTICIDI BOTANICI
Nord America
Attualmente, gli USA autorizzano la più larga gamma di insetticidi botanici fra i Paesi industrializzati. Sono stati registrati piretro, neem, rotenone, diversi oli essenziali, sabadilla, ryania e nicotina; diversi insetticidi a base di azadirachtina (neem) e numerosi oli essenziali sono del tutto esenti dalla registrazione.
Il Canada, invece, autorizza l’uso di piretro, rotenone, e nicotina, ma solo un esiguo numero di oli essenziali. Neem deve sempre ricevere la registrazione completa, con il disappunto di molti operatori agricoli nel biologico.
Il Messico permette l’uso di molti prodotti venduti negli USA, sebbene non ci siano specifiche esenzioni per gli oli.
Europa
Sebbene la normativa europea sia considerata da molti addetti all’industria agrochimica particolarmente restrittiva nei confronti della registrazione dei prodotti fitosanitari, l’Unione Europea permette l’uso di piretro, neem, rotenone, insieme ai “componenti degli oli eterei di origine vegetale”.
I singoli Paesi dell’Europa hanno legislazioni in materia molto varie. Per esempio, l’Ungheria permette piretro e nicotina, la Danimarca soltanto piretro e rotenone, la Germania piretro e neem, la Norvegia solo piretro. Dopo anni di ricerca su azadirachtina e neem, nel Regno Unito non ne è stata ancora approvata la registrazione, lasciando piretro e rotenone come unici insetticidi botanici ammessi.
Asia
L’India sembra la più interessata agli insetticidi di origine vegetale, ammettendo tutti i prodotti citati, ad eccezione di sabadilla, e permettendo la registrazione provvisoria di nuovi, in attesa dei risultati delle prove tossicologiche ed ambientali per la registrazione definitiva.
La Nuova Zelanda ha registrato piretro, rotenone e neem, mentre l’ Australia, dopo almeno due decadi di ricerca, deve ancora approvare neem. Analogamente, l’uso del neem deve essere approvato nelle Filippine, dove il piretro è il solo ammesso.
America Latina
Ogni Stato ha regolamenti autonomi. In genere sono ammessi piretro, rotenone, neem e garlic. Sebbene nicotina ed estratti di piante native non siano molto usati, in tutta l’America Latina gli oli e gli estratti vegetali sono prodotti da attività industriali che si basano sul lavoro a domicilio su piccola scala e sono usati fuori da ogni regolamentazione, su base regionale.
Africa
In molti Stati i dati sulla regolamentazione degli insetticidi non sono facilmente disponibili. Riguardo a quelli di origine vegetale, solo il piretro è approvato in Sud Africa. Come nell’America Latina, numerosi estratti crudi di piante e gli oli sono usati verosimilmente nei Paesi più poveri.
1.5. RUOLO DEGLI INSETTICIDI BOTANICI NEL FUTURO
Nei Paesi industrializzati la produzione biologica copre annualmente dall’8 al 15% di quella totale, rispettivamente in Europa ed in Nord America. In questo spazio gli insetticidi di origine botanica possono trovare un uso sempre più ampio.
Nell’agricoltura convenzionale troppo forte è la concorrenza degli insetticidi tradizionali a minor rischio e dei neonicotinoidi, come è avvenuto in California tra la fine dello scorso secolo e gli inizi dell’attuale. Promettente appare la diffusione degli insetticidi botanici nei Paesi più ricchi, per tutelare la salute pubblica (riduzione di mosche e scarafaggi) e per usi domestici.
Nei Paesi in via di sviluppo, dove gli agricoltori possono essere nella condizione di non permettersi l’uso degli insetticidi di sintesi, quelli botanici potrebbero trovare applicazione nella protezione dei prodotti in magazzino, soprattutto alla luce del fatto che in questi luoghi è diffusa da lungo tempo la pratica di utilizzare piante o loro derivati per la protezione degli alimenti conservati.
Anche dove i sintetici sono alla portata degli agricoltori, per esempio grazie a sussidi statali, la mancanza di protezione e di attenzione nel seguire le istruzioni per la distribuzione sono responsabili ogni anno di migliaia di avvelenamenti (Isman M.B., 2006).
La produzione di essenze vegetali che contengano p.a. insetticidi può essere considerata nel quadro più ampio della coltivazione delle essenze stesse per usi no food.
L’ 80% delle piante cresce spontaneamente, con grossi problemi di sostenibilità, intesa come bilancio tra produzione e domanda di materiale vegetale da parte dell’industria farmaceutica. Con l’estendersi dell’uso delle piante per scopi non alimentari, tale situazione si aggraverà sempre più, diventando non solo un problema economico, ma anche ecologico, sociale e culturale.
Soprattutto nei Paesi d’origine, le essenze vegetali venivano coltivate dagli indigeni su piccola scala, ma mantenendo una certa biodiversità. Con il passare del tempo, alterazioni climatiche, distruzione delle coltivazioni, migrazioni e mutamenti sociali hanno determinato un cambiamento dello scenario, proprio nel momento di un nuovo interesse verso le essenze, soprattutto per un uso alternativo.
piante selvatiche medicinali ed aromatiche nelle diverse parti del globo, anche perché esse rappresentano un materiale genetico prezioso e possono preservare l’ambiente agrario dalla degradazione, senza contare che possono rappresentare una fonte di reddito per chi le coltiva.
La conservazione di specie e di habitat a rischio, attraverso la creazione di parchi e riserve, può attrarre turisti ed aumentare le opportunità lavorative delle popolazioni locali, soprattutto nei Paesi più poveri e non industrializzati. La chiave comunque è rappresentata dai Governi e dall’Industria. (Central Institute of Medicinal and Aromatic Plants, INDIA).
Negli ultimi anni è cresciuto l'interesse verso l'identificazione e la produzione di principi attivi d’origine vegetale. Le tecniche agronomiche, d’altra parte, non sono state ancora ottimizzate per gran parte delle colture d’interesse farmaceutico. Di conseguenza, il loro rendimento produttivo, sia quantitativo che qualitativo, non è ancora soddisfacente. In tal senso, l’impiego di sistemi di coltura artificiale, quali l'idroponica e la coltura in vitro, potrebbe consentire numerosi vantaggi, soprattutto in termini di standardizzazione del processo produttivo, aumento della resa in principi attivi e miglioramento della qualità del materiale vegetale destinato alla lavorazione industriale (Pardossi A. et al., 2007).
La coltivazione delle essenze officinali, medicinali ed aromatiche ha avuto, dall’inizio del nuovo millennio, un notevole incremento anche in Italia, sia come superficie coltivata sia come numero di aziende agricole coinvolte, nella prospettiva di migliorare la redditività aziendale, di ampliare il portafoglio dei prodotti offerti e di recuperare superfici agricole a rischio di marginalizzazione, riconvertendo la gestione aziendale convenzionale in biologica e introducendo nuove colture, medicinali ed officinali.
L’Unione Europea, attraverso i Piani di Sviluppo Rurale (PSR), ha inteso incentivare la possibilità di riconvertire le produzioni agricole aziendali, attraverso misure specifiche, finalizzate alla introduzione di piante officinali.
L’area interna dell’Appennino centrale presenta una molteplicità di strutture poderali di limitate dimensioni, che si collocano in zone nelle quali le erbe officinali possono essere coltivate, recuperando superfici marginali, diversificando le produzioni, generando un elevato effetto imitativo nelle comunità rurali vicine, incrementando i livelli di Plv del 160% e di Reddito netto dell’80%, pur con aumento dei costi per la meccanizzazione delle operazioni colturali e per una nuova metodica produttiva biologica. Tuttavia, i dati più interessanti sono stati l’incremento delle vendite e quello degli investimenti, in termini di una preparazione adeguata del personale ed una modifica radicale del parco macchine, della fitotecnica e dell’ agrotecnica.
Le prospettive economiche appaiono abbastanza interessanti per quelle imprese che già presentano un ordinamento colturale caratterizzato dalle coltivazioni di fiori e/o di altre piante erbacee in pieno campo o in serra.
Le erbe officinali consentono anche di realizzare quegli obiettivi, previsti dall’Unione Europea, finalizzati a rendere le aziende agricole strutture di presidio e di salvaguardia del territorio, capaci di garantire la multifunzionalità.
L’accorciamento della filiera, necessario per contenere i costi produttivi, consentire un più facile accesso al mercato, maggiore coesione e scambio reciproco delle informazioni tra tutti i soggetti coinvolti, è rappresentato dal commercio elettronico e dalla diffusione di Internet (Galluzzo N., 2007).
Il nostro Paese, esteso in latitudine, permette la diffusione di piante di origine tropicale e subtropicale, con proprietà biocide testate in prove in vitro. (Gamboa M.M. et al., 2008)
In tal modo, valorizzando zone ben determinate, si potrebbe contribuire alla sostenibilità delle risorse botaniche nella lotta contro nematodi (Cristobal A.J. et
al., 2006), insetti, e funghi che infestano le derrate alimentari (Srivasan D.&
Nadarajan L., 2004) .
in letteraturaindividuate nelle cui parti (radici, foglie, steli, frutti, semi) sono stati isolati oli essenziali, flavonoidi, alcaloidi e proteine ad attività medicinale e biocida.
Artemisia sieberi (Compositae) (Negabahn M. et al., 2006), Calotropis
procera (Asclepiadaceae) (Salunke B.K. et al., 2005), Cassia sophera
(Fabaceae) (Kestenholz C. et al., 2007), Clitoria ternatea (Fabaceae) (Kelemu
S. et al., 2004), Flourensia cernua (Asteraceae) (Tellez M. et al., 2001), Hyptis
spicigera (Labiatae) (Sanon A. et al., 2006), Hyptis suaveolens (Raizada P.,
2006), Inula conyza (Compositae) (Levinson H. & A., 1998), Schizonepeta
tenuifolia (Lamiaceae) (Park I.L.K. et al., 2006), Securidaca longipeducolata
(Polygalaceae) (Jayasekara T. K. et al., 2005), Tephrosia spp (Leguminosae)
(Shrikalp D. et al., 2005).
Molte di esse, di origine tropicale e subtropicale, erano conosciute fin dall’antichità per le loro proprietà curative e vengono tuttora usate nella medicina tradizionale popolare, a scopo alimentare e per difendere le produzioni vegetali in serra o in magazzino da insetti ed altri fitofagi.
1.6. PROBLEMATICHE NELLA CONSERVAZIONE DELLE DERRATE ALIMENTARI
I prodotti di origine animale e vegetale conservati sono attaccati da più di 600 specie di Coleotteri, 70 specie di Lepidotteri e circa 350 specie di Acari, che causano gravi perdite a livello qualitativo e quantitativo e provocano contaminazioni delle derrate alimentari, con seri problemi, soprattutto per l'industria conserviera (Rajendran S. et al., 2008).
Gli insetti causano grossi danni ai cereali conservati e ai prodotti granari, con un' incidenza tra il 5 ed il 10% nelle zone a clima temperato e tra il 20 ed il 30% in quelle a clima tropicale, così come ai legumi, importante ed economica fonte di proteine nelle diete vegetariane dell'Asia e dell’ Africa. Basti pensare che l’India é la piu grande produttrice di granaglie, coprendo il 28% della
produzione mondiale.
Grossi problemi durante l'immagazzinamento sono rappresentati, sia a livello quantitativo che qualitativo, dall'attacco di varie specie di Coleotteri Bruchidi e Curculionidi. Il fagiolo dall' occhio (Vigna unguiculata L.) è attaccato da Callosobruchus maculatus (F.), mentre C. chinensis (L.) è il maggiore responsabile delle infestazioni al fagiolo adzuki conservato (Salunke B.K. et al., 2005).
Un altro Coleottero Bruchide che attacca il fagiolo dall’occhio, deponedo le uova sul frutto in maturazione, è Bruchidius atrolineatus (Pic): le larve penetrano nel baccello e nel tegumento del seme fino ai cotiledoni, di cui si nutrono e dove si sviluppano. Dall’uno al tre per cento dei semi raccolti sono già contaminati al momento dell’immagazzinamento. Si sviluppano solo due generazioni di questo insetto, perché gli adulti che emergono dai semi nel secondo mese dal magazzinaggio entrano in diapausa riproduttiva.
Anche C maculatus comincia la sua infestazione in campo, ma è in magazzino che provoca i maggiori danni. In assenza di una strategia di controllo, la popolazione, specialmente le forme attere, si sviluppa rapidamente, con successive generazioni, provocando la perdita quasi totale di prodotto in tre-cinque mesi dall’immagazzinamento (Sanon A. et al., 2006). I semi attaccati non possono germinare per il foro creato dalla fuoriuscita dell’insetto, perdono peso e valore merceologico.
Il metodo di lotta tradizionale, adottato dagli agricoltori nelle zone tropicali e subtropicali, consiste nel mescolare ai semi cenere, sabbia o altre sostanze essiccate e polveri inerti, che riempiono gli spazi tra i semi stessi e impediscono il movimento dell’insetto. Questo tipo di lotta è condotto anche con materiale vegetale essiccato, che esplica un’azione tossica o repellente verso gli adulti.
Vi sono anche metodi basati sulla conservazione in contenitori ermetici di plastica o di acciaio, sull’uso di insetticidi chimici, radiazioni gamma, basse od alte temperature. Alcuni di essi sono costosi e non alla portata di un’agricoltura di sussistenza. Altri, come la cenere e le piante, devono essere usati in grandi quantità per essere efficaci, solo su una limitata quantità di semi. Con l’introduzione degli insetticidi chimici, per i quali spesso sono previsti sussidi, l’uso di materiale vegetale è diminuito, ma C. maculatus continua a distruggere stocks di fagioli, che potrebbero prevenire carestie. Questo accade anche perché si sono sviluppate forme di resistenza, per la mancanza di specificità d’azione negli insetticidi in commercio.
Acanthoscelides obtectus (Say) infesta il fagiolo comune, principale fonte
economica dei poveri agricoltori dell’Africa occidentale e centrale, portando una diminuzione di produzione stimabile fino al 60% (Koona P.K. et al., 2007).
Abbiamo già citato il Coleottero Curculionide Sitophilus oryzae, che infesta il riso. Nell’Africa occidentale e in Ghana, gli agricoltori si devono difendere dagli attacchi di Rhyzopertha dominica (F.) su Triticum aestivum, di Sitophilus
zeamais (Motsch.) su mais, fonte di sostentamento per l’economia locale