9
CAPITOLO I
ANATOMIA DEI TENDINI FLESSORI:
Durante la filogenesi, gli arti del cavallo si sono notevolmente modificati con una notevole semplificazione della struttura scheletrica distale dell’arto e la conseguente formazione di un solo dito robusto, la riduzione della componente muscolare e lo sviluppo dei legamenti accessori finalizzati al movimento passivo e automatico degli arti. Questo garantisce al cavallo la possibilità di procedere ad alta velocità.
I tendini della porzione distale dell’arto del cavallo sono quindi divenute delle strutture anatomiche molto forti che riescono a sostenere carichi e tensioni notevoli, sia durante la fase di riposo che durante il movimento.
Questi organi hanno una duplice funzione:
-fornire supporto al nodello e prevenire l’iperestensione del carpo;
-restituire l’energia accumulata, sia durante l’impatto con il terreno che durante il momento di pieno carico del peso, per favorire la propulsione e il successivo distacco del piede dal suolo (Spinabella, 2002 ).
1.1 Anatomia descrittiva
per capire appieno la dinamica del movimento nel cavallo dobbiamo necessariamente considerare tutte le strutture che cooperano con il tendine flessore superficiale delle falangi nell’arto.
In ogni arto possiamo riconoscere tre diverse unità anatomo- funzionali:
1. Tendine flessore superficiale delle falangi (TFS) e suo legamento accessorio (LA-TFS) o briglia radiale;
10 2. Tendine flessore profondo delle falangi (TFP) e suo legamento accessorio
(AL-TFP) o briglia carpica;
11 Tendine flessore superficiale delle falangi e suo legamento accessorio:
Il muscolo flessore superficiale delle falangi nell’arto anteriore è unitario, compenetrato profondamente da tessuto muscolo tendineo. Ha una forma pressoché triangolare in sezione trasversale e viene coperto quasi completamente dal muscolo flessore ulnare del carpo. È appoggiato al muscolo flessore profondo delle falangi al quale è intimamente unito. Origina sull’epicondilo flessorio dell’omero (fig 1.1 e fig 1.2), tra il muscolo flessore ulnare del carpo e il muscolo flessore digitale profondo e al di sopra del carpo libera un robusto tendine detto tendine flessore superficiale delle falangi.
Il tendine flessore superficiale riceve, prossimamente al carpo, un legamento di rinforzo detto legamento accessorio o briglia radiale (Shively, 1983). Questa origina dal margine mediale del radio, 7-11 cm prossimamente all’articolazione radio- carpica.
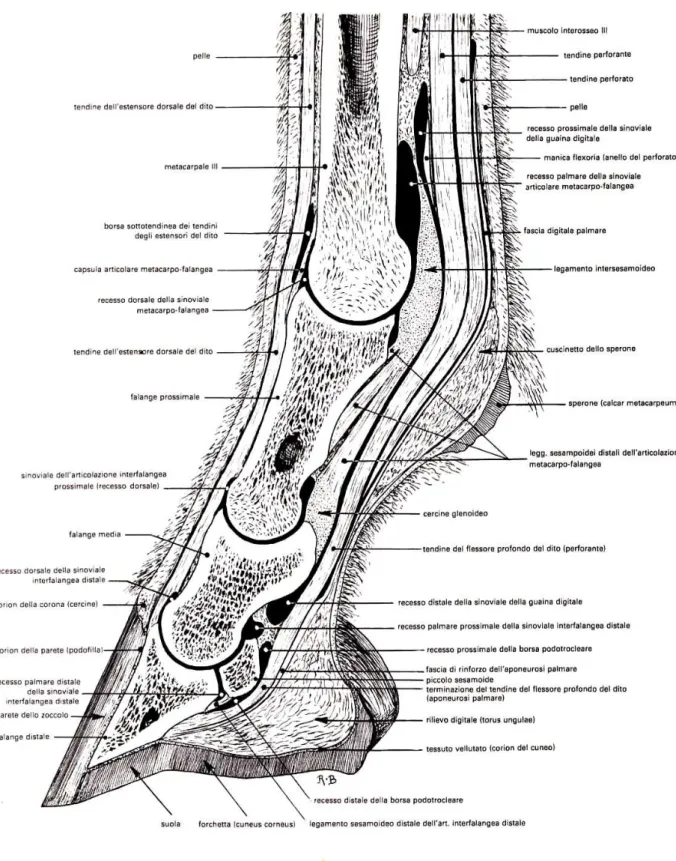
A questo livello il tendine flessore superficiale delle falangi, mantenendo una posizione palmare rispetto al tendine flessore profondo, con il quale è avvolto da una guaina tendinea (guaina tendinea comune prossimale), passa sotto il retinacolo del metacarpo.
Nel quarto distale del metacarpo il tendine flessore superficiale delle falangi, al di sopra della superficie di scorrimento dei sesamoidi, abbraccia, come un manicotto anulare, detto manica flexoria (fig 1.3), il tendine flessore profondo. I due tendini passano nel lato palmare e all’interno della guaina tendinea comune distale in posizione palmare rispetto ai sesamoidi e al legamento intersesamoideo digitale; distalmente alla regione del nodello forma, intorno al tendine flessore profondo, una seconda cintura molto sottile, che nella maggior parte dei casi, a livello della prima falange è costituita da due strette briglie. Sulla superficie flessoria del pastorale il tendine flessore superficiale delle falangi si divide in due branche, tra le quali passa il tendine profondo.
12 Le due briglie prendono attacco medialmente e lateralmente sul rilievo palmare della prima falange e ciascuna, con un ramo più sottile, prende inserzione anche sull’estremità distale del margine, laterale o mediale, della seconda falange.
13 Il muscolo flessore digitale superficiale delle falangi, nell’arto posteriore, ha assunto il carattere di un cordone legamentoso, quasi completamente tendineo, contrattile, che, coperto da entrambi i capi del gastrocnemio, prende origine nella fossa sopracondiloidea del femore, ed è collegato strettamente con il capo laterale del muscolo gastrocnemio.
Il tratto crurale, molto robusto, e prossimalmente ancora a costituzione muscolare (tendine plantare), si colloca dapprima sotto il tendine di Achille e poi, al di sopra della tuberosità del calcaneo, si avvita passando sulla faccia mediale e quindi sulla caudale del predetto tendine.
Sulla tuberosità del calcaneo si allarga nella calotta calcaneale e prosegue ulteriormente verso il dito come tendine flessore superficiale delle falangi. Sotto la calotta del calcagno si trova la grande borsa calcaneale sottotendinea che si estende prossimamente alla tuberosità del calcaneo, tra tendine plantare e il tendine di Achille e si insinua distalmente, fino a metà del tarso, tra il tendine flessore superficiale e il legamento plantare lungo.
Le branche laterale e mediale della calotta calcaneale, mediante le quali la calotta stessa viene fissata alla tuberosità del calcagno, sostituiscono funzionalmente il legamento di rinforzo, che nell’arto anteriore tiene in posizione, al di sopra del carpo, il tendine flessore superficiale.
Nel resto del suo percorso il tendine flessore superficiale delle falangi dell’arto posteriore, forma un anello intorno al TFP a livello della porzione prossimale del nodello, biforcandosi nella branca laterale e mediale che si inseriscono rispettivamente nella parte distale della prima falange e prossimale della seconda falange, come nell’arto anteriore (Nickel, 1991).
Per quanto riguarda la vascolarizzazione un tendine può ricevere sangue dal muscolo o dall’osso su cui il tendine si inserisce, dallo strato mesotendineo della guaina e da quello paratendineo nel caso in cui la guaina non sia presente.
14 È stato dimostrato che l’osso e il muscolo apportano sangue solo al 25% della porzione prossimale e distale del tendine e quindi si ritiene che sia di importanza fondamentale lo strato paratendineo (Mc Ilwraith, 1990).
15 Il TFS riceve prossimalmente vasi sanguigni grazie alla connessione diretta con l’arteria che apporta sangue al muscolo flessore digitale superficiale e da un’arteria nutritizia che deriva dall’arteria mediana, strettamente associata al legamento accessorio del TFS.
Le branche principali dell’arteria mediana vascolarizzano la superficie del tendine mediante il mesotendine.
Nella guaina digitale il tendine flessore superficiale del dito riceve il sangue caudalmente da vasi che passano attraverso il legamento anulare del nodello e dorsalmente da vasi che derivano dall’arteria digitale comune che scorre sulla superficie del tendine e della guaina digitale.
Allo stesso modo i vasi sanguigni che derivano dall’arteria digitale vascolarizzano il tendine flessore superficiale distalmente al nodello.
Il tendine è maggiormente vascolarizzato nella porzione centrale, sul metacarpo (Fackelman, 1973), grazie alla presenza del paratendine da cui è ricoperto.
Lo strato paratendineo è vascolarizzato da molte branche che provengono dall’arteria palmare mediale. All’interno del tendine l’apporto ematico è garantito da una fitta rete di arteriole, che viene chiaramente danneggiata in caso di lesione.
I vasi intratendinei decorrono attraverso le fibre collagene e si anastomizzano con altre che decorrono perpendicolarmente, alcune delle quali sembrano provenire dalla zona limitrofa del paratendine. Questa rete anastomotica del copro del tendine mima una scala a pioli vista la presenza di due vasi di dimensioni maggiori che scorrono sul margine laterale e mediale del corpo del tendine e di piccole branche anastomotiche perpendicolari.
A livello del terzo distale del legamento accessorio del TFS è stata rinvenuta un’arteria nutritizia che deriva o dall’arteria mediana o dall’arteria palmare immediatamente dopo la sua biforcazione. Questa decorre lungo la porzione palmare del legamento accessorio e penetra nella faccia palmare del tendine, distalmente alla giunzione muscolo-tendinea (Kraus- Hansen, 1992) .
17 Tendine flessore profondo delle falangi e suo legamento accessorio:
Nel muscolo flessore profondo delle falangi dell’arto anteriore si riconoscono tre diversi capi. Il robusto capo omerale è costituito da tre ventri muscolari, uniti tra loro, caratterizzati da una architettura pennata complessa, che originano insieme dall’epicondilo flessorio dell’omero e si adagiano sulla faccia caudale del radio, coperti quasi completamente dai flessori del carpo e dal muscolo flessore digitale superficiale. Prossimalmente al radio liberano un tendine molto grosso (fig. 1.1 e fig 1.2).
Il capo ulnare è molto più sottile e origina, dalla superficie mediale e dal margine posteriore dell’olecrano; nella prima parte è posto superficialmente tra il muscolo flessore e il muscolo estensore ulnare del carpo e si continua poi, in uno stretto tendine che passa, distalmente, tra il capo omerale e il muscolo estensore ulnare del carpo, per unirsi prossimalmente al carpo, al tendine principale.
Il capo radiale è quello meno sviluppato. Si presenta come un muscolo piatto che origina, a livello del terzo medio dell’avambraccio, dalla superficie caudomediale del radio e con il suo sottile tendine si fonde, all’estremità distale del radio, con il tendine principale. A questo livello il tendine principale diviene il tendine flessore profondo delle falangi (TFP) che decorre, appiattito, medialmente all’osso accessorio, sul legamento radiato del carpo, sopra la faccia flessoria del carpo stesso. Distalmente al carpo il TFP assume una forma cilindrica e si accolla al TFS, e in corrispondenza del terzo medio del metacarpo riceve una briglia di rinforzo detta legamento accessorio o briglia carpica (Shively, 1983), proveniente dal legamento radiato del carpo (fig. 1.1 e fig 1.2). Al di sopra dell’articolazione metacarpofalangea, il TFP viene avvolto da un manicotto anulare detto manica flexoria, formata dal TFS, e si pone poi sulla superficie di scorrimento dei sesamoidi dove si ingrossa. Distalmente ai sesamoidi, nuovamente avvolto dal TFS, curva verso la superficie flessoria del pastorale e passa qui tra le due branche terminali del TFS.
18 Un sottile fascio elastico detto branca coronale lo unisce al terzo distale della seconda falange e poi scorre sul sesamoide distale e prende saldamente inserzione sulla faccia flessoria della terza falange (Nickel, 1991).
19 Il muscolo flessore digitale profondo nell’arto posteriore presenta tre capi, che formano una sola unità funzionale, dato che i loro tendini si uniscono in un unico tendine flessore digitale profondo. Il muscolo lungo dell’alluce, molto robusto e riccamente inframmezzato da fasci tendinei è posto direttamente sulla tibia e origina dal condilo laterale e dalla faccia posteriore di detto osso e dalla fibula.
Nell’estremità distale dell’arto il ventre muscolare diviene un forte tendine rotondeggiante che, dopo aver ricevuto il tendine tibiale caudale si estende sulla superficie di scorrimento del sustentaculum tali e sul lato plantare del metatarso. A livello del terzo medio del metatarso si unisce al tendine del muscolo flessore digitale lungo a formare il tendine flessore digitale profondo. A questo livello il TFP riceve un legamento di rinforzo, abbastanza sottile, che proviene dal tarso e si inserisce sul terzo dito.
Il muscolo tibiale caudale, piatto e molto sottile, si trova caudalmente e in parte fuso con il muscolo flessore lungo dell’alluce. Origina dal condilo laterale della tibia e dal capitello della fibula. Tra il terzo medio e il terzo distale dell’arto forma un tendine piatto che, nella parte distale della gamba, si unisce a quello del flessore lungo dell’alluce.
Il muscolo flessore digitale lungo si presenta fusiforme ed è posto medialmente al muscolo flessore lungo dell’alluce. Origina caudalmente dal condilo laterale della tibia e, a livello della sua porzione mediale, diviene un tendine rotondo. Il tendine scorre in una doccia del malleolo tibiale per poi passare obliquamente sopra il lato mediale dell’articolazione del tarso. Si unisce al forte tendine terminale comune degli altri due capi a formare il tendine flessore digitale profondo a livello del terzo medio del metatarso. A questo livello il TFP giace in posizione dorsale rispetto al TFS.
Sopra all’articolazione del tarso, sia i tendini del muscolo flessore lungo dell’alluce e del muscolo tibiale caudale sia il tendine del muscolo flessore digitale lungo sono avvolti da guaine tendinee, che iniziano già al limite tra
20 terzo medio e terzo distale della tibia e spesso confluiscono tra di loro nella sede di unione dei due tratti tendinei (Nickel, 1991).
21 La vascolarizzazione del TFP è garantita principalmente da tre strutture (Kraus- Hansen 1992):
- l’arteria digitale comune emette, prossimamente al nodello, una branca metacarpale distale che decorre distalmente sulla porzione palmare del tendine; - distalmente al nodello, si formano dalle branche palmari della prima falange uno o due vasi che raggiungono la parte dorsale del tendine e riforniscono l’arteria sagittale dorsale;
- dall’arteria digitale propria originano due piccoli vasi simmetrici che raggiungono i lati del tendine nella sua parte distale.
La microangiografia ha documentato un’estesa rete vascolare intratendinea ad eccezione che nella regione palmare del nodello.
Legamento sospensore del nodello
Prende anche il nome di muscolo interosseo terzo e origina dalla ossa distali di carpo e tarso, dal margine prossimale del metacarpo e metatarso e dal legamento palmare carpale e tarsale. Nell’arto anteriore l’origine si presenta bilobata e appare incompletamente separata a livello del secondo e terzo osso carpale. Si estende distalmente, in posizione palmare, tra il secondo e il quarto osso metacarpale o metatarsale.
Si biforca in due branche che si inseriscono sulla faccia abassiale delle ossa sesamoidee prossimali. A questo livello si distaccano sottili branche che si vanno ad inserire sul margine prossimale dorso-mediale e dorso-laterale della prima falange.
Da ogni osso sesamoideo prossimale si stacca una branca estensoria che si va ad inserire nel tendine estensore comune del dito, sulla faccia dorsale della prima e seconda falange. Nell’arto anteriore ha una lunghezza media di 20- 25 cm, mentre in quello posteriore di 25-30 cm con forma trapezoidale. Il legamento sospensore del nodello si presenta formato da fasci di muscolatura striata, grasso, tessuto connettivo lasso, tessuto connettivo fibroso, vasi sanguigni e nervi (Spinabella, 2002).
23
24
Fig. 1.2 Muscoli flessori delle falangi del cavallo. Arto sinistro, veduta mediale dopo ampia
25 Strutture correlate ai tendini
All’interno del tendine si rilevano delle trabecole di tessuto connettivo lasso che decorrono tra i fasci tendinei, i vasi sanguigni, i nervi e i vasi linfatici e che prendono il nome di endotenio.
Questo è un’estensione dell’epitendine (peritenio) che riveste strettamente il tendine in superficie ed è costituito da tessuto connettivo lasso.
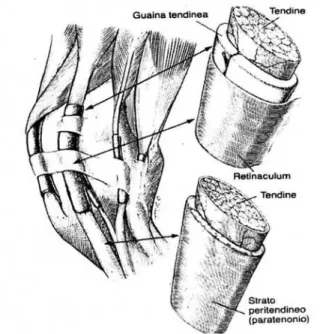
Ancora più esternamente al peritenio ritroviamo una guaina tendinea, detta strato paratendineo, formata da tessuto connettivo lasso vascolarizzato. Quest’ultimo strato è elastico e flessibile con lunghe fibre che permettono al tendine di scorrere. Nelle zone di maggior attrito i tendini sono avvolti da guaine tendinee (Fig 1.3).
Nella guaina tendinea possiamo riconoscere uno strato parietale ed uno viscerale; i due strati si continuano lungo una piega detta mesotendine, la cui presenza non è sempre evidente. Considerando i tendini flessori digitali il mesotendine è rinvenuto a livello del canale del carpo, mentre è assente a livello della porzione media del metacarpo e della guaina sinoviale digitale. Quando il tendine scorre su una superficie che potrebbe provocare un cambiamento della sua corretta posizione è mantenuto in loco da robuste fasce fibrose detti legamenti anulari o retinacoli (Mc Ilwraith, 1992)
Per quanto riguarda i tendini flessori digitali superficiale e profondo si ricorda che, a livello della superficie flessoria del carpo, sono avvolti dalla guaina tendinea prossimale dei flessori o guaina tendinea carpale dei flessori e tenuti in posizione dal retinacolo dei flessori (Nickel, 1991).
La guaina inizia 8-10 cm al di sopra del carpo e si estende distalmente, sotto il punto di unione della briglia carpica, con il TFP per poi fondersi con il TFS a livello del metacarpo.
A livello dell’articolazione metacarpofalangea e della superficie flessoria del pastorale, i due tendini flessori sono avvolti dalla guaina tendinea comune distale o guaina digitale, che origina a livello del terzo distale del metacarpo/tarso, avvolgendo il TFS e il TFP, e si estende verso la parte distale
26 della prima falange, avvolgendo a questo livello solo il flessore profondo (Spinabella, 2002).
Fig. 1.3 Schema dell’anatomia dei tendini e dei loro rapporti con il peritenio e le guaine
27 1.2 Anatomia funzionale
Sebbene in termini generali la morfologia dei tendini e dei legamenti sia strutturalmente simile, hanno funzioni diverse. I legamenti, infatti, impediscono o limitano la distrazione dei due capi ossei che connettono, mentre i tendini, funzionano come trasduttori di forza, unendo il ventre muscolare agli elementi scheletrici, e come vincoli articolari (Goodship, 1994). Vista la loro elasticità, i tendini sono fondamentali nell’assorbire le forze che si sprigionano al momento dell’impatto dell’arto sul terreno, accumulando e rilasciando l’energia immagazzinata successivamente, con una conseguente riduzione della spesa energetica dell’apparato locomotore. Un esempio ci viene dal TFS, il cui muscolo, essendo notevolmente pennato, è incapace di contrarsi per più di qualche millimetro. L’elasticità del tendine, quindi, permette l’assorbimento degli shock e favorisce il movimento, minimizzando questo handicap (Spinabella, 2002).
Anche se all’osservazione, il tendine appare come una banda o corda di tessuto connettivo denso, bianco e compatto, microscopicamente ci troviamo di fronte a strutture estremamente complesse. Vi possiamo rinvenire cellule, fibre e matrice extracellulare, intimamente compenetrate tra loro, che agiscono sinergicamente garantendo al tendine l’elasticità e la resistenza alla tensione e alla pressione, necessari allo svolgimento delle sue funzioni.
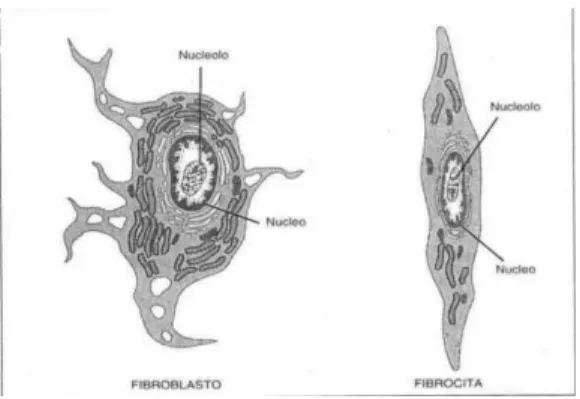
Le cellule del tessuto connettivo sono di solito di due tipi: uno risiede permanentemente all’interno del tessuto, come i fibroblasti e i fibrociti, ed uno si trova nel connettivo solo transitoriamente, come i linfociti, macrofagi, plasmacellule e mastcellule, neutrofili, eosinofili e basofili (Bergman,1996) (Fig1.4)
28
Fig 1.4 - Fibroblasto e fibrocita (Bergmann; 1996; modificato).
Con il termine di fibroblasto si identifica la cellula che produce la componente fibrosa ed amorfa della sostanza fondamentale, mentre per fibrocita la forma inattiva del fibroblasto, che ha la capacità di riprendere l’attività sintetica in caso di necessità. Sono quindi due stadi della stessa cellula. Il fibroblasto ha dimensioni considerevoli, una forma irregolare, citoplasma abbondante con organuli molto sviluppati, mentre il fibrocita è più piccolo e il contenuto di citoplasma e organuli decisamente minore. I fibroblasti sono in grado di produrre fibre collagene, elastiche e reticolari e i glicosaminoglicani e le glicoproteine che compongono per la maggior parte la matrice extracellulare. I tenociti, fibrociti specifici del tessuto tendineo, all’interno dei tendini e dei legamenti del cavallo sono almeno di tre tipi e variano da un tendine all’altro, a seconda della porzione tendinea considerata e in base all’età dell’animale. I tenociti si differenziano tra loro in base alla morfologia nucleare:
- tipo I: cellule con nucleo sottile a forma di spirale. Si rinvengono in quantità maggiori nei cavalli adulti;
- tipo II: cellule con nucleo tondeggiante, a forma di sigaro. Costituiscono le cellule predominanti negli animali giovani;
- tipo III: cellule con nucleo tondo e nucleoli ben visibili. Sono soprattutto evidenziabili nelle aree soggette a forze compressive.
Il significato di queste diverse popolazioni cellulari è sconosciuto, né se ne conosce il ruolo nel metabolismo tendineo e quindi sono state fatte una serie di
29 ipotesi sul loro significato. Potrebbero essere diverse linee cellulari o potrebbero indicare diversi stadi di maturazione dei tenociti (Goodship, 1994). Il tipo II e III infatti sembrano metabolicamente più attive poiché hanno nuclei voluminosi e una certa quantità di nucleoli e quindi potrebbero essere responsabili del mantenimento della matrice extracellulare circostante (Dowling, 2000).
I tenociti di tipo II si possono rinvenire nei legamenti, che presentano una popolazione cellulare maggiore, e nella zone adiacenti alle aree acellulari che si sviluppano nell’TFS a livello della regione metacarpale. Si ricorda che in questo tendine il numero dei tenociti, molto elevato nel periodo giovanile, rimane relativamente costante anche nel tessuto maturo, pur creandosi aree acellulari non strettamente correlate con l’età.
I tenociti di tipo III si trovano in quantità abbondante soprattutto nel TFP a livello della regione metacarpofalangea, viste le compressioni che agiscono sul tendine a questo livello.
La distribuzione e la densità delle cellule sembra differire tra i vari tendini, per esempio c’è una notevole differenza tra il tendine flessore e il sospensore del nodello. Le cellule tendinee e la matrice sono reciprocamente influenzate, visto che l’orientamento cellulare influenza l’organizzazione e l’allineamento delle macromolecole della matrice e, quest’ultima fa uso delle reciproche influenze tra i tenociti; grazie a questo meccanismo di feedback viene modulata la formazione di nuova matrice.
Pur avendo poche informazioni su come avviene la recezione e la trasmissione dei segnali all’interno dei tenociti sembra che la deformazione meccanica a cui sono sottoposte le membrane cellulari attivi i canali ionici. In più è evidente che la forma e la pressione delle cellule influenzano il controllo meccanico della composizione della matrice del tendine. Questo fenomeno è particolarmente evidente nelle aree sottoposte a pressione in cui si ha un aumento della porzione cartilaginea (Giori, 1993).
È fondamentale anche ricordare che i carichi meccanici a cui sono sottoposti i tendini influenzano il metabolismo dei tenociti e, indirettamente, l’apporto
30 ematico del tendine, modificando i valori della tensione dell’ossigeno e dei nutrienti nel tessuto e quindi influenzando indirettamente la sintesi di matrice da parte dei tenociti.
Il tendine ha una vascolarizzazione abbondante, tanto che misurando la tensione dell’ossigeno in un tendine normale si trovano valori simili a quelli del tessuto muscolare (2,20 +/- 0,65 Ml/ 100g/min), anche se non si osserva alcun incremento del flusso ematico durante l’esercizio fisico (Stromberg, 1969).
A seguito di queste considerazioni è facile comprendere come un aumento delle richieste metaboliche durante l’esercizio fisico si possa tradurre in una compromissione del sistema tissutale. (Goodship, 1994)
La matrice extracellulare (MEC) è prodotta dai tenociti, che presentano una forma fusata e bipolare, con nucleo allungato e organizzate in colonne poste tra le bande di collagene (Bernard –Beaubois et al., 1997).
La MEC conferisce al tessuto resistenza alla tensione e alla deformazione, e, inoltre, costituisce l’ambiente che permette alle cellule tendinee di vivere ed espletare le loro funzioni, garantendo il passaggio dei nutrienti, dei cataboliti, dei gas e degli ormoni (Bergman, 1996).
La MEC è composta da quattro tipi principali di macromolecole (collageno, elastina, proteoglicani e glicoproteine). Insieme, il collageno e l’elastina formano la componente che provvede alla forza tensile, mentre il collagene, da solo, provvede per circa l’80% alla resistenza dei tendini e legamenti (Goodship, 1994).
L’MEC è un gel viscoso che costituisce il 60- 80% del tendine, composto prevalentemente da glicoproteine e proteoglicani che imprigionano l’acqua, i sali e altre sostanze diffusibili. I proteoglicani sembrano avere un ruolo metabolico fondamentale, sequestrando il fattore di crescita nella matrice (Dowling 2000) e inoltre possono interagire con le cellule e giocare un ruolo di controllo sulle proprietà della matrice stessa, influenzando l’aggregazione delle fibrille collagene. I proteoglicani hanno un centro proteico a cui si lega una catena di carboidrati (glicosaminoglicani o GAG) e le catene saccaridiche
31 laterali sono altamente variabili nel tipo e nella lunghezza, anche all’interno dello stesso tessuto. Sono stati identificati diversi tipi di glicosaminoglicani nel TFS equino incluso il condroitin-solfato, il dermatin-solfato, il cheratin-solfato, l’eparina, l’eparina solfato e l’acido ialuronico.
I proteoglicani possono essere divisi in due categorie:
- molecole di grandi dimensioni: possiedono una notevole quantità di GAG. trattengono un’elevata percentuale di acqua. Si trovano abbondantemente nella cartilagine e nel tendine, a livello di quelle aree che sono sottoposte a notevole compressione, come ad esempio la regione metacarpo-falangea sia nel TFS che nel TFP;
- molecole di piccole dimensioni: hanno una o due catene laterali di GAG. hanno ruoli strutturali e di regolazione. Tra questi ricordiamo il decorin, diffuso nelle aree di tensione dei tendini (regione metacarpale del TFS), legato alle fibrille collagene di tipo I. Sembra influire sulla resistenza del tendine, regolando il diametro delle fibrille collagene e i legami crociati fra le fibrille stesse (Spinabella 2002).
La regione metacarpo-falangea di un SDFT normale contiene più proteoglicani rispetto alla regione media del metacarpo. Questa differenza probabilmente riflette le variazioni funzionale e metaboliche di tensione e compressione che esistono tra le due regioni (Dowling, 2000).
Delle glicoproteine la COMP (Cartilage Oligomeric Matrix Protein) è una delle più abbondanti. Anche se la sua funzione non è ancora nota sembra giocare un ruolo fondamentale nella struttura del tendine conferendogli una certa resistenza, vista la sua capacità di legare le molecole di collagene per formare le fibrille. Infatti la COMP è costituita da 5 subunità che gli fanno assumere una forma a 5 bracci con i quali può interagire con altri componenti della matrice. È ampiamente presente in tutti quei tessuti che sono sottoposti a notevoli carichi, come tendini, legamenti, cartilagine, dischi intervertebrali e menischi. La COMP è presente in quantità elevata nella regione metacarpale del TFS prima del raggiungimento della maturità scheletrica, per poi diminuire con l’aumentare dell’età, mentre nel TFP la quantità di COMP è minore, ma costante (Dowling, 2000).
32 Nella composizione del tendine giocano un ruolo fondamentale le fibre collagene, che, immerse nella matrice, rappresentano la maggior parte della componente fibrosa dei tessuti connettivi. Nei tendini dei cavalli adulti si possono individuare tre categorie di fibre in base alle diverse taglie: piccole (40 nm), medie (120 nm) e grandi (>200 nm) (Goodship, 1994).
Il collagene è un tessuto con alta resistenza alla trazione (pari a quella dell’acciaio) ed inoltre presenta altre utili caratteristiche come la flessibilità e la bassissima elasticità, permettendo quindi l’espletamento delle funzioni meccaniche del tendine. Alla microscopia ottica, previa colorazione con Ematossilina-Eosina (il collagene si colora in rosa) e con blu di anilina (assume un colore blu), l’esame della superficie di taglio dei tendini flessori rivela la presenza di setti interfascicolari che separano fasci di varia grandezza e forma. Ad una più attenta osservazione la superficie mostra un aspetto granulare, indice della presenza di fasci come sub-unità strutturali, separate da collagene lasso e irregolare. Infatti il tendine è composto da unità longitudinali, detti fasci, con un diametro compreso tra i 50 e i 300 µm che, se esaminate con un microscopio a luce polarizzata, mostrano una tipica bandeggiatura, derivante dal fatto che le fibre hanno una forma pieghettata, angolata, ondulata allo stato di riposo, il che contribuisce all’elasticità del tendine durante il primo stadio di caricamento del peso (Dowling et al., 2000).
I fascicoli sono composti da un insieme di fibrille, ben evidenti al microscopio elettronico, con un diametro compreso tra 50-500 nm. Le fibrille sono strutture cilindriche di alcuni mm di lunghezza, composte da molecole di collagene di Tipo I organizzate tra loro. È stato calcolato che in un TFS di cavallo adulto il range di diametro delle fibrille varia da 20 a 300 nm (Patterson-Kane, 1997). Le fibrille sono a loro volta composte da sub-fibrille con un diametro di 10-20 nm e queste da microfibrille di 3,5 nm la cui sub-unità è data dal tropocollagene con un diametro di 1,5 nm, che aggregandosi danno una tipica bandeggiature trasversale con un periodo di 64 nm. Questa particolare struttura, data dalle interazioni idrofobiche e idrofiliche tra molecole di collageno adiacenti, conferisce al tendine una caratteristica bandeggiatura trasversale (Goodship, 1994).
33 Le bande di collagene sono allineate con una direzione che va verso quella della forza muscolare e microscopicamente mostrano una caratteristico pattern impilato.
Fig 1.4 Schema della gerarchia strutturale del tendine (da Goodship, 1994; modificato)
Di fondamentale importanza, quindi, per conferire al tendine la resistenza alla trazione e la stabilità meccanica, sono i legami crociati che interessano i proteoglicani della matrice, creando legami tra le microfibrille, le fibrille e le fibre. Inoltre le singole molecole di tropocollagene presentano legami crociati tra aminoacidi e subunità polipeptidiche che formano il tropocollagene stesso. Il tipo e il numero di legami intermolecolari varia con la funzione della struttura e con l’età del tessuto, visto che l’aumentare dell’età incide sia sulla solubilità che sulla resistenza del collagene alla digestione enzimatica (Goodship, 1994).
La molecola di tropocollagene è formata da tre catene polipeptidiche avvolte ad elica, legate tra loro da legami covalenti. Il procollagene, a sua volta, è formato dalla ripetizione di triplette aminoacidiche nelle quali in terza posizione si presenta regolarmente la glicina, mentre gli altri due aminoacidi generalmente sono rappresentati da idrossiprolina e idrossilisina. Questi aminoacidi non si rinvengono frequentemente nell’organismo ad eccezione che nel collagene. Di particolare interesse sono i siti di legame dell’idrossiprolina per specifici
34 carboidrati, dato che tali siti sono di fondamentale importanza nell’assemblaggio delle molecole di tropocollagene allorché queste vengono secrete dalla cellula nello spazio extracellulare (Bergmann, 1996).
Nel corpo si possono distinguere circa 11 tipi di collagene, viste le variazioni della sequenza aminoacidica del tropocollagene, anche se non di tutti si conosce ancora la funzione. I diversi tipi di collagene non sono uniformemente distribuiti, ma sono localizzati in tessuti diversi o sono caratteristici di diversi stadi di sviluppo, oppure compaiono durante i processi riparativi dei tessuti. Nel tendine si ritrova:
- Collagene di tipo I: composto da due polipeptidi alfa. È il tipo più abbondante nei tendini e nei legamenti (95%). Le fibre sono caratterizzate da flessibilità e resistenza alla trazione. All’esame microscopico si evidenzia una caratteristica bandeggiatura,
- Collagene di tipo II: si rinviene prevalentemente nelle aree dove il tendine cambia la direzione delle sue fibre, inserendosi sulle prominenze ossee. Questo accresce la sua resistenza alla compressione (ad esempio la regione metacarpo falangea del flessore superficiale). È composto da fibrille di 100 nm di lunghezza e 20 nm di diametro che non presentano una caratteristica bandeggiatura e appaiono trasparenti per la grande quantità di carboidrati che legano acqua. (Bergman, 1996);
35 - Collagene di tipo III: differisce dal collagene di tipo I a causa del più piccolo diametro delle sue fibre. È reticolare con una struttura ricca di carboidrati. Ha una grande elasticità ma ridotta resistenza allo stiramento. E’ associato alle membrane basali e ai vasi;
- Collagene di tipo IV: si trovano nel tendine in piccole proporzioni, associato all’endotelio;
- Collageno di Tipo V: anche questo tipo di collagene si trova nel tendine associato all’endotelio e alle membrane basali (Goodship, 1994 e Bergmann, 1996).
36
CAPITOLO II
PROPRIETA’ MECCANICHE DEI TENDINI
Tenendo conto della composizione istologica del tendine possiamo dire che questo tessuto presenta una elevata flessibilità e resistenza alla tensione, ma ridotta estensibilità. Queste caratteristiche permettono al tendine di svolgere appieno il suo ruolo funzionale, sia durante la stazione che la locomozione. In termini meccanici, il tendine si comporta come un trasduttore di forza, visto che costituisce una connessione tra muscolo e tessuto scheletrico, e permette un’amplificazione dinamica durante la contrazione muscolare rapida, un carico di energia elastica ed una forza di attenuazione durante il movimento rapido e improvviso (Denoix, 1994), funzionando quindi come un “paraurti” che protegge le fibre muscolari. I tendini hanno anche la funzione di stabilizzare le articolazioni, grazie ad appropriate modificazioni delle forze tendinee che antagonizzano il movimento del muscolo. I tendini flessori del cavallo durante
37 la locomozione, flettono lo zoccolo permettendo il piegamento dell’arto nella fase oscillatoria del passo, mentre, in stazione, sono sottoposti ad un elevato stress tensile, supportando l’articolazione del nodello (Goodship, 1994).
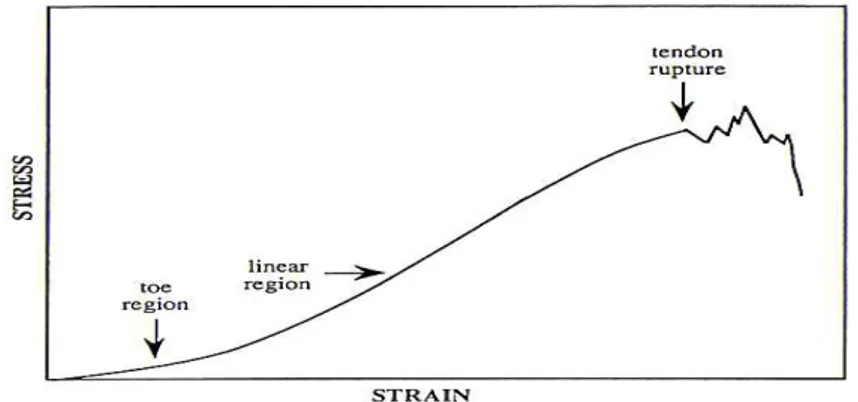
La deformazione a cui è sottoposto il tendine durante il carico può essere riassunta nel grafico (Fig 2.1)
Fig 2.1 Grafico della deformazione non lineare del tendine sottoposto a carico (da Dowling, 2000;
modificato).
Nel grafico, che mostra la deformazione non lineare del tendine sottoposto a carico, possiamo evidenziare che, inizialmente, per incrementi di carico piccoli, si verificano estensioni relativamente grandi che danno come risultato la regione iniziale (toe region) con un grado di inclinazione di circa 1,5% (Herrick, 1978).
Questa zona del grafico rappresenterebbe il raddrizzamento dell’ondulatura (crimp) delle fibre collagene in risposta a tensioni di circa il 3% che permettono di recuperare bene la forma iniziale al momento in cui viene eliminato il carico, così che il crimp ritorna nelle condizioni di lunghezza e agli angoli originari (Bufler, 1978).
Una volta terminata la fase iniziale in cui il tendine risponde in modo elastico, inizia una fase di risposta lineare, visco-elastica, dove il tendine diviene più resistente all’estensione e si ha un rapporto direttamente proporzionale tra tensione e allungamento. Nel grafico questa area è indicata con il termine di regione lineare (linear region); in questa fase ad ogni incremento di carico corrisponde un aumento equivalente nell’estensione. Una volta terminato il carico il tendine recupera la sua forma iniziale senza aver subito nessun danno,
38 visto che si comporta come un elastico. Il meccanismo dell’allungamento non è del tutto chiarito ma sembra legato allo scorrimento delle singole fibre collagene o di interi fasci di fibre gli uni sugli altri.
Nel caso in cui sul tendine vengono applicati carichi maggiori si può osservare un cambiamento non lineare, durante il quale si hanno estensioni più grandi del previsto. Il punto in cui si verificano questi cambiamenti prende il nome di punto di carico o punto di rottura. A questo livello si ha perdita di linearità e la capacità del tendine di recuperare la forma dopo la rimozione del carico viene meno. Questo fenomeno sembra essere legato alla rottura dei legami covalenti tra le microfibrille e fra le unità di tropo-collagene. Carichi che superano il punto di carico determinano una deformazione plastica e il tendine va incontro ad un danno strutturale irreversibile fino ad avere la rottura completa del tendine. Nel caso del SDFT del cavallo occorrono tensioni di 12- 20% per raggiungere il punto di carico (Goodship, 1994).
Durante il movimento una certa quota di energia elastica è immagazzinata nei tendini flessori. Questa energia viene usata nel successivo passo per ridurre l’energia richiesta e aumentare l’efficienza.
Quando il tendine è sottoposto a pressioni ripetute in modo ciclico una certa parte di energia viene persa sotto forma di calore. L’energia perduta corrisponde all’area sotto la curva della fig. 2.1.
Le caratteristiche ondulature delle fibre variano all’interno del tendine, tanto che le fibre ondulate della regione centrale del TFS si tendono precocemente rispetto a quelle della regione periferica nei cavalli adulti e questo suggerisce che la regione centrale sia più predisposta al cedimento (Wilmink et al., 1992). In laboratorio è stato dimostrano che le fibre centrali del tendine, sottoposte a tensione, si rompono prima di quelle periferiche e retraendosi all’interno del tendine, creano un vuoto centrale, ecograficamente rilevabile. Questo schema di cedimento ci permette di capire meglio le caratteristiche del core lesion. In cavalli di razza PSI durante le corse in piano, al galoppo, nel tendine TFS si hanno tensioni pari al 16% (Herrick et al., 1978).
39 A livelli di performance molto alta, quindi, il margine di sicurezza per l’integrità del tendine è limitata e, per questo, l’incidenza delle lesioni tendinee è molto elevata. Osservando attentamente un cavallo in movimento si può osservare come i diversi tendini giochino un ruolo fondamentale nelle diverse fasi del passo.
Grazie alle inserzioni distali a livello della faccia palmare dell’articolazione interfalangea prossimale, la tensione del TFS durante il riposo contribuisce a limitare, insieme ai legamenti palmari e allo scutum prossimale, l’estensione e il dislocamento dei condili distali della prima falange verso la faccia articolare prossimale della seconda falange. Le due inserzioni distali del TFS sulla seconda falange sono essenziali nel garantire la stabilità dell’articolazione interfalangea prossimale e per prevenire sia gli spostamenti latero-mediali che le rotazioni (Denoix, 1994).
Le vibrazioni che si creano quando l’arto viene a contatto con il suolo sono limitate e parzialmente assorbite dalla fascia metacarpale palmare, dal legamento anulare e dalla contrazione attiva dei muscoli che tendono preventivamente i tendini (fig. 2.2) (Rooney, 1978).
Quando il peso corporeo è scaricato sull’arto (Fig. 2.2) l’estensione del nodello provoca la tensione del TFS e l’estensione dell’articolazione metacarpo-falangea la tensione del suo legamento accessorio. Quindi la pressione a cui è sottoposto l’apparato di sospensione in questa fase è molto elevato. L’estensione dell’articolazione metacarpo-falangea provoca un ampio scorrimento del TFS in senso distale, parzialmente contrastato dall’AL-TFS, che si fa carico di parte del peso. L’estensione dell’articolazione metacarpo-falangea è comunque controllata e limitata dalla tensione che si instaura in tutta questa struttura a partire dall’inserzione prossimale sul radio fino all’inserzione sulla seconda falange. Che il ruolo dell’ LA-TFS, è notevole viene facilmente dimostrato dal fatto che in seguito alla sua desmotomia si ha un aumento significativo della tensione sul TFS. Durante questa fase di riposo, cioè quando il peso carica sull’arto, il TFP e il suo LA, pur dando un notevole contributo alla stabilità delle articolazioni interfalangee e alla sospensione del nodello,
40 sono meno stressati perché l’articolazione distale è flessa. La tensione dell’ LA-TFP comunque facilita l’estensione del carpo (Denoix, 1994).
Durante la flessione dell’articolazione interfalangea distale (che corrisponde alla prima fase di caricamento del peso, quando l’arto riprende contatto con il terreno dopo la fase oscillatoria), il TFP scivola prossimamente sulla superficie ossea, facilitando la flessione dell’articolazione interfalangea prossimale (in antagonismo con l’azione esercitata dal TFS).
La sua tensione induce una compressione assiale delle superfici articolari tra l’articolazione interfalangea prossimale e quella interfalangea distale e bilancia la tensione della parte distale del tendine estensore dorsale delle falangi. Durante il sostegno totale del peso, il TFP è in stretto contatto solo con il bordo distale dell’osso sesamoideo distale.
Nel momento in cui inizia la propulsione, cioè durante l’ultima fase di contatto dell’arto con il terreno (Fig. 2.2), si osserva l’elevazione del nodello. Questa è dovuta all’elasticità passiva dell’apparato sospensore, all’azione dei tendini flessori, soprattutto il TFP, al grande allungamento dei legamenti accessori che avviene nelle fasi precedenti, soprattutto l’ LA-TFP, e alla contrazione dei ventri muscolari dei flessori profondo e superficiale delle falangi. Prima che lo zoccolo si sollevi dal suolo, quindi durante l’estensione dell’articolazione interfalangea distale, il TFP subisce un leggero spostamento “distale”, all’interno della guaina digitale, sulla tuberosità flessoria della seconda falange e il legamento accessorio del tendine è allungato ai massimi livelli, fornendo un contributo fondamentale nella stabilizzazione dell’articolazione interfalangea distale. Inoltre il tendine TFP si flette ed entra in pieno contatto con il piccolo sesamoide.
Alla fine della propulsione la tensione passiva dei tendini e la contrazione attiva del ventre muscolare permettono il sollevamento dello zoccolo dal terreno e la flessione dell’articolazione interfalangea distale, dando inizio alla fase oscillatoria del passo. All’inizio della fase oscillatoria, la tensione e l’elasticità del TFS e il TFP, contribuiscono passivamente ad iniziare la flessione delle articolazioni interfalangee, metacarpale e carpale. Nel momento in cui lo zoccolo si solleva dal suolo il TFS si rilassa completamente,
41 scivolando prossimalmente nel canale del carpo. La flessione delle articolazioni è aumentata dalla contrazione attiva del ventre muscolare che provoca il completo rilasciamento del LA-TFS e del LA-TFP. Questi fenomeni sono accompagnati dallo scivolamento prossimale del tendine TFP all’interno della guaina digitale e nel canale del carpo.
Alla fine della fase di oscillazione, prima che lo zoccolo impatti nuovamente con il suolo, il TFP provoca la flessione dell’articolazione interfalangea distale riportando lo zoccolo in posizione orizzontale. In questo momento si ha anche la contrazione del muscolo da cui origina il TFS, al fine di evitare l’allungamento improvviso del tendine al momento del carico.
3 2 1
Fig. 2.2. Anatomia funzionale dei tendini flessori delle falangi e del legamento sospensore
durante il movimento. Legenda - 1: presa di contatto con il terreno; 2: pieno carico; 3: inizio della propulsione
Quindi, riassumendo e semplificando, il TFS sostiene il carico durate la prima fase del passo, facendo registrare a questo livello tensioni elevate, mentre il massimo caricamento del TFP avviene nell’ultimo stadio del passo, e la percentuale di carico a cui è sottoposto è più bassa così come l’incidenza delle lesioni a questo livello.
42 Nel trotto il legamento sospensore del nodello è caricato soprattutto nella parte iniziale del passo. Questa differenza nel carico funzionale delle strutture flessorie può spiegare la maggiore incidenza delle lesioni nel TFS di cavalli da corsa e del sospensore del nodello in cavalli trottatori (Goodship, 1994). È importante osservare che quando al radio sono applicate elevate compressioni anche il metacarpo e la falange prossimale subiscono un aumento della compressione sulla faccia dorsale e un aumento di tensione sulla faccia palmare.
I tendini flessori contribuiscono a limitare l’inclinazione palmare dei segmenti ossei, bilanciando la pressione sulla regione del terzo metacarpale e sulla prima falange riducendo notevolmente il rischio di fratture. Per carichi elevati, la parte prossimale del TFP limita l’estensione del carpo, mentre la parte distale limita l’estensione dell’articolazione metacarpo-falangea. Il TFP ha anche un ruolo fondamentale nel garantire la stabilità dell’articolazione interfalangea distale orientando la pressione della seconda falange dorsalmente sulla superficie articolare della terza falange.
Il muscolo flessore profondo delle falangi, conseguentemente al fatto che ha un’inserzione prossimale a livello dell’epicondilo mediale dell’omero, contribuisce anche a limitare la flessione del ginocchio. Nella regione del nodello il TFP è sottoposto a diverse forze. Sostiene la tensione fra l’inserzione prossimale e quella distale, ma anche la pressione proveniente dallo scutum prossimale. Questa zona, in cui si vengono ad applicare varie forze, presenta un’architettura fibro-cartilaginea con molti condrociti che si dispongono tra le fibre collagene. Anche sulla faccia palmare della seconda falange il TFP presenta un tappeto fibro-cartilagineo che sostiene la pressione della tuberosità flessoria dell’osso coronale.
Cambiamenti anomali dell’angolazione dell’inserzione del tendine possono portare a ineguale distribuzione delle forze che potrebbero indurre un indebolimento della struttura tendinea fino ad una sua rottura (Evans, 1975). Da ciò emerge l’importanza funzionale dello scutum distale che previene eventuali modifiche dell’orientamento delle fibre dell’inserzione durante i movimenti di flessione e di estensione dell’articolazione interfalangea distale.
44
CAPITOLO III
EFFETTI DELL’ESERCIZIO E DELL’ETA’ SULLA
FUNZIONALITA’ TENDINEA
Nel tentativo di spiegare l’elevata incidenza delle patologie tendinee nel cavallo, soprattutto a carico del tendine flessore superficiale, molti autori hanno cercato di identificare i fattori predisponenti le lesioni. Sembrano giocare un ruolo fondamentale le modificazioni che si hanno nei tendini con l’avanzare dell’età e con l’esercizio fisico, a cui l’animale spesso viene sottoposto a partire dai 18 mesi di età (Patterson-Kane, 1997).
I tendini raggiungono la maturità strutturale intorno ai due anni (Dowling, 2000). In questo momento si ha, infatti, il consolidamento delle fibre collagene, dei legami crociati tra le macromolecole e la caratteristica morfologia ondulata, tipica delle strutture tendinee (Patterson- Kane, 1997).
Nei cavalli di età superiore ai tre anni, le strutture tendinee dell’arto tendono ad irrigidirsi (Gillis, 1995; Dowling, 2000), probabilmente per la riduzione degli angoli che caratterizzano la forma delle fibre, per l’aumento del numero di legami crociati non riducibili tra le macromolecole e per una diminuzione del diametro delle fibre stesse (Parry, 1978; Dowling, 2000).
45 Tenere in considerazione questi fattori ci potrebbe aiutare a ridurre l’incidenza delle patologie tendinee.
3.1 Variazioni del Crimp pattern
Per capire meglio le variazioni che avvengono con l’età e l’esercizio fisico all’interno del tendine si deve necessariamente ricordare che le fibre collagene rappresentano l’unità funzionale di questo tessuto, garantendogli la resistenza necessaria allo svolgimento delle sue funzioni.
Le fibre hanno un diametro variabile tra i 20 e diverse centinaia di nm. In base al diametro possono essere classificate, attraverso un sistema bimodale, in fibre di piccole dimensioni, con un diametro massimo di 35 nm, e di grandi dimensioni, con un diametro che può superare i 165 nm (Parry,1978).
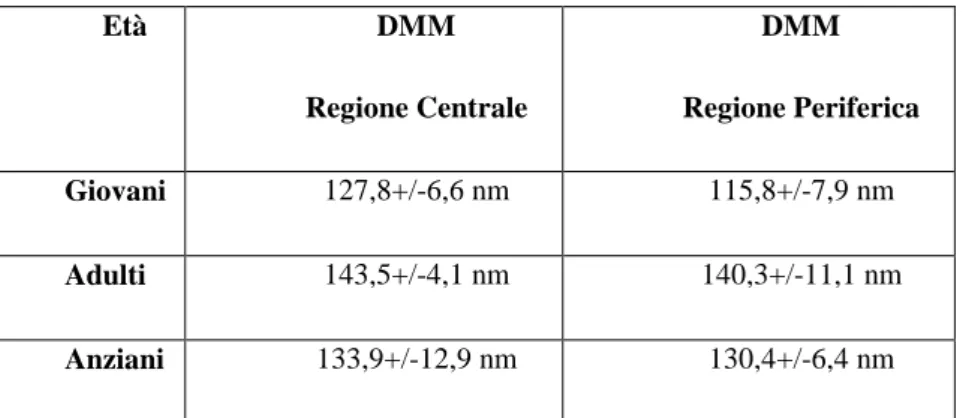
Le fibre grandi e piccole si trovano nei tendini in percentuale e con una distribuzione diversa. La media della distribuzione di fibre con quel dato diametro sul totale delle fibre stesse è indicato dal diametro medio della massa (DMM). Il DMM differisce dalla semplice media aritmetica, in quanto tiene conto anche del fatto che un piccolo numero di fibre di grandi dimensioni occupa un’area proporzionalmente più grande rispetto ad uno stesso numero di fibre di piccole dimensioni sulla superficie di taglio (Lindsey, 2005).
Il DMM ha quindi una correlazione positiva con la resistenza del tendine alla trazione (Oakes, 1989) visto che, maggiore è il diametro delle fibre all’interno del tendine, maggiore sarà il numero di legami crociati covalenti interfibrillari e quindi la resistenza del tessuto (Parry, 1978). Da questo si evince che un aumento del DMM indica un rafforzamento della struttura tendinea, incrementando la sua resistenza alle lesioni.
Le fibre di dimensioni maggiori hanno una superficie area-volume ridotta con una maggiore densità di legami interfibrillari che permettono di aumentare la resistenza del tendine alla trazione (Lindsey, 2005). Sono in concentrazione maggiore, quindi, in quei tessuti designati ad avere una elevata resistenza alla tensione (Parry, 1978).
46 Le fibre di piccole dimensioni, invece, hanno il ruolo di prevenire lo scivolamento delle fibrille le une sulle altre. Questo avviene in virtù della loro notevole area di superficie per unità di volume che garantisce una maggiore interazione delle fibre con la matrice circostante (Patterson-Kane, 1998). Si trovano, quindi, in quantità maggiore nei tessuti elastici (Parry, 1978). A parità di forze applicate sul tendine, le fibre con diametro minore si romperanno prima di quelle con diametro maggiore. Un fattore di notevole importanza è che il diametro delle fibre collagene non si mantiene costante nel tempo, ma varia sia con l’età che con l’esercizio fisico a cui è sottoposto l’animale (Patterson-Kane, 1996).
Si ha un aumento del diametro delle fibre durante lo sviluppo corporeo e una loro riduzione con la senescenza, infatti il DMM di tendini prelevati da feti e da animali con età inferiore ai 5 anni è minore rispetto a quello di cavalli con un’età compresa tra i 5 e i 10 anni (Tabella 3.1) (Patterson-Kane, 1995).
Età DMM Regione Centrale DMM Regione Periferica Giovani 127,8+/-6,6 nm 115,8+/-7,9 nm Adulti 143,5+/-4,1 nm 140,3+/-11,1 nm Anziani 133,9+/-12,9 nm 130,4+/-6,4 nm
Tabella 3.1 Differenze tra i DMM della regione centrale e periferica nel TFS (Patterson-Kane,
1997; modificato).
Inoltre il DMM della zona centrale del tendine flessore digitale superficiale, soprattutto a livello della regione media metacarpale, diminuisce molto se i cavalli sono sottoposti ad allenamento, passando da valori di 131,7 nm in animali non allenati a circa 105,3 nm in quelli sottoposto ad esercizio fisico costante (Patterson- Kane, 1997).
47 Anche nella regione periferica si evidenziano variazioni nel MAD con l’allenamento, anche se meno intensamente di quanto avviene nella regione centrale, forse perché le fibre di questa zona non sono sottoposte alle stesse condizioni meccaniche o termiche di quelle localizzate nel core del tendine (Fig. 3.1).
Molto probabilmente i cambiamenti che si hanno nella parte centrale del tendine possono essere interpretati come il risultato di microtraumi che avvengono nelle fibre di grandi dimensioni durante l’esercizio fisico (Lindsey, 2005), a seguito dei quali queste fibre sono sostituite da quelle con diametro minore.
L’aumento delle fibre di piccolo diametro riduce la forza tensile nel core del tendine, aumentando l’incidenza delle lesioni a questo livello, quando il tendine è ripetutamente e ciclicamente sottoposto a un rapido aumento di estensione durante il galoppo. Le nuove fibre di piccolo diametro potrebbero essere subunità che derivano dalla degenerazione delle fibre di grandi dimensioni o potrebbero essere di nuova sintesi, per la stimolazione dei tenociti. È anche possibile che questi due meccanismi avvengano contemporaneamente (Patterson-Kane,1997) .
48
3 4
Fig 3.1 1). Regione periferica del TFS non sottoposta ad esercizio; 2) regione periferica di un
TFS sottoposta ad esercizio; 3) Regione centrale di un TFS non sottoposto ad esercizio; 4) regione centrale di un TFS sottoposto ad esercizio (Patterson-Kane, 1997; modificato).
Nel tendine flessore digitale profondo, a differenza di quanto avviene in quello superficiale, non si registrano variazioni significative nei valori del DMM a seguito dell’allenamento fisico dell’animale. Questo probabilmente è dovuto al fatto che il tendine flessore digitale profondo non è sottoposto a carichi tanto elevati da minare la sua integrità strutturale, ma nemmeno a forze che, avvicinandosi ai suoi limiti di resistenza meccanica, ne provochino l’ipertrofia (Platt, 1994).
Dagli studi effettuati si è visto come l’esercizio fisico, oltre a una riduzione evidente del DMM, provochi una risposta di adattamento funzionale nel tendine flessore digitale superficiale, caratterizzata da ipertrofia delle fibre collagene (Patterson-Kane, 1997).
Insieme alla riduzione fisiologica del diametro delle fibre con l’avanzare dell’età si assiste anche a un loro cambiamento di forma.
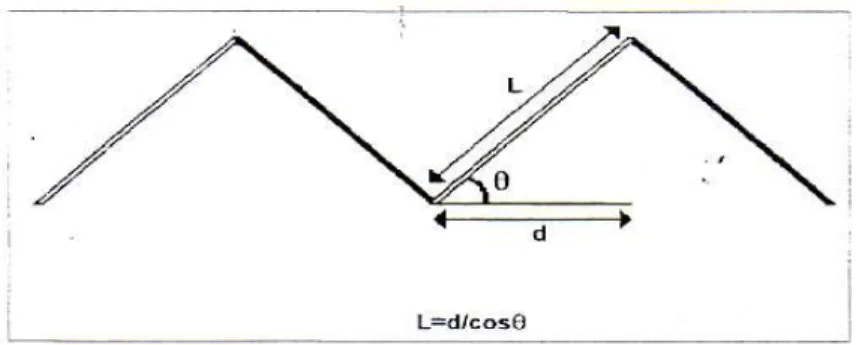
Per spiegare questo fenomeno si deve ricordare il crimp pattern. Questo termine inglese indica la particolare disposizione delle fibre collagene all’interno del tendine, facendo riferimento ai loro angoli e alla loro lunghezza (fig. 3.2), che determinano la classica forma a zig-zag delle fibre del tendine e che si evidenzia come un’alternanza di bande chiare e scure alla studio con luce polarizzata.
49
Fig. 3.2. Schema grafico del crimp pattern.
Legenda - L: lunghezza del segmento; d: lunghezza della proiezione del segmento; Ө: ampiezza dell’angolo (da Patterson- Kane, 1997; modificato).
La formazione del crimp è una caratteristica dei tessuti soggetti ad alti livelli di tensione, infatti questo permette al tendine di sopportare una maggiore stress meccanico, cosa che non sarebbe possibile se le fibrille fossero distese già all’inizio del carico. La presenza del crimp è anche un meccanismo di protezione contro forze repentine a cui spesso sono sottoposti i tendini flessori delle falangi. Questa funzione è convalidata dal fatto che il crimp ha un angolo maggiore nella porzione centrale del tendine flessore digitale superficiale, rispetto alla periferia, in risposta al maggiore stress a cui la prima è sottoposta. Il crimp pattern, soprattutto all’interno del tendine flessore digitale superficiale, subisce una serie di variazioni con l’avanzare dell’età, in cavalli sottoposti o meno ad esercizio fisico (tabella 3.2) (Patterson-Kane, 1997).
50
Angolo del crimp (°) Lunghezza del crimp (µµµµm) Parte centrale Parte periferica Parte centrale Parte periferica Giovani 14,6 13,2 23,0 21,2
Adulti 13,1 12,0 19,8 18,0
Anziani 10,5 12,7 17,9 20,3
Tabella 3.2. Differenze nell’angolo e nella lunghezza del crimp in base all’età (da
Patterson-Kane, 1997; modificato)
L’angolo e la lunghezza del crimp pattern si riducono molto velocemente dalla nascita fino alla maturità, dove arrivano a un plateau. Nei cavalli anziani c’è poi una consistente riduzione nell’angolo e nella lunghezza del crimp della regione centrale del tendine, mentre quelli della regione periferica non si modificano in modo significativo, o addirittura possono aumentare leggermente. I valori medi degli angoli e della lunghezza del crimp, quindi subiscono una diminuzione proporzionale all’età che interessa soprattutto la parte centrale del tendine e meno la parte periferica (Patterson- Kane, 1995). Nei cavalli giovani, infatti, l’ampiezza media degli angoli delle fibre e la loro lunghezza sono maggiori nella parte centrale del tendine, rispetto a quella periferica, mentre l’esatto contrario avviene nei cavalli anziani, dove le fibre esterne hanno angoli e lunghezza maggiori rispetto a quelle interne al tendine. Includendo tutte queste considerazioni in un unico ragionamento possiamo arrivare a conclusioni estremamente interessanti. Abbiamo già visto, nel capitolo sulla meccanica, come i tendini rispondano alla tensione di carico. Un tendine sottoposto a carico risponde con una curva non lineare in cui possiamo evidenziare una parte iniziale, detta regione iniziale, che corrisponde all’allungamento degli angoli delle fibre collagene, alla fine della quale l’ampiezza degli angoli del crimp è praticamente ridotta a zero (Diamant, 1972). Con l’osservazione alla luce polarizzata della struttura tendinea in
51 questo momento viene meno la tipica bandeggiatura chiara e scura (Wilmink, 1992).
Alla regione inziale fa seguito una parte di curva ad andamento lineare che rappresenta l’allungamento elastico delle fibre. Qualora le fibre siano sottoposte a tensioni eccessive tendono a danneggiarsi, dissociandosi in fibrille e rompendosi. In seguito a questo fenomeno è facile capire come fibre caratterizzate da ampiezze angolari ridotte, se sottoposte a carichi elevati, raggiungano il punto di rottura prima di quelle che hanno angoli più ampi, che invece dovranno essere sottoposti a tensioni nettamente maggiori prima di lesionarsi. In fig. 3.3 si può notare come le fibre che hanno angoli ridotti (low crimp angle), come quelle che si trovano per esempio nella parte centrale del tendine di un cavallo anziano, raggiungano il punto di rottura quando le fibre con angoli maggiori (high crimp angle), disposte alla periferia, sono ancora nella fase lineare della curva, dandoci una spiegazione scientifica delle caratteristiche core lesions che tipicamente vengono rinvenute nei tendini flessori (Patterson- Kane, 1997).
Fig. 3.3 Grafico che mette a confronto fibre che hanno un low crimp pattern (lc) con fibre che
52 Molti studi hanno cercato di capire la causa della riduzione dell’ampiezza degli angoli del crimp nella regione centrale del tendine, anche se diversi aspetti sono a oggi sconosciuti. Per cercare di capire questo fenomeno alcuni autori hanno misurato i livelli di glicosilazione del collagene nel TFS di cavallo (Patterson –Kane, 1997) e si è potuto notare che la sintesi del collagene nel tendine diminuisce con l’avanzare dell’età, anche se il suo tempo di emivita rimane abbastanza lungo, se comparata a quello di un altro tessuto connettivo (Birch, 1993).
Molto probabilmente si assiste con l’andare del tempo a un rimodellamento della struttura, con la sintesi di fibre di piccole dimensioni, che vanno a sostituire quelle di grandi dimensioni precedentemente presenti. I cambiamenti strutturali più gravi che si evidenziano nella regione centrale dei tendini dei cavalli da competizione, potrebbero essere il risultato di sovraccarichi che gravano sul complesso fibre-matrice, provocando lo scivolamento tra la matrice stessa ed alcune fibre collagene, con il conseguente rimodellamento e con il cambiamento della normale distribuzione degli angoli. Tra le ipotesi formulate per spiegare la diminuzione dell’ampiezza degli angoli del crimp, la più accreditata sembra essere quella per cui la diminuzione dell’ampiezza degli angoli è una conseguenza dell’allungamento irreversibile, a cui vanno incontro le fibre sottoposte a innumerevoli cicli di tensione che si verificano durante la vita del cavallo, e che possono portare alla distruzione della struttura fibrillare. Si ipotizza quindi l’esistenza di un progressivo affaticamento che conduce alla rottura del tendine (Wilmink, 1992).
Queste modificazioni avvengono normalmente con l’avanzare dell’età, anche se un esercizio fisico intenso può rendere il processo più rapido, a causa della formazione di microtraumi (Patterson-Kane, 1998). Per dimostrare questa correlazione gli Autori hanno confrontato due gruppi di cavalli, omogenei per età, con attività fisiche diverse (agonismo o pascolo). Nei cavalli atleti i tendini presentano nelle fibre della regione centrale del tendine angoli significativamente minori rispetto a quelle della zona periferica, a differenza di quanto avviene nei cavalli al pascolo. Questo meccanismo può essere spiegato
53 ricordando che i cavalli in allenamento subiscono un elevato numero di cicli ad alta tensione nei tendini, che accelerano il progressivo affaticamento soprattutto della regione centrale del tendine flessore superficiale digitale. Oltre alla riduzione dell’ampiezza degli angoli si assiste anche ad una diminuzione della lunghezza del periodo, cosa che non è evidenziabile nei cavalli non allenati. Infatti una elevata percentuale di soggetti con età inferiore ai 10 anni, che hanno svolto attività agonistica ad alte velocità mostrano una regione centrale del TFS con una riduzione degli angoli delle fibre, che potrebbe predisporre ad ulteriori danneggiamenti. Tale riduzione può essere interpretata ragionevolmente come il risultato della somma di microtraumi.
Non possiamo comunque esimerci dal ricordare che ci potrebbe essere anche una predisposizione soggettiva alla lesione dei tendini flessori della dita, dovuta sia a modificazioni nella composizione del tendine stesso che ad alterazioni nella conformazione dell’arto e nell’andatura.
3.2. Variazioni della componente cellulare
Oltre alle variazioni che si possono individuare nel crimp pattern si evidenziano modificazioni anche a carico della componente molecolare del tendine, correlate sia all’avanzare dell’età che all’esercizio fisico (Dowling, 2000).
Un’altra considerazione fondamentale da fare è che un esercizio fisico troppo scarso può inibire l’abilità del tendine a produrre matrice di buona qualità, mentre un livello di esercizio troppo alto durante la fase di accrescimento scheletrico può danneggiare facilmente il tendine. L’allenamento quindi accelera quei processi degenerativi che avvengono inevitabilmente con l’invecchiamento. Le modificazioni che si hanno nel tendine con la crescita sembrano essere legate a un cambiamento di metabolismo dei tenociti, anche se con la maturità scheletrica il tendine ha ridotte possibilità di adattarsi.
Le cause che provocano l’alterazione della matrice tendinea sono ancora sottoposte a studio, anche se sono state formulate diverse ipotesi; la più attendibile indica che l’alterazione della matrice potrebbe essere dovuta a una
54 distruzione diretta dei suoi componenti per via dei cicli di carico ripetuti, aggravata dall’incapacità dei tenociti di riparare i microtraumi. Qualunque sia la causa, la modificazione della matrice extracellulare incide sulle caratteristiche meccaniche del tendine (Patterson- Kane, 1997).
Per capire appieno le modificazioni della matrice extracellulare e le conseguenze che queste hanno nelle lesioni tendinee (Birch, 1999) ha studiato la composizione dei tendini flessori (TFS e TFP) nei cavalli giovani e anziani. La comparazione tra i due tendini prende spunto dal fatto che nel TFS le lesioni hanno un’incidenza nettamente maggiore rispetto al TFP, che solo in rari casi mostra fenomeni degenerativi con successive lesioni (Birch, 1999).
55 I fattori presi in considerazione sono:
- Contenuto di acqua: la percentuale di acqua contenuta nei tendini non presenta grosse differenze tra i due gruppi di animali, mentre la regione centrale del TFP ha un contenuto di acqua significativamente minore rispetto al TFS, nel quale non ci sono differenze tra la regione centrale e periferica.
- Contenuto di DNA: la quota di DNA nel TFP è minore rispetto al TFS, e tende a diminuire ulteriormente con l’aumentare dell’età. L’elevata cellularità del TFS, rispetto al TFP, e il suo aumentare con l’età indica che questo tendine rimane metabolicamente più attivo.
- Contenuto di glicosaminoglicani solforati: nel TFP la loro quantità è maggiore rispetto all’SDFT, mentre non si hanno differenze degne di nota nei due gruppi di animali studiati. I glicosaminoglicani sono implicati nel controllo del diametro delle fibre collagene e nell’organizzazione delle fibre collagene stesse.
- Contenuto di COMP (cartilage oligomeric matrix protein): la COMP si accumula durante lo sviluppo corporeo, grazie al carico al quale è sottoposto il tendine. Nei giovani cavalli in crescita, si è potuto notare che la rimozione del carico dal tendine si traduce in una riduzione della concentrazione di COMP nella matrice, cosa che non avviene quando il carico è rimosso dopo che l’accumulo di COMP è avvenuto. Dopo la conclusione dello sviluppo scheletrico la sua concentrazione tende a ridursi, soprattutto nella regione metacarpale. Questo fenomeno è accelerato dall’esercizio fisico intenso. C’è sicuramente un’associazione positiva tra i livelli di COMP e la resistenza del tendine nei cavalli adulti. È probabile, infatti, che i livelli di COMP riflettano la qualità della matrice del tendine (Dowling, 2000).
- Legami crociati: l’idrossilisilpiridolina (HP) è il legame più frequente sia nel TFS che nel TFP, con una percentuale maggiore nel TFS in entrambi i gruppi di animali. Gli alti livelli di legami crociati HP sono stati correlati con tessuti sottoposti a notevoli pressioni e tensioni. Questo è confermato dal fatto che la loro percentuale è maggiore nel TFS (Vogel and Koob, 1989).