6
RIASSUNTO
Parole chiave: cane, urine, sedimento, cytospin, Wright.
L’analisi completa delle urine è parte integrante dell’inquadramento complessivo delle funzioni metaboliche e d’organo e della visita clinica. Al pari di uno striscio di sangue nell’interpretazione di un emogramma, l’esame microscopico del sedimento è imprescindibile per una corretta lettura dell’analisi dell’urina.
In questo studio è stata effettuata la valutazione microscopica di 61 campioni di sedimento di urine ottenute da pazienti canini per minzione spontanea. Ciascun sedimento è stato allestito per centrifugazione standard delle urine e tramite citocentrifugazione. Entrambi i vetrini, tal quale e cytospin, sono stati sottoposti alla colorazione di Wright e l’esame microscopico del sedimento colorato è stato confrontato con quello a fresco non colorato. La stima eritrocitaria e leucocitaria sui campioni di sedimento colorati ha dimostrato di differire in maniera significativa da quella condotta sui campioni di sedimento non colorati e la numerosità delle emazie e dei leucociti appare essere in relazione con la patologia dei soggetti in studio.
ABSTRACT
Keywords: dog, urine, sediment, cytospin, Wright.
Urinalysis is an integral part of the overall framework of metabolic and organ functions and the clinical exam. As a blood smear in the interpretation of a CBC, microscopic examination of the urinary sediment is essential for a correct interpretation of the urine analysis. In this study the microscopic evaluation of 61 sediment samples of urine obtained from canine patients by spontaneous urination was carried out. Each sediment was set up using standard centrifugation of urine and via cytocentrifuging. Both the slides, as it is and cytospin, were subjected to Wright staining and microscopic examination of colored sediment was compared with the non-colored fresh one. The erythrocyte and leukocyte estimation on colored sediment samples has been shown to differ significantly from that carried out on non-colored ones and the number of red blood cells and leukocytes seems to be in relation with the pathology of the patients included in this study.
7
PARTE
GENERALE
8
Capitolo 1
L’esame completo delle urine
1.1 Indicazioni e metodi di campionamento.
Sia nella medicina umana che in quella veterinaria, l’analisi delle urine è considerata, a pieno diritto, una parte fondamentale delle informazioni minime su di un paziente che vengono apportate dalla diagnostica di laboratorio, insieme ad un emogramma completo e ad un profilo biochimico eseguito su siero o plasma (Fry, 2011). L’esame delle urine di routine è in grado di fornire al clinico informazioni riguardo la capacità di concentrazione del rene, la permeabilità glomerulare, oltreché altri possibili processi patologici coinvolgenti l’apparato urinario (es. flogosi, infezioni, emorragie, danni tubulari) od altri sistemi corporei (es. metabolismo dei glucidi, emolisi intravascolare, fenomeni di rabdomiolisi, alterazioni dell’equilibrio acido-base).
Le indicazioni per le quali questa indagine di laboratorio può essere richiesta sono le più svariate: come ausilio per giungere ad una diagnosi conclusiva, virtualmente, in tutti i pazienti malati; come monitoraggio della progressione di una specifica patologia e/o della risposta ad un protocollo terapeutico in soggetti affetti da una malattia già diagnosticata; come screening di soggetti asintomatici nei confronti di affezioni sottostanti - es. quale parte di una valutazione preanestetica, in check-up condotti annualmente per controllare lo stato di salute di pazienti apparentemente sani o in altri con una predisposizione genetica od ambientale allo sviluppo di patologie caratterizzate da manifestazioni urinarie - [Fry, 2011]; come strumento utile per controllare il possibile comportamento biologico di una malattia (irreversibile, progressiva o non progressiva), dove l’analisi delle urine può rendersi indispensabile nel ridefinire prognosi e terapia (Osborne, 1999).
Di concerto alle tecniche di analisi ed all’interpretazione dei risultati, il metodo di raccolta è parte integrante delle esame delle urine, sia dal punto di vista del tipo di campionamento utilizzato che del contenitore entro cui le stesse vengono poste.
In medicina veterinaria, l’utilizzo di contenitori improvvisati dai proprietari per la raccolta del campione non è una prassi consigliabile, dal momento che questi
9 contengono solitamente vari tipi di agenti contaminanti (detergenti, residui alimentari, prodotti cosmetici, ecc.) che potrebbero interferire con i test enzimatici e biochimici. L’impiego di recipienti trasparenti realizzati in vetro o plastica rende subito agevole l’osservazione dei caratteri macroscopici delle urine (Osborne, 1999).
Se l’esame non può essere condotto entro 30 minuti dal campionamento, l’utilizzo di contenitori opachi dovrebbe esser preso in considerazione per minimizzare la degradazione chimica dei costituenti delle urine da parte della luce.
Le urine raccolte per l’esecuzione di colture batteriche devono necessariamente essere poste in siringhe o in contenitori sterili provvisti di coperchi a chiusura ermetica.
Campioni ottenuti per cateterizzazione o cistocentesi possono essere trasportati e conservati nelle siringhe con cui sono stati raccolti.
Per quanto concerne il prelievo delle urine, in medicina veterinaria può essere realizzato con quattro diverse modalità: per minzione spontanea, per compressione manuale della vescica, mediante cateterizzazione transuretrale o per cistocentesi .
In riferimento alla metodica impiegata, dovrebbero essere messi in atto specifici accorgimenti in modo da prevenire traumi iatrogeni a carico dell’uretra o della vescica e infezioni delle basse vie urinarie (UTI), anch’esse iatrogene. Infatti, la significatività delle cellule o degli organismi rilevati all’analisi del sedimento dovrebbe sempre essere interpretata alla luce del tipo di campionamento utilizzato, specificandolo ogniqualvolta si richieda l’esame delle urine.
A meno che non si sospettino patologie uretrali o del tratto genitale, la prima frazione del flusso di urina dovrebbe essere esclusa dal campione sottoposto ad esame in quanto esso viene, di solito, contaminato durante il contatto con le vie genitali, la pelle ed il pelo (Osborne, 1999).
1.1.1 La raccolta per minzione spontanea.
I principali vantaggi della raccolta per minzione spontanea sono da ricondursi all’assenza di ogni possibile traumatismo connesso al prelievo, oltre ad essere facilmente realizzabile, in sede domiciliare, anche da parte del proprietario.
Gli svantaggi legati al metodo riguardano la frequente contaminazione dei campioni da parte di cellule, batteri ed altri costituenti presenti a livello del tratto genitale o della cute e del mantello. È per tale motivo che campioni prelevati per minzione spontanea
10 non possono essere impiegati, con una buona affidabilità, per la realizzazione di urinocolture. I campioni minzionali spontanei potrebbero essere contaminati da sostanze presenti nell’ambiente esterno (es. urine raccolte da terra) o, quale possibile evenienza, potrebbero non essere disponibili al momento della richiesta da parte del proprietario o del medico, in quanto dipendenti dalla volontà del paziente ad effettuare la minzione (Osborne, 1999).
1.1.2 La raccolta per compressione manuale della vescica.
La compressione manuale delle pareti vescicali ha, invece, il vantaggio di minimizzare il rischio di infezioni delle basse vie urinarie e traumi iatrogeni, oltre al fatto che i campioni possono essere raccolti da pazienti con distensione vescicale ed al momento più congeniale per il clinico.Gli aspetti svantaggiosi di questa pratica clinica sono da ascrivere al possibile traumatismo del viscere nel caso in cui si applichi un’eccessiva pressione digitale nello svuotamento; ciò non solo è lesivo per il paziente, ma l’ematuria associata al danno è in grado di interferire con la corretta interpretazione dei risultati (Osborne, 1999).
Inoltre, la vescica potrebbe non contenere un adeguato volume urinario in grado di consentire le operazioni di svuotamento.
I campioni ottenuti con questo metodo sono frequentemente contaminati da cellule, batteri ed altri detriti localizzati a livello genitale, cutaneo o del mantello; urina contaminata od infetta da parte di microrganismi batterici potrebbe essere forzatamente veicolata verso la prostata, gli ureteri, la pelvi renale ed il rene.
A differenza della minzione spontanea, dove la contrazione del detrusore è accompagnata da un contemporaneo rilassamento degli sfinteri uretrali volontario ed involontario, la compressione manuale della vescica aumenta la pressione all’interno del viscere, ma può non associarsi ad un simultaneo rilassamento degli sfinteri uretrali. L’applicazione di una pressione digitale prolungata sulla vescica urinaria per avviare il processo minzionale è legato ad un maggior rischio di reflusso nelle suddette strutture rispetto ad una compressione esercitata per un breve periodo; infine, questo metodo di campionamento non è adatto ad essere impiegato nel post-operatorio di un intervento di cistotomia (Osborne, 1999).
11
1.1.3 La raccolta per cateterismo uretrale.
La cateterizzazione transuretrale, invece, dovrebbe essere evitata soprattutto nei pazienti a maggiore rischio di sviluppare infezioni delle vie urinarie ad eziologia batterica, oltreché in particolari condizioni quali patologie urinarie, specialmente delle basse vie, insufficienza renale, iperadrenocorticismo, diabete mellito e poliuria (Osborne, 1999). La principale controindicazione del campionamento mediante cateterizzazione è essenzialmente da attribuirsi al possibile veicolo di germi dalle vie genitali, dall’esterno o dalla superficie del catetere stesso nell’evenienza in cui non sia stato preventivamente sterilizzato in maniera idonea, ma anche all’eventuale induzione di traumi iatrogeni che conducano a sanguinamento, potendo interferire con l’interpretazione dei risultati.
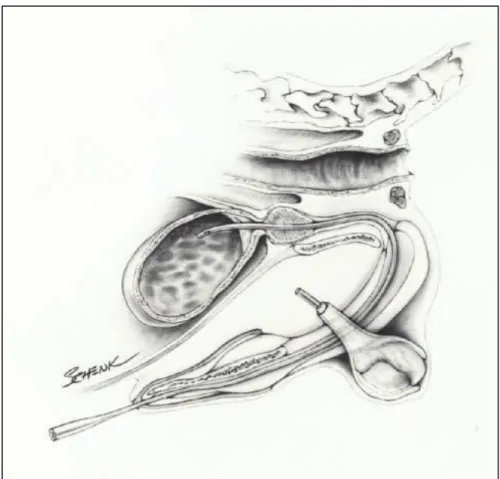
Figura 1.1 Corretto posizionamento dell’apice del catetere flessibile nel lume vescicale di un cane maschio; cateteri in plastica rigida non sono sempre idonei, in quanto possono provocare traumi iatrogeni e dolore durante il loro passaggio attraverso la porzione curva dell’uretra peniena.
Osborne CA, Schenke MP, Techniques of urine collection. In: Forty-Fourth Annual Proceedings of the American Annual Hospital Association. Denver, Colo, American Animal Association; 1.977, pp. 431-442.
12
1.1.4 Il campionamento per cistocentesi.
Il prelievo per cistocentesi, consistente in un tipo di paracentesi eseguita per punzione della parete vescicale con un ago allo scopo di rimuovere una quantità variabile di urina mediante aspirazione, si è rivelato essere, se adeguatamente eseguito, una procedura di grande valore diagnostico (Osborne, 1999). Questa tecnica si associa, infatti, ad un minor rischio di infezioni iatrogene rispetto alla cateterizzazione ed è solitamente meglio tollerata dai pazienti (soprattutto gatti e cagne) rispetto alla precedente.
La cistocentesi è molto indicata per prevenire la contaminazione del campione da parte di batteri, elementi cellulari e residui provenienti dal tratto urinario inferiore, oltre ad essere di ausilio nella localizzazione di ematuria, piuria e batteriuria (Osborne, 1999).
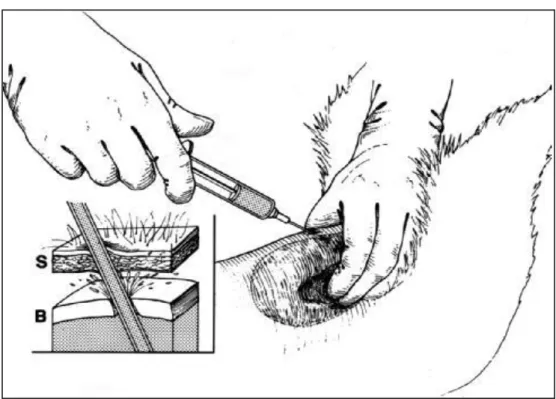
Figura 2.1 L’immagine schematica illustra la fuoriuscita di urina attraverso la parete vescicale adiacente all’ago inserito nel viscere per la centesi come conseguenza dell’esercizio di una eccessiva pressione digitale messa in atto per localizzare ed immobilizzare l’organo. S = cute della parete addominale; B = parete della vescica urinaria.
Osborne CA, et al. Cystocentesis. In: Kirk RW, ed. Current Veterinary Therapy VII. Philadelphia: W.B. Saunders Co.; 1980, pp. 1150-1153.
13 Le principali controindicazioni al metodo possono essere un insufficiente volume di urina nella vescica e la resistenza da parte del paziente alla palpazione addominale; la cistocentesi eseguita alla cieca, senza localizzazione digitale ed immobilizzazione del viscere, è solitamente fallimentare e può associarsi ad un danno della vescica o alle strutture adiacenti.
La tecnica, se eseguita su pazienti riportanti incisioni per un intervento di cistotomia recente, deve essere messa in pratica con le necessarie cautele (Osborne, 1999).
La maggiore limitazione diagnostica della cistocentesi è data dal fatto che frequentemente si accompagna a diversi gradi di ematuria microscopica; nei soggetti affetti da cistite, l’ematuria microscopica dovrebbe essere attesa come esito del traumatismo indotto all’ago sul tessuto della parete vescicale infiammata, contenente un aumentato numero e diametro dei vasi sanguigni.
Ad ogni modo, la raccolta di campioni di urina per cistocentesi non è consigliabile per monitorare la remissione di patologie inducenti ematuria poiché non è possibile distinguere correttamente se questa sia dovuta al tipo di campionamento piuttosto che all’affezione.
Ci sono evenienze in cui la raccolta delle urine per cistocentesi viene raccomandata per controllare la risposta di un paziente alla terapia: un esempio è il monitoraggio del trattamento antibatterico per infezioni microbiche delle vie urinarie (Osborne, 1999). È importante precisare che i risultati emergenti dall’esame delle urine e la loro interpretazione non sono svincolati da fattori preanalitici e che questi possono essere dovuti a variabili connesse al campionamento ed al paziente (Fry, 2011).
14
1.2 Affezione dei risultati di laboratorio da parte di variabili
pre-analitiche.
1.2.1 Variabili legate alla raccolta ed al tipo di
campionamento delle urine.
In linea teorica, il campione di urine da sottoporre ad esame dovrebbe essere libero da ogni possibile contaminante, raccolto entro un recipiente pulito, opaco, (sterile) oltre che ermetico e venire esaminato entro 60 minuti dalla raccolta. Le variabili più rilevanti (non connesse al paziente) di cui il clinico deve tener conto sono, essenzialmente, il momento di raccolta del campione, il metodo di campionamento e, nel caso in cui le urine non siano analizzate immediatamente, il tempo e le condizioni di conservazione (Fry, 2011).
Urine raccolte in un momento qualsiasi del giorno potrebbero essere idonee per l’esecuzione di un’analisi di controllo; però, la composizione dell’urina può cambiare considerevolmente durante la giornata (Osborne, 1999). Campioni raccolti casualmente potrebbero essere limitati a ciò che si è accumulato nel lume vescicale pochi minuti prima o potrebbero essere un misto di urine formatesi da svariate ore.
Le prime urine del mattino sono da preferirsi per la valutazione della funzionalità tubulare perché quelle provenienti da animali da compagnia in buono stato di salute che non abbiano bevuto durante il sonno sono, con molta probabilità, concentrate.
La capacità di concentrazione delle urine fornisce, infatti, importanti indicazioni sullo stato funzionale del rene. Le prime urine del mattino sono solitamente più acide e questo valore di pH tende a prevenire la dissoluzione delle strutture proteinacee.
Dal momento che l’assunzione di acqua è probabilmente maggiore durante il giorno, l’urina è, verosimilmente, meno concentrata in questo periodo; urine diluite (con un peso specifico inferiore a 1.008) esitano nella lisi di elementi corpuscolati come eritrociti e leucociti. In aggiunta a ciò, la formazione di un notevole volume di urine non concentrate o diluite tende a ridurre la concentrazione di tutte le sostanze disciolte nel campione. D’altro canto, campioni delle prime urine della giornata sono meno indicati per il rilevamento di iperglicosuria rispetto a campioni prelevati 3 o 4 ore dopo il pasto; non da ultimo, la morfologia degli elementi cellulari è passibile di risultare alterata ad opera delle variazioni di pH, osmolarità e rifiuti prodotti. Ciò può arrecare difficoltà nel differenziare cellule normali da reperti anormali (Osborne, 1999).
15 Nei campioni di urina di recente formazione il dettaglio citologico è solitamente migliore rispetto a quelli rimasti in vescica per diverse ore, anche se i primi potrebbero essere non sufficientemente concentrati per consentire la valutazione della capacità di concentrazione tubulare renale. Urine prelevate da 3 a 6 ore dopo il pasto possono essere utilizzate per valutare l’influenza dei diversi tipi di dieta su pH urinario, cristalluria, glicosuria ed escrezione dei minerali.
La modalità con cui il campione viene raccolto è importante quale variabile preanalitica, in riferimento alla possibilità di contaminazione dello stesso.
I campioni ottenuti per minzione spontanea dalla frazione intermedia dell’urinazione sono idonei per effettuare analisi di controllo in pazienti da monitorare per anomalie del tratto urinario e di altri sistemi corporei (Osborne, 1999).
Quando possibile, la prima parte del campione ottenuto per minzione spontanea dovrebbe essere escluso dalla frazione da sottoporre ad analisi; i campioni minzionali spontanei possono anche essere impiegati per valutazioni seriali dei parametri biochimici (glucosio, chetoni, bilirubina, ecc.), ma non sono adatti per l’allestimento di urocolture per l’isolamento batterico.
Campioni di urina raccolti inducendo manualmente la minzione risultano anch’essi frequentemente inquinati da cellule, batteri ed altri residui localizzati nel tratto genitale o su cute e mantello; pertanto, anche questi non sono idonei per la realizzazione di colture batteriche.
Urine ottenute attraverso la cateterizzazione transuretrale sono solitamente alterate dall’emorragia indotta dalla procedura di campionamento; a meno che non siano richiesti per uno studio specifico, i primi millilitri di urina ottenuti con il catetere dovrebbero essere scartati, dal momento che possono risultare contaminati da batteri, cellule e residui del tratto genitale e dell’uretra.
Per quanto riguarda la cistocentesi, il maggiore limite diagnostico di questa tecnica sta nel fatto che essa si associa non di rado a diversi gradi di microematuria, la cui entità è maggiore in quei pazienti con flogosi e/o congestione della vescica urinaria; quindi, la cistocentesi è sconsigliata nei casi in cui sia necessario controllare la remissione dell’ematuria microscopica successiva alla diagnosi (Osborne, 1999).
16
1.2.2. Variabili connesse alla conservazione ed ai tempi di
processazione del campione urinario.
Il tempo e le condizioni di conservazione potrebbero anch’essi influenzare i risultati dell’analisi: le possibili evenienze riguardano cambiamenti in vitro della composizione delle urine o la contaminazione di queste ad opera di microrganismi batterici.
Le urine, infatti, sono una miscela instabile, specialmente a temperature elevate ed in ambiente alcalino (Osborne, 1999).
Le modificazioni in vitro che possono verificarsi nei campioni dopo il prelievo includono processi di ossidazione, reazioni di fotolisi e/o effetti connessi alla crescita ed al metabolismo di microrganismi batterici; per questi motivi, è oltremodo consigliabile che i campioni (soprattutto quelli che dopo la raccolta risultano alcalini) siano esaminati il prima possibile per limitare variabili sconosciute e non prevedibili. L’obiettivo è infatti quello di analizzare campioni le cui caratteristiche in vitro siano paragonabili a quelle in vivo; in linea generale, quanto più lungo è l’intervallo tra il momento di raccolta delle urine e l’inizio della loro analisi, tanto meno affidabili sono i risultati. È difficile stimare con esattezza quanto i campioni di urina possano essere mantenuti a temperatura ambiente senza subire modificazioni degne di nota della loro composizione; tuttavia, la stima di eritrociti, leucociti e cilindri in campioni non refrigerati (specialmente se alcalini e/o diluiti) non sarà molto accurata dopo diverse ore dalla raccolta (Osborne, 1999).
Una delle più svantaggiose alterazioni che si verificano quando le urine sono mantenute a temperatura ambiente dopo il campionamento è rappresentata da un variabile incremento del pH, secondario alla proliferazione di batteri ureasi-produttori; urine alcaline promuovono reazioni false-positive nel rilevamento delle proteine con il dipstick, così come la distruzione di globuli rossi, cilindri e, soprattutto, globuli bianchi dopo svariate ore.
Ad eccezione della cistocentesi, le urine ottenute mediante le altre tecniche di prelievo riportano un grado variabile di contaminazione batterica, in quanto questi microrganismi sono normalmente residenti a livello della porzione distale dell’uretra. L’urina, infatti, è un ottimo pabulum per questi microrganismi i quali, proliferando, sono in grado a loro volta di alterarne i caratteri chimici; ad esempio, i batteri possono catabolizzare il glucosio, diminuendone l’effettiva concentrazione urinaria, modificare il
17 pH, provocare intorbidamento del campione se vi si moltiplicano in numero elevato, modificare l’odore dell’ urina in ammoniacale (Osborne, 1999). Inoltre, alcuni microrganismi sono in grado di esplicare attività perossidativa, la quale conduce alla produzione di falsi-negativi nella ricerca di sangue occulto, mioglobina ed emoglobina.
1.2.3 Metodi di conservazione delle urine in attesa di
processazione.
Nei casi in cui l’analisi delle urine non possa essere condotta prima di 1-2 ore dal prelievo, è consigliabile prevedere un metodo di conservazione, il quale è importante soprattutto per le urine su cui allestire colture batteriche o per la raccolta dell’urina prodotta nelle 24 ore (Osborne, 1999).
Il congelamento è una modalità di conservazione idonea per preservare la maggior parte delle caratteristiche chimiche delle urine (bilirubina inclusa) dal momento che inibisce la crescita batterica e ritarda la decomposizione della quasi totalità dei metaboliti presenti; è un metodo efficace anche per mantenere inalterati calcio, sodio, potassio, cloruro, magnesio e fosfato per al massimo 10 settimane, ma non è adatto per conservare campioni di cui si desidera effettuare l’analisi del sedimento poiché dà luogo a distruzione cellulare di varia entità. Inoltre, il congelamento comporta una perdita significativa di diversi metaboliti come l’ormone antidiuretico, la creatinina, l’epinefrina, l’idrossiprolina, la norepinefrina e l’azoto ureico (Osborne, 1999).
In riferimento agli altri possibili metodi di conservazione del campione, la refrigerazione è in grado, invece, di promuovere la formazione di cristalli; l’esposizione alla luce o all’aria possono altresì alterare la composizione del campione come esito di fotodegradazione, ossidazione od evaporazione (Fry, 2011).
1.2.4 Variabili pre-analitiche legate al paziente.
Queste possono essere ricondotte, essenzialmente, a variabili fisiologiche ed a variabili indotte nel percorso di formulazione di una diagnosi o legate alla terapia in atto (Fry, 2011).
Tra le variabili fisiologiche, la dieta può avere un effetto sul pH urinario o sulla formazione di cristalli; l’estro od accoppiamenti recenti potrebbero, invece, influenzare i rilievi microscopici. Variabili inducibili nel paziente che comunemente influenzano i risultati analitici comprendono, invece, la somministrazione di farmaci, fluidi od altre
18 sostanze esogene (Fry, 2011). Poiché i farmaci possono alterare i risultati dell’esame di laboratorio attraverso un’ampia varietà di meccanismi farmacologici, fisici e/o chimici, i campioni delle urine destinati all’analisi dovrebbero essere raccolti preliminarmente alla somministrazione di ausili diagnostici o terapeutici (Osborne, 1999). Se la terapia è stata effettuata prima della raccolta del campione, il momento e l’ordine temporale con cui la terapia ed il campionamento sono stati effettuati dovrebbero essere registrati per consentire una corretta interpretazione dei risultati; in alcuni casi, è consigliabile ripetere l’esame dopo la sospensione della terapia.
Ad esempio, la somministrazione di acidificanti od alcalinizzanti delle urine può alterare la composizione dei cristalli presenti, oltre a modificare il pH urinario; campioni fortemente alcalini possono indurre reazioni false-positive nei confronti della rilevazione delle proteine urinarie da parte delle strisce reattive comunemente impiegate, così come possono produrre reazioni false-negative nel caso in cui le urine vengano testate con l’acido sulfosalicilico.
Metionina ed altri composti farmacologici contenenti gruppi sulfidrilici liberi come il captopropile e la d-penicillamina potrebbero esitare in reazioni false-negative per i chetoni nei casi in cui questi vengano rilevati con le strisce reattive.
L’acido ascorbico, a sua volta, può dare reazioni false-positive per la rilevazione del glucosio urinario, oltre ad essere in grado di inibire la riduzione dei nitrati a nitriti, la misurazione analitica della bilirubina e quella degli eritrociti, dell’emoglobina e della mioglobina (Osborne, 1999).
Composti corticosteroidei e diuretici interferiscono con la capacità di concentrazione da parte del rene (Fry, 2011). I primi possono ridurre il peso specifico delle urine e l’osmolalità, interferendo con i normali meccanismi di concentrazione, specialmente nel cane; farmaci antimicrobici potrebbero altresì mascherare un’infezione delle vie urinarie o portare alla formazione di cristalli; mezzi di contrasto radiografici possono interferire con la misurazione del peso specifico delle urine o con la determinazione dei valori biochimici oppure esitare nella formazione di cristalli.
Le sezioni di base dell’esame delle urine di routine includono la descrizione dei caratteri macroscopici del campione (volume, colore, torbidità) e dell’odore, la misurazione del peso specifico con la tecnica refrattometrica, l’analisi biochimica delle urine utilizzando
19 delle strisce reattive in grado di valutare più analiti contemporaneamente e l’esame microscopico del sedimento (Fry, 2011).
20
1.3 L’esame fisico delle urine.
1.3.1 Volume urinario.
La determinazione del volume delle urine prodotte fornisce numerose informazioni cliniche; è infatti fondamentale al fine di verificare l’esistenza di un fenomeno di poliuria o di oliguria, determinare i soluti escreti con le urine, valutare la perfusione renale in pazienti con shock, oltreché per la stima di un’eventuale perdita di liquidi o in caso di eccessi durante una fluidoterapia parenterale (Osborne, 1999). Il volume di urina emesso può essere desunto dal peso specifico stesso; se il peso specifico di un campione di urine non glicosurico è superiore a 1.030 (nel cane) ed a 1.035 (nel gatto), è altamente improbabile che sia presente poliuria; valori di questa entità indicano che l’acqua è stata riassorbita dal filtrato glomerulare in eccesso di soluti (Osborne, Stevens, 1999). Se, invece, il peso specifico è inferiore a 1,030 (nel cane ) ed a 1.035 (nel gatto), il paziente potrebbe essere caratterizzato da poliuria fisiologica, poliuria patologica od oliguria patologica. È stimato che un cane adulto sano in normali condizioni ambientali produca, approssimativamente, da 20 a 40 ml/kg/die di urina (1-20 ml/kg/h). In paragone, cuccioli neonati hanno una capacità inferiore di concentrare o diluire le urine in risposta a cambiamenti del volume extracellulare dei fluidi.
La poliuria di tipo fisiologico si verifica, di solito, come risposta compensativa ad un’aumentata assunzione idrica; l’investigazione in un paziente della poliuria fisiologica può richiedere l’esecuzione del test di privazione dell’acqua o del test di risposta alla vasopressina (Osborne, 1999).
La poliuria patologica, invece, può essere classificata in diuresi di acqua ed in diuresi di soluti: la prima è caratterizzata da peso specifico (ps=1.001-1.006) ed osmolarità urinari inferiori a quelli del filtrato glomerulare (ps=1.008-1.012) e si manifesta più comunemente nei casi di insufficiente produzione di ADH (diabete insipido centrale), di diminuita risposta del rene ad adeguate concentrazioni di ADH (diabete insipido nefrogeno) o di eccessiva assunzione di acqua (polidipsia psicogena) [Osborne, 1999]. La diuresi di soluti è invece contraddistinta da peso specifico ed osmolarità urinari uguali o superiori a quelli del filtrato glomerulare; essa risulta dall’escrezione di soluti in quantità superiore rispetto alle capacità tubulari di assorbirli (es. glucosio in corso di diabete mellito), da un riassorbimento tubulare anormale di uno o più soluti (es. urea,
21 creatinina, fosforo ed altre sostanze nell’insufficienza renale primaria) e/o da una riduzione patologica della concentrazione midollare di soluti che conduce a compromissione del sistema in controcorrente (es. la diminuzione della concentrazione midollare di urea in soggetti con shunt porto-sistemico o di sodio in pazienti affetti da ipoadrenocorticismo) [Osborne, 1999].
L’oliguria patologica nei piccoli animali consiste nella produzione di urine non adeguatamente concentrate nella quantità di meno di 0,5-1,0 ml/kg/h; quest’affezione può verificarsi nella fase precoce di insufficienza renale acuta primaria, dovuta a patologie ischemiche generalizzate o a tubulopatie nefrotossiche. I meccanismi fisiopatologici coinvolti nella genesi dell’oliguria sono diversi: marcata vasocostrizione renale, diminuita permeabilità glomerulare, ostruzione del lume tubulare, anormale riassorbimento del filtrato glomerulare attraverso le pareti dei tubuli danneggiati.
Una condizione di oliguria patologica può svilupparsi in pazienti con insufficienza renale poliurica primaria se si instaurano anche problematiche di natura prerenale come vomito, diminuzione dell’assunzione di acqua o scompenso cardiaco; in questo caso, l’oliguria è la conseguenza delle riduzione della portata renale plasmatica a seguito della diminuita perfusione, la quale esita nella diminuzione della quantità di filtrato glomerulare prodotto. Se le cause prerenali sono di natura reversibile e/o se un’adeguata perfusione dei reni viene ripristinata, la poliuria tornerà a sostituire l’oliguria.
L’oliguria nel contesto della riduzione del volume di urine emesse durante la minzione spontanea si associa ad affezioni del tratto urinario inferiore (ureteri, vescica ed uretra), le quali rendono difficoltoso il flusso dell’urina attraverso le vie urinarie stesse.
Esempi significativi di questa evenienza riguardano possibili neoplasie, stenosi o calcoli in grado di occludere parzialmente il lume uretrale, ernie vescicali che possono impedire il passaggio all’esterno delle urine attraverso l’uretra o, ancora, la rottura della vescica (Osborne, 1999).
22
1.3.2 Colore.
Il colore delle urine è il risultato della sommatoria di tutte le sostanze pigmentate in esse contenute; l’intensità del colore può variare in conseguenza di svariate evenienze: la quantità delle sostanze colorate disciolte nelle urine, il pH urinario, la struttura biochimica dei costituenti presenti che può cambiare a seconda che la valutazione sia effettuata in vivo o in vitro (Osborne, 1999).
Poiché l’intensità della colorazione dipende dalla quantità di acqua nella quale le sostanze pigmentate vengono escrete, il colore assume significatività se interpretato alla luce del valore del peso specifico; è molto importante, ad ogni modo, fare attenzione a non sovrastimare l’importanza della colorazione, in quanto patologie clinicamente significative possono sussistere in assenza di alterazioni cromatiche delle urine (ad es. la glicosuria) e colorazioni anormali non sempre sono indicative di patologia.
Le urine normali sono tipicamente chiare, giallo chiaro, giallo o ambra; l’intensità del tono di giallo in campioni urinari normali varia con il grado di concentrazione o diluizione delle urine. La colorazione gialla è determinata principalmente dall’escrezione renale dell’urocromo presente nel plasma e, essendo la sua eliminazione nelle 24 ore pressoché costante, il colore delle urine fornisce un indice approssimativo della concentrazione o diluizione dello stesso. Perciò, campioni molto concentrati tenderanno all’ambra, mentre urine diluite potranno essere quasi trasparenti o giallo chiaro. La concentrazione di urocromo può aumentare anche nell’urina conservata a temperatura ambiente o quando questo è esposto alla luce diretta, ma quantità superiori di urobilinogeno possono essere eliminate anche a seguito di episodi febbrili o digiuno. Anche l’urobilina, composto arancio-brunastro dell’urobilinogeno (privo invece di colorazione) è in grado di contribuire al normale colore giallo delle urine (Osborne, 1999).
La rilevazione di una pigmentazione anormale delle urine dovrebbe orientare verso l’investigazione della dieta, di un’eventuale terapia farmacologica in corso e delle condizioni del paziente. Sebbene ciò sia sintomo di una possibile alterazione, il colore anormale delle urine non fornisce specifiche indicazioni per la localizzazione della/e eventuale/i causa/e, richiedendo pertanto un’ulteriore investigazione mediante appositi test di laboratorio ed esame del sedimento urinario (Osborne, 1999).
23 La pigmentazione associata ad ematuria può variare dal rosso al nero a seconda della quantità di sangue presente, del grado di acidità urinaria e del tempo durante il quale il sangue è rimasto a contatto con le urine; infatti, nel momento in cui gli eritrociti si lisano, essi rilasciano emoglobina che, una volta ossidata a metaemoglobina, assume una colorazione marrone o nera.
Anche la mioglobinuria può comportare l’emissione di urine brune, mentre la bilirubina o i suoi prodotti di degradazione possono dar luogo ad un giallo maggiormente intenso del normale - urine verdi possono attribuirsi all’ossidazione di grandi quantità di bilirubina in biliverdina - [Osborne, 1999].
Campioni urinari freschi dovrebbero essere trasparenti; se appaiono torbidi, è necessario approfondire facendo ulteriori accertamenti. Il grado di torbidità può essere descritto come scarso, leggermente torbido, moderatamente torbido o estremamente torbido. Nei campioni lievemente torbidi si notano precipitati visibili, ma che consentono ancora di vedere attraverso le urine; quelli moderatamente torbidi presentano precipitati ben visibili che diminuiscono la capacità di visione attraverso il campione; un campione estremamente torbido impedisce la visione attraverso di esso. È da precisare che urine maggiormente concentrate saranno più torbide rispetto ad urine diluite.
Tra le cause di anormale torbidità sono da annoverarsi la presenza di cristalli, eritrociti, leucociti e/o cellule epiteliali, batteri, lieviti o gocce lipidiche (Osborne, 1999).
In medicina umana, il riscontro di urine nere è un rilievo tipico di alcaptonuria, mentre in pazienti affetti da porfiria acuta intermittente l’urina può presentarsi molto scura (Israni, 2012). Urine verdastre, oltre a poter essere legate alla presenza di pigmenti biliari, sono riconducibili anche a fenomeni di batteriuria da Pseudomonas spp.; analogamente alla medicina veterinaria, anche in umana la causa più comune della colorazione rossa delle urine è l’emoglobinuria. Urine rosse in assenza di eritrociti nel sedimento solitamente indicano la presenza di emoglobina o mioglobina libere; al contrario, urine rosse contestualmente ad un sedimento caratterizzato dalla presenza di emazie sono suggestive di emoglobinuria (Israni, 2012).
Per contro, campioni di urine rossi in presenza di un sedimento privo di emazie sono più frequentemente risultato di mioglobinuria, anche se sono stati riscontrati in alcuni casi di porfiria o a seguito dell’assunzione di fenazopiridina - un colorante azoico dotato di azione analgesica sulla mucosa delle vie urinarie, il cui cloridrato trova impiego nella
24 riduzione dei sintomi di bruciore, urgenza e disuria in cistiti, uretriti e prostatiti – in grado di determinare la colorazione delle urine di rosso o arancio. Uno degli effetti farmacologici più noti è anche la pigmentazione rosso-arancio delle urine in corso di terapia antibiotica con rifampicina (Israni, 2012).
1.3.3 Odore.
Il riconoscimento di un odore anomalo delle urine ha raramente uno specifico significato diagnostico; ad ogni modo, ciò indica la necessità di ulteriori valutazioni mediche. L’odore, per ovvi motivi, non è un parametro dell’analisi delle urine che possa essere rilevato con procedure automatizzate né tantomeno con l’ausilio delle strisce reattive; viene perciò riportato dall’operatore che esegue l’esame.
Anche un’impropria conservazione del campione è passibile di indurre un’alterazione dell’odore delle urine, il quale diviene in questo caso molto forte. Perciò, questo assunto dà modo di valutare se un campione, caratterizzato da un odore particolarmente forte, sia stato correttamente conservato prima di procedere all’analisi ed all’interpretazione dei risultati (Osborne, 1999).
Nell’uomo, invece, il rilevamento di un odore anomalo nelle urine di neonati è spesso suggestivo di patologie metaboliche.
L’odore ammoniacale è un’evenienza molto frequente e può essere dovuta alla trasformazione dello ione ammonio (inodore, come l’urea, presente in notevole quantità nell’urina) in ammoniaca come risultato di processi di degradazione dell’urea da parte di batteri ureasi-produttori, i quali possono essere presenti a livello del tratto urinario come patogeni o semplici contaminanti (Osborne, 1999).
Campioni minzionali freschi caratterizzati da odore ammoniacale sono suggestivi di infezioni del tratto urinario da parte di batteri ureasi-produttori, anche se ciò dovrà essere comunque verificato.
Urine con esalazioni putride possono indicare la presenza di degradazione batterica di una considerevole quantità di materiale proteico; la chetonuria, invece, può essere rilevata già odorando le urine, in quanto conferisce a queste un odore dolce o fruttato, anche se i test di laboratorio, essendo la rilevazione dell’odore operatore-dipendente, sono maggiormente affidabili per la valutazione di questo importante parametro biochimico.
25
1.3.4 Peso specifico.
Questa parte dell’esame fisico delle urine viene routinariamente eseguito con la tecnica refrattometrica, la quale misura l’indice di rifrazione del campione di urina, direttamente dipendente dalla concentrazione di tutti i soluti, ionici e non ionici, in essa disciolti.
Oltre alla concentrazione dei soluti disciolti, anche la temperatura influisce sul valore del peso specifico; ad ogni modo, i refrattometri vengono calibrati ad una temperatura di riferimento (Osborne, 1999).
I refrattometri non sono tutti identici e non forniscono sempre risultati sovrapponibili: esistono scale di calibrazione differenti per l’uomo e gli animali e, in modo particolare, per il gatto (Fry, 2011). Se si utilizzasse in medicina veterinaria un refrattometro con una scala calibrata per l’impiego in medicina umana, il valore che ne risulterebbe sarebbe falsamente aumentato (più concentrate sono le urine, tanto più la differenza sarebbe marcata). Sebbene l’entità della differenza dei due valori sia modesta, sarebbe potenzialmente di rilevanza clinica, soprattutto se il peso specifico urinario è prossimo al limite per discriminare se la capacità di concentrazione da parte del rene sia completa. Ad esempio, se venissero rimisurate le urine di un gatto con peso specifico risultato pari a 1.034 mediante un refrattometro calibrato per l’uomo, il valore che si potrebbe leggere sarebbe pari a 1.040, fuorviando il clinico riguardo le reali capacità di concentrazione del rene.
Una marcata proteinuria o glicosuria può dar luogo ad una lieve sovrastima della concentrazione urinaria; per ogni g/dL presente nelle urine, le proteine aumenteranno il valore del peso specifico approssimativamente di 0.003-0.005 ed il glucosio di circa 0.004-0.005 (Fry, 2011).
Il limite inferiore di 1.025 è stato estrapolato dalla medicina umana; dal momento che l’uomo riesce a concentrare le urine fino ad un valore massimo di 1.035-1.040, mentre i valori nel cane possono raggiungere 1.060 o più e nel gatto addirittura 1.080 e superiori, un peso specifico prossimo a 1.025 riflette meglio la funzione tubulare renale nell’uomo piuttosto che nei piccoli animali.
Una compromissione significativa della capacità di concentrare le urine sussiste in cani disidratati o iperazotemici, che risultano incapaci di produrre urine con un peso specifico superiore a 1.025 (Fry, 2011).
26 A questo proposito, ribadendo che il peso specifico delle urine esprime la concentrazione totale di soluti presenti, le quantità di ciascuna sostanza devono, pertanto, essere interpretate alla luce del valore di questa. Per esempio, valori di proteine pari a 4+ in un campione di urina con peso specifico di 1.010 rappresentano una proteinuria più grave rispetto ad un valore di proteine urinarie uguale a 4+, ma con un peso specifico di 1.045 (DiBartola, 2007).
Figura 3.1 È sempre consigliabile utilizzare un refrattometro provvisto di una scala differenziata per la misurazione del peso specifico di campioni urinari di gatto.
Michael M. Fry. Urinalysis. In: Nephrology and Urology of Small Animals; Bartges J., Polzin D. eds., 2011.
27 In medicina umana, il peso specifico urinario può essere determinato mediante il metodo refrattometrico, con l’impiego di un igrometro o, in maniera più approssimativa, con l’utilizzo delle strisce reattive (Israni, 2012); l’accuratezza e l’utilità delle strisce reattive per la determinazione del peso specifico urinario è stato ampiamente dibattuto; questo tipo di misurazione dipende in maniera diretta dalla forza ionica delle urine e dal fatto che esiste, generalmente, un rapporto direttamente proporzionale tra la forza ionica e l’osmolalità urinaria.
La striscia contiene, infatti, un polimero poliionico provvisto di siti di legami saturati da idrogenioni; il rilascio degli ioni idrogeno quando questi vengono competitivamente rimpiazzati da cationi delle urine comporta un cambiamento della colorazione dell’indicatore pH-sensibile. Il valore del peso specifico determinato con l’impiego delle strisce reattive tende ad essere falsamente aumentato se il pH urinario è inferiore a 6.0 od erroneamente diminuito se il pH è superiore a 7.0. Nei neonati, la misurazione del peso specifico risulta inaccurata sia con l’uso del refrattometro che con le strisce reattive (Israni, 2012).
Nell’uomo, il normale range del valore del peso specifico urinario è compreso tra 1.003 e 1.030, ma decresce con l’età, parallelamente alla diminuzione della capacità del rene di concentrare le urine. Essendo il peso specifico inversamente correlato con il volume urinario delle 24 ore, il monitoraggio del suo valore può essere molto utile per pazienti affetti da urolitiasi, i quali traggono beneficio dal mantenimento di urine diluite (Irani, 2012).
L’esame chimico delle urine viene usualmente eseguito con l’ausilio delle strisce reattive; il grado di variazione cromatica sulla porzione della striscia dove sono presenti i reagenti è in rapporto diretto con la concentrazione dell’analita in esame (Osborne, 1999).
I risultati vengono valutati in maniera semi-quantitativa, solitamente indicati come negativi, presenza in tracce e da 1+ a 4+; la lettura dei risultati può essere effettuata sia con l’ispezione visiva diretta della striscia che con uno strumento capace di leggere automaticamente la striscia (Fry, 2011).
In linea generale, è consigliabile valutare le proprietà chimiche con le strisce reattive su un campione non centrifugato e ben mescolato, dal momento che le cellule e gli altri
28 elementi particolati potrebbero non essere presenti nel surnatante di un campione centrifugato. Con questa tecnica è possibile avere risultati falsi-negativi o falsi-positivi in alcune evenienze, tra le quali la pigmentazione anormale delle urine, in grado di interferire con la corretta interpretazione dei risultati (Fry, 2011).
29
1.4 L’esame chimico delle urine.
L’esame chimico delle urine fornisce la valutazione dei seguenti analiti: pH, glucosio, bilirubina, chetoni, sangue occulto, proteine, urobilinogeno, nitriti e leucociti.
1.4.1 pH.
La determinazione del pH urinario può essere eseguita mediante l’utilizzo di appositi pHmetri o con le comuni strisce reattive disponibili in commercio. Risultati maggiormente attendibili vengono ottenuti su campioni di urina fresca e con l’impiego del pHmetro. Le strisce reattive, anche in questo caso, costituiscono uno strumento economico e facilmente reperibile, ma la scarsa accuratezza di questa metodica trova una maggiore significatività clinica nel caso in cui l’effettivo pH urinario sia prossimo alla neutralità; in uno studio di recente pubblicazione, infatti, è stato provato che il metodo delle strisce reattive tende a sovrastimare il pH, conducendo alcune volte alla lettura di un risultato alcalino laddove, con la determinazione mediante l’uso del pHmetro, questo sia in realtà moderatamente acido (Fry, 2011).
La valutazione con il pHmetro rimane pertanto il metodo di riferimento, soprattutto nel caso in cui un’eventuale pigmentazione delle urine potrebbe offuscare od alterare il colore della striscia (Osborne, 1999).
Il pH può essere considerato un indice approssimativo dell’equilibrio acido-base dell’organismo, in grado di fornire indicazioni sulle condizioni metaboliche del paziente.
Il normale range di pH nel cane e nel gatto è tra 5.5 e 7.0, ma tende a variare nell’arco della giornata, in conseguenza dei processi di alimentazione e digestione.
Ciò dipende dalla cosiddetta “marea alcalina”, presumibilmente dovuta all’increzione di acido cloridrico in sede gastrica durante la digestione.
Nei piccoli animali, i reni riescono a mantenere il pH urinario tra 4.5 e 8.5, ma il tipo di dieta ed alcune patologie sono in grado di alterarne anche in maniera significativa il valore; ad esempio, l’alimentazione con proteine animali, tanto nell’uomo quanto nei piccoli animali, esita nella produzione di urine acide.
È quindi ragionevole ritenere che l’entità della variazione del pH urinario successiva al pasto sia dipendente dalla composizione dello stesso, dalla frequenza di alimentazione e dalla quantità di cibo assunta.
30 Nell’uomo, dopo diverse ore di sonno, il pH delle urine tende ad essere più acido, presumibilmente in conseguenza di una condizione di acidosi respiratoria instauratasi durante il sonno per la diminuita frequenza della ventilazione polmonare (Osborne, 1999).
I valori anormali o inappropriati di pH si attestano, comunque, su livelli simili a quelli della normalità, per cui, vista la scarsa frequenza con la quale il pH scende al di sotto di 5.5 o sale oltre 7.0, nel cane, dovrebbero suscitare il sospetto di una condizione di anormalità del paziente.
Ad esempio, disordini associati alla produzione di urine acide possono essere ricondotti a stati di acidosi respiratoria e metabolica, acidosi diabetica, insufficienza renale primaria, vomito e diarrea gravi, digiuno, febbre, carenza di ossigeno e catabolismo di composti proteici endogeni od esogeni (Osborne, 1999).
Alterazioni del normale pH delle urine possono anche essere il risultato di un artefatto, legato alla contaminazione del campione da parte di batteri ureasi-produttori del tratto distale dell’uretra, delle vie genitali o dell’ambiente esterno e che dà luogo all’alcalinizzazione dell’urina, mentre la proliferazione di altre specie batteriche, soprattutto in campioni glicosurici, può provocare acidificazione urinaria.
Nell’uomo, il normale range di pH si attesta tra 4.5-7.8; analogamente a quanto detto per i piccoli animali, valori di pH molto alcalini (>7.0) sono suggestivi di infezioni delle vie urinarie da parte di batteri ureasi-produttori, come Proteus mirabilis, ma anche la conservazione per molto tempo del campione senza refrigerazione o aggiunta di conservanti può condurre ad una sovracrescita delle suddette popolazioni batteriche, con conseguente innalzamento del pH. Ad ogni modo, diete vegetariane, terapie con diuretici, vomito o terapie alcalinizzanti possono portare ad un aumento dei valori di pH. Un pH urinario basso, inferiore a 5.0, viene rilevato più comunemente in luogo di acidosi metabolica, mentre valori ancora inferiori possono essere indicativi di una forma di acidosi tubulare renale (Israni, 2012).
1.4.2 Glucosio.
Sebbene un’esigua quantità possa normalmente ritrovarsi nelle urine, questa è di norma insufficiente per essere rilevata dai test comunemente impiegati per determinarne la presenza (Osborne, 1999).
31 L’evidenziazione di una condizione di glicosuria necessita di essere adeguatamente valutata per quanto attiene la possibile presenza di uno stato di iperglicemia o di normoglicemia, le quali possono essere fisiologiche, farmacologicamente indotte o patologiche .
La glicosuria si verifica ogni volta che la soglia di riassorbimento tubulare renale viene superata a causa di un’aumentata concentrazione ematica di glucosio, anche se solo transitoriamente, ma può anche essere la conseguenza di una difettosa funzione del tubulo renale (Fry, 2011).
La determinazione del glucosio urinario con il metodo delle strisce reattive impregnate con la glucosio ossidasi/perossidasi ed altri diversi reagenti è un test di tipo enzimatico facile da utilizzare, ma che implica reazioni enzimatiche interconnesse che si verificano in maniera sequenziale; per cui, l’affidabilità dei risultati dipende dalla fedele aderenza alle indicazioni di utilizzo riportate dalla casa produttrice (Osborne, 1999).
Nonostante le sostanze cromogene presenti in questi test siano molteplici, l’intensità e la sfumatura dei colori possono essere grossomodo paragonati alla concentrazione di glucosio urinario. La glucosio-ossidasi e la glucosio-perossidasi sono proteine labili, quindi le strisce con cui è condotto il test hanno una durata limitata, come indicato dalla data di scadenza riportata sul loro contenitore.
Il risultato della misurazione può essere influenzato dalla temperatura: studi sperimentali condotti dall’Università del Minnesota su urine di cani con una concentrazione di glucosio in acqua nota (0, 100, 250, 500, 1000 e 2000 mg/dL) hanno evidenziato che quasi il 25% dei campioni refrigerati a 6 °C ed immediatamente analizzati a temperatura ambiente (21 °C) con il Clinistix® risultavano falsi-negativi (Osborne, 1999). Questi dati indicano che campioni di urina refrigerati dovrebbero essere riportati a temperatura ambiente prima di venire esaminati per la presenza di glucosio con test enzima-dipendenti che richiedono un tempo di reazione breve (10’’ circa).
Anche la presenza di acido ascorbico in concentrazioni superiori a 50 mg/dL è passibile di provocare inibizione della determinazione della glicosuria quando questa è prossima alla minima concentrazione rilevabile con le strisce reattive.
In caso di risultati controversi della misurazione della glicosuria o di colorazioni inusuali delle strisce reattive, è possibile avere una conferma dalla determinazione del
32 glucosio urinario e/o eseguendo sul campione il test colorimetrico basato sulla riduzione del rame; la misurazione quantitativa del glucosio urinario può essere eseguita con successo con la tecnica basata sull’impiego della esochinasi o della glucosio-deidroigenasi.
Il metodo basato sulla riduzione del rame si fonda sulla variazione cromatica associata alla conversione dello ione rameico (blu) in ossido rameoso (arancio-rosso): il viraggio dal blu, attraverso il verde, fino al rosso è legato alla concentrazione di composti riducenti (tra cui il glucosio) nelle urine (Osborne, 1999).
A causa delle sue caratteristiche molecolari, il glucosio passa senza grandi difficoltà attraverso i capillari glomerulari e quindi nel filtrato; quasi tutto il glucosio presente nel filtrato glomerulare è riassorbito in maniera attiva da parte del tubulo prossimale e soltanto un’esigua quantità (da 2 a 10 mg/dL) normalmente finisce nelle urine.
La glicosuria fisiologica può verificarsi ogniqualvolta la concentrazione di glucosio nel filtrato glomerulare supera la capacità di trasporto dei tubuli renali (cosiddetto “trasporto massimo”, Tm) per questo metabolita; il Tm per il glucosio urinario, nella specie canina, corrisponde ad una concentrazione di glucosio sanguigno venoso pari a circa 170-180 mg/dL, mentre nel gatto si attesta su valori più elevati, da 260 a 310 mg/dL.
La glicosuria fisiologica è solitamente transitoria e può manifestarsi a seguito di stress significativi, soprattutto nel gatto, nonostante in questa specie la soglia renale per il glucosio sia relativamente elevata (Osborne, 1999). Questo fenomeno è solitamente legato al rilascio di adrenalina e glucocorticoidi endogeni e si ritiene che l’iperglicemia e la conseguente glicosuria siano dipendenti dalla mobilizzazione del glicogeno immagazzinato a livello epatico.
Stati di glicosuria iperglicemica sono stati riportati nell’uomo in conseguenza del consumo di quantità insolitamente eccessive di glucosio; ciò non viene osservato nel cane e nel gatto. Tuttavia, i gatti hanno dimostrato di avere una scarsa capacità nella metabolizzazione degli zuccheri della dieta.
Un incremento della quota di glucosio perso con le urine nelle 24 ore è stato osservato anche in donne gestanti (Osborne, 1999).
Glicosuria farmacologica iperglicemica può verificarsi a seguito della somministrazione parenterale di fluidi contenenti glucosio; anche la terapia parenterale con glucocorticoidi
33 può produrre diversi livelli di glicosuria, anche se, nei piccoli animali, è un evento meno frequente che nell’uomo. Tra le altre sostanze ad azione farmacologica di cui è stata dimostrata una potenziale azione incrementante il glucosio urinario vanno ricordati l’ACTH, il glucagone, l’adrenalina, la morfina, le fenotiazine ed il progesterone.
Stati di glicosuria patologica sono solitamente associati a sindromi iperglicemiche, ma ci sono casi in cui la glicosuria è di tipo normoglicemico.
Le cause della glicosuria iperglicemica possono essere riconosciute nel diabete mellito, talvolta nelle pancreatiti acute così come nell’iperadrenocorticismo o in lesioni del S.N.C., nel feocromocitoma, nel glucagonoma, nell’ipersomatotropismo, in alcune infezioni, nelle epatopatie croniche o in caso di situazioni estremamente stressanti, mentre la glicosuria normoglicemica può essere indotta, ad esempio, dalla sindrome di Fanconi, da patologie renali congenite o da insufficienza renale acuta associata a lesioni tubulari significative (Osborne, 1999).
La glicosuria, oltre a costituire un importante rilievo diagnostico, è in grado di comportare sequele anche gravi nel paziente come uno stato di disidratazione ed incremento dell’azotemia, in ragione della poliuria osmotica indotta dalla presenza del glucosio urinario.
Per correttezza, è necessario precisare che la misurazione dei livelli di glucosio urinario mediante le strisce reattive, una volta impiegate per monitorare la terapia del diabete mellito, sono stati oggi quasi totalmente rimpiazzati da strumenti maggiormente affidabili - i glucometri - che misurano i livelli di glicemia attraverso l’analisi di un’esigua quantità di sangue ottenuta per punzione del polpastrello digitale nell’uomo e per scarificazione della mucosa labiale o punzione del cuscinetto digitale nel cane e nel gatto, rispettivamente.
Infatti, la glicosuria è più difficilmente quantificabile rispetto alla glicemia ed è dipendente dal volume di urine emesse; in aggiunta a ciò, la comparsa di glucosio nelle urine si verifica sempre successivamente a livelli di glucosio ematico aumentati. Pertanto, il valore della misurazione della glicosuria con le strisce reattive è oggi quasi totalmente limitato ad un esame di screening (Israni, 2012).
Analogamente a quanto detto per il cane ed il gatto, anche nell’uomo, poiché la soglia renale per il glucosio è molto elevata (160-180 mg/dL), la presenza di livelli evidenziabili di glucosio nelle urine corrisponde a valori di glicemia pari a 210 mg/dL,
34 ben più prontamente individuabili con l’utilizzo di un glucometro. Senza dubbio, comunque, la presenza di glucosio nelle urine è un indicatore specifico della presenza di livelli sierici di glucosio oltre il normale range di riferimento.
1.4.3 Corpi chetonici.
I corpi chetonici sono sostanze di norma non presenti nelle urine, pertanto la loro rilevazione nel campione è sempre un reperto anormale (Fry, 2011). Questi metaboliti includono l’acido acetoacetico, l’acetone e l’acido β-idrossibutirrico. La valutazione di questi analiti è oltremodo importante in pazienti diabetici, in quanto la positività per i corpi chetonici in questi soggetti è indice dello sviluppo di chetoacidosi diabetica. Inoltre, la valutazione delle urine per questi composti può fornire un essenziale ausilio nel differenziare il coma diabetico da uno shock insulinico indotto farmacologicamente (Osborne, 1999).
La rilevazione della formazione di corpi chetonici è indicata in tutte quelle affezioni e condizioni cliniche associate ad un’aumentata gluconeogenesi e/o ad un eccessivo catabolismo lipidico; i meccanismi in grado di produrre la chetonuria possono essere ricondotti ad una compromessa capacità di utilizzare i carboidrati disponibili (diabete mellito), ad un inappropriato consumo dei carboidrati (stati di inedia, diete scorrette, esercizio fisico strenuo, esposizione prolungata ad ambienti eccessivamente freddi) e ad una perdita di glucidi (per altrerazioni delle strutture tubulari renali o per disordini dei processi digestivi).
La valutazione delle urine per i corpi chetonici nell’ultima fase della gestazione può essere d’aiuto nell’individuazione di uno stato gravidico tossiemico e di un’inadeguata gestione durante la gravidanza del diabete mellito (Osborne, 1999).
La presenza di acido aceto acetico ed acetone è routinariamente determinata con l’impiego del nitroprussiato, il quale, in ambiente alcalino, reagisce formando un composto viola scuro in presenza dei suddetti corpi chetonici. Per la precisione, il 96% della reazione cromatica che compare è dovuto alla presenza dell’acido acetoacetico, mentre l’acido β-idrossibutirrico non può affatto essere rilevato con il test del nitroprussiato.
La porzione rilevatrice dei chetoni posta sulle strisce reattive è molto sensibile agli effetti dell’umidità, del calore e della luce, quindi è importante riposizionare il tappo del
35 contenitore delle strisce non appena se ne è tolta una dall’interno per minimizzare i possibili falsi-negativi (Osborne, 1999).
Il piruvato, un altro chetone, è capace di produrre un’inusuale colorazione blu della porzione della striscia deputata al rilevamento dei corpi chetonici e può essere presente nelle urine in concentrazioni sufficienti per interferire con la rilevazione dei chetoni; sebbene l’escrezione di fenilchetoni con le urine in concentrazioni uguali o maggiori a 100 mg/dL possa causare reazioni cromatiche false-positive (colore arancio-rosso), una fenilchetonuria (condizione caratterizzata da alti tassi di fenilpiruvato nelle urine e di fenilalamina nel sangue dovuta a diversi tipi di mutazioni recessive di un gene localizzato sul cromosoma 12 dell’uomo) di questa entità è poco comune in medicina umana e non è addirittura mai stata evidenziata nel cane e nel gatto.
Sostanze contenenti gruppi sulfidrilici liberi come il captopropile, la d-penicillamina e l’amminoacido cistina possono dar luogo a risultati falsi-positivi (Osborne, 1999). In conclusione, la chetonuria non è un’evenienza molto comune nel cane (1,9%) e nel gatto (2,6%), mentre lo è abbastanza nei bovini da latte e nei suini.
Stati di chetonemia e chetonuria possono conseguire a qualsiasi disordine associato ad un sostanziale cambiamento della produzione di energia a partenza dai grassi anziché dai carboidrati (Osborne, 1999). I processi di gluconeogenesi diminuiscono le riserve di ossalacetato, il quale spinge l’acetilcoenzima A verso la produzione di corpi chetonici; quest’ultima conduce ad uno stato di acidosi metabolica in cui l’elevata concentrazione di idrogenioni produce la traslocazione degli ioni potassio nel comparto extracellulare e, quindi, nel plasma, con una sua conseguente deplezione dall’organismo.
Il diabete mellito non adeguatamente controllato rappresenta l’evenienza più frequente di chetonuria nei piccoli animali (Osborne, 1999). L’escrezione urinaria dei chetoni comporta l’instaurarsi di disordini elettrolitici anche importanti quali ipokaliemia e iponatriemia; la perdita di potassio, sodio e corpi chetonici con le urine non fa che incrementare l’osmolalità urinaria legata al glucosio, aumentando così l’entità della poliuria data dal diabete mellito (Osborne, 1999).
Un’aumentata concentrazione di acido β-idrossibutirrico può condurre ad un imponente stato di disidratazione, diminuendo significativamente la perfusione e l’ossigenazione tissutale; in questo caso, un grave stato chetosico può esitare nella rilevazione di una chetonuria di minima entità se la valutazione viene eseguita con il test del
36 nitroprussiato. Anche il digiuno, diete a basso contenuto glucidico o ad alto tenore lipidico (diete chetogeniche) sono altre possibili cause di chetonuria.
Animali di giovane età hanno una maggiore probabilità di sviluppare chetonuria come conseguenza del digiuno; l’esercizio fisico è in grado di produrre positività al test per la rilevazione dei corpi chetonici.
Le condizioni fisiopatologiche associate a chetonuria o a risultati falsi-positivi/negativi sono molteplici ed includono diabete mellito, alimentazione con restrizione dell’apporto glucidico, febbre, vomito frequente o persistente, somministrazione di ormone somatotropo, diete ad elevato contenuto lipidico e proteico, tireotossicosi, lattazione, ultimo trimestre gestazionale nella donna, digiuno, oltre alla presenza di acido butirrico, cisteina, paracetamolo, d-penicillamina, fenilchetoni e piruvato (Osborne, 1999).
1.4.4 Bilirubina.
La bilirubinuria può essere un indicatore precoce di disturbi a potenziale evoluzione itterica dal momento che il suo rilevamento con l’esame urinario di routine può talvolta precedere il riconoscimento clinico dell’ittero nella maggior parte delle specie; ma la sua assenza nelle urine non può escludere disordini associati al metabolismo della bilirubina.
Oltre alla sola filtrazione glomerulare, nella specie canina, i reni producono bilirubina causandone la comparsa nelle urine; questo fenomeno elimina l’associazione diretta della bilirubina sierica come unica causa di bilirubinuria nel cane (Osborne, 1999). Pertanto, l’elevato numero di risultati positivi per la bilirubinuria in mancanza di disturbi in grado di produrre potenzialmente una condizione itterica rende il test non specifico come screening nella specie canina.
Il rilevamento di anormali quantità di bilirubina nelle urine può essere utilizzato come un indice grossolano di epatotossicità causata da ausili terapeutici a potenziale effetto tossico. I test impiegati per la valutazione della bilirubina urinaria sono basati sulla diazoreazione; questa reagisce meglio con la bilirubina coniugata (diretta) rispetto a quella libera (che è meno solubile).
La bilirubina è un composto instabile che può ossidarsi spontaneamente a biliverdina, soprattutto se il campione viene lasciato per diverso tempo a temperatura ambiente; la biliverdina non può essere valutata con la diazoreazione, per questo motivo è opportuno
37 non agitare le urine in modo che i processi ossidativi vengano il più possibile evitati. Anche la luce diretta è in grado di degradare la bilirubina, risultando nella formazione di prodotti come i dipirroli che conferiscono pigmentazione alle urine, ma che non sono rilevati con la diazoreazione (Osborne, 1999).
La bilirubina è un metabolita di colore giallo-arancio intenso, derivante principalmente dal catabolismo del gruppo eme dell’emoglobina all’interno delle cellule reticolo-endoteliali; piccole quantità non derivano dalle cellule della serie eritroide , bensì dal fegato, da precursori delle emazie nel midollo osseo e dai processi metabolici del midollo osseo stesso, oltre che da proteine provviste di un gruppo eme come la mioglobina .
Una volta che il gruppo eme è stato liberato dalla struttura dell’emoglobina, esso è di solito metabolizzato in bilirubina in circa 3 ore (Osborne, 1999). La bilirubina formatasi come risultato delle degenerazione emoglobinica ad opera delle cellule reticolo-endoteliali è insolubile in acqua e si lega reversibilmente all’albumina, passando così in circolo; dal torrente ematico, la bilirubina raggiunge il rene, ma non oltrepassa la parete dei capillari del glomerulo in quanto legata all’albumina. In sede epatica, la bilirubina legata all’albumina viene rimossa dalla circolazione e coniugata con l’acido glucuronico o solforico, divenendo bilirubina coniugata o diretta (idrosolubile) in grado di oltrepassare con facilità la parete dei capillari glomerulari.
La maggior parte della bilirubina diretta viene trasportata con la bile attraverso il sistema biliare fino al tratto intestinale; ad ogni modo, una piccola frazione di bilirubina diretta sfugge dal fegato per prendere il torrente ematico (Osborne, 1999). La bilirubina eliminata nel piccolo intestino è trasformata in urobilinogeno (un composto tetrapirrolico incolore) ad opera dei microrganismi batterici; la maggior parte dell’urobilinogeno è infine ossidata ad urobilina, la quale conferisce il caratteristico colore scuro alle feci.
L’urobilina non può essere riassorbita, ma una frazione dell’urobilinogeno viene recuperata ed escreta con le urine. La bilirubina diretta che sfugge al filtro glomerulare può comparire nelle urine; la soglia renale per la clearance della bilirubina coniugata differisce apparentemente da una specie all’altra. La quantità di bilirubina eliminata con le urine di un gatto sano è insufficiente per dar luogo ad un risultato positivo; studi
38 effettuati nel cane hanno portato alla conclusione che la bilirubina venga prodotta anche dal rene all’interno dei tubuli.
Dal momento che è stata dimostrata la presenza dell’enzima glucoronil-transferasi a livello delle cellule tubulari renali, è verosimile la capacità di questi elementi cellulari di coniugare la bilirubina. Cani sani, specialmente se maschi interi (ma anche le femmine), tendono a manifestare bilirubinuria anche quando le concentrazioni sieriche della bilirubina sono normali (Osborne, 1999).
Anormali quantità di bilirubina diretta nelle urine possono essere dovute ad aumentata produzione a seguito di un’anomala eritrocateresi, di patologie epatocellulari e/o di ostruzione del dotto biliare; la combinazione di questi disturbi, assieme ad una disfunzione renale, arrecano difficoltà nell’identificazione quantitativa della bilirubinuria a causa delle alterazioni della soglia renale per l’escrezione dei pigmenti biliari. Concentrazioni anormali di bilirubina indiretta si verificano in condizioni associate a iperbilirubinemia (ad esempio, nell’anemia emolitica).
A causa del notevole numero di risultati falsi-positivi e negativi, i test comunemente disponibili per la bilirubina non sono affidabili come screening nel cane; trovano,invece, utilità nel gatto.
Quindi, nella specie canina, piccole quantità di bilirubina sono comunemente osservate nei campioni urinari ottenuti da cani normali; ciò è stato attribuito ad una bassa soglia renale per la bilirubina ma, attualmente, la bilirubinuria in assenza di bilirubinemia è da attribuirsi al catabolismo dell’emoglobina da parte del rene con la successiva escrezione di bilirubina coniugata con le urine. Nei gatti sani, invece, la bilirubinuria è un evento raro e sempre patologico, anche se compare in campioni molto concentrati; per cui, quando la si rileva ad un esame di controllo delle urine, non dovrebbe mai essere trascurata (Osborne, 1999).
Negli studi condotti presso l’Università del Minnesota, la bilirubinuria felina è stata associata a diverse tipi di affezioni tra cui diabete mellito, epatopatie primarie, FIP e disordini correlati con la leucemia felina; anche nel gatto, la bilirubinuria può anticipare la comparsa di iperbilirubinemia. Bilirubinuria di varia entità può essere associata ad emolisi intravascolare di grado tale da superare la capacità legante l’emoglobina dell’aptoglobina: in queste situazioni, nel gatto, la bilirubinuria si accompagna ad