INTRODUZIONE
L’ombelico è una potenziale via di accesso per gli agenti patogeni negli equini neonati. Nonostante le infiammazioni ombelicali non siano necessariamente all’origine di setticemie in puledri di età inferiore ai sette giorni, le infezioni delle strutture interne ombelicali sono associate a complicazioni, quali artrite settica, infezioni polmonari, meningite ed altre malattie infettive.
Per questo, la prevenzione e la diagnosi precoce delle infezioni ombelicali sono di grande importanza in neonatologia equina e rappresentano un passo decisivo nel successo del controllo delle malattie patologie del neonato. Alcune patologie neonatali infatti possono non essere individuabili ad un semplice esame clinico.
A livello della regione ombelicale si possono comunemente riscontrare sintomi classici come calore, gonfiore, dolore, formazione di essudato purulento in puledri malati; le infezioni della vena o delle arterie ombelicali o dell’uraco tuttavia, possono essere presenti anche quando tali sintomi sono assenti.
Il limite del coinvolgimento delle strutture ombelicali è difficile da stabilire mediante la semplice palpazione della parete ventrale dell’addome e dell’ombelico stesso, mentre la possibilità di poter visualizzare le sue strutture interne renderebbe la diagnosi più facile e sicura.
La finalità del presente studio è appunto quella di visualizzare l’immagine ecografica ed effettuare le misurazioni delle strutture ombelicali, in puledri clinicamente sani, al fine di utilizzare i ranges ottenuti come valori di riferimento nella valutazione di puledri con sospette patologie ombelicali.
Variazioni delle dimensioni medie del diametro o dello spessore delle pareti della insieme ad un’immagine ecografica anomala
(variazioni di ecogenicità, di limiti e confini delle strutture) fanno sospettare la presenza di un processo patologico.
L’ecografia delle strutture interne dell’ombelico permette quindi al clinico di determinare la compromissione di tali strutture e di predisporre un trattamento medico o l’intervento chirurgico più appropriato.
Inoltre la rilevazione della misura delle strutture ombelicali permette di correlare quantitativamente e significativamente i cambiamenti strutturali dell’ombelico con l’età dei puledri.
La valutazione ecografica è dunque in grado di determinare in modo precoce, efficace e non invasivo se l’ombelico è la sede di un possibile focolaio di infezione nel periodo neonatale.
Sulla base di tali ipotesi è stata condotta la ricerca mediante indagine ecografica esposta nel presente studio: essa ha coinvolto 23 puledri, nell’arco di tempo di due stagioni riproduttive.
1. ANATOMIA
1.1 Anatomia ombelicale.
L’ombelico si trova topograficamente nella regione ombelicale, posta ventralmente alla regione addominale media, sulla linea mediana.
Nel feto, la parete ventrale dell’addome a livello della linea alba presenta un orificio, l’anello ombelicale, in cui passano i vasi, i peduncoli dell’allantoide e il sacco vitellino (Nickel e Schummer, 1975). Tali strutture formano il cordone ombelicale, che, allungandosi, collega l’embrione al corion che a sua volta, stabilisce rapporti placentari con le pareti dell’utero (Bloom e Fawcett, 1996). L’anello ombelicale, dopo la rottura del cordone ombelicale, è destinato a chiudersi per cicatrizzazione nei primi giorni di vita e diventare così l’ombelico.
Il cordone ombelicale è costituito da tessuto connettivo mucoso, dotato cioè di una grande quantità di sostanza fondamentale amorfa, ricca di acido jaluronico. Questo tipo di tessuto, definito anche gelatina di Wharton, raro negli adulti, è comune nell’embrione e rappresenta la componente principale del cordone (Bloom e Fawcett, 1996).
Sono presenti quattro strutture interne all’ombelico: l’uraco, le due arterie ombelicali e la vena ombelicale; sono strutture piccole e si trovano 1 o 2 cm al di sotto della superficie addominale.
L’uraco (o dotto allantoideo) è un canale presente nel feto che
mette in comunicazione la vescica con l’allantoide (che si trova all’esterno del feto); la sua funzione consiste nel trasporto di urina dalla vescica fetale alla cavità allantoidea. L’uraco è sorretto dal
legamento mediano della vescica il quale si estende dal pavimento
l’uraco diventa uno spazio virtuale a causa della parete molto sottile e dell’assenza del contenuto fluido (Reef, 1998).
Le arterie ombelicali hanno la funzione di portare il sangue refluo
dal feto alla placenta. Esse originano dall’A. pudenda interna, dorsalmente nella regione dell’apertura craniale della pelvi. Entrano ciascuna nel rispettivo legamento laterale ai lati della vescica e si dirigono cranialmente alla sua sommità dove prendono contatto con l’uraco (Nickel e Schummer, 1975). Sia nel feto che nel neonato, le arterie accompagnano l’uraco verso l’ombelico, il tutto avvolto da un involucro di tessuto connettivo mucoso (Reef e Collatos, 1988). Le arterie hanno una parete spessa ed un diametro costante per tutta la loro lunghezza di circa 12 mm (Reef e Collatos, 1988).
La vena ombelicale ha la funzione di portare sangue dalla placenta
al fegato fetale. Essa decorre lungo il piano sagittale mediano dal residuo ombelicale fino al fegato, dove determina ventralmente al
solco della vena ombelicale; è un piccolo vaso ovale o ellittico che
misura circa 10mm di diametro a livello dell’ombelico a all’ingresso nel fegato, ma che tende ad assottigliarsi leggermente a metà del decorso.
1.2 Involuzione delle strutture ombelicali post-partum.
Al momento del parto, la rottura del cordone ombelicale avviene per strappamento; in questo modo si ha la retrazione e la chiusura dell’uraco e delle arterie, dovute alla componente elastica delle loro pareti. Ciò non avviene invece per la vena, la cui parete, invece, ha una componente muscolare ed elastica più ridotta.
Dopo alcuni giorni dalla nascita, il peduncolo ombelicale tende ad asciugarsi e dopo circa due settimane si stacca dalla parete addominale ventrale, mentre le strutture interne vanno incontro ad un processo di atrofizzazione.
L’uraco, in seguito allo strappamento del cordone, si ritrae in prossimità dell’anello ombelicale, chiudendosi (uraco obliterato). Successivamente si atrofizza diventando parte del legamento
mediano della vescica (Reef e Collatos, 1988). Il residuo della parte
caudale dell’uraco si presenta come una specie di cicatrice a livello dell’apice della vescica stessa.
Le arterie ombelicali si ritirano fino a 6 cm nel tessuto connettivo, oltre l’anello ombelicale interno. Sempre per la loro componente elastica le arterie si chiudono, incappucciandosi su se stesse. Immediatamente dopo la nascita, per breve tempo, le arterie sono grosse e regrediscono nelle prime settimane di vita dall’ombelico alla vescica. Nel lume sono presenti coaguli di sangue e le loro pulsazioni possono essere scoperte fino a 24h. Nel tratto craniale, le arterie si atrofizzano diventando il legamento rotondo della vescica, mentre nel tratto più caudale i residui delle arterie diventano parte dei legamenti laterali della vescica lungo i lati della vescica stessa. Alla la nascita la vena rimane all’interno del peduncolo ombelicale senza ritirarsi. In seguito si ha una graduale obliterazione del lume della vena dovuta alla proliferazione del tessuto connettivo ed alla contrazione della parete del vaso. Progressivamente la vena si atrofizza formando il legamento rotondo del fegato, il quale va a
1.3 Circolazione fetale.
Nel feto il 55% della gittata cardiaca viene indirizzato alla placenta attraverso l’aorta, passando dalle arterie pudende interne per giungere alle arterie ombelicali. In questi vasi, la saturazione di O2 è pari al 60%. Il sangue che transita nella vena ombelicale presenta una saturazione di O2 del 80%. Al momento della nascita la circolazione placentare cessa e il neonato va in asfissia; ciò stimola quegli atti respiratori necessari ad espandere i polmoni. Nel passaggio dalla circolazione fetale alla circolazione neonatale si ha la contrazione dei vasi ombelicali e del dotto arterioso, nella quale sembra essere coinvolta la bradichinina (Bloom e Fawcett).
2. ECOGRAFIA
2.1 INTRODUZIONE ALL’ESAME ECOGRAFICO
Nell’ambito della clinica di campo, la diagnosi delle malattie del puledro si basa quasi esclusivamente sull’esame fisico. Poiché i sintomi di malattia di un equino neonato sono spesso vaghi e non localizzati, la diagnosi può essere problematica. Questa condizione spesso causa errori di interpretazione e può portare ad una profilassi e terapia inefficaci. La diagnostica per immagine può essere, allora, una tecnica utile per osservare l’addome del puledro nelle condizioni di campo (Behn C. e Bostedt H., 2000).
La valutazione ecografica degli organi addominali è particolarmente utile nei puledri, visto che altre tecniche diagnostiche sono scarsamente applicabili a causa della mole dell’addome. Infatti la minore dimensione dell’addome del puledro e la vicinanza degli organi alla parete addominale, unite ad un’alta incidenza di malattie intestinali, rendono il puledro il paziente ideale per l’esame ecografico rispetto, ad esempio, al cavallo adulto (Reef, 1998).
Le immagini ecografiche offrono una “finestra” per una visualizzazione non invasiva degli organi addominali, altrimenti difficilmente valutabili. Esse quindi permettono al veterinario di determinare se sia più opportuna una terapia medica piuttosto che un intervento chirurgico, di formulare una prognosi e di monitorare la risposta al trattamento medico (Reef, 2003).
Inizialmente la tecnica ecografica è stata sfruttata per lo studio delle strutture ombelicali e per la diagnosi delle patologie connesse. Successivamente si è sviluppata come tecnica diagnostica d’elezione per un’ampia varietà di malattie neonatali: in particolare in caso di uroperitoneo, di disordini gastrointestinali e di infezioni ombelicali (Reef, 1998).
Poiché le strutture ombelicali sono vicine 1-2cm alla superficie della pelle, nel neonato sono facilmente rappresentabili mediante l’ecografia, mentre in puledri maggiori di 2 mesi non sono più visibili a causa dei cambiamenti morfologici (quali l’ispessimento della parete addominale e lo spostamento di fegato e vescica nella cavità addominale), e ritornano ad essere visibili solo quando sono sede di processi patologici (Reef e Collatos, 1988).
Infine l’ecografia può essere usata per correlare il cambiamento delle dimensioni dei diametri dei vasi ombelicali con l’età dei puledri, poiché a parità di età, la variazione delle dimensioni può essere sintomo di una patologia in corso. E’ necessario, quindi possedere dati specifici sull’aspetto e sulle dimensioni delle strutture ombelicali nei primi 7-8gg di vita, considerando che le patologie ombelicali si sviluppano principalmente nelle prime 2 settimane di vita.
2.2 TECNICA DELL’ESAME ECOGRAFICO.
2.2.1 Strumenti: ecografo e sonda.
L’esame delle strutture interne al residuo ombelicale e della vescica viene eseguito con un ecografo portatile che disponga di una sonda da 7.5-10 MHz. dotata di un fluido incorporato o di un distanziatore interposto manualmente e che raggiunga una profondità da 4 a 6cm. Per la visualizzazione di strutture più superficiali si possono utilizzare distanziatori interposti manualmente o sonde già predisposte di distanziatori. Una sonda standard di 7,5-MHz permette una maggiore risoluzione dell’immagine di queste strutture e può essere usata per valutarle clinicamente qualora sia presente un rigonfiamento del peduncolo ombelicale, un’ernia ombelicale. Una sonda a banda larga di 6.0-MHz microconvex oppure anche una sonda di 5.0-MHz possono essere usate, invece, per valutare interamente tutto il tratto gastro-intestinale, offrendo inoltre una qualità migliore dell’immagine. Infatti maggiore è la frequenza della sonda, minore è la penetrazione degli ultrasuoni all’interno dell’area in esame e minore è la profondità dell’immagine ottenuta (Reef, 1998).
Nelle condizioni di campo dunque è preferibile usare un ecografo che disponga sia di una sonda da 7,5-MHz che da 5.0-MHz per poter esaminare adeguatamente tutta la cavità addominale (Behn C. e Bostedt H., 2000). Le sonde lineari usate nella clinica ginecologica forniscono importanti informazioni ed immagini, ma risulta difficile mantenere un buon contatto con la superficie cutanea in esame. Le sonde convex si adattano bene a questo tipo di applicazione (Behn C. e Bostedt H., 2000).
2.2.2 Preparazione del paziente.
L’esame ecografico dell’addome è solitamente ben tollerato dal puledro e la sedazione raramente necessaria, se non per rendere più docile un soggetto intrattabile. E’ necessario comunque portare il puledro ad una condizione di tranquillità e a questo scopo esistono procedure per la contenzione e l’atterramento:
- si prende il puledro mettendo un braccio sotto la gola e tenendo la coda ripiegata verso il dorso con l’altro braccio;
- si afferra il muso del puledro ruotandolo verso i posteriori, mentre si esercita una pressione su di essi con l’altro braccio;
- il puledro si abbassa all’indietro appoggiandosi all’operatore e scende nella posizione di decubito;
- si afferrano gli arti anteriori appoggiando l’avambraccio sul collo del puledro e con l’altra mano si afferrano gli arti posteriori;
- il puledro viene mantenuto disteso finché è completamente rilassato; può essere utile bendare il puledro per frenare l’agitazione;
- è preferibile mettere il puledro in decubito laterale sinistro. Generalmente tutti i puledri si calmano nell’arco di pochi minuti. Tuttavia si può rendere necessario un trattamento farmacologico per poter contenere in sicurezza puledri. E’ indicato per quelli che pur essendo di età inferiore ai 15gg sono particolarmente esuberanti o hanno già raggiunto una mole considerevole, come nel caso dei puledri TPR, oppure per puledri più grandi, di un mese e oltre di età, che per forza e peso sarebbe impossibile abbattere fisicamente. Il farmaco d’elezione per la sedazione di questi soggetti è il diazepam alla dose di 0,1-0,4 mg/kg ev.
In altri casi, invece, può essere necessario sedare leggermente la fattrice perchè a volte tollera male la presenza degli operatori attorno al puledro e le manovre di atterramento, agitandosi e diventando una minaccia per le persone e per gli strumenti. I
farmaci più adatti sono la Xilazina alla dose di 0,2-1,1 mg/kg ev, la Detomidina alla dose di 0,005-0,02 mg/kg oppure la Romefidina alla dose di 0,08-1 mg/kg ev.
E’ possibile, a discrezione, effettuare la tosatura della regione oppure procedere direttamente all’esame diagnostico senza che la visualizzazione delle strutture in esame venga alterata.
Se si decide di non tagliare il pelo, allora la porzione di regione ombelicale in esame viene bagnata con alcool ed il pelo disteso manualmente secondo la sua direzione. L’utilizzo di alcool etilico ha la funzione principale di rimuovere l’aria tra i peli, che altrimenti interferirebbe con gli ultrasuoni della sonda, generando degli artefatti e quindi un’immagine falsa. Inoltre la cute viene sgrassata e lavata dalla polvere e da corpuscoli.
Per facilitare l’esame della vena ombelicale si può procedere alla tosatura di una striscia ampia 5-6 cm lungo la linea mediana ventrale, partendo dal peduncolo ombelicale, cranialmente verso il processo xifoideo. Per visualizzare invece tutto il decorso dell’uraco, delle arterie e la vescica, si continua la tosatura caudalmente all’ombelico di una striscia ampia 5cm fino al prepuzio e poi lateralmente fino all’incavo delle cosce (Fig. 1-A)
In aggiunta si può eseguire una tosatura più ampia, dall’ombelico verso ciascuno degli anelli inguinali, per un esame ecografico generale dell’addome (Reef e Collatos, 1988) (Fig 1-B).
Una rappresentazione dell’area interessata dalla tosatura è riportata nella figura 1.
Figura 1. tosatura pelo (Reef, 1998)
La preparazione del paziente si conclude con una accurata rimozione dei peli, con la pulizia della superficie con alcool che favorisce anche lo sgrassamento della cute ed infine con l’applicazione di un gel per ecografia. La rasatura dell’addome non è molto gradita, ma viene tollerata dalla maggior parte dei puledri, anche senza sedazione, mentre l’uso di acqua calda per la pulizia dell’addome e di gel riscaldato è meglio tollerato (Reef, 1998).
L’esame ecografico dell’ombelico viene effettuato più facilmente nel puledro vigile e in stazione quadrupedale quando gli organi interni giacciono sul pavimento addominale ed il gas contenuto al loro interno sale, senza interferire con l’esame. Anche le strutture ombelicali vengono rintracciate più facilmente in questa posizione. Nel puledro in decubito laterale, invece, le arterie, l’uraco e parte del tratto della vena scivolano lateralmente al piano sagittale mediano e si allontanano leggermente dal pavimento ventrale dell’addome. Questa posizione rende il peduncolo ombelicale più difficile da trovare e seguire ecograficamente, a causa delle sue piccole dimensioni nel puledro neonato. Anche l’esame della vescica è praticabile più facilmente nel puledro in stazione, perché il peso
dell’urina sposta contro il pavimento addominale la vescica che, a sua volta, spinge le anse intestinali piene di gas in posizione dorsale. Nel puledro coricato, la vescica scende ventralmente oltre la linea mediana, ma rimane facilmente localizzabile per dimensioni ed aspetto.
2.2.3 Punti di repere.
L’esame ecografico comprende una valutazione completa delle vestigia ombelicali e delle strutture interne lungo il loro intero decorso. La letteratura individua alcune aree anatomiche di riferimento dove è più opportuno eseguire l’esame ecografico.
La vena ombelicale viene sondata interamente partendo dal peduncolo ombelicale fino all’ingresso nel fegato in sezione trasversale. Vengono prese le immagini e la misura del diametro del vaso appena cranialmente al peduncolo ombelicale, all’altezza dell’entrata nel fegato e a metà tra questi due estremi (Reef, 1998). Occorre ricordare che la vena è di forma ovale ed il suo diametro si ottiene dalla media dell’asse verticale e dell’asse orizzontale (Reef e Collatos, 1988). La vena può essere seguita anche in sezione longitudinale, ma ciò risulta più difficile (Reef, 1998) (Fig. 2).
L’uraco e le arterie vengono esaminati insieme, a partire dal peduncolo ombelicale fino all’apice della vescica. La misura dei loro diametri viene registrata a livello dell’apice vescicale, considerando, per l’uraco, sia l’asse verticale che l’asse orizzontale. Inoltre è possibile eseguire anche una sezione longitudinale dell’uraco per verificare la presenza di un eventuale diverticolo uracale o di un uraco pervio (Fig. 2).
Le arterie possono essere sondate ulteriormente seguendo il percorso di ciascuna di esse lungo i lati della vescica fino a quando non sono più visibili. La misura del loro diametro si prende più caudalmente possibile, vicino all’arteria iliaca (Reef, 1998) (Fig. 2). La misura del diametro di ciascun vaso, a livello dei siti di misurazione, è dato dalla media matematica dell’altezza e della larghezza. Per ogni sito di misurazione, inoltre, l’immagine ecografica viene registrata, per poter valutare l’aspetto delle strutture rappresentate e per permettere il confronto ad un controllo successivo.
Un esame completo dell’uraco comporta anche l’esplorazione della vescica. La vescica viene sondata sia in sezione trasversale che longitudinale; di essa vengono esaminati soprattutto l’apice dove si congiunge l’uraco, la parete vescicale e lo spazio retroperitoneale, in particolare intorno all’ombelico. Viene inoltre valutata l’ecogenicità dell’urina per rilevare la presenza di calcoli o contenuti anomali (Reef, 1998).
Figura 2. Decorso intraddominale di vena ed arterie ombelicali ed uraco. Note: Vena=viola;
Arteria=rossa; Uraco=giallo.
2.3 ANATOMIA ECOGRAFICA.
La diagnostica ecografica permette al clinico di accertare le caratteristiche e le condizioni delle strutture interne all’ombelico. La completa comprensione dell’anatomia ecografica delle strutture ombelicali e le loro dimensioni in puledri clinicamente sani è il punto di partenza nella valutazione di sospette patologie del tratto ombelicale (Reef e Collatos, 1988).
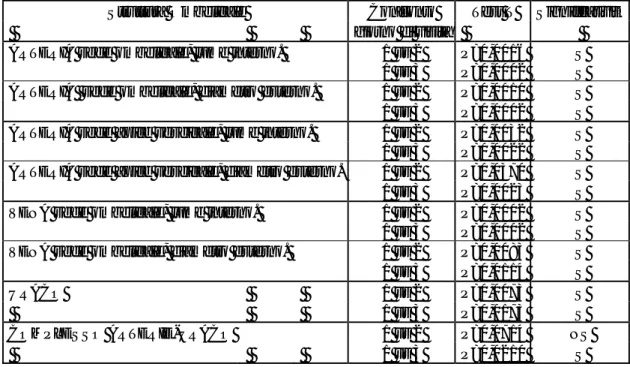
Le strutture di interesse (uraco, arteria e vena ombelicale) sono facilmente visualizzabili poiché poggiano sul pavimento addominale, circa 2cm al di sotto della superficie cutanea. L’addome dovrebbe essere sempre esaminato dalla posizione più ventrale, sia in condizioni normali, sia in condizioni patologiche. Nell’animale sano, infatti, il gas presente nelle viscere gastrointestinali sale dorsalmente ed è meno probabile che interferisca con l’esame. Anche in una condizione patologica del tratto intestinale, quando le anse, rese pesanti dai liquidi, cadono sul pavimento addominale, l’individuazione delle strutture ombelicali è possibile (Reef, 1998). L’osservazione del residuo ombelicale e delle sue strutture interne è migliore nei primi 7-10gg post-partum, perchè poi subiscono un processo di atrofizzazione: le vestigia del peduncolo ombelicale si staccano dalla pelle dell’addome e le strutture interne diventano normali legamenti all’interno della cavità addominale(Reef, 1998); tuttavia possono essere visibili al massimo fino ad un mese di età. La vena ombelicale si presenta come un piccolo vaso ellittico dove il diametro orizzontale è maggiore di quello verticale. E’ ben visibile lungo il piano sagittale mediano e si presenta con una parete ecogena sottile; in alcuni puledri di età maggiore è possibile rilevare al centro anche del materiale ecogeno. Le sue dimensioni non sono sempre costanti: essa è leggermente più grande appena cranialmente all’ombelico e all’ingresso nel fegato, mentre è poco più piccola al centro del suo percorso. Il diametro viene misurato comprendendo lume e parete vasale. Il diametro medio della vena è
di 0,6±0,20cm appena cranialmente all’ombelico, 0,53±0,19cm a metà tra ombelico e fegato e 0,6±1,9cm al fegato (Reef e Collatos, 1988) (Fig. 4).
Le arterie ombelicali sono vasi a sezione circolare. Presentano una parete vasale ecogenica spessa ed un centro che può variare da ipoecogeno ad ecogeno, per la presenza di un coagulo di sangue. Infatti subito dopo il parto esse contengono sangue fluido e nelle prime 24h post-partum alcune pulsazioni sono ancora apprezzabili ecograficamente. Le arterie, a causa dello spessore della parete, hanno dimensioni maggiori rispetto alla vena ombelicale e vengono misurate individualmente lungo i lati della vescica. Il loro diametro medio è di 0,85±0,21cm (Fig. 5).
L’uraco è uno spazio virtuale e non contiene liquidi in puledri sani, quindi non è una struttura ben definita nell’immagine ecografica, ma appare come uno spazio di tessuto ipoecogeno delimitato dalle due arterie. Per questo motivo l’uraco viene misurato assieme alle arterie come una struttura unica. Il sito di misurazione è a livello dell’apice della vescica e il diametro medio registrato è di 1,75±0,37. La struttura “uraco + arterie” è visibile nella maggior parte dei puledri fino a 4 settimane di vita per poi scomparire a causa dell’aumento di volume del grosso colon tra la 4° e l’8° settimana(Reef e Collatos, 1988; Reef, 1998) (Fig. 6).
La vescica infine è una organo facile da sondare e si presenta come una struttura da rotonda ad ovale con un contenuto anecogeno delimitato da una parete ecogena, il cui spessore varia in base al grado di replezione. La posizione può variare: nel neonato si trova pochi centimetri caudale all’ombelico, mentre in puledri più grandi tende ad avvicinarsi alla pelvi. La parte anatomica più importante da indagare è l’apice della vescica dove si connette l’uraco. L’apice dovrebbe avere un profilo circolare senza soluzioni di continuità e nei puledri maggiori di un mese si dovrebbe poter vedere una
piccola cicatrice ecogena che indica la definitiva involuzione del tratto caudale dell’uraco (Nickel e Schummer, 1975L).
Figura 4. Vena ombelicale, sezione trasversale.
Figura 5. Arterie ombelicali e vescica, sezione trasversale.
3. PATOLOGIE OMBELICALI Le patologie ombelicali includono:
• Infezioni ombelicali;
• Uraco persistente e patente; • Cisti e diverticoli dell’uraco; • Ernia ombelicale.
I segni clinici spesso sono generici e simili per le diverse patologie, perché è lo stesso organo ad avere un numero limitato di possibilità di manifestare diversamente le varie patologie. Tuttavia alcuni dei sintomi rilevabili più frequentemente possono aiutare a formulare una prima diagnosi differenziale, essi sono:
ANURIA DISURIA STRANGURIA POLLACHIURIA OMBELICO UMIDO e DERMATITE TUMEFAZIONE OMBELICALE INFEZIONE SISTEMICA • Rottura della vescica o delle vie urinarie; • Insufficienza renale. • Onfaloarteriti; • Onfaloflebiti; • Urachiti; • Diverticlolo o cisti uracale. • Uraco persistente; • Uraco patente. • Infezione; • Flemmone; • Ernia; • Trauma. • Onfaloflebite; • Onfaloarterite; • Urachite.
La diagnosi si raggiunge basandosi sui dati anamnestici, sull’esame clinico generale e particolare sul peduncolo ombelicale e sull’esame ecografico.
I dati così raccolti hanno valore diagnostico se vengono confrontati tra loro in maniera comparata. Una diagnosi fondata solo sull’esame clinico può essere fatta se i sintomi si mostrano in maniera evidente, ovvero se dall’ombelico fuoriesce essudato materiale purulento, oppure se è possibile apprezzare calore, gonfiore e dolorabilità alla palpazione.
Molte altre alterazioni, invece, possono sfuggire all’esame fisico perché le strutture ombelicali apprezzabili esternamente sono solo la più piccola parte. Quindi la possibilità di affiancare la diagnostica ecografica, senza attribuirne un’efficacia risolutiva assoluta, permette una indagine più accurata e una diagnosi più sicura. (HOLDSTOCK, 2004)
Questa considerazione è dimostrata anche da uno studio che raccoglie l’esperienza di due anni di diagnosi di patologie ombelicali, nel quale è stato constatato che, al momento dell’esame ecografico, le alterazioni ombelicali erano palpabili solo nel 30% dei casi con ascessi ombelicali interni.
3.1 INFEZIONI OMBELICALI
Le infezioni a carico delle strutture ombelicali prendono il nome di
onfaloflebiti, onfaloarteriti, urachiti o onfaliti, a seconda che la sede
colpita sia la vena, le arterie, l’uraco o l’ombelico nel suo complesso.
Eziologia. L’infezione delle strutture ombelicali interne, con o senza
il coinvolgimento del residuo ombelicale esterno, è un problema frequente nei puledri neonati. L’infezione si sviluppa generalmente nelle prime 2 settimane di vita, ma possono essere colpiti puledri anche fino a 2 mesi di età. In letteratura viene riportato un caso in cui un infezione alle strutture ombelicali interne è stata scoperta all’età di 16 mesi.
La porta di ingresso dell’infezione è il punto di rottura del cordone ombelicale dove non c’è la copertura cutanea ed il contagio avviene per contatto con l’ambiente contaminato. Tuttavia studi recenti ritengono molto probabile che l’ingresso dei batteri avvenga invece a livello intestinale e che vi sia una deposizione di patogeni a livello dei trombi nei vasi ombelicali, a seguito di batteriemia o pioemia. A sostegno di questa teoria sta il fatto che, nei primi giorni di vita, i canali dell’epitelio duodenale rimangono pervi per permettere l’assorbimento delle macro-molecole proteiche del colostro. (HOLDSTOCK, 2004).
Gli agenti eziologici sono aspecifici, sono di natura batterica soprattutto Gram-negativi. Presumibilmente l’origine di tali agenti è esogena e con una successiva virulentazione anche di quelli saprofiti. Rhodococcus equi e Streptococcus equi sono batteri specifici e possono essere gli agenti causali anche di infezioni ombelicali. Essi sono associati allo sviluppo di ascessi addominali, localizzabili soprattutto a livello della parete addominale ventrale (Reef, 1998).
Segni clinici. Il quadro clinico generale del puledro può non essere
significativo, poiché i sintomi sono spesso generici. Possono andare da reperti accidentali, in puledri altrimenti sani, a febbre, depressione e anoressia in quelli malati.
L’esame obiettivo particolare può essere più indicativo: si possono osservare colìo sieroso o purulento, tumefazione del peduncolo esterno ed edema periombelicale (sottocute e connettivo mucoso perivascolare.
Diagnosi. E’ possibile eseguire una emocultura da un campione di
sangue che permette di stabilire se sono presenti degli agenti infettanti e quali sono. In concomitanza di altre patologie, quali un’artrite settica, pneumonia, una setticemia, è utile prendere un campione da ogni infezione e testare la sensibilità dei patogeni, perchè queste patologie spesso originano dai microrganismi presenti nelle infezioni ombelicali (Reef, 1998).
L’esame ematologico rivela neutrofilia, leucocitosi e un livello alto di fibrinogeno. Si può riscontrare anche un basso livello di IgG (<8g/L) (HOLDSTOCK, 2004) in quei puledri a cui è mancato il trasferimento dell’immunità passiva.
L’ecografia è il mezzo diagnostico che permette una diagnosi migliore: un aumento delle dimensioni delle strutture ombelicali interne, insieme ad un cambiamento del loro aspetto ecografico sono indice di uno stato infettivo (Reef, 1998)).
Reperti ecografici. Quando la vena ombelicale è sede di una
infezione, si presenta aumentata di diametro (>10mm). Il lume contiene materiale che appare da ipoecogeno ad ecogeno, talvolta è però possibile che il materiale purulento appaia anecogeno. Possono essere presenti echi iperecogeni che indicano la presenza di una infezione anaerobica. La parete si può presentare ispessita e ciò avviene più spesso durante infezioni persistenti.
In genere il diametro della vena è aumentato a livello del peduncolo ombelicale, mentre tende a ridursi, ritornando ad avere dimensioni
ed aspetto eografico normali, procedendo cranialmente. Infatti le infezioni ombelicali difficilmente raggiungono il fegato; nel caso in cui invece, l’infezione si estendesse si possono generare ascessi epatici o epatite. Per questo motivo è importante non trascurare gli organi connessi anatomicamente alle strutture ombelicali in esame. Anche le arterie ombelicali nel corso di un’infezione si ingrandiscono (>13mm). La parete vasale può essere ispessita e presentarsi ecogena o anche ipoecogena. Anche le strutture circostanti possono essere aumentate di volume. Di solito il lume delle arterie contiene materiale liquido ipoecogeno, mentre in quelle infette si presenta disteso e con materiale ecogeno o iperecogeno. L’aumento delle dimensioni delle arterie si apprezza appena caudalmente all’ombelico e all’apice della vescica, mentre ritorna ad avere dimensioni normali lungo il decorso ai lati della vescica.
L’uraco nel corso di un’infezione si presenta aumentato e tende a riempirsi di detriti cellulari. Il materiale fluido contenuto può variare molto nell’aspetto: anecogeno, ipoecogeno o ecogeno. Si possono individuare echi iperecogeni che indicano presenza di gas suggestivo di una infezione anaerobica. L’uraco può aumentare di volume lungo tutto il tratto dal peduncolo ombelicale all’apice della vescica, ma più frequentemente agli estremi e nel mezzo. La migliore visualizzazione dell’uraco insieme all’apice della vescica si ottiene disponendo la sonda sul piano sagittale mediano, così da avere sullo schermo entrambe la strutture.
L’apice vescicale è anche il punto di repere per poter accertare la presenza di un processo patologico a carico di uraco ed arterie. Si misura il diametro complessivo della struttura formata da arterie e uraco, ottenuta su un piano di scansione trasversale; se le dimensioni sono superiori a 25 mm ciò suggerisce la presenza di un’infezione. L’uraco e le arterie ombelicali sono colpiti da infezioni più spesso rispetto alla vena ombelicale.
Frequentemente, in puledri malati, vengono colpite anche più strutture nello stesso momento.
E’ indicato esaminare ecograficamente anche le strutture circostanti, in quanto l’infezione potrebbe coinvolgerle per contiguità.
La vescica può essere interessata sia esternamente che internamente da una infezione originatasi da una delle strutture ombelicali interne.
Il coinvolgimento della parete esterna può portare ad una cistite necrotica. La parete si presenta ispessita e “rigida”, l’ecogenicità è di solito aumentata, come conseguenza dell’infiltrazione di cellule infiammatorie e della necrosi. La necrosi della parete è un fenomeno diffusivo e ciò può portare alla compromissione di una buona parte dell’organo ed alla sua rottura con conseguente uroperitoneo, soprattutto se viene interessato l’apice vescicale, che è più soggetto alle alterazioni dell’uraco. L’alterazione patologica della superficie dell’organo, inoltre, può provocare peritonite, fenomeni aderenziali con gli altri organi addominali e con il peritoneo stesso (Reef, 1998).
Internamente alla vescica si può visualizzare un aspetto ecografico compatibile con un quadro di cistite che è un reperto spesso concomitante all’infiammazione dell’uraco. In questo caso è possibile osservare un aumento dell’ecogenicità dell’urina dovuta all’aumento del contenuto cellulare conseguente all’infezione; si possono rilevare detriti cellulari a partire dall’uraco fino all’interno della vescica, adagiati sulla sua porzione ventrale. Mentre invece l’urina che fuoriesce attraverso la minzione appare normale.
Le complicazioni dell’infezione comprendono ascessi ombelicali, peritoniti localizzate e aderenze per rottura degli ascessi, uraco pervio, onfaliti, onfaloflebiti, onfaloarteriti. Eventualmente il puledro può presentare, contemporaneamente alle alterazioni ombelicali, anche sindromi neonatali quali, setticemia neonatale, artrite settica,
osteomielite o sindromi respiratorie; in questo caso è importante poter stabilire se l’infezione ombelicale è all’origine del processo patologico. La diffusione delle infezioni ombelicali può colpire altri organi come le meningi, gli occhi, le valvole cardiache.
Infine l’ascite e la peritonite possono essere delle complicazioni ad infezioni ombelicali, si rimanda al capitolo rispettivo per un approfondimento.
Diagnosi differenziali.
• Traumi e emorragia ombelicale; • Uraco pervio e patente;
• Ernia ombelicale;
• Flemmone localizzato alla regione ombelicale.(E. EONATOLOGY)
Terapia. Le infezioni ombelicali possono essere trattate sia
clinicamente che chirurgicamente. La scelta dipende da alcuni fattori:
• numero e dimensione delle strutture coinvolte;
• costo e possibilità di somministrazione degli antibiotici;
• costo e possibilità di monitoraggio della risposta del paziente; • presenza contemporanea di altre malattie debilitanti.
Il trattamento medico è indicato per i casi in cui:
• l’infezione interessa il moncone ombelicale esterno e mentre le strutture interne sono normali;
• le condizioni generali del puledro sono stabili e l’infezione è stata diagnosticata al suo esordio;
• non sono interessate più strutture contemporaneamente; • non sono presenti ascessi di grosse dimensioni.
Il trattamento iniziale è d’attacco, per mezzo di una copertura antibiotica forte e ad ampio spettro. I batteri generalmente presenti in corso di setticemia neotale sembrano essere sensibili soprattutto alla penicillina. Altrimenti, nel caso di infezioni minori e più localizzate, è possibile somministrare sulfamidici che hanno il
vantaggio di essere meno costosi e di poter essere somministrati per via orale. Se l’infezione progredisce nonostante il trattamento antibiotico di 14-21 giorni si può pensare all’intervento chirurgico.(Holdstock, 2004)
L’intervento chirurgico è indicato quando:
• il puledri è stato trattato con una terapia aggressiva ma senza mostrare miglioramenti;
• in presenza di patologie secondarie a diffusione batterica dall’ombelico (es. artrite settica);
• sono coinvolte più strutture;
• le loro dimensioni aumentano fino a raddoppiare;
• prevenzione dell’uroperitoneo nell’infezione delle arterie ombelicali e dell’uraco;
• è pianificato un’altro intervento chirurgico (es. stripping periostale).
L’intervento chirurgico offre due vantaggi importanti: la risoluzione della malattia in breve tempo e la riduzione del pericolo di diffusione della malattia. Mentre gli svantaggi sono la necessità di conoscere dettagliatamente le parti anatomiche interessate, il ricorso all’anestesia in un puledro già ammalato, la possibilità di disseminare l’infezione se vengono coinvolti tessuti patologici ed infine il pericolo se strutture vitali (aorta e fegato) sono interessate dal fenomeno settico (Holdstock, 2004).
Le strutture ombelicali rimosse chirurgicamente vanno sottoposte ad esami di laboratorio per poter risalire agli agenti patogeni, perché spesso sono gli stessi che determinano altre eventuali patologie concomitanti.
La marsupializzazione è un intervento particolare che può essere praticato nel caso di una infezione della vena ombelicale. Infatti spesso non è possibile procedere alla rimozione completa di tutti i tessuti infetti quando l’infezione si spinge fino al fegato o addirittura lo coinvolge (Reef, 1998).
Prognosi. I puledri hanno una prognosi favorevole se le infezioni
ombelicali interne od esterne sono trattate in maniera aggressiva con antibiotici ad ampio spettro d’azione e se il decorso viene monitorato sia clinicamente che ecograficamente. Il follow up ecografico dura almeno da 3 a 5 giorni.
Invece se l’infezione interessa la vena ombelicale la prognosi deve essere più cauta: è probabile una diffusione dell’infezione, soprattutto al fegato, che rende l’intervento chirurgico e il drenaggio dei liquidi patologici più difficile, per il pericolo di contaminare il peritoneo e la cavità addominale.
Profilassi. La profilassi è di tipo igienico: è importante evitare il più
possibile che il puledro ingerisca batteri Gram-negativi. La principale fonte di contagio sono le feci della madre. Di conseguenza altre fonti diventano i capezzoli della madre, che possono contaminarsi al contatto con la lettiera, e la placenta, perché la madre spesso defeca al momento del parto. Una corretta profilassi igienica prevede l’intervento sulla madre affinché venga pulita prima del parto, ed uno sul neonato attraverso la disinfezione del moncone ombelicale con la tintura di Iodio al 2% durante le prime 24h di vita.(HOLDSTOCK, 2004).
Considerazioni conclusive. Da quanto detto si deduce che la
pericolosità delle infezioni ombelicali non è data solo dalle alterazioni locali (le strutture ombelicali e quelle contigue), ma anche dalla possibilità che tali infezioni si propaghino, assumendo così un carattere sistemico. Un accertamento precoce delle alterazioni dell’ombelico può essere quindi decisivo per il successo nella gestione sanitaria del neonato: cioè un’infezione ombelicale può essere già presente anche quando altri siti sono sede di processi settici primari o quando è presente un quadro infiammatorio generale di origine sconosciuta (Madigan e House). Infatti, secondo una indagine condotta su casi clinici con infezione dell’ombelico, il 25% presentava un’anamnesi febbrile, il 30%
leucocitosi e livelli elevati di fibrinogeno, mentre la maggior parte di coloro che presentavano questi stessi sintomi erano anche colpiti da un’infezione ombelicale concomitante o pregressa.
3.1.1 Flemmone ombelicale acuto.
Consiste in una infezione dell’ombelico con cellulite necrosante dei tessuti circostanti.
L’eziologia è varia e molti microrganismi possono esserne la causa. I sintomi sono acuti e l’evoluzione può essere rapida con la morte anche in 24h.
Si può rilevare grande dolorabilità, tumefazione dell’ombelico con coinvolgimento degli strati circostanti della parete addominale, edema della parte ventrale dell’addome, respiro corto ed affannoso, febbre e anoressia.
La diagnosi si ottiene mediante l’esame ecografico. L’ecografia permette di fare due diagnosi differenziali: la prima con l’ernia strangolata; la seconda con la rottura della parete addominale e contemporanea infiammazione e necrosi dei tessuti per coinvolgimento dell’uraco o della vescica stessa.
Vista la natura diffusiva della patologia, è necessario ricorrere urgentemente all’intervento chirurgico con rimozione dei tessuti infetti e necrotici. Il trattamento post-chirurgico consiste in una fluidoterapia e terapia antibiotica.(HOLDSTOCK, 2004)
3.1.2 Ascessi ombelicali ed addominali.
Nel corso di infezioni persistenti alla vena ombelicale ed all’uraco è possibile che l’infezione venga delimitata ed appaia quindi una struttura incapsulata. Come già detto, tali ascessi sono associati alla presenza di due batteri in particolare: Rhodococcus equi e
Streptococcus equi. La loro patogenicità non si limita al distretto
ombelicale ma si possono osservare masse multiloculate a livello mesenterico (per lo più nella parte ventrale dell’addome). Queste masse contengono materiale purulento la cui ecogenicità aumenta con l’aumentare dello stato caseoso. La presenza di ascessi addominali può portare ad una alterazione, sia quantitativa che qualitativa, del liquido peritoneale (Reef, 1998)
3.1.3 Ascite e peritonite.
Ascite e peritonite possono essere le conseguenze di infezioni ombelicali, possono presentarsi contemporaneamente oppure essere indipendenti l’una dall’altra.
L’esame d’elezione per controllare la cavità peritoneale è quello ecografico, che permette di individuare anche piccole quantità di liquido peritoneale. Lo scopo è quello di giudicare la quantità e la qualità del liquido peritoneale e di individuare eventuali aderenze tra i visceri, gli organi e il foglietto viscerale del peritoneo (Reef, 1998).
Si possono usare sonde da 7.5 e 10.0 MHz, oppure da 5.0 e 6.0 MHz se è necessario visualizzare una porzione maggiore di addome o se nel cavo peritoneale si frappone una eccessiva quantità di liquido (Reef, 2003). La sonda andrebbe mantenuta in una stessa posizione per poter apprezzare che movimenti di singoli segmenti intestinali siano indipendenti da quelli adiacenti; tuttavia, anche in un puledro neonato, il pacchetto intestinale non può essere sondato completamente a causa delle sue grandi dimensioni.
L’ascite da cause infiammatorie è un reperto frequente in neonatologia equina. Il cavo peritoneale, in condizioni fisiologiche, contiene liquido trasudato che appare anecogeno. In caso di uroperitoneo si può, però, presentare un trasudato modificato che appare comunque anecogeno o ipoecogeno per la presenza di materiale di piccole dimensioni e poco riflettente. E’ però patologica la quantità di liquido libero in addome.
Il liquido peritoneale tende a diventare più ecogeno quando aumenta la cellularità ovvero quando è presente un processo infiammatorio. L’essudato è un liquido origine flogistica, con elevata cellularità ed è dotato di un aspetto ecogenico omogeneo o settato. Tale essudato si può formare quando un processo infiammatorio a carico dei diversi organi addominali, tra cui i vasi ombelicali, si diffonde per contiguità ad altri organi e quindi anche al peritoneo.
In entrambi i casi l’aumento del contenuto liquido in addome dovrebbe essere verificato anche con un esame citologico (Reef, 1998)
La peritonite può presentarsi diffusa o, meno frequentemente, localizzata. L’eziologia è quasi sempre batterica e questa condizione si può verificare come conseguenza dello stato infiammatorio delle strutture ombelicali (onfaloflebiti, onfaloarteriti e urachiti). Ancora, la rottura di un ascesso ombelicale, la rottura dell’uraco all’apice vescicale con uroperitoneo possono essere la causa di peritonite (Reef, 1998). L’aspetto del liquido peritoneale in corso di peritonite è diverso da quello fisiologico e si può presentare con una ecogenicità eterogenea da ipoecogena ad ecogena, composto di filamenti iperecogeni di fibrina (REEF, 2003)
Il trattamento iniziale della peritonite si fa con una terapia antibiotica a largo spettro finché i risultati dell’antibiogramma ne permettono una più mirata. La cultura del liquido peritoneale può risultare negativa, ma è corretto sospettare che siano comunque presenti degli agenti patogeni quando è presente una contemporanea infezione ombelicale e che provengano proprio dalle strutture ombelicali infette (Reef, 1998).
Una esplorazione chirurgica può essere utile se è stata individuata l’origine della peritonite ed è possibile correggerla. Quindi oltre all’ombelico, anche l’apparato gastroenterico e gli organi addominali devono essere sondati attentamente per poter determinare la sede del difetto.
Pur non essendo una applicazione molto diffusa nella pratica, è possibile eseguire un lavaggio peritoneale, specialmente nel caso in cui sia stata diagnosticata la presenza di coaguli di fibrina.
In caso di emoperitoneo l’esame ecografico mostra un liquido omogeneo ipoecogeno od ecogeno, che si distingue da un liquido purulento per la fluidità del sangue in accordo con i movimenti dell’intestino e degli atti respiratori. In questo caso è importante
esaminare anche il fegato e la milza per risalire all’origine dell’emorragia.(Reef, 2003)
3.1.4 Emorragia ombelicale.
Al momento del parto, la rottura per strappamento del cordone ombelicale provoca la retrazione delle tuniche dei vasi su se stesse e la chiusura del vaso stesso, quindi normalmente si ha solo una lieve emorragia del peduncolo ombelicale. Tuttavia in alcuni casi si può assistere ad una emorragia massiva.
Segni clinici. Esternamente si evidenziata colìo di sangue non
coagulato e tumefazione dell’ombelico. All’esame ecografico si osserva gonfiore dei vasi ombelicali, emorragia nel tessuto perivascolare e la presenza di grandi coaguli di fibrina nel lume vasale.
E’ indicato controllare anche lo stato della vescica. In molti casi di puledri setticemici, con una anamnesi di emorragia ombelicale alla nascita, si può trovare materiale ecogenico nella vescica rappresentato da coaguli di sangue e di fibrina. Infatti i microrganismi prelevati dalla vescica sono gli stessi di quelli del presenti nei coaguli di sangue. Può essere coinvolto anche l’uraco, nel quale però si ritrovano solo coaguli di fibrina (Reef, 1998).
Terapia. Trattamento antibiotico profilattico ad ampio spettro
d’azione, perché i coaguli di sangue favoriscono la pullulazione batterica; la setticemia e la cistite sono possibili sequele delle infezioni ombelicali. Monitoraggio ecografico del riassorbimento degli ematomi perivascolari. L’intervento chirurgico è necessario solo se non si ha il riassorbimento di grossi coaguli.
3.2 ALTERAZIONI DELL’URACO.
3.2.1 Uraco patente e uraco pervio.
Si definisce pervio (o persistente) l’uraco che non si è chiuso spontaneamente alla nascita, patente quello che si è normalmente chiuso alla nascita e per poi riaprirsi successivamente.
L’uraco pervio può essere dovuto ad un difetto congenito. E’ possibile avanzare alcune ipotesi che giustifichino una eccessiva tensione e dilatazione dell’uraco tale che si verifichi una deformazione ed un successivo difetto di chiusura alla nascita. Le cause possibili sono la torsione o una eccessiva lunghezza del cordone ombelicale oppure una sua resezione artificiale invece della rottura naturale per strappamento.
L’uraco patente è un difetto acquisito. Può essere dovuto ad una eccessiva tensione addominale nei primi giorni di vita a causa della ritenzione di meconio, ad infezioni, insufficiente trattamento terapeutico ecc.
In passato la condizione di uraco pervio o patente era ritenuta il principale fattore predisponente alle infezioni ombelicali e quindi anche alla setticemia neonatale. Tuttavia studi più recenti dimostrano che le alterazioni dell’uraco si sviluppano successivamente (giorni o settimane) alla diagnosi di setticemia (HOLDSTOCK, 2004). Questo è vero soprattutto in puledri poco più grandi (da 1 settimana a 1 mese), nei quali lo sviluppo di uraco patente svela una infezione ombelicale preesistente (Reef, 1998). In realtà, quindi, le alterazioni dell’uraco si configurano come frequenti complicazioni in puledri già malati. Altre complicazioni possono essere:
• dermatite periombelicale;
• cistite, necrosi della parete vescicale (per infezione ascendente);
• peritonite; • setticemia.
Segni clinici. L’esame obiettivo generale potrebbe rivelare un
deficit dello stato generale del puledro con abbattimento, febbre, disidratazione, vista l’alta incidenza di patologie dell’uraco in corso di setticemia e in neonati con problemi al parto.
All’esame obiettivo particolare si osserva un gocciolamento continuo o intermittente di urina (a seconda della pressione addominale) che porta l’ombelico ad essere sempre bagnato e allo sviluppo di dermatite.
Diagnosi. I sintomi clinici permettono una diagnosi agevole, che
viene confermata attraverso l’esame ecografico. Quest’ultimo consente di determinare con maggiore certezza lo stato fisiologico dell’uraco oppure se si è già sviluppato un processo settico. E’ utile eseguire anche un emogramma e la ricerca delle IgG.
Reperti ecografici. Il segno principale che distingue l’uraco
patente è la presenza di una piccola quantità di liquido anecogeno lungo tutto il lume fino all’apice della vescica. Invece, la presenza di liquido solo nella porzione caudale dell’uraco senza continuazione nel peduncolo ombelicale suggerisce l’esistenza di un diverticolo uracale.
Il piano di scansione migliore è quello longitudinale che permette di visualizzare tratti più lunghi nello stesso momento (apice vescicale + uraco caudale; moncone ombelicale + uraco craniale). Il sondaggio richiede una manualità delicata perché la pressione sulle pareti addominali e sull’uraco può portare allo spostamento del liquido contenuto e quindi ad un falso negativo.
Diagnosi differenziali.
• Infezione vasi ombelicali; • ernia ombelicale;
• edema della parete addominale ventrale; • flemmone ombelicale localizzato;
• trauma ombelicale.
Terapia. Si interviene attraverso un trattamento medico locale e
sistemico e nei casi più gravi con l’intervento chirurgico.
La terapia locale consiste in una disinfezione esterna del moncone ombelicale con clorexidina e nell’applicazione di una gelatina oleosa sulla cute circostante per impedire l’irritazione data dalla fuoriuscita di urina. La disinfezione interna si esegue mediante l’introduzione di un piccolo tampone di cotone impregnato di una soluzione di formalina al 10% o tintura di iodio al 2%. Queste soluzioni favoriscono la cauterizzazione dell’uraco. Il tampone viene inserito nell’uraco fino a 1-2cm e mantenuto in sede per qualche istante; è importante non procedere oltre perché si è possibile trasportare più internamente l’infezione oppure aggravare meccanicamente l’alterazione dell’uraco. Questa procedura viene ripetuta 2-4 volte al giorno per 2-3 giorni finché l’urina cessa di gocciolare.
Il trattamento sistemico consiste in una copertura antibiotica. Si somministrano antibiotici forti e ad ampio spettro, ciò anche in senso preventivo alla setticemia.
L’intervento chirurgico è l’approccio consigliato quando insorgono
complicazioni, quando la terapia medica non risolve il problema in 24-48h e la cauterizzazione ha fallito e può essere rischioso rimandare ulteriormente l’intervento. Infatti se i trattamenti risultano inefficaci, ciò può significare che un uraco patente in realtà è l’evidenza di un problema più complesso, quale l’infezione di più strutture ombelicali. In conclusione, i segni che suggeriscono la rimozione chirurgica dell’uraco sono il peggioramento delle condizioni generali del puledro, la necrosi o la suppurazione dell’ombelico. L’operazione è relativamente semplice e consiste nella escissione dell’uraco dopo doppia legatura, ma è importante riuscire a rimuovere tutte le strutture intaccate dal processo infettivo. La copertura antibiotica va data dal momento della diagnosi fino a 3 giorni dopo l’intervento (Holdstock, 2004).
3.2.2 Uroperitoneo.
La causa di uroperitoneo è data più spesso dalla rottura o da un difetto congenito della vescica o dell’uraco. Sono colpiti soprattutto puledri maschi di una settimana di età, con una incidenza che va da 0,2% a 2,5%. Questi presentano sforzo alla minzione o continuo gocciolio di urina, depressione del sensorio e un progressivo ingrossamento dell'addome (Reef, 1998).
La valutazione ecografica dei soggetti malati permette una diagnosi agevole e la localizzazione del probabile punto di fuoriuscita dell’urina. Nel caso in cui non fosse possibile individuare il difetto a carico della vescica o dell’uraco, prima dell’eventuale intervento chirurgico, è necessario procedere ad una analisi più approfondita sull’integrità dell’uretra e degli ureteri. L’aspetto ecografico di uroperitoneo è dato da una grande quantità di liquido anecogeno libero nella cavità addominale con anse intestinali fluttuanti sul liquido stesso. Il liquido peritoneale può però diventare ipoecogeno per la presenza di filamenti di fibrina se si sviluppa una peritonite secondaria o una cistite. (Reef, 2003)
Nel caso della rottura della vescica, questa si presenta collassata e piegata su se stessa con solo una piccola quantità di urina all’interno. Generalmente l’apertura si trova sulla parete dorsale, ma non è sempre possibile individuarla proprio per il fatto che la vescica si piega su se stessa. Questo aspetto è differente da una vescica integra ma vuota, che è piccola e contratta ma non ripiegata su se stessa (Reef, 1998).
La rottura dell’uraco non è facilmente visibile, a causa del fatto che le pareti dell’uraco stesso si riconoscono male nell’immagine ecografica. Tuttavia i segni evidenti di uroperitoneo sono un abbondante liquido anecogeno, libero attorno all’uraco, nello spazio retroperitoneale e nel sottocute della parete ventrale dell’addome. La fessura dell’uraco, da cui si ha la fuoriuscita di urina, di solito è piccola e l’accumulo di liquido in addome è graduale. La vescica,
infatti, non presenta difetti di riempimento ed ecograficamente ha la normale forma circolare con contenuto anecogeno (Reef, 1198). Infine la rottura dell’uretra è una evenienza più rara e anche più difficile da diagnosticare. Anche in questo caso la vescica può essere normalmente piena e si dovrebbe apprezzare una grande quantità di liquido anecogeno nello spazio retroperitoneale tutto intorno al rene omolaterale alla lesione.
Le conseguenze dell’uroperitoneo si rendono evidenti in un momento successivo rispetto all’esordio della patologia: puledri di 3-4 settimane di età, quindi, sono colpiti da peritonite, aderenze degli organi addominali, cistite necrotica e infiammazioni dei vasi ombelicali (onfaloarteriti e onfaloflebiti) (Reef, 1998).
3.2.3 Diverticolo uracale.
Questa alterazione non è di origine infiammatoria e consiste nell’accumulo di liquido (urina) all’interno dell’uraco. Può essere diagnosticata solo attraverso l’esame ecografico, ma il più delle volte è un reperto occasionale.
Ecograficamente è possibile vedere alcune piccole aree anecogene cranialmente all’apice della vescica. La struttura dell’uraco appare nella norma eccetto una possibile dilatazione rappresentata appunto dalle aree anecogene.
Tale alterazione non è evidenziata da nessun tipo di sintomatologia, in alcuni casi può essere presente solo una moderata stranguria. Generalmente si assiste ad una involuzione spontanea nell’arco di alcuni giorni (Holdstock, 2004).
3.3 ERNIA OMBELICALE o ONFALOCELE.
E’ una condizione frequente in neonatologia equina. Sono colpiti più spesso i purosangue inglesi e con maggiore incidenza le femmine. Per ernia si intende la fuoriuscita di organi o visceri attraverso aperture naturali, accidentali o teratologiche all’interno di cavità preformate o neoformate.
Le ernie ombelicali sono dovute sia a fattori ereditari che acquisiti. Nel primo caso si assiste ad una mancata chiusura della parete addominale ventrale in coincidenza dell’anello ombelicale, a livello del quale la pressione addominale determina uno sfiancamento del peritoneo che esce e forma l’iniziale cavità erniaria; nel secondo caso entrano in gioco soprattutto fattori traumatici, quali cadute, sforzi (ad esempio un parto laborioso), trazioni eccessive sul cordone ombelicale.
La classificazione delle ernie ombelicali viene fatta in base alle dimensioni e alle complicazioni da processi infettivi o da incarceramento del contenuto erniario. Secondo questi parametri le ernie possono essere: piccole o grandi, e semplici o complicate. Le ernie piccole si presentano come una tumefazione dell’ombelico di pochi cm di diametro e sono le ernie abbastanza frequenti. L’ernia piccola semplice si può ridurre manualmente e si possono apprezzare facilmente le pareti fibro-cartilaginee della porta erniaria. Il sacco erniario contiene l’omento e il liquido peritoneale. In alcuni casi può contenere anche tratti di intestino, quali l’ileo o il digiuno, ma raramente questi rimangono incarcerati. Semeiologicamente un’ernia si considera piccola quando le sue dimensioni esterne non superano i 5 cm e alla palpazione passano meno di tre dita attraverso la porta erniaria.
Le ernie grandi sono le più frequenti. Esternamente il sacco erniaro può superare i 5 cm di diametro ed alla palpazione attraverso la porta erniaria possono passare più di tre dita. Il sacco erniario
contiene l’omento e tessuto adiposo e, date le dimensioni, è molto probabile che vi entri una porzione di intestino: sono contenute più spesso anse del piccolo intestino, ma eccezionalmente si può trovare il colon ventrale ed il cieco, i quali, una volta alloggiati nel sacco erniario, hanno più probabilità di essere incarcerati, complicando l’ernia stessa.
L’ernia semplice può essere sia piccola che grande, ma comunque è riducibile manualmente. Non sono presenti segni di aderenza tra i visceri erniati ed il sacco erniario. Lo stato fisiologico degli organi erniati e la funzionalità sono mantenuti, senza che la permanenza nel sacco abbia alterato la perfusione ematica con conseguente edema, aumento di volume, stasi ematica e necrosi delle pareti dell’organo.
L’ernia ombelicale si considera complicata quando una porzione dell’intestino rimane strangolato nel sacco erniario insieme all’omento, per cui l’ernia non può essere ridotta manualmente. Solitamente sono interessati da questo fenomeno soprattutto puledri di età superiore ai 6 mesi (con una media di 11,5 mesi di età) (Reef, 1998).
L’ernia in questo caso deve essere risolta chirurgicamente, in caso contrario l’ansa intestinale incarcerata andrà incontro a processi ischemici e necrosi. Le alterazioni più gravi infatti si verificano a livello del microcircolo delle pareti intestinali. Questo viene interrotto e ciò provoca ischemia dei tratti più a valle, congestione ed edema di quelli a monte; l’ischemia porta a necrosi e a rottura della parete viscerale con conseguente inquinamento del peritoneo e della cavità addominale. L’incarceramento dell’intestino ha una sintomatologia colica acuta e si presenta come una tumefazione calda e dolente a livello del moncone ombelicale. Quindi, in un puledro con un’ernia ombelicale, al manifestarsi di una sindrome colica, è sempre opportuno intervenire velocemente, visitando il soggetto ed effettuando una ecografia ombelicale.
Segni clinici. L’esame obiettivo generale può rilevare sintomi
significativi nel caso di ernia complicata o incarcerata, a causa rispettivamente di un coinvolgimento sistemico dell’infezione o di una compromissione degli organi incarcerati.
Il sintomo principale è quello di addome acuto. Si osserva un calo delle condizioni generali del puledro con abbattimento, anoressia, alterazione delle grandi funzioni organiche.
All’esame obiettivo particolare, la tumefazione dell’ombelico è il segno clinico patognomonico. Le dimensioni della massa permettono di differenziare le ernie piccole e semplici (<5cm) dalle
grandi (>5cm). Non si associano altri sintomi al caso di ernia semplice.
Per quanto riguarda l’ernia complicata, si osserva edema infiammatorio dei tessuti adiacenti e alla palpazione si avverte calore e dolorabilità acuta. E’ possibile percepire l’esistenza di un ascesso e la sua presenza è svelata da una massa fluida dotata di pareti proprie ma non comunicante con il sacco erniario. In associazione all’ernia può essere presente uno scolo, del quale è necessario determinare la composizione (sieroso, siero-emorragico o purulento) e l’origine (un ascesso sottocutaneo, infezione dei vasi ombelicali, una perdita di urina dalla vescica incarcerata).
Nel caso di ernia incarcerata la sintomatologia è acuta, data da sindromi coliche associate ad aumento di volume dell’addome, grande dolorabilità e durezza del sacco erniario. E’ importante considerare che spesso i segni di colica addominale possono essere sia i sintomi dell’ernia incarcerata, ma possono dimostrare anche il contrario, ovvero che patologie preesistenti del tubo digerente o dell’apparato urinario favoriscono lo sviluppo dell’ernia e lo strangolamento ei visceri. Infatti molti di questi puledri hanno un’anamnesi patologica prossima comune, data da coliche ricorrenti.
Nel caso particolare della fistola entero-cutanea, oltre alla ragionevole possibilità che si sviluppi un’enterite, si ha la perdita del contenuto liquido intestinale che porta ad un grave squilibrio elettrolitico e ad una pericolosa debilitazione (Reef, 1998).
Diagnosi. L’esame ecografico è il mezzo più efficace e meno
invasivo per verificare il contenuto dell’ernia (liquido, omento o anse intestinali), le dimensioni, la presenza di infezioni ed il coinvolgimento di strutture ombelicali o di altri organi. Durante l’esame è essenziale distinguere l’ernia dalla rottura del pavimento addominale (sventramento), nel quale si ha la rottura del peritoneo e gli organi erniari giacciono a contatto con i piani sottocutanei intatti.
La diagnosi di ernia semplice è possibile attraverso il solo esame clinico, nel quale viene accertata la possibilità di ridurre l’ernia e l’indipendenza anatomica tra le varie strutture coinvolte. L’ernia
complicata o irriducibile, invece, richiedono l’esame ecografico
perché è necessario determinare il contenuto del sacco erniario, le dimensioni della porta erniaria e lo stato delle strutture interessate.
Reperti ecografici. In condizioni fisiologiche l’omento ha un
aspetto eterogeneo, da ipoecogeno ad ecogeno, dovuto alla presenza di grasso. Invece, l’omento incarcerato appare compatto o cavitato a seconda della quantità del tessuto necrotico e dell’infiltrazione cellulare dei tessuti strangolati. Il digiuno o l’ileo, quando sono incarcerati nell’ernia, assumono un aspetto simile a quello di una ostruzione intestinale.
Il lume intestinale è dilatato e meteorico prossimalmente e collassato distalmente. A monte dello strangolamento, le anse si presentano atoniche e meteoriche. La parete appare ingrossata, assume un aspetto turgido e corrugato in prossimità dello strozzamento. Nello spessore della parete è possibile individuare la presenza di masse: ascessi, nel caso ci sia una complicazione infettiva, o raccolte ematiche secondarie a traumi, delle quali sono
riconoscibili i coaguli iperecogeni di fibrina. Il contenuto luminale consiste in una massa fluida e in gas meteorici che distendono il tratto d’organo. A valle non si osservano alterazioni patologiche evidenti: l’intestino è vuoto e le pareti sono collassate.
Il grosso intestino non può essere inglobato interamente nell’ernia, ma solo una porzione del colon ventrale o del cieco. Tale porzione si presenta come una dilatazione sacciforme dell’organo strangolata nell’ernia. La parete intestinale è ispessita, edematosa ed atonica. Gli organi erniari, dopo incarceramento e strangolamento, si presentano devitalizzati perché parte di loro può andare incontro velocemente a necrosi (Reef, 1998).
Diagnosi differenziali.
• Infezione vasi ombelicali; • edema addominale ventrale; • flemmone tessuti peri-ombelicali;
• trauma/rottura dell’ombelico (Holdstock, 2004)
Terapia. Indipendentemente dalle dimensioni, ogni tipo di ernia
deve essere trattata. Infatti, benché in neonatologia l’incarceramento di anse intestinali nell’ernia ombelicale abbia una incidenza bassa, la persistenza dell’ernia dopo un trattamento di tipo conservativo sembra favorire il realizzarsi dell’incarceramento e dello strozzamento delle anse (Reef, 1998). La risoluzione dell’ernia ombelicale, inoltre, permette di proteggere gli organi interni dai traumi, dal possibile conseguente sventramento e ne migliora l’aspetto estetico.
Nel caso di ernie piccole ma che contengono una porzione di intestino è raccomandato sospingere manualmente con delicatezza il contenuto attraverso la porta erniaria in addome (taxis manuale). Questo procedimento va eseguito giornalmente fino a quando i muscoli addominali ventrali (m.lo retto) acquistano una tonicità sufficiente a riparare il difetto; ha inoltre lo scopo di prevenire la
formazione di aderenze tra le anse intestinali o il loro incarceramento.
Ernie di piccole dimensioni possono essere trattate con l’uso di
anelli elastici quando l’ecografia ha escluso la presenza di tratti di
intestino e non è possibile ricorrere altrimenti alla chirurgia. L’anella va assicurato alla parete addominale in modo che chiuda ermeticamente il sacco erniario e lasci fuori la parte esuberante dell’ernia. Bisogna accertarsi che la quantità di tessuto esuberante sia sufficiente a permettere questa manovra altrimenti l’anello rischia di scivolare via. In seguito si può avere gonfiore, edema e infiammazione dell’ombelico, ma regredisce gradualmente nell’arco di 2-4 giorni, finché l’ernia va incontro a necrosi, si stacca e lascia una piccola superficie ulcerata che cicatrizza.
L’intervento chirurgico è richiesto per le ernie complicate o di grandi
dimensioni. L’erniorrafia si esegue in anestesia generale e il puledro
viene messo in decubito dorsale. Dopo aver fatto una tricotomia ovale intorno all’ernia e preparato il campo chirurgico, si esegue una dissezione di cute e sottocute e ribaltate. Il peritoneo sottostante deve essere lasciato integro per impedire l’inquinamento suo e della cavità addominale, quindi viene spinto all’interno dell’addome. Tuttavia è possibile che infezioni preesistenti compromettano lo stato del peritoneo o del sottocute in modo tale che al momento della dissezione sia impossibile evitare di strappare il peritoneo. Dopo la riduzione e la correzione di eventuali complicazioni (exeresi dei tessuti necrotici ed infetti, resezione delle porzioni intestinali necrotiche), il sacco erniario viene chiuso. La sutura della breccia operatoria viene fatta con un filo di nylon monofilamento. Può essere eseguita con la tecnica di Mayo (Mayo overlap) con la quale si ottiene la sovrapposizione dei tessuti suturati, peritoneo e piani fasciali, oppure mediante l’applicazione di una “maglia” sterile contenitiva, posta tra il peritoneo la guaina del m.lo retto addominale. Infine per assicurarsi che la chiusura della
porta erniaria sia resistente, si possono cruentare i margini della porta stessa per stimolare la formazione di tessuto fibroso mediante un processo di cicatrizzazione per seconda intenzione. Cute e sottocute sono chiuse con una sutura continua con monofilamento assorbibile, mentre la cute eccedente viene rimossa.
Alcuni chirurghi sostengono che l’intervento debba essere eseguito su tutti i casi di ernia piuttosto che solo in quelli che presentano un coinvolgimenti delle anse intestinali, cosicché ogni eventuale complicazione può essere risolta tempestivamente (Holdstock, 2004).
Il follow-up post-operatorio si svolge con l’ecografia che consente di seguire la riparazione dell’ernia o la comparsa di complicazioni. I parametri sotto controllo sono la chiusura dell’anello ermiario, il liquido peritoneale, l’aspetto e la motilità intestinale. La chiusura dell’ernia si considera consolidata dopo che si è creato un anello fibroso spesso attorno ai margini della porta erniaria.
1. MATERIALI e METODI
1.1 I TEMPI, I LUOGHI, I SOGGETTI.
La presente ricerca è stata condotta nell’arco di due stagioni riproduttive 2005 e 2006 ed ha riguardato un totale di 23 soggetti. L’osservazione si è svolta nel periodo di maggior concentrazione delle nascite, da Aprile a Luglio, in entrambe le stagioni.
I 23 puledri provenivano da allevamenti e contesti diversi e appartenevano a specie e razze diverse.
Secondo il protocollo di ricerca, i soggetti sono stati suddivisi in due gruppi di studio: il gruppo di controllo, formato da 16 puledri clinicamente sani (6 maschi, 37,5% e 10 femmine, 62,5%) ed il gruppo dei casi clinici, formato da 7 puledri con patologie ombelicali.
Il gruppo di controllo era costituito da:
- 12 puledri trottatori, nati presso la stazione di monta “La Piaggia” di Staffoli;
- 2 puledri asini di razza amiatina appartenenti alla regione Toscana, nati presso la clinica di S.Piero a Grado della facoltà di Medicina veterinaria. Erano figli di fattrici gravide provenienti dalla provincia di Grosseto che vivevano allo stato semibrado sul monte Amiata;
- 1 puledro italiano da sella, nato presso un allevamento di cavalli da salto in provincia di Pisa;
- 1 puledro trotter, nato da meno di una settimana e ricoverato presso la clinica universitaria per patologie a carico di altri organi, mentre l’ombelico non presentava alterazioni.
Il gruppo dei 7 soggetti patologici era costituito da: - 3 puledri trottatori;