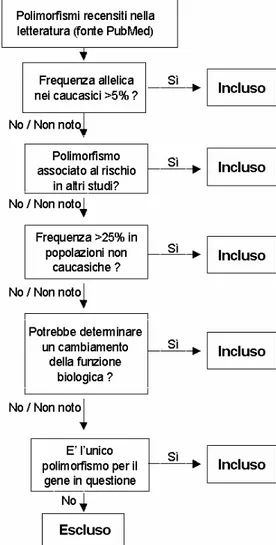
Indice Generale
RIASSUNTO ________________________________________________________ 2 ABSTRACT _________________________________________________________ 4 1. INTRODUZIONE _________________________________________________ 6 1.1 Le neoplasie del tratto aero-digestivo superiore ________________________ 6 1.2 Epidemiologia descrittiva_____________________________________________ 7 1.3 Fattori di rischio _____________________________________________________ 9 1.3.1 Il tabacco ______________________________________________________________ 10 1.3.2 L’alcol _________________________________________________________________ 11 1.3.3 Associazione alcol-tabacco_______________________________________________ 13 1.4 Lesioni precancerose _______________________________________________ 13 1.5 Tabacco come xenobiotico __________________________________________ 14
1.5.1 Metabolismo dei PAHs __________________________________________________ 17 1.5.2 Origine e metabolismo delle N-nitrosamine tabacco specifiche ________________ 21
1.6 Tabacco e cancro: meccanismo di cancerogenesi _____________________ 24 1.7 Alcol e cancro delle vie aero-digestive superiori_______________________ 26 1.8 Suscettibilità genetica _______________________________________________ 31 1.9 Gli studi di associazione_____________________________________________ 32 1.10 Precedenti studi di associazione ____________________________________ 32 1.11 Scopo della tesi____________________________________________________ 41 2. MATERIALI E METODI____________________________________________ 43 2.1 Campioni di DNA____________________________________________________ 43 2.2 Scelta degli SNPs ___________________________________________________ 45 2.3 Amplificazione mediante PCR________________________________________ 47 2.4 Purificazione post-PCR ______________________________________________ 51 2.5 Preparazione dei Micro-Array ________________________________________ 52 2.6 APEX ______________________________________________________________ 53 2.7 Analisi Statistica ____________________________________________________ 55 3. RISULTATI ______________________________________________________ 57 4. DISCUSSIONE ___________________________________________________ 62 Bibliografia _________________________________________________________ 69
RIASSUNTO
Le neoplasie delle vie aero-digestive superiori comprendono i tumori maligni che insorgono nella cavità orale, nella faringe e nella laringe. Il tasso di incidenza varia al variare della distribuzione dei fattori di rischio, i maggiori dei quali sono rappresentati dal fumo di sigaretta, l’abuso di alcol e il masticare tabacco. Nell’Unione Europea è stato stimato che approssimativamente il 60% dei casi negli uomini e il 30% nelle donne può essere attribuito al solo fumo di sigaretta. Quando l’abitudine al fumo e il consumo di alcol sono associati il rischio può aumentare più di 15 volte. Il cancro delle vie aero-digestive superiori colpisce più frequentemente gli uomini con un rapporto maschi/femmine che si aggira sul 3 a 1. L’incidenza aumenta con l’età: in Europa il 98% dei pazienti hanno un’età superiore ai 40 anni. Durante l’ultimo decennio è stato comunque messo in evidenza un incremento dell’incidenza nei soggetti più giovani, in modo particolare delle neoplasie localizzate nel cavo orale, più frequentemente nella lingua.
Benchè i principali fattori di rischio siano stati definiti chiaramente, esiste un’evidente disparità fra la larga fascia di persone esposte ai cancerogeni e il piccolo numero di persone che effettivamente contraggono la malattia. Una parte di questa disparità potrebbe essere spiegata da polimorfismi ereditari che portano a differenze nel metabolismo dei cancerogeni e nell’attivazione dei pro-cancerogeni.
Lo scopo della tesi è quello di studiare i geni che codificano per gli enzimi coinvolti nel metabolismo degli xenobiotici, sia di fase I sia di fase II, quali fattori di suscettibilità al cancro delle vie aero-digestive superiori. Questi enzimi sono presenti specialmente nel fegato ma anche in questa regione anatomica, ed alcuni di essi sono polimorfici, alterando la risposta biologica individuale ai cancerogeni. I maggiori agenti cancerogeni che rivestono un ruolo nello
sviluppo di queste neoplasie sono sostanze chimiche presenti nell’alcol e nel tabacco.
Nel nostro studio abbiamo utilizzato il DNA di 104 soggetti affetti da cancro delle vie aero-digestive superiori e di 280 soggetti sani rappresentativi della popolazione generale, che costituiscono il gruppo di controllo. Lo studio è stato condotto su individui con un’età inferiore ai 50 anni, nell’ipotesi che sia possibile identificare più agevolmente i fattori genetici di suscettibilità se la malattia presenta un esordio precoce. La tecnica che abbiamo utilizzato si avvale di un “oligonucleotide microarray” che ha permesso una genotipizzazione simultanea di 83 polimorfismi in 30 geni coinvolti nel metabolismo degli xenobiotici di fase I e di fase II.
Abbiamo così identificato alcuni possibili fattori genetici di suscettibilità al cancro delle vie aero-digestive superiori: in particolare i polimorfismi nei geni NAT1 e NAT2 sono risultati associati ad un aumento del rischio, mentre i polimorfismi nei geni NQO1 e GSTP1 si sono dimostrati protettivi nei confronti del tumore.
ABSTRACT
Cancers of the upper aerodigestive tract (UADT) includes cancers arising from the mucosal surfaces of the oral cavity, pharynx and larynx. The incidence rates greatly vary depending on differences in the prevalence of risk factors between countries, alcohol consumption, and tobacco use (cigarette and smokeless tobacco) in particular. In the European Union it has been estimated that approximately 60% of oral cancers in men and 30% in women could be attributable to smoking alone. When tobacco smoking and alcohol consumption are combined, they may increase the risk by more than 15-fold. In industrialized countries, men are affected two to three times as often as women. The incidence increases with the age: in Europe, 98 percent of the patients are over 40 years of age. However, during the past decades, there has been an alarming rise in the incidence of oral cancer particularly among younger men, a trend that appears to be continuing.
Despite the importance of the causal habits, such as tobacco and alcohol, relatively few persons who have them actually develop cancer, often despite years of exposure, and, conversely, there are patients who develop the neoplasm in the absence of such habits or other identifiable lifestyle or environmental aetiological factors. Host susceptibility must therefore play a role. Individual susceptibility to cancer may sometimes be explained by a genotype that result in increased carcinogen exposure as a consequence of their carcinogen or pro-carcinogen metabolism.
The aim of this study is to point out the presence of possible susceptibility factors for cancer of UADT in fase I and fase II genes of xenobiotic metabolism. Xenobiotic metabolising enzymes (XMEs) are expressed especially in the liver, but also in the mucosae of the upper aerodigestive tract, and several are polymorphic, influencing individual biological responses to tobacco and alcohol carcinogens.
We analysed 104 DNA samples of patients affected with cancer of the upper aerodigestive tract and 280 DNA samples of healthy subjects (controls) representing a general population, selectively chosen with an age similar to the control group. We analysed samples from young subjects, under 50’s, since it has been supposed that this group of people represent a distinct clinical and pathological entity. In this study we employed a genotyping microarray for 83 polymorphic sequences of 30 genes mainly involved in fase I and II xenobiotic methabolism.
Our case-control study showed an increase risk in cancer of UADT for individuals in associations with the presence of NAT1 and NAT2 variants, whereas polymorphic sequence of NQO1 and GSTP1 are associated with decreased cancer risk.
1. INTRODUZIONE
1.1 Le neoplasie del tratto aero-digestivo superiore
Il tratto aero-digestivo superiore consta di un condotto rivestito da mucosa, atto al passaggio di cibo e aria, che si estende dal margine del vermilion labiale all’esofago cervicale (Diaz et al., 2003). In questo gruppo di neoplasie sono inclusi quindi i tumori che insorgono nelle membrane mucose della bocca (come ad esempio nelle labbra, nella lingua, nelle gengive, nel pavimento della bocca e nel palato), nella faringe (comprendendo le sue tre porzioni nasofaringe, orofaringe e ipofaringe) e nella laringe.
Circa il 90% dei tumori che si rilevano in questa complessa regione anatomica sono carcinomi a cellule squamose (SCC), che si originano dall’epitelio di rivestimento delle mucose (Dobrossy, 2005). Dal punto di vista istologico possono presentare diversi gradi di differenziazione (Mao et al., 2004), a seconda del quale possono essere classificati in:
• carcinomi ben differenziati: caratterizzati da un’ordinata stratificazione e da una massiccia cheratinizzazione;
• carcinomi moderatamente differenziati: caratterizzati da un modesto grado di stratificazione e da una minor cheratinizzazione;
• carcinomi scarsamente differenziati: che manifestano un elevato pleiomorfismo nucleare e mitosi atipiche.
Tra le caratteristiche istologiche considerate il grado di pleiomorfismo nucleare sembra quello più correlato all’aggressività del tumore; nei cancri avanzati della laringe il grado di pleiomorfismo nucleare presagisce accuratamente il loro progresso (Wolf et al., 1990). Dimensioni nucleari elevate presumibilmente riflettono aberrazioni cromosomiche ed un aumento nel contenuto di DNA (Diaz et al., 2003). Numerosi studi sul contenuto di DNA hanno dimostrato un elevato
grado di aneuploidia nei carcinomi a cellule squamose che varia dal 50% al 70%. L’aneuploidia è stata associata ad una prognosi sfavorevole (Kokal et al., 1988). Anche il tasso mitotico è stato considerato un fattore che riflette l’attività proliferativa delle cellule tumorali, ma numerosi studi effettuati sui tumori del tratto aero-digestivo superiore sono stati insoddisfacenti.
Ulteriori caratteristiche che riflettono l’aggressività del tumore includono l’invasione linfatica, l’invasione perineurale, la presenza di metastasi linfonodali e la penetrazione del tumore attraverso la capsula dei linfonodi coinvolti (diffusione extracapsulare). Nei tumori delle vie aero-digestive superiori la caratteristica che determina maggiormente la prognosi è la presenza di metastasi a livello dei linfonodi regionali ed è associata ad una diminuzione del 50% del tasso di sopravvivenza, nei confronti dei pazienti che non presentano metastasi regionali (Diaz et al., 2003).
I tumori che invadono i tessuti circostanti attraverso sottili proiezioni digitiformi o attraverso singole cellule indipendenti presentano un comportamento più aggressivo, qualsiasi sia il grado di differenziazione, e tendono ad essere associati ad invasione vascolare e neurale (Jakobsson et al., 1973). La presenza di diffusione extracapsulare nei tumori delle vie aero-digestive superiori è stata associata direttamente ad un alto grado di metastasi a distanza. Queste diverse caratteristiche istologiche rivestono un ruolo molto importante nella decisione degli interventi terapeutici da adottare.
1.2 Epidemiologia descrittiva
Le neoplasie delle vie aero-digestive superiori rappresentano, nel complesso, il sesto tipo di tumore più diffuso nel mondo, con oltre 640.000 casi stimati nel 2002 (Parkin et al., 2005). Circa i due terzi di questi tumori colpiscono i paesi in via di sviluppo; una frequenza particolarmente elevata si osserva in India, seguita dalle aree tropicali del Sud America e dal Sud Africa (Dobrossy, 2005).
Il tumore colpisce più frequentemente gli individui di sesso maschile, con un rapporto maschi:femmine di poco inferiore al 3:1. Questo rapporto risulta
particolarmente spiccato per il cancro alla laringe, che colpisce 1 donna ogni 7 uomini.
In Europa i casi stimati di cancro alla cavità orale, faringe e laringe ammontano a circa 143.900 nel 2004, rappresentando il 5% di tutti i casi di tumore (Boyle et al., 2005). Il rapporto maschi:femmine appare ancora più marcato: per il cancro alla laringe supera il 10:1. I tassi di incidenza più elevati si registrano nell’Europa dell’Est: l’Ungheria presenta tassi di incidenza superiori alla media europea per tutti i siti anatomici considerati, con un massimo di 29,1 su 100.000 per il cancro alla cavità orale nei maschi. Le neoplasie delle vie aero-digestive superiori colpiscono frequentemente anche l’Europa del sud: Spagna e Croazia presentano tassi di incidenza superiori alla media per il cancro alla cavità orale e alla faringe, mentre a Malta si registra il tasso di incidenza più elevato per il tumore nasofaringeo (4,1 su 100.000 nei maschi). E’ da sottolineare comunque che il tasso più significativo in assoluto si registra tra gli uomini francesi: 29,6 su 100.000 per il cancro alla faringe (Bray et al., 2002). Presumibilmente queste differenze nell’incidenza della malattia riflettono una diversa distribuzione dei fattori di rischio e delle abitudini associate a questo tipo di cancro.
Il tasso di sopravvivenza in Europa per i tumori delle vie aero-digestive superiori risulta essere inferiore al 50%; la prognosi è migliore per il cancro alla laringe, che ha un tasso di sopravvivenza del 60-70%. In generale le donne presentano un tasso di sopravvivenza più alto rispetto agli uomini (Berrino et al., 1998). Benché gran parte dei tumori delle vie aero-digestive superiori insorgano in regioni anatomiche accessibili è frequente che la loro diagnosi avvenga quando la neoplasia è già ad uno stadio avanzato; inoltre negli ultimi vent’anni ci sono stati ben pochi miglioramenti sul tasso di sopravvivenza (Forestiere et al., 2001).
L’incidenza del tumore aumenta con l’età: in Europa circa il 98% dei pazienti presenta un’età maggiore di 40 anni (Dobrossy, 2005). Benché questa neoplasia colpisca prevalentemente individui di sesso maschile durante la sesta-settima decade di vita, nell’ultimo decennio è stato registrato un allarmante incremento della malattia nei pazienti con un’età inferiore ai 45 anni
(Myers et al., 2000; Funk et al., 2002). Il sito più colpito sembra essere la cavità orale, in particolare la lingua e le tonsille palatine (Shiboski et al., 2005). Il fatto che molti di questi giovani pazienti non siano fumatori e un basso rapporto maschi:femmine suggerisce che fattori di rischio differenti potrebbero agire su questo gruppo di individui, rispetto ai soggetti più anziani (Goldstein et al., 2005).
1.3 Fattori di rischio
Le cause dei tumori delle vie aero-digestive superiori non sono ancora del tutto chiare. Prove epidemiologiche comunque suggeriscono che diversi fattori non sono necessariamente agenti causali, ma sono associati, individualmente o in combinazione, con un aumento del rischio di insorgenza della malattia.
Il consumo di tabacco e l’uso/abuso di alcol sono fattori di rischio universalmente riconosciuti. Presi insieme, gli effetti dell’uso di tabacco, di un forte consumo di alcol e di una alimentazione carente probabilmente spiegano più del 90% dei casi di questi tumori (Johnson, 2001). Numerosi studi hanno mostrato una significativa diminuzione del rischio di contrarre la malattia nei soggetti che consumano abitualmente frutta e verdura (Franceschi et al., 1991). I micronutrienti implicati non sono stati ancora identificati chiaramente: l’associazione tra il cancro delle vie aero-digestive superiori e il β-carotene, la vitamina A e la vitamina C risultano meno forti rispetto alla frutta e alla verdura. Un altro probabile fattore di rischio potrebbe essere rappresentato dal
papilloma virus umano (HPV): recentemente diversi studi hanno investigato
la presenza del virus nei tumori delle vie aero-digestive superiori, ma i tassi di rilevamento dei rispettivi marcatori molecolari variano molto a seconda della popolazione, del tipo di campione e del metodo di rilevamento (Mork et al., 2001; Shah, 1998). Più recentemente, i risultati di uno studio condotto dall’IARC (Herrero et al., 2003) ha confermato un probabile ruolo eziologico dell’HPV per alcuni tumori che insorgono in alcune regioni delle vie aero-digestive superiori: il DNA del virus è stato rinvenuto nel 3.9% di 766 tumori del cavo orale e nel 18.6% di 142 tumori dell’orofaringe. Il tipo più frequente
rilevato è stato l’HPV 16, ritrovato nel 94.7% dei campioni positivi. La presenza del DNA virale è stata rilevata meno frequentemente tra i soggetti fumatori; sembra che i tumori HPV-positivi rappresentino una entità clinico-patologica distinta, la cui associazione con l’abitudine al fumo e con il consumo di alcol sia meno caratteristica (Dobrossy, 2005).
Inoltre l’esposizione professionale agli idrocarburi policiclcici rappresenta un fattore di rischio per il cancro della cavità orale e della laringe, mentre l’esposizione alla formaldeide sembra essere associata causalmente al cancro del nasofaringe (Aupérin et al., 2005).
1.3.1 Il tabacco
Il fumo di sigaretta è una causa riconosciuta di cancro della cavità orale, della faringe e della laringe (Aupérin et al., 2005). Nell’Unione Europea è stato stimato che circa il 60% dei casi di cancro della cavità orale negli uomini e il 30% dei casi nelle donne può essere attribuito al solo fumo di sigaretta (Bray et al., 2002). Il rischio di cancro aumenta con il numero di sigarette fumate e con la durata del tabagismo: il rischio di morire per un tumore delle vie aero-digestive superiori è sette volte più elevato per soggetti fumatori rispetto ai non fumatori, mentre per gli ex fumatori il rischio scende alle tre volte, sempre rispetto ai non fumatori (Doll et al., 2004).
Numerosi sono stati gli studi effettuati per stimare l’effettivo rischio attribuibile al fumo per questo tipo di tumore; uno di essi è stato condotto nel Nord Italia, da Franceschi e collaboratori, pubblicato nel 1990. In questo studio è stato riscontrato, per tutti i siti anatomici considerati, un elevato rischio associato al numero di sigarette fumate e alla durata dell’abitudine al fumo, nonché un’associazione inversa del rischio rispetto all’età di inizio dell’abitudine. Il rischio associato al fumo di pipa e di sigaro risultava anch’esso elevato, soprattutto per cavità orale e faringe.
E’ da sottolineare tuttavia che gran parte del tabacco nel mondo non è consumato attraverso il fumo di sigarette, pipe o sigari, ma viene masticato: il tabacco viene posto in contatto con le membrane mucose della bocca,
attraverso le quali la nicotina viene assorbita per fornire il suo effetto farmacologico. Nei paesi in via di sviluppo il tabacco è principalmente consumato miscelato ad altri ingredienti: è stato estensivamente provato che queste preparazioni contengono elevate quantità di nitrosamine tabacco-specifiche (Johnson, 2001).
Nel 1985 l’IARC stabilì che il tabacco non fumato consumato per via orale aumentava il rischio di cancro della cavità orale e della faringe; successivi studi realizzati in Svezia e negli Stati Uniti, dove questa abitudine è piuttosto diffusa, non riscontrarono la stessa associazione (Critchley et al., 2003). Il fatto che i produttori svedesi e americani avessero successivamente diminuito il livello delle nitrosamine cancerogene nei loro prodotti potrebbe spiegare questi risultati discordanti (Aupérin et al., 2005).
In alcune parti del mondo, particolarmente in Asia, il tabacco viene masticato anche associato alle foglie di Betel (Piper betel, pianta tropicale appartenente alla famiglia delle piperacee), abitudine che è considerata un fattore di rischio per i tumori delle vie aero-digestive superiori; anche in assenza di tabacco il masticare foglie di Betel rappresenta un fattore di rischio per il cancro della cavità orale (Aupérin et al., 2005). La noce di areca, che è spesso associata alle foglie di Betel, può indurre una fibrosi sotto-mucosa della bocca, che risulta essere uno stato precanceroso.
1.3.2 L’alcol
Nonostante l’etanolo puro non abbia mai mostrato uno specifico effetto cancerogeno negli esperimenti condotti su animali (Johnson, 2001), è stato dimostrato attraverso studi epidemiologici che il consumo di alcol è associato ad un aumento del rischio per il cancro delle vie aero-digestive superiori, anche in soggetti non fumatori (Kato et al., 1994).
E’ stato stimato che consumando 2,5 bicchieri al giorno (intendendo per bicchiere un quantitativo di bevanda contenente 10 g di alcol puro) il rischio di cancro della cavità orale e della faringe è doppio rispetto ai non bevitori, è triplo per un consumo di 5 bicchieri ed è moltiplicato per sei per un consumo di 10
bicchieri. Per il cancro alla laringe il rischio è moltiplicato per 1.3, 1.7 e 2.8 rispettivamente (Bagnardi et al., 2001).
Tutti i tipi di bevande alcoliche, se consumate abitualmente ad alte dosi, risultano essere nocive: un evidente aumento del rischio di contrarre la malattia è stato dimostrato per la birra (Bundgaard et al., 1995; Blot et al., 1988), per il vino (Andre et al., 1995; Franceschi et al., 1990) e per i liquori (Zheng et al., 1990). Tuttavia, tra le diverse popolazioni indagate i vari tipi di bevande mostrano stime del rischio differenti, con stime del rischio più elevate per quelle bevande che sono tipiche della popolazione in esame: ciò probabilmente è dovuto al fatto che i forti bevitori tendono a consumare più frequentemente le bevande che in quella zona sono più comuni, e quindi più economiche. In definitiva, le differenze nella stima del rischio riflettono più che altro diverse caratteristiche socioculturali, piuttosto che differenze nel potenziale cancerogeno delle varie bevande alcoliche (La Vecchia et al., 1997).
Un’ulteriore prova della relazione tra uso di alcol e insorgenza della neoplasia deriva dal lavoro di Winn e collaboratori del 1991, che mette in evidenza un’associazione tra l’aumento del rischio per il cancro della cavità orale e l’uso regolare di collutorio. E’ interessante notare che questa associazione dipende dal contenuto alcolico del collutorio: il rischio è evidente solo per concentrazioni superiori al 25%, ed aumenta in proporzione alla frequenza e alla durata dell’utilizzo.
E’ comunque importante considerare che l’alcol ha un elevato contenuto calorico, e tende a sopprimere l’appetito. In genere i forti bevitori tendono a spendere il loro denaro in bevande alcoliche, piuttosto che in cibo, e il loro metabolismo viene ulteriormente danneggiato dai danni epatici che derivano dall’abuso di alcol. Nei forti bevitori stati di carenze nutrizionali sono comuni (Harris et al., 1997), e questo potrebbe concorrere all’aumento del rischio di contrarre la malattia.
1.3.3 Associazione alcol-tabacco
Il consumo combinato di alcol e di tabacco aumenta enormemente il rischio di cancro delle vie aero-digestive superiori (Aupérin et al., 2005). Mentre ciascun fattore da solo può aumentare il rischio dalle due alle tre volte, l’esposizione ad entrambi i fattori produce un effetto moltiplicativo (Tuyns et al., 1988; Bundgaard et al., 1995; Franceschi et al., 1999; Castellasagué et al., 2004): quando il fumo di tabacco e il consumo di alcol sono associati il rischio può aumentare di oltre quindici volte.
Benché la maggior parte degli studi effettuati non si allontanino da questo modello, almeno altri due, uno condotto in Brasile e uno a Cuba, esibiscono risultati compatibili con un modello più che moltiplicativo (Garrote et al., 2001; Franco et al., 1989).
1.4 Lesioni precancerose
In generale, per “precursore” si intende una condizione che precede l’inizio patologico di una malattia, che non rappresenta necessariamente un fattore causale, ma che è associato con un aumento della probabilità dello sviluppo della patologia stessa (Dobrossy, 2005). Nel contesto dei tumori delle vie aero-digestive superiori, si distinguono lesioni precancerose e condizioni precancerose. Le condizioni precancerose si riferiscono ad uno stato generalizzato caratterizzato da cambiamenti a livello della mucosa (associato ad anemia, come ad es. le glossiti o la disfagia sideropenica che si osservano nei soggetti affetti da sindrome di Plummer-Vinson, oppure causate da lichen planus orale) che portano ad un significativo aumento del rischio di cancro. Per lesione precancerosa si intende invece un tessuto morfologicamente alterato nel quale il cancro si sviluppa più frequentemente rispetto alla sua controparte normale (Pindborg, 1994).
Eritroplachia e leucoplachia sono due tra le più importanti lesioni precancerose ad alto rischio. L’eritroplachia è un termine clinico usato per descrivere qualsiasi lesione della mucosa orale che si manifesta con placche di
colore rossastro, che non può essere né clinicamente né istologicamente correlata ad una patologia nota (Reibel, 2003). Displasia, carcinoma in situ o carcinoma a cellule squamose invasivo vengono diagnosticati in ben il 90% di questo tipo di lesioni (Neville e Day, 2002).
La leucoplachia consiste in una placca bianca clinicamente e istologicamente non correlabile ad alcuna causa o patologia nota (Bsoul et al., 2005). Questa lesione risulta fortemente associata all’uso di tabacco in ogni sua forma (Banoczy et al., 2001). Una recente analisi di 23 studi condotti in tutto il mondo ha rilevato una prevalenza globale che varia dall’1.49% al 2.6%; gli uomini sono affetti da questo tipo di lesione più frequentemente delle donne (Petti, 2003). I dati riguardanti il tasso di trasformazione maligna della leucoplachia sono limitati e di difficile interpretazione; tuttavia i dati disponibili indicano un tasso che va dal 3.6% al 17.5% (Neville e Day, 2002).
1.5 Tabacco come xenobiotico
Il fumo di sigaretta è un agente xenobiotico costituito da un aerosol contenente circa 1010 particelle/ml e circa 4800 composti chimici differenti (Pfeifer et al.,
2002). La fase gassosa è costituita principalmente da: azoto (60%), ossigeno (13%), anidride carbonica (13%), monossido di carbonio (3.5%), acqua (2%), argon (1%), idrogeno (0.1-0.2%), acetone (1%), ossidi di azoto (NO, NO2, N2O;
< 0.1%) e composti volatili dello zolfo (< 0.1%). La fase particolata contiene più di 3500 composti, molti dei quali sono riconosciuti agenti cancerogeni, tra cui gli idrocarburi aromatici policiclici (PAHs), le N-nitrosamine, le amine aromatiche e i metalli (Hoffmann et al., 2001).
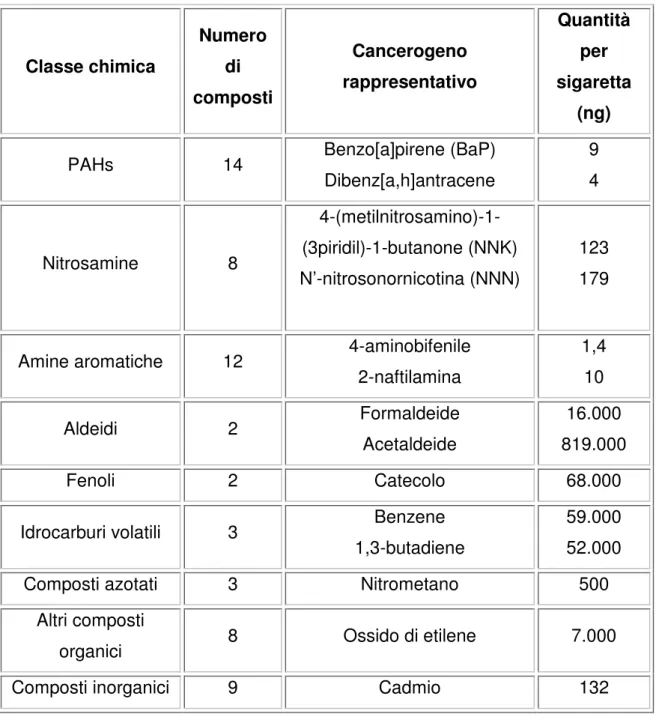
Nel fumo di sigaretta sono stati identificati più di 60 composti ad attività cancerogena (Tabella 1), che differiscono tra loro sia per la potenza sia per la concentrazione con la quale sono presenti. I forti cancerogeni, come i PAHs, le nitrosamine e le amine aromatiche, sono presenti in concentrazioni piuttosto basse (1-200 ng per sigaretta), mentre i cancerogeni deboli, come l’acetaldeide, sono presenti a concentrazioni più alte (circa 1mg per sigaretta). Il totale dei composti cancerogeni ammonta a 1-3 mg per sigaretta, una
quantità simile a quella della nicotina, anche se bisogna precisare che gran parte di essi sono agenti cancerogeni deboli, come acetaldeide e isoprene (Hecht, 2003). Classe chimica Numero di composti Cancerogeno rappresentativo Quantità per sigaretta (ng)
PAHs 14 Benzo[a]pirene (BaP)
Dibenz[a,h]antracene 9 4 Nitrosamine 8 4-(metilnitrosamino)-1-(3piridil)-1-butanone (NNK) N’-nitrosonornicotina (NNN) 123 179
Amine aromatiche 12 4-aminobifenile 2-naftilamina 1,4 10 Aldeidi 2 Formaldeide Acetaldeide 16.000 819.000 Fenoli 2 Catecolo 68.000
Idrocarburi volatili 3 Benzene
1,3-butadiene
59.000 52.000
Composti azotati 3 Nitrometano 500
Altri composti
organici 8 Ossido di etilene 7.000
Composti inorganici 9 Cadmio 132
TABELLA 1. Principali cancerogeni presenti nel fumo di sigaretta.
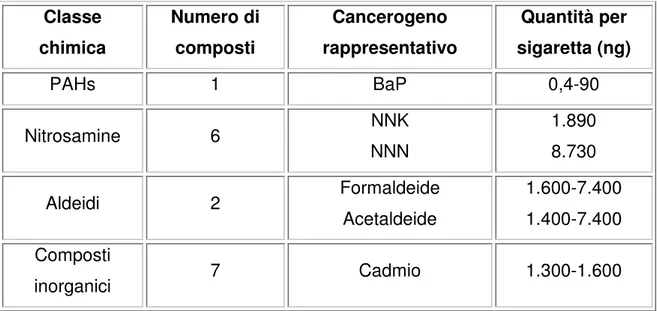
Il tabacco da masticare contiene una quantità minore di cancerogeni (Tabella
effetto del processo di combustione (Hecht, 2003). I livelli di PAHs risultano relativamente bassi, mentre le nitrosamine tabacco specifiche, come NNN e NNK, rappresentano i principali agenti cancerogeni. Questi composti si formano dagli alcaloidi del tabacco durante la sua conservazione e il suo processamento, benché sia stata documentata la presenza di queste nitrosamine anche nelle foglie fresche di tabacco (Hoffmann et al., 1994). Inoltre sono presenti aldeidi e metalli in quantità significative.
Classe chimica Numero di composti Cancerogeno rappresentativo Quantità per sigaretta (ng) PAHs 1 BaP 0,4-90 Nitrosamine 6 NNK NNN 1.890 8.730 Aldeidi 2 Formaldeide Acetaldeide 1.600-7.400 1.400-7.400 Composti inorganici 7 Cadmio 1.300-1.600
TABELLA 2. Principali cancerogeni presenti nel tabacco non fumato.
La fase particolata del fumo di sigaretta causa cancro alla laringe negli animali da laboratorio, e questo effetto cancerogeno è stato attribuito principalmente ai PAHs (Wogan et al., 2004). La presenza delle caratteristiche mutazioni di p53 identificate nei tumori laringei nell’uomo supporta l’ipotesi del ruolo predominante dei PAHs nello sviluppo di queste neoplasie. Sempre secondo studi condotti su animali da laboratorio, PAHs, NNK e NNN rappresentano i maggiori agenti cancerogeni per il cancro della cavità orale e della faringe nei soggetti fumatori (Hoffmann e Hecht, 1990). Inoltre NNK e NNN sono i maggiori agenti cancerogeni per il cancro del cavo orale nei soggetti che consumano tabacco non fumato, dato che sono i principali composti con un potente effetto cancerogeno presenti in questi prodotti; essi inducono infatti
tumori del cavo orale negli animali da laboratorio quando queste nitrosamine vengono somministrate insieme (Hecht e Hoffmann, 1988; Hecht et al., 1986).
La risposta dell’organismo all’esposizione dei cancerogeni è del tutto simile a quella verso qualsiasi altro composto esogeno. Molti dei cancerogeni presenti nel tabacco necessitano di un’attivazione metabolica per poter esplicare i propri effetti dannosi, benché alcuni, come la formaldeide e l’acetaldeide, possano agire direttamente. L’attivazione metabolica è generalmente iniziata dai citocromi P450, che rappresentano i maggiori enzimi di fase I coinvolti nell’ossidazione degli xenobiotici. Questi enzimi catalizzano la reazione di aggiunta di un atomo di ossigeno; in questo modo aumenta la solubilità del composto esogeno, che viene reso più facilmente eliminabile dall’organismo (Guengerich, 2001). Questo processo di “detossificazione metabolica” è ulteriormente aiutato dagli enzimi di fase II, che convertono l’agente cancerogeno ossidato in una forma altamente solubile in acqua (Pfeifer et al., 2002). Tuttavia, alcuni degli intermedi che si formano attraverso l’azione dei citocromi P450 sono di fatto composti reattivi, che generalmente possiedono un centro elettrofilo. Questi intermedi possono reagire con il DNA, formando degli addotti; in altre parole questi composti reattivi possono legare covalentemente le molecole di DNA, formando dei complessi. Questo processo, che converte un agente cancerogeno inattivo in una forma capace di legare il DNA, viene definito come attivazione metabolica (Miller, 1994). L’equilibrio tra attivazione metabolica e detossificazione varia da individuo a individuo e influenza il rischio di sviluppare la neoplasia, dato che la formazione di addotti tra DNA e cancerogeni è un evento centrale nel processo di cancerogenesi (Wiencke, 2002; Hecht, 1999).
1.5.1 Metabolismo dei PAHs
Gli idrocarburi aromatici policiclici hanno bisogno di un’attivazione metabolica per esercitare i propri effetti mutageni e cancerogeni (Miller e Miller, 1966; Miller, 1978). Nella maggior parte dei casi, l’ossidazione dei PAHs catalizzata
dai citocromi P450 rappresenta l’evento iniziale di questo processo di attivazione, che porta alla produzione di composti polari elettrofili biochimicamente reattivi in grado di interagire con le macromolecole cellulari, in modo particolare con gli acidi nucleici e le proteine (Xue e Warshawsky, 2005).
Sono state identificate tre principali vie metaboliche, supportate da evidenze sperimentali. Una di queste, considerata il principale meccanismo attraverso il quale i PAHs esercitano il loro effetto cancerogeno, comporta la successione di tre reazioni: inizialmente i citocromi P450 catalizzano l’ossidazione di un doppio legame, con la formazione di un epossido; successivamente si ha l’idrolisi dell’epossido attraverso l’azione dell’enzima epossido idrolasi microsomale (mEH) in un diidridiolo; infine, con una seconda reazione catalizzata dai citocromi P450, si ha l’ossidazione di un doppio legame adiacente al precedente con la formazione di un diol-epossido. Attraverso questa via nella molecola si forma una regione elettrofila capace di legare il DNA. Un esempio di questi composti altamente reattivi è illustrato in
Figura 1. Molti dei PAHs contenuti nel fumo di sigaretta vengono metabolizzati
attraverso questa via, tra i quali il benzo[a]pirene (Gelboin, 1980).
Figura 1. Struttura chimica del 3S,4R,1R,2S-BaA-diolepossido.
Gli addotti tra i PAH-diol-epossidi e il DNA si formano principalmente attraverso il legame tra il carbonio benzilico del PAH (indicato dalla freccia in Figura 1) e l’amino gruppo esociclico delle desossiguanosine e delle desossiadenosine (Xue e Warshawsky, 2005). La reattività dei PAH-diol-epossidi con i due nucleosidi purinici dipende dalla struttura chimica dei PAHs: quelli che derivano
da PAHs planari, come il BaP, mostrano una grossa preferenza per i residui di desossiguanosina, mentre quelli che derivano da PAHs non planari, come il benzo[c]fenantrene (BcPh), tendono a reagire con i residui di desossiadenosina (Dipple et al., 1987; Jernstrom e Graslund, 1994).
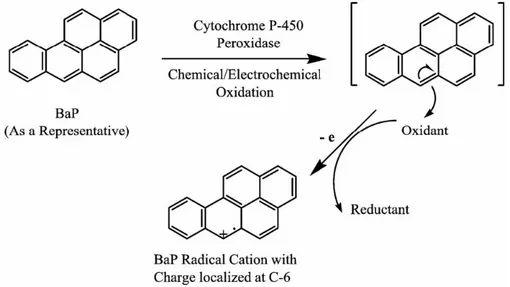
Una via metabolica alternativa, ritenuta un’ulteriore modalità di attivazione dei PAHs, è rappresentata dall’ossidazione catalizzata dalla perossidasi P450 (Cavalieri e Rogan, 1992, 1995), che porta alla formazione di un radicale cationico (Figura 2). Il radicale cationico è elettrofilo, quindi in grado di interagire con i centri nucleofili delle macromolecole cellulari. Gli addotti che si formano tra il radicale e il DNA sono complessi instabili, che portano tendenzialmente ad una depurinazione spontanea (Cavalieri e Rogan, 2005). Questi addotti instabili si formano principalmente attraverso il legame con l’N7 delle guanine e con l’N7 o l’N3 delle adenine; ciò comporta la rottura del legame glicosidico e il distacco del desossiribosio. La depurinazione spontanea che ne risulta porta alla formazione di siti apurinici, che rappresentano il maggiore danno al DNA causato da questi composti.
Figura 2. Formazione di un radicale cationico attraverso la reazione catalizzata dalla perossidasi P450.
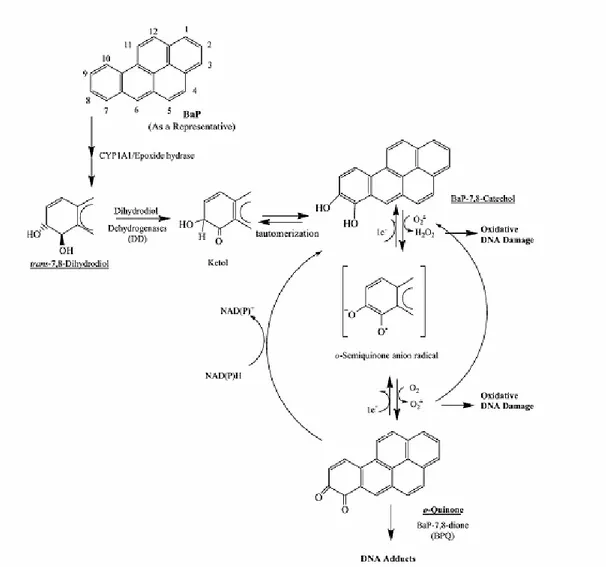
Una terza via metabolica che porta all’attivazione dei PAHs è catalizzata dalle diidrodiolo deidrogenasi (DDs), con la formazione di o-chinoni (Penning et al., 1996, 1999). Questa reazione, NAD(P)+-dipendente, porta inizialmente alla formazione di un chetolo, che spontaneamente si riarrangia a formare un catecolo; successivamente questo composto instabile subisce un’auto-ossidazione, dando origine ad un o-chinone (reazione illustrata in Figura 3). Questa molecola mostra un’elevata reattività nei confronti di tioli, glutatione e cisteine, ed è in grado di generare vari tipi di addotti con il DNA (Xue e Warshawsky, 2005).
Figura 3. Attivazione metabolica dei PAHs attraverso l’azione dell’enzima diidrodiolo deidrogenasi.
Da questa via metabolica inoltre si originano forme reattive dell’ossigeno: la prima reazione di ossidazione, che porta alla formazione di un anione radicale, produce perossido di idrogeno; la seconda ossidazione, che porta alla formazione dell’o-chinone, produce un anione superossido, che può propagare una successiva reazione di auto-ossidazione di un altro catecolo. L’o-chinone prodotto dalle DDs può subire una riduzione, con la presenza di un cofattore riducente, per tornare a formare l’anione radicale e successivamente catecolo. In questo modo si stabilisce un ciclo attraverso il quale vengono generate grandi quantità di forme reattive dell’ossigeno (Flowers-Geary et al., 1996; Penning et al., 1996), che possono reagire con le molecole di DNA ed indurre danno ossidativo.
1.5.2 Origine e metabolismo delle N-nitrosamine tabacco specifiche
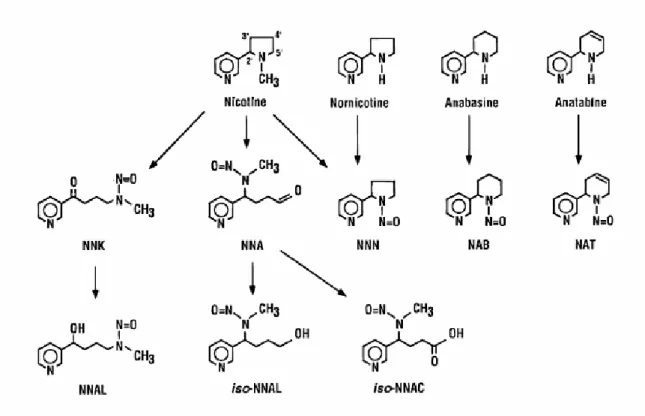
Le N-nitrosamine sono dei composti chimici stabili che derivano dalla reazione di amine secondarie e terziarie con agenti nitrosanti (Hecht e Hoffmann, 1988). Il tabacco contiene numerosi alcaloidi, tra i quali il più significativo è la nicotina; essa rappresenta circa l’ 1-2% del tabacco da masticare ed è presente nel fumo di sigaretta a concentrazioni di 0.5-2 mg per sigaretta. Diversi altri alcaloidi strutturalmente correlati alla nicotina sono stati ritrovati nel tabacco, alcuni dei quali sono raffigurati in Figura 4.
Nicotina Nornicotina Anabasina Anatabina
Come si può osservare dalla figura, la nicotina è un’amina terziaria, mentre nornicotina, anabasina e anatabina sono amine secondarie. Nel caso di amine secondarie, il risultato di una reazione di nitrosazione è la sostituzione di N–H con N–N=O; invece nel caso di amine terziarie il legame azoto–carbonio viene rotto per ossidazione (vedi Figura 5). In questo modo la nitrosazione della nicotina con nitrito di sodio produce un nitrosamino chetone, denominato NNK, una nitrosamino aldeide, NNA, e N’-nitrosonornicotina (NNN), che si forma attraverso la perdita del gruppo metilico (Hecht et al., 1978). Complessivamente, NNK, NNN, NNA, NAB e NAT, illustrate in Figura 5, sono conosciute come nitrosamine tabacco-specifiche.
Dato che il nitrito è presente nella saliva e che ossido di azoto è presente nel fumo di sigaretta, quantità aggiuntive di nitrosamine probabilmente possono formarsi in vivo attraverso la reazione di questi agenti nitrosanti con la nicotina e gli altri alcaloidi (Hecht e Hoffmann, 1988).
Figura 5. Struttura delle nitrosamine tabacco-specifiche e dei loro precursori. Con l’eccezione di NNA, tutte sono state ritrovate nei prodotti del tabacco.
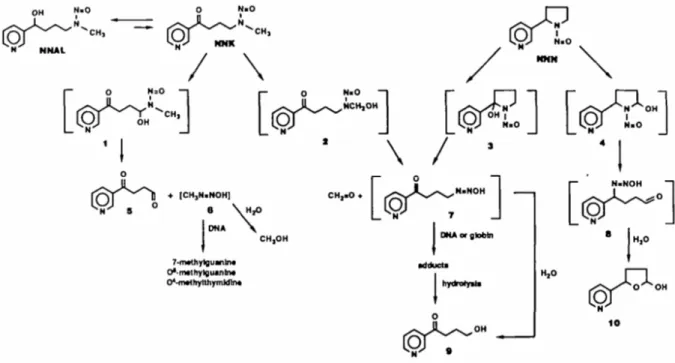
Le nitrosamine richiedono un’attivazione metabolica per legare il DNA e le altre macromolecole cellulari (Hecht, 1998). Il metabolismo di NNK (Figura 6) prevede un’iniziale riduzione del gruppo carbonilico a NNAL (Hecht et al., 1980, 1997), l’ossidazione dell’azoto piridinico (Carmella et al., 1997) e un’idrossilazione del carbonio metilenico e metilico adiacenti all’azoto N-nitroso (α-idrossilazione) (Peterson et al., 1991). La maggior parte di queste reazioni sembrano essere catalizzate dai citocromi P450: le isoforme 2A6 e 3A4 sono implicate nell’α-metilen idrossilazione nel fegato umano (Patten et al., 1996), mentre il P450 1A2 sembra essere importante nella catalisi dell’α-metil idrossilazione (Smith et al., 1992, 1996). Pochi dati sono disponibili sul ruolo dei P450 nell’ossidazione dell’azoto piridinico; comunque uno studio mostra una correlazione tra la formazione di N-ossidi di NNK e l’attività di P450 3A4 negli epatociti umani (Staretz et al., 1997). Per quanto riguarda la riduzione del gruppo carbonilico, i citocromi P450 non rappresentano i maggiori catalizzatori, ma questa reazione sembra essere mediata da carbonil reduttasi (Hecht, 1998).
Per quanto riguarda l’NNN (Figura 6), le principali vie metaboliche prevedono un’iniziale α-idrossilazione del carbonio 2’ e 5’ (Chen et al., 1978) e un’ossidazione dell’azoto piridinico (Castonguay et al., 1983). Nel fegato umano la via metabolica principale è rappresentata dalla idrossilazione del carbonio 5’ (Staretz et al., 1997; Hecht et al., 1979; Patten at al., 1997). Mentre l’enzima P450 3A4 è coinvolto nell’idrossilazione del carbonio 2’, il citocromo che svolge il ruolo predominante nell’idrossilazione del carbonio 5’ sembra essere il 2A6 (Patten et al., 1997).
La via metabolica più importante nell’attivazione delle nitrosamine è rappresentata dall’α-idrossilazione, che porta alla formazione di intermedi in grado di legare il DNA (Hecht e Hoffmann, 1988). Come illustrato in Figura 6, l’α-idrossilazione del gruppo metilenico di NNK produce CH3N═NOH, che è in
grado di reagire con il DNA generando 7-mG, O6-mG e O4-mT (Hecht, 1998). E’ stato dimostrato che tra queste, almeno l’O6-metilguanina è in grado di
causare mutazioni, prevalentemente del tipo G → A (Loechler et al., 1984). L’α-idrossilazione del carbonio metilico comporta invece la formazione di composti, come il composto 7 illustrato in figura 6, in grado di produrre addotti piridilossobutil-DNA (Hecht, 1998). Questi addotti inibiscono l’AGT, l’enzima responsabile della riparazione di O6-mG (Peterson et al., 1993). Poiché l’O6 -mG è anch’essa formata in seguito all’attivazione metabolica di NNK, è chiara l’importanza di questo fenomeno, che comporta la persistenza di O6-mG nei
tessuti esposti a NNK.
1.6 Tabacco e cancro: meccanismo di cancerogenesi
Nel meccanismo di cancerogenesi mediato dal tabacco l’evento cruciale è rappresentato dalla formazione di addotti al DNA. Interferendo con la formazione di questi complessi, si assiste ad una diminuzione della capacità dei cancerogeni contenuti nel tabacco di indurre il cancro (Hecht, 1998; Boysen et al., 2003; Kensler et al., 1999; Adriaenssens et al., 1983). I sistemi di riparazione cellulari sono deputati alla rimozione di questi addotti e al ripristino delle condizioni strutturali normali del DNA (Norbury e Hickson, 2001; Goode et
al., 2002), ma se questi addotti sfuggono ai sistemi di riparazione e persistono, possono insorgere delle mutazioni. Le cellule che hanno subito un danno permanente possono essere rimosse attraverso il processo di morte programmata (apoptosi). Se queste mutazioni si generano in regioni critiche di oncogeni, come RAS e MYC, o in geni onco-soppressori, come TP53 e CDKN2A (che codifica per la proteina p16), il risultato può essere l’attivazione dell’oncogene o la disattivazione del gene onco-soppressore. Eventi multipli di questa natura portano alla formazione di cellule aberranti che hanno perso il normale controllo della crescita cellulare e infine a cellule neoplastiche (Wogan et al., 2004).
Studi più recenti indicano, comunque, che ulteriori effetti dannosi della nicotina e delle nitrosamine tabacco-specifiche, come NNK, potrebbero essere mediati attraverso recettori posti sulla superficie cellulare (Hecht, 2003). La nicotina, NNK, e probabilmente anche NNAL, hanno la capacità di legare i recettori nicotinici per l’acetilcolina, portando all’attivazione della serina/treonina chinasi AKT (conosciuta anche come protein chinasi B), della protein chinasi A e di altri fattori di trasduzione (West et al., 2003). L’attivazione di questi segnali intracellulari comporta vari effetti, tra cui inibizione dell’apoptosi, aumento nella formazione dei metaboliti dell’acido arachidonico e aumento della proliferazione cellulare. La nicotina ha anche la capacità di stimolare l’angiogenesi e la crescita tumorale (Heeschen et al., 2001). Tutti questi effetti sono mediati dal legame con il recettore nicotinico per l’acetilcolina, ma probabilmente è coinvolta anche la produzione di ossido di azoto, di prostacicline e di fattore di crescita vascolare da parte dell’endotelio. Tutti questi dati suggeriscono che la nicotina potrebbe avere un ruolo di promozione nello sviluppo del tumore, o un’attività co-cancerogena. Bisogna comunque precisare che studi sulla cancerogenicità della nicotina sono risultati prevalentemente negativi, eccetto in casi in cui la nicotina veniva somministrata in condizioni di iperossia (Schuller et al., 1995).
L’esposizione agli agenti cancerogeni e co-cancerogeni contenuti nel tabacco deve protrarsi in maniera cronica per circa trent’anni affinché il cancro si sviluppi (Hecht, 2003). Il cancro delle vie aero-digestive superiori si sviluppa
attraverso l’accumulo di alterazioni genetiche multiple: la mutazione di geni onco-soppressori, l’amplificazione e l’aumentata espressione di oncogeni è stata frequentemente riscontrata in questo tipo di neoplasie (Brennan et al., 1995; Hasegawa et al., 2002; Izzo et al., 2003). Molte di queste alterazioni insorgono a stadi precoci della cancerogenesi e sono state identificate anche in lesioni precancerose del tratto aero-digestivo superiore, in soggetti che sono cronicamente esposti ai cancerogeni (Mao et al., 1996). Il danno al DNA che risulta da questa esposizione protratta nel tempo è coerente con un modello progressivo, attraverso il quale un tessuto epiteliale normale subisce delle trasformazioni graduali, dall’iperplasia alla displasia, fino al carcinoma in situ e al tumore invasivo (Califano et al., 1996).
1.7 Alcol e cancro delle vie aero-digestive superiori
Benché i dati epidemiologici supportino chiaramente il ruolo dell’alcol come un fattore di rischio indipendente per il cancro delle vie aero-digestive superiori, il meccanismo attraverso il quale l’alcol esplica questo effetto cancerogeno è ancora poco chiaro. Studi sperimentali effettuati sugli animali da laboratorio non mostrano alcun effetto cancerogeno diretto dell’etanolo puro (Boffetta e Hashibe, 2006).
La maggior parte dell’etanolo che viene introdotto nell’organismo viene metabolizzata attraverso l’azione dell’enzima alcol deidrogenasi (ADH), che ossida l’etanolo ad acetaldeide. L’ADH è un enzima citosolico dimerico contenente zinco, la cui attività è dipendente dal NAD; esso è un membro di una vasta superfamiglia di enzimi che catalizzano l’ossidazione di una larga varietà di alcoli, sia endogeni che esogeni (Ehrig et al., 1990). L’ossidazione dell’etanolo ad acetaldeide rappresenta la tappa limitante nel metabolismo dell’alcol. L’alcol deidrogenasi è composta da 5 subunità (α, β, γ, π e χ; Duester et al., 1999), codificate da 7 geni, da ADH1 a ADH7. Le alcol deidrogenasi appartenenti alla classe I (ADH1, ADH2 e ADH3), che sono responsabili della maggior parte dell’ossidazione dell’etanolo in vivo, sono formate da una combinazione omodimerica o eterodimerica delle subunità α, β
e γ, codificate rispettivamente dai loci ADH1, ADH2 e ADH3 (Yokoyama e Omori, 2003). L’espressione delle ADH all’interno delle mucose differisce significativamente lungo le vie aero-digestive: l’esofago e la cavità orale presentano un’elevata attività di questi enzimi, ed in particolare risulta elevata l’espressione di ADH7 (Yin et al., 1993; Dong et al., 1996). Anche la normale flora batterica orale contribuisce alla formazione di acetaldeide dall’etanolo (Muto et al., 2000).
Successivamente l’acetaldeide prodotta viene convertita ad acido acetico, attraverso l’azione dell’enzima aldeide deidrogenasi (ALDH): la maggior parte dell’acetaldeide generata attraverso il metabolismo dell’etanolo in vivo viene rapidamente eliminata dall’ALDH2, un enzima mitocondriale omotetramerico codificato dal gene ALDH2 (Bosron e Li, 1986). Questo enzima è espresso in molti organi, incluso lo stomaco e il colon, ma non nella cavità orale (Dong et al., 1996), dove la sua espressione appare estremamente debole.
E’ stato ipotizzato che gran parte della potenza cancerogena dell’alcol sia mediata attraverso il suo primo metabolita, l’acetaldeide (Homann et al., 2000). Studi effettuati su topi esposti cronicamente a vapori di acetaldeide hanno dimostrato che questo composto è in grado di aumentare significativamente l’incidenza di tumori nasali (Woutersen et al., 1986), mentre numerosi studi hanno documentato la capacità dell’acetaldeide di aumentare la frequenza di scambi tra cromatidi fratelli e di aberrazioni cromosomiche in cellule di mammifero (Obe e Anderson, 1987).
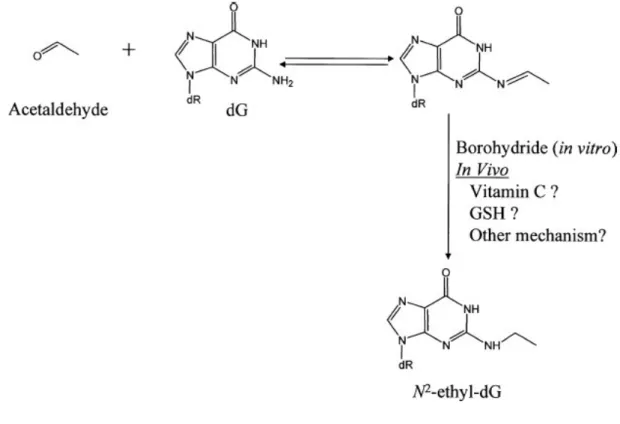
La più conosciuta e la più studiata lesione al DNA provocata dall’acetaldeide è rappresentata dall’N2-etil-2’-desossiguanosina (Brooks e Theruvathu, 2005). E’ importante sottolineare che la reazione dell’acetaldeide con la desossiguanosina produce un composto instabile; come illustrato in
Figura 7, la formazione del composto stabile N2-etil-dG richiede una
successiva riduzione (Vaca et al., 1995). Affinché questo complesso possa formarsi in vivo questa riduzione deve essere catalizzata da qualche molecola o enzima intracellulare. La vitamina C e il glutatione possono portare avanti la reazione in vitro (Fang e Vaca, 1995); questi composti potrebbero essere coinvolti anche nella reazione in vivo. Questo addotto risulta essere mutageno
in Escherichia coli (Terashima et al., 2001), ma non nelle cellule di mammifero (Matsuda et al., 1999; Perrino et al., 2003).
Figura 7. Meccanismo di formazione dell’N2-etil-2’-desossiguanosina
attraverso la reazione dell’acetaldeide con la desossiguanosina. GSH ═ glutatione.
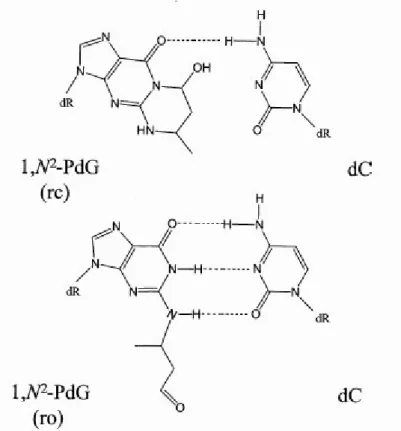
Comunque, la reazione tra acetaldeide e DNA può risultare nella formazione di altri tipi di addotti, diversi dall’N2-etil-dG (Wang et al., 2000), tra i quali l’1,N2 -propano-2’-desossiguanosina (1,N2-PdG). La formazione di quest’ultimo composto richiede una quantità di acetaldeide pari a 40mM, livelli che non vengono raggiunti in vivo in seguito al metabolismo dell’etanolo. Tuttavia gli aminoacidi lisina e arginina possono facilitare tale reazione (Sako et al., 2002). Questi aminoacidi aa sono presenti ad elevate concentrazioni nelle proteine istoniche; è da notare che anche gli istoni direttamente possono facilitare la formazione di PdG (Sako et al., 2003). Altri composti basici abbondanti nella cellula sono le poliamine, come spermina, spermidina e putrescina; anche la spermina e la spermidina possono facilitare la reazione (Brooks e Theruvathu, 2005).
Nel DNA a singolo filamento il PdG esiste nella sua forma ciclica (Figura 8), che rappresenta la configurazione con proprietà metagene: durante la replicazione la presenza di questo complesso comporta la sostituzione della desossiguanosina con una desossicitosina (de los Santos et al., 2001). Nel DNA a doppio filamento il PdG esiste invece nella sua forma aperta (Figura 8). Probabilmente, durante la replicazione e la trascrizione del DNA, c’è una continua interconversione tra le due forme, a causa della presenza di temporanee regioni di DNA a singolo filamento che si formano nel corso di questi processi (Brooks e Theruvathu, 2005).
Figura 8. Struttura dell’1,N2-propano-2’-desossiguanosina nella sua forma
ciclica (rc) e nella sua forma aperta (ro).
La presenza del gruppo aldeidico libero nella configurazione aperta permette la formazione di ulteriori complessi al DNA, inclusi addotti DNA-proteine e legami crociati DNA-DNA (Brooks e Theruvathu, 2005). Sulla base di queste considerazioni, la creazione di 1,N2-PdG dall’acetaldeide, stimolata dalla
plausibile meccanismo per spiegare molti degli effetti tossici accertati dell’acetaldeide, che è il maggiore metabolita dell’etanolo.
Un altro meccanismo attraverso il quale l’alcol potrebbe sviluppare il suo effetto cancerogeno consiste nella sua azione diretta sul doppio strato fosfolipidico delle membrane cellulari: l’alcol potrebbe funzionare come un solvente sulle membrane delle cellule della mucosa, rendendo la mucosa stessa più permeabile. Tutto questo porterebbe ad un aumento nella possibilità di penetrazione da parte di altri cancerogeni (Odgen e Wight, 1998; Simanowski et al., 1995). In effetti è stato dimostrato che l’etanolo è in grado di aumentare la penetrazione dei cancerogeni del tabacco, come la NNN, attraverso la mucosa orale (Squier et al., 1986), ed inoltre è stato provato in vitro un aumento della permeabilità di tessuto linguale umano, nei confronti di molecole ad alto peso molecolare, in presenza di alcol (Howie et al., 2001). Benché questa ipotesi potrebbe spiegare l’effetto sinergico di tabacco e alcol, essa non rende ragione dell’aumento del rischio che si osserva tra i forti bevitori che non fumano.
Altri fenomeni, quindi, potrebbero essere implicati. Altri composti presenti nelle bevande alcoliche, diversi dall’etanolo, potrebbero essere responsabili dell’aumento del rischio. Idrocarburi aromatici policiclici sono stati ritrovati nei liquori come il whisky, e N-nitrosamine sono state identificate nella birra (Boffetta e Hashibe, 2006); tuttavia informazioni precise sulla composizione delle bevande alcoliche, specialmente dei liquori, sono limitate. Se questi agenti contaminanti fornissero un contributo importante nell’azione cancerogena, il rischio dovrebbe variare a seconda del tipo di bevanda. Tuttavia, non è stata riscontrata alcuna relazione tra tipo di bevanda alcolica e rischio per il cancro delle vie aero-digestive superiori.
Un abuso costante e prolungato di alcol comporta spesso una carenza di importanti fattori nutrizionali, attraverso una riduzione del consumo di cibi ricchi in micronutrienti, un danneggiamento dell’assorbimento intestinale e attraverso un cambiamento delle normali vie metaboliche (Lieber, 2003). L’alcol interferisce con il metabolismo della vitamina A, che attraverso il suo metabolita, l’acido retinoico, controlla la proliferazione, la crescita e la
differenziazione cellulare, nonché l’apoptosi. Individui che consumano forti quantità di alcol presentano basse concentrazioni plasmatiche di vitamina A e di β-carotene (Leo e Lieber, 1999) e il metabolismo della vitamina A subisce significativi cambiamenti in seguito ad un consumo cronico di alcol (Wang, 2003). L’abuso di alcol riduce inoltre la sorveglianza immunitaria, favorendo in tal modo lo sviluppo del cancro e la diffusione di metastasi (Cook, 1998).
1.8 Suscettibilità genetica
Sebbene alcol e tabacco siano stati identificati chiaramente quali principali fattori di rischio per il cancro delle vie aero-digestive superiori, esiste un’evidente disparità fra la larga fascia di persone esposte a questi cancerogeni e il piccolo numero di persone che effettivamente contraggono la malattia (Biolchini et al., 2005). Una parte di questa disparità potrebbe essere spiegata attraverso differenze nell’efficienza dei processi di attivazione metabolica e detossificazione dei cancerogeni e dei pro-cancerogeni (Lazarus e Park, 2000); pertanto, il rischio individuale di sviluppare questa neoplasia potrebbe essere determinato, almeno in parte, da un diverso grado di espressione e/o attività di enzimi coinvolti nell’attivazione (enzimi di fase I) o nella deattivazione (enzimi di fase II) dei cancerogeni. Gli enzimi coinvolti nel metabolismo degli xenobiotici (XMEs) sono una famiglia di enzimi che sono presenti principalmente nel fegato, ma che si ritrovano anche nelle vie aero-digestive superiori. Alcuni di questi sono polimorfici e potrebbero alterare, in misura importante, la risposta biologica individuale agli agenti cancerogeni (Biolchini et al., 2005).
1.9 Gli studi di associazione
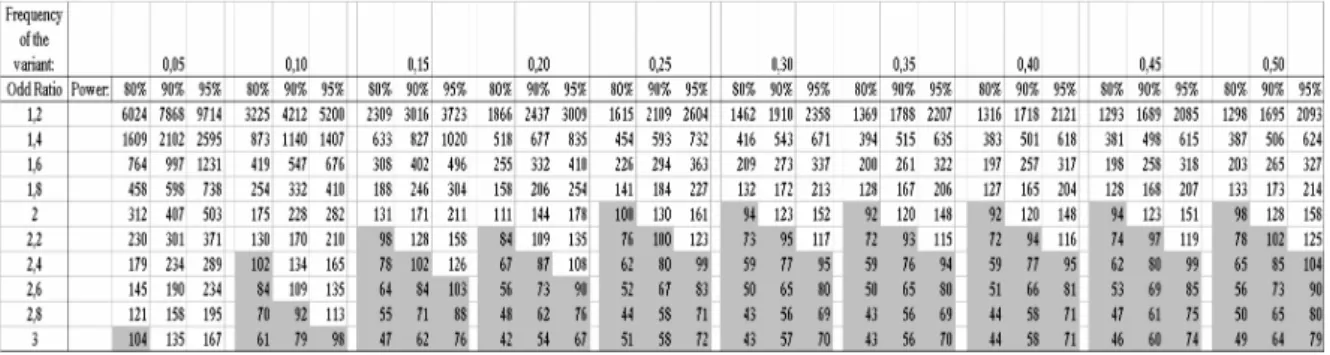
Quando si studiano fattori genetici di bassa penetranza e casi sporadici di caratteri complessi, come il cancro, un metodo di indagine idoneo è quello di effettuare uno studio di associazione di tipo caso-controllo. Esistono due principali tipi di studio di associazione caso-controllo: quello per dati appaiati e quello per dati non appaiati, che è il tipo di studio che abbiamo utilizzato nel nostro lavoro. Uno studio di associazione caso-controllo si basa sul confronto di due gruppi di individui: un gruppo è costituito da soggetti che presentano la malattia (i “casi”), il secondo gruppo invece è di soggetti sani (i “controlli”). I controlli sono scelti in modo che siano rappresentativi della popolazione generale e che abbiano caratteristiche simili a quelle dei casi (come ad esempio l’eta’ media, la condizione socio-economica e il rapporto dei sessi). Tramite il confronto delle frequenze genotipiche osservate nei casi e nei controlli è possibile evidenziare fattori di suscettibilità a bassa penetranza che aumentano o diminuiscono il rischio. Questo metodo si è rivelato efficace anche per identificare alcuni dei fattori di rischio per il cancro delle vie aero-digestive superiori.
1.10 Precedenti studi di associazione
Come precedentemente descritto, i composti chimici presenti nel tabacco e nelle bevande alcoliche subiscono un’attivazione metabolica attraverso l’azione degli enzimi di fase I, principalmente dei citocromi P450; questi enzimi catalizzano reazioni che portano alla formazione di gruppi funzionali all’interno dei loro substrati, generando in questo modo cancerogeni attivi. Questi possono legarsi al DNA e formare degli addotti, causando un danno al materiale genetico.
I citocromi P450 appartengono ad una superfamiglia composta da oltre cento enzimi diversi; per gran parte di essi sono state individuate differenze
inter-individuali nella loro attività enzimatica che potrebbero determinare variazioni nella capacità di metabolizzare i cancerogeni, rappresentando quindi dei fattori di suscettibilità al tumore (Gonzàlez et al., 1998). Per quanto riguarda il cancro delle vie aero-digestive superiori, gli enzimi appartenenti a questa famiglia maggiormente studiati sono il CYP1A1, il CYP2E1, il CYP2D6 e il CYP1B1.
Il CYP1A1 è coinvolto nell’attivazione del benzo[a]pirene e di altri idrocarburi aromatici presenti nel fumo di sigaretta (Gonzalez e Gelboin, 1994). Sono stati identificati due polimorfismi per questo gene che risultano in un incremento della sua attività (Crofts et al., 1994): una sostituzione isoleucina → valina nell’esone 7 e una mutazione puntiforme T → C nella regione 3’-UTR (Msp1). Gli studi di associazione precedentemente realizzati non hanno mostrato nessuna significativa relazione tra il polimorfismo Msp1 e rischio per il cancro delle vie aero-digestive superiori (Gronau et al., 2003; Kao et al., 2002; Oude Ophuis et al., 1998; Jahnke et al., 1996). Per quanto concerne il polimorfismo nell’esone 7 i dati sono contrastanti: mentre gran parte degli studi non sono stati in grado di rilevare alcuna associazione (Evans et al., 2004; Gronau et al., 2003; Olshan et al., 2000; Oude Ophuis et al., 1998; Jahnke et al., 1996), Kao et al. (2002) e Morita et al. (1999) hanno invece dimostrato un aumento del rischio per il genotipo Val/Val, particolarmente per il cancro del cavo orale e della faringe.
Il CYP2E1 catalizza l’attivazione metabolica di diversi composti presenti nel fumo di sigaretta, come l’N-nitroso-dimetilamina, il benzene e la NNN (Yamazaki et al., 1992); è responsabile inoltre dell’ossidazione dell’etanolo ad acetaldeide (Hayashi et al., 1991). Più di 25 polimorfismi sono stati identificati per questo gene (Li et al., 2005), alcuni dei quali sono stati studiati quali fattori di suscettibilità per il cancro delle vie aero-digestive superiori. In particolare, per i polimorfismi -1293G>C (Morita et al., 1999; Gonzalez et al., 1998), G1532C (Li et al., 2005) -1053C>T e 7632T>A (Neuhaus et al., 2004) non è stata riscontrata nessuna evidente associazione; il polimorfismo di recente identificazione -71G>T, correlato ad un aumento dell’espressione del gene, è
risultato invece associato ad un aumento del rischio tra i soggetti fumatori (Neuhaus et al., 2004).
Il CYP2D6 è coinvolto nella detossificazione della nitrosamina tabacco-specifica 4-(metilnitrosamino)-1-butanone (Rannug et al., 1995). Sono stati identificati tre rilevanti polimorfismi, che hanno come effetto l’inattivazione del gene: una sostituzione G → A nella giunzione tra l’introne 3 e l’esone 4, una delezione nell’esone 5 e una delezione totale del gene. Nessuno dei tre ha però mostrato una significativa correlazione con l’insorgenza del cancro delle vie aero-digestive superiori (Gronau et al., 2003; Gonzalez et al., 1998).
Anche il CYP1B1 è implicato nell’attivazione dei cancerogeni del tabacco, come gli idrocarburi aromatici policiclici e le amine aromatiche (Shimada et al., 1999). Tra i suoi polimorfismi, una sostituzione valina → leucina al codone 432 altera l’efficienza catalitica nella reazione di idrossilazione (Hanna et al., 2000); tuttavia non è stata riscontrata una significativa relazione tra questo polimorfismo e la suscettibilità a questo tipo di cancro (Li et al., 2005).
Tra gli enzimi di fase II coinvolti nella detossificazione dei composti cancerogeni contenuti nel tabacco un ruolo importante è sostenuto dalle glutatione-S-transferasi (GST); gli enzimi appartenenti a questa famiglia catalizzano la reazione di attacco del glutatione ad una vasta gamma di composti, tra i quali i radicali aromatici eterociclici e gli epossidi (Geisler e Olshan, 2001). La coniugazione facilita l’escrezione di questi substrati, quindi costituisce una tappa nel processo di detossificazione. Le GST sono formate da due subunità aggregate in omodimeri o eterodimeri e sono classificate in 5 classi: α, µ, π, σ e θ. Principalmente questi enzimi vengono espressi nel fegato, ma molti di essi sono stati ritrovati anche in tessuti extraepatici, come nel muscolo, nel cervello, nel cuore, nel sangue e nelle vie aero-digestive superiori (Hayes e Pulford, 1995). Tra gli enzimi appartenenti a questa famiglia i più studiati quali fattori di suscettibilità per il cancro delle vie aero-digestive superiori sono: GSTM1, GSTT1, GSTP1 e GSTM3.
GSTM1 è coinvolto nella detossificazione di agenti cancerogeni del
tabacco, come gli epossidi e i metaboliti idrossilati del benzo[a]pirene (Hayes e Pulford, 1995); il locus GSTM1 è polimorfico ed è caratterizzato dalla presenza
di almeno tre alleli, uno dei quali deriva da un’ampia delezione del gene e causa la perdita dell’attività enzimatica. Tale variante allelica è chiamata “GSTM1 nullo” (Seidegard et al., 1988). Alcuni studi di associazione, effettuati per valutare l’influenza di questo gene sulla suscettibilità al cancro delle vie aero-digestive superiori, hanno evidenziato un aumento del rischio di contrarre la malattia tra gli individui portatori dell’allele nullo (Gronau et al., 2003; Buch et al., 2002; Park et al., 2000; Cheng et al., 1999; Jourenkova et al., 1998). Tuttavia, numerosi studi non hanno rilevato tale associazione (Gajecka et al., 2005; Evans et al., 2004; To-Figueras et al., 2002; Hahn et al., 2002; Olshan et al., 2000; Katoh et al., 1999; Jourenkova-Mironova et al., 1999a; Morita et al., 1999; Matthias et al., 1998; Oude Ophuis et al., 1998; Gonzalez et al., 1998).
L’influenza del locus GSTT1, anch’esso dotato di un allele nullo, è una questione ancora più controversa: mentre numerosi studi non hanno rilevato alcuna correlazione (Gajecka et al., 2005; Gronau et al., 2003; To-Figueras et al., 2002; Buche t al., 2002; Olshan et al., 2000; Katoh et al., 1999; Matthias et al., 1998; Jourenkova et al., 1998; Oude Ophuis et al., 1998), alcuni hanno dimostrato un aumento del rischio per i soggetti portatori dell’allele nullo (Drummond et al., 2005; Sikdar et al., 2004; Jourenkova-Mironova et al., 1999a; Jahnke et al., 1996); Evans et al. (2004) hanno invece riscontrato un’associazione positiva tra la presenza dell’allele wild-type di GSTT1 e lo sviluppo del cancro delle vie aero-digestive superiori.
GSTP1 è responsabile della detossificazione dei metaboliti attivi degli
idrocarburi aromatici policiclici (Ali-Osman et al., 1997). Nel gene GSTP1 sono state identificate due varianti alleliche, GSTP1*B e GSTP1*C, oltre all’allele wild-type GSTP1*A. Entrambe le varianti sono caratterizzate dalla sostituzione A → G al nucleotide 313, che comporta il cambiamento di una isoleucina con una valina al codone 105. L’attività e l’affinità dell’enzima per i suoi substrati elettrofili risulta alterata dalla presenza della valina (Ali-Osman et al., 1997). Anche il ruolo di GSTP1 nello sviluppo della malattia risulta poco chiaro: gli studi condotti su questo polimorfismo hanno mostrato sia associazioni positive (Jourenkova-Mironova et al., 1999a) sia negative (Sikdar et al., 2004) con un aumento del rischio; bisogna inoltre precisare che diversi studi non hanno
mostrato evidenti associazioni (Evans et al., 2004; To-Figueras et al., 2002; Olshan et al., 2000; Jourenkova-Mironova et al., 1999b).
Un altro membro della classe µ è GSTM3; per questo gene sono stati identificati due alleli: GSTM3*A e GSTM3*B. Quest’ultimo contiene una delezione di 3 pb nell’introne 6 che genera un motivo di riconoscimento per il fattore di trascrizione YY1. E’ stato ipotizzato che la presenza dell’allele GSTM3*B comporti un aumento della trascrizione del gene, forse promuovendo l’azione detossificante dell’enzima (Yengi et al., 1996). Mentre alcuni studi hanno in effetti supportato quest’ipotesi, dimostrando una diminuzione del rischio per gli individui portatori dell’allele GSTM3*B (Sidkar et al., 2004; Park et al., 2000; Matthias et al., 1998; Jahnke et al., 1996), Jourenkova-Mironova et al. (1999b) hanno trovato invece un aumento del rischio per il cancro della laringe, nei soggetti portatori dello stesso allele.
Altri importanti enzimi di fase II coinvolti nella detossificazione dei cancerogeni del tabacco sono le N-acetiltransferasi (NAT), l’epossido idrolasi microsomale (mEH), la NAD(P)H chinone ossidoreduttasi (NQO) e le S-transferasi (SULT). Le N-acetilS-transferasi metabolizzano varie amine aromatiche e eterocicliche presenti nel tabacco; le amine aromatiche e le idrazine (attraverso una N-acetilazione) e le amine eterocicliche (attraverso una O-acetilazione) sono esempi dei loro substrati che, in generale, vengono deattivati (via N-acetilazione) o attivati (via O-acetilazione) per azione di questi enzimi (Hein, 1988). Esistono due N-acetiltransferasi, distinte sia per la specificità nei confronti di vari substrati sia da un punto di vista genetico, definite NAT1 e NAT2. L’attività di NAT2 risulta elevata nel fegato e nel tratto gastrointestinale, mentre NAT1 è espressa in molti tessuti extra epatici, ma il contributo relativo dell’attivazione o deattivazione dei cancerogeni a livello epatico ed extra epatico non è ancora del tutto chiaro (Hein et al., 2000). Per NAT1 sono stati identificati almeno 26 aplotipi, con NAT*4 che è riconosciuto come l’aplotipo wild-type (Vatsis et al., 1995). Per NAT2 sono state identificate sette sostituzioni nonsenso (G191A, T341C, A434C, G590A, A803G, A845C e G857A) e quattro silenti (T111C, C282T, C481T e C759T); NAT2*4 è considerato l’aplotipo wild-type (Hein et al., 2000). Poiché sia NAT1 sia NAT2