Alla mia emicrania che in tutti questi anni mi è sempre stata vicina senza mai abbandonarmi...
INDICE
• Definizione e spiegazione...3
• Effetto nocebo e aspettative negative...7
• Aspetti etici dell'uso di placebo...12
• Impieghi...17
• Aspettative di beneficio e condizionamento classico...26
• Cure evidenti (attese) a confronto con cure nascoste (inattese)
ovvero l'effetto placebo senza placebo...33
• Meccanismi molecolari o cellulari...37
• Neuroimaging...44
• Rilascio di neurotrasmettitori endogeni...55
• Gli effetti del placebo nella cura dell'osteoartrite...63
• Omeopatia e placebo: sinonimo, simile o differente?...66
• Conclusioni...70
• Glossario...72
DEFINIZIONE E SPIEGAZIONE
L'origine del termine placebo deriva dal latino placere, letteralmente “piacerò”. Il Dizionario Medico di Mooper (1811) definisce il placebo come “un epiteto dato a qualsiasi medicina atta più al piacere che a dar beneficio al paziente”.
Il placebo ha quindi la funzione di compiacere il malato, nonostante l'assenza di effetti terapeutici sull'organismo.
Questa definizione rimase immutata fino alla metà del secolo scorso, quando venne riconosciuta per la prima volta al placebo la capacità di svolgere un'azione terapeutica vera e propria.
L'uso diffuso della parola placebo nella letteratura medica ed il suo utilizzo in molte procedure sperimentali è una chiara evidenza dell'importanza di questo fenomeno.
Il placebo è una sostanza farmacologicamente inerte che viene somministrata al paziente come farmaco attivo assieme, molto spesso, a suggerimenti verbali di miglioramento clinico facendo si che il paziente creda vera ed efficace la cura. Quindi gli effetti psicobiologici sul cervello e/o sul corpo che seguono la somministrazione di un placebo, possono essere chiamati effetto placebo o
responso placebo.
Generalmente l'effetto placebo gioca un ruolo centrale nell'organizzazione terapeutica di certe condizioni neurologiche poiché il sistema nervoso centrale (SNC) agisce come interfaccia tra gli stati mentali e gli stati fisici.
Per definizione, se non viene somministrato alcun placebo, gli effetti che seguono non possono essere chiamati effetto placebo.
Ultimamente si è giunti quindi alla conclusione che il termine effetto placebo inteso esclusivamente come avvenimento che segue la somministrazione per esempio di una pillola, sia troppo restrittivo e che debba essere esteso a fenomeni correlati che dividono meccanismi simili.
Si possono descrivere infatti diversi effetti collegati al placebo, caratterizzati dal fatto che non viene somministrato il farmaco inerte, i quali sono attribuibili all'influenza del contesto psico-sociale che circonda il trattamento.
Collard J. (1977) infatti, riconosce come elementi costitutivi dell'effetto placebo, oltre al farmaco inerte, al terapeuta ed alla capacità del paziente di rispondere o meno al trattamento, anche l'ambiente nel quale questa procedura viene effettuata. Un ambiente simbolicamente significativo come un ospedale, un centro di ricerca, un ambulatorio con personale serio e specializzato, tranquillizzano il malato riducendone ansia e stress e rafforzando quindi la capacità di “autoguarigione”. L'ambiente non è comunque l'unico stimolo che influisce su questo effetto, Lancet (1994) ha individuato una serie di fattori che annullano o rinforzano l'effetto placebo:
•Le iniezioni sono più efficaci delle compresse a parità di dosaggio e le compresse più grosse sono più efficaci delle piccole.
•La fiducia del paziente nel medico aumenta l'effetto placebo.
•L'effetto aumenta se si spiega al paziente il supposto meccanismo d'azione del farmaco.
•L'effetto placebo è migliore nei pazienti ansiosi e dotati di scarsa capacità critica. Fattori non meno importanti sono il colore della compressa, il gusto, il prezzo, l'imballaggio e la forma che dovrebbe essere diversa da quella delle compresse di uso quotidiano.
Lo stato psicologico del paziente incide sia sulla risposta a farmaci attivi che inattivi; più è alto il livello di partecipazione del soggetto e più è grande la sofferenza, con maggior probabilità il placebo apporterà beneficio.
Soprattutto la speranza e la convinzione dell'efficacia del trattamento sembrano influenzare maggiormente il grado di efficacia del placebo.
Oltre alla suggestione psicologica, che inevitabilmente si accompagna ad ogni atto terapeutico, è stato dimostrato che anche la parola può innalzare (e talvolta diminuire) la soglia dolorifica, e può opporsi (perlomeno temporaneamente) ad azioni farmacodinamiche molto potenti.
In una popolazione di pazienti, la risposta terapeutica o tossicologica alla somministrazione di placebo, non sempre compare; molti autori ritengono quindi che anche variabili sociali e psicologiche del soggetto influenzino la comparsa di effetti placebo.
L'effetto placebo è quindi quel fenomeno per cui un trattamento non farmacologico (di qualsiasi natura) risulta benefico qualora chi lo riceve sia convinto della sua efficacia.
Detto ciò, possiamo individuare, all'interno di una popolazione, pazienti che in seguito alla somministrazione di placebo manifestano una risposta terapeutica o tossicologica (placebo responders) e pazienti che al contrario non rispondono alla cura (placebo non responders).
Joyce et al. (1959) individuano nel soggetto più dipendente, ansioso, accentratore, emotivamente labile, il paziente più sensibile al placebo.
Questo soggetto è più estroverso, socievole e dipendente dagli stimoli esterni ma meno fiducioso in se stesso.
Tuttavia, un determinato soggetto può non mostrare una coerente risposta al placebo in differenti situazioni.
In altre parole, un soggetto può rispondere in una certa situazione ma può diventare un non responder in un altro contesto terapeutico.
Lieberman (1964) concluse che “la risposta al placebo deve essere vista come una tendenza potenziale che può diventare manifesta sotto le giuste circostanze in chiunque, piuttosto che come un attributo posseduto da alcuni ma non da altri”. Purtroppo, i problemi concettuali e metodologici rendono difficile una valutazione accertata dell'effetto placebo negli ambienti clinici, poiché non tutti i cambiamenti che accadono possono essere considerati veritieri; per esempio, la veridicità dei segni e dei sintomi riportati dal paziente, possono variare nel tempo e questo è dovuto ad una serie di processi che sono indipendenti da qualsiasi intervento placebo, processi come il naturale corso della malattia e la regressione alla media.
Nonostante queste difficoltà, la comprensione dei processi cerebrali coinvolti in questo effetto è considerevolmente migliorata negli ultimi anni e questo grazie a tecniche di neuroimaging funzionali (visualizzazione dell'attività cerebrale in
vivo) che hanno aperto nuove strade nell'esplorazione scientifica di questo fenomeno.
misurare il metabolismo cerebrale al fine di relazionare l'attività di determinate aree cerebrali con specifiche funzioni cerebrali.
Sono stati utilizzati infatti sofisticati strumenti come la Tomografia ad Emissione di Positroni (Positron Emission Tomography, PET) e la Risonanza Magnetica Funzionale (Functional Magnetic Resonance Imaging, fMRI).
Queste tecniche hanno scoperto meccanismi specifici sia a livello biochimico che cellulare, i quali possono influenzare il corso di una malattia e le risposte alla terapia.
Mentre la forza del pensiero positivo è scientificamente conosciuta, meno famoso è il suo fratello malvagio, il così detto effetto nocebo, dal Latino nocere ovvero nuocere.
Questo termine venne introdotto da Kissel e Barrucand (1964) per distinguere gli effetti positivi del placebo da quelli negativi.
L'effetto nocebo è anch'esso un effetto placebo in quanto viene somministrata anche in questo caso una sostanza farmacologicamente inerte.
Tuttavia, per indurre un effetto nocebo, la sostanza inerte viene somministrata assieme a suggerimenti verbali di peggioramento clinico, così da indurre aspettative negative circa il risultato.
Sia l'effetto placebo che quello nocebo non possono essere espressione di pura suggestione psichica in quanto entrambi hanno una solidissima base neurobiologica sfruttabile non solo per potenziare l'effetto placebo di un farmaco ma anche per limitare gli effetti negativi, specialmente ma non solo, nella terapia del dolore (Walach e Jonas, 2004).
EFFETTO NOCEBO E ASPETTATIVE NEGATIVE
L'effetto nocebo è la comparsa di effetti collaterali in assenza di principio attivo. Questo fenomeno non può essere assolutamente considerato raro, anzi, ogni medico lo può osservare quotidianamente, basti pensare alla serie di effetti collaterali che è in grado di scatenare la sola lettura del foglietto illustrativo da parte del paziente.Negli studi clinici, questo effetto, si può manifestare secondo due metodiche: la prima è che il paziente può attribuire al farmaco che assume (in realtà un placebo) problemi o sintomi preesistenti a cui prestava però poca importanza; la seconda è che l'effetto nocebo, operando attraverso il condizionamento negativo, vada ad agire poi sul sistema neurobiologico, immunitario e ormonale.
Certi soggetti sono in grado di manifestare effetti secondari esclusivamente, o dopo la loro lettura, o dopo una loro descrizione, prima della somministrazione nell'ambito della sperimentazione.
Quindi, durante i trials clinici, dopo la somministrazione di un placebo, possono palesarsi due differenti effetti: quello placebo (positivo) e quello nocebo (negativo), ciò che farà pendere l'ago da una parte anziché dall'altra saranno lo stato psicosociale del paziente, le aspettative consce e i fattori inconsci.
La vulnerabilità nei confronti dell'effetto nocebo può essere aumentata da fattori come: personalità ansiosa, depressione, paura del futuro, scarsa fiducia in se stessi e nel medico, il quale potrà contribuire assumendo un atteggiamento frettoloso e distaccato.
Talvolta il ricordo sgradevole degli effetti legati ad un certo farmaco è sufficiente per rievocarli.
Sembrerebbe quindi molto strano, ed invece accade realmente, che questi spiacevoli effetti scompaiano improvvisamente o addirittura non compaiano, proprio nel momento in cui il paziente è cosciente del fatto che ha preso o sta per prendere un placebo.
Al fine di avere una reale valutazione delle prove cliniche, è quantomeno essenziale chiarire se tali sintomi siano dovuti al farmaco-placebo oppure
dipendano da interazioni con un altro trattamento farmacologico.
E' necessario conoscerne la reale natura in quanto, all'interno di un protocollo terapeutico, gli effetti collaterali gravano sull'esito della terapia, risultando talvolta così insopportabili da concretizzarsi in una scarsa adesione al protocollo o addirittura in un suo successivo abbandono.
Recentemente Scott et al. (2008) hanno evidenziato che la base neurobiologica dell'effetto nocebo è riconducibile ad una minor liberazione di dopamina e oppioidi endogeni in diverse aree cerebrali.
Questa e le successive osservazioni sono state possibili grazie all'utilizzo della Tomografia ad Emissione di Positroni, la quale ha anche evidenziato che, le aree cerebrali coinvolte nell'effetto nocebo (ma anche placebo), sono le stesse interessate nei meccanismi di ricompensa e nei comportamenti motivati.
Iperalgesia da nocebo
L'iperalgesia da nocebo, rispetto all'analgesia da placebo, risulta essere meno conosciuta poiché presenta limitazioni sia etiche che metodologiche in quanto, l'induzione di una risposta di questo tipo, comporterebbe l'uso di procedure ansiogeniche e stressanti.
E' risultato, in uno studio fatto nel 1997 su pazienti che erano stati sottoposti ad un operazione e in un ambiente psicologicamente condizionante (Benedetti et al.,
1997b), che il proglumide, un farmaco antagonista non specifico dei recettori CCK-A e CCK-B, blocca l'iperalgesia da nocebo in modo dose-dipendente pur non essendo un analgesico, ciò ha suggerito che questa iperalgesia sia mediata dalla colecistochinina (Cholecystokinin, CCK), ormone di natura proteica attivo soprattutto su cistifellea e pancreas.
Poiché la CCK è coinvolta anche nei meccanismi ansiogeni, è stato ipotizzato che il proglumide influenzi, ovvero vada a bloccare, l'ansia anticipatoria (Benedetti et al. , 1997b; Benedetti et al. , 1997c).
Per superare i limiti etici e per poter compiere una procedura simile, sono stati utilizzati, in un successivo studio, pazienti volontari e sani (Benedetti et al.
2006a).
Ai pazienti è stato provocato un dolore al braccio destro e, assieme a suggerimenti verbali di iperalgesia, è stato somministrato loro un placebo.
Un'evidenza interessante, evidenziata attraverso le misure delle concentrazioni plasmatiche di ormone adrenocorticotropo (adrenocorticotropic hormone, ACTH) e di cortisolo, è risultato essere l'iperattività dell'asse Adrenergico-Ipotalamico-Pituitario (Hypothalamic-Pituitary-Adrenal axis, HPA), solitamente iperfunzionante durante stress e ansia.
Pertanto, somministrando benzodiazepine (ansiolitici) come il diazepam, si riscontra un blocco sia dell'iperalgesia che dell'asse HPA, indicando il coinvolgimento di meccanismi ansiogeni; somministrando proglumide invece viene bloccata solo l'iperalgesia prodotta dalla CCK, senza diminuire o bloccare l'azione dell'asse HPA (Figura 1)
Questi dati rivelano una correlazione tra ansia e iperalgesia da nocebo ma non dimostrano ciò che è stato precedentemente ipotizzato e cioè che la proglumide agisce bloccano l'ansia anticipatoria (Benedetti et al., 1997b; Benedetti et al.,
1997c).
.La proglumide interrompe quindi unicamente il sistema pronocicettivo attivato dall'ansia e responsabile dell'iperalgesia.
L'azione pronocicettiva e anti-oppioide della CCK è stata documentata in molte regioni cerebrali (Benedetti F., 1997a; Benedetti et al., 2007); è stato dimostrato che inverte l'analgesia oppioide agendo a livello della medulla rostrale ventromediale (Rostral Ventromedial Medulla, RVM) (Heinricher et al., 2001) e attiva i neuroni che facilitano il dolore all'interno di questa zona cerebrale (Heinricher e Neubert, 2004).
(Fig. 1) The biochemical and neuroendocrine bases of hyperalgesic nocebo effect
Benedetti F, Annu. Rev. Pharmacol. Toxicol. ; 48:33-60 (2008).
Effetto nocebo nel Morbo di Parkinson
I meccanismi neuronali dell'effetto nocebo, in condizioni di non dolore, sono poco compresi.
In uno studio (Benedetti et al. , 2003a), effettuato su pazienti con Parkinson, precedentemente sottoposti all'intervento neurochirurgico di impianto di elettrodi intracerebrali per la stimolazione cerebrale profonda in entrambi i nuclei subtalamici (Subthalamic Nucleus deep brain stimulation, STN-DBS), è stata
esaminata e valutata la velocità della loro mano destra nel compiere un movimento.
La STN-DBS viene eseguita per diminuire l'iperattività dei nuclei subtalamici e migliorare quindi i sintomi del Parkinson.
Dopo che lo stimolo, prima della sessione di esperimento, era stato spento alcune volte, alla seconda e quarta settimana, il giorno della sessione di esperimento, anche se la stimolazione non era stata interrotta, ai pazienti venne detto il contrario, così da indurre aspettative negative circa la performance motoria. Ebbene, il risultato fu un peggioramento del movimento, paragonabile a quello ottenuto quando lo stimolatore era realmente spento.
Recentemente, replicando queste scoperte (Mercado et al. , 2006), è stato notato che questo risultato si otteneva per la bradicinesia ma non per rigidità e tremore. Non sono comunque conosciuti meccanismi neurobiologici alla base di questa bradicinesia da nocebo.
ASPETTI ETICI DELL'USO DI PLACEBO
Quando si parla di etica nelle prove cliniche controllate da placebo, la domanda che più frequentemente viene posta è: “Le prove cliniche controllate da placebo, sono etiche o necessarie, quando esiste un trattamento alternativo?” (Simon,
2000).
Ebbene, queste e molte altre considerazioni circa l'utilizzo del placebo nella pratica clinica, vengono prese in considerazione nella Dichiarazione di Helsinki. La Dichiarazione di Helsinki fu sviluppata dall'Associazione Medica Mondiale (World Medical Association, WMA), come un insieme di principi riguardanti tutta la comunità medica ed è divenuta una guida per ciò che concerne le sperimentazioni che coinvolgono gli esseri umani (Finlandia, giugno 1964). I principi fondamentali sono:
• rispetto dell'individuo (articolo 8).
• diritto di autodeterminazione ed il loro diritto ad ottenere una decisione dopo adeguata spiegazione(articoli 20, 21 e 22) per quanto riguarda la partecipazione alla ricerca, sia inizialmente che durante il corso della ricerca stessa.
• dovere del ricercatore di salvaguardare la salute del paziente (articoli 2, 3 e 10) o del volontario (articoli 16, 18).
• sottolineare sempre la necessità della ricerca (articolo 6).
• precedenza sempre del benessere del soggetto sugli interessi della società (articolo 5).
• le considerazioni etiche devono essere sempre prioritarie rispetto alle leggi o regolamenti (articolo 9).
• riconoscere che una crescente vulnerabilità dell'individuo e di gruppi obbliga ad una speciale vigilanza (articolo 8).
• riconoscere che quando il soggetto partecipante alla ricerca è incompetente, incapace fisicamente o mentalmente di dare un consenso informato, o è un minore (articoli 23 o 24), il permesso dovrebbe essere
considerato per consenso surrogato da una persona che agisce per il miglior interesse del soggetto. Nel qual caso il loro assenso deve ancora essere ottenuto in tutti i modi possibili (articolo 25).
Dall'anno della stesura fino ai giorni nostri, la Dichiarazione di Helsinki, ha subito sei revisioni e due chiarificazioni.
La quinta revisione (World medica Association, Declaration of helsinky, 2000) o revisione di Edinburgh, fatta dalla WMA nell'ottobre 2000 ha subito diverse e severe modificazioni in alcune sezioni.
In particolare, la sezione 29, se interpretata e attuata rigorosamente, potrebbe causare grosse difficoltà per lo sviluppo di nuovi medicinali.
Un'analitica interpretazione sembra escludere la sperimentazione clinica che utilizza un gruppo di controllo con placebo quando esistono metodi terapeutici che utilizzano controlli attivi, cioè farmaci con comprovata efficacia.
Sezione 29
La sezione 29 si trova in quella parte di dichiarazione che si occupa dei principi della ricerca medica combinata con le cure mediche.
I benefici, i rischi, i contenuti e l'efficacia di un nuovo metodo dovrebbero essere testati attraverso un confronto con la miglior profilassi ed i migliori e attuali metodi diagnostici e terapeutici; ciò non esclude l'uso del placebo, o di un gruppo di controllo al quale non viene dato nessun trattamento, nel caso in cui non esistano metodi di confronto precedentemente testati.
Lo scopo della sezione 29, come molte altre sezioni, è quello di assicurarsi che i pazienti non vengano svantaggiati o sfruttati quando prendono parte ad un esperimento clinico.
Un punto che viene spesso discusso riguarda gli individui che, provenienti da paesi sottosviluppati, potrebbero essere usati nella ricerca di nuovi farmaci per i paesi più sviluppati (Shapiro, Meslin et al. , 2001).
effettuati in paesi sviluppati che sottosviluppati.
La difficoltà è che, ciò di cui tratta la sezione 29, sembra escludere anche alcuni usi vitali del placebo in aree della medicina dove esistono metodi diagnostici e terapeutici approvati.
Al riguardo, esistono opinioni che sostengono l'efficacia del controllo attivo nel valutare l'azione terapeutica di una nuova molecola e opinioni che vedono nel giusto uso di un placebo, l'unico metodo essenziale per stabilire la validità di un farmaco.
Esistono certe circostanze in cui le prove controllate con placebo sono eticamente accettate nonostante la disponibilità di alternative terapeutiche efficaci.
Provato che le condizioni, che assicurano la natura etica di queste prove, siano rispettate, il Comitato per il Brevetto dei Prodotti medicinali (Committee for
Proprietary Medicinal Products, CPMP) asserisce che l'uso di un placebo è necessario per soddisfare i bisogni della salute pubblica.
Sebbene siano sempre disponibili schemi alternativi all'uso del placebo, spesso non forniscono prove soddisfacenti.
In genere, gli studi clinici controllati da placebo e randomizzati, sono i più richiesti da un punto di vista scientifico, anche quando esiste un trattamento attivo largamente in uso.
Quindi, in quali circostanze tali test possono essere eticamente eseguiti?
Molti esaminatori, anche quando sono disponibili cure attive, ritengono che, in determinate circostanze, l'uso del placebo sia eticamente accettabile, ovvero: il periodo di cura placebo, non deve comportare nessun rischio di danno irreversibile al paziente; quando il paziente, o il suo rappresentante legale, è in grado di fornire e fornisce un consenso dopo aver ricevuto tutte le informazioni circa la sperimentazione; quando il paziente può richiedere, in qualsiasi fase del trattamento, che gli venga somministrata la cura convenzionale e che tale cura eventualmente possa essere portata a termine dal suo medico curante.
Queste condizioni sono eticamente in linea con la Dichiarazione di Helsinki se non appunto per la sezione 29 e vengono enfatizzate nel manuale dell'International Conference of Harmonisation (ICH) sulla “Buona Pratica
Clinica” (Anon, 1997).
Ci sono comunque dei punti che andrebbero chiariti: i test controllati con placebo, intesi a mostrare una diminuzione di un danno irreversibile, sono inaccettabili nel momento in cui le terapie che possiedono questi effetti sono disponibili e accettate dal paziente.
Di conseguenza, test a lungo termine controllati con placebo, su pazienti affetti per esempio da ipertensione, sono considerati inaccettabili mentre quelli a breve termine potrebbero essere soddisfacenti.
Inoltre, al paziente che si sottopone a un trattamento, sia esso con placebo o con una cura attiva, gli dovrebbe essere garantito un attento e regolare monitoraggio per evidenziare ogni minimo segnale di allarme, in modo tale da fornire un controllo totale.
Nel momento in cui il paziente (o il suo legale) firma il consenso per la sperimentazione, deve essere in grado di capire la natura del test a cui parteciperà, i sintomi e i rischi che potrebbe correre; inoltre deve essere informato sulla natura e sui benefici della cura standard che non gli verrebbe somministrata ma che potrebbe, se lo ritenesse necessario, richiedere in ogni fase della sperimentazione. Comunque, la firma posta sul consenso, non può fornire una difesa nel momento in cui viene eseguito un test non etico.
I pazienti che si sottopongono a queste prove sicuramente credono e desiderano di prendere parte a ricerche che possano portare a conclusioni rilevanti e affidabili; i test che non riescono a soddisfare queste richieste dovrebbero essere considerati non etici.
Come detto prima, esistono aree della medicina in cui una affidabile prova di efficacia può essere generata soltanto da test controllati con placebo.
Qualsiasi limitazione sul suo uso andranno sia a svantaggio del paziente che della ricerca, ecco perché alcuni autori propongono una revisione della sezione 29 (Lewis Prof. JA, et al. , 2002).
Il placebo può essere impiegato, anche nel caso in cui esistono terapie efficaci, in studi clinici di breve durata su pazienti affetti da patologie minori come: rinite allergica, pirosi, insonnia, dermatiti, ansia moderata, cefalea.
Le sperimentazioni cliniche, che non consentono l'uso del placebo, sono quelle che riguardano le classi di farmaci come: chemioterapici e antitumorali, chemioterapici anti-HIV, chemioterapici anti-infettivi e farmaci cardio-vascolari (trombolitici post-infarto).
Per certi farmaci è necessario sviluppare un disegno ADD-ON cioè un trattamento che, nel rispetto di tutte le norme vigenti per la sperimentazione clinica, utilizza in entrambi i gruppi un trattamento standard con un farmaco di comprovata efficacia al quale viene aggiunto in un braccio il placebo, mentre all'altro il nuovo farmaco da testare.
Se esiste una sostanziale differenza a favore del nuovo farmaco, questo viene ritenuto efficace.
Uso del placebo nel disegno ADD-ON
Trattamento Trattamento standard migliore standard migliore + RANDOM +
FARMACO NUOVO PLACEBO (meccanismo diverso)
IMPIEGHI
I placebo vengono impiegati con due finalità:
1) Come controllo nella valutazione clinica sperimentale dei farmaci
2) Per dare beneficio nel trattamento di patologie che coinvolgono il sistema neurovegetativo
1) SPERIMENTAZIONE CLINICA
studi in cieco e doppio cieco
L'uso del placebo per convalidare l'efficacia di un farmaco, rappresenta uno, se non la maggior parte delle credenze di molte prove terapeutiche.
Le sperimentazioni che utilizzano il placebo possono essere con singola cecità (o singolo cieco) oppure con doppia cecità (o doppio cieco).
Nel primo caso, solo il paziente è all'oscuro del fatto che gli venga somministrato il farmaco attivo o il placebo, mentre nel secondo caso, lo sperimentatore si trova nelle stesse condizioni del paziente, anche nella fase di valutazione dei risultati. In queste prove, sia i farmaci attivi che il placebo, riportano sulle etichette dei codici di identificazione che verranno svelati solo alla fine dell'esperimento, o in caso di necessità.
Ovviamente prima di partecipare in uno studio in cieco i pazienti devono essere messi al corrente della possibilità che non venga loro somministrato il farmaco sperimentale ma il placebo.
Per far si che l'influenza della variabilità individuale venga ridotta si può ricorrere a modalità di indagine clinica tipo crossover, tipo coppie contrapposte, alla
randomizzazione o alla sperimentazione sequenziale.
Nel crossover i soggetti vengono divisi in due gruppi, in uno, la somministrazione del placebo precede quella del farmaco, nell'altro vi è un'inversione dell'ordine. La randomizzazione consiste nella scelta casuale mediante estrazione a sorte dei
gruppi sperimentali o mediante successione dei numeri delle tavole randomizzate con sequenza dei numeri presa a caso.
La sperimentazione sequenziale permette di valutare il farmaco ed il placebo o due farmaci alternativamente su ciascuna coppia idonea di pazienti che si presentano all'osservazione in modo da giungere successivamente, dopo un certo numero di prove abbinate, a conclusioni in maniera comparativa sull'efficacia di due trattamenti (farmaco e placebo oppure farmaco A e farmaco B).
Uno studio randomizzato in doppio cieco è uno studio scientifico prospettico teso a valutare solitamente le azioni di un farmaco.
Come abbiamo detto, la particolarità di questo studio sta nel fatto che, né il medico, né il paziente conoscono la natura del farmaco effettivamente somministrato.
Tutto ciò viene fatto perché bisogna tener conto che lo sperimentatore ha una propria soggettività la quale può influenzare la valutazione dei risultati attraverso un involontario fraintendimento dei dati osservati.
Per ovviare a tali inconvenienti è quindi necessario predisporre procedure e protocolli che eliminino il rischio di errori di interpretazione e portino ad una valutazione oggettiva dei dati osservati.
Nel caso della sperimentazione clinica quindi, neppure i medici devono conoscere la natura della terapia somministrata e da qui il nome di procedura doppio cieco, la quale si è dimostrata l'unica strada percorribile per valutare correttamente i risultati di un esperimento.
Che cos'è uno studio clinico controllato
Uno studio clinico controllato compara un gruppo di persone che ricevono un trattamento sperimentale, il gruppo in trattamento, con un gruppo di persone che non ricevono il trattamento, il gruppo di controllo.
Il gruppo di controllo riceve una terapia standard (ad esempio un farmaco già utilizzato per la stessa patologia), oppure (dove sia eticamente/clinicamente accettabile), un placebo.
Il gruppo di controllo deve avere le stesse caratteristiche del gruppo trattato con il farmaco attivo, cioè, solita patologia, età, razza, quadro sintomatologico e clinico. Questo confronto è fondamentale perché in quelle patologie con una marcata componente psicosomatica (cefalea, insonnia, depressione e anche dolore) , l'effetto placebo può portare ad un miglioramento del 35-40% , talvolta anche superiore, nei primi 3 mesi, dopo i quali l'effetto placebo tende a diminuire e quindi il gruppo di controllo torna a manifestare i sintomi abituali, mentre se il farmaco ha spiccate proprietà terapeutiche, il gruppo attivo mostrerà sia un miglioramento più marcato che persistente nel tempo.
In uno studio clinico controllato in doppio cieco l'efficacia della terapia farmacologica viene valutata facendo il confronto tra i dati ottenuti nei pazienti trattati con il farmaco e i pazienti trattati con il placebo.
Solo se c'è una differenza statisticamente significativa (30%) tra i due tipi di trattamento a favore del gruppo di pazienti che è stato trattato con il farmaco si può dire che quest'ultimo ha un'efficacia terapeutica.
Fasi della sperimentazione clinica
La sperimentazione avviene in 4 fasi, anche se talvolta non si possono delineare confini netti tra una fase e l'altra in quanto per certi farmaci, a seconda della metodologia utilizzata, le fasi si possono sovrapporre.
Fase I
E' la prima fase che si effettua sull'uomo ed ha lo scopo di valutare la dose massima di farmaco in studio tollerata dall'uomo.
Solitamente si esegue su un numero limitato di soggetti sani e serve a confermare quanto sperimentato sull'animale e cioè che la molecola non sia pericolosa.
I volontari verranno suddivisi in gruppi e ciascun gruppo per un certo periodo di tempo, solitamente alcune settimane, riceverà ogni giorno una certa dose della sostanza in esame ovviamente in ambito ospedaliero in quanto saranno necessari continui controlli.
Sorgono durante questa fase i primi problemi etici: per partecipare al programma sperimentale i soggetti devono manifestare il proprio consenso, a seguito delle informazioni ricevute, sottoscrivendo un' apposita dichiarazione.
Tuttavia nella fase I, le informazioni che i ricercatori possono dare, sono ancora limitate in quanto lo studio ha finalità conoscitive e non terapeutiche e gli individui rispetto al tipo di patologia in discussione sono sani e tutto ciò contrasta con il principio etico “evitare trattamenti inutili o dannosi”.
Per alcune patologie come i tumori, la fase I viene testata su pazienti con tumori in fase avanzata in quanto il farmaco antitumorale per un soggetto sano sarebbe troppo tossico mentre per un malato terminale non diminuirebbe la tossicità però nel caso di attività del nuovo farmaco, il paziente ne trarrebbe subito vantaggio.
Fase II
La sperimentazione si allarga ad un numero maggiore di individui, affetti dalle patologie che rientrano nella probabile attività del farmaco in esame.
Si identifica in questo modo la patologia (o le patologie) verso la quale la molecola è sicuramente attiva.
Ulteriore scopo di questa fase è quello di valutare la minima dose efficace, la posologia e la durata del trattamento.
Questo studio dura circa due anni.
Fase III
Questa fase può richiedere alcuni anni perché rappresenta l'ultima verifica prima dell'entrata in commercio del farmaco, quindi deve soddisfare un elevato numero di requisiti.
La sperimentazione si effettua su un centinaio di pazienti che vengono randomizzati in gruppi ai quali verrà somministrato il nuovo principio attivo o il farmaco di elezione per quella specifica patologia oppure un placebo.
In questa fase si deve verificare che la nuova molecola offra dei vantaggi rispetto a quella già esistente (o al placebo), che ne giustifichino la commercializzazione.
Fase IV
E' la fase della farmacovigilanza, l'obiettivo è di raccogliere informazioni sul farmaco messo in commercio, sull'efficacia ed in particolare su eventuali reazioni avverse non previste e addirittura più gravi della malattia a cui il farmaco deve porre rimedio.
Purtroppo questo è inevitabile perché esistono dei limiti sia per quanto riguarda le conoscenze scientifiche che le metodologie tecniche.
Quando un nuovo farmaco è commercializzato, la sua efficacia è stata dimostrata su 100 o 1000 pazienti però è un numero che non rappresenta la variabilità individuale del genere umano.
Le sperimentazioni che riguardano farmaci già in commercio, ma per indicazioni diverse da quelle già presenti nel foglietto illustrativo, ricadono in studi di fase III.
2) TRATTAMENTO DI PATOLOGIE NEUROVEGETATIVE
Gli effetti da placebo, essendo riportati in parecchie patologie (Beecher, 1955) e in migliaia di sperimentazioni controllate e randomizzate, non possano essere confinati ad un unico tipo di patologia o condizione (Benedetti et al. , 2005). Una delle applicazioni più diffuse del placebo è rappresentata dal sollievo del dolore, ovvero l'analgesia da placebo.
L'esistenza di un effetto analgesico, ottenuto mediante questa procedura, è da tempo documentata in letteratura ed è ampiamente sfruttata nella pratica clinica quotidiana.
Inoltre, quasi tutte le intuizioni che abbiamo sui meccanismi cerebrali che stanno alla base dell'effetto placebo, provengono da studi fatti sulle condizioni di dolore. E' stato dimostrato, attraverso diversi esperimenti, prima da Levin et al. (1978) e successivamente 20 anni dopo da Benedetti et al. (1997d), che l'aspettativa e/o il condizionamento inducono il rilascio di determinati neurotrasmettitori in grado di agire su specifiche aree cerebrali e di produrre una risposta fisiologica.
di trarre beneficio dai trattamenti con placebo.
L'analgesia da placebo si è dimostrata un fenomeno particolarmente potente e consistente in quei pazienti che soffrono, per esempio, di emicrania.
In una recente meta-analisi, fatta da de Crean et al. (2000) sui risultati ottenuti durante le prove cliniche per lo sviluppo di una nuova famiglia di antiemicranici, i Triptani, è stato riscontrato un significativo effetto placebo (26-32%) nei pazienti sottoposti a questo studio.
Da un punto di vista clinico, l'utilità di una miglior e più approfondita conoscenza dei meccanismi neurochimici che intervengono in questo tipo di analgesia, deriva dal fatto che potrebbero essere utilizzati per la cura di emicranie complicate. Nel corso degli anni, a seguito di numerosi studi, l'effetto placebo (e quindi le potenzialità che ne derivano), è stato riscontrato anche in altri modelli clinici. Il placebo, viene infatti utilizzato anche in vari disordini del movimento, in particolare nel morbo di Parkinson.
In questa patologia, la risposta al trattamento, può essere valutata obiettivamente dall'esaminatore e questa misurabilità diretta rende più precisa la stima dell'effetto placebo, cosa che non può accadere nella condizione di dolore, in cui la percezione del sintomo è soggettiva ed è anche l'unico parametro utilizzabile per valutare il miglioramento clinico.
Sebbene tutti i classici sintomi Parkinsoniani dimostrino una reazione clinica alle procedure placebo, l'effetto migliore si ottiene sulla bradicinesia rispetto a tremore e disturbi dell'equilibrio (Goetz et al. , 2000; de la Fuente-Fernàndez e Stoessl,
2002).
Ancora, il placebo può trovare impiego nei disordini psichiatrici, come la
depressione, anche se in questo tipo di patologia esistono correnti di pensiero contrastanti.
Contrariamente alle patologie sopra descritte, gli antidepressivi hanno un lungo tempo di latenza, ovvero, dalla prima somministrazione alla comparsa dell'effetto terapeutico passano in media 2-3 settimane.
E' quindi comprensibile che esplorare gli effetti placebo nella depressione comporti numerose problematiche sia da un punto di vista etico che
metodologico.
Nelle prove eseguite su antidepressivi, si riscontra comunemente che circa il 35% dei pazienti che ricevono il placebo dimostrano un certo miglioramento; alcuni autori ritengono che la percentuale sia ancora più alta.
Per esempio Kirsch e Sapirstein (1998), dalla loro meta-analisi su 19 prove di antidepressivi, hanno concluso che circa il 75% dell'efficacia di questi farmaci derivi dall'effetto placebo.
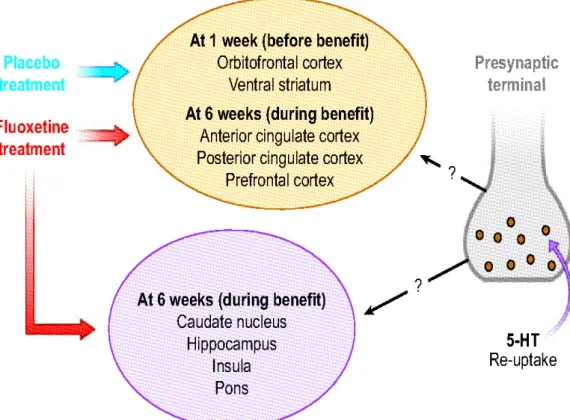
Al contrario, in uno studio controllato con placebo di un farmaco antidepressivo (Mayberg et al. , 2002) durato 6 settimane, sono state evidenziate delle diversità tra l'attività del placebo e quella del farmaco attivo.
Dopo le 6 settimane di trattamento, sono stati trovati cambiamenti specifici nelle aree cerebrali di quei soggetti che avevano assunto il farmaco mentre non ci sono stati cambiamenti regionali da attribuire unicamente al placebo dopo le sei settimane di trattamento.
E' interessante notare che i cambiamenti nelle stesse aree cerebrali, dei soggetti rispondenti al placebo e di quelli rispondenti al farmaco attivo, sono stati riscontrati dopo una settimana e quindi molto prima del benefico clinico, ciò suggerisce che queste alterazioni non siano associate alla risposta clinica ma coinvolgano le aspettative.
Meccanismi d'azione analoghi sono stati riscontrati invece tra l'analgesia da placebo e l'ansia.
In uno studio di imaging cerebrale è stato trovato che i trattamenti placebo possono modulare la percezione emotiva nello stesso modo in cui modulano la percezione del dolore (Petrovic et al. , 2005).
Pare infatti che l'ansia aumenti il rilascio di neurotrasmettitori endogeni responsabili dell'analgesia, il che suggerisce il coinvolgimento di meccanismi simili nella risposta placebo sia per gli stimoli emozionali che analgesici.
Pearlis et al. (2005) hanno analizzato una documentazione riguardante l'effetto placebo nell'insonnia primaria (disturbo meno suscettibile ai trattamenti farmacologici in quanto non ci sono cause riconosciute di questo fenomeno) rivelando un importante ruolo del placebo in questa condizione.
In questi studi clinici randomizzati su pazienti insonni, si può concludere che il placebo produca cambiamenti significativi nelle misure di continuità del sonno. L' efficacia dell'effetto placebo trova impiego anche nel campo dell'ipertensione (Brown, 1998), nel caso in cui, dopo la sospensione di una terapia beta-bloccante specifica, il trattamento antipertensivo venga proseguito all'insaputa del paziente con un placebo.
E' stato ripetutamente osservato che i risultati ipotensivi, garantiti dalla terapia farmacologica, persistono grazie alla somministrazione del placebo.
Al contrario, nei pazienti in cui la terapia beta-bloccante viene sospesa senza proseguimento con un farmaco inerte, si ha un notevole peggioramento dei valori pressori.
Altri esempi di efficacia del placebo su parametri clinici oggettivi riguardano il campo dell'immunologia, il placebo si è dimostrato efficace nei disordini neurologici immuno-mediati come la sclerosi multipla, anche se la la potenza dell'effetto varia da uno studio all'altro.
La Mantia et al. (1996), in uno studio controllato con placebo ed effettuato su pazienti con sclerosi multipla recidivante-remittente, hanno dimostrato una minor frequenza degli attacchi ed una più lenta progressione della disabilità.
Questa variante clinica della sclerosi multipla (recidivante-remittente) colpisce circa il 30-40% dei soggetti affetti da questa patologia nei quali, i segni e i sintomi, tendono a comparire e a scomparire.
Il termine recidiva sta ad indicare una fase attiva della malattia che si manifesta con la comparsa di nuovi sintomi o con l'aggravarsi di quelli preesistenti; al termine dell'attacco i soggetti possono avere o un recupero totale, ovvero le condizioni ritornano allo stato precedente l'attacco, o un recupero parziale dove permane un'invalidità.
La fase di remissione invece, corrisponde ad uno stato di quiescenza della malattia in cui non vi è progressione della disabilità.
Oltre a ciò, l'efficacia dell'effetto placebo è stata riscontrata nel trattamento dell'epilessia.
randomizzate di farmaci antiepilettici, hanno rivelato che il 9,3-16,6% dei pazienti che avevano assunto placebo, riportavano una diminuzione del 50% degli attacchi.
Ultimamente, è stata fatta una meta-analisi degli studi clinici controllati randomizzati nell'osteoartrite, per meglio chiarire l'esistenza o meno di un effetto placebo anche in questa patologia (Zhang, et al. , 2008).
Possiamo asserire che le procedure placebo innescano una serie di eventi cerebrali in grado di alterare la neurotrasmissione in regioni chiave del sistema nervoso centrale attraverso un processo analogo al condizionamento classico e/o attraverso l'elaborazione cognitiva di una precisa aspettativa.
E' desiderio comune che il placebo e il farmaco dimostrino un reciproco effetto potenziante in quelle condizioni patologiche dove, le medesime aree cerebrali, sono coinvolte sia nell'effetto placebo che nel trattamento farmacologico.
Da una diversa prospettiva, queste conclusioni suggeriscono che l'effetto placebo potrebbe fornire una nuova cornice di lavoro concettuale nella quale riformulare l'antica questione filosofica, se gli stati mentali (res cogitans, nelle parole di Descartes) possono essere considerati come la vera causa di qualsiasi reazione fisica (res extensa) (Campbell, 1994).
ASPETTATIVE DI BENEFICIO E CONDIZIONAMENTO
CLASSICO
Sia le aspettative che i processi di condizionamento classico sembra siano coinvolti nelle interazioni tra gli stati mentali e i meccanismi fisiologici.
Studi recenti, che hanno cercato le basi psicologiche dell'effetto placebo, hanno dimostrato che entrambi i meccanismi contribuiscono a produrre diverse risposte placebo (Benedetti et al. , 2003a ).
E' stato proposto che, mentre le aspettative risultano essere importanti quando si ha un coinvolgimento delle funzioni fisiologiche consce come il dolore o le performance motorie, il condizionamento classico gioca invece un ruolo fondamentale nelle funzioni fisiologiche inconsce come la risposta immunitaria e ormonale (Benedetti et al. , 2003a).
Aspettative di beneficio
L'aspettativa è in grado di modificare l'atteggiamento che la persona ha verso i sintomi di cui soffre e nei confronti della malattia.
Ciò implica il cambiamento di un enorme quantità di neurotrasmettitori all'interno delle aree cerebrali, ossia, aumentano quelli che mediano le sensazioni di dolore e di piacere, mentre si riducono quelli coinvolti nelle risposte di allarme che il cervello ha di fronte al dolore (es. ansia e panico).
L'aspettativa di beneficio, viene trasmessa (nel paziente diffidente) e viene incrementata (nel paziente fiducioso) attraverso suggerimenti verbali di miglioramento clinico.
Il suggerimento verbale è una componente talmente forte e suggestiva da risultare talvolta efficace senza che venga somministrata nessuna sostanza inerte.
Si può trovare conferma di ciò in uno studio (Benedetti et al. , 2003a) sulla
percezione dolorosa: i soggetti sono stati divisi in 2 gruppi distinti ed è stato somministrato loro Ketorolac (analgesico non oppioide) per due giorni
consecutivi; al terzo giorno all'insaputa dei pazienti, la cura farmacologica è stata proseguita con un placebo e per dimostrare quanto le aspettative influenzino il risultato, al primo gruppo il placebo è stato somministrato assieme a suggerimenti verbali di miglioramento clinico, al secondo invece, è stato dato assieme ad aspettative di iperalgesia.
Il risultato è stato una forte risposta analgesica nel primo gruppo, mentre nel secondo, oltre al blocco dell'analgesia, è stato riferito anche un peggioramento del quadro clinico.
Si evince che le aspettative influenzino il risultato pur essendo stato eseguito un precondizionamento farmacologico.
Similmente a ciò che è stato osservato per la percezione dolorosa, nel Morbo di
Parkinson, l'attendersi una buona o una cattiva performance motoria, modula sia gli effetti terapeutici della stimolazione cerebrale profonda (Pollo et al. , 2002; Mercado et al. , 2006), che il rilascio di neurotrasmettitori in seguito alla somministrazione di un placebo.
Entrambe le situazioni hanno in comune i consigli verbali, ma nello studio fatto da Pollo et al. (2002), la DBS viene effettuata senza la somministrazione di un placebo; è l'esempio di come il solo suggerimento verbale basti a produrre un cambiamento motorio.
Questo studio ha utilizzato come parametro di valutazione l' analisi della velocità con cui i pazienti eseguivano il movimento della mano.
Tutti i pazienti avevano impiantati, nei nuclei subtalamici, elettrodi per la DBS; tale stimolazione cerebrale ha lo scopo di inibire l'iperattività patologica del nucleo subtalamico causata dalle alterazioni neurodegenerative correlate al Parkinson.
I pazienti sono stati esaminati secondo due diverse condizioni: nella prima loro si aspettavano una buona esecuzione dei movimenti, al contrario, nella seconda, loro attendevano una cattiva performance motoria.
I risultati ottenuti hanno indicato che queste opposte aspettative erano in grado di modulare l'effetto terapeutico della stimolazione dei nuclei subtalamici.
movimento, ha rivelato che la mano si muoveva più velocemente nei pazienti che attendevano una buona performance, contrariamente a quanto è accaduto a quelli che si aspettavano una cattiva esecuzione.
In un altro studio (de la Fuente-Fernandez et al. , 2001), utilizzando la PET, è stato osservato il rilascio di neurotrasmettitori endogeni nelle specifiche regioni cerebrali coinvolte in questa malattia, dopo la somministrazione di un placebo che i pazienti credevano essere Apomorfina (farmaco antiparkinson).
Gli autori proposero quindi un'associazione tra lo specifico rilascio endogeno e l'aspettativa dei pazienti di un miglioramento dei sintomi, il quale potrebbe essere considerato una sorta di ricompensa.
Sempre riguardo al Morbo di Parkinson e al valore delle aspettative, è interessante notare come specifici parametri clinici possano essere modificati dalla chirurgia simulata (sham surgery).
In questa sperimentazione (McRae et al. , 2004), un gruppo di pazienti è stato sottoposto a trapianto di tessuto mesencefalico fetale umano (valutato come possibile cura per questa patologia), mentre un secondo gruppo è stato sottoposto a chirurgia simulata (cura placebo).
Gli esaminatori hanno osservato i due gruppi per un periodo di 12 mesi, al termine dei quali non hanno visto differenze significative tra il gruppo sottoposto a vero trapianto e quello di chirurgia simulata per quanto riguarda diversi risultati come gli scores fisici e di qualità di vita.
I pazienti che credevano di aver ottenuto il vero trapianto, indipendentemente dal fatto che lo avessero ricevuto o meno, ebbero un significativo miglioramento per quanto riguarda la qualità della vita e i movimenti indipendenti.
Informazioni interessanti ci pervengono anche da studi fatti su soggetti ansiosi (Petrovic et al. , 2005) i quali, il primo giorno di esperimento, prima di essere sottoposti alla visione di immagini spiacevoli, sono stati trattati o con Benzodiazepine o con un farmaco antagonista come il Flumazenil.
Come ci si aspettava, il farmaco ansiolitico ha diminuito il senso di spiacevolezza mentre il Flumazenil ha avuto l'effetto opposto.
seguente avrebbero ricevuto il solito tipo di cura e cioè, o il farmaco ansiolitico o il Flumazenil, tuttavia, anziché ricevere il farmaco è stato dato loro un placebo. I risultati hanno messo in evidenza una significativa e robusta risposta placebo (ansiolisi) in quei soggetti che pensavano di aver ricevuto il farmaco ansiolitico. Tutti questi studi sono supportati da imaging cerebrali che evidenziano, in seguito alla somministrazione di un placebo, oltre alle specifiche aree attivate nei diversi disturbi, anche i neurotrasmettitori chiave coinvolti.
Studi interessanti sull'importanza delle aspettative sono stati effettuati anche nel campo dell'agopuntura.
In un esperimento clinico (Bausell et al. , 2005), sono stati confrontati i risultati ottenuti da una vera seduta di agopuntura, in cui l'ago è stato veramente inserito nella pelle, con una seduta di agopuntura simulata (sham acupuncture), in cui l'ago non è stato inserito nella pelle; ai pazienti venne poi chiesto di identificarsi o con il gruppo placebo o con quello di cura attiva.
I pazienti, che credevano di essere stati sottoposti a vera agopuntura, riportarono miglioramenti clinici maggiori rispetto a quelli che pensavano di aver partecipato ad una seduta di agopuntura simulata.
In un secondo esperimento (Linde et al. , 2007), è stato chiesto ai pazienti, prima di iniziare la seduta di agopuntura (vera o simulata), se consideravano in generale questo tipo di terapia una cura efficace e che cosa personalmente si attendevano. I pazienti più fiduciosi sul risultato riportarono benefici clinici maggiori rispetto a quelli che avevano aspettative più basse, indipendentemente dalla loro appartenenza ai gruppi di agopuntura vera o simulata.
Pertanto, non è stato molto importante il fatto che i pazienti avessero ricevuto agopuntura vera o simulata, piuttosto, ciò che ha influito sul risultato clinico sono state le aspettative personali e la fiducia in questa pratica clinica.
Condizionamento classico
Sebbene i farmacologi siano da lungo tempo consapevoli degli effetti farmaco-condizionanti (Ader, 1997) il condizionamento in farmacoterapia per ciò che
concerne l'effetto placebo, è stato meglio concettualizzato recentemente.
Nel condizionamento classico vengono associati ripetutamente: uno stimolo
condizionato che può essere rappresentato da diversi incentivi contestuali (colore, forma, odore della pillola etc.) e uno stimolo incondizionato (Principio Attivo nella pillola).
E' stato osservato che dopo ripetute associazioni tra i due stimoli, se viene utilizzato il solo stimolo condizionato, esso può indurre una risposta simile a quella del farmaco attivo.
Come premesso precedentemente, il condizionamento classico trova riscontro in quelle funzioni fisiologiche inconsce come la risposta immune e la secrezione ormonale.
Una delle osservazioni più interessanti sul ruolo dell'effetto da placebo, nel sistema immunitario, fu riportata da MacKenzie nel 1896.
Esso dimostrò che in soggetti predisposti, la sola vista di un fiore artificiale (quindi privo di polline), era in grado di scatenare in loro una reazione allergica. In ogni caso, le prime evidenze che le risposte al placebo, nel campo immunologico, possono essere ottenute attraverso l'accoppiamento di uno stimolo condizionato (soluzione di sodio-saccarina) ed uno stimolo incondizionato (ciclofosfamide, farmaco immunosopressore), derivano da studi realizzati sui topi.
I topi, successivamente, in presenza del solo stimolo condizionato, dimostrarono comunque un'immunosopressione senza il bisogno di utilizzare lo stimolo incondizionato (Ader e Cohen, 1982).
In un ulteriore studio, sempre fatto su cavie, è stato dimostrato un miglioramento condizionato nella produzione anticorpale.
Ai topi sono state somministrate ripetute immunizzazioni con emocianina (proteina prelevata da un mollusco), associate con uno stimolo condizionato gustativo.
Ebbene, è stata dimostrata la produzione di anticorpi contro questa proteina nel momento in cui al topo è stato riproposto solo lo stimolo gustativo (Ader et al. ,
Nell'uomo, il condizionamento classico è stato descritto in un caso clinico (Olness e Ader, 1992) di un bambino con Lupus Eritematoso (malattia cronica autoimmune) il quale riceveva ciclofosfamide associata a stimoli olfattivi e gustativi secondo le procedure di condizionamento utilizzate per le cavie.
Nei 12 mesi di trattamento, il risultato clinico finale si è dimostrato un successo pur utilizzando per la metà delle sessioni mensili di chemioterapia, solo gli stimoli condizionati.
In un altro studio, pazienti con Sclerosi Multipla (patologia infiammatoria cronica autoimmune che colpisce il SNC), hanno ricevuto anch'essi trattamenti con Ciclofosfamide associati con sciroppo al gusto di anice e otto dei dieci pazienti hanno dimostrato una diminuzione nel conteggio dei leucociti periferici in seguito al solo stimolo condizionato (Giang et al. , 1996).
E' interessante notare che in uno studio (Benedetti et al. , 2003a) fatto sul sistema endocrino ed in particolare sulla secrezione di ormoni, quali l'ormone della crescita (growth hormone, GH) e il cortisolo, l'aspettativa di un loro aumento o di una loro diminuzione indotta solo attraverso i suggerimenti verbali, non ha dato nessun risultato, ovvero la secrezione non è stata minimamente influenzata. E' stato quindi eseguito, per due giorni consecutivi, un precondizionamento con sumatriptan, un agonista del recettore serotoninergico 5-HT1B-1D , utilizzato per il trattamento dell'emicrania, che ha anche effetti ormonali, come quelli di stimolare la produzione di GH ed inibire quella di cortisolo.
Il terzo giorno di trattamento, dopo la somministrazione di un placebo, sono stati riscontrati sia un aumento significativo delle concentrazioni plasmatiche di GH, che una diminuzione di cortisolo.
La dimostrazione che i suggerimenti verbali non influiscono sul risultato finale, è data dal fatto che, il placebo, mimando l'azione del sumatriptan, ha aumentato le concentrazioni di GH indipendentemente dall'aspettativa dei pazienti di una sua diminuzione.
Alla stessa maniera, le concentrazioni di cortisolo sono diminuite anche se ai pazienti era stato detto che sarebbero aumentate.
iniettare l'agente farmacologico (cioè il contesto attorno al trattamento).
Infine, in uno studio clinico (Benedetti, et al. , 1999) sugli effetti dei narcotici sulla depressione respiratoria, sono stati riscontrati i seguenti risultati: il placebo, dato dopo ripetute somministrazione di buprenorfina (farmaco che induce una mite depressione respiratori), ha mimato l' effetto depressivo sul sistema respiratorio anche se da parte dei pazienti non era atteso nessun effetto ed inoltre, non è nota la comparsa di qualche calo di ventilazione.
Anche in questo caso, la miglior spiegazione a tale risultato si può ritrovare nel meccanismo di condizionamento, dove l'atto stesso di somministrare il farmaco, rappresenta lo stimolo condizionato.
Tutto ciò conferma quanto precedentemente asserito e cioè che, funzioni psicologiche inconsce, sembrano rispondere più ai condizionamenti che non alle aspettative.
D'altro canto, le aspettative sembrano prevalere sul condizionamento quando sono le funzioni consce a predominare.
CURE EVIDENTI (ATTESE) A CONFRONTO CON CURE
NASCOSTE (INATTESE)
OVVERO L'EFFETTO PLACEBO SENZA IL PLACEBO
Una minor efficacia delle cure, quando somministrate all'oscuro del paziente, è il miglior elemento di prova che sottolinea il ruolo cruciale delle aspettative nel risultato terapeutico.Questi studi prevedono la somministrazione nascosta del farmaco, in questo modo si elimina la componente placebo (psicosociale) e si è liberi da qualsiasi contaminazione psicobiologica (Colloca e Benedetti, 2005; Colloca et al. , 2004). Lo sperimentatore si avvale di un macchinario che è in grado di somministrare, attraverso un'infusione nascosta, il medicinale.
Le infusioni possono essere somministrate attraverso una pompa, che a sua volta, è azionata da un computer pre-programmato per il rilascio di una certa dose ad un tempo prestabilito.
Il fattore decisivo, che permette di sostenere il ruolo delle aspettative, è dato dal fatto che i pazienti non sono consapevoli che il medicinale gli verrà somministrato a loro insaputa.
Tutto ciò viene eseguito proprio per contrastare la somministrazione evidente che viene utilizzata nella pratica medica di routine e per eliminare l'aspettativa che essa crea.
Possiamo quindi dire che, un'iniezione di farmaco visibile al paziente, fornisce una “cura attesa” mentre quella effettuata all'oscuro del paziente, una “cura inattesa”.
La differenza tra i risultati che si ottengono conseguentemente alla somministrazione di una cura attesa e una non attesa, rappresenta la componente psicologica placebo anche se questo non viene materialmente somministrato (Colloca e Benedetti, 2005; Colloca et al. , 2004).
Dopo l'estrazione del terzo molare (Levin e Gordon, 1984), il dolore post-operatorio che ne deriva, diminuisce in seguito all'iniezione visibile al paziente di
una soluzione salina, che corrisponde ad una dose intravenosa di 6-8 mg di morfina.
Ovvero: dire al paziente che gli si sta somministrando un analgesico (in realtà soluzione salina), ha lo stesso potere che hanno 6-8 mg di morfina.
La conclusione è stata che, un'iniezione evidente di morfina, porta a risultati clinici maggiori rispetto alla medesima dose somministrata però all'oscuro del paziente; ciò è dato dal fatto che la componente placebo risulta essere assente nell'ultima situazione.
Un'altra attenta analisi delle differenze tra iniezioni visibili e nascoste, nel decorso post-operatorio, è stata eseguita su 5 analgesici (morfina, buprenorfina, tramadol, ketorolac e metamizolo) (Colloca et al. , 2004; Benedetti et al. , 2003b; Amanzio et al. , 2001).
Un'analisi (Amanzio et al. , 2001), ha messo a conoscenza che, la dose di analgesico necessaria per ridurre il dolore del 50%, risultava essere più alta con le infusioni nascoste rispetto a quelle evidenti.
Un'altra analisi fatta sullo stesso studio, ha preso in considerazione l'entità del dolore percepito dal paziente dopo le due differenti infusioni; il risultato è stato una più alta percezione del dolore dopo la somministrazione nascosta.
Ciò ha suggerito che, il vedere l'atto della somministrazione, aumenta l'aspettativa di beneficio e con questa anche la produzione di neurotrasmettitori endogeni in grado di potenziare l'analgesia prodotta dal farmaco antidolorifico.
Non si spiegherebbe altrimenti la minor capacità antidolorifica della stessa dose di farmaco, somministrato però all'oscuro del paziente.
E' interessante notare, che anche le interruzioni dell'analgesia sono influenzabili dal fatto che esse siano eseguite visibilmente o all'oscuro del paziente.
Ad esempio, è stato dimostrato che il dolore torna e ad un'intensità maggiore, quando l'interruzione della morfina è fatta palesemente, invece, un'interruzione nascosta prolunga l'analgesia post-interruzione (Benedetti et al. , 2007; Colloca et al. , 2004).
Una spiegazione plausibile circa questo effetto, è data dall'aspettativa negativa del paziente di ritorno del dolore (effetto simil-nocebo).
Nella stimolazione cerebrale profonda dei nuclei subtalamici, sono state riscontrate differenze a seconda delle regioni stimolate ( Lanotte et al. , 2005) cioè: la stimolazione della parte più dorsale della regione subtalamica, che include la zona incerta, ha prodotto risposte autonome che non sono state discordi in condizioni visibili o nascoste, diversamente, stimolando la regione più ventrale, che include la substantia nigra pars reticulata, sono state notate risposte autonome differenti, a seconda che la stimolazione fosse visibile o meno.
Inoltre, durante la somministrazione nascosta, per poter avere una risposta autonoma, è stato necessario alzare l'intensità dello stimolo.
La parte ventrale, essendo una regione correlata alle funzioni limbiche, ha fatto suggerire un cambiamento dell'eccitabilità neuronale in queste strutture dovuto proprio all'aspettativa (Lanotte, et al. , 2005).
In un altro studio (Colloca et al. , 2004), effettuato su pazienti in decorso post-operatorio e con una forte componente ansiosa, la somministrazione di diazepam (ansiolitico) secondo le due metodiche, ha dato come risultato una forte diminuzione dello stato ansioso nel gruppo sottoposto a cura visibile, mentre nel gruppo sottoposto a cura nascosta, il diazepam fu totalmente inefficace.
Anche in questo studio è stata riscontrato un effetto simil-nocebo, infatti, interrompendo visibilmente la somministrazione del farmaco, l'ansia è aumentata significativamente dopo 4-8 ore, all'opposto, nelle condizioni di interruzione nascosta non è stato riscontrato nessun cambiamento.
Un' esperimento che rispecchia sempre lo schema del visivo-nascosto, ma che presenta delle piccole variazioni, è proposto nel caso di pazienti
tossicodipendenti.
Lo studio (Volkow et al. , 2003) è stato fatto in condizioni differenti su pazienti cocainomani: nella prima condizione, loro si aspettavano di ricevere il farmaco (metilfenidato, stimolante del SNC) ed effettivamente così è stato, nella seconda condizione invece, loro si aspettavano di ricevere un placebo ed invece, anche in questo caso, hanno ricevuto il metilfenidato.
Possiamo identificare la prima situazione, con una somministrazione visibile, la seconda invece, con una somministrazione nascosta.
Concludendo, il farmaco nella prima condizione ha avuto un effetto sul metabolismo cerebrale del glucosio maggiore rispetto all'effetto riscontrato nella seconda condizione (quando si aspettavano un placebo).
Tutti i meccanismi descritti sopra indicano che, gli stimoli sociali all'interno del contesto di una cura, possono attivare neurotrasmettitori e modulatori connessi agli stessi recettori sui quali vanno ad agire i farmaci, e possono, come loro, innescare determinate vie biochimiche.
I contesti psicosociali attivano queste vie attraverso meccanismi anticipatori, di aspettativa e/o condizionamento classico.
I farmaci difatti vengono somministrati in un complesso ambiente biochimico che varia sia a seconda dello stato emotivo che conoscitivo del paziente, sia a causa di un precondizionamento farmacologico.
Il contesto terapeutico, potrebbe andare quindi a modificare quel gruppo di recettori sui quali dovrebbe andare ad agire il farmaco somministrato per una condizione patologica specifica.
Questo concetto, ha portato Colloca e Benedetti a proporre un principio basato sull'incertezza all'interno della farmacologia umana (2005).
Questo principio asserisce che: al momento della somministrazione di un agente farmacologico non si hanno certezze circa la sua azione poiché la sua farmacodinamica potrebbe essere modificata dall'atto della somministrazione. Nella farmacologia, l'atto stesso di somministrare un farmaco, compromette il sistema (cervello/corpo) nel quale avviene la misurazione (il risultato terapeutico).
Per esempio, nella sperimentazione clinica, il presupporre di appartenere al gruppo placebo o al gruppo di cura farmacologica, può interagire con gli effetti farmacodinamici perché, al momento della somministrazione, in base alle aspettative, possono essere attivati sia neurotrasmettitori endogeni che modulano l'analgesia, sia sistemi responsabili dell'iperalgesia.
Può essere quindi modificata l'azione globale del farmaco e l'unica soluzione sfruttabile per eliminare queste variabili, è la somministrazione inattesa o nascosta dove il farmaco è somministrato libero da condizionamenti psicologici.
MECCANISMI MOLECOLARI O CELLULARI
Meccanismo del placebo nell'analgesia
In base alle ipotesi più accreditate, la semplice aspettativa di analgesia, sarebbe in grado di indurre il rilascio di oppioidi endogeni responsabili della diminuita percezione del dolore riportata dal soggetto sottoposto ad una cura placebo. Questa ipotesi venne formulata per la prima volta da Levin et al. (1978) i quali dimostrarono, con un celebre esperimento, che la somministrazione di naloxone (potente antagonista oppioide mu), determina una diminuzione dell'effetto analgesico da placebo bloccando i recettori che mediano l'azione sia della morfina che delle endorfine (oltre ad altri farmaci e sostanze oppioidi).
La consistente dose di naloxone, necessaria per bloccare l'analgesia, ha fatto pensare ad un coinvolgimento non solo dei recettori mu ma anche dei k e delta in quanto l'affinità del naloxone per i recettori mu è da 10 a 15 volte maggiore rispetto agli altri.
Pare che il sistema oppioide non sia l'unico meccanismo coinvolto nell'analgesia placebo; tuttavia, si conosce ancora molto poco a proposito di questi effetti sulla trasmissione non oppioide.
Il rapporto tra analgesia e sistema oppioide endogeno, è stato meglio evidenziato a seguito dell'utilizzo di PET e fMRI.
I risultati ottenuti da queste tecniche di neuroimaging concordano col fatto che la porzione rostrale della corteccia cingolata anteriore (Rostral Anterior Cingulate
Cortex, rACC), quando è attivata durante la procedura placebo, accentua i sistemi di controllo discendenti del dolore.
E' verosimile che questa porzione della corteccia frontale costituisca il tramite tra l'elaborazione cognitiva delle informazioni che veicolano l'aspettativa di una riduzione del dolore, indotta dalla procedura placebo, e il rilascio di oppioidi endogeni.
Meccanismo del placebo nell'ansia
Proprio come è stato dimostrato che i placebo allevino il dolore, Petrovic et al. , (2005), hanno dimostrato che possono avere anche un effetto su pazienti ansiosi quando vengono trattati con stimoli visivi emotivamente spiacevoli.
Le aspettative del paziente sono state manipolate attraverso la somministrazione di benzodiazepine o di un loro antagonista.
Il giorno seguente ai pazienti è stato detto che avrebbero ricevuto il medesimo farmaco del giorno precedente, in realtà, è stato somministrato loro un placebo. Questo studio, attraverso l'utilizzo della fMRI, ha evidenziato che l'influenza neuronale del placebo sul trattamento emotivo coinvolge regioni in comune con la rete descritta negli studi sull'analgesia del dolore (Wagner et al. , 2004).
Meccanismo del placebo nella depressione
Anche nel caso di soggetti depressi, in seguito alla somministrazione di un placebo, si possono evidenziare cambiamenti sia elettrici che metabolici, a livello cerebrale.
Uno studio fatto la Leuchter et al. (2002), ha dimostrato che, pazienti depressi trattati con antidepressivi placebo, hanno evidenziato una specifica modalità di attivazione dell'area prefrontale, in particolare dell'emisfero destro, come rivelato da misure quantitative Elettroencefalografiche.
Inoltre, attraverso la PET, sono stati riscontrati cambiamenti nel metabolismo del glucosio nei soggetti con depressione unipolare, a cui venivano somministrati placebo.
Gli incrementi metabolici sono stati evidenziati nella corteccia prefrontale (prefrontal cortex, PFC), nell'ACC, nella corteccia premotoria, nella corteccia parietale, nella corteccia insulare posteriore e nella corteccia cingolata posteriore. I decrementi sono stati associati alla corteccia cingolata subgenuale, al paraippocampo e al talamo.