MALATTIE DELL’APPARATO RESPIRATORIO
1. PROCEDURE DIAGNOSTICHE UTILI ALLA
DIAGNOSI DELLE MALATTIE DELL’APPARATO
RESPIRATORIO
1.1 VALUTAZIONE GENERALE DEL PAZIENTE CON PROBLEMI RESPIRATORI (Warner, 1996)
I reperti semeiologici che fanno sospettare un problema a carico delle vie respiratorie sono i seguenti:
1. tosse, 2. tachipnea, 3. dispnea, 4. cianosi, 5. emottisi, 6. scolo nasale, 7. epistassi.
1) Tosse: è un segno non specifico della stimolazione dei recettori specifici, della clearance mucociliare danneggiata e/o della eccessiva secrezione di muco. L’espulsione con la tosse di essudato giallo o verde indica la presenza di leucociti (neutrofili od eosinofili) che sono espressione di un processo infiammatorio in atto.
2) Tachipnea: è l’aumento della frequenza degli atti respiratori (normale frequenza nell’adulto è di 12-20 atti/minuto; nel puledro all’inizio è di 60-80 atti/minuto per poi decrescere con l’età). Può venir scatenata da varie condizioni come dolore, caldo, febbre, ansietà o esercizio oppure da alterazioni patologiche: scarsa ossigenazione del sangue, acidosi metabolica, eccessive temperature ambientali, danni al centro del respiro nel SNC, disfunzione dei nervi motori.
3) Dispnea: è la respirazione difficoltosa che viene dedotta dall’atteggiamento e dall’aspetto del paziente. Può conseguire all’ostruzione delle vie respiratorie, a malattie parenchimatose e a malattie vascolari cardiache o polmonari. Un inadeguato scambio gassoso stimola un maggiore sforzo ventilatorio profondo evidenziato dall’abduzione dei gomiti, dal respiro a bocca aperta, dall’incremento dell’attività dei muscoli addominali e dall’allargamento delle narici.
4) Cianosi: decolorazione bluastra delle mucose. Non appare fino a che i valori dell’emoglobina deossigenata non scendono a 5 mg/100 ml di sangue (il normale valore è di 15 mg/100 ml di sangue) ed è la conferma di un decremento dell’ossigenazione tissutale (attenzione: una forte anemia può nascondere questo problema).
5) Emottisi: è l’espulsione con la tosse di sangue proveniente da un qualunque distretto dell’apparato respiratorio. Quindi, bisogna accertarsi della provenienza, poiché si potrebbe trattare anche di sangue che arriva dal cavo orale o da altre zone dell’apparato gastroenterico.
6) Epistassi: sangue che fuoriesce dalle narici e spesso origina dai passaggi nasali, dai seni, dai turbinati, dal nasofaringe o dalle tasche gutturali. Se bilaterale indica un’origine aborale rispetto alle coane.
7) Scolo nasale: può essere spesso occulto, poiché gli animali tendono a deglutire l’eccesso delle secrezioni respiratorie. Può essere scoperto solo quando l’animale piega la testa verso il terreno, se si ritrova materiale mucoide in mangiatoie ed abbeveratoi o se si nota una depigmentazione al di sotto delle narici. Se è unilaterale è caratteristico dell’infiammazione dei seni, altrimenti può suggerire un’origine più profonda.
1.1.1. ESAME FISICO
Il normale ritmo respiratorio dei puledri è di 30-40 atti/minuto nei primi giorni di vita, si stabilizza intorno ai 30 atti/minuto al primo mese d’età e con la crescita raggiunge i valori dell’animale adulto (12-20 atti/minuto).
Bisogna analizzare tutto l’insieme della respirazione: inspirazione, sollevamento addominale espiratorio, rantoli e segni associati al dolore. Sono da notare le narici, che possono essere palpate ed esaminate con una fonte luminosa, la simmetria delle vie respiratorie e qualsiasi segno di asimmetria sopra i seni.
Alla palpazione si può apprezzare la laringe e verificare la presenza di asimmetrie o prominenze anomale ed in particolare i processi muscolari dei muscoli cricoaritnoidei dorsali. Nell’atto della palpazione bisogna anche notare il tipo di sforzo richiesto per stimolare la tosse (tramite questo stimolo tussigeno si può anche prelevare del materiale per esami citologici).
1.1.2. AUSCULTAZIONE
Le vie respiratorie profonde possono essere controllate tramite auscultazione ed è molto importante che l’ambiente sia calmo e silenzioso. E’ importante riuscire ad ottenere dei respiri profondi da parte del paziente e per far questo è utile aumentare l’inspirazione di anidride carbonica tramite il “rebreathing bag” o tappando le narici per alcuni secondi. I primi respiri profondi dopo le precedenti manualità permettono di udire anormalità altrimenti non percepibili.
I suoni polmonari si possono udire solo nelle vie profonde, sono generati dal flusso d’aria e la loro intensità è legata alla velocità dello stesso. I suoni vescicolari sono correlati con la miglior ventilazione regionale e rappresentano i suoni bronchiali segmentali.
Una volta generati i suoni possono essere attenuati da diversi fattori quali ad esempio: infiammazione pleurica con o senza spandimento, pneumotorace, obesità, pelo e mentre un polmone insufflato attenua i rumori udibili come nel caso dell’enfisema o pneumotorace, uno consolidato è un ottimo mezzo di trasmissione acustica. Questa evenienza può accadere anche in corso di broncopolmonite acuta con il consolidamento delle regioni ventrali.
I suoni bronchiali sono udibili anche oltre il sito di produzione: trachea, area dell’ilo e bronchi di passaggio.
L’aumento dell’intensità di questi suoni indica l’aumento della velocità del passaggio dell’aria causato da una ventilazione più rapida o più profonda che può essere determinata da esercizio, ansia, ipertermia, acidosi e malattie cardio-polmonari.
L’assenza dei suoni ventralmente indicano spandimento pleurico, mentre se sono dorsali si può trattare di pneumotorace.
Di recente si è adottata una classificazione del tipo di suono comune sia alla medicina umana che a quella veterinaria:
- suoni discontinui, <20 msec, intermittenti o esplosivi, definiti “crepitii”, dovuti o alla presenza di edema o al pareggiamento esplosivo delle pressioni a monte e a valle quando si riaprono segmenti collassati. Si riscontrano con polmonite, fibrosi interstiziale, malattia polmonare ostruttiva cronica, congestione cardiaca e atelettasia;
- suoni continui, >250 msec, spesso musicali, definiti come “sibili”, che rappresentano l’oscillazione delle pareti delle vie aeree prima della completa apertura in inspirazione o chiusura in espirazione. Le cause sono le stenosi delle vie aeree o compressioni esterne, corpi estranei ostruttivi, materiale purulento, cisti o neoplasie e con l’ispessimento delle pareti dei bronchi e nella broncocostrizione,
- sfregamenti o stridori che si possono ascoltare in corso di pleuriti e conseguente sfregamento dei foglietti.
1.1.3. PERCUSSIONE
La percussione polmonare si basa su suoni di risonanza ottenuti percuotendo la parete toracica. La metodica prevede l’uso di un plessimetro e di un martelletto, o in alternativa delle dita delle mani o di un cucchiaio e un martelletto da riflessi. Il plessimetro viene spostato dalla zona dorsale a quella ventrale lungo ogni spazio costale, percuotendo in maniera ritmica. I punti in cui si passa da un suono chiaro ad uno ottuso possono venire segnati, in modo da rendere visibile il limite polmonare. Un’altra zona di ottusità sonora corrisponde all’area cardiaca.
Tramite percussione si possono individuare, ma non distinguere tra loro, masse e aree consolidate e si può evidenziare pleurodinia.
1.2 PROCEDURE DIAGNOSTICHE SPECIALI PER VALUTARE LE CONDIZIONI DEL SISTEMA RESPIRATORIO (Warner, 1996)
La valutazione dell’apparato respiratorio si avvale degli esami radiologico, ecografico, endoscopico e della medicina nucleare.
L’esame citologico del materiale raccolto tramite aspirato trans-tracheale (TTA), lavaggio broncoalveolare (BAL), toracocentesi, trapanazione dei seni e cateterizzazione delle tasche gutturali può permettere di valutare il tipo di processo flogistico, neoplastico oltre che rilevare la presenza di parassiti.
L’efficacia degli scambi gassosi è determinabile attraverso il test della funzionalità polmonare e dalla valutazione dei gas presenti nel sangue arterioso.
Esami aggiuntivi prevedono l’esame emocromocitometrico, la concentrazione plasmatica del fibrinogeno, gli esami batteriologici e sierologici per determinazione della presenza di anticorpi specifici delle infezioni virali.
1.2.1. RADIOGRAFIA ED ECOGRAFIA TORACICHE
Sono gli esami di valutazione dell’apparato respiratorio maggiormente usati e meritano una descrizione più dettagliata che verrà fatta più avanti.
1.2.2. ENDOSCOPIA
Tramite l’endoscopio si possono visionare il passaggio nasale, i turbinati dell’etmoide, l’apertura nasale dei seni, faringe, l’apertura delle tasche gutturali, laringe e la trachea. Questa tecnica permette la diagnosi di iperplasia del tessuto linfoide faringeo, emiplegia laringea, dislocazione dorsale del palato molle, cisti faringee, masse retrofaringee e deformità dell’epiglottide , oltre alla possibilità di eseguire prelievi bioptici.
Per effettuare l’esame broncoscopico è necessario sedare il soggetto ed eseguire un’analgesia locale delle vie profonde instillando lidocaina al 2% per impedire i ripetuti colpi di tosse stimolati dalla presenza della sonda.
1.2.3. ASPIRATO TRANS-TRACHEALE (TTA)
E’ un esame che permette la raccolta di campioni sia per analisi batteriologiche che citologiche e viene effettuato con l’animale in stazione.
Innanzi tutto occorre effettuare una sedazione con alfa2-agonisti, quindi si procede alla tricotomia e attraverso una piccola incisione sulla cute si entra in trachea inserendo un ago da 16-12 G tra due anelli tracheali e direzionandolo verso la biforcazione. Mediante l’ago si inserisce un catetere fino alla biforcazione (un colpo di tosse confermerà la giusta posizione) e si infondono 30-60 ml di soluzione salina che verranno immediatamente riaspirati. Al termine si sutura la cute e si effettua una copertura con antibiotici.
L’alternativa a questa tecnica prevede l’ausilio dell’endoscopio che permette il lavaggio attraverso il suo canale di servizio.
1.2.4. LAVAGGIO BRONCOALVEOLARE (BAL)
Questa metodica permette il prelievo di un campione rappresentativo della popolazione cellulare presente a livello polmonare. Il BAL è utile sia per la diagnosi,che per l’impostazione della terapia. Deve essere associato al TTA per avere un quadro generale della patologia, sia dal punto di vista cellulare (BAL) che batterico (TTA); i due esami non sono l’alternativa l’uno dell’altro.
Il BAl viene eseguito con l’animale in stazione quadrupedale, sedato e/o contenuto manualmente (per il puledro è sufficiente il contenimento manuale). Viene effettuato con due metodiche:
- per via endoscopica: l’uso dell’endoscopio non solo serve per effettuare il BAL, ma permette anche una valutazione
della mucosa tracheale e bronchiale, nonché la visualizzazione di muco, sangue, corpi estranei etc.
L’endoscopio viene inserito attraverso il meato ventrale dx o sx fino a visualizzare il laringe; quindi si prosegue entrando in trachea sino a visualizzare la biforcazione. Superata anche la biforcazione, si prosegue finché il diametro dell’endoscopio non trova un bronco di uguali dimensioni. Un catetere inserito nel canale di servizio dell’endoscopio permette di insufflare soluzione fisiologica e lidocaina al 2% per anestetizzare localmente la mucosa (sia durante il passaggio attraverso il laringe, sia nelle porzioni più profonde del polmone) al fine di evitare i colpi di tosse che farebbero perdere la posizione dell’endoscopio. Il BAL viene effettuato insufflando circa 300-350 ml di soluzione fisiologica (150 nel puledro) attraverso il catetere posizionato nel canale di servizio. Da notare che l’insufflazione deve essere effettuata molto rapidamente per poter riuscire ad aspirare un campione, perché le mucose bronchiale e polmonare hanno una velocità di assorbimento molto elevata. Una volta insufflata, la soluzione fisiologica viene rapidamente riassorbita. Da notare che la presenza di materiale schiumoso indica che il lavaggio è riuscito in quanto la soluzione fisiologica ha raggiunto gli alveoli ed ha reagito con il surfactante, andando a formare appunto la sostanza schiumosa in questione;
- alla cieca: si utilizza un tubo unico con un canale di servizio che permette di insufflare aria e gonfiare il palloncino, in modo da mantenere il tubo in situ. La metodica del BAL è la stessa di quella descritta per la tecnica endoscopica.
I campioni vengono raccolti in EDTA per le analisi citologiche ed in provette sterili senza anticoagulante per le analisi batteriologiche. Se il campione citologico non può essere processato entro 4h dalla raccolta, allora deve essere addizionato con metanolo al fine di fissare le cellule (proporzione di 50:50).
1.2.5. RADIOGRAFIA TORACICA (Butler, 2000)
La radiografia è un esame collaterale che permette una diagnosi ed un monitoraggio delle patologie dell’apparato respiratorio più completo rispetto alla sola visita fisica.
L’esame radiografico può essere effettuato sia mediante un apparecchio radiologico fisso, sia con un portatile (Bucky). In entrambi i casi si ricorre ad una tensione di 70-75 Kv e a intensità di corrente e tempo di esposizione di 20-25 mAs.
Se si lavora in campo, ovviamente con un apparecchio portatile, il puledro può essere radiografato in stazione quadrupedale con proiezione latero-laterale dx e sx, oppure il soggetto deve essere sedato ed in questo caso possiamo effettuare proiezioni non solo latero-laterali, ma anche ventro-dorsali. In questo caso è necessario non estendere eccessivamente gli arti anteriori, perché si provocherebbe una rotazione del torace con una conseguente alterazione della proiezione latero-laterale.
La radiografia dovrebbe essere scattata sia durante la fase inspiratoria che espiratoria; quest’ultima immagine è utile per avere una valutazione completa del diametro tracheale e per l’esame dell’albero bronchiale in corso di malattie polmonari ostruttive.
a) ANATOMIA
Il polmone appare ben definito e con le strutture vascolari ben evidenziabili, soprattutto alla base del cuore.
Le cartilagini tracheali non sono ben visibili nei giovani a causa del basso contenuto minerale, che aumenta con l’età.
I bronchi principali risultano ben demarcati nella zona della biforcazione tracheale ed il sinistro è più dorsale rispetto al destro.
Da ricordare che in entrambe le proiezioni latero-laterali si ha l’area cardiaca che risulta sprovvista di vasi polmonari e potrebbe, per questo, essere scambiata per un’area di consolidazione.
b) PATTERN POLMONARI
Le immagini radiografiche patologiche possono essere definite come pattern: interstiziale, bronchiale ed alveolare.
Nel pattern interstiziale o peribronchiale, le pareti dei bronchi e degli alveoli separano l’interstizio dallo spazio aereo. Nelle fasi iniziali di malattia polmonare, il pattern interstiziale si presenta come un aumento dell’opacità sullo sfondo ed una diminuita visibilità delle strutture vascolari, normalmente ben evidenti in un polmone sano. Questo tipo di immagine potrebbe essere erroneamente individuata in un RX effettuato in espirazione.
Molte patologie partono da un quadro interstiziale per poi coinvolgere lo spazio aereo, per cui questo non è un pattern patognomonico.
Un quadro peribronchiale, invece, è indice di un processo infiltrativo attorno ai bronchi che può avere insorgenza acuta o cronica, come in corso di broncopolmonite allergica.
Nel pattern bronchiale (o broncogramma) si ha un aumento dello spessore e del diametro delle strutture bronchiali; inoltre possiamo avere un cambiamento della forma ed aumento del numero di bronchi visualizzabili poiché diventano visibili bronchi che normalmente non si vedono. Il pattern bronchiale è indice di una patologia cronica con aumento della mineralizzazione e bronchiectasia.
Il pattern alveolare si evidenzia quando vengono coinvolti gli spazi aerei terminali, gli alveoli risultano sempre pieni di fluido (trasudato, essudato, etc.) e assumono una maggiore radiopacità. Questo quadro si ha in corso di polmoniti batteriche, micotiche ed edema polmonare che può essere di origine cardiogena o meno. c) QUADRO RADIOGRAFICO IN CORSO DI MALATTIE POLMONARI
Il quadro radiografico in corso di bronchiti e bronchioliti si evidenzia come un leggero aumento dell’opacità polmonare associato alla parete bronchiale, senza segni radiografici patognomonici. La bronchiectasia da bronchite cronica è caratterizzata da bronchi grandi e ben delineati o irregolarmente sagomati.
La polmonite batterica è solitamente bilaterale, ha una distribuzione concentrata soprattutto nelle aree ventrali del polmone e può essere diffusa o caratterizzata da formazioni ascessuali o granulomatose. Gli ascessi possono presentarsi anche cavitati ed in questo caso l’RX mostrerà delle linee di separazione significative di interfacce aria-fluido. Lesioni di riscontrabili in corso di polmonite sono:
- ascessi: sono le lesioni polmonari riscontrate più di frequente nel cavallo. Appaiono come masse opache con o senza una zona di maggior radioopacità dorsale. Se singoli, possono essere abbastanza grandi e, se cavitati, possono essere confusi con l’immagine radiografica di ernia diaframmatica. Sono sempre associati ad altri segni di infezione, quali ad esempio infiltrati interstiziali ed alveolari. Di solito hanno margini indistinti ed irregolari;
- lesioni cavitarie: frequenti nei giovani. Di solito sono esiti di ascessi che si liquefanno e perdono la parte fluida centrale; si presentano con pareti spesse e con una parte centrale radiotrasparente. Generalmente la lesione scompare con la
risoluzione della polmonite, ma è l’ultimo segno radiografico a scomparire. Per valutare le dimensioni e l’evoluzione delle lesioni cavitarie è molto importante tenere conto della posizione, della fase del respiro e dei cambiamenti dovuti alla crescita del paziente. Esistono anche forme ad eziologia diversa (cavità neoplastiche, traumatiche, congenite), ma nel cavallo sono rare o mai riscontrate;
- granulomi: possono formarsi per consolidazione degli ascessi, possono essere lesioni primarie di malattia polmonare (ad esempio TBC nell’uomo) o possono essere l’unico segno rimasto di una malattia polmonare in via di risoluzione. Sono radiopachi e hanno margini più definiti rispetto agli ascessi.
Nonostante la maggior parte delle polmoniti di origine batterica non possano essere differenziate tra loro, la polmonite da
R. equi in giovani puledri è caratterizzata dall’aspetto a palle di
cotone che può evolvere, in seguito, in un quadro di cavitazione o consolidazione polmonare.
Nella polmonite ab ingestis le lesioni radiografiche si localizzano soprattutto nelle zone ventrali del polmone, poiché il materiale aspirato si deposita nelle zone più areate. Radiograficamente ne consegue un aumento dell’opacità polmonare e la perdita di tutti i dettagli ad eccezione della formazione di broncogrammi.
1.2.6. ECOGRAFIA TORACICA (Reef, 1998)
Il fondamento di questa tecnica è la capacità che hanno gli ultrasuoni di attraversare i diversi tessuti, riflettersi/rifrangersi e generare echi di ritorno alla sonda. Quest’ultima li veicola all’interno dell’apparecchio ecografico dove vengono trasformati in impulsi elettrici e quindi in un’immagine.
a) PROPRIETA’ DEGLI ULTRASUONI
Hanno una frequenza compresa tra 2 e 10 MHz. Le onde sono descritte secondo la frequenza, periodo, lunghezza, velocità di propagazione, ampiezza ed intensità. La fonte delle onde caratterizza la frequenza e gli ultrasuoni emessi dalla sonda, la loro ampiezza, l’intensità e periodo.
Il tessuto attraverso cui gli ultrasuoni passano influenza la velocità di propagazione ed in alcuni casi la lunghezza d’onda.
La frequenza è il numero di cicli o di variazioni complete che il raggio degli ultrasuoni compie nell’unità di tempo e il periodo è il tempo che occorre per completare un ciclo e viene espresso in microsecondi (µs). Il periodo decresce con l’aumentare della frequenza degli ultrasuoni, poiché diminuisce il tempo che occorre per completare un ciclo.
La lunghezza d’onda indica la distanza che coprono gli ultrasuoni durante un ciclo e viene espressa in millimetri (mm). Più corta è la lunghezza d’onda, maggiore è la frequenza e migliore è la risoluzione dell’immagine. E’ da tenere presente che le onde ad alta frequenza arrivano meno in profondità rispetto a quelle a bassa frequenza.
La velocità di propagazione è influenzata dalle caratteristiche del mezzo attraverso cui passano le onde: densità e consistenza. La densità è la massa per unità di volume, mentre la consistenza determina la resistenza della materia alla compressione. Una maggiore consistenza determina un aumento della velocità di propagazione, mentre un alto valore di densità ne determina la diminuzione. Generalmente la velocità di propagazione è alta nei tessuti solidi, intermedia attraverso le strutture ripiene di liquidi e più bassa in quelle ripiene d’aria.
L’ampiezza degli ultrasuoni ne indica la massima variazione d’onda.
L’intensità indica la forza con cui l’energia ultrasonica viene liberata divisa per l’area attraverso cui la forza è diffusa. L’intensità è proporzionale al quadrato dell’ampiezza.
Le onde vengono riflesse dall’interfaccia dei tessuti e la forza della riflessione dipende dall’angolo della direzione del raggio degli ultrasuoni e dall’impedenza acustica dei tessuti attraversati. L’impedenza acustica equivale al prodotto di densità dei tessuti e velocità di propagazione, per cui aumenta all’aumentare sia della densità che della velocità. I valori dell’impedenza acustica variano leggermente tra i vari tessuti molli, mentre sono decisamente differenti tra le ossa e le strutture contenenti aria. L’aria è un riflettente perfetto perché non permette ai raggi di arrivare in profondità, generando un’ombra acustica o artefatto.
Oltre a quanto segnalato finora, gli ultrasuoni vengono riflessi, rifratti, diffusi, attenuati ed assorbiti. La migliore immagine si ha massimizzando la riflessione e minimizzando la rifrazione e questo si può ottenere con un’incidenza perpendicolare del raggio. b) ECOGRAFIA TORACICA
Questa metodica è molto utile nelle diagnosi di polmonite interstiziale, edema polmonare, COPD, emorragie da sforzo, ferite penetranti, sospette neoplasie o malattie granulomatose.
Lo svantaggio nel cavallo è la possibilità di visualizzare solo le parti più superficiale del parenchima polmonare.
Le fasi di questa tecnica sono essenzialmente due:
- preparazione del paziente con tricotomia e/o utilizzo di alcool o gel per assicurare un contatto adeguato tra la sonda e la parete toracica;
- scanning tramite sonda da 7,5-10 MHz lungo gli spazi intercostali.
In un cavallo sano il limite caudale del polmone decorre a partire dal punto di incrocio tra il diaframma e la muscolatura
dorsale. Da questo punto parte il limite ventrale che decorre inclinato e incrocia la linea longitudinale dell’anca a livello del 17° spazio intercostale, quella ischiatica al 15°, il punto della spalla nell’ 11° e quello del gomito nel 9° e il margine anteriore si trova nel 5° spazio intercostale.
Le pleure appaiono come una linea iperecogena caratterizzata da artefatti dovuti all’aria evidenziabili ad intervalli equidistanti. La linea pleurica si muove dorsalmente e ventralmente durante gli atti respiratori, a meno che l’animale non sia in apnea o faccia dei respiri poco profondi. In un soggetto sano non viene evidenziato nessun tipo di liquido, ad eccezione di una piccola raccolta ipoecogena nella porzione più ventrale. Il diaframma è curvilineo e subito ventralmente ad esso si riscontrano fegato e milza.I muscoli intercostali hanno la caratteristica striatura dei muscoli scheletrici. c) IMMAGINE ECOGRAFICA IN CORSO DI PATOLOGIE PLEURICHE E POLMONARI
Tra le alterazioni a carico delle pleuriche, la più comune è l’effusione pleurica. Questa alterazione può essere conseguenza di pleurite, pleuropolmonite, emorragie, neoplasie a carico di pleura o di polmone. Ecograficamente appare come uno spazio anecogeno, privo di echi compreso tra il foglietto parietale e viscerale della pleura e delimitato caudalmente dal diaframma.
L’ispessimento pleurico può essere legato a pleuropolmoniti o polmoniti ascessuali/granulomatose pregresse o nella fase iniziale. Si evidenzia con un aumento dello spessore (misurabile ecograficamente), con una maggiore ecogenicità delle pleure e con la visualizzazione di formazioni miliari iperecogene con coda di rondine.
L’ateclettasia può essere la conseguenza di un consolidamento polmonare secondario ad una polmonite (diffusa o ascessuale), o ad una minore areazione di una porzione di
polmone, secondaria ad esempio a versamento pleurico o emorragia. Il polmone compresso e collassato non è più aerato, per cui appare all’ecografia come un tessuto molle ipoecogeno.
Gli ascessi polmonari sono evidenziabili grazie alla loro struttura. Dal punto di vista ecografico, si evidenzia la capsula come una struttura iperecogena e la zona interna come iper-, ipo- o anecogena in relazione al tipo di contenuto (presenza di numerose cellule, fibrina, etc). In generale, il materiale contenuto nell’ascesso tende a stratificarsi: quello più denso, quindi iperecogeno, si stratifica nella porzione ventrale, la parte fluida (ipo- anecoica) al centro ed i gas (se presenti indicano infezione da Gram-), nella porzione dorsale. Resta da considerare che la maggior parte degli ascessi sono ecograficamente visibili poiché si localizzano nelle porzioni superficiali del polmone.
Le masse neoplastiche o granulomatose, da ultime, appaiono come zone ipoecogene e omogenee all’interno del normale tessuto polmonare.
2. LA POLMONITE NEL PULEDRO (Wilson, 2003)
La polmonite causa mortalità nei puledri di 1-6 mesi di età e costituisce una delle maggiori cause di perdite economiche.
In studi effettuati negli U.S.A. e Canada, la morbilità va dal 6,1% all’82%, mentre la mortalità dal 20% all’80% quando l’agente causale è il R. equi.
E’ molto importante monitorare tutti i soggetti, perché la manifestazione dei segni clinici varia in tempi e tipologia.
2.1. EZIOLOGIA
Di solito è complessa e dovuta all’interazione di più agenti causali e vari fattori predisponenti. La polmonite batterica è generalmente determinata da patogeni opportunisti, normalmente presenti nelle alte vie respiratorie e nel tratto gastrointestinale del cavallo, nonché nell’ambiente.
La frequenza di isolamento di una specie o un’altra varia dalla zona geografica, anche se batteri come S. zooepidemicus e R.
equi sono diffusi in tutto il mondo. Altri batteri di frequente
riscontro sono i Gram negativi non-enterici: Actinobacillus spp.,
Pasteurella spp. E Bordetella bronchiseptica, che possono essere
isolati da soli o in associazione con S. zooepidemicus.
Per quanto riguarda gli agenti virali, questi sono virus influenzali, erpetici, rhinovirus e adenovirus e sono per lo più predisponenti alla successiva sovrainfezione batterica, perchè inducono l’ulcerazione dell’epitelio respiratorio, compromettendo le difese polmonari e la clearance muco-ciliare e, inoltre, alterano la funzionalità dei macrofagi alveolari (PAM). Al momento che il puledro manifesta i segni clinici dell’avvenuta infezione batterica secondaria, il virus eventualmente presente non è più identificabile.
L’infezione da Influenza Equina è di riscontro sporadico e si verifica quasi esclusivamente nei puledri che non hanno acquisito l’immunità passiva.
Puledri con infezione congenita da EHV-1 presentano gravi lesioni polmonari, con o senza versamento pleurico e con alte probabilità di decesso.
Anche i parassiti possono avere un’azione predisponente per la successiva colonizzazione batterica e, nel caso delle larve di ascaridi, possono determinare un danno polmonare diretto durante la migrazione inducendo, una broncopolmonite eosinofilica.
In rari casi le broncopolmoniti sono sostenute da: Aspergillus spp e Pneumocystis carinii. Queste infezioni sono associate a stati di immunodeficienza o a lunghi trattamenti antibiotici.
2.2. EPIDEMIOLOGIA
Le broncopolmoniti colpiscono soprattutto i puledri dalle 4 settimane ai 6 mesi di età e questo ha suggerito agli studiosi una possibile correlazione con un’immunodeficienza legata all’età. Fattori ambientali e di management possono favorire l’insorgenza della malattia: basse o alte temperature ambientali (la dissipazione del calore con alte temperature esterne determina stress nel puledro rispetto all’adulto nelle stesse condizioni); la polverosità (irrita le vie aeree, compromette le difese polmonari e può fungere da veicolo dei microrganismi); il sovraffollamento (altra fonte di stress oltre che di contagio facilitato tra i soggetti malati e quelli sani); erba polverosa o contaminata dal letame; elevati valori di calore e umidità nei locali al chiuso (favoriscono la sopravvivenza dei patogeni); mostre e svezzamento (ulteriori fonti di stress).
2.3. PATOGENESI
La maggior parte delle infezioni che causano polmonite sono dovute alla trasmissione dei patogeni tramite inalazione di
sospensioni aerosoliche o polveri, ma anche trasmissione per via ematogena o, più raramente, orale.
Gli agenti infettivi tendono a depositarsi sulla mucosa respiratoria e nelle giunzioni broncoalveolari. La colonizzazione di batteri opportunisti si verifica in seguito ad un’infezione massiva che sopraffa o limita le difese polmonari quando vengono danneggiate da virus, stress, polveri o gas nocivi.
La risposta infiammatoria che ne risulta è caratterizzata dall’afflusso di neutrofili e altre cellule dell’infiammazione, che determinano danni all’epitelio polmonare e all’endotelio dei capillari polmonari, con la formazione di siero, detriti cellulari e fibrina.
Questo processo si sviluppa soprattutto a carico della porzione cranioventrale del polmone (generalmente il destro), con la formazione di aree congeste, consolidate e umide che interferiscono con gli scambi gassosi e determinano ipoventilazione ed ipoperfusione con ipossiemia e manifestazione clinica della malattia.
2.4. SINTOMI
Il quadro clinico può variare da tosse intermittente e lieve scolo nasale mucoso a febbre, depressione grave, anoressia, abbondante scolo nasale purulento, grave di stress respiratorio e cianosi.
Generalmente si rileva tachipnea e caratteri del respiro alterati, un aumento dello sforzo intercostale spesso accompagnato da escursione asincrona delle coste rispetto a quella addominale che risulta aumentata, intolleranza all’esercizio e riluttanza al movimento.
La tosse è un importante segno clinico, ma non è sempre presente, soprattutto in puledri affetti da R. equi. Si rileva per lo più di giorno e può essere intermittente, produttiva o secca,
superficiale o profonda. La maggior parte dei puledri tossisce dopo l’applicazione della “rebreathing bag”.
Lo scolo nasale mucopurulento bilaterale può variare in quantità e manifestazione nel tempo, ma è un reperto comune, anche se non in tutti i puledri.
La febbre ha una range di 38,8°-40°C con valori massimi di 40,5°C.
La maggior parte dei rilievi clinici si osservano nella forma cronica ed in alcuni casi in forma subacuta.
In soggetti affetti da forma leggera si percepisce un aumento del murmure broncovescicolare durante gli atti respiratori e alterata sonorità tracheale per la presenza di essudato; occasionalmente si riscontra affanno e un crepitio nelle zone interessate (soprattutto quelle cranio-ventrali). Capita che affanno e crepitio si percepiscano in zone vicine a quelle coinvolte e che, soprattutto all’inizio, per questo rilievo, sia necessaria la “rebreathing bag”.
I suoni polmonari diminuiscono se le aree in esame sono interessate da consolidamento, formazione di ascessi o versamento pleurico.
2.5. DIAGNOSI
La diagnosi clinica non determina anche quella eziologica e non avviene sempre ai primi stadi della malattia, poiché i primi sintomi vengono spesso sottovalutati dai proprietari.
E’ bene che la valutazione clinica non interessi solo i malati, ma tutto il gruppo. Bisogna prestare attenzione alla storia dei puledri: età, durata e progresso dei sintomi, risposta ai trattamenti, precedenti casi nel branco ed eziologia, sensibilità antimicrobica, storia del branco di malattie virali e vaccinazioni, stagione, management, controllo parassitario, movimentazione
degli animali e la presenza di altri segni clinici come diarrea e linfoadenite nei puledri malati.
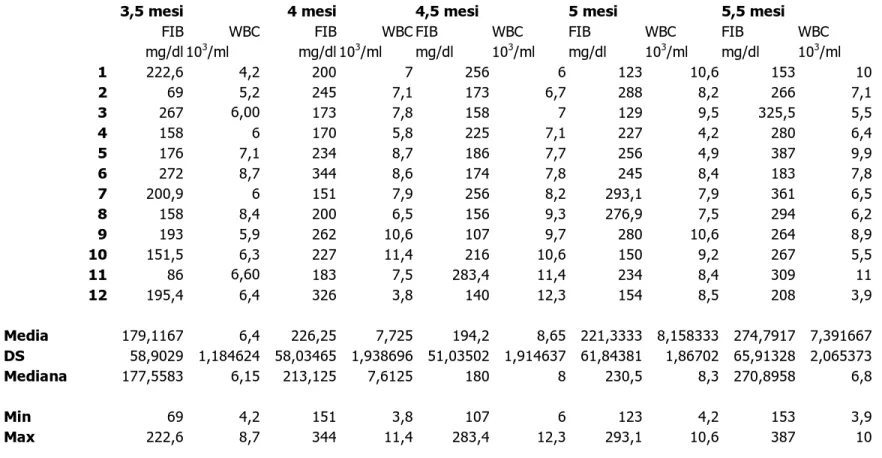
Il rilievo della conta leucocitaria, delle proteine plasmatiche e della concentrazione del fibrinogeno mostra la presenza di un processo infiammatorio caratterizzato da leucocitosi con neutrofilia (con o senza spostamento a sinistra) e un’elevata concentrazione del fibrinogeno. Comunque, sembra accertata la correlazione tra la gravità dei segni clinici e il valore delle variazioni della conta cellulare, anche se molti puledri con infezioni del tratto respiratorio distale presentano valori normali.
Misurazioni sequenziali del fibrinogeno possono fornire un valido monitoraggio della risposta al trattamento, che non dovrebbe essere interrotto finché il valore di questo parametro non torna a valori normali (≤400 mg/dl).
L’ecografia del torace con sonde di 5.0-7.5 MHz dà un immediato quadro della condizione delle pleure, della presenza o meno del versamento toracico e degli ascessi polmonari nelle zone più superficiali.
L’esame citologico e colturale del BAL e/o TTA permette di valutare al meglio il quadro infiammatorio e la localizzazione (intra- o extra-cellulare) e il tipo dei batteri.
La radiografia è utile per stabilire le modificazioni macroscopiche dei bronchi, degli interstizi e della vascolarizzazione e può permettere di avanzare ipotesi di diagnosi nei casi di rodococcosi.
Al momento non esistono test diagnostici utili per la diagnosi precoce di infezione batteriche associate a polmonite.
L’emogas è utile per il monitoraggio dell’ossigenazione e dello stato acido-base durante la terapia, soprattutto in puledri con marcato stress respiratorio e cianosi.
Per completare una valutazione diagnostica ottimale sarebbero necessarie delle operazioni routinarie di buon
management per individuare le nuove infezioni: attenta osservazione degli animali, controllo regolare della temperatura rettale, auscultazione giornaliera del respiro quando i puledri vengono allevati e maneggiati regolarmente o al momento del foraggiamento per i nuovi puledri per evitare stimoli stressanti, un esame fisico completo due volta e settimana e, se è economicamente possibile, screening regolare dei valori ematologici, fibrinogemia e sierologia per virus e R. equi.
2.6. TRATTAMENTO
E’ importante che esista un apporto integrato per distruggere l’organismo causale con una specifica terapia antimicrobica ma anche per ripristinare la funzione respiratoria, minimizzare lo stress e massimizzare il conforto e la qualità ambientale per il paziente.
3. MALATTIE RESPIRATORIE AD EZIOLOGIA VIRALE (Scatozza e Farina, 1998)
3.1. INFLUENZA EQUINA
E’ una malattia respiratoria altamente contagiosa causata da virus influenzali di tipo A e caratterizzata da ipertermia, tosse e depressione dello stato del sensorio.
3.1.1. EZIOLOGIA
Sono responsabili due virus influenzali (A equi 1 e 2), appartenenti alla famiglia Orthomyxoviridae.
Virus pleomorfi o filamentosi con diametro di 80-120 nm, con genoma segmentato RNA monocatenario a polarità negativa.
Gli 8 segmenti genomici codificano per altrettante proteine strutturali o funzionali. Due proteine strutturali importanti sono l’emoagglutinina (H) e la neuroaminidasi (N). A equi 1 e 2 hanno rispettivamente la costituzione H7N7 e H3N8.
Questi virus presentano le caratteristiche generali dei virus influenzali: sono labili al calore, ai raggi UV e ai comuni disinfettanti.
Come noto i virus influenzali vanno incontro a drift e shift antigenici, ma A equi 1 e 2 sono rimasti abbastanza stabili nel tempo. alcuni drift antigenici sono stati osservati solo in A equi 2.
Sono emoagglutinanti per eritrociti di diverse specie animali (cavallo, vitello, suino, scimmia, volatili, cavia e uomo).
Lo spettro d’ospite in vivo include cavallo, asino, mulo di tutte le età con maggiore sensibilità per i puledri. L’inoculazione cerebrale di topini neonati provoca encefalite. Non infettano l’uomo.
In vitro il substrato più adatto per la coltura del virus è il sacco amniotico dell’embrione di pollo. Replica anche su cellule di rene bovino, fibroblasti di pollo, linea cellulare Madin-Darby da rene di cane. L’effetto citopatogeno è caratterizzato dalla formazione di sincizi e le cellule infette manifestano il fenomeno dell’emoadsorbimento con eritrociti di cavia.
3.1.2. PATOGENESI
L’infezione avviene per inalazione; il virus replica nelle cellule epiteliali delle mucose nasale, faringea, tracheale e bronchiale (la replicazione stimola un’elevata produzione di interferone); il virus viene liberato per gemmazione e infetta le altre cellule contigue.
Viene escreto con cariche virali elevate attraverso i colpi di tosse nei primi giorni dopo l’infezione. Dalla nona giornata il virus non viene più rilevato nelle secrezioni respiratorie.
La necrosi delle cellule delle mucose respiratorie determina la perdita della funzione mucociliare. Solo eccezionalmente il virus invade il letto circolatorio e si localizza a livello di fegato, milza, linfonodi e SNC.
3.1.3. CARATTERI DELLA MALATTIA
Il periodo di incubazione è di 1-3 giorni con esordio improvviso e comparsa di febbre, rinite con scolo nasale prima sieroso, poi mucoso o mucopurulento, tosse, laringotracheite, bronchite, rigidità muscolare, fotofobia, lacrimazione, depressione. La tosse persiste per 1-3 settimane e talvolta si ha polmonite, edema delle regioni declivi del tronco e degli arti ed enterite.
La malattia decorre in media in 7 giorni con 1-3 settimane di convalescenza. Negli anziani sono possibili danni cardiaci e nei puledri la malattia è più grave.
Inoltre l’infezione predispone ad infezioni batteriche secondarie sostenute frequentemente da Streptococcus equi
zooepidemicusi.
L’immunità da infezione dura circa 1 anno e il virus A equi 1 è dotato di maggiore attività immunogena.
3.1.4. DIAGNOSI
L’isolamento del virus si ottiene dal secreto nasale prelevato entro 1-2 giorni dall’inizio della malattia. Il materiale deve essere immerso in terreno di trasporto, conservato a 4°C se utilizzato entro 24 ore, oppure congelato e –20°C.
Per l’isolamento si esegue l’inoculazione di uova embrionate di 10-12 giorni per via amniotica e successivamente si possono inoculare colture cellulari.
Il virus non uccide l’embrione di pollo e la sua presenza viene messa in evidenza in base alla capacità di emoagglutinare i liquidi amniotico, talvolta è necessario eseguire dei passaggi ciechi.
L’identificazione sierologica del virus si fa mediante immunodiffusione ed ELISA e la diagnosi sierologica si esegue, di solito, tramite inibizione dell’emoagglutinazione confrontando un siero acuto e uno convalescente.
3.1.5. PROFILASSI
Per la profilassi vaccinale sono stati allestiti sia preparati inattivati che attenuati. Attualmente vengono utilizzati vaccini inattivati bivalenti con somministrazione parenterale a cui viene associata anche la vaccinazione antitetanica.
Lo schema vaccinale prevede la prima vaccinazione a 3-4 mesi (per eventuale l’eventuale interferenza con gli anticorpi materni), richiami dopo 4 settimane, dopo 6 mesi e annuali.
In corso di epidemie è importante monitorare possibili drift antigenici del virus, in quanto possono diminuire l’efficacia del vaccino.
3.2. ARTERITE VIRALE EQUINA
L’arterite virale equina (AVE) è una malattia virale del cavallo caratterizzata da febbre, sintomi respiratori, edemi sottocutanei, aborto, lesioni infiammatorie nei piccoli vasi ed in particolare nelle arterie. Sono frequenti infezioni subcliniche e gli stalloni infetti rimangono escretori persistenti di virus con il seme.
La malattie è stata descritta e caratterizzata per la prima volta nel 1953 negli U.S.A. e attualmente è diffusa in buona parte del mondo: Europa, Australa, Nuova Zelanda, Africa e Asia.
3.2.1. EZIOLOGIA
L’agente eziologico è classificato nel genere Arterivirus della famiglia Arteriviridae. Il virus è provvisto di envelope, presenta simmetria icosaedrica, dimensioni di 50-70 nm, genoma ad RNA monocatenario a polarità positiva, è abbastanza labile, sensibile ad acidi, solventi dei lipidi, detergenti e comuni disinfettanti e viene rapidamente inattivato da temperature di 56°C.
L’ospite naturale è il cavallo, ma si hanno evidenze di infezioni anche in altri equidi, compresi asini selvatici e le cellule bersaglio sono i macrofagi e le cellule endoteliali. In vitro replica su cellule di origine equina e sulla linea continua RK13, determinando effetto citopatico poco evidente, che si esprime con la vacuolizzazione del citoplasma, seguita da distacco del monostrato cellulare; dopo isolamento il virus replica anche su altre cellule (BHK e Vero).
Fra gli stipiti isolati nelle diverse parti del mondo sono state osservate variazioni nella patogenicità e una discreta variabilità nelle caratteristiche genetiche, ma minime differenze antigeniche, per cui viene riconosciuto un solo sierotipo del virus.
3.2.2. PATOGENESI
A seguito dell’infezione, che può avvenire per via inalatoria o attraverso l’accoppiamento, il virus replica nei macrofagi, passa ai linfonodi e si dissemina attraverso il torrente circolatorio; dopo 5 giorni dall’infezione tutti i tessuti e i liquidi biologici ad eccezione del cervello contengono virus.
La replicazione avviene soprattutto negli endoteli vasali e nei macrofagi e secondariamente nelle cellule epiteliali e mesoteliali, per cui vengono colpiti polmoni, intestino, apparato riproduttore ed in particolar modo ghiandole surrenali, tiroide, tubuli seminiferi e fegato. L’ultimo tessuto ad essere invaso è l’epitelio dei tubuli renali da dove il virus viene escreto per circa 3 settimane dall’inizio dell’infezione.
Il virus causa una vasculite generalizzata: le lesioni endoteliali determinano il passaggio del virus nella tonaca muscolare delle arterie e la conseguente infiltrazione infiammatoria provoca aumento dello spessore delle pareti vasali e diminuzione del lume. Le lesioni più gravi a carico dei vasi si riscontrano intorno al 10° giorno post infezione.
Tutti gli stipiti del virus hanno la capacità di dare infezione persistente nell’apparato genitale localizzandosi primariamente a livello dell’ampolla dei dotti e delle ghiandole accessorie e secondariamente nelle porzioni distali del tratto genitourinario. Il virus persiste per circa 6 mesi nei puledri impuberi e periodi più lunghi in quelli già maturi, dato che il tasso di testosterone influenza positivamente la durata dello stato di portatore.
Inoltre,agisce a livello uterino determinando aborto, poiché l’imponente processo infiammatorio coinvolge endometrio e miometrio e l’edema che ne consegue limita gli scambi dell’unità feto-placentare e si arriva al distacco placentare.
L’immunità conseguente all’infezione dura per tutta la vita e non sembrano possibili i casi di reinfezione.
3.2.3. EPIDEMIOLOGIA
La trasmissione prevalente è quella di tipo orizzontale per le vie aerogena e genitale, più rara, ma possibile, anche la trasmissione verticale.
Il virus viene trasmesso per via aerogena dai soggetti in fase acuta di malattia, i quali eliminano virus con secreti ed escreti. Sono necessari contatti abbastanza ravvicinati in scuderie, ippodromi, mostre; non si esclude la trasmissione indiretta tramite veicoli contaminati (mezzi di trasporto, alimenti, finimenti, vagine artificiali). Nei casi di infezione naturale non è facile isolare il virus dal tratto respiratorio, ma in condizioni sperimentali è stato isolato per 2 settimane dal nasofaringe e per 3 dai leucociti circolanti.
Nella trasmissione per via genitale rivestono un ruolo importante gli stalloni infetti poiché il 20-40% rimane portatore per periodi molto lunghi, se non per tutta la vita. In alcuni si può anche avere una cessazione spontanea dello stato di portatore. L’infezione viene trasmessa alle fattrici tramite l’accoppiamento e queste possono poi infettare altri soggetti al rientro in scuderia, anche se non rimangono portatrici, dato che l’escrezione dura per circa 3 settimane.
In caso di aborto anche placenta, liquidi e feti possono contribuire alla disseminazione del virus.
Gli aspetti anatomo-clinici della malattia sono molto variabili in relazione allo stipite virale in causa, alla carica infettante ed alle condizioni dell’animale.
Sono molto frequenti forme subcliniche, soprattutto nelle fattrici che si infettano dopo l’accoppiamento e questo determina una sottostima dell’infezione.
Il periodo di incubazione è, generalmente, di 6-8 giorni, successivamente compare febbre fino a 41°C, leucopenia, anoressia, depressione, edema palpebrale e periorbitale, congiuntivite con epifora, fotofobia e talvolta opacità corneale, edema delle parti declivi del tronco e degli arti, scolo nasale, tosse, difficoltà respiratorie e lesioni del tipo maculo-papulare.
Nel puledro non protetto dall’immunità passiva, l’infezione determina gravi broncopolmoniti ed enteriti ad esito rapidamente letale.
Il 40-80% delle fattrici gravide che si infettano abortiscono (generalmente fra il 3° e l’11° mese) senza avere altri segni clinici apparenti e i feti abortiti vanno rapidamente incontro ad autolisi.
Le lesioni anatomo-patologiche conseguono alle alterazioni vascolari: raccolta di essudato giallastro nelle cavità pleurica e peritoneale, congestione, edema ed emorragie nel sottocute, nei linfonodi e nei visceri toracici ed addominali.
3.2.5. DIAGNOSI
La diagnosi anatomo-clinica è piuttosto difficile, poiché altre malattie possono presentare un quadro simile.
Nel caso dell’edema delle palpebre, del sottocute ed emorragie è necessario fare una diagnosi differenziale con la peste equina; l’aborto deve essere differenziato da quelli da virus della Rinopolmonite equina, da EHV1; la forma respiratoria da quelle sostenute da virus influenzali, Rinovirus ed Adenovirus.
L’isolamento del virus presenta qualche difficoltà, è necessario prelevare materiale da diversi soggetti nel focolaio di infezione, inviandolo al laboratorio in terreno di trasporto refrigerato.
Per l’esame colturale può essere usato muco nasale, organi di feti abortiti e sperma, in caso di mortalità è necessario prelevare diversi organi e linfonodi degli apparati respiratorio, digerente e riproduttore. Il materiale viene isolato su cellule di origine equina o su RK13, l’effetto citopatico compare dopo alcuni passaggi ciechi. Gli stessi campioni biologici possono essere usati per la ricerca dell’acido nucleico mediante PCR.
L’IFD per la ricerca dell’antigene è stata applicata direttamente sul materiale patologico e sulle colture cellulari come tecnica di identificazione del virus.
Sono molto utili anche gli esami istologici per caratterizzare le lesioni e quelli immunoistochimici per confermare la diagnosi.
Per la diagnosi sierologica si utilizzano sieroneutralizzazione ed ELISA, dato che i titoli anticorpali persistono per molto tempo dopo l’infezione.
3.2.6. PROFILASSI E CONTROLLO
Attualmente sono disponibili negli U.S.A. due vaccini, uno vivo attenuato e uno inattivato utilizzati nei piani di profilassi americani, ma non sono ammessi in Italia.
L’AVE è stata inserita nella lista delle malattie degli equini soggette a denuncia (O.M. 12/08/1970) e in quella delle malattie soggette a controllo ai fini dell’autorizzazione alla monta e alla produzione di sperma (D.M. 13/01/1994). Con l’O.M. 13/01/19994 è stato varato un piano di controllo nazionale:
- controllo sierologico degli stalloni autorizzati alla monta: o stalloni sieropositivi sottoposti all’esame virologico;
o stalloni sieropositivi non escretori possono essere adibiti alla monta;
o stalloni sieropositivi ed escretori devono essere esclusi dalla monta e tenuti in isolamento
- deroga per gli stalloni riconosciuti di grande valore:
le fattrici montate da questi stalloni non possono venir coperte anche da altri soggetti; le stesse fattrici devono essere sottoposte a
vigilanza sanitaria.
3.3. RINOPOLMONITE EQUINA/ABORTO VIRALE
Malattia virale contagiosa del cavallo caratterizzata da sintomi respiratori, aborto ed encefalite.
3.3.1. EZIOLOGIA
L’agente eziologico è un virus appartenente alla famiglia Herpesviridae, sottofamiglia Alfaherpesviridae. I caratteri generali del virus sono quelli comuni degli altri herpesvirus: diametro di 100 nm, resistenza in un range di pH da 4 a 10, inattivato a 50°C in 10-15 minuti, labile ai solventi a comuni disinfettanti ed enzimi proteolitici.
Si riconoscono due tipi virali:
o EHV-1: responsabile di aborto, forme respiratorie e forme nervose:
o EHV-4: non aborigeno e prevalentemente implicato nelle forme respiratorie.
I due tipi di virus presentano diversità genetiche e biologiche, ma sono strettamente correlate antigenicamente e danno resistenza crociata. Nel corredo antigenico si hanno epitomi comuni
ai tipi 1 e 4 ed epitomi specifici per ciascun tipo. E’ stata osservata una certa variabilità antigenica all’interno di ciascun tipo.
Lo spettro in vivo è determinato solo dagli equidi che sono naturalmente ricettivi. In vitro entrambi i tipi replicano su cellule di origine equina dando effetto citopatico caratterizzato dalla formazione di sincizi ed inclusi endonucleari.
3.3.2. PATOGENESI
Ambedue i tipi virali vanno incontro ad una prima replicazione nelle prime vie respiratorie (nasofaringe e trachea). Nel puledro si può avere localizzazione primaria nel polmone. Con il tipo 4 l’infezione si esaurisce nell’apparato respiratorio, coinvolgendo in fase acuta solo i linfonodi regionali, mentre il tipi 1 infetta anche gli endoteli vasali di nasofaringe e polmone e i leucociti circolanti e può raggiungere anche il feto.
La localizzazione encefalica si ha per invasione dell’endotelio dei vasi encefalici o attraverso i nervi periferici (entrambi i tipi virali).
Si ha infezione latente nei leucociti circolanti e nei gangli del trigemino e la riattivazione avviene a seguito di condizioni stressanti (trasporto, svezzamento, castrazione) o, meno frequentemente, a seguito di terapia cortisonica.
3.3.3. EPIDEMIOLOGIA
La rinopolmonite è ampiamente diffusa fra i puledri, l’incidenza sale in autunno ed in inverno, quando si riuniscono in gruppo i giovani soggetti svezzati.
Diversi fattori favoriscono la trasmissione dell’infezione: eccessivo affollamento, stretti contatti in fiere, mercati e manifestazione ippiche. E’ possibile anche la trasmissione diretta per via iatrogena. I feti abortiti sono una fonte di contagio molto importante per le fattrici gravide; le fattrici che hanno abortito non
eliminano più virus con gli scoli vaginali dopo 2 giorni dall’aborto e raramente abortiscono nelle gravidanze successive.
L’infezione si mantiene nelle scuderie infette a seguito di riattivazione dell’infezione in soggetti con infezione latente e per infezioni ricorrenti asintomatiche. La protezione immunitaria, infatti, è di breve durata e reinfezioni possono avvenire dopo 3-6 mesi dall’infezione primaria e avvengono, generalmente, in assenza di sintomatologia clinica, ma la replicazione virale, sebbene di lieve entità, porta all’escrezione di particelle virali con possibilità di contagio.
3.3.4. ASPETTI ANATOMO-CLINICI
- Rinopolmonite: malattia acuta febbrile con rialzo termico difasico fino a 40°-40,5°C e decorso di circa una settimana. L’animale presenta segni di rinofaringite e tracheobronchite, scolo nasale sieroso e successivamente mucopurulento, tosse, tumefazione dei linfonodi intermandibolari e anoressia. Con il tipo 1 si ha viremia e leucopenia in corrispondenza del secondo picco febbrile; con il tipo 4 so osservano sintomi più lievi. Le lesioni osservate sono: iperemia, ulcerazioni e necrosi della mucosa delle prime vie respiratorie e focolai di polmonite di aspetto rosso cupo.
- Aborto e malattia neonatale: presenta un’incidenza più bassa rispetto alla forma respiratoria. L’aborto avviene negli ultimi 4- 5 mesi di gravidanza. L‘infezione del feto a termine gravidanza porta alla nascita di soggetti vivi che muoiono precocemente con lesioni a fegato, polmone e sistema linfatico. Nel feto si osservano: edema polmonare, aumento di spessore dei setti interlobulari, edema dei linfonodi, necrosi del timo, focolai necrotici puntiformi nel fegato.
- Forma nervosa: si presenta in forma sporadica con turbe della deambulazione, paralisi degli arti posteriori. Talvolta l’animale si procura traumi gravi nel tentativo di rialzarsi e nel caso che non riesca più a sollevarsi muore per complicazioni circolatorie e respiratorie. All’esame necroscopico si osservano emorragie puntiformi diffuse alle meningi e al parenchima cerebrale e spinale. Tali lesioni conseguono a vasculite delle vene e delle arterie, trombosi e danno ischemico in aree ristrette dell’encefalo e del midollo spinale.
- Forma genitale: rara e solo ad opera del tipo 1. 3.3.5. DIAGNOSI
Impossibile differenziare clinicamente la forma respiratoria del tipo 1 da quella del tipo 4.
L’isolamento del virus è più probabile dal muco nasale raccolto nella fase iniziale febbrile della malattia e da polmone, milza, fegato e timo dei feti abortiti, usando cellule di origine equina e della linea continua RK13.
La ricerca dell’antigene virale con anticorpi marcati si fa su vetrini preparati per impressione da organi di feti abortiti e sezioni istologiche.
Gli esami di laboratorio più utilizzati sono la sieroneutralizzione e l’ELISA ed è preferibile esaminare un doppio campione. Tale esame non fornisce informazioni sulla natura dell’aborto, poiché ad aborto avvenuto non si ha sieroconversione. 3.3.6. PROFILASSI
- P. sanitaria: curare il management dell’allevamento, consentire una buona aerazione dei ricoveri, evitare affollamento e stress agli animali. Quando si introducono nuovi animali, procedere all’isolamento per 3 settimane.
Isolare i soggetti con sintomi sospetti immediatamente e procedere ad accurata pulizia e disinfezione;
- P. vaccinale: sono disponibili vaccini inattivati e attenuati preparati con stipiti di EHV-1. I primi sono più sicuri, soprattutto nelle femmine gravide, ma sono meno protettivi. Sono reperibili anche vaccini bivalenti con i due tipi, anche se il tipo 1, che è il più temuto, dà una buona protezione anche per il tipo 4. La vaccinazione si esegue per proteggere i puledri dalle forme respiratorie gravi e le fattrici dall’aborto. Una buona protezione è importante a partire dal 6° mese di gravidanza e bisogna tenere conto che l’immunità vaccinale è di breve durata (2-4 mesi). Le fattrici vanno vaccinate con 3 dosi di vaccino inattivato al 5°, al 7° e al 9° mese di gravidanza, mentre tutti gli altri soggetti della scuderia devono essere vaccinati al 4° mese di età, con un primo richiamo dopo un mese e i successivi a scadenza semestrale.
La vaccinazione può essere poco efficace se si verificano intense movimentazioni degli animali e sono presenti situazioni stressanti.
3.4. RHINOVIRUS
Si tratta di un virus di discutibile importanza. Si possono ritrovare anticorpi nel 60-80% dei cavalli con oltre 5 anni di età e, al contrario di EHV1, dà solo piccole alterazioni in vitro.
I segni clinici riportati sono vari e possono comprendere febbre, anoressia, scolo nasale e faringite oppure solo una febbre transitoria.
3.5. ADENOVIRUS
L’infezione provocata da Adenovirus determina una grave malattia respiratoria in puledri di razza araba che presentano una immunodeficienza combinata ereditaria (CID).
In puledri neonati sani, l’inoculazione del virus ha portato ad una transitoria linfopenia seguita da linfocitosi e i segni clinici caratterizzati da febbre, tachipnea e scolo nasale ed oculare. Tali manifestazioni sono scomparse 10 giorni dopo l’infezione.
In puledri che non hanno assunto il colostro sono state riscontrate delle lesioni post-mortem molto gravi.
Il virus è molto diffuso e persiste nelle alte vie respiratorie degli adulti che fungono da portatori e serbatoi.
La conferma diagnostica può arrivare dalla titolazione del siero.
4. MALATTIE REPIRATORIE AD EZIOLOGIA FUNGINEA (Sweeney, 1987)
4.1. DEFINIZIONE ED EZIOLOGIA
I funghi in natura sono ubiquitari ed è inevitabile l’esposizione dell’apparato respiratorio; basta tener conto che il 90% delle particelle d’aria visibili con microscopio ottico sono spore di funghi o di actinomiceti.
La malattia respiratoria si ha dopo l’acquisizione del fungo per via inalatoria e bisogna tener presente che le piccole dimensioni permettono il raggiungimento anche degli alveoli. Generalmente, l’invasione tissutale si ha in ospiti immunosoppressi, anche se si può riscontrare in soggetti normali.
Fattori predisponenti importanti sono la anormalità qualitativa, ma soprattutto quantitativa, dei granulociti e la presenza di tessuto devitalizzato.
In cavalli immunologicamente normali si possono avere infezioni ad opera di Coccidioides immitis, Histoplasma capsulato e Cryptococcus neoformans.
Un gruppo a parte è costituito dai cosiddetti opportunisti che infettano solo i soggetti con problemi alle difese immunitarie e ne fanno parte Aspergillus spp., Phycomicetes, Mucor, Rhizopus e Candida spp.
In uno studio americano è risultato che i pazienti con polmonite fungina data da questi agenti patogeni riportavano gravi problemi primari di enterocoliti, nefriti, endotossiemia o setticemia. Inoltre molti non hanno manifestato i segni clinici respiratori e la diagnosi di polmonite è stata fatta solo nel post mortem.
4.2. DIAGNOSI
Bisogna fare attenzione a dare troppa importanza al ritrovamento di elementi fungini negli aspirati transtracheali, poiché le ife fungine sono presenti libere o in grandi cellule mononucleate anche nei cavalli sani (circa il 70% dei soggetti esaminati in uno studio). Per questo motivo, per poter essere significante, il ritrovamento dei funghi deve essere accompagnato da un processo infiammatorio a carico dei polmoni. Una conferma diagnostica arriva dalla biopsia, ma poiché tramite ecografia non si riescono a vedere bene le piccole lesioni, si corre il rischio di prelevare tessuto dalla zona non colpita.
In pazienti con infezione da Aspergillus sppdevono essere esaminati il naso e i seni paranasali che possono presentare erosioni o ulcerazioni.
L’analisi sierologica non è di alcun aiuto poiché, come detto prima, l’Aspergillus spp. È di frequente riscontro nella popolazione equina.
Radiograficamente si dovrebbe vedere un pattern infiltrativo e il riscontro iniziale è di una broncopolmonite variegata, mentre un quadro miliare viene ritrovato solo occasionalmente. Sono comuni i siti multipli e le lesioni tendono ad avere una distribuzione periferica.
Per quanto riguarda i segni clinici questi sono tosse ed emottisi.
4.3. TRATTAMENTO
La scelta del farmaco dipende dall’agente fungino in questione. Sostanze specifiche contengono amfotericina B, ketoconazolo, miconazolo, 5-fluorocitosina. Il problema fondamentale della terapia è che di solito la patologia primaria rispetto a quella fungina è molto grave ed è, di solito, responsabile di insuccesso.
La prevenzione è molto difficile, date le condizioni ambientali. Per questo bisognerebbe migliorare la ventilazione, cercare di limitare l’esposizione aerea alle spore da parte di soggetti immunocompromessi e trattare prontamente le malattie predisponenti cercando di evitare un uso eccessivo di corticosteroidi e antibiotici ad ampio spettro.
5. MALATTIE RESPIRATORIE BATTERICHE
5.1. STREPTOCOCCUS EQUI (Sweeney, 1987) 5.1.1. EZIOLOGIA
Streptococcus equi è un cocco Gram positivo, munito di una
larga capsula. Le colonie sono altamente mucoidi. Altre specie, in particolar modo S. equi zooepidemicus, hanno colonie con la struttura e l’aspetto simili e sono distinte tramite le caratteristiche biochimiche.
5.1.2. SEGNI CLINICI E DIAGNOSI
Come primi segni si ha la comparsa improvvisa di febbre e catarro nelle prime vie respiratorie, seguiti da edema e formazioni asessuali a carico dei linfonodi sottomascellari, sottomandibolari e retrofaringei.
Questo batterio è definito “strangles” (strangolatore), poiché animali non trattati emettono suoni come se venissero strangolati, dato che l’ingrossamento dei linfonodi restringe il faringe.
I primi segni clinici si riscontrano dopo 2-6 giorni dall’esposizione a S. equi. Il cavallo si presenta depresso, anoressico e febbricitante. I linfonodi sottomandibolari ingrossati sono ben visibili e possono essere palpati. Il cavallo può stare con il collo esteso ed essere riluttante alla deglutizione. Questi segni sono accompagnati da scolo nasale che diventa presto mucopurulento.
L’edema infiammatorio acuto dei linfonodi è inizialmente resistente alla palpazione, ma poi tende a svilupparsi un processo suppurativo che , di solito, tende a provocare una rottura della parete e fuoriuscita all’esterno del materiale purulento. Generalmente tale rottura è preceduta da perdita del pelo e lenta fuoriuscita di siero. Nella maggior parte dei cavalli colpiti, tutto
questo avviene tra 7 e 14 giorni dopo la comparsa dei primi sintomi.
Morbilità e mortalità hanno un range rispettivamente di 30-100% e 9-10%.
La diagnosi si basa sulla presenza dei caratteristici segni di linfoadenite, ascessualizzazione e rottura. Può essere confermata solo dall’isolamento di S. equi dallo scolo nasale o dal materiale linfonodale, dal momento che questo batterio non è normalmente presente nelle alte vie respiratorie del cavallo.
5.1.3. EPIDEMIOLOGIA
Gli “strangles” possono essere riscontrati in cavalli di ogni età, ma quelli tra 1 e 5 anni sono i più predisposti.
S. equi è trasmesso attraverso il contatto diretto con lo scolo
mucopurulento di cavalli infetti oppure tramite veicoli, quali utensili, secchi o altro.
L’esplosione, di solito, si ha quando un gran numero di animali sensibili sono mantenuti insieme tra loro ed esposti ad animali nel periodo di incubazione o che presentano escrezione del batterio nella fase di recupero (l’escrezione da cavalli sani per tempi lunghi (più di 8 settimane) è stata documentata solo una volta.
5.1.4. TRATTAMENTO
S. equi è molto sensibile a penicillina, cloramfenicolo,
eritromicina e tetracicline. La penicillina G procaina è l’antibiotico di scelta e il trattamento e la sua riuscita dipendono dallo stato della malattia.
• segni precoci, inclusi febbre e depressione: i cavalli devono essere isolati e sottoposti al trattamento appropriato, che può impedire lo stadio dell’ascessualizzazione linfonodale;
• ascessi linfonodali: la terapia antibiotica con penicillina G procaina deve essere associata al trattamento diretto dei linfonodi, che prevede il drenaggio tramite incisione della parete ventrale degli ascessi maturi;
• esposizione a S. equi senza apparenti segni clinici: tra l’esposizione e i primi sintomi, trascorrono 3-4 giorni e una terapia con antibiotici in questo periodo può prevenire l’invasione linfonodale da parte di S. equi, anche se questa evenienza può comunque verificarsi con interruzione della terapia concomitante alla continua esposizione al batterio;
• cavalli con complicazioni: la terapia deve essere diretta alla risoluzione del problema ad insorgenza secondaria, che può essere rappresentato dalla metastasi asessuale in cavità toracica o peritoneale (basta la penicillina G procaina) oppure dalla purpura emorragica (bisogna associare anche i corticosteroidi).
5.1.5. SEQUELE E COMPLICAZIONI
Nella maggior parte dei casi si ha il recupero dopo la rottura (naturale o chirurgica) e il drenaggio dei linfonodi.
La metastasi ai linfonodi di altre regioni è spesso associata a “strangles” diversi (“bastard”), che hanno una prevalenza molto bassa, ma che sono molto difficili da trattare e spesso portano alla morte dell’animale.
Se gli ascessi interessano i linfonodi retrofaringei possono comportare ostruzione delle vie aeree superficiali.
Inoltre è stata segnalata una broncopolmonite suppurativa necrotica per l’aspirazione del pus o per diffusione metastatica ai polmoni.
Altre complicazioni sono rappresentate dall’empiema delle tasche gutturali, miocardite (meno frequente) e purpura emorragica.
5.1.6. CONTROLLO
Sono disponibili vaccini commerciali che possono determinare una riduzione del rischio di infezione del 50%.
5.2. RHODOCOCCUS EQUI (Prescott, 1991) 5.2.1. INTRODUZIONE
Rhodococcus equi è un batterio patogeno ben conosciuto in
medicina veterinaria. Isolato per la prima volta in puledri svedesi da Magnusson nel 1923 (Magnusson, 1923), causa un’importante polmonite granulomatosa cronica e ascessi polmonari in puledri al di sotto dei 4 mesi d’età ed un isolato comune dai linfonodi cervicali nei suini. Sebbene raramente, l’infezione può riscontrarsi anche in altri animali a seguito di un’immunosoppressione di varia natura. L’infezione in questi ospiti inusuali include la polmonite granulomatosa che evolve in ascessi polmonari, linfoadeniti (soprattutto a carico dei linfonodi mesenterici, bronchiali o cervicali), infezioni localizzate, e ascessi in varie parti del corpo. Prima del 1983, sono stati riportati solo 12 casi in medicina umana e di recente ne sono stati riscontrati altri 20, la maggior parte dei quali in individui affetti primariamente da AIDS.
5.2.2. TASSONOMIA
Magnusson, nel 1923, propose il nome di “Corynebacterium equi” per i microrganismi isolati dai puledri con polmonite piogranulomatosa (Magnusson, 1923). Il genere Rhodococcus (“redpigmented coccus”) appartiene al gruppo filogenetico descritto come “actinomycetes nocardioformi”, che contiene i generi
Caseobacter, Corynebacterium, Mycobacterium, Nocardia, Rhodococcus e la tassonomia “aurantiaca” (GoodfelHow, 1986), di
cui uno degli ultimi generi proposti è stato il Tsukumurella (Collins
et al., 1988). Questi generi sono Gram-positivi, aerobi e
catalasi-positivi e sono ben caratterizzati gli uni rispetto agli altri tramite criteri biochimici (GoodfelHow, 1984/1986; Butler, 1986). Insieme
all’Actinomices nocardiforme, il genere Rhodococcus è
(bastoncello che diventa cocco) durante il ciclo di crescita, dalla presenza di difosfatidilglicerolo, fosfatidiletanolamine, e fosfatidilinositolo; acidi micolici con catene carboniose di 34 – 64 atomi con quattro doppi legami; menachinoni deidrogenati con otto o nove unità isopreniche; grandi quantità di catene di acidi grassi insaturi e acido tubercolostearico. Il genere Rhodococcus (GoodfelHow, 1986) è eterogeneo e può essere diviso in due gruppi. Nel primo, il gruppo Gordona, troviamo tre specie (R.
bronchialis, R. rubropectinus e R. terrae) (Stackebrandt et al., 1988), che posseggono acidi micolici con 48-66 atomi di carbonio e
nove menachinoni isoprenici deidrogenati ed in grado di podere micobacterine (GoodfelHow, 1986). Nel secondo ci sono tutte le altre specie che producono acidi micolici a catene di 34 – 52 atomi di carbonio con due doppi legami e otto menachinoni isoprenici deidrogenati, ma non mycobacterine (Tsukumura, 1971;
GoodfelHow, 1986; Hall et al., 1986). Ci sono 12 specie conosciute
(Goodfellow et al., 1982; Apajalahti et al., 1986; Stackebrandt et
al., 1988; Zakrzewska-Czerwinska et al., 1988) che sono
ampiamente diffuse in natura, particolarmente nel suolo e nel letame degli erbivori. Oltre a R. equi, che è la specie con il più alto potenziale patogenetico per gli animali, incluso l’uomo, altre specie potenzialmente tali sono quattro specie di Rhodococcus a sede incerta (GoodfelHow, 1986) isolate dagli espettorati di pazienti con malattie polmonari (Tsukumura, 1982/1988) e R. fascians, patogeno per le piante. Specie non identificate sono state isolate da una varietà di lesioni granulomatose non caseose in polmoni, linfonodi, pleura, pericardio e pelle di pazienti umani, spesso associate a malattie immunosoppressive o a trattamenti farmacologici (Tsukumura, 1988). Poco si sa della patogenicità dei rodococci per animali e uomo, eccetto per quanto riguarda R. equi.