1
SOMMARIO
Riassunto pag. 2
Introduzione pag. 6
Il carcinoma tiroideo differenziato pag. 6 Epidemiologia pag. 6 Comportamento biologico pag. 14
Terapia pag. 15
Fattori prognostici pag. 21 Oncogeni e tumore pag. 23 Follow up pag. 30 Ruolo della Tg al momento dell’ablazione pag. 36
Scopo dello studio pag. 41
Pazienti e metodi pag. 42
Analisi statistica pag. 45
Risultati pag. 46
Dati epidemiologici dei pz studiati pag. 46 Analisi delle frequenze in base al valore pag. 49 di Tg basale/LT4
Analisi delle frequenze in base al valore pag. 52 di 3°gg-Tg
Commento pag. 54
Discussione pag. 60
Conclusioni pag. 65
2
1. Riassunto
Il carcinoma differenziato della tiroide (DTC) è una neoplasia maligna ad origine dall’epitelio follicolare della tiroide, che mantiene le caratteristiche strutturali della cellula tiroidea nativa. Le due principali varianti istologiche sono rappresentate dal carcinoma papillare (PTC) e follicolare (FTC) che rappresentano circa l’80% e il 20% rispettivamente delle forme ben differenziate. Nei tumori tiroidei è stata identificata l’attivazione di vari oncogeni tra cui RAS, RET, MET, TRK. La mutazione del gene BRAF rappresenta ad oggi la più comune alterazione genetica nel carcinoma papillare della tiroide (BRAFV600E). La mutazione di questo gene è presente esclusivamente nel carcinoma papillare e nel carcinoma anaplastico. Il trattamento iniziale del DTC consta dell’intervento chirurgico di tiroidectomia totale e, tranne per i carcinomi a “rischio molto basso”, della terapia radiometabolica ablativa con 131I. Il follow up successivo è clinico (ogni 6-12 mesi), ecografico (ecografia del collo con valutazione delle stazioni linfonodali) e laboratoristico (esami di funzionalità tiroidea, dosaggio degli anticorpi antitireoglobulina [AbTg] e della tireoglobulina [Tg]); il punto cardine del follow up è caratterizzato dal test di stimolo con TSH umano ricombinante (rhTSH). Il risultato del test è importante per distinguere i pazienti in remissione clinica di malattia da quelli che invece dovrebbero essere sottoposti ad ulteriori accertamenti diagnostici e/o terapeutici.
3
Recentemente l’introduzione del dosaggio routinario della Tg con metodica ultrasensibile ha modificato gli schemi classici di trattamento.
Scopo della tesi: scopo del presente lavoro è stato di valutare il significato prognostico della tireoglobulina al giorno 1 e dopo 3 giorni dallo stimolo con rhTSH, al momento dell’ablazione, correlandola con la guarigione e recidiva/persistenza di malattia dopo 12 mesi di follow up, valutandone la relazione con diverse caratteristiche cliniche, epidemiologiche ed anatomo-patologiche. Altro fine del nostro lavoro è stato quello di proporre un algoritmo diagnostico/terapeutico per discernere i pazienti da trattare con terapia radiometabolica ablativa con 131I.
Pazienti e metodi: i dati clinici di 250 pazienti consecutivi, afferiti fra il 2010 e il 2011 presso il Dipartimento di Endocrinologia, affetti da carcinoma differenziato della tiroide, aventi anticorpi anti-tireoglobulina (AbTg) negativi, trattati con tiroidectomia totale e in procinto di eseguire terapia radiometabolica ablativa con 131I, sono stati analizzati.
Tutti i pazienti avevano effettuato il trattamento terapeutico tradizionale che secondo il nostro protocollo prevede l’intervento di tiroidectomia totale seguito dall’ablazione del residuo tiroideo con 30 mCi di 131I. La valutazione della tireoglobulina al momento dell’ablazione, dopo 3 giorni dallo stimolo con rhTSH e dopo 12 mesi di follow up è stata eseguita; inoltre sono stati valutati diversi parametri epidemiologici
4
(sesso, età), clinici e strumentali (variante istologica alla diagnosi, TNM, staging, uni o multifocalità della neoplasia, dissezione linfonodale del compartimento centrale, valori di Tg al momento dell’ablazione in terapia soppressiva con levotiroxina, valori di Tg al 3° giorno dopo la stimolazione con rhTSH, presenza o meno di linfonodi metastatici ecograficamente e citologicamente confermati al momento dell’ablazione e a 12 mesi dalla terapia radiometabolica, valori percentuali di captazione alla 3° e alla 24° ora, presenza o meno di metastasi iodocaptanti alla scintigrafia totale corporea post dose ablativa, valori di Tg dopo 12 mesi dal trattamento radiometabolico).
Risultati: L’analisi statistica delle frequenze ha evidenziato come i pazienti con Tg, valutata con metodica ultrasensibile, al momento dell’ablazione non dosabile (<0,1 ng/ml), in terapia soppressiva del TSH con levotiroxina (LT4-Tg), un’ecografia negativa per ripetitività linfonodali, avevano un’altissima probabilità di essere guariti dopo 12 mesi di follow up. Di contro, quelli che invece avevano una LT4-Tg > 1 ng/ml, avevano un’alta probabilità di non esser guariti e quindi dover eseguire ulteriori presidi diagnostici e/o terapeutici. La presenza di linfonodi, ecograficamente e citologicamente caratterizzati al momento dell’ablazione, ha correlato in maniera significativa con la persistenza di malattia; ma non la presenza di linfonodi metastatici al momento dell’intervento chirurgico (N1).
Anche una tireoglobulina al 3° giorno dopo lo stimolo con TSH umano ricombinante (3°gg-Tg), <0,5 ng/ml, seppur dosata con
5
metodica “non ultrasensibile”, ha correlato in maniera significativa con la remissione clinica di malattia a 12 mesi. Inoltre, anche bassi di valori di captazione alla 3° ora, sono significativamente associati con la guarigione.
Conclusioni: Il valore di LT4-Tg dosata con metodica ultrasensibile al momento dell’ablazione è un ottimo indice prognostico di guarigione/recidiva di malattia dopo 12 mesi di follow up, così come il valore di 3°gg-Tg. La presenza di linfonodi
metastatici al momento dell’ablazione correla
significativamente con una persistenza/recidiva di malattia dopo 12 mesi dal trattamento iniziale. Altri parametri, in accordo con gli studi della letteratura, come l’iniziale istologia meno aggressiva, l’assenza di linfonodi metastatici al momento dell’esame istologico e la bassa captazione alla 3° ora, sono significativamente associati alla remissione di malattia. In un futuro prossimo, i pazienti “a rischio intermedio” potrebbero non esser più sottoposti a terapia radiometabolica ablativa ma solo ad un attento follow up clinico, laboratoristico ed ecografico.
6
2. Introduzione
2.1 Il carcinoma tiroideo differenziato
2.1.1 Epidemiologia
Il carcinoma differenziato della tiroide (DTC) rappresenta circa l’1% di tutte le neoplasie maligne dell’adulto con un picco di incidenza tra la terza e quarta decade di vita, è la forma più frequente di patologia neoplastica maligna di origine endocrina, e fra tutte le neoplasie endocrine è secondo come mortalità solo al carcinoma dell’ovaio. La sua incidenza è aumentata dal 2,4 per 100.000 abitanti riportata negli anni 40-50 fino al 10,2 per 100.000 delle più recenti casistiche [1-2]. Pur con queste premesse rappresenta solo lo 0,7% di tutte le neoplasie maligne e da un rapporto del 2006 dell’AIRT (Associazione Italiana Registri Tumori) ogni anno in Italia ne insorgono circa 500 nuovi casi con un rapporto maschi/femmine di 1/3 che tradotto in termini numerici starebbe a significare un’incidenza di 5,2 casi per 100.000 abitanti fra i maschi e 15,5 casi ogni 100.000 abitanti nelle femmine [3]
Il rischio di avere nel corso della vita una diagnosi di tumore tiroideo è di 1 / 272 uomini (3,7 per 1000) con un rischio di decesso pari a 0,4 per 1000 e 1 / 93 donne (10,8 per 1000). Tuttavia la mortalità annua è relativamente bassa con rischio di decesso pari a 0,5 per per 100.000 persone per anno sia negli uomini che nelle donne, ed è rimasta costante nonostante l’aumento della sua incidenza [4]
7
Dati epidemiologici abbastanza recenti, mostrano come l’incidenza del carcinoma tiroideo sia in aumento anche negli USA, in particolare nelle donne, rappresentando il settimo tumore come diagnosi di nuovi casi annui [5] (Fig.1)
Fig.1 – Incidenza e mortalità per cancro negli USA
Oggi è opinione comune che l'aumento dell'incidenza del carcinoma differenziato della tiroide (in particolar modo dell'istotipo papillare) sia dovuto ad un “over-diagnosis” di carcinomi che sarebbero potuti rimanere clinicamente silenti per anni, e che vengono invece diagnosticati in seguito a procedure diagnostiche più accurate, invece che ad un reale aumento
8
dell'incidenza. Di contro, altri studi mostrano invece come l'incidenza di carcinomi differenziati della tiroide di tutte le dimensioni è incrementata in entrambi i sessi, e tale incremento non è dovuto esclusivamente al miglioramento delle tecniche diagnostiche; non possono essere esclusi, in tal senso, i fattori ambientali (carcinogeni, stile di vita industrializzato, e gli “endocrine disruptors”) riscontrati in molti paesi sviluppati [6-7]. Il carcinoma tiroideo si riscontra in circa il 3-4% dei noduli tiroidei la cui incidenza clinica nella popolazione generale è del 5-10% [8].
In letteratura è stato dimostrato che non c’è differenza significativa nell’incidenza del carcinoma tiroideo in pazienti con noduli tiroidei singoli o multipli aventi dimensioni maggiori di 10 mm [9]. Nelle casistiche chirurgiche, non selezionate sulla base della citologia pre-operatoria, la percentuale di malignità varia tra l’8 e il 20% mentre, nelle casistiche autoptiche, varia tra il 5 e il 45% [6, 10-11].
Tra i fattori di rischio, l’esposizione a radiazioni ionizzanti particolarmente durante il periodo infantile e l’adolescenza rappresenta ad oggi il principale fattore di rischio del DTC [10]. Studi volti a valutare l’effetto della terapia radiante esterna su soggetti in età pediatrica affetti da patologie benigne della testa e del collo, come tinea capitis, acne, tonsillite cronica, angiomi cutanei, iperplasia timica, hanno mostrato un’incidenza del carcinoma tiroideo significativamente più elevata rispetto a soggetti non irradiati (“irradiazione esterna”)
9
[12]. Inoltre, a seguito dell’ esplosione della centrale nucleare di Chernobyl (1986), l’incidenza del DTC è aumentata drammaticamente nelle popolazioni della Bielorussia e dell’Ucraina e, in minor misura, anche in quelle della Russia, colpite dal fall-out radioattivo (“irradiazione interna”) [10, 13-14]. Altri fattori di rischio sono la familiarità (carcinoma papillare nella sindrome di Gardner e di Cowden [15], carcinoma tiroideo familiare non midollare); la presenza di una malattia tiroidea concomitante, come la tiroidite cronica autoimmune; il carente apporto alimentare di iodio [16]; fattori ormonali e gravidanze (rapporto femmine/maschi vicino a 1 prima della pubertà e dopo la menopausa, tra 2 e 4 nell’età media della vita).
Un recente lavoro ha evidenziato anche un rapporto causale diretto fra i livelli di TSH sierico e l'incidenza del tumore tiroideo; all'incremento lineare del TSH corrisponde infatti un aumento lineare dell'incidenza di carcinoma papillare della tiroide. [17]
I tumori maligni della ghiandola tiroide possono originare dalle cellule follicolari (90-95%) o dalle cellule parafollicolari o cellule C (5-10%). Il carcinoma papillare della tiroide (PTC) ed il carcinoma follicolare della tiroide (FTC), che derivano dalle cellule follicolari, rappresentano l’80% e il 10% rispettivamente, di tutti i carcinomi della tiroide. La caratteristica di questi tumori è quella di essere ben differenziati (DTCs) ossia di mantenere l’architettura e le caratteristiche (TSH dipendenza, sintesi di tireoglobulina, capacità iodocaptante) della cellula tiroidea
10
originaria, ed hanno un tasso di sopravvivenza molto elevato, di circa il 95% per il PTC e dell’80% per il FTC [18].
Colpiscono tutte le fasce di età, con un picco di incidenza tra la terza e la sesta decade di vita ed hanno una netta prevalenza per il sesso femminile nell’adulto (F:M=4:1), mentre nei bambini il rapporto d’incidenza fra femmine e maschi è sostanzialmente in equilibrio.
Istologicamente, soprattutto in passato, quando non tutte le varianti istologiche oggi conosciute, erano ancora state caratterizzate, il carcinoma papillare della tiroide era chiamato anche “Orphan Annie Tumor”.
Tale denominazione, oltre che per le caratteristiche dei nuclei contenenti una cromatina finemente dispersa che conferiva ad alcuni di essi un aspetto otticamente chiaro denominato “nucleo a vetro smerigliato” o “Orphan Annie” per la similitudine con gli occhi dell’orfanella Annie [19-20] (Fig 2), serviva a ricordare al clinico che il carcinoma papillare:
• Colpiva più frequentemente le giovani donne • Rimaneva anche per anni in maniera stabile
• Non influiva in maniera significativa sull’aspettativa di vita • Gli “Psammoma Bodies” (Fig 3) (in greco psammos significa "sand") ricordavano il nome del fedele cane dell’Orfanella Annie, Sandy
11
Fig 2 – Copertina storica di “Little Orphan Annie”
Fig 3 – Corpo Psammomatoso
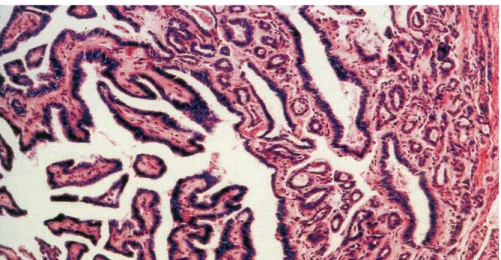
Attualmente sappiamo, che nell’ambito dei carcinomi papillari come nei follicolari, si distinguono diverse varianti istologiche. La variante classica rappresenta circa il 70% dei casi diagnosticati [21]; caratterizzata da un aspetto architetturale a papille con assi connettivo-vascolari densi rivestiti di cellule con un nucleo di aspetto tipico (Fig. 4).
12
Fig. 4 - Carcinoma papillare variante classica
Il 15-20% dei carcinomi papillari presentano un aspetto istologico meno tipico in cui solo le caratteristiche peculiari dei nuclei permettono la diagnosi. I nuclei sono più voluminosi della norma, hanno un aspetto “a vetro smerigliato” e una forma “a chicco di caffè”; inoltre presentano spesso una invaginazione intranucleare del citoplasma [22]. La variante follicolare interessa soprattutto soggetti giovani e rappresenta il 20% circa dei carcinomi papillari diagnosticati nell’infanzia in Bielorussia dopo l’incidente di Chernobyl [23] (Fig. 5).
13
Fig. 5 - Carcinoma papillare variante follicolare
Si riconoscono poi le forme sclerosanti diffuse che colpiscono soprattutto bambini e giovani adulti [24] e le varianti a cellule alte e colonnare, tipiche dei soggetti anziani [25] (Fig. 6); altre varianti che si riscontrano con minore frequenza sono: trabecolare, ossifile, warthin like e macrofollicolare.
14
Anche nel carcinoma follicolare si distinguono, una variante istologica classica, una variante a cellule chiare, una a cellule ossifile (o a cellule di Hürthle) e infine i carcinomi insulari.
2.1.2 Comportamento biologico
Il carcinoma papillare ha la tendenza a rimanere localizzato nella ghiandola tiroidea e, nel caso di metastatizzazione, si diffonde più spesso localmente alle stazioni linfonodali cervicali e del mediastino superiore. Talora i linfonodi sede di metastasi sono di dimensioni molto superiori rispetto al tumore primitivo, che può non essere rilevato alla palpazione. Da un punto di vista prognostico, ancora più grave della diffusione linfatica, è l’infiltrazione con superamento della capsula tiroidea e l’invasione di importanti strutture adiacenti quali esofago, trachea e nervo laringeo ricorrente. Per via ematogena il tumore diffonde più frequentemente ai polmoni e alle ossa. Nel 40-50% dei casi circa il carcinoma papillare presenta focolai multipli in uno o entrambi i lobi tiroidei [26-29]. Il carcinoma papillare è un tumore che cresce molto lentamente ed è, come già ricordato, uno dei tumori maligni a prognosi più favorevole (sopravvivenza a 5, 10, 20 anni del 95, 90, 83% rispettivamente)[30]; nonostante questi dati rassicuranti, la potenzialità di questo tumore di trasformarsi nel tempo in una neoplasia con elevato grado di malignità non può essere trascurata [31-33].
15
L’istotipo follicolare rappresenta circa il 10% dei carcinomi tiroidei e predilige la fascia di età tra i 30 e i 50 anni; è un tumore a lenta crescita e con prognosi relativamente favorevole. Ha però un comportamento clinico più aggressivo del carcinoma papillare ed è, al pari di quest’ultimo, più frequente nelle donne. A differenza del carcinoma papillare però, la diffusione avviene
prevalentemente per via ematogena localizzandosi
preferibilmente a livello polmonare e osseo dove provoca lesioni di tipo osteolitico in particolar modo a livello delle coste, del cingolo scapolo-omerale, dello sterno e del cranio. Sebbene più raramente anche il parenchima cerebrale e il fegato possono essere sede di metastasi.
2.1.3 Terapia
Benché il DTC abbia un’ evoluzione lenta ed una prognosi generalmente buona, non possiamo dimenticare che resta una neoplasia potenzialmente letale, soprattutto in quel 20% dei casi che hanno una perdita della differenziazione cellulare nel tempo, smarrendo sia la capacità di produrre tireoglobulina ma soprattutto quella di captare lo iodio radioattivo. Pertanto, il trattamento iniziale, che rappresenta lo step più importante, deve essere il più radicale possibile e tendere ad ottenere una guarigione definitiva, una bassa incidenza di recidive locali e metastasi a distanza, ed un’ottima qualità della vita, evitando complicanze iatrogene [34-35].
16
Le linee guida in tal senso proposte in letteratura, variano in alcuni casi, in maniera importante a seconda degli organismi di studio, in particolar modo per quelle neoplasie considerate a “basso rischio”. Nonostante le controversie, la terapia iniziale del DTC consiste in un intervento chirurgico di tiroidectomia totale o “quasi totale” (lobectomia e istmectomia totale della parte del tumore e lobectomia parziale del lobo controlaterale).
Nel caso di tumori piccoli (< 1cm), a basso rischio, unifocali, intratiroidei, in assenza di pregressa irradiazione di testa e collo e metastasi linfonodali cervicali, è considerata da alcuni, risolutiva anche solo la lobectomia [36-37] in alcuni casi anche per i carcinomi tiroidei minimamente invasivi [37]. La dissezione linfonodale profilattica del comparto centrale, può essere eseguita nei casi di un’istologia iniziale che mostri l’infiltrazione ed il superamento della capsula tiroidea da parte del tumore. La dissezione linfonodale del comparto latero-cervicale, viene, invece, eseguita in genere nei casi di metastasi linfonodali latero-cervicali già citologicamente diagnosticate prima dell’intervento chirurgico [36].
17
Fig.7 – modifiche negli anni della stadiazione sec TNM (1992 vs 2002 vs 2009)
18
Fig.8 – Classificazione stazioni linfonodali del collo
Una chirurgia radicale riduce notevolmente il rischio di recidive specialmente se accompagnata dalla terapia radiometabolica con 131I che ha lo scopo di ablare il tessuto tiroideo residuo mediante l’emissione di radiazioni β (90%) ma anche radiazioni γ (10%). L’ablazione post-chirurgica del residuo tiroideo con iodio radioattivo, viene attualmente eseguita per tutti i tipi e le istologie di carcinoma differenziato della tiroide, eccetto per quelli a “rischio molto basso”, aventi diametro <10 mm, unifocali, senza evidenza di infiltrazione ne di superamento della capsula e senza metastasi linfonodali (T1aN0M0, sec. TNM).
Il razionale dell’utilizzo del radioiodio dopo la chirurgia si basa sulla conservata capacità delle cellule tiroidee neoplastiche di
19
captare e organificare lo iodio per la sintesi ormonale. In una ampia casistica di carcinomi tiroidei raccolta presso la Ohio University è stato chiaramente dimostrato che i pazienti affetti da DTC e trattati con tiroidectomia totale, terapia radioablativa con 131I e terapia soppressiva con levotiroxina avevano il minor rischio di recidiva e/o persistenza di malattia [38]. Il razionale dell’ablazione del residuo tiroideo può essere riassunto in 3 punti:
diminuisce la frequenza di recidive e, secondo alcuni, anche la mortalità, eradicando foci microscopici del tumore all’interno del tessuto tiroideo residuo [39]
facilita la scoperta precoce di recidive mediante il dosaggio della tireoglobulina circolante (Tg) e della scintigrafia totale corporea con 131I, grazie all’eliminazione dell’interferenza del residuo tiroideo normale [40]
la scintigrafia corporea totale eseguita sfruttando la radioattività della dose ablativa permette di svelare metastasi locali e/o a distanza non rilevabili al momento dell’intervento chirurgico [18].
Pertanto, l'ablazione del tessuto tiroideo residuo post-chirurgico ha un triplice scopo: a) terapeutico perché elimina il rischio di presenza di un potenziale focolaio tumorale nel tessuto tiroideo residuo, rischio effettivo nel 45-50% dei casi; b) diagnostico perché consente di completare la stadiazione iniziale della malattia rivelando eventuali focolai tumorali extracervicali; c)
20
adiuvante perché consente di migliorare il follow-up, in quanto l'eliminazione del residuo, anche normale, aumenta l'accuratezza diagnostica del dosaggio della Tg sierica, facilitando l'evidenza di recidiva di malattia qualora si evidenzi un incremento anche minimo della Tg circolante ad uno dei controlli eseguiti [36]. Uno degli aspetti ancora controversi riguarda la dose di 131I da utilizzare per l'ablazione del residuo post-chirurgico. Una revisione dei casi trattati prima del 1990 ha consentito di osservare che la percentuale di pazienti che ottenevano una radioablazione efficace e definitiva del residuo tiroide, non era dissimile tra i pazienti che venivano trattati con 30 mCi o tra 30 e 80 mCi o maggiori di 80mCi, e la percentuale si attestava intorno al 60%. Tuttavia, dal 1990 in poi, quando non è stata più impiegata la STC diagnostica, eseguita dopo
somministrazione di 4-5 mCi 48 ore prima della
somministrazione della dose terapeutica, si otteneva una percentuale di casi ablati dell'85%, anche con dosi di 30 mCi di 131I. Questo incremento significativo del successo dell'ablazione è stato imputato alla assenza dell'effetto “stunning” dato dalla somministrazione di basse attività di 131I per eseguire la STC diagnostica. Si ritiene, infatti, che la dose tracciante utilizzata per la STC diagnostica, somministrata poco prima della dose terapeutica, possa stordire le cellule senza peraltro eliminarle, impedendo loro la captazione della dose ablativa [41]. Vi sono vari studi riportati in letteratura eseguiti per dimostrare l'efficacia ablativa di attività di radioiodio relativamente basse. In particolare Johansen et al., che hanno confrontato i risultati del
21
trattamento ablativo in due gruppi di pazienti trattati con 30 o con 100 mCi di 131I [42] hanno dimostrato la sostanziale equivalenza dei due regimi di trattamento (81% vs 84%).
La terapia radiometabolica con 131I è la terapia di scelta anche per le lesioni metastatiche che hanno ancora la capacità di captare il radioiodio. Trattamenti ripetuti con 131I possono essere eseguiti ogni 6-12 mesi fino alla remissione clinica e strumentale di malattia o fino alla perdita della capacità iodocaptante del tumore. Nel momento in cui le metastasi abbiano perso la capacità di captare lo iodio occorrerà intervenire con altri approcci terapeutici di tipo chirurgico e/o chemioterapico e/o radioterapico a seconda del caso [18].
Recentemente, data la scarsa responsività di alcuni pazienti alle terapie convenzionali e grazie alle nuove scoperte nel campo della biologia molecolare numerosi trial clinici con farmaci sperimentali rappresentano l’unica valida alternativa per questi pazienti.
2.1.4 Fattori prognostici
I pazienti con carcinoma tiroideo differenziato hanno un’alta probabilità di guarigione completa e una bassa probabilità di recidiva. Sono già stati identificati diversi fattori prognostici che permettono di identificare la piccola percentuale di pazienti ad alto rischio di recidiva e di morte. Tra questi, l’età del paziente nel momento dell’insorgenza del tumore è il più importante
22
fattore prognostico indipendente per i carcinomi tiroidei ben differenziati [43]. Un importante significato prognostico per la sopravvivenza è dato inoltre dalle dimensioni del tumore primitivo, dalla presenza di invasione extratiroidea e dalle metastasi a distanza. Le metastasi linfonodali presenti all’esame iniziale invece non aumentano il rischio di mortalità per DTC ma aumentano il rischio di recidiva locale e regionale [34-35, 44-46]. Più recentemente anche lo studio degli oncogeni coinvolti nella genesi tumorale tiroidea ha valutato l’eventuale ruolo come fattore prognostico di tali marker.
23
2.2 Oncogeni e tumori della tiroide
La proliferazione delle cellule follicolari tiroidee è controllata da fattori di crescita extra-cellulari che modulano le vie intra-cellulari della trasmissione del segnale. Il TSH è il principale fattore di regolazione della proliferazione nelle cellule follicolari. Uno squilibrio nei meccanismi di regolazione con un aumento dell’attività stimolatoria o una riduzione del controllo inibitorio è alla base della proliferazione incontrollata delle cellule e quindi della crescita tumorale [47]. Una migliore comprensione dei meccanismi della tumorigenesi tiroidea è stata resa possibile dagli enormi progressi realizzati nel campo della biologia molecolare. Il carattere monoclonale della maggior parte dei tumori benigni e maligni della tiroide suggerisce che la loro genesi è dovuta in parte anche ad anomalie genetiche [48]. La maggior parte delle alterazioni geniche esercita un’azione oncogena attraverso l’attivazione della via MAP chinasica (mitogen-activated protein kinase) che include RET→ Ras→Raf→MAP chinasi. L’attivazione di questa via è infatti un importante meccanismo nella genesi e nella progressione tumorale poiché stimola la divisione e la proliferazione cellulare [49].
L’attivazione dell’oncogene RAS per mutazioni puntiformi è presente in circa il 40% dei tumori tiroidei benigni e maligni e può essere considerata l’alterazione genica più frequente [48]. Gli oncogeni RAS includono HRAS, KRAS e NRAS che sintetizzano
24
un gruppo di proteine di 21 KDa importanti nella genesi e nella progressione di molti tumori umani. Da un punto di vista biochimico esistono due stati funzionali distinti per le proteine RAS, uno inattivo in cui la proteina è legata al GDP ed uno attivo in cui la proteina esibisce attività GTPasica promuovendo la trasduzione del segnale responsabile dell'attivazione delle chinasi MAP. Il gene RAS mutato stimola la proliferazione cellulare e inibisce la differenziazione delle cellule follicolari determinando la perdita o l’attenuata espressione dei marcatori della differenziazione, quali la tireoglobulina, la tireoperossidasi e la captazione dello iodio.
L’attivazione del proto-oncogene RET ad oncogene è stata trovata esclusivamente nel PTC da qui ne deriva l’acronimo di RET/PTC (Papillary Thyroid Carcinoma) [50]. Il gene è espresso in varie linee cellulari neuronali, nelle cellule C della tiroide e nella midollare del surrene ma non nelle cellule follicolari della tiroide. Questi oncogeni sono geni chimerici che risultano da riarrangiamenti cromosomici che giustappongono il dominio tirosin-chinasico di RET (cromosoma 10q11-2) a regioni 5' terminali di geni eterologhi. Ad oggi si contano 12 forme riarrangiate riferite come RET/PTC1-9, PCM-RET, ELKS-RET e RFP-RET, isolate da forme tumorali sporadiche o indotte da radiazioni. Le proteine di fusione risultano costitutivamente attivate nella loro attività fosforilativa come conseguenza della loro dimerizzazione, e sono localizzate in genere nel citoplasma e non nella membrana plasmatica [51-52].
25
Sono state identificate tre principali classi di RET/PTC la cui frequenza, escludendo i tumori con storia di esposizione a radiazioni, varia tra il 2,5 e il 59%, a seconda delle casistiche [53]:
RET/PTC 1 – riarrangiamento intracromosomico fra il dominio tirosin kinasico di ret e un gene chiamato H4, la cui funzione è tutt’oggi non conosciuta [54]
RET/PTC 2 – riarrangiamento intercromosomico fra il dominio tirosin kinasico di ret ed un gene che si trova sul cromosoma 17 che codifica per la subunità regolatoria Riα della protein kinasi A [55].
RET/PTC 3 – riarrangiamento intracromosomico fra il dominio tirosin kinasico di RET e un gene chiamato ELE1, la cui funzione non è a tutt’oggi conosciuta [56]
Le oncoproteine riscontrate con maggiore frequenza sono RET/PTC1 e RET/PTC3. Mentre l'oncogene RET/PTC1 è prevalente in tumori sporadici, (60-70%), quello RET/PTC3 è prevalente nel carcinoma papillare indotto da radiazioni, caratterizzato da una breve latenza d'insorgenza e frequente nel sub-istotipo solido-follicolare. I risultati di studi condotti su colture cellulari e topi transgenici per definire le proprietà oncogeniche di RET/PTC1 e RET/PTC3 concordano nell'indicare che RET/PTC3 è l'oncogene più aggressivo. A supporto di tale ipotesi, concorrono le evidenze che RET/PTC3 è l'oncogene prevalente nel carcinoma papillare sporadico a cellule alte e RET/PTC1 nel carcinoma papillare occulto [57]. Inoltre, recenti risultati mostrano che i riarrangiamenti RET/PTC inducono l'espressione del recettore
26
per chemochine CXCR4 e dell'osteopontina (OPN), così come del suo recettore CD44. OPN è una glicofosfoproteina ritenuta funzionare come citochina. L'aumento di CXCR4 ed OPN conferisce caratteristiche invasive a cellule epiteliali tiroidee trasformate da RET/PTC.
Dunque le chemochine ed i relativi recettori potrebbero giocare un ruolo nella progressione dei tumori tiroidei RET/PTC-positivi L’attivazione del proto-oncogene TRK, localizzato nel cromosoma 1 e codificante un recettore di membrana con dominio tirosino-chinasico, avviene attraverso un riarrangiamento genico. Sono stati identificati 4 tipi di riarrangiamenti in cui si ha la fusione del dominio C-terminale di TRK con la regione 5’ di un gene ad espressione ubiquitaria con l’attivazione costitutiva dell’oncogene. Questi sono presenti nei carcinomi tiroidei papillari con una frequenza compresa tra lo 0 e il 10% [58].
L’iperespressione di MET, proto-oncogene codificante un recettore di membrana con un dominio tirosino-chinasico, è stata riscontrata nel 50% circa dei carcinomi tiroidei, soprattutto in quelli papillari [59].
Ad oggi, l’oncogene associato alla forma anaplastica è p53. Mutazioni puntiformi di questo “oncosoppressore” sono state infatti riscontrate prevalentemente nelle forme sdifferenziate e anaplastiche suggerendo un ruolo di queste mutazioni nella progressione finale verso forme completamente indifferenziate [60-61].
27
L'evento genetico però prevalente del carcinoma papillare è la mutazione di BRAF, presente mediamente nel 44% dei casi con una variabilità dal 28 all'83% nei diversi studi. E' rappresentato dall'attivazione oncogenica del gene BRAF, causata dalla mutazione Val600Glu (genotipo T1799A) ed è riscontrata frequentemente anche in nevi benigni, melanomi maligni ed in un sottogruppo di tumori dell'ovaio e del colon [62]. BRAF è un forte attivatore della chinasi MAP; infatti, risulta un componente della cascata RAS>RAF>MEK>ERK/MAP che gioca un ruolo centrale nella regolazione della crescita, del ciclo cellulare e della proliferazione [63].
La mutazione Val600Glu attiva costitutivamente la chinasi BRAF ed è responsabile in topi transgenici dell'iniziazione e progressione del carcinoma papillare [64]. Constatata la sua presenza anche in carcinomi papillari di dimensioni ridotte, si ritiene possa avere un ruolo nelle prime fasi della progressione del tumore anche nell'uomo.
Diversi studi indicano che le mutazioni in BRAF si associano ad una maggiore aggressività del tumore in termini di invasione, stadio clinico e rischio di ripresa e sono prevalentemente associate alle varianti a cellule alte (77%) e classica (60%) dell'istotipo papillare [65]
La stretta associazione rilevata da più Autori tra la mutazione T1799A in BRAF [66] e le caratteristiche clinico-patologiche più severe della malattia inducono a ritenere questa alterazione un marcatore genetico, potenzialmente utile nel processo
28
diagnostico pre-operatorio. A tal riguardo è bene evidenziare che la mutazione in BRAF risulta anche associata alla perdita della capacità di captare lo 131I e quindi ad una scarsa risposta terapeutica. Questa tesi è sostenuta da studi che dimostrano una stretta associazione tra presenza della mutazione in BRAF e silenziamento dei geni nel carcinoma papillare, nello specifico di SLC5A8 e TPO, il primo codificante per la proteina responsabile per il trasporto apicale dello iodio ed il secondo per l'enzima che lo metabolizza (“hypermethylation of promoters of several functional thyroid genes, leading to loss of expression”) [67] Eccetto rare eccezioni [68-69] è stata individuata una esclusione reciproca tra la mutazione BRAFV600E e altre alterazioni geniche presenti nel cancro tiroideo tra cui la mutazione di Ras e i riarrangiamenti di RET/PTC [70-71]. In particolare la mutazione Ras è più frequente nella variante follicolare del carcinoma papillare, mentre i riarrangiamenti di RET/PTC sono più prevalenti nella forma classica del PTC e nella variante a cellule alte così come BRAF.
Un fattore importante nel determinare la dominanza di una delle due alterazioni genetiche nel carcinoma papillare è l’età: mentre RET/PTC ha un’alta prevalenza nella popolazione pediatrica ed in particolare in quella esposta a radiazioni ionizzanti, BRAFV600E è riscontrato più frequentemente in pazienti adulti. In particolare nei carcinomi papillari diagnosticati nell’infanzia c’è una bassissima prevalenza di BRAFV600E [72]: l’età più avanzata al momento della diagnosi correla con la mutazione di BRAF indipendentemente dall’esposizione all’irradiazione [73].
29
Anche il nostro gruppo di studio, in un lavoro del 2008 ha dimostrato, in un gruppo di pazienti con follow-up medio molto lungo, che BRAFV600E è un fattore predittivo indipendente di persistenza di malattia e che i pazienti con la mutazione nel tessuto primitivo hanno una sopravvivenza inferiore [74].
In conclusione possiamo ritenere che il pattern genetico (RET/PTC, BRAF ecc) è presente nell’80% dei PTC circa, e le mutazioni che coinvolgono tale pattern sono considerate come eventi sia inizianti che promuoventi il fenotipo mitogenico, nella carcinogenesi tiroidea.
30
2.3 Follow up
Il gold standard del trattamento congiunto (chirurgico e radiometabolico) del paziente con carcinoma differenziato della tiroide è quello di ottenere la remissione clinica di malattia, definita come la non dosabilità dei valori tireoglobulina basale (bTg) e stimolata (sTg) da elevati livelli ematici di TSH (>25 mCu/ml), in assenza di immagini suggestive di lesioni secondarie all’esame ecografico del collo e/o alla scintigrafia totale corporea con 131I [75-76]. La presenza di una tireoglobulina dosabile, sia in condizioni basali che dopo stimolo, è indicativa di una persistenza e/o recidiva di malattia [77].
Attualmente la metodica utilizzata più frequentemente per valutare la sTg, è la stimolazione con TSH umano ricombinante (rhTSH) che permette di evitare gli effetti collaterali dell’ipotiroidismo, non sospendendo la terapia soppressiva con levotiroxina. Diversi lavori in letteratura hanno mostrato l’uguale efficacia nello stimolo della tireoglobulina, confrontando pazienti ipotiroidei con pazienti che eseguivano la stimolazione con rhTSH; è però l’ interpretazione dei dati relativi al valore della tireoglobulina stimolata (sTg), che è stata oggetto di diversi dibattiti degli esperti. Oggi si assume che il valore di sTg al di sotto del quale un paziente è considerato libero da malattia è di 1 ng/ml (associato con la negatività dell’ecografia del collo e della scintigrafia totale corporea diagnostica per i pazienti con anticorpi anti-tireoglobulina positiva) [36, 77-78]. Per contro,
31
valori di sTg superiori a 2 ng/ml sono considerati meritevoli di ulteriori accertamenti diagnostici, in quanto indicativi di persistenza/recidiva di malattia [79]. La “zona grigia” è chiaramente la fascia di pazienti che presentano una sTg compresa fra 1 e 2 ng/ml per i quali, le decisioni diagnostico-terapeutiche vengono valutate di caso in caso.
L’introduzione del dosaggio della tireoglobulina ultrasensibile (UsTg) in questi ultimi anni, ha portato ad una riduzione nell'esecuzione del numero dei test di stimolo con rhTSH, di circa l’80% [80]. Due importanti lavori della letteratura, hanno messo in evidenza la capacità di questa nuova metodica di dosaggio della Tg, di individuare i pazienti “liberi da malattia”, anche nel follow up a lungo termine, se i valori di bTg erano compresi fra <0,1-0,3 ng/ml [81-82]. Sulla base di questi dati, il test di stimolo con rhTSH, pertanto, potrebbe essere riservato ai pz che hanno una bUsTg >0,3. Schlumberger et al, comparando sette diversi metodi di dosaggio della tireoglobulina plasmatica, hanno però evidenziato come all’elevata sensibilità della UsTg, corrisponda una bassa specificità [83], che in termini pratici significa la presenza di diversi “falsi positivi”. Anche nell’utilizzo della UsTg pertanto dovranno essere studiati nuovi cut-off per ottimizzare la gestione di questi pazienti. Nella nostra esperienza, consideriamo liberi da malattia tutti i pazienti che hanno AbTg negativi, un valore di UsTg non dosabile (<0,1 ng/ml) in assenza di immagini ecografiche e/o scintigrafiche, suggestive di persistenza/recidiva di malattia.
32
La valutazione clinica, con dosaggio degli ormoni tiroidei, del TSH, della Tg e degli AbTg, in pazienti in terapia con levotiroxina, e l’ecografia del collo, andrebbero eseguiti ad intervalli regolari di 12-18 mesi nei pazienti considerati “liberi da malattia” [36]. Il test di stimolo a cadenza annuale con rhTSH pertanto, potrebbe essere evitato nei pazienti con UsTg basale non dosabile, anche se ciò rimane ancora oggi tema di frequenti dibattiti degli esperti [84-85]; in ogni caso, attualmente è sconsigliato eseguire il test di stimolo in pazienti considerati liberi da malattia prima che siano trascorsi 5 anni dalla diagnosi.
La terapia soppressiva con levotiroxina, resta comunque, il primo cardine nel follow up dei pazienti con DTC trattati chirurgicamente e con terapia radiometabolica. Un lavoro ormai
abbastanza datato, ma dal contenuto estremamente
interessante, ha messo in evidenza come una terapia anche mild-suppressive (TSH ~0.4 mU/l) è capace di indurre la massima soppressione sulla Tg sierica, suggerendo così che l’incremento ulteriore del grado di soppressione del TSH potrebbe non influire sull’ eventuale crescita tumorale [86].
Biondi & Cooper, hanno valutato il rapporto rischio/beneficio della terapia soppressiva con levotiroxina nel carcinoma differenziato della tiroide, confrontando le principali linee guida di riferimento internazionali (American Thyroid Association vs European Thyroid Association) suggerendo di mantenere livelli di TSH soppresso (<0,1 mCu/ml) nei primi anni dopo l’intervento, per poi passare a livelli di TSH mediamente soppressi (0,1>0,5 mCu/ml), fino a virare verso una terapia sostitutiva (TSH 1>2
33
mCu/ml), relazionando questa modifica di terapia in base alla guarigione e/o persistenza di malattia e alla classe di rischio iniziale del tumore (Fig. 9)
Fig. 9 – Terapia soppressiva con levotiroxina ATA vs ETA
Il dibattito è ancora attuale, sul timing dello shift dalla terapia soppressiva del TSH a quella sostitutiva, specialmente nei pazienti considerati ad “alto rischio”; è però uniformemente accettato che una volta considerato il paziente libero da malattia, non è più necessario, specialmente negli anziani, mantenere una condizione di ipertiroidismo subclinico [87].
Tutti i pazienti con una UsTg basale dosabile, in assenza di diagnostica per immagini positiva per lesioni secondarie o persistenza di malattia, vengono considerati come in
34
“persistenza biochimica” di malattia. In tal caso, la strategia del “wait and see” sembra essere l’unica attuabile, riservando la ripetizione di esami di diagnostica per immagini al trend incrementale dei valori di tireoglobulina nel tempo [88-89]. Il monitoraggio dell’andamento dei valori di tireoglobulina nel tempo, vista anche l’ampia variabilità dei metodi di dosaggio disponibili, sembra oggigiorno essere ancor più importante nella valutazione dei pazienti considerati “a basso rischio” che non hanno eseguito la terapia radiometabolica ablativa con 131I. In questi pazienti, come in quelli ablati, studi preliminari hanno mostrato come il “doubling time” (tempo di raddoppiamento) della tireoglobulina nell’arco di un periodo inferiore ai 12 mesi, in corso di terapia soppressiva del TSH con levotiroxina, sia un fattore prognostico negativo per la sopravvivenza [90].
I pazienti con metastasi da DTC, vanno invece seguiti ad intervalli regolari di circa 6 mesi, in relazione anche al tipo di metastasi presente. Se le metastasi mostrassero ancora una capacità di iodocaptazione, la terapia radiometabolica con 131I dovrebbe essere somministrata ogni 8-10 mesi circa evitando, specialmente nei pazienti giovani con metastasi polmonari, somministrazioni molto ravvicinate (< 6 mesi), al fine di prevenire eventuali eventi fibrotici polmonari [91]. Se le metastasi non fossero iodocaptanti, o avessero perso la capacità di captare lo iodio, un controllo con esami radiologici (ecografia del collo, TC total body con e senza mdc) dovrebbe essere eseguito ogni 6-12 mesi per valutare l’andamento di malattia; in considerazione della lenta crescita di questo tipo di tumore,
35
l’utilizzo di terapie attive sperimentali come la terapia con farmaci inibitori delle tirosino-kinasi (terapia chemioterapica poco efficace del carcinoma della tiroide), dovrebbe essere riservato a percentuali di crescita tumorale maggiori del 20% [92].
Nei pazienti con metastasi da carcinoma differenziato della tiroide il valore di TSH ottimale da mantenere con la terapia con levotiroxina dovrebbe essere <0,1 mCu/ml, tale concetto rappresenta parte integrante della terapia antineoplastica; i valori delle frazioni libere invece (FT3 ed FT4) dovrebbero rimanere nel range della norma, e sarebbero clinicamente rilevanti, nel caso di pazienti con metastasi secernenti elevate quantità di FT3 ed FT4.
36
2.4 Il ruolo della tireoglobulina al momento dell’ablazione
Molti studi hanno mostrato come la Tg sia fondamentale nel follow up del carcinoma differenziato della tiroide, poco invece è conosciuto circa il suo possibile ruolo nel momento che intercorre fra l'intervento chirurgico e la terapia radiometabolica ablativa con 131I.
Il valore della Tg sierica in ipotiroidismo al momento dell’ablazione, è già stato valutato in diverse casistiche come efficace fattore predittivo di persistenza/recidiva di malattia [93-95]. Le recenti modifiche delle linee guida nel trattamento del DTC, hanno mostrato come la terapia radiometabolica ablativa con 131I eseguita dopo lo stimolo con rhTSH, è meno traumatica per il paziente evitando tutti gli effetti collaterali dell’ipotiroidismo, pur mantenendo lo stesso profilo di efficacia [78, 96].
Tale parametro è stato preso in considerazione anche in un lavoro di Giovanella et al, che analizzando 126 pz, hanno mostrato come un valore di LT4-Tg di 0,65 ng/ml al momento dell’ablazione con rhTSH aveva una sensibilità del 82,9%, una specificità del 55,2%, un valore predittivo positivo del 43,3% e una valore predittivo negativo del 97,8% nel rilevare pazienti con metastasi da DTC dopo 12 mesi dall’ablazione [97].
Il valore della Tg, 48 ore dopo la somministrazione del radioiodio nei pazienti ablati con rhTSH (5° giorno), in conseguenza del danno cellulare indotto dalle radiazioni, secondo diversi lavori
37
non avrebbe alcun possibile ruolo come fattore predittivo di persistenza/recidiva di malattia [98].
Recentemente diversi autori hanno cercato però di dare un ruolo prognostico al valore della Tg in terapia soppressiva del TSH (LT4-Tg) al momento dell’ablazione, al fine di proporre un modello di trattamento per i pazienti a basso rischio, che sarebbe volto ad evitare la terapia radiometabolica ablativa, dimostrando il buon outcome di questa categoria di pazienti.
Nascimento et al, hanno valutato in maniera retrospettiva 242 pazienti trattati chirurgicamente per DTC, con AbTg negativi, sTg <1 ng/ml, che avevano eseguito la terapia radiometabolica ablativa con 131I dopo stimolo con rhTSH e in ipotiroidismo (202 vs 40), sia con dose di 100 mCi (205 pz) che con dose di 30 mCi (37 pz), seguiti in follow up per una mediana di 3,5 aa. Il maggior fattore di rischio predittivo per una persistenza di malattia al momento dell’ablazione era la presenza di linfonodi metastatici (N1). 203 pz avevano una SCT negativa, di questi solo 173, mantenevano una sTg non dosabile, in un arco di tempo variabile fra i 6 e i 12 mesi. Dopo il periodo di follow up, si osservava una recidiva di malattia in solo 2 casi entrambi con varianti istologiche aggressive. Pertanto, si concludeva che vista la frequenza con cui si osservava una sTg non dosabile al momento dell’ablazione, la ripetizione di un secondo test di stimolo con rhTSH (6-12 mesi) non aggiungeva nulla alla diagnosi iniziale, dunque, la terapia radiometabolica ablativa poteva essere evitata in tutti i pazienti con sTg <1 ng/ml, senza metastasi linfonodali ne varianti istologiche aggressive. Il modello di
38
trattamento proposto dunque per i pazienti trattati chirurgicamente per DTC, senza evidenza di linfonodi metastatici all'esame istologico, con istotipi non aggressivi, era eseguire la terapia soppressiva del TSH con levotiroxina per circa 3 mesi, seguita da un test di stimolo con rhTSH, e in tutti quei pazienti in cui la sTg risultava <1 ng/ml, evitare l’esecuzione della terapia radiometabolica ablativa ed eseguire follow up nel tempo. [99] Anche Rosario et al, hanno eseguito la stessa valutazione del lavoro precedente, prendendo in esame i pazienti con DTC “low risk”. Analizzando 237 pazienti con DTC a basso rischio che eseguivano la terapia radiometabolica ablativa con 30 o 100 mCi di 131I in ipotiroidismo, con AbTg negativi, il valore predittivo negativo dell’associazione sTg<1, sTg<10 ed ecografia del collo negativa per metastasi linfonodali, era del 100%. Dunque, i pazienti trattati chirurgicamente e con terapia radiometabolica (indipendentemente dalla dose di 131I ricevuta) per DTC, a basso rischio, con una sTg non dosabile, ed un'ecografia del collo negativa, venivano considerati liberi da malattia, dopo circa 1 anno di follow up dall'ablazione [100-101]; gli autori supponevano, pertanto, che se questi pazienti avevano già i parametri clinico biochimici di remissione della malattia prima dell’ablazione, a maggior ragione li avrebbero avuti dopo il trattamento radiometabolico ablativo; tale accezione veniva dunque proposta per decidere di non ablare questa categoria di pazienti [102]. (Fig. 10)
39
Fig.10 – Modello di selezione dei pazienti da non trattare con 131I (Rosario et al)
Secondo la nostra esperienza e anche sulla base dei dati in letteratura, questi lavori presentano diversi bias di fondo. Una prima osservazione è che sono tutti studi di tipo retrospettivo; prendono in considerazione lunghi follow up, ma con dosaggio della Tg eseguito con diverse metodiche solo parzialmente comparabili; che, seppur osservando un numero considerevole di pazienti, in gran parte i parametri analizzati per singolo paziente non erano completi; che nella selezione dei pazienti considerati guariti, hanno considerato come in remissione clinica di malattia pazienti che nei controlli di follow up presentavano una LT4-12mTg < 1 ng/ml. In particolare nei confronti di tale ultima
40
accezione, è stata considerata guarita anche tutta una fascia di soggetti abbastanza ampia, ossia quelli che avevano una LT4-12mTg compresa fra 0,1 e 1. Spencer et al, hanno invece dimostrato come, pur eseguendo il dosaggio della tireoglobulina ultrasensibile, se i valori della Tg in soppressione al follow up sono compresi fra 0,1 e 1 ng/ml, le possibilità che la Tg dopo stimolo del TSH umano ricombinante sia superiore a 2 ng/ml, che allo stato dell’arte è ritenuto essere il cut-off al di sopra del quale indagare con ulteriori presidi diagnostico-terapeutici, incrementa in maniera lineare per ogni incremento della Tg da 0,1 fino a 1. [103]
41
3. Scopo dello studio
Sulla base dell’analisi dei dati della letteratura rimangono ancora aperte una serie di domande le cui risposte rappresentano gli scopi del nostro studio. In particolare ci siamo proposti di:
Valutare se il test di stimolo con TSH umano ricombinante, eseguito prima dell’ablazione, al fine di selezionare i pazienti a cui somministrare la terapia radiometabolica con radioiodio, sia davvero efficace nel discernere i pazienti da ablare rispetto a quelli da non ablare.
Valutare quale potrebbe essere il fattore, o i fattori prognostici predittivi di remissione clinica, dopo la terapia radiometabolica con 131I, ponendo particolare attenzione sull’eventuale ruolo della tireoglobulina ultrasensibile.
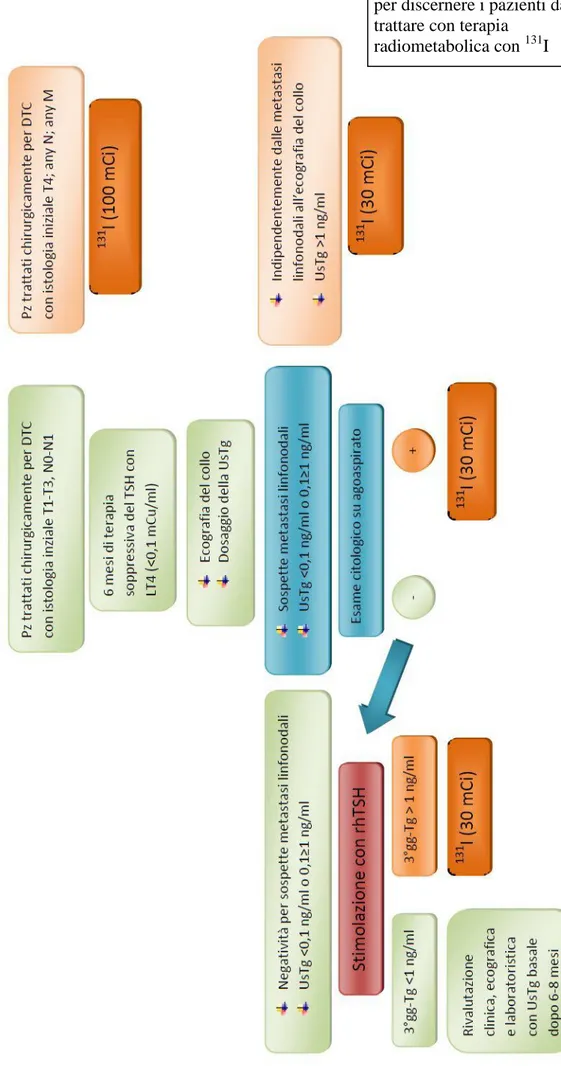
Proporre un nuovo algoritmo per l’identificazione dei pazienti con carcinoma differenziato della tiroide a rischio basso e intermedio da sottoporre o meno a terapia radioablativa
42
4. Pazienti e metodi
Abbiamo valutato retrospettivamente i dati di 250 pazienti affetti da carcinoma differenziato della tiroide, aventi anticorpi anti-tireoglobulina negativi (< 20 U/ml), afferiti consecutivamente al Dipartimento di Endocrinologia dell’Università di Pisa, fra il 2010 e il 2011 per eseguire trattamento radiometabolico ablativo con 30 mCi di 131I dopo stimolazione con rhTSH.
I criteri di inclusione nello studio, sono stati i seguenti: 1) pazienti con diagnosi istologica accertata di carcinoma differenziato della tiroide, 2) diagnosi istologica confermata dai nostri anatomo-patologi, 3) anticorpi anti-tireoglobulina (AbTg) negativi (<20 U/ml) al momento dell’ablazione, 4) terapia radiometabolica ablativa con 30 mCi di 131I dopo stimolo con rhTSH, 5) livelli di TSH sierico dopo stimolo con rhTSH >25 mU/L. Sono stati esclusi dal nostro studio: a) i pazienti con carcinoma differenziato della tiroide “a rischio molto basso” (tumore unifocale, diametro max della neoplasia <1 cm, non invasione extracapsulare, assenza di linfonodi sede di metastasi) per i quali le linee guida di consenso internazionali prevedono esclusivamente l’intervento chirurgico di tiroidectomia totale, senza l’esecuzione della terapia radiometabolica con 131I; b) i pazienti che presentavano al momento dell’intervento chirurgico un’ invasione delle strutture del collo, quali la laringe, la trachea, l’esofago, l’arteria carotide ecc, che venivano trattati con una terapia radiometabolica ablativa ad alte dosi di 131I (100 mCi). I pazienti inclusi nello studio, sono stati raggruppati in base a diversi parametri quali, sesso, età, variante istologica alla
43
diagnosi, TNM, staging, uni o multifocalità della neoplasia, dissezione linfonodale del compartimento centrale, valori di tireoglobulina al momento dell’ablazione in terapia soppressiva con levotiroxina, valori di tireoglobulina al 3° giorno dopo la stimolazione con rhTSH, presenza o meno di linfonodi metastatici ecograficamente e citologicamente confermati al momento dell’ablazione e a 12 mesi dalla terapia radiometabolica, valori percentuali di captazione alla 3° e alla 24° ora, presenza o meno di metastasi iodocaptanti alla scintigrafia totale corporea post dose ablativa, valori di tireoglobulina dopo 12 mesi dal trattamento radiometabolico. Tutti i pazienti avevano eseguito il trattamento terapeutico tradizionale che secondo il nostro protocollo prevede, come già menzionato in precedenza, l’intervento di tiroidectomia totale, seguito dall’ ablazione del residuo tiroideo con 30 mCi di 131I dopo stimolo con TSH umano ricombinante. Una scintigrafia del collo con captazione del radioiodio dopo 3 e 24 ore dall’assunzione di una dose di 0,05 mCi di 131I, è stata eseguita a scopo diagnostico. Una scintigrafia totale corporea (STC) è stata eseguita circa 3-7 giorni dopo il trattamento radiometabolico utilizzando una gamma camera equipaggiata con collimatori ad alta energia. Sulla base della captazione, abbiamo suddiviso il risultato della STC in 1) negativa (presenza di uptake del radiofarmaco esclusivamente nel letto tiroideo), 2) presenza di captazione riferibile a metastasi linfonodali, 3) presenza di captazione riferibile a metastasi a distanza (polmonari, ossee ecc). Il dosaggio della tireoglobulina basale (LT4-Tg) al momento dell’ablazione, e al controllo a 12
44
mesi, è stato eseguito con metodica
immunochemilluminometrica di seconda generazione (Beckman Coulter, Fullerton, CA – sensibilità funzionale 0,05 ng/ml). Il dosaggio della tireoglobulina al 3° giorno dopo stimolo con rhTSH (3°g-Tg), è stato eseguito con metodo immunometrico altamente sensibile, introdotto a partire dal 1998 (ICMA: saggio ad immunochemioluminescenza), con una sensibilita pari a 0.9 ng/ml (Immulite 2000 Thyroglobulin, Diagnostic Product Corporation, Los Angeles, CA). Il dosaggio degli anticorpi anti-tireoglobulina (AbTg) è stato eseguito con metodo immunofluorimetrico (Aia-Pack TgAb Tosoh Corporation, Tokyo, Japan) introdotto dal 2002 (range di normalita: 0-30 U/ml, CV variabile tra 10,5 % e 17,7 % a seconda del titolo).
Il follow-up successivo ha compreso una valutazione clinica, un dosaggio delle frazioni libere degli ormoni tiroidei (FT3, FT4), del TSH, della Tireoglobulina con metodica di dosaggio ultrasensibile e degli AbTg, ed un’ecografia del collo a distanza di 12 mesi dal trattamento iniziale.
Tutti i pazienti hanno eseguito la terapia con levotiroxina (LT4) a dosi soppressive del TSH senza mai sospendere e/o interrompere il farmaco, dal momento dell’operazione fino al momento del controllo dopo 12 mesi.
Secondo la nostra esperienza, abbiamo considerato come “guariti” o più propriamente “in remissione clinica di malattia” i pazienti che presentavano una ecografia del collo negativa, scintigrafia totale corporea post dose ablativa di 131I negativa e a al controllo dopo 12 mesi, valori non dosabili di Tg valutati con
45
metodica ultrasensibile (< 0,1 ng/ml). Abbiamo definito invece “non guariti” coloro che continuavano a mostrare i segni clinici e/o biochimici e/o strumentali di malattia.
4.2 Analisi Statistica
L’analisi statistica è stata eseguita utilizzando il software ” SPSS statistics” v.20 per Mac OS. Abbiamo valutato l’analisi delle frequenze, eseguendo per la significatività il Test del Chi Quadro assumendo come statisticamente significativo un valore di p < 0,05. E’ stata inoltre eseguita un’analisi di regressione logistica binaria per valutare l’associazione dei fattori di rischio con la remissione e la persistenza/recidiva di malattia (Odds Ratio – Intervallo di confidenza al 95%).
46
5. Risultati
5.1 Dati epidemiologici dei pazienti studiati
Dei 250 pazienti consecutivi, aventi anticorpi anti-tireoglobulina negativi (< 20 U/ml), affetti da carcinoma differenziato della tiroide, afferiti presso il Dipartimento di Endocrinologia, fra il 2010 e il 2011 per eseguire trattamento radiometabolico ablativo con 30 mCi di 131I, 181 erano femmine (72,4%) e 69 maschi (27,6%) con un rapporto F:M=2,6:1.
L’età media dei pazienti alla diagnosi era di 47±14 anni con un range di 20-87 anni e una mediana di 46 anni; 116 pazienti avevano un’ età al momento dell’ablazione inferiore a 45 anni (46,4%), 134 pz avevano più di 45 anni (53,6%). Per questo studio specifico, il periodo di follow up è stato volutamente fissato in 12 mesi.
Nella suddivisione per tipo istologico, 111 (44,4%) pz avevano un carcinoma papillare variante classica, 76 (30,4%) pz un papillare variante follicolare, 18 (7,2%) pz un carcinoma follicolare e infine 45 (18%) pz erano affetti da un carcinoma papillare variante aggressiva (cellule alte, cellule solide); 123 (49,2%) pz avevano un singolo focolaio di carcinoma, in 127 (50,8%) pz la malattia era multifocale.
Durante l’intervento chirurgico, 29 pz avevano avuto la dissezione profilattica dei linfonodi del comparto centrale (11,6%), a 221 pz era stata praticata invece solo la tiroidectomia totale (88,4%).
47
Sulla base del TNM è stato possibile suddividere i pazienti come in tabella: TNM Frequenza % T1a(m) 29 11,6 T1b(s) 58 23,2 T1b(m) 33 13,2 T2(s) 23 9,2 T2(m) 16 6,4 T3(s) 44 17,6 T3(m) 47 18,8
Sulla base dello Stage la suddivisione era così composta:
Stage Frequenza %
1 179 71,6
2 16 6,4
3 52 20,8
4 3 1,2
Le metastasi linfonodali (comparto centrale + laterocervicale) erano documentate in 30 pz (12%). In 220 pz il dato istologico non era disponibile in quanto non era stato eseguito lo svuotamento linfonodale (88%).
48
Dividendo i pazienti per categorie sulla base del valore di LT4-Tg, 96/250 pz (38,4%) avevano una Tg <0,1 ng/ml, 118/250 (47,2%) pz 0,1 ≥ 1 ng/ml, 36 (14,4%) pz, >1 ng/ml
Sulla base della captazione alla 3° ora, 59/209 (23,6%) pz avevano una captazione <0,1%, 131/209 (52,4%) pz compresa fra 0,1 e 2%, 19/209 (7,6%) pz, >2%; il dato non era disponibile per 41 (16,4%) pz.
La captazione alla 24° ora, risultava <0,1%, in 85/215 (34%) pz, 85/215 (34%) pz avevano una captazione compresa fra 0,1 e 2%, 45/215 (18%) pz, >2%; il dato non era disponibile per 35 (14%) pz.
Valutando invece la 3°gg-Tg, dopo lo stimolo con rhTSH, 34 pz avevano una Tg <0,5 ng/ml (13,6%), 58 pz 0,5≥1 ng/ml (23,2%), 158 pz >1 ng/ml (63,2%).
L’ecografia al momento della ablazione era suggestiva di metastasi linfonodali in 28 pz (11,2%), negativa in 222 pz (88,8%).
La scintigrafia totale corporea post dose ablativa di 131I era negativa in 243 pz (97,2%), positiva per metastasi linfonodali in 4 pz (1,6%) e positiva per metastasi a distanza in 3 pz (1,2%).
Inoltre, nella nostra casistica 244 pz erano stati trattati chirurgicamente presso la Chirurgia Generale del nostro Dipartimento (97,6%), mentre 6 pz non erano stati operati a Pisa (2,4%).
49
Dopo 12 mesi dall’ablazione, 167 (66,8%) pz avevano una LT4-12mTg <0,1 ng/ml, 70 (28%) pz 0,1 ≥ 1 ng/ml, 13 (5,2%) pz >1 ng/ml.
5.2 Analisi delle frequenze in base al valore di Tg basale/LT4
L’analisi delle frequenze ha permesso di caratterizzare al meglio i pazienti che avevano eseguito la terapia radiometabolica ablativa con rhTSH, suddividendoli sulla base dei valori di tireoglobulina basale in terapia soppressiva con LT4 (LT4-Tg), al momento dell’ablazione (1° giorno). Tale suddivisione è illustrata nelle tabelle descritte in seguito.
LT4-Tg Sesso Età M F <45 >45 <0,1 ng/ml (96/250) 23 (24%) 73 (76%) 43 (44,8%) 53 (55,2%) 0,1≥1 ng/ml (118/250) 37 (31,4%) 81 (68,6%) 56 (47,5%) 62 (52,5%) >1 ng/ml (36/250) 9 (25%) 27 (75%) 17 (47,2%) 19 (52,8%) LT4-Tg Istologia
Pap V Cl Pap V Foll Foll Pap V Aggr
<0,1 ng/ml 41 (42,7%) 27 (28,1%) 6 (6,2%) 22 (22,9%)
0,1≥1 ng/ml 57 (48,3%) 40 (33,9%) 9 (7,6%) 12 (10,2%)
50 LT4-Tg TNM T1a(m) T1b(s) T1b(m) T2s T2m T3s T3m <0,1 ng/ml 9 (9,4%) 26 (7,1%) 17 (17,7%) 5 (5,2%) 7 (7,3%) 17 (17,7%) 15 (15,6%) 0,1≥1 ng/ml 15 (12,7%) 25 (1,2%) 10 (8,5%) 15 (12,7%) 9 (7,6%) 22 (18,6%) 22 (18,6%) >1 ng/ml 5 (13,9%) 7 (19,4%) 6 (16,7%) 3 (8,3%) 0 5 (13,9%) 10 (27,8%) LT4-Tg Dissezione Profilattica del Comparto Centrale Multifocalità Linfonodi Metastatici all’Istologia Ecografia suggestiva per metastasi linfonodali al momento dell’ablazione No Si No Si No Si No Si <0,1 ng/ml 83 (86,5%) 13 (13,5%) 47 (49%) 49 (51%) 83 (86,5%) 13 (13,5%) 89 (92,7%) 7 (7,3%) 0,1≥1 ng/ml 106 (89,8%) 12 (10,2%) 61 (51,7%) 57 (48,3%) 107 (90,7%) 11 (9,3%) 107 (90,7%) 11 (9,3%) >1 ng/ml 32 (88,9%) 4 (11,1%) 15 (41,7%) 21 (58,3%) 30 (83,3%) 6 (16,7%) 26 (72,2%) 10 (27,8%) LT4-Tg Staging
Stage1 Stage2 Stage3 Stage4
<0,1 ng/ml 66 (68,8%) 6 (6,2%) 24 (25%) 0 0,1≥1 ng/ml 84 (71,2%) 10 (8,5%) 22(18,6%) 2 (1,7%) >1 ng/ml 29 (80,6%) 0 6 (16,7%) 1 (2,8%) LT4-Tg 3°gg-Tg <0,5 ng/ml 0,5-1 ng/ml >1 ng/ml <0,1 ng/ml 31 (32,3%) 33 (34,4%) 32 (33,3%) 0,1≥1 ng/ml 2 (1,7%) 25 (21,2%) 91 (77,1%) >1 ng/ml 1 (2,8%) 0 35 (97,2%)
51
LT4-Tg Captazione alla 3° ora*
<0,1% 0,1-2% >2%
<0,1 ng/ml 28 (36,8%) 45 (59,2%) 3 (3,9%)
0,1≥1 ng/ml 21 (20,4%) 71 (68,9%) 11 (10,7%)
>1 ng/ml 10 (33,3%) 15 (50%) 5 (16,7%)
* Il dato era disponibile per 209/250 pz
LT4-Tg Captazione alla 24° ora*
<0,1% 0,1-2% >2%
<0,1 ng/ml 36 (48%) 34 (45,3%) 5 (6,7%)
0,1≥1 ng/ml 37 (34,6%) 36 (33,6%) 34 (31,8%)
>1 ng/ml 12 (36,4%) 15 (45,5%) 6 (18,2%)
* Il dato era disponibile per 215/250 pz
LT4-Tg Scintigrafia Totale Corporea post Ablazione
Negativa Metastasi Linfonodali Metastasi a Distanza <0,1 ng/ml 94 (97,9%) 2 (2,1%) 0 0,1≥1 ng/ml 115 (97,5%) 0 3 (2,5%) >1 ng/ml 34 (94,4%) 2 (5,6%) 0 (0%) LT4-Tg Luogo dell’intervento Pisa No Pisa <0,1 ng/ml 93 (96,9%) 3 (3,1%) 0,1≥1 ng/ml 117 (99,2%) 1 (0,8%) >1 ng/ml 34 (94,4%) 2 (5,6%) LT4-Tg LT4-12mTg <0,1 ng/ml 0,1-1 ng/ml >1 ng/ml <0,1 ng/ml 84 (87,5%) 12 (12,5%) 0 0,1≥1 ng/ml 73 (61,9%) 45 (38,1%) 0 >1 ng/ml 10 (27,8%) 13 (36,1%) 13 (36,1%)
52
Tg basale Guariti (dopo 12 mesi di follow up)
Si No
<0,1 ng/ml 84 (87,5%) 12 (12,5%)
0,1≥1 ng/ml 73 (61,9%) 45 (38,1%)
>1 ng/ml 10 (27,8%) 26 (72,2 %)
5.3 Analisi delle frequenze in base al valore di Tg al 3° giorno
3°gg-Tg Sesso Età M F <45 >45 <0,5 ng/ml (34/250) 8 (23,5%) 26 (76,5%) 16 (47,1%) 18 (52,9%) 0,5≥1 ng/ml (58/250) 10 (17,2%) 48 (82,8%) 30 (51,7%) 28 (48,3%) >1 ng/ml (158/250) 51 (52,3%) 107 (67,7%) 70 (44,3%) 88 (55,7%) 3°gg-Tg Istologia
Pap V Cl Pap V Foll Foll Pap V Aggr
<0,5 ng/ml 17 (50%) 7 (20,6%) 1 (2,9%) 9 (26,5%) 0,5≥1 ng/ml 26 (44,8%) 20 (34,5%) 2 (3,4%) 10 (17,2%) >1 ng/ml 68 (43%) 49 (31%) 15 (9,5%) 26 (16,5%) 3°gg-Tg TNM T1a(m) T1b(s) T1b(m) T2s T2m T3s T3m <0,5 ng/ml 1 (2,9%) 13 (38,2%) 6 (17,6%) 1 (2,9%) 2 (5,9%) 4 (11,8%) 7 (20,6%) 0,5≥1 ng/ml 6 (10,3%) 15 (25,9%) 9 (15,5%) 7 (12,1%) 4 (6,9%) 9 (15,5%) 8 (13,8%) >1 ng/ml 22 (13,9%) 30 (19%) 18 (11,4%) 15 (9,5%) 10 (6,3%) 31 (19,6%) 32 (20,3%)