INTRODUZIONE
LaserCyte® è un contaglobuli a fascio laser di recente introduzione nel panorama dell’ematologia veterinaria. Rispetto ai contaglobuli ad impedenza elettrica LaserCyte® fornisce delle informazioni aggiuntive quali il conteggio dei reticolociti ed il conteggio differenziale dei leucociti, essenziali per una completa e corretta valutazione dell’emogramma. Grazie alla disponibilità di poter utilizzare lo strumento LaserCyte® nel laboratorio di Biochimica ed Ematologia Clinica Veterinaria del Dipartimento di Clinica Veterinaria dell’Università di Pisa, su accordi bilaterali di cooperazione scientifica con l’azienda produttrice “Idexx Laboratories” e la sua filiale italiana è stato possibile istituire un particolare protocollo di utilizzo in condizioni “estreme” o particolarmente alterate di emogrammi di cane. A questo scopo sono stati inclusi trenta cani, pervenuti per visite di referenza presso il Dipartimento di Clinica Veterinaria dell’Università di Pisa. Tali soggetti, dopo una visita clinica completa e numerosi accertamenti di laboratorio, sono risultati affetti da linfoma, leucemia o altre neoplasie. Per ciascuno di essi, sul sangue ottenuto da un medesimo prelievo, sono stati eseguiti due emogrammi, uno effettuato con LaserCyte® ed uno effettuato con HeCo VET C®, un contaglobuli ad impedenza. Quest’ultimo strumento però non fornisce la formula leucocitaria né la
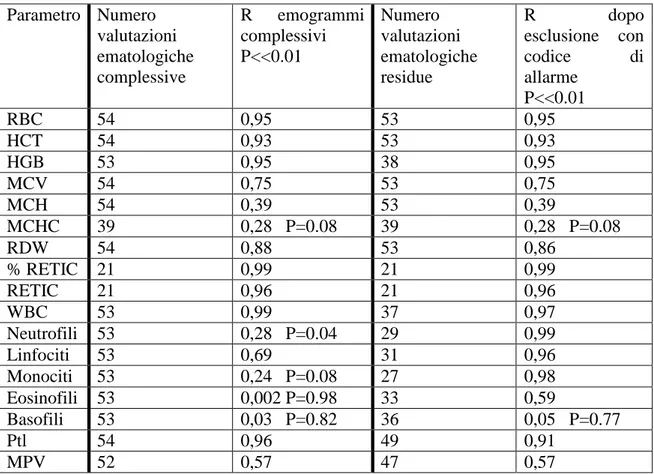
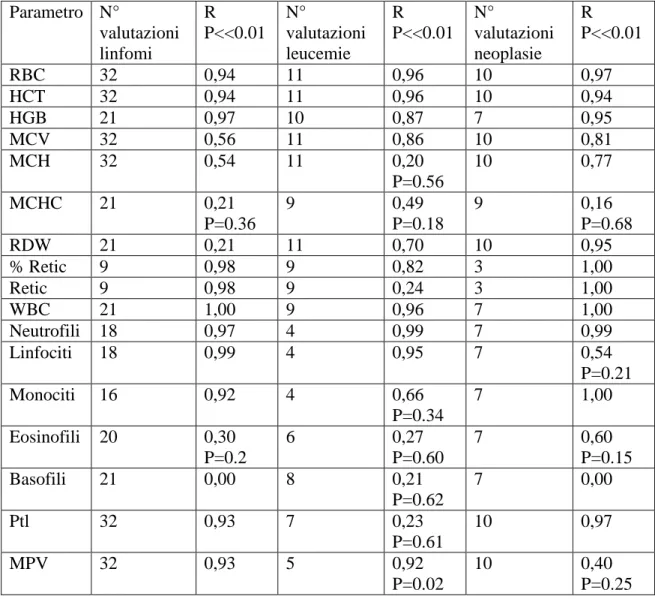
conta dei reticolociti, che invece sono stati ottenuti dalla conta differenziale e dal conteggio dei reticolociti su vetrino. Le valutazioni ematologiche comparative, dapprima valutate complessivamente e poi suddivise per patologia, sono state sottoposte ad analisi statistica per valutare se vi sia concordanza fra i risultati ematologici forniti da LaserCyte® e quelli ottenuti con HeCo VET C®, conta manuale leucocitaria differenziale e conteggio dei reticolociti su vetrino. L’impiego dell’emogramma completo unitamente alla conta reticolocitaria risulta essere un importante elemento nella corretta classificazione dei pazienti con affezioni oncoematologiche e nel loro monitoraggio in seguito all’uso di protocolli chemioterapici.
CAPITOLO 1
IL LINFOMA
Il linfoma è una neoplasia linfoide maligna che si sviluppa a carico di organi solidi quali, per esempio, i linfonodi, il fegato, la milza. L’eziologia nei cani è di tipo multifattoriale visto che non è stato possibile individuare un singolo agente eziologico. Sicuramente, fra le varie cause, c’è una componente genetica poiché è stata riscontrata una elevata prevalenza in certe linee di sangue così come c’è una predisposizione di razza. Le razze canine più colpite sono il boxer, il basset hound, il rottweiler, il cocker spaniel, il golden retriever ed il san bernardo. In recenti studi epidemiologici inoltre è stata riscontrata una associazione, da debole a moderata, fra il linfoma canino e l’impiego di erbicidi [27], l’esposizione a forti campi elettromagnetici [52] e la residenza in aree industrializzate [19], tuttavia tali ipotesi dovranno essere ulteriormente verificate. L’età dei soggetti affetti da linfoma in genere va dai sei ai dodici anni. [9]
1.1 Caratteristiche cliniche
Il linfoma può presentarsi in quattro forme anatomiche (classificazione WHO):
Forma multicentrica: caratterizzata da una linfoadenopatia generalizzata, da un coinvolgimento epatico, splenico o del midollo osseo o da una loro combinazione. [9]
Forma mediastinica: si osserva una linfoadenopatia mediastinica, con o senza infiltrazione del midollo osseo. [9]
Forma alimentare: caratterizzata da un’infiltrazione solitaria, diffusa o multifocale del tratto gastroenterico, può essere presente o meno una linfoadenopatia endoaddominale. [9]
Forma extranodale: può colpire qualunque organo o tessuto, per esempio si può trovare nel rene, nel sistema nervoso, nell’occhio o a livello cutaneo. [9]
Nel cane l’80-85% dei linfomi si presenta in forma multicentrica, il 7% in forma alimentare, il 5% è in forma extranodale, soprattutto a localizzazione cutanea, ed il 3% in forma mediastinica. [9]
I sintomi clinici variano a seconda della sede in cui si trova il tumore. Nel caso del linfoma multicentrico molto spesso i soggetti vengono sottoposti alla visita poiché il proprietario nota una o più masse sottocutanee, che poi
risultano essere linfonodi aumentati di volume e, frequentemente, questo è peraltro l’unico sintomo riscontrabile. In altri casi invece il soggetto può essere sottoposto a visita per problemi aspecifici quali la perdita di peso, l’anoressia e la letargia. Se i linfonodi ingrossati vanno a determinare un’ostruzione meccanica al drenaggio linfatico si può avere un edema, se comprimono le vie respiratorie il soggetto può presentare tosse, se si è instaurata una ipercalcemia paraneoplastica si può avere poliuria e polidipsia. Alla visita clinica i cani con questa forma di linfoma presentano solitamente una linfoadenopatia generalizzata che può essere associata anche a splenomegalia, epatomegalia o lesioni extralinfonodali che si possono trovare a livello renale, oculare, cutaneo o al sistema nervoso. I linfonodi interessati sono 5-15 volte più grandi della norma, indolenti alla palpazione e non sono adesi ai tessuti circostanti. [4, 9, 21, 51]
I cani con linfoma mediastinico presentano improvvisamente dispnea, tosse e più raramente rigurgito, se inoltre si instaura una ipercalcemia paraneoplastica, cosa che accade quasi nel 50% dei soggetti colpiti, si può avere anche poliuria e polidipsia. I linfonodi mediastinici craniali ingrossati vanno a determinare, con la compressione che esercitano, la sintomatologia respiratoria e gastroenterica, a volte si può avere anche un versamento maligno pleurico che concorre ad esacerbare il quadro clinico. Alla visita clinica si riscontra una diminuzione dei suoni bronco-alveolari, uno spostamento della normale sonorità polmonare nelle porzioni caudo-dorsali
del torace e, alla percussione, si apprezza una sonorità ottusa nella parte ventrale della cavità toracica. Altre manifestazioni cliniche che possono presentarsi in corso di linfoma mediastinico sono la sindrome di Horner, che può essere mono o bilaterale, e la cosiddetta “sindrome della vena cava anteriore”che si presenta con edema della testa, del collo e delle estremità anteriori e che è causata dalla compressione che i linfonodi ingrossati vanno a esercitare sulla vena cava craniale. [4, 9, 21]
I soggetti colpiti dal linfoma in forma alimentare presentano sintomi gastroenterici quali vomito, anoressia, diarrea sanguinolenta o meno e perdita di peso. A volte si può verificare un’ostruzione intestinale o una peritonite causata dalla rottura del tumore. Alla visita clinica sono riscontrate masse intraddominali che possono essere costituite o dai linfonodi mesenterici o ileocolici ingrossati o da masse intestinali, possono anche essere apprezzate anse intestinali inspessite qualora il linfoma sia esteso a tutto l’intestino tenue. Nei soggetti con linfoma colon-rettale delle masse polipoidi linfomatose possono fuoriuscire dall’ano.[4, 9, 21]
Nella forma extralinfonodale i sintomi variano in base alla sede di localizzazione della massa e sono causati per lo più dalla azione compressiva che il tumore esercita sugli organi affetti. [8, 9]
Il linfoma extralinfonodale a localizzazione cutanea si suddivide in due forme, il linfoma non epiteliotropo e quello epiteliotropo.
Il linfoma non epiteliotropo può originare sia dai linfociti T che dai linfociti B e si riscontra per lo più in soggetti anziani. Si presenta di norma con noduli multipli duri nel derma o nel sottocute che possono essere alopecici o ulcerati. Tali neoformazioni si localizzano più frequentemente sul tronco, testa ed estremità, raramente si ritrovano sulla mucosa orale. Sono comuni i segni di interessamento sistemico. [8, 9]
Il linfoma epiteliotropo, detto anche “micosi fungoide”, origina dai linfociti T, anche questo si riscontra per lo più in soggetti anziani. Le lesioni possono comprendere placche e/o noduli singoli o multipli che variano da pochi millimetri a diversi centimetri di diametro. Possono essere presenti eritema, alopecia, desquamazione e prurito generalizzati oltre che depigmentazione e ulcerazione mucocutanee e/o stomatite ulcerativa. La patologia in genere è lentamente progressiva, nei casi cronici si può avere linfoadenopatia periferica e segni di interessamento sistemico. [8, 9]
Il linfoma extranodale a localizzazione oculare può essere associato alla forma multicentrica, determina un’ampia gamma di sintomi quali la fotofobia, il blefarospasmo, l’epifora, l’ifema, ipopion, masse oculari, infiltrazione della terza palpebra, uveite anteriore, coinvolgimento corioretinico e distacco della retina. [8, 9]
Il linfoma extranodale con localizzazione rinofaringea è molto raro nel cane, i sintomi comprendono starnuti, scolo nasale uni o bilaterale con
essudato muco purulento o schiettamente emorragico, respirazione difficoltosa, esoftalmo e deformazione facciale. [8, 9, 31]
Il linfoma extranodale a localizzazione renale è molto raro nel cane e i soggetti possono essere sottoposti a visita per sintomi generici, solitamente secondari a insufficienza renale cronica. Alla visita clinica si può riscontrare emaciazione ed anemia. [8, 9]
Il linfoma extranodale localizzato a livello del sistema nervoso centrale determina una sintomatologia nervosa variabile in base anche alla sede ed all’estensione della neoplasia. Clinicamente, nel cane, si può distinguere il linfoma solitario epidurale ed il linfoma del neuropilo detto anche “vero linfoma del sistema nervoso centrale” che può essere intracranico o intraspinale. Queste neoplasie possono essere sia primarie che secondarie a forme di linfoma multicentrico. I cani sottoposti a chemioterapia per una
forma multicentrica, apparentemente in regressione, possono
improvvisamente manifestare sintomi nervosi dovuti appunto allo sviluppo del tumore a livello del sistema nervoso. Ciò accade poiché i chemioterapici in uso non sono in grado di attraversare la barriera ematoencefalica , se somministrati a dosaggi standard, e quindi il sistema nervoso diventa un’area protetta per le cellule tumorali. [8, 9]
A volte i soggetti affetti da linfoma sono sottoposti a visita perché manifestano sintomi secondari a sindromi paraneoplastiche, causate da molecole prodotte dal tumore ed agenti a distanza. I sintomi che possono
essere paraneoplastici sono l’ipercalcemia, l’unica che nel cane ha una effettiva rilevanza clinica, le gammopatie mono o policlonali, le citopenie su base immunitaria, la polineuropatia e l’ipoglicemia. [4, 9, 21]
1.2 Caratteristiche ematologiche e biochimiche
In corso di linfoma si ritrovano varie alterazioni ematologiche e biochimiche non specifiche e che pertanto non sono sufficienti a fini diagnostici. Le anomalie ematologiche riscontrabili possono essere causate dall’infiltrazione tumorale del midollo osseo, dalla diminuita o aumentata funzionalità della milza, sempre a causa degli infiltrati tumorali, dalla cronicità della patologia o dalle modificazioni paraneoplastiche quali, per
esempio, anemia emolitica immunomediata o trombocitopenia
immunomediata che sono, tuttavia, poco frequenti. La monocitosi e la reazione leucemoide che si possono ritrovare in corso di linfoma sono causate dalla produzione locale o sistemica di sostanze bioattive da parte del tumore (fattori di crescita emopoietici, interleuchine). Le alterazioni ematologiche più comuni includono l’anemia, che solitamente è normocitica normocromica non rigenerativa tipica delle patologie croniche, ma che a volte può essere rigenerativa se c’è stata emolisi o perdita ematica, la leucocitosi, la neutrofilia (con o senza deviazione a sinistra), la monocitosi, la presenza in circolo di cellule linfoidi anormali,
trombocitopenia, forme di citopenia e reazioni leucoeritroblastiche. La linfocitosi è piuttosto rara e, se presente, è di modesta entità (<10000-12000/µL). [9, 41, 42]
Le anomalie biochimiche riscontrabili possono essere causate sia dalla sindrome paraneoplastica, determinata da sostanze bioattive prodotte dal tumore, sia da un’insufficienza d’organo secondaria all’infiltrazione neoplastica. Le alterazioni più comuni sono le gammopatie e l’ipercalcemia. Quest’ultima si riscontra nel 20-40% dei casi, è più tipica nei linfomi in forma mediastinica e in quelli di tipo cellulare T e pare che sia causata dalla produzione, da parte del tumore, di una proteina simile al paratormone. Un’altra alterazione paraneoplastica è l’iperproteinemia che è causata dalla produzione da parte delle cellule neoplastiche di una globulina monoclonale che può determinare una iperviscosità ematica, si possono riscontrare anche delle gammopatie policlonali. [9, 43]
1.3 Caratteristiche radiografiche ed ecografiche
Le alterazioni radiografiche nei soggetti affetti da linfoma variano in base alla localizzazione del tumore. I soggetti con linfoma in forma multicentrica presentano linfoadenopatia sternale e/o tracheobronchiale, infiltrati polmonari di tipo interstiziale, broncoalveolare o entrambi, raramente può essere presente versamento pleurico, linfoadenopatia
intraddominale a carico per esempio dei linfonodi mesenterici o iliaci,
epatomegalia, splenomegalia, renomegalia, presenza di masse
intraddominali. Occasionalmente è possibile evidenziare, nelle radiografie in bianco dell’addome o del torace, lesioni litiche o proliferative a carico delle ossa. Nei soggetti con linfoma di tipo mediastinico si può evidenziare una massa nel mediastino anteriore, più raramente nel posteriore, associata o meno a versamento pleurico. Nei cani colpiti da linfoma in forma alimentare le radiografie in bianco sono indicative in meno della metà dei soggetti. Le alterazioni eventualmente visibili sono epatomegalia, splenomegalia e masse endoaddominali. Le radiografie con contrasto positivo svelano invece modificazioni nella maggior parte dei casi. Si notano irregolarità della mucosa, difetti di riempimento del lume intestinale, ispessimenti irregolari della parete intestinale suggestivi di patologia infiltrativa. L’esame ecografico è indispensabile per valutare soggetti con sospetta o confermata patologia linfomatosa endoaddominale ed è importante anche per la stima delle masse mediastiniche. Modificazioni dell’ecogenicità di organi parenchimatosi quali, per esempio, il fegato, la milza ed i reni, spesso indicano modificazioni del parenchima secondarie a infiltrazione neoplastica. Con l’esame ecografico inoltre si evidenziano anche aumenti di volume delle strutture linfoidi o degli organi. Comunemente si riscontra epatomegalia, splenomegalia, alterazioni di ecogenicità a carico del fegato o della milza (ecogenicità mista o aree
multiple ipoecogene), ispessimento della parete intestinale, linfoadenopatia, masse spleniche e versamenti addominali. E’ inoltre possibile effettuare degli aspirati ad ago sottile o dei prelievi bioptici ecoguidati. [9]
1.4 Diagnosi
La diagnosi di linfoma deve essere sempre confermata da un esame citologico o istopatologico. Nei soggetti con linfoma in forma multicentrica, extranodale superficiale o alimentare la diagnosi può essere eseguita attraverso esame citologico di un campione prelevato per aspirazione ad ago sottile dagli organi o dai linfonodi interessati. Nel 10% dei cani è invece indispensabile sottoporre ad esame istologico un linfonodo o una massa escissa chirurgicamente per giungere a diagnosi. [9]
1.5 Classificazione citoistologica dei linfomi
Negli anni sono state proposte varie classificazioni. Una prima classificazione è quella di Rappaport che suddivide i linfomi in 5 tipi in base alle caratteristiche morfologiche delle cellule predominanti. Tale schema interpretativo risulta poco valido perché la maggior parte dei gruppi classificativi sono eterogenei dal punto di vista immunologico e
quindi tipi morfologicamente simili originano in realtà da cellule differenti per funzioni cioè cellule B e cellule T. La mancata classificazione della linea cellulare di origine determina dei problemi a livello prognostico e terapeutico considerando che i linfomi a cellule B sono molto più responsivi alla terapia e quindi con prognosi migliore rispetto ai linfomi a cellule T. Nelle classificazioni successive vengono quindi prese in considerazione non soltanto le caratteristiche strutturali e citologiche, ma anche quelle immunologiche. Una prima classificazione rispondente ai suddetti criteri è quella di Lukes-Collins che va a suddividere i linfomi in tipo cellulare U (Undefinited Cells, cellule cioè non assimilabili né alle cellule T né alle cellule B), in tipo cellulare B, in tipo cellulare T, in tipo istiocitico ed in tipo inclassificabile. Un’altra classificazione è quella di Kiel che suddivide i linfomi in base al grado di malignità individuando quindi linfomi a basso ed alto grado di malignità. Questa è stata poi aggiornata nella classificazione “Update Kiel”, attualmente quella più usata che, oltre al grado di malignità, considera anche il fenotipo, importante criterio classificativo che non può essere individuato solo attraverso l’esame cito-morfologico che solitamente tende a sovrastimare il linfoma a cellule B. Per identificare correttamente il fenotipo si ricorre quindi all’immunofenotipizzazione che può essere eseguita su striscio di sangue fresco o congelato, su blocchi in paraffina o su sospensioni di aspirato linfonodale/midollo in citofluorimetria. L’esame si basa sull’utilizzo di
anticorpi monoclonali specifici grazie ai quali è possibile classificare i linfomi in base alle cellule di origine. Gli anticorpi utilizzati nel cane sono quelli che riconoscono sulla superficie le molecole dei linfociti T (CD3, CD4, CD5, CD8), le molecole dei linfociti B (CD79a, CD21, immunoglobuline di superficie e citoplasmatiche) e l’antigene di proliferazione Ki67. Un linfoma T risulterà pertanto CD3+, CD79a-, CD21-, c Ig/s Ig- e potrà essere positivo per le altre molecole quali CD4, CD8, CD5. Un linfoma B sarà invece CD3-, CD4-, CD8-, CD79a+, CD21+, c Ig/s Ig +. Il Ki67 rappresenta l’antigene di proliferazione che indica se la cellula abbia intrapreso o meno il ciclo cellulare. [55]
1.6 Aspetti citologici dei principali tipi di linfoma
Linfocitico
Non è mai stato rilevato nel cane un linfoma linfocitico in senso stretto, ma solo invasioni linfonodali da parte di leucemia. Ciò spiega come mai la diagnosi spesso sia tardiva e contemporanea all’infiltrazione midollare ed all’invasione sanguigna delle cellule maligne. Il linfoma linfocitico si presenta come un tappeto di cellule omogenee, composto da piccoli linfociti, molto simili a quelli normali, caratterizzati da nucleo rotondo, cromatina addensata ed a zolle, nucleoli invisibili. Il citoplasma è poco
esteso, pallido o leggermente basofilo. Le mitosi sono eccezionali ed è pertanto a crescita lenta. [1, 11, 16, 17, 57]
Linfoplasmocitico
E’ detto anche “immunocitoma”, questo tipo di linfoma è caratterizzato dal fatto che una percentuale variabile di cellule presenta una differenziazione plasmocitica consistente in una eccentricità del nucleo, in una estensione del citoplasma nettamente basofilo e nella presenza in alcune cellule di un’area più chiara iuxta-nucleare (zona dell’apparato di Golgi). L’assenza di mitosi, di macrofagi fagocitanti nonché di centroblasti ed immunoblasti ne sottolineano il carattere linfomatoso e ne permettono la differenziazione nei confronti di una iperplasia plasmocitaria. [1, 11, 16, 17, 57]
Prolinfocitico
Secondo la classificazione di Kiel aggiornata può avere sia fenotipo B che T. Il linfoma prolinfocitico è caratterizzato da una predominanza di cellule di piccola taglia che hanno nuclei con cromatina densa e nettamente nucleolata, citoplasma a corona stretta. Hanno crescita lenta. [1, 11, 16, 17, 57]
Centrocitico
Questo tipo di linfoma è assai raro. Si identifica con la presenza di una popolazione cellulare, di numero variabile, caratterizzata da un nucleo di taglia leggermente superiore a quello dei linfociti normali che presenta una incisura più o meno profonda. La cromatina è sempre a zolle ma un po’ meno addensata rispetto ai linfociti normali. [1, 11, 16, 17, 57]
Centroblastico-centrocitico
Linfoma assai raro nel cane caratterizzato dalla presenza di cellule di taglia variabile, piccole e medie. Le cellule più piccole presentano le caratteristiche dei centrociti (da ricercare le incisure nucleari, a volte poco evidenti), mentre le cellule medie sono rappresentate da centroblasti le cui caratteristiche sono: cromatina fine, numerosi nucleoli addossati alla membrana nucleare, nucleo talvolta irregolare e citoplasma basofilo. La presenza di un miscuglio di centrociti e centroblasti può far pensare erroneamente ad una iperplasia follicolare, il carattere disperso dei centroblasti, l’assenza di plasmocitosi e di macrofagi fagocitanti nonché il ridotto indice mitotico ne confermano il carattere tumorale. [1, 11, 16, 17, 57]
A cellule medie macronucleolato
Questo tipo di linfoma è caratterizzato da una grande omogeneità di cellule tumorali di taglia variabile piccola-media (una volta e mezzo il volume di un’emazia). Il nucleo di tali cellule presenta cromatina decondensata e un voluminoso nucleolo centrale il cui contorno è sottolineato da un rinforzamento della cromatina. Il citoplasma è poco esteso, moderatamente basofilo (senza area chiara iuxta-nucleare). L’indice mitotico è ridotto e tali linfomi rispondono negativamente al marker di proliferazione Ki67. Sembra che le cellule tumorali di tale linfoma derivino dalla zona marginale del follicolo secondario del linfonodo. [1, 11, 16, 17, 57]
Centroblastico monomorfo
Questo tipo di linfoma è poco frequente ed è caratterizzato da una popolazione omogenea di cellule grandi (taglia superiore al volume di due emazie). Le cellule linfomatose presentano un nucleo rotondo, cromatina fine e numerosi nucleoli in posizione iuxta-nucleare, un citoplasma stretto di media basofilia. Grado di malignità elevato. [1, 11, 16, 17, 57]
Centroblastico polimorfo
La maggior parte dei linfomi del cane appartiene a questo gruppo che, come indica il nome, è costituito da più tipi cellulari. Sul preparato linfonodale si possono ritrovare infatti cellule di taglia media, rappresentate
dai centroblasti, in percentuale elevata, piccole cellule blastiche con nucleo rotondo, cromatina decondensata ed irregolarmente rinforzata, nucleoli multipli e prominenti, citoplasma stretto e iperbasofilo, anche queste sono presenti in percentuale assai elevata, cellule di taglia grande di tipo immunoblastico, mai superori al 20% e cellule medie macronucleolate della zona marginale presenti in minore percentuale. Sono frequenti i macrofagi fagocitanti che, per la loro particolare distribuzione in mezzo alle cellule linfomatose, assumono il cosiddetto aspetto “a cielo stellato”. L’indice mitotico è variabile: da medio a elevato. Questo tipo di linfoma proprio per il suo carattere eterogeneo può essere ulteriormente diviso in due sottogruppi: uno in cui predominano le piccole cellule (PSC ovvero “predominantly small cell”), l’altro in cui predominano le cellule più grandi (PLC ovvero ”predominantly large cell”). [1, 11, 16, 17, 57]
Immunoblastico
Linfoma poco frequente e talvolta difficile da distinguere dal precedente. Caratterizzato da una elevata percentuale di cellule di tipo immunoblastico (maggiori dell’80%) che presentano le seguenti caratteristiche: taglia molto grande, nucleo irregolare, volume nucleolare elevato, citoplasma abbondante. Talvolta si può ritrovare in stretta differenziazione plasmocitaria. L’indice mitotico è alto. Può avere fenotipo sia B che T
anche se nel cane quest’ultimo non è stato ancora descritto. [1, 11, 16, 17, 57]
Tipo Burkitt
Questo tipo di linfoma è caratterizzato da una proliferazione omogenea di cellule di piccola taglia con nucleo rotondo, cromatina irregolarmente rinforzata, nucleoli multipli o singoli prominenti, citoplasma ridotto e iperbasofilo. L’indice mitotico è elevato. [1, 11, 16, 17, 57]
Plasmocitoide
Secondo la classificazione di Kiel aggiornata questo tipo di linfoma può presentare entrambi i fenotipi e quindi può essere sia B che T. Caratterizzato da cellule di taglia piccola che assumono una differenziazione plasmocitaria grazie al loro citoplasma esteso e iperbasofilo. L’indice mitotico è elevato. [1, 11, 16, 17, 57]
Linfoblastico
Linfoma caratterizzato dalla proliferazione di cellule piccole-medie con nucleo irregolare, spesso convoluto, cromatina fine, decondensata, nucleoli discreti poco evidenti, citoplasma moderatamente esteso e basofilo, può essere unipolare. Indice mitotico elevato con numerose mitosi raggruppate.
Secondo la classificazione di Kiel aggiornata può avere entrambi i fenotipi. [1, 11, 16, 17, 57]
A piccole cellule chiare
Linfoma appartenente al gruppo T con basso grado di malignità in base alla Update Kiel Classification. Si caratterizza per la presenza di un contingente di piccole cellule tumorali presentanti le stesse atipie: citoplasma pallido ed esteso che talvolta può contenere fini granulazioni azzurrofile. [1, 11, 16, 17, 57]
Pleomorfi
Questi tipi di linfomi possono a loro volta essere suddivisi in tre gruppi: il primo caratterizzato da cellule di taglia piccola e da un indice mitotico basso, il secondo caratterizzato da un miscuglio di cellule di taglia piccola-media e facente parte dei linfomi con grado di malignità elevato, il terzo costituito da cellule di taglia grande e grado di malignità elevato. Presentano tutti un fenotipo T e sono caratterizzati dall’avere un nucleo irregolare, una cromatina fine e un citoplasma chiaro, scarsamente basofilo. [1, 11, 16, 17, 57]
Micosi fungoide
Linfoma T cutaneo primariamente epidermotropo che secondariamente può invadere anche i linfonodi loco regionali. La morfologia di questo linfoma è variabile, si possono infatti avere cellule con nucleo cerebriforme, cellule di aspetto monocitoide, entrambe con cromatina e citoplasma abbondante e chiaro ed infine grandi cellule granulose con citoplasma pallido contenente delle grosse granulazioni azzurrofile. Fanno parte dei linfomi T a basso grado di malignità della classificazione di Kiel aggiornata. [1, 11, 16, 17, 57]
Anaplastico
Contemplato nella prima classificazione di Kiel, manca invece nella forma aggiornata. Caratterizzato dalla presenza di cellule di taglia grande, nucleo molto irregolare, talvolta binucleato, citoplasma esteso e intensamente basofilo. Possono essere presenti anche cellule pseudo-Sternberg. [1, 11, 16, 17, 57]
1.7 Stadiazione del linfoma
Dopo aver emesso la diagnosi citologica si deve procedere alla stadiazione per ottenere la prognosi. Per stadiare il linfoma si utilizza un sistema messo a punto dall’Organizzazione Mondiale della Sanità derivante dal metodo
TNM (tumore, linfonodo, metastasi) per la valutazione delle neoplasie umane e che si basa sui rilievi clinici e clinicopatologici per determinare l’estensione della malattia e correlarla alla prognosi. In base a questo sistema si va a distinguere:
Stadio 1: coinvolgimento di un solo linfonodo
Stadio 2: coinvolgimento di più di un linfonodo, ma soltanto da una parte del diaframma (per esempio in posizione craniale o caudale rispetto al diaframma)
Stadio 3: coinvolgimento linfonodale generalizzato
Stadio 4: come nello stadio 3 con in aggiunta epatomegalia e/o splenomegalia
Stadio 5: qualunque degli stadi precedenti con in aggiunta interessamento del midollo osseo o coinvolgimento di strutture non linfonodali
Sotto stadio “a”: asintomatico Sotto stadio “b”: sintomatico
Lo stadio non ha tuttavia valenza prognostica infatti, per esempio, soggetti al primo stadio possono avere tempi di sopravvivenza analoghi a quelli al quarto stadio, molto importanti sono invece i sotto stadi e cioè se il paziente sia asintomatico o meno, gli asintomatici hanno infatti prognosi migliore rispetto ai sintomatici. [9]
1.8 Trattamento
I soggetti affetti da linfoma sottoposti a chemioterapia hanno una sopravvivenza di circa 12-16 mesi contro le 4-8 settimane dei soggetti non trattati [2, 6, 10]. Il protocollo chemioterapico è suddiviso in varie fasi:
Fase di induzione della remissione: in genere si utilizza il protocollo COAP cioè si va a somministrare ciclofosfamide, vincristina, citosina arabinoside e prednisone per 6-8 settimane durante le quali devono essere effettuati controlli settimanali. La remissione completa avviene di norma in 1-14 giorni dall’inizio della terapia e perdura per tutta la fase di induzione. [24]
Fase di intensificazione: se il soggetto, sottoposto alla fase di induzione, ha solo una remissione parziale si va a somministrare anche L-asparaginasi. Viene data per via intramuscolare da ripetere ogni 2-3 settimane e dovrebbe determinare la completa remissione del linfoma. [18, 25]
Fase di mantenimento: dopo aver ottenuto la remissione si passa quindi alla fase di mantenimento. Il protocollo impiegato è LMP e prevede la somministrazione per via orale di clorambucil, metotrexato e prednisone, le
visite vengono effettuate ogni 6-8 settimane. La remissione solitamente dura 3-6 mesi dopodiché si ha una recrudescenza della malattia. [23]
Fase della reinduzione: quando compare la recidiva si passa a tale fase. I protocolli previsti sono diversi, uno di questi è il D-Mac che prevede la somministrazione di desametazone, melfalan, citosina arabinoside e actinomicina D per 4-6 cicli. Qualora non si ottenga la remissione possono essere usati i protocolli ADIC (doxorubicina, dacarbazina) o il protocollo CHOP (ciclofosfamide, doxorubicina, vincristina, prednisone) [50]. Una volta ottenuta la remissione si passa di nuovo alla fase di mantenimento per poi ripassare alla reinduzione appena si verifica una nuova ricaduta. I protocolli sono sempre i suddetti solo con cicli più lunghi. In linea generale è possibile bloccare l’evoluzione del linfoma per due, tre volte dopodiché si sviluppa una farmaco resistenza della neoplasia e la prognosi diventa infausta. Nel caso in cui il linfoma sia localizzato o extranodale è possibile intervenire chirurgicamente e/o con radioterapia prima o in concomitanza alla chemioterapia. [3, 5, 44, 49]
CAPITOLO 2
LEUCEMIA
La leucemia è una neoplasia maligna che deriva dalla proliferazione clonale ed anormale di una cellula primitiva del midollo osseo. Tale proliferazione porta alla sostituzione delle cellule midollari normali da parte di quelle neoplastiche che, secondariamente, possono anche invadere il sangue periferico ed infiltrare altri organi emopoietici quali la milza, i linfonodi ed il fegato. Le leucemie sono classificate, in base alla linea cellulare coinvolta, in leucemie linfoidi e/o disordini linfoproliferativi e leucemie mieloidi e/o disordini mieloproliferativi. Queste a loro volta possono essere suddivise, in base all’evoluzione ed allo stadio di differenziazione, in leucemia acuta e leucemia cronica. La leucemia acuta è caratterizzata dalla proliferazione di cellule poco mature, dette “blasti”, ha evoluzione breve con morte rapida, in pochi giorni o settimane dalla diagnosi. La leucemia cronica è invece caratterizzata dalla proliferazione di cellule più mature, dette “citi”, ha evoluzione piuttosto lunga e la morte
può sopraggiungere dopo mesi dalla diagnosi. Ciascun tipo di leucemia viene classificato dettagliatamente tramite una classificazione umana, riadattata alle leucemie acute mieloidi dei carnivori domestici, che è la FAB (French, American, British) e che va a distinguere le leucemie in base a criteri morfologici, utili per l’identificazione della linea cellulare ed il grado di differenziazione, ed in base alla positività a particolari reazioni citochimiche caratteristiche per ciascuna linea. [7, 26, 29]
2.1 Leucemia linfoblastica acuta (LLA)
E’ una neoplasia caratterizzata dalla proliferazione clonale di progenitori linfoidi maligni nel midollo osseo. Tali cellule neoplastiche sono scarsamente differenziate e sono caratterizzate da linfoblasti e prolinfociti che possono passare nel circolo sanguigno periferico determinando leucocitosi (si parla di “fase leucemica”) oppure possono non ritrovarsi nel sangue ed essere associati a leucopenia (si parla di “fase aleucemica”). Ci può essere infiltrazione secondaria di organi quali milza, fegato e linfonodi ed in tale stadio risulta difficile distinguere la leucemia linfoblastica acuta da un linfoma di 5 stadio con leucemizzazione. In base alla classificazione FAB la leucemia linfoblastica acuta viene suddivisa in tre tipi a seconda delle caratteristiche morfologiche dei blasti che la compongono. Si individua quindi:
• LLA-L1: è una forma abbastanza rara nel cane ed è caratterizzata da cellule di piccola taglia con nucleo regolare, raramente indentato, cromatina omogenea, finemente decondensata e talvolta leggermente addensata, nucleoli poco visibili, discreti, citoplasma poco esteso, debolmente basofilo e contenente talvolta piccoli vacuoli. [26, 38]
• LLA-L2: è la forma più frequente nel cane ed è caratterizzata da cellule di taglia variabile, spesso grande, con nucleo a contorno irregolare, spesso indentato, cromatina eterogenea, fine o irregolarmente addensata, uno o più nucleoli voluminosi e ben visibili, citoplasma variabilmente esteso, marcatamente basofilo, contente talvolta piccoli vacuoli. [26, 38]
• LLA-L3: è detta anche “di Burkitt”, per ora non è mai stata descritta nei carnivori domestici. E’ caratterizzata da cellule di taglia grande, con nucleo a contorno regolare di forma rotonda o ovale, cromatina omogenea e finemente addensata, uno o più nucleoli ben visibili, citoplasma mediamente esteso ed intensamente basofilo, contenente spesso numerosi vacuoli. [26, 38]
Talvolta può risultare difficile differenziare le LLA dalle leucemie mieloidi acute e quindi, se la morfologia non è sufficiente, si può ricorrere a colorazioni citochimiche o all’immunofenotipizzazione. Altrettanto
complessa può risultare la differenziazione fra leucemia linfoblastica acuta e un linfoma leucemico poiché, in entrambe le patologie, la morfologia cellulare può essere la stessa, solitamente tuttavia le LLA presentano evoluzione rapida con infiltrazione preponderante del fegato e della milza prima dei linfonodi e la proliferazione midollare è massiva con rapida insufficienza ematopoietica. Per quanto concerne il fenotipo delle LLA nel cane possono essere di tipo B, T, natural killer o nullo. [26, 38]
La LLA ha evoluzione rapida e sono colpiti soggetti giovani ed animali di mezza età. I segni clinici possono essere:
• Letargia, anoressia, pallore, febbre o segni di infezione batterica
• Diatesi emorragica
• Segni neurologici: dati solo nel caso di invasione delle meningi e quindi comparirà apatia, aumento della pressione del liquido cefalo rachidiano, anormalità nervi craniali
• Splenomegalia ed a volte linfoadenomegalia. [26, 38]
La diagnosi viene effettuata con l’emogramma in cui si può riscontrare leucocitosi linfoblastica, riscontro di linfoblasti con conta WBC normale oppure, nella fase aleucemica, si può avere leucopenia. E’ essenziale
effettuare il prelievo del midollo osseo per avere una diagnosi certa, nella LLA si riscontrano linfoblasti. [26, 38]
La terapia è analoga a quella utilizzata per i linfomi (vedi capitolo 1, paragrafo 8). Le complicazioni possono essere infezioni, mancato recupero del midollo con aplasia, effetti collaterali dei chemioterapici, ricomparsa precoce della leucemia. Inoltre va posta particolare attenzione alla cosiddetta “sindrome da lisi acuta tumorale”. Questa è una condizione di collasso acuto che porta a morte il paziente subito dopo la somministrazione di un chemioterapico al quale il tumore da cui era affetto era sensibile. La chemioterapia determina la morte rapida di una grande quantità di tumore ed il rilascio di contenuti cellulari tossici. Il rapido rilascio di fosfati e di potassio intracellulari determina una grave ipocalcemia, iperkaliemia e ipofosfatemia. Entro 48 ore dal primo trattamento di un tumore che ha grande massa cellulare ed è fortemente chemiosensibile si può avere collasso cardiovascolare, vomito, diarrea e shock incipiente, inoltre può esservi neutropenia, disidratazione, sepsi e disturbi coagulativi. In caso di sindrome da lisi acuta tumorale si può avere insufficienza renale quindi va instaurata la fluidoterapia con cristalloidi e riduzione dei chemioterapici. [26, 38]
Nei cani affetti da LLA la risposta al trattamento ed il tempo di sopravvivenza sono molto minori che nei cani affetti da linfoma, il tasso di remissione con LLA è più breve di quelli con linfoma, mediamente 1-3
mesi, nonostante la chemioterapia. Il decorso è legato alla durata della remissione che è simile al linfoma eccetto che per i segni sul SNC. La prognosi è riservata nel caso di grave diminuzione di WBC, RBC e/o Ptl (gli RBC possono essere reintegrati con la trasfusione, mentre per WBC e Ptl si richiede 2-3 settimane di terapia antiblastica), nel grado di coinvolgimento ed insufficienza di organi sulla preesistenza di infezioni. [26, 38]
2.2 Leucemia linfocitica cronica (LLC)
La leucemia linfocitica cronica è caratterizzata dalla proliferazione maligna ed indipendente della cellula staminale linfoide la cui progenie manifesta una forte tendenza alla differenziazione intramidollare ed alla disseminazione nei tessuti e nel sangue. Le cellule sono morfologicamente simili ai piccoli linfociti normali e si presentano con un nucleo regolare, talvolta indentato, cromatina addensata a zolle, senza nucleoli evidenti ed un citoplasma poco esteso e chiaro. Tali cellule, infiltrando progressivamente il midollo, determinano nel tempo una soppressione delle altre linee emopoietiche con conseguenti citopenie periferiche moderate e, appunto, tardive. Nel cane il fenotipo prevalente è quello B e, nel 50% di casi, è presente una immunosecrezione monoclonale di IgM senza tuttavia la comparsa della sindrome da iperviscosità ematica. [26, 38]
La leucemia linfocitica cronica è molto rara, colpisce per lo più soggetti di età medio-alta ed è lentamente progressiva. I segni clinici sono:
• Spesso possono essere silenti o minimi e quindi si può ipotizzare solo dalla forte linfocitosi riscontrabile all’emogramma
• A volte si può riscontrare ipergammaglobulinemia monoclonale
• Splenomegalia e/o epatomegalia
• Lieve linfoadenomegalia
• Vomito saltuario, diarrea, dimagrimento, se vi è infiltrazione del tratto gastrointestinale
• In seguito compare anemia o neutropenia. [26, 38]
La diagnosi viene effettuata attraverso l’emogramma in cui si ritrovano valori di linfociti fino ad oltre 100X109/L. Essenziale effettuare un prelievo del midollo in cui si riscontrano piccoli linfociti in quantità maggiore al 30%. Nel caso della leucemia linfocitica cronica è importante fare una diagnosi differenziale con una linfocitosi fisiologica e transitoria o con una stimolazione antigenica cronica in cui, tuttavia, i valori dei linfociti arrivano solo a 10X109/L. [26, 38]
La terapia per la leucemia linfocitica cronica è instaurata per controllare e rallentare la malattia, al contrario di quanto accade nella LLA dove si tende a sopprimere quasi totalmente il clone neoplastico. Si suggerisce di iniziare
il trattamento quando si hanno valori dei WBC superiori a 75X109/L, anemia, granulocitopenia e trombocitopenia in atto. Il protocollo per tale forma leucemica prevede l’associazione di clorambucile (0,2 mg/mq os sid per 7 giorni o 14 giorni quindi 0,1 mg/mq) e prednisolone (30 mg/mq os sid per 7 giorni, quindi 20 mg/mq os sid per 7 giorni e poi 10 mg/mq os sid o a giorni alterni). A volte può essere impiegata, in alternativa, una dose singola di clorambucile (20 mg/mq os ogni 14 giorni) oppure può essere aggiunta vincristina (0,5-0,7 mg/mq ev ogni 7 giorni). La prognosi è buona e con la terapia la remissione si protrae per 2-3 anni. [26, 38]
2.3 Disordini linfoproliferativi con grandi linfociti granulari
(LGL)
E’ una forma particolare di leucemia linfocitica cronica ed è caratterizzata dalla presenza di grandi linfociti granulosi. Tali linfociti presentano una cromatina addensata ed un citoplasma esteso e chiaro contenente granulazioni color rosso porpora, generalmente localizzate. La taglia è più grande dei linfociti normali ed il rapporto nucleo/citoplasma è inferiore. Tali cellule originano nel midollo osseo dalle cellule staminali (CD34+) e costituiscono una piccola minoranza dei linfociti circolanti identificabili sia con le cellule “Natural Killer” che con i linfociti citotossici, una loro
proliferazione incontrollata determina pertanto questo peculiare tipo di LLC. In sostanza, al quadro tipico di una leucemia linfocitica, si associa la comparsa di un elevato numero di linfociti LGL. [26, 38]
2.4 Mieloma multiplo (MM)
Il mieloma multiplo è una proliferazione maligna di plasmacellule nel midollo osseo ed in altri tessuti emolinfopoietici. L’infiltrazione midollare da parte delle plasmacellule può avere un carattere focale o diffuso e tali cellule possono rappresentare il 5-90% della popolazione di cellule nucleate midollari. Generalmente quando questa percentuale supera il 30% la probabilità che si tratti di mieloma multiplo è più concreta anche se una plasmocitosi reattiva, altra patologia da porre in diagnosi differenziale, non può mai essere esclusa. Esistono infatti importanti plasmocitosi midollari associate a patologie non neoplastiche quali, per esempio, la Leishmaniosi o il Lupus Eritematoso Sistemico. Morfologicamente le plasmacellule neoplastiche si differenziano da quelle reattive per la presenza di un citoplasma molto più abbondante, basofilo, omogeneo senza area chiara perinucleare. Il citoplasma può apparire inoltre di colore violaceo nelle cosiddette “plasmacellule a fiamma” ed è dovuto alla secrezione di IgA oppure può essere granuloso o vacuolizzato. Il nucleo delle plasmacellule neoplastiche appare più immaturo, caratterizzato dalla presenza di una
cromatina fine, decondensata, contenente talvolta uno o più nucleoli, il nucleo può essere localizzato in posizione paracentrale e il rapporto nucleo/citoplasma è aumentato. Talvolta si possono riscontrare plasmacellule binucleate. Oltre a queste plasmacellule più o meno mature si possono ritrovare nel midollo anche cellule pre-plasmacellulari ed immunoblasti. Le plasmacellule neoplastiche possono inoltre mostrare segni di displasia ancora più marcati con presenza di forme giganti a nucleo irregolare o multiplo. Queste tuttavia possono però anche apparire totalmente differenziate e pertanto difficili da distinguere da quelle normali, in questo caso sarà necessario valutare l’anormale omogeneità della popolazione plasmacellulare, simile nell’aspetto, taglia e grado di differenziazione. [26, 38]
Sono colpiti soggetti di età adulta in media di otto anni e tale neoplasia rappresenta circa l’8% dei tumori ematopoietici. Il mieloma multiplo determina una secrezione monoclonale di immunoglobuline di classe IgA o IgG che sono identificabili solo tramite immunoelettroforesi, raramente può produrre proteine biclonali o componenti immunoglobuliniche cioè catene pesanti o leggere, può essere presente la “proteinuria di Bence-Jones” cioè vi può essere escrezione urinaria di catene leggere immunoglobuliniche. I segni clinici sono appunto per lo più causati dalla iperviscosità del sangue e dalla mieloftisi midollare e si hanno pertanto:
• Segni neurologici: debolezza, paresi transitoria per mielopatia periferica, nistagmo, depressione e coma per infiltrazione plasmocitaria o emorragie del SNC
• Diatesi emorragia: per esempio si può riscontrare epistassi, la diatesi emorragia è causata dal fatto che le Ig interferiscono sull’attività delle Ptl, dei fattori della coagulazione e chelano il calcio
• Ipercalcemia da liberazione di sostanze PTH-simili ad attività osteoclastica con dolore osseo, riluttanza al movimento e fratture patologiche con zoppia
• Anemia da mieloftisi o da aumentata distruzione degli RBC che sono ricoperti da Ig e visibili sul vetrino come aggregati
• Disturbi oculari con vasi retinici tortuosi e dilatati, emorragie retiniche, papilledema e distacco retinico
• Nefropatia per proteinuria di Bence-Jones, infiltrazione
plasmocitaria, ipercalcemia e amiloidosi
• Cardiopatia per eccessivo sovraccarico cardiaco determinato dall’iperviscosità
• Segni d’infezione per alterata produzione di Ig. [26, 38]
La diagnosi viene effettuata con: emogramma e profilo biochimico in cui si riscontra anemia non rigenerativa, grave iperprotidemia, azotemia e
ipercalcemia, esame delle urine in cui si trova proteinuria, talvolta di tipo Bence Jones. Questa si manifesta a circa 60° e sparisce con l’ebollizione. Va effettuata anche una elettroforesi urinaria. All’esame radiografico sono riscontrabili lesioni litiche alle vertebre, pelvi, scapola e ossa lunghe, nel midollo osseo si riscontra infiltrazione plasmacellulare, con la sieroelettroforesi si nota la presenza di un picco monoclonale da caratterizzare con l’immunoelettroforesi, da differenziare da quello benigno e da malattie infettive come l’Ehrlichiosi. [26, 38]
La terapia viene effettuata somministrando melfalan (0,1 mg/kg os sid per 10 giorni, quindi 0,05 mg/kg os sid continuamente) associato a prednisolone (1 mg/7kg per 7-10 giorni quindi 0,5 mg/kg per 7-10 giorni e poi a giorni alterni). In alternativa possono essere impiegati la ciclofosfamide o il clorambucile a dosaggi standard, talora può essere utile somministrare melfalan in dosaggio elevato come 7 mg/kg per 5 giorni consecutivi ogni 3 settimane. Per ridurre la sindrome da iperviscosità può essere effettuata la plasmaferesi che consiste in un prelievo di sangue reso incoagulabile, allontanamento del plasma e restituzione al paziente dei globuli rossi. La prognosi in genere è buona con una vita media di circa due anni, ma è in relazione ai danni prodotti dall’iperproduzione di immunoglobuline. [26, 38]
2.5 Leucemia mieloide acuta (LAM)
E’ un disordine mieloproliferativo neoplastico a carico della cellula staminale ematopoietica che controlla la produzione delle linee eritroidi, granulocitiche, monocitiche e megacariocitiche. Si tratta di una patologia maligna caratterizzata dalla presenza di un numero di blasti mieloidi maggiori del 30% delle cellule nucleate totali midollari, dette CNT. Le leucemie mieloidi sono classificate con la classificazione FAB e, nel complesso, sono stati distinti sette tipi di leucemie alle quali, tuttavia, devono esserne aggiunte altre due che sono la leucemia acuta mieloide senza maturazione, detta LAM 0 o MO e la leucemia acuta indifferenziata detta LAI. Per quanto riguarda la leucemia mieloide senza maturazione nel midollo sono rinvenuti solo mieloblasti e quelli perossidasi positivi risultano inferiori al 3%. L’origine granulocitica però può essere dimostrata solo tramite microscopia elettronica, reazioni citochimiche in cui risultano positivi alla mieloperossidasi ed infine tramite l’immunofenotipizzazione. La leucemia acuta indifferenziata o LAI è caratterizzata dalla presenza di blasti indifferenziati che hanno sostituito le cellule del midollo osseo e che risultano negativi a tutte le colorazioni citochimiche ed a tutti i marker immunologici. I blasti della LAI sono caratterizzati dalla presenza di un piccolo citoplasma con pseudopodi e/o granulazioni color magenta.
Attualmente, con l’avvento di nuovi marker immunologici in ambito veterinario, sta sempre più diminuendo la difficoltà classificativa. [26, 38] Le restanti leucemie mieloidi acute, classificate mediante FAB sono:
• LAM 1: “leucemia acuta mieloblastica con minima maturazione”. Il mielogramma è caratterizzato dalla presenza soprattutto di blasti di tipo I (cellule medio-grandi con elevato rapporto nucleo/citoplasma, superiore a 1,5, contorno nucleare regolare e liscio, cromatina fine, nucleoli singoli o multipli ma sempre evidenti, citoplasma esteso moderatamente basofilo e senza granulazioni) e da alcuni blasti di II tipo (simili ai precedenti ma contenenti nel citoplasma piccole e fini granulazioni color magenta in numero inferiore a 15). Tali blasti rappresentano più del 90% delle cellule nucleate non eritroidi
determinate dalla sottrazione delle cellule eritroidi dal
compartimento delle CNT. Affinchè possano essere classificati come appartenenti alla linea granulocitica almeno il 3% di tali cellule deve risultare positiva alla perossidasi o al Sudan black B. Le cellule granulocitiche restanti e comprendenti tutti gli stadi dal promielocita al granulocita maturo non superano il 10%, le cellule eritroidi sono rare e spesso sono presenti megaloblasti. [26, 38]
• LAM 2: ”leucemia acuta mieloide con maturazione”. I blasti di tipo I e II rappresentano più del 30% delle CNT e dal 30 al 90% delle cellule nucleate non eritroidi. Le cellule granulocitiche restanti
comprendono una maggioranza di promielociti rispetto ai metamielociti o ai granulociti maturi. Il compartimento monocitico risulta < del 20% delle cellule non eritroidi. La maggior parte delle cellule risulta fortemente positiva alla mieloperossidasi (MPO) e negativa all’esterasi non specifica (NSE). [26, 38]
• LAM 3: “leucemia acuta mieloide promielocitica”. E’ stata descritta nell’uomo ma non ancora nei carnivori domestici, è caratterizzata dalla presenza di promielociti anormali con nucleo indentato, reniforme o bilobato, contenente grosse granulazioni porpora e forme bastoncellari dette di Auer. [26, 38]
• LAM 4: “leucemia acuta mielo-monocitica”. E’ la più frequente nel cane, è caratterizzata dalla presenza, nel mielogramma, di una doppia popolazione di blasti superiore sempre al 30% delle CNT e di quelle eritroidi e di aspetto sia mieloblastico che monoblastico. La componente granulocitica e monocitica ben differenziata rappresenta ciascuna più del 20% delle cellule nucleate non eritroidi. I monoblasti appaiono simili ai mieloblasti dai quali si differenziano solo per la forma del nucleo che può essere rotondo o convoluto, per il citoplasma che presenta spesso un’area chiara perinucleare e per il rapporto nucleo/citoplasma che pur essendo elevato risulta sempre inferiore a quello dei mieloblasti. L’emogramma è caratterizzato dalla presenza di una doppia popolazione granulocitica e monocitica
ugualmente importante. Per l’identificazione di alcune forme poco differenziate è necessario l’uso di colorazioni citochimiche e si deve avere almeno il 20% di precursori midollari positivi all’esterasi non specifica. [26, 38]
• LAM 5: “leucemia acuta monocitica”, rara nel cane. E’ caratterizzata dalla proliferazione nel midollo osseo di una popolazione cellulare di aspetto monocitico, più o meno differenziata, comprendente monoblasti e monociti. Tali cellule rappresentano più dell’80% delle cellule non eritroidi ed i monoblasti superano il 30% delle cellule totali nucleate. A sua volta la LAM 5 può essere differenziata in due sottotipi:
• LAM5a: i monoblasti ed i promonociti superano l’80% delle cellule non eritroidi. [26, 38]
• LAM 5b: monoblasti e promonociti sono superiori al 30% ma inferiori all’80% delle cellule non eritroidi. I granulociti rappresentano meno del 20% delle cellule non eritroidi. I monociti, anche se apparentemente possono sembrare ben differenziati, presentano spesso numerose anomalie morfologiche: taglia grande, atipie nucleari, citoplasma iperbasofilo contenente a volte granulazioni azzurrofile. Se per l’identificazione delle cellule neoplastiche si utilizzano colorazioni citochimiche queste risultano positive all’esterasi non specifica inibita dal fluoruro di sodio, la
mieloperossidasi può essere negativa o debolmente positiva. L’emogramma può essere caratterizzato da una monocitosi significativa. [26, 38]
• LAM 6: “eritroleucemia”: è caratterizzata dalla presenza di una popolazione eritroide superiore al 50% delle CNT, mentre i blasti non eritroidi (mieloblasti, monoblasti, megacarioblasti) risultano superiori al 30% delle cellule non eritroidi. Il rapporto M/E è minore di 1. Esiste una variante, la LAM6 Er, in cui il rapporto M/E è minore di 1, le cellule eritroidi superano il 50% delle CNT mentre i blasti non eritroidi associati ai rubriblasti superano il 30% delle CNT. I rubriblasti presentano un citoplasma intensamente basofilo senza granulazioni ed un nucleo rotondo con cromatina finemente addensata ed uno o più nucleoli distinti. Nei casi in cui il contingente non eritroide rappresenta meno del 30% dei blasti non si può parlare di leucemia bensì di sindrome mielodisplastica. Attualmente non si conoscono marker citochimici specifici per i precusori eritroidi.
L’emogramma è caratterizzato da un’anemia refrattaria,
paradossalmente associata ad una eritroblastosi sanguigna molto imponente in cui gli eritroblasti possono apparire atipici. [26, 38]
• LAM 7: “leucemia megacarioblastica”. E’ caratterizzata dalla proliferazione nel midollo osseo di megacarioblasti che superano il 30% delle cellule non eritroidi e di megacariociti immaturi. Tale
proliferazione può verificarsi anche in organi ematopoietici quali la milza. Sembra rara nel cane ed il segno clinico più importante è la tendenza al sanguinamento, può essere associata a mielofibrosi. L’esame del midollo osseo mette in evidenza blasti di taglia variabile, indifferenziati, simili a blasti linfoidi dai quali si distinguono per la presenza di un nucleo denso, di vacuoli e protrusioni citoplasmatiche. Associati a questi si possono trovare anche megacariociti atipici multinucleati e micromegacariociti. La messa in evidenza di protrusioni citoplasmatiche e la formazione di piastrine aiutano nel riconoscimento della linea cellulare. Per distinguere le forme indifferenziate si possono utilizzare colorazioni immunocitochimiche per il fattore VII e l’acetilcolinesterasi o per la glicoproteina specifica delle piastrine GP IIb IIIa. L’emogramma è caratterizzato spesso dal riscontro di una trombocitopenia grave con presenza in circolo di piastrine anormali, di taglia gigante (macropiastrine) ipo od ipergranulose, malfunzionanti e responsabili della diatesi emorragica. I micromegacariociti possono passare anche nel circolo periferico sanguigno. Spesso si riscontra una anemia non rigenerativa e una leucopenia associate alla presenza di blasti indifferenziati circolanti, simili a quelli midollari ma di piccola taglia. Sono state descritte sindromi di eritrofagocitosi e trombocitiche associate a questo tipo di leucemia. [26, 38]
Nella leucemia mieloide acuta non vi è alcuna predilezione per sesso, razza ed età, i segni clinici sono aspecifici e possono comparire
• Anoressia, letargia, dimagrimento e febbre
• Pallore
• Splenomegalia, epatomegalia, talvolta linfoadenomegalia
• Anemia marcata mieloftisica (sostitutiva) da parte della
proliferazione mieloide che interferisce con la produzione eritrocitaria
• Trombocitosi presente negli stadi terminali
• Ematopoiesi extramidollare nei linfonodi, milza e fegato
• Rapide alterazioni degenerative nei WBC dei campioni di sangue prelevati, con allargamento e vacuolizzazione del citoplasma e coartazione e picnosi nucleare. [26, 38]
La terapia dà risultati normalmente insoddisfacenti. La risposta alla terapia non è buona e la remissione prolungata è rara. L’insuccesso del trattamento normalmente deriva dall’incapacità di indurre la remissione o di mantenerla, dalla presenza o dallo sviluppo di insufficienze di organi derivata dall’infiltrazione di cellule leucemiche (questo non permette di
usare combinazioni chemioterapiche aggressive perché aumenta la tossicità) ed infine dallo sviluppo di sepsi e/o sanguinamenti fatali causati sia dal trattamento, che induce gravi citopenie, o già preesistenti legati alla neoplasia. Una remissione prolungata nei cani affetti da LMA trattati con la chemioterapia è estremamente rara. La terapia prevede l’uso di citosina arabinoside (5-10 mg/mq SC per due tre settimane poi a settimane alterne) oppure di una combinazione con citosina arabinoside 100 mg/mq SC o IV al dì per 2-6 giorni, 6-tioguanina 50 mg/mq PO sid o a giorni alterni e doxorubicina 10 mg/mq una volta alla settimana. Infine è possibile questa ulteriore combinazione con citosina arabinoside 100-200 mg/mq IV lenta per 4 ore una volta ogni 3 settimane e mitoxantrone 4-6 mg/mq IV lenta per 4 ore, da ripetere ogni tre settimane. Nella maggior parte dei cani la remissione è osservata raramente in risposta a qualcuno dei protocolli descritti. Se l’animale risponde la remissione è di breve durata e raramente la sopravvivenza supera i tre mesi, inoltre più della metà dei cani muore per una grave sepsi o emorragie. Il trattamento di supporto in questi animali richiede agenti chemioterapici, terapie con componenti ematiche, terapia intensiva e monitoraggio. I cani non trattati vivono meno di due settimane. [26, 38]
2.6 Leucemia mieloide cronica (LMC)
E’ una proliferazione clonale di una cellula mieloide pluripotente che
determina una mieloproliferazione di cellule prevalentemente
granulocitarie che hanno raggiunto la loro maturazione. Le leucemie mieloidi croniche sono caratterizzate da un aumento graduale del numero di cellule emopoietiche differenziate che determina leucocitosi, eritrocitosi o trombocitosi significativa. Il motivo per cui una linea cellulare prevale rispetto alle altre resta ancora sconosciuto, si pensa che il meccanismo eziopatogenetico coinvolga un ritardo nella maturazione cellulare che determina un aumento della massa mieloide. La LMC interessa soprattutto la linea neutrofilia anche se nel cane è stata anche descritta una LMC basofilica. L’esame del midollo osseo non è patognomonico e mette in evidenza un campione ricco di elementi cellulari dovuto ad una iperplasia mieloide che rispetta però la piramide di maturazione. Il rapporto mieloide/eritroide risulta notevolmente aumentato, circa 23/1. Ci può essere o meno ipoplasia megacariocitica e/o eritroide. I mieloblasti non superano mai il 30% delle CNT e possono esserci segni di displasia a carico di una o più linee cellulari. I precursori granulocitici neutrofili possono presentarsi ipersegmentati, negli stadi finali può anche comparire fibrosi midollare. [26, 38]
E’ una patologia rara ed è più frequente nei cani di età avanzata. Il decorso è lento e subdolo, i segni clinici sono vaghi:
• Anoressia, perdita di peso ed anemia
• Quasi sempre si riscontra splenomegalia associata o meno ad epatomegalia causate dall’infiltrazione da parte delle cellule neoplastiche, ci può essere coinvolgimento anche dei linfonodi. [26, 38]
La sopravvivenza varia da pochi giorni a 4,5 anni. Nel cane la leucemia mieloide cronica si può trasformare in una forma acuta, la cosiddetta ”crisi blastica” in cui si ha una diminuzione della maturazione dei granulociti e una predominanza di blasti nel circolo periferico e nel midollo osseo, la morte può essere la conseguenza delle infiltrazioni di organo e delle conseguenti anomalie funzionali oppure può essere secondaria ad emorragie o infezioni durante la fase terminale. [26, 38]
Nella leucemia mieloide cronica l’emogramma è caratterizzato da una leucocitosi importante, superiore generalmente a 100000/µL con più del 90% di cellule identificabili come mieloidi ed a predominanza granulociti segmentati, anche se possono essere presenti forme immature, i mieloblasti e i promielociti però non possono superare il 7% delle cellule leucocitarie contate nella formula, se predominano i monociti si parla di leucemia
cronica monocitica. Sempre all’emogramma è possibile riscontrare un’anemia moderata con presenza di eritroblasti in circolo oppure una trombocitosi con un numero di piastrine che può essere superiore a 500.000/µL. La diagnosi differenziale deve essere fatta con una neutrofilia da infezione da piogeni, forme neoplastiche non mieloproliferative e malattie immunomediate. [26, 38]
La terapia per la leucemia granulocitaria neutrofila prevede la somministrazione di idrossiurea: 20-25 mg/kg ovvero 0,5 mg/mq os bid per 6 settimane, con valori di WBC prossimi a 10X109/L dimezzare la dose o alternare 7 giorni di terapia a 7 giorni di sospensione. [26, 38]
2.7 Trombocitemia essenziale
E’ una sindrome mieloproliferativa cronica caratterizzata da una proliferazione midollare persistente e marcata di megacariociti, responsabili delle anomalie piastriniche qualitative e quantitative (conta delle Ptl che supera 1000000/µL). Il mielogramma mette in evidenza un midollo osseo ipercellulare caratterizzato da una proliferazione importante della serie megacariocitica con presenza di megacarioblasti sempre minori del 30% delle cellule nucleate totali. I megacariociti possono mostrare segni di displasia ed apparire di taglia grande o gigante mentre nel circolo
sanguigno periferico si possono riscontrare piastrine atipiche o di dimensioni giganti. [26, 38]
E’ una patologia rara e si manifesta con:
• Splenomegalia
• Tendenza all’emorragia. [26, 38]
All’emogramma si riscontra una trombocitosi persistente ed estrema associata ad una leucocitosi (<50000/µL) ed una anemia microcitica ipocromica non rigenerativa dovuta ai frequenti e prolungati sanguinamenti. La diagnosi differenziale deve essere posta nei confronti delle trombocitosi che accompagnano le sindromi infiammatorie, la carenza di ferro, l’anemia emorragica grave, la risposta esuberante ad una trombocitopenia, la splenectomia o altri disordini mieloproliferativi. [26, 38]
CAPITOLO 3
LE ALTERAZIONI EMATOLOGICHE
3.1 Anemia
L’anemia è un disordine in cui il conteggio degli RBC, il valore dell’ematocrito e/o dell’emoglobina sono diminuiti rispetto ai valori di riferimento. Di questi tre parametri quello che fornisce una rapida indicazione sulla gravità del processo morboso è l’ematocrito e si definisce un’anemia “leggera” quando l’ematocrito è compreso fra 30-37, “moderata” quando l’ematocrito è compreso fra 20-29, “grave” quando l’ematocrito è compreso fra 13 a 20 e ”gravissima” quando l’ematocrito è inferiore a 13. [34, 63]
L’anemia è classificata in base a due parametri, gli indici eritrocitari e il comportamento della risposta eritropoietica. La classificazione in base agli indici corpuscolari prende in considerazione l’MCV (volume corpuscolare
medio) e l’MCHC (concentrazione emoglobinica corpuscolare media) e si può avere:
• Anemia macrocitica normocromica: in tal caso l’MCV risulta aumentato e l’MCHC normale, è un’anemia che può essere causata da carenza di acido folico o vitamina B12, neoplasia o displasia degli RBC ed a volte è osservata in alcuni stadi delle anemie rigenerative. [34, 63]
• Anemia macrocitica ipocromica: in tal caso l’MCV è aumentato e l’MCHC diminuito, è indicativa di una anemia rigenerativa. [34, 63]
• Anemia normocitica ipercromica: in tal caso l’MCV è normale e l’MCHC aumentato. E’ una condizione rara visto che la concentrazione di emoglobina degli eritrociti maturi è molto prossima al punto di saturazione al di sopra del quale si formano cristalli. Questo tipo di anemia può essere causato da emoglobinemia per emolisi intravasale o in vitro, misurazione erroneamente bassa del valore Hct o misurazione della concentrazione di emoglobina erroneamente troppo alta per lipemia, leucocitosi, presenza di corpi di Howell-Jolly ed errori di laboratorio. [34, 63]
• Anemia normocitica normocromica: in tal caso sia l’MCV che l’MCHC sono normali. Tale tipo di anemia si può osservare nell’anemia non rigenerativa, per esempio causata da soppressione dell’eritropoiesi, nell’anemia rigenerativa iperacuta dove non vi è
stato il tempo sufficiente affinchè i giovani eritrociti fossero rilasciati nel sangue periferico per elevare l’MCV e abbassare l’MCHC e nelle anemie rigenerative troppo leggere per rilasciare un numero sufficiente di giovani eritrociti nel sangue. [34, 63]
• Anemia normocitica ipocromica: in tal caso l’MCV è normale mentre l’MCHC risulta diminuito. Può essere causata da una deficienza iniziale o leggera di ferro, rame o vitamina B6 e può comparire in alcuni stadi o situazioni con anemia rigenerativa. In questi casi la concentrazione di emoglobina può essere sufficientemente diminuita perché l’indice MCHC sia basso, ma non per influenzare l’MCV. Se la concentrazione di emoglobina continuerà a decrescere un numero sufficiente di eritrociti in grado di proliferare andranno incontro ad ulteriori divisioni diventando sempre più piccoli e si svilupperà il quadro tipico dell’anemia microcitica ipocromica. [34, 63]
• Anemia microcitica ipercromica: in tal caso l’MCV è diminuito e l’MCHC è innalzato. L’anemia emolitica immunomediata iperacuta con marcata sferocitosi può essere microcitica prima che si sviluppi un’iperplasia eritropoietica. L’ipercromasia si verifica per un basso valore di Hct in paragone ad un elevato valore di Hgb e tiene conto dell’emoglobina contenuta sia negli RBC che nel plasma. [34, 63]