45
CAPITOLO 4
4 Idrogenazione del catecolo a 1,2-cicloesandiolo
4.1 1,2-cicloesandiolo (1,2-CED)
Figura 1: 1,2-cicloesandiolo
L’1,2-cicloesandiolo (C6H12O2, PM=116 g\mol) è un composto cristallino bianco, molto solubile in acqua, che presenta un punto di fusione tra 100 e 104°C (il ∆T di fusione è dovuto al fatto che tale molecola può avere due stereoisomeri, cis e trans). Questa molecola può essere annoverata nella categoria dei fine chemicals, cioè prodotti ad alto valore aggiunto; le sue applicazioni sono molteplici: può essere infatti impiegato come elasticizzante, agente colorante, ritardante di fiamma ed anche come additivo in cosmetica. Negli ultimi tempi l’interesse verso l’1,2-cicloesandiolo sta aumentando moltissimo in quanto, come si è visto nel capitolo 2, molti studi si concentrano sul suo utilizzo come intermedio per processi di produzione dell’acido adipico a basso impatto ambientale.
4.1.1 Sintesi dell’1,2-cicloesandiolo via ossidazione del cicloesene
Il processo più utilizzato per la produzione dell’1,2-CED è l’ossidazione del cicloesene con perossiacidi organici come agenti ossidanti[1] (figura 2), formati in situ dagli acidi corrispondenti, (in genere acido formico o acetico), e perossido di idrogeno.
Figura 2:ossidazione del cicloesene a 1,2-CED con perossiacidi.
Gli stadi di reazione previsti per questo processo sono due: il primo consiste nell’ossidazione dell’olefina all’epossido corrispondente ed il secondo è la successiva idrolizzazione di
46
quest’ultimo a 1,2-CED, che avviene grazie all’acidità del mezzo di reazione. Entrambi gli stadi di reazione sono fortemente esotermici, il che implica una problematica sul controllo della temperatura: infatti, per mantenere la miscela di reazione tra i 40 e i 45°C, è necessario lavorare con un forte eccesso di solvente aggiungendo il cicloesene molto lentamente, ed impiegando sistemi di raffreddamento esterni[2]. Un ulteriore inconveniente di questo processo sta nell’impossibilità di un recupero diretto dell’1,2-CED dalla miscela dei prodotti tramite distillazione: è infatti prima indispensabile distruggere l’eccesso di perossidi ancora presente con sodio bisolfito, NaHSO3, ed al termine di tale stadio è necessario un work-up molto laborioso consistente di numerosi stadi: neutralizzazione della miscela di reazione con NaOH, successiva estrazione del prodotto con quantità ingenti di etilacetato ed infine una serie di concentrazioni e filtrazioni delle acque madri per recuperare la maggior quantità di prodotto possibile. La resa di 1,2-cicloesandiolo per questo tipo di processo varia tra il 65 e il 73 %. I processi più recenti si basano invece sull’utilizzo del perossido di idrogeno diluito (30-35 % v\v) come agente ossidante, in presenza di catalizzatori come l’acido tungstico, coordinato a leganti organici, o il tetrossido di osmio[3], in presenza di N-metilmorfolina: lo svantaggio intrinseco di questi processi consiste nell’elevato costo e nella notevole tossicità dei catalizzatori.
I metodi di sintesi dell’1,2-cicloesandiolo appena descritti sono validi, con alcune modifiche, per i dioli vicinali in generale, per cui, data l’importanza di questi prodotti, nel corso degli anni sono stati molti i tentativi di innovare e migliorarne il processo di produzione, con l’obiettivo di aggirare le problematiche dei processi già esistenti sia intervenendo sulle apparecchiature, sia sviluppando nuove tecniche di sintesi o impiegando nuovi catalizzatori. Gli studi di ricerca di nuove apparecchiature per attenuare le problematiche processuali sono rivolti verso l’utilizzo di microreattori in serie[2], che consentono un miglior controllo della temperatura grazie alle dimensioni limitate delle tubature ed ai tempi di contatto dei reagenti molto brevi: in queste condizioni è inoltre possibile lavorare con concentrazioni di reagente più elevate, quindi con minor consumo di solvente, anche se il work-up del prodotto rimane comunque elaborato e, seppure condotto con apparecchiature che lavorano in continuo, porta all’ottenimento di rese in prodotto moderate.
Lo studio dell’ottimizzazione della reazione di ossidazione del cicloesene passa anche per la ricerca di condizioni di reazione diverse, sia al fine di evitare gli acidi organici come solventi, sia per ottenere il prodotto per estrazione diretta dalla miscela dei prodotti, evitando, nel primo caso, le problematiche di sicurezza ed i costi di impianto dovuti alla presenza di
47
solventi corrosivi e, nel secondo, un work-up laborioso che aumenta il costo del prodotto e ne diminuisce le rese. Una possibile via di sintesi, che attutisce entrambe le problematiche appena descritte, è stata individuata nella tecnica di reazione bifasica[4], che si basa sulla differente solubilità in acqua del diolo rispetto al substrato di partenza. L’olefina viene disciolta nel solvente organico, dove è più solubile, insieme al catalizzatore, sali di N, P, As o Sb, con struttura simile all’ammonio e il fosfonio, ma con lunghe catene alifatiche come sostituenti al posto dell’idrogeno, mentre la fase acquosa è una miscela diluita di perossido di idrogeno. Una volta che le due fasi immiscibili vengono messe in contatto, tramite agitazione, a temperatura di 70°C e pressione atmosferica, la reazione di ossidazione avviene all’interfaccia tra il solvente organico e la fase acquosa dove, una volta finito il processo, rimane l’1,2-cicloesandiolo a causa della sua maggior solubilità nel solvente polare. Operando in questo modo, al termine della reazione, è possibile recuperare il prodotto direttamente dalla fase acquosa effettuando soltanto il trattamento di distruzione del perossido in eccesso tramite aggiunta di sodio bisolfito, NaHSO3, e le rese ottenute sono del 92 %.
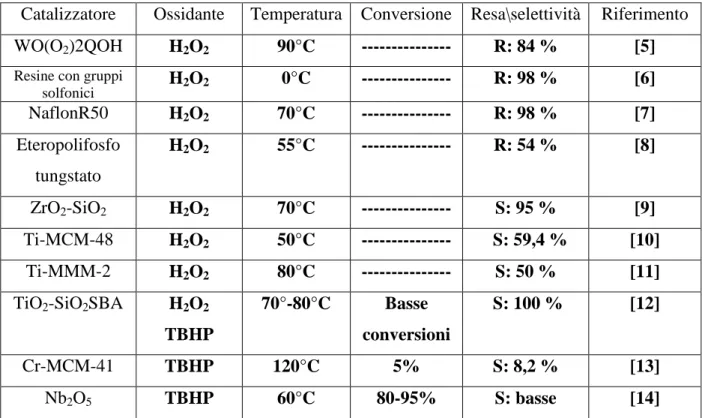
Molti altri studi si concentrano, invece, sulla ricerca di catalizzatori, sia omogenei che eterogenei, facilmente recuperabili, riciclabili ed in grado di garantire buone rese e selettività, che siano efficienti per far avvenire la reazione usando come agenti ossidanti perossido di idrogeno, H2O2, o t-butil-idroperossido, THBP. In tabella 1 sono elencati alcuni esempi riportati in letteratura.
Catalizzatore Ossidante Temperatura Conversione Resa\selettività Riferimento
WO(O2)2QOH H2O2 90°C --- R: 84 % [5]
Resine con gruppi
solfonici H2O2 0°C --- R: 98 % [6] NaflonR50 H2O2 70°C --- R: 98 % [7] Eteropolifosfo tungstato H2O2 55°C --- R: 54 % [8] ZrO2-SiO2 H2O2 70°C --- S: 95 % [9] Ti-MCM-48 H2O2 50°C --- S: 59,4 % [10] Ti-MMM-2 H2O2 80°C --- S: 50 % [11]
TiO2-SiO2SBA H2O2
TBHP 70°-80°C Basse conversioni S: 100 % [12] Cr-MCM-41 TBHP 120°C 5% S: 8,2 % [13] Nb2O5 TBHP 60°C 80-95% S: basse [14]
48
Tutti i processi di ossidazione del cicloesene, sopra descritti, presentano notevoli svantaggi: come il costo elevato del perossido di idrogeno, i problemi di sicurezza legati all’uso di questo agente ossidante, il work-up molto laborioso, le rese e le selettività non sempre soddisfacenti. Tali problematiche, superabili nell’ambito di processi di nicchia, per prodotti ad alto valore aggiunto, diventano invece limitanti per un processo con elevata produzione, come quello per l’acido adipico.
4.2 Idrogenazione del catecolo
Figura 3: schema della reazione di idrogenazione del catecolo.
L’idrogenazione del catecolo (1,2-diidrossibenzene) rappresenta una via alternativa di produzione del 1,2-cicloesandiolo, che permetterebbe di evitare gli svantaggi della sintesi dell’ossidazione del cicloesene, come ad esempio il controllo della temperatura, (descritti nel paragrafo precedente), e potrebbe inserirsi come stadio intermedio all’interno di un processo ad alta produttività come quello dell’acido adipico.
Obiettivo di questo lavoro di tesi è stato unire i vantaggi connessi con la reazione di idrogenazione cercando di ottimizzarla utilizzando lo stesso solvente (H2O) e lo stesso catalizzatore con cui l’1,2-cicloesandiolo viene poi ossidato ad acido adipico, in modo da poter proporre un processo “one-pot” che permetta di evitare la separazione e la purificazione dell’1,2-cicloesandiolo, diminuendo in tal modo i costi processuali e la perdita del prodotto, rendendo la produzione dell’acido adipico molto più “green” ed anche più economicamente sostenibile, almeno sul lungo periodo.
Lo studio della reazione proposto in questo lavoro è stato infatti affrontato in una prospettiva di lungo periodo: ad oggi infatti si propone di partire da un substrato di partenza, il catecolo, che ha un costo medio di 2 €/Kg, mentre il benzene costa 0,4 €/Kg ed il fenolo 0,9 €/Kg, dovuto all’impiego nel processo di produzione più diffuso, del perossido di idrogeno come ossidante del fenolo. L’innovazione della reazione studiata consiste, invece, nella possibilità di produrre 1,2-CED da un substrato che può essere ottenuto, come è stato descritto nel capitolo precedente, da biomasse o riciclando prodotti di scarto, come il protossido di azoto derivante dalla produzione dell’acido nitrico. Il nostro studio è stato basato sullo sviluppo di
49
un processo che rispetti il più possibile i principi della “Green Chemistry”: infatti la continua emanazione di norme che restringono i limiti di emissione di agenti inquinanti porterà, in futuro, a privilegiare la scelta di processi che offrano prodotti ad un costo medio, invece che ad un costo minimo, ma condotti nel massimo rispetto ambientale ed a partire da materie prime rinnovabili, anziché da materie prime fossili.
4.2.1 Meccanismo di reazione
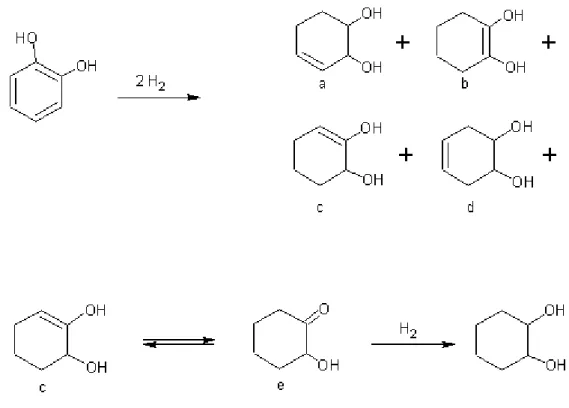
Il meccanismo della reazione di idrogenazione del catecolo non è stato molto indagato negli studi riportati in letteratura sull’argomento, i lavori che lo riguardano propongono comunque alcune alternative concordanti tra loro. H.A. Smith e B.L. Stump[15] hanno studiato il meccanismo della reazione (figura 4) usando metanolo come solvente e Rh supportato su allumina come catalizzatore.
Figura 4: meccanismo di reazione proposto da H.A.Smith e B.L.Stump
Il catecolo, una volta adsorbito sul catalizzatore, viene attivato per l’idrogenazione, la reazione procede con la formazione del 2-idrossicicloesanone (e) come intermedio. Questo andamento è spiegabile ammettendo che dopo l’idrogenazione dei primi 2 doppi legami, il catecolo possa essere trasformato nei 4 intermedi a, b, c e d:
• l’ intermedio a presenta il doppio legame in posizione β-γ rispetto al gruppo idrossile che lo rende soggetto a reazioni di idrogenolisi, pertanto tale intermedio è il
50
responsabile della formazione dei principali sottoprodotti della reazione, cicloesanolo e cicloesanone;
• l’intermedio d è quello con minor probabilità di formazione, per ragioni steriche (difficilmente l’idrogeno può reagire con i carboni legati al gruppo idrossile), per cui darà il contributo minore al decorso della reazione;
• Gli intermedi b e c, sempre per ragioni steriche, hanno la più alta probabilità di formazione e sono in equilibrio di risonanza: il 2-idrossiciloesanone è infatti l’intermedio maggiormente riscontrato nella reazione.
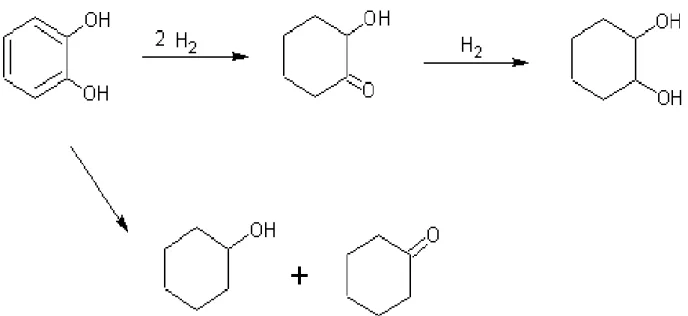
M. Huang e C.Y. Chen[16] hanno studiato la reazione di idrogenazione del catecolo in acqua impiegando numerosi catalizzatori a base di metalli nobili, individuando il tipo di meccanismo operante a seconda del tipo di metallo nonchè l’ordine di attività per i vari metalli testati che è risultato essere: Pt > Rh > Ru > Pd.
I meccanismi individuati in questo studio sono illustrati in figura 5 e 6:
51
Figura 6:meccanismo di idrogenazione del catecolo, modello con reazione a triangolo.
Il primo meccanismo di reazione (figura 5) è di tipo consecutivo, il catecolo viene infatti prima idrogenato a 2-idrossicicloesanone, il quale desorbe dal catalizzatore per essere in seguito nuovamente adsorbito ed idrogenato a 1,2-cicloesandiolo; questo modello di meccanismo si riscontra prevalentemente con catalizzatori di Pt e Pd.
Impiegando catalizzatori a base di Rh e Ru il meccanismo è invece descrivibile con un modello triangolare, la reazione può infatti prendere due diversi cammini:
• la maggior parte del catecolo subisce l’idrogenazione diretta a 1,2-ciclesandiolo
• la frazione rimanente di substrato subisce, invece, l’idrogenazione di tipo consecutivo, con formazione nella miscela di reazione del 2-idrossicicloesanone.
L’esistenza di due meccanismi di reazione differenti a seconda del catalizzatore utilizzato può essere razionalizzata considerando le diverse proprietà dei metalli: il Rh e il Ru, infatti, sono più affini all’ossigeno rispetto al Pt e al Pd, per cui in loro presenza l’intermedio di reazione desorbe più lentamente dal catalizzatore e la maggior parte di esso viene idrogenato direttamente a 1,2-cicloesandiolo; al contrario in presenza di Pt e Pd il desorbimento dell’intermedio è veloce per cui il 2-idrossicicloesanone torna in soluzione prima di essere nuovamente adsorbito sul metallo ed idrogenato al prodotto finale.
I sottoprodotti identificati per questo tipo di reazione, il cicloesanolo ed il cicloesanone, derivano dalla reazione di idrogenolisi, che avviene direttamente sul substrato, e sono gli
52
stessi per tutti i metalli indagati, mentre la quantità che se ne forma varia a seconda del catalizzatore impiegato: il Pt è il metallo che favorisce la maggior formazione di sottoprodotti, seguito nell’ordine dal Rh, il Ru e infine il Pd.
4.2.2 Stato dell’arte
Non sono molti i lavori in letteratura che propongono lo studio di questa reazione, in seguito si riportano le condizioni di lavoro che sono state indagate per l’idrogenazione del catecolo negli anni.
Lichtenberger e Hincky (1961)[17] riportano la preparazione di 1,2-cicloesandiolo attraverso l’idrogenazione del catecolo; in questo studio la reazione viene condotta in una autoclave con volume pari a 500 cm3 sciogliendo 1 mole di catecolo in 20 ml di metanolo, in presenza di 20 g di Ni/Raney come catalizzatore, la temperatura di esercizio varia tra 140 e 145°C, mentre la pressione di idrogeno è di 100 atm, ottenendo in tal modo una resa variabile tra l’85 e il 95 % in 1,2-cicloesandiolo; la stessa preparazione è stata eseguita per la preparazione dell’1,3-cicloesandiolo partendo, in questo caso, dal resorcinolo (1,3-diidrossibenzene), diminuendo solamente la temperatura tra i 120-130°C e la resa in diolo è del 30-40 %.
Allo stesso anno risale il primo vero studio su questo tipo di reazione da parte di Smith e Stump[15] che, come è stato descritto nel paragrafo precedente, riportano anche la proposta di un possibile meccanismo di reazione. Gli autori hanno studiato due differenti sistemi:
• nel primo caso è stato usato metanolo come solvente, Rh\Al2O3 come catalizzatore, con una temperatura variabile tra i 30 e i 50°C e una pressione di idrogeno pari a 50 psig (3,5 atm circa), mentre il tempo di reazione non è specificato. La resa di prodotto ottenuta è del 16 % su conversioni di catecolo del 50 %.
• Un secondo studio è stato effettuato utilizzando acido acetico come solvente e PtO2 Adams come catalizzatore, nelle stesse condizioni di pressione e temperature del caso precedente; in questo modo le rese ottenute sono pari circa al 23 % su conversioni di catecolo del 50 %.
Huang e Chen[16] hanno pubblicato, nel 1980, uno studio su questa reazione dedicato prevalentemente allo studio meccanicistico, specificando soltanto di aver utilizzato acqua come solvente e di aver indagato la reazione alla presenza di Rh, Ru, Pd e Pt come catalizzatori, non sono riportate però né le condizioni di lavoro né le rese ottenute. In uno studio del 1990, Sbar et al. riportano i risultati ottenuti indagando l’idrogenazione del catecolo
53
in fase solida[18]: 500 g di catecolo vengono miscelati con 50 g di vari tipi di catalizzatore a 25°C e 1 bar di idrogeno, ottenendo i seguenti risultati:
• utilizzando come catalizzatore uno dei seguenti sistemi Pd\Al2O3, Pd\CaCO3 o PdBaSO4, tutti al 5 % in peso di metallo, non si ottiene conversione del substrato;
• impiegando Pd\C al 5% in peso si ha invece una conversione del 28 %, con selettività in 1,2-cicloesandiolo pari a circa il 25 %;
• nel caso si utilizzi Rh\Al2O3 al 5 % in peso si ottiene una conversione del 15 % e una selettività del 14 % in cicloesandiolo;
• il sistema Rh\C al 10 % in peso permette di ottenere conversioni pari al 38 % mentre la selettività nel prodotto desiderato è del 35 %;
• l’impiego di Pt\C al 5 % in peso permette di raggiungere conversioni pari al 41 % di catecolo e selettività in 1,2-cicloesandiolo del 28 %;
• i risultati migliori sono stati ottenuti utilizzando PtO2 Adams come catalizzatore: la conversione di catecolo raggiunge l’80 % e la selettività in diolo è del 68 %.
Uno studio pubblicato nel 2006[19] riporta un’ indagine meccanicistica della reazione fatta per via elettrocatalitica, in acqua con Rh\Al2O3 al 5 % in peso: le rese e le conversioni ottenute non sono specificati, mentre viene descritto il diverso andamento della reazione al variare del pH:
• in soluzione acquosa di NaOH 1 M, a pH 13, l’intermedio di reazione riscontrato è l’1,2-cicloesandione;
• lavorando in soluzione acquosa a pH 7, ottenuto con un tampone di fosfato, si riscontrano due tipi diversi di intermedio: l’1,cicloesandione e il 2-idrossicicloesanone;
• a pH 5, ottenuto con una soluzione acquosa di acido acetico, l’intermedio riscontrato è il 2-idrossicicloesanone.
Marcowski et al.[20], nel 2008, riportano i risultati ottenuti per l’idrogenazione del catecolo ed i suoi isomeri, lavorando in presenza di nanoparticelle di palladio supportate su carbone idrofilico (50 mg per 100 g di substrato), in acqua, alla temperatura di 100°C e con 10 bar di pressione di idrogeno :
• dopo 20 ore di reazione si riscontra una conversione del catecolo pari al 25 % e una selettività in 1,2-cicloesandiolo del 15 % (sottoprodotto 2-idrossicicloesanone);
• dopo 72 ore di reazione la conversione del catecolo è aumentata al 75 % e la selettività nel prodotto desiderato è del 25 % (sottoprodotto 2-idrossicicloesanone);
54
• per il resorcinolo, dopo 20 ore di reazione, viene riportata una conversione dell’80 % e una selettività a diolo del 30 % (sottoprodotto 3-idrossicicloesanone);
• l’idrogenazione dell’idrochinone, isomero para del catecolo, dopo 20 ore mostra una conversione di substrato pari al 55 % ed una selettività in diolo estremamente bassa, di solo il 5%: il sottoprodotto principale è il 4-idrossicicloesanone, ma in questo caso sono presenti anche il benzochinone (1,4-cicloesandione) e il cicloesanone.
Maegawa et al.[21], nel 2009, hanno indagato la reazione di idrogenazione del catecolo in presenza di rutenio su carbone al 10 % in peso, utilizzando isopropanolo come solvente a diverse temperature e pressioni; una millimole di catecolo è disciolta in 1 ml di solvente in presenza del catalizzatore (10 % in peso rispetto al substrato da idrogenare). I risultati ottenuti nelle diverse condizioni di reazione sono riportate nei punti seguenti:
• a 90°C e 5 atm di H2 dopo 24 ore di reazione, la conversione non è ancora totale ed è stata osservata una resa in 1,2-CED del 72 %, calcolata su un recupero del prodotto di partenza del 17 %;
• a 120°C e 10 atm di H2, dopo 8 ore di reazione,si ottiene una resa in 1,2-cicloesandiolo circa dell’89 %, valutata sul consumo di idrogeno.
L’indagine più recente sull’idrogenazione del catecolo risale al 2011: Wang et al.[22] hanno studiato la reazione in presenza di un catalizzatore a base di nanoparticelle di palladio supportate su una matrice grafitica mesoporosa di carbonio nitrile, Pd\mpg-C3N4. Tale sistema avendo caratteristiche basiche e di semiconduttore attiva maggiormente il catecolo all’idrogenazione e favorisce selettivamente la formazione del 2-idrossicicloesanone. Le caratteristiche elettroniche del catalizzatore fanno si che il fenolo venga adsorbito più facilmente attraverso la formazione di forti interazioni π-π tra esso e l’anello aromatico, mentre i siti basici garantiscono una buona interazione con l’idrogeno acido del gruppo alcolico. Queste forti interazioni tra substrato e superficie catalitica permettono un’attivazione migliore della molecola e un’idrogenazione più veloce: infatti, una volta che si è formato l’enolato, la molecola perdendo l’aromaticità desorbe velocemente a favore di un’altra molecola di catecolo, che grazie all’anello aromatico ha un’interazione più favorita con il catalizzatore. In figura 7 è illustrato il meccanismo catalitico per l’idrogenazione del fenolo a cicloesanone, che è del tutto simile a quello appena descritto per il catecolo.
55
Figura 7: meccanismo di idrogenazione del fenolo sul catalizzatore mpg-C3N4.
I risultati ottenuti, sciogliendo 0,5 millimoli di reagente in 2 ml di acqua, a 80°C e a pressione atmosferica di idrogeno, dopo 6 ore di reazione, hanno permesso di ottenere una conversione di catecolo pari all’80 % e una selettività in 2-idrossicicloesanone del 99 %.
56
Bibliografia
[1] Cope A.C., Spencer C.F., Organic Synthesis, coll. Vol. 3 (1955) 217. [2] Hartung A., Keane M.A:, Kraft A., J. Org. Chem., 72 (2007) 10235. [3] Bergstad K., Jonsson S.Y. et al., J. Am. Chem. Soc., 121 (1999) 104.
[4] Venturiello C., Gambaro M., U.S. Patent 4,562,299 (1985) (assegnato a Montedison S.p.A.).
[5] Li H., Zhu W., React Kinet. Catal .Lett., 92 (2007) 319.
[6] Usui Y., Sato K. et al., Angew. Chem. Int .Ed., 42 (2003) 5623.
[7] Tanaka M., Sato K., Usui Y., U.S. Patent 7,385,096 (2008) (assegnato a Japan Science and Technology Agency, National Institute of Advanced Industrial Science and Technology). [8] Zhang A., Gao S., Lv Y., Xi Z., Res Chem. Intermed., 35 (2009) 563.
[9] Morandin M., Gavagnin R., J. Catal.,212 (2002) 193.
[10] Tatsumi T., Koyano K.A. et al., Chem. Commun., (1998) 325.
[11] Timofeeva M.N., Kholdeeva O.A. et al., Appl. Catal. A, 345 (2008) 195.
[12] Chiker F., Launay F., Nogier J.P., Bonardet J.L., Green Chemistry, 5 (2003) 318. [13] Sakthivel A., Depurkar S.E. et al., Appl. Catal. A, 246 (2003) 283.
[14] Shima H., Tanaka M., Imai H., Yokoi T., Tatsumi T., Kondo J.N., J. Phys. Chem. C, 113 (2009) 21699.
[15] Smith H.A., Stump B.L., J. Am. Chem. Soc., 83(12) (1961) 2739. [16] Huang M., Chen C.Y., J. Chinese Chem. Soc., 27 (1980) 151. [17] Lichtenberger J., Hincky J., Bull. Soc. Chim. Fr., (1961) 854.
57
[19]Brisach-Wittmeyer A., Bouchard N.A., Breault R., Menard H., Can. J. Chem., 84 (12) (2006) 1640.
[20] Marcowski P., Cakan D., Antonietti M., Gattman F., Titirici M.M., Chem. Commun., 8 (2008) 999 DOI: 10.1039/b717928f , (2008).
[21] Maegawa T., Akashi A., Yaguchi K., Iwasaki Y., Shigetsune M., Manguchi Y., Sajiki H.,
Chem. Eur. J., 15 (2009) 6953.
[22] Wang Y., Yao J., Li H., Su D., Antonietti M., J. Am. Chem. Soc., 133 (2011) 2362 dx.doi.org/10.1021/ja109856y, (2011).